4-7 注射用无菌粉末教学教材
14.无菌粉末 眼用制剂

二、药物吸收 1. 药物吸收途径 吸收 角膜 前房→虹膜(90%) 眼球 巩膜:吸收少 眼 吸收 多 血液 浓度↓ 结膜 少 巩膜→眼球后部
有血-眼屏障,局部应用较好。
2. 影响吸收的因素 眼睑缝隙损失:7µ l,最大30µ l 全身吸收:消除、全身作用、毒副作用 药物水溶性与PH值:中性最佳 刺激性:渗透压、PH值 表面张力↓,吸收↑ 粘度↑,吸收↓
(3)再干燥:0℃以上保持恒温数小时,使 彻底干燥。 药物浓度5-10%,装量1/5~1/4
(三)冷冻干燥中常见问题 1. 制品含水量偏高 2. 喷瓶 3. 制品外形不饱满或萎缩成团
第六节 ห้องสมุดไป่ตู้用制剂
一、概述 眼用制剂(ophthalmic preparations):直接用于眼部 疾病的无菌制剂。 包括供滴眼剂(eye-drop),洗眼剂、眼内注射剂 质量要求: 等渗,PH5.0-9.0,无菌 眼内注射液及供手术、外伤、角膜穿通伤滴眼剂、 洗眼剂不应加抑菌剂、抗氧剂和不适当的缓冲剂。 滴眼剂装量不超过10ml。
四、注射用冷冻干燥制品 概念:将药物制成无菌水溶液,进行无菌灌装, 经冷冻干燥后在无菌条件下熔封或严封制成的 粉针剂。 如辅酶A、辅酶Q10、干扰素,a-糜 蛋白酶、前列腺素E、冻干人血浆等。 优点: 1、可避免药物受热破坏——适于生物制品 2、产品疏松易溶 3、含水量低(1—3%),有利于长期贮存 4、污染机会少,微粒少
三、制备方法 (一)容器处理 1、塑料滴眼瓶 滤过注射用水冲洗→环氧乙烷灭菌 2、玻璃滴眼瓶 瓶:滤过注射用水冲洗→干热灭菌 橡胶塞、帽:碱、酸各煮15分→冲洗 (二)溶剂:注射用水。
(三)工艺: 1、主药性质稳定:先配液→灭菌→分装。 2、主药性质不稳定:先灭菌→配液→分装。 3、眼部手术、外伤用:单剂量装,同注射剂。 四、质量检查 1、可见异物:无异物 2、无菌:角膜外伤、手术用应绝对无菌。一般滴眼 剂不得检出铜绿假单胞菌和金黄色葡萄球菌,霉菌 和酵母菌,1毫升含细菌数≤100个, 3、装量等 举例
执业西药师《药剂学》经典知识:注射用无菌粉末

执业西药师《药剂学》经典知识:注射用无菌粉末注射用无菌粉末是注射剂的一种,指药物制成的供临用前用适宜的无菌溶液配制成澄清溶液或均匀混悬液的无菌粉末或无菌块状物。
以下是店铺带来的详细内容,欢迎参考查看。
一、概念专供注射用的无菌粉末,简称粉针。
使用前用无菌注射用水溶解。
二、适用范围在水中不稳定的药物、不能在溶液中加热灭菌的药物,均须制成粉针。
如抗生素类药物、酶制剂、血浆等生物制剂。
必须在无菌条件下进行。
三、分类1.注射用无菌分装产品制备本类粉针的关键是原料药物的精制,通过精制得到无菌粉末,在无菌条件下分装即得。
在水中特别不稳定的药物适合制成此类粉针。
2.注射用冷冻干燥产品简称冻干制品。
将药物的除菌水溶液经无菌分装,并在无菌条件下冷冻干燥、封口而制得的产品。
具有产品质地疏松、溶解迅速、含水量低、剂量准确等优点。
特别适合对温度敏感的药物。
冷冻干燥的工艺过程:测定产品的低共熔点一预冻一升华干燥一再干燥渗透压的调节与体液渗透压相等的溶液为等渗溶液,如0.9%NaCl溶液。
人体可耐受的渗透压,肌肉注射为0.45%~2.7%的NaCl溶液的渗透压,相当于0.5~3个等渗浓度的溶液。
常用的调整方法如下:1.冰点降低法计算将药液调整为等渗溶液需加入等渗调节剂的量,可用下式计算:0.52=a + b WW:配成等渗溶液中需加等渗调节剂的量(%,g/ml)。
a:未经调整的药物溶液(1%)冰点下降摄氏度数(℃)。
b:1%等渗调节剂溶液的.冰点下降摄氏度数(℃),若用氯化钠为等渗调节剂,则b=0.58。
2.氯化钠等渗当量法与1g药物呈等渗效应的氯化钠的量称氯化钠等渗当量,用E表示,可按下式计算:0.9%V=E W + XX:药物溶液中需加等渗调节剂的量,g; V:欲配制药物溶液的体积,ml; E:1g药物的氯化钠等渗当量(可由表查得或测定); W:溶液中药物的量,g。
等渗溶液与等张溶液1.等渗溶液与血浆渗透压相等的溶液。
4-7 注射用无菌粉末教学文稿

(2)不溶性微粒问题
按《中国药典》现行版附录的规定,注射用无菌粉 末应进行不溶性微粒检查。
由于制备药物粉末的工艺步骤多,以致污染机会增 多,易使药物粉末溶解后出现纤毛、小点,以致不 溶性微粒检查不合格。
因此应从原料的精制处理开始பைடு நூலகம்控制环境洁净度, 严格防止污染。
(3)无菌问题
药品无菌检查合格,只能说明抽查那部分产品是无 菌的,不能代表全部产品完全无菌。
(4)印字、贴签与包装
目前生产上均已实现机械化,印字或贴印有药物名 称、规格、批号、用法等的标签,并装盒。
2.无菌分装工艺中存在的问题
(1)装量差异问题
物料的流动性是影响装量差异的主要因素,药粉的 物理性质如吸潮性、晶型、粒度、粉末松密度及机 械设备性能等因素均能影响装量差异。
应根据具体情况采取相应措施,尤其应控制分装环 境的相对湿度。
因此,应对所有橡胶塞进行密封防潮性能测定,选 择性能符合规定的橡胶塞,同时铝盖压紧后瓶口烫 蜡,防止水汽透入。
(二)注射用冷冻干燥制品的生产
注射液冷冻干燥制品:是将药物制成无菌水
溶液,进行无菌灌装,再经冷冻干燥,在无菌生 产工艺条件封口制成的粉针剂。 凡对热敏感、在水溶液中不稳定的药物,可采用 此法制备。
玻璃瓶可180℃干热灭菌1.5小时,胶塞洗净后要用硅油进 行硅处理,再用125℃干热灭菌2.5小时。灭菌空瓶的存放 柜应有净化空气保护,存放时间不超过24小时。
药物粉末:无菌原料可采用无菌结晶法、喷雾干燥法精
制或发酵法制备而成,必要时需进行粉碎、过筛等操作。
(2)分装
分装必须在规定的洁净环境中按照无菌生产工艺操 作进行。
由于产品系无菌生产工艺操作制备,稍有不慎就有 可能使局部受到污染,而微生物在固体粉末中繁殖 又较慢,不易为肉眼所见,危险性更大。
第四节粉针剂[专业类别]
![第四节粉针剂[专业类别]](https://img.taocdn.com/s3/m/4489e1ffa417866fb94a8e2a.png)
粉针剂生产设备联动工艺
高级课件
No.3 灭菌和异物检查 对于能耐热的品种(青霉素)可补充灭菌,以确保安全; 不耐热的品种,必须严格高洁净度控制技术工艺操作。
异物检查一般在传送带上,用目视检查。
No.4 印字、贴签与包装 目前生产上均已实现机械化,印字或贴印有药物名称、 规格、批号、用法等的标签,并装盒。
依据:药物的性质与生产工艺条件
1. 注射用冷冻干燥制品 简称冻干粉针,用冷冻干燥工艺制得; 2. 注射用无菌分装制品 用适宜方法制得的粉末无菌分装制得。
高级课件
2. 注射用无菌分装制品
Requirement
粉针剂为非最终灭菌药品,其生产必须采用高洁 净度控制技术工艺。 注射用无菌粉末的质量应按照《中国药典》2010 版附录的规定,进行装量差异、不溶性微粒、无 菌、含量均匀度等项目检查,并符合规定。
因此,应对所有橡胶塞进行密封防潮性能测定, 选择性能符合规定的橡胶塞,同时铝盖压紧后于 瓶口烫蜡,加强密封性,防止水汽透入。
高级课件
3. 注射用冷冻干燥制品
对热敏感,在水溶液中不稳定的药物
药
物
的 无 菌 水
无 菌 灌 装
冷 封口 冻 干 燥
粉 针 剂
溶
液
高级课件
Theory 在三相平衡点以下的条件下,升高温度或降低压力都可以 使冰从冻结状态不经过液态而直接升华变成水蒸气。 冷冻干燥就是根据这个原理:将被干燥的物品先冻结到三 相平衡点温度以下,然后在真空条件下,缓缓加热,使物 品中的固态水分(冰)直接升华成水蒸气,从物品中排除 达到干燥。
高级课件
药物粉末:无菌原料可采用无菌结晶法、喷雾干燥 法精制或发酵法制备而成,必要时需进行粉碎、过 筛等操作。
第七节 注射用无菌粉末
冷冻干燥中存在的问题、原因及处理办法
存在问题 原 因 解决办法
含水量偏高
喷
瓶
装入容器的药液太厚; 升华干燥过程中热量 供给不足;冷凝器温 度偏高;系统内真空 度不够 预冻不完全;系统供 热太快;制品受热不均
采取针对性的方法或 采用旋转冷冻机
控制预冻温度在共熔 点以下10~20℃ ,并 维持足够时间 ;调节 供热速度,加热升华 温度不超过共熔点。
产品外观不饱满或萎缩 药液黏稠、结构致密,定义 应用方法
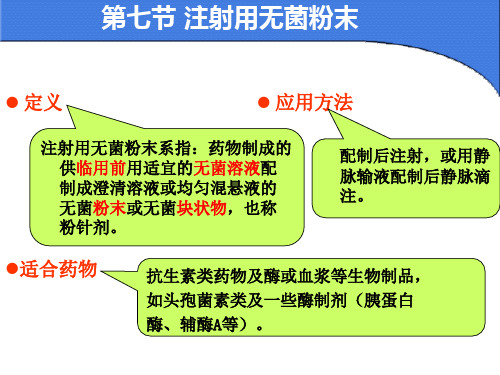
配制后注射,或用静 脉输液配制后静脉滴 注。
注射用无菌粉末系指:药物制成的 供临用前用适宜的无菌溶液配 制成澄清溶液或均匀混悬液的 无菌粉末或无菌块状物,也称 粉针剂。
适合药物
抗生素类药物及酶或血浆等生物制品, 如头孢菌素类及一些酶制剂(胰蛋白 酶、辅酶A等)。
存在的问题及解决措施
• 装量差异:改善流动性。 • 澄明度:控制环境洁净度。 • 无菌度:采用层流净化装置。 • 吸潮变质:轧盖后瓶口烫蜡。
二、注射用冻干制品的制备工艺
定义
采用冷冻干燥的方法,使已 滤除微生物的溶液在低温下冻 结,再使其在真空条件下形成 固体状态,这类制剂称为注射 用冻干制品。
• 质量要求: 粉末无异物,配制后澄明度合格;粉末细度和结 晶适宜,便于分装;无菌、无热原。
• 分类: 无菌分装产品和冷冻干燥制品。
无菌分装产品
冻干制品
1.冻干无菌粉末 的制备工艺 2.存在的问题和 处理方法
1.无菌粉末的分 装及主要设备
2.存在的问题 及解决措施
一、注射用无菌分装制品
重结晶法或 喷雾干燥法
制备方法:
容器
无菌的粉末原料
无菌操作条件
4-灭菌与无菌制剂-简化版

制备注射用水依据此性质 (5) 其它 能被强酸、强碱破坏,也能被强氧化 剂所钝化,超声波也能破坏热原
热原的除去方法
(1) 高温法
(2) 酸碱法
(3) 吸附法 活性炭对热原有较强的吸附作用,同时有助滤脱 色作用,使用较广,常用量为0.1%~0.5%。 (4) 离子交换法
1. 概 述
第三节 输 液
输液的概念:
输液(infusion solution):是指由静脉滴注输入体内的大剂量注射 液,它是注射剂一个分支。由于其用量和给药方式与普通注射剂不同, 故质量要求,生产工艺等均有一定差异。
输液的种类:
电解质输液:用以补充体内水份、电解质,纠正体内酸碱平衡等。 如氯化钠输液、复方氯化钠输液、乳酸钠输液等。 营养输液:有糖类输液、氨基酸输液、脂肪乳剂输液等。 胶体输液:有明胶类、多糖类、高分子聚合物等。
污染热原的途径
(1) 从溶剂中带入:注射剂出现热原的主要原因 (2) 从药物各类原辅料中带入 (3) 从容器、用具、管道和装置等带入 (4) 制备过程中的其它污染 (5) 输液过程中污染(从输液器带入等)
热原的性质
(1) 耐热性 在通常注射剂灭菌的条件下,不足 以使热原破坏。
(2) 滤过性 :热原体积小,一般滤器均可通过
第四章
灭菌与无菌制剂
主要教学内容(2学时)
第一节 第二节 第三节 第四节 第五节 第六节 概 述 注射剂 输 液 注射用无菌粉末(粉针剂) 眼用制剂 其它灭菌与无菌制剂
本章学习要求
掌握灭菌制剂、无菌制剂以及灭菌与无菌技术相关基
本概念,熟悉空气净化技术、冷冻干燥技术; 掌握注射剂的定义、分类、特点、质量要求、处方组 成、基本制备工艺; 掌握热源、等渗调节、纯化水、注射用水、灭菌注射 用水等基本概念; 熟悉注射用无菌粉末(粉针剂)的分类、处方组成、 基本制备工艺及质量要求;熟悉输液的分类、处方组成、 基本制备工艺及质量要求;熟悉眼用制剂的定义、处方 组成、基本制备工艺及质量要求; 了解其它灭菌与无菌制剂的基本概念
药剂学课件-注射用无菌粉末

将药物溶液在低温下冻结,然后在真空条件下进行干燥,得到疏松、多孔的结构,易于溶解和吸收。
灭菌与无菌保证
辐射灭菌
利用放射性元素产生的射线进行灭菌,具有操作简便、灭菌效果好、对物品无损害等优 点。
环氧乙烷气体灭菌
将无菌粉末置于密封容器中,通入环氧乙烷气体进行灭菌,具有穿透能力强、灭菌效果 可靠等优点。
VS
新型载体材料的应用
新型载体材料如聚合物纳米颗粒、脂质体 等在无菌粉末制备中得到广泛应用,有助 于提高药物的溶解度、稳定性及靶向性。
临床需求与市场前景
适应症的拓展
随着医学的进步,注射用无菌粉末的应用范 围不断扩大,涉及抗肿瘤、抗病毒、抗炎等 多个治疗领域,市场需求持续增长。
国际化市场拓展
国内制药企业正积极开拓国际市场,注射用 无菌粉末的出口量逐年增加,国际竞争力不 断提升。
注射用无菌粉末应针对明 确的适应症进行治疗,并 通过临床试验验证其疗效 。
治疗效果
注射用无菌粉末应具有显 著的治疗效果,并能改善 患者的生活质量。
药物经济学
注射用无菌粉末应具备合 理的药物经济学价值,降 低医疗成本。
不良反应与处理措施
不良反应监测
医疗机构和患者应密切关注注射 用无菌粉末可能引起的不良反应 ,如过敏反应、呼吸系统反应等
储存要求高
注射用无菌粉末需要严格 的无菌环境下储存,对储 存条件要求较高。
适用范围与临床应用
适用范围
注射用无菌粉末适用于需要注射给药的药品,尤其适用于需要长期给药或需要精 确控制剂量的药物。
临床应用
注射用无菌粉末在临床中广泛应用于抗肿瘤药物、抗生素、麻醉药等需要注射给 药的药品。
与其他剂型的比较
剂量准确
无菌制剂生产—注射用无菌粉末制备(中药制剂技术课件)

注射用无菌粉末认知
●含义 ●分类
注射用无菌粉末制备
注射用无菌粉末系指药物制成的供临用前用 适宜的无菌溶液配制成溶液的无菌粉末或无 菌块状物,也称粉针剂
凡是对热比较敏感或在水溶液中很不稳定的 药物,如双黄连粉针剂、茵栀黄粉针剂等。
含义 适ห้องสมุดไป่ตู้药物
注射用无菌粉末制备
分类 根据其制备方法与工艺可分为两种: 其一、将原料——喷雾干燥——无菌粉末 无菌粉末直接分装法 其二、将药物制成灭菌水溶液——冷冻干燥——无 菌粉末或块状物(注射用冻干制品) 冷冻干燥法
[正式版]注射粉末冶金ppt资料
![[正式版]注射粉末冶金ppt资料](https://img.taocdn.com/s3/m/ec43b22f4028915f814dc263.png)
烧结
烧结是 MIM工艺中的最后一步工序,烧结消除了粉末颗粒之间 的孔隙.使得MIM产品达到全致密或接近全致密化。金属注射 成形技术中由于采用大量的粘结剂,所以烧结时收缩非常大, 其线收缩率一般达到13%-25%。
模具培训资料
注射粉末培训教材
金属粉末颗粒尺寸一般在0.5~20μm
铁基,低合金,高速钢,不锈钢,克阀合金,硬质合金
胶粘剂作用是粘接金属粉末颗粒,使 混合料在注射机料筒中加热具有流变 性和润滑性,也就是说带动粉末流动 的载体。
首先将粒状喂混料料加热:至混一定炼高是的温将度金使之属具粉有流末动与性,粘然结后将剂其混注入合 具中取出得到得MI到M成均形匀坯。喂料的过程。由于喂料的性质 在的不孔产 隙生.缺使陷得决的MI定情M产况了品下最达,到将终全粘注致结密剂射或脱成接离近开形全注产致射密成品化形的。毛坯性。能,所以 性和润滑性,混也炼就是这说一带动工粉艺末流步动骤非常重要。
铁基,低合金,高速钢,不锈钢,克阀合金,硬质合金
铁基,低合金,高速钢,不锈钢,克阀合金,硬质合金
这个过程同传统塑料注射成形过程一化, 的热孔脱隙 脂.、使溶得剂然脱M后I脂M产、降品虹温达吸到脱,全脂加致、密催入或化低接脱近脂熔全点致密组化元。 ,然后分批加 决定了最终注入射金成形属产粉品的末性。能,所以
但由于MIM喂料高的粉末含量,使得其注射成形过程在工艺参数上及 烧结是 MIM工艺中的最后一步工序,烧结消除了粉末颗粒之间
的孔隙.使得MMIMM产喂品料达到的全混致密合或是接近在全热致密效化应。 和剪切力的 热混脱炼脂 的、方溶法剂一联脱般脂是合、先作虹加吸入用脱高下脂熔、点完催组成化元脱熔的脂化。,
这个过程同传统塑料注射成形过程一致, 但由于MIM喂料高的粉末含量,使得其注射成形过程在工艺参数上及 金属粉末颗粒尺寸一般在0. 首先将粒状喂料加热至一定高的温度使之具有流动性,然后将其注入 金属粉末颗粒尺寸一般在0.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)分装
分装必须在规定的洁净环境中按照无菌生产工艺操 作进行。
目前使用分装机械有螺杆式分装机、气流式分装机 等。
进瓶、分装、压塞或封口在局部100级层流装置下进 行;分装后应立即加塞、轧铝盖密封。
(3)灭菌和异物检查
对于能耐热的品种如青霉素,可进行补充灭菌,以 确保安全。对于不耐热的品种,必须严格高洁净度 控制技术工艺操作。
(三)分类
1. 注射用冷冻干燥制品:简称冻干粉针,用冷冻
干燥工艺制得;
2. 注射用无菌分装制品:用适宜方法制得的粉末
无菌分装制得。
(四)质量要求
粉针剂为非最终灭菌药品,其生产必须采用高洁 净度控制技术工艺。
注射用无菌粉末的质量应按照《中国药典》现行 版附录的规定,进行装量差异、不溶性微粒、无 菌、含量均匀度等项目检查,并符合规定。
溶液,进行无菌灌装,再经冷冻干燥,在无菌生 产工艺条件封口制成的粉针剂。 凡对热敏感、在水溶液中不稳定的药物,可采用 此法制备。
1.冷冻干燥的原理及设备
(1)原理
在三相平衡点以下的条件下,升高温度或降低压 力都可以使冰从冻结状态不经过液态而直接升华 变成水蒸气。
冷冻干燥就是根据这个原理:将被干燥的物品先 冻结到三相平衡点温度以下,然后在真空条件下, 缓缓加热,使物品中的固态水分(冰)直接升华 成水蒸气,从物品中排除达到干燥。
(4)产品所含微粒较其他生产方法产生的少; (5)外观色泽均匀,形态饱满。
3.注射用冷冻干燥制品制备工艺
注射用冷冻干燥制品制备工艺流程:
原辅料
西林瓶处理 测定低共熔点
配液、滤过
成 品
分装 质检
预冻 加塞封口பைடு நூலகம்
升华干燥 再干燥
(1)测定产品低共熔点
低共熔点(eutectic point)是在水溶液冷却过程中, 冰和溶质同时析出结晶混合物(低共溶混合物)时 的温度。
(2)设备
冷冻干燥机:由制冷系统、真空系统、加热系统、电
器仪表控制系统组成。真空系统为升华干燥仓建立低气 压条件,加热系统向物料提供升华潜热,制冷系统向冷 冻仓和干燥室提供所需的冷量。
主要部件:冻干箱、凝结器、冷冻机组、真空泵、加热
/冷却装置等。
制备过程:物料经前处理后,被送入速冻仓冻结,再送
(3)无菌问题
药品无菌检查合格,只能说明抽查那部分产品是无 菌的,不能代表全部产品完全无菌。
由于产品系无菌生产工艺操作制备,稍有不慎就有 可能使局部受到污染,而微生物在固体粉末中繁殖 又较慢,不易为肉眼所见,危险性更大。
为了保证用药安全,解决无菌分装过程中的污染问 题,应注意生产的各个环节,包括无菌室的洁净环 境。
(4)吸潮变质问题
在储存过程中的吸潮变质,对于瓶装无菌粉末时有 发生。原因是由于橡胶塞的透气性所致,轧铝盖封 不严。
因此,应对所有橡胶塞进行密封防潮性能测定,选 择性能符合规定的橡胶塞,同时铝盖压紧后瓶口烫 蜡,防止水汽透入。
(二)注射用冷冻干燥制品的生产
注射液冷冻干燥制品:是将药物制成无菌水
入干燥仓升华脱水,之后在后处理车间包装。
冻干箱
搁板
控制面板
箱体 (内有冷凝 器、冷冻机、热 交换器、真空泵 和阀门、电器控 制元件等)
2.冷冻干燥制品的优点
(1)生物活性不变,对热敏感的药物可避免高温 而分解变质,如蛋白质和酶制剂;
(2)制品质地疏松,加水后迅速溶解恢复原有特 性;
(3)含水量低,同时由于干燥在真空中进行,药 物不易氧化;
应根据具体情况采取相应措施,尤其应控制分装环 境的相对湿度。
(2)不溶性微粒问题
按《中国药典》现行版附录的规定,注射用无菌粉 末应进行不溶性微粒检查。
由于制备药物粉末的工艺步骤多,以致污染机会增 多,易使药物粉末溶解后出现纤毛、小点,以致不 溶性微粒检查不合格。
因此应从原料的精制处理开始,控制环境洁净度, 严格防止污染。
容器:西林小瓶及胶塞均按规定方法处理,但均需灭菌。
玻璃瓶可180℃干热灭菌1.5小时,胶塞洗净后要用硅油进 行硅处理,再用125℃干热灭菌2.5小时。灭菌空瓶的存放 柜应有净化空气保护,存放时间不超过24小时。
药物粉末:无菌原料可采用无菌结晶法、喷雾干燥法精
制或发酵法制备而成,必要时需进行粉碎、过筛等操作。
二、注射用无菌粉末的制备
(一)注射用无菌分装制品的生产
注射用无菌分装制品:将符合注射要求的药
物粉末,在高洁净度控制技术工艺条件下直接分 装于洁净灭菌的西林小瓶中,密封制成粉针剂。 药物若能耐受一点的温度,则可进行补充灭菌。
1.生产工艺
流程:原材料准备→分装→灭菌和异物检查 →印字、贴签与包装
(1)原材料准备
异物检查一般在传送带上,用目检视。
(4)印字、贴签与包装
目前生产上均已实现机械化,印字或贴印有药物名 称、规格、批号、用法等的标签,并装盒。
2.无菌分装工艺中存在的问题
(1)装量差异问题
物料的流动性是影响装量差异的主要因素,药粉的 物理性质如吸潮性、晶型、粒度、粉末松密度及机 械设备性能等因素均能影响装量差异。
第七节 注射用无菌粉末
一、概述
(一)概念
注射用无菌粉末:亦称粉针,是指药物制
成的供临用前用适宜的无菌溶液配制成澄清 溶液或均匀混悬液的无菌粉末或无菌的块状 物,可用适宜的注射用溶剂配制后注射,也 可用静脉输液配制后静脉滴注。 注射用无菌粉末在标签中应标明所用溶剂。
(二)适合的药物
在水溶液中不稳定的药物,特别是一些对湿热十 分敏感的抗生素类药物及酶或血浆等生物制品, 如青霉素G的钾盐和钠盐、头孢菌素类及一些酶 制剂(胰蛋白酶、辅酶A等),用一般药剂学稳 定化技术尚难得到满意的注射剂产品时,可制成 固体形态的注射剂。
对新产品进行冻干之前,应先测出其低共熔点, 以便控制冷冻温度在低共熔点以下,以保证冷冻 干燥的顺利进行。
测定低共熔点的方法有电阻法和热分析法(热分 析法通过绘制DSC冷却曲线就可求出低共熔点)。
(2)配液、滤过和分装
冻干前的原辅料、西林小瓶需按适宜的方法处理, 然后进行配液、无菌过滤和分装,其制备应在 100级洁净条件下操作。
当药物剂量和体积较小时,需加适宜稀释剂(甘 露醇、乳糖、山梨醇、右旋糖酐、牛白蛋白、明 胶、氯化钠和磷酸钠等)以增加容积。
