第三章 离子聚合和配位聚合
离子聚合和配位聚合课件

通过离子聚合和配位聚合的方法, 合成出具有特殊功能性的聚合物, 如导电聚合物、荧光聚合物等。
绿色合成路径的研究
无毒引发剂
研究无毒、环保的引发剂, 替代传统的有毒引发剂, 降低对环境的污染。
高效催化剂
研究高效、环保的催化剂, 替代传统的有毒催化剂, 降低对环境的污染。
循环利用
研究聚合物的循环利用技 术,实现聚合物的环保处 理和再利用,降低对环境 的污染。
配位聚合可以通过选择不同的 催化剂和聚合条件,实现对聚 合物分子链结构和性能的精细 调控。
配位聚合可以应用于合成高性 能纤维、功能性膜材料、液晶 材料等领域,具有广泛的应用 前景。
03
离子聚合与配位聚合的 比
聚合方式的比 较
离子聚合
通过正负离子之间的相互作用形 成聚合物链,聚合过程中无金属 催化剂参与。
配位聚合的实际应用
高性能聚合物制备
配位聚合可以合成高性能聚合物,如聚酰胺、聚酯等,用于制造 纤维、塑料和复合材料等。
高分子功能材料
通过配位聚合可以制备具有特殊功能的高分子材料,如导电聚合物、 光敏聚合物等,用于传感器、光电转换器件等领域。
高分子药物
配位聚合可以合成具有特定结构和药理性能的高分子药物,用于治 疗癌症、心血管等疾病。
配位聚合
通过过渡金属催化剂与配体形成 活性中心,再与单体进行配位反 应形成聚合物链。
聚合产物的比较
离子聚合
聚合物分子量分布较窄,但可能存在 支链和交联结构。
配位聚合
聚合物分子量分布较宽,但聚合物结 构规整,结晶度高。
应用领域的比较
离子聚合
主要用于合成橡胶、热塑性弹性体等材料。
配位聚合
广泛应用于合成纤维、塑料、涂料等领域。
离子型聚合物

❖ 单体、溶剂中的杂质会使引发剂失活;杂质的存在会影响聚合反
应的速率、聚合物的相对分子质量、相对分子质量分布以及聚合物的
微观结构,其结果必然会影响产品的质量。
❖
单体中的H2O和O2能与引发剂中的金属有机化合物激烈反应,使
引发剂失去活性。其它杂质允许含量以10-6计。因此,原料、反应系
统中设备和管道必须经脱氧、脱水处理,使H2O和O2含量在10-6以下。 ❖
③溶剂的选用要与引发剂匹配 采用Co系和Ti系引发剂时以苯或甲苯作溶剂;采用
Ni-三元引发剂时,采用芳烃和烷烃的混合物作溶剂。 我国因采用Ni-三元引发剂
[(CH2)nCOO]2 Ni/BF3.O(C2H5)2 /Al(i-C4H9)3
溶剂选用抽余油或加氢汽油。
• 其优点:来源丰富、毒性小、回收费用低、容易分离,因而 成本低。
❖ ②溶剂的选择 ❖ 聚合用溶剂国外主要采用苯或甲苯或烷烃和芳烃的混合物。 ❖ 用苯作溶剂的优点是其对单体和聚合物的溶解性能好、沸点低容
易回收和分离;其缺点是聚合物溶液粘度大对传热不利,且冰点低 (5℃)要求管道保温,毒性大。 ❖ 用甲苯作溶剂的优点是其对单体和聚合物的溶解性能好,反应平 稳;其缺点是由于沸点高(110℃)回收时蒸气消耗量大, ❖ 聚合物溶液粘度大传热和搅拌都有困难,毒性也大。采用烷烃和 芳烃的混合物,既可以使聚合物溶液粘度降低,又可以调节聚合物的 相对分子质量。
此外,如丙二烯、丁二烯、甲基乙炔等对聚合反应和聚 合物的立构规整性都是有害的;
饱和烃如乙烷和丙烷如含量高会降低单体的分压,影响 聚合速率,如有积累需定期排除。
因此,聚合用原料和助剂中杂质的含量必须减少到允许 的范围以下。聚合用丙烯的纯度>99.6%,其它杂质允许含 量以10-6计。
第三章链式聚合反应3()配位聚合(学生)PPT课件

带有“假不对称碳原子”的立体异构中心标记为:d、l构型或r、s构 型
(2) 高聚物中立体异构体的类型
(B) 旋光异构体
➢ 单取代烯烃的立体异构类型 全同立构:分子链中每个结构单元上的立体异构中心具有
相同的dddddd或llllll构型。 如,isotatic PP (it-PP) 间同立构:分子链中d和l构型交替排列。如, syndiotatic
结晶度高。 ● 主要贡献
实现了难于进行自由基聚合的丙烯的工业化生产; 实现了乙烯的低压聚合等。开辟了新的聚合领域。 ● 应用
PP、HDPE、PS、BR、EPR等。
一、引言
不同类型聚合反应合成的聚合物性能相差很大
表 聚合反应类型和聚乙烯的主要物性
条件和性质
自由基
配位型
引发剂 温度/C 压力/MPa 密度/g/cm3 结晶度/% 熔点/C 问世时间 名称
(2) 高聚物中立体异构体的类型 (A) 几何异构体
产生的原因:由双键或环上的取代基在空间的排布方式不同引起的。 实例:
(2)高聚物中立体异构体的类型
(B) 旋光异构体
产生原因:由分子中存在一个或多个不对称碳原子,或者虽无不对称 碳原子,但存在着分子整体的不对称性所引起的。其中具有旋光性的 为旋光性聚合物,不显光学活性的碳原子称为“假不对称碳原子”, 但是真的立体异构中心。
实例:聚丙烯
CH3
CH3
CH3
CH3
CH3
CH3
~CH2-C| *-CH2-C| *-CH2-C| *-CH2-C| *-CH2-C|*-CH2-C| *~
|
|
|
|
|
|
H
H
H
H
H
阴离子聚合
丙烯腈 甲基丙烯腈 甲基丙烯酮
偏二氰乙烯
a-氰基丙烯酸乙酯
硝基乙烯
单体活性
低
中
较高
高
苯乙烯在自由基聚合是活性单体,在阴离子聚合成低活性单体?
四. 阴离子聚合机理
1.机理:引发、增长、終止。
链引发:I
链增长: 链終止:
极快
M-
慢 M nM M n1M
M n1M 难終止
烷基卤化镁RMgX由于其C-Mg键极性弱,不能直 接引发阴离子聚合,但制成格氏试剂后使C-Mg键的 极性增大,可以引发活性较大的单体聚合。
以丁基锂和萘钠最为重要也最为常用的引用剂。
三. 阴离子聚合引发剂和单体的匹配
阴离子聚合与自由基聚合相比,单体对引发剂 有较强的选择性,只有当引发剂与单体活性相 匹配才能得到所需的聚合物。
甲基丙烯酸甲酯
CH3
H2C CH CH CH2
H2C C
CH CH2
苯乙烯
甲基苯乙烯
丁二烯
异戊二烯
乙烯基单体,取代基的吸电子能力越强,双键上的电子云密度 越低,越易与阴离子活性中心加成,聚合反应活性越高。
二. 阴离子聚合引发体系和引发 阴离子聚合引发剂——电子给体,即亲核 试剂,属于碱类。
直接转移引发
一. 阴离子聚合的单体 (1)带吸电子取代基的乙烯基单体
一方面,吸电子性能能使双基上电子云密度降低,有利 于阴离子的进攻,另一方面,形成的碳阴离子活性中心由于 取代基的共轭效应而稳定,因而易阴离子聚合:
H2C CH X
降低电子云密度,易 与富电性活性种结合
H2C CH X
H R CH2 C X
分散负电性,稳定活性中心
强碱性高活性引发剂能引发各种活性的单体,而弱碱 性低活性引发剂只能引发高活性的单体。
高分子化学第三章 自由基聚合

• 链转移反应前后,自由基的数目未变。
35
1. 向单体转移
· ~~CH2-CH + CH2=CH Cl Cl
· ~~CH=CH + CH3-CH Cl Cl
• 注意CH2=CHCl单体
36
2. 向溶剂或链转移剂转移
X ~~CH2CH · + YS X ~~CH2CHY + S ·
• 溶剂:
• 链转移剂:有较强的链转移能力的化合
1 2
[I ]
1
2
[M ] (3—35式)
注意本方程的适用范围
73
二、温度对聚合速率的影响
• 阿累尼乌斯公式:K=Ae–Ea/RT
其中:K=kp(kd/kt)½ 则:Ea=Ep+Ed/2–Et/2
74
一般情况下: Ep≈29kJ•mol–1, Ed≈126kJ•mol–1 Et≈17kJ•mol–1
10
一、 聚合的可能性
• 主要取决于双键上取代基的空间 效应
11
1.烯类单体: CXY=CMN
(1)一取代( CH2=CHX)
可均聚合
12
(2)二取代
(CH2=CXY、CHX=CHY) (a)1,1——二取代:一般不考虑空 间位阻效应,可均聚合。
注意:CH2=C(Ar)2只能形成二聚体
13
(b)1,2——二取代
54
2.半衰期
[I] ln = Kd t [I0]
• 60℃
ln2 t½ = K d
(3—17)
t½ >6h,低活性引发剂 1h< t½ <6h,中活性引发剂 t½ <1h,高活性引发剂
55
3. 引发效率
高分子化学名词解释

第一章绪论(Introduction)高分子化合物(High Molecular Compound):所谓高分子化合物,系指那些由众多原子或原子团主要以共价键结合而成的相对分子量在一万以上的化合物。
重复单元(repeating unit):聚氯乙稀分子链可以看作结构单元多次重复构成,因此括号内的化学结构也可称为重复单元或链节(chain element)。
聚合度(degree of polymerigation):重复单元的数目n,表征聚合物分子量大小的一个物理参数。
分子量分布(Molecular Weight Distribution, MWD ):由于高聚物一般由不同分子量的同系物组成的混合物,因此它的分子量具有一定的分布,分子量分布一般有分布指数和分子量分布曲线两种表示方法。
分子量分布指数(多分散系数): D=1 均一分子量 D>1 分子量多分散性多分散性(Polydispersity):聚合物通常由一系列相对分子量不同的大分子同系物组成的混合物,用以表达聚合物的相对分子量大小并不相等的专业术语叫多分散性。
加聚反应(addition polymerigation):通过打开环或双键、三键互相联结起来而形成聚合物的反应。
聚合过程中无小分子副产物生成。
缩聚反应(polycondensation):缩聚反应通常是经由单体分子的官能团间的反应,在形成缩聚物的同时,伴有小分子副产物的生成。
链(增长)式聚合(链式聚合,chain (growth) polymerigation):烯类单体的加聚反应,绝大多数属于链增长聚合反应。
反应过程中,反应体系始终由单体、高相对分子质量聚合物和微量引发剂组成,没有中间产物,单体转化率与反应时间无关。
逐步(增长)聚合(step growth polymerigation):逐步聚合没有活性中心,它是通过一系列单体上所带的能相互反应的官能团间的反应逐步实现的。
绝大多数缩聚反应以及合成聚氨酯的聚加成反应等等都是逐步增长聚合反应。
自由基聚合(第三章)

46
(4)无机过氧化类引发剂 过硫酸盐,如过硫酸钾(K2S2O8)和过硫 酸铵[(NH4)2S2O8]。水溶性引发剂,主要用于 乳液聚合和水溶液聚合。 分解温度:60~80℃,解离能109~140kJ/mol
O KO S O O O O S O OK 2 KO O S O O O 2 O S O O + 2K
发反应速率最小,是控制聚合过程的关键。
慢引发、快增长、易转移,速终止
39
(2)只有链增长反应使聚合度增加。从单体 转化为大分子的时间极短,瞬间完成。体系中 不存在聚合度递增的中间状态。聚合度与聚合 时间基本无关。
自由基聚合中分子 量与时间的关系
40
(3)单体浓度随聚合时间逐步降低,聚合物 浓度逐步提高。延长聚合时间是为了提高单体 转化率。 (4)少量阻聚剂(0.01~0.1%)足以使自由 基聚合终止。
RMn*
聚合过程中有时还会发生链转移反应, 但不是必须经过的基元反应。
3
引发剂分解成活性中心时,共价键有两种
裂解形式:均裂和异裂。
均裂的结果产生两个自由基;异裂的结果形
成阴离子和阳离子。
R A R B 2R A + B
自由基、阴离子和阳离子均有可能作为连 锁聚合的活性中心,因此有自由基聚合、阴
离子聚合和阳离子聚合之分。
CH2 CH + X CH X CH2 CH2 CH X CH X
32
CH2
歧化终止:链自由基夺取另一自由基的氢原
子或其他原子而相互终止的反应。生成的高分
子一端为引发剂碎片,另一端为饱和或不饱和
结构,两者各半,聚合度与链自由基中的单元
配位聚合

配位聚合
TiCl4/Al(C2H5)3称为Ziegler引发剂, TiCl3/ Al(C2H5)3称为Natta引发剂,合称为Ziegler— Natta引发剂。
重要意义:可使乙烯、丙烯等低级烯烃
聚合,产物具有高度规整性
3
配位聚合
Goodrich-Gulf公司采用TiCl4-AlEt3引发体
系使异戊二烯聚合,得到高顺式1, 4-聚异戊二
烯(顺式率达95%~97%)。
Firestone轮胎和橡胶公司采用Li或烷基锂引
发丁二烯聚合,得到高顺式1, 4-聚丁二烯(顺 式率90%~94%)。
4
配位聚合
4.2 聚合物的立体规整性
4.2.1 聚合物的立体异构体 结构异构(同分异构):化学组成相同,原子
和原子团的排列不同。
头-尾和头-头、尾-尾连接的结构异构;
引发剂活性可提高到5×104 g PP/g Ti。
第三代引发剂,除添加第三组分外,还使
用了载体,如:MgCl2、Mg(OH)Cl等,引发剂
活性可达6×105 g/g Ti 或更高。
37
配位聚合
4.4.2 Z-N引发剂的类型
将主引发剂、共引发剂、第三组分进行组
配,获得的引发剂数量可达数千种,现在泛指一 大类引发剂。 就两组分反应后形成的络合物是否溶于烃类 溶剂,分为可溶性均相引发剂和不溶性非均相引 发剂,后者的引发活性和定向能力较高。
高压聚乙烯或低密度聚乙烯。
1
配位聚合
1953年,德国人Ziegler 采用TiCl4/Al(C2H5)3 为引发剂,在低温(60~90 ℃)和低压(0.2~1.5MPa) 条件下实现了乙烯的聚合。分子链中支链较少, 结晶度较高,密度达0.94~0.96。因此称为低压 聚乙烯或高密度聚乙烯。 1954年,意大利人Natta 采用TiCl3/Al(C2H5)3 为引发剂,实现了丙烯的聚合,产物具有高度的 等规度,熔点达175 ℃。
高分子化学第三章(5)

CH3 CH2 C + H (BF3OH) CH3 CH3
CH3 C (BF3OH) CH3
对于碳阳离子供体供引发剂的情况:
SnCl4 + RCl RX
CH3 CH2
活性聚合物
阴离子聚合在适当条件下(体系非常纯净;单体为非极性共轭 双烯),可以不发生链终止或链转移反应,活性链直到单体完 全耗尽仍可保持聚合活性。 这种单体完全耗尽仍可保持聚合活性的聚合物链阴离子称 为“ 活性高分子”(Living Polymer)。
实验证据 萘钠在THF中引发苯乙烯聚合,碳阴离子增长链为红色,直到 单体100%转化,红色仍不消失。
(3)终止反应
离子聚合无双基终止。阳离子聚合主要通过链转移终 止。而阴离子聚合连链转移反应都很难发生,因此实际上 不存在终止反应。增长反应中的活性链直到单体完全耗尽 仍可保持活性,因此有“活性聚合”的概念。
每一活性中心所连接的单体数基本相等,分 子量等于单体摩尔数除以引发剂摩尔数,且比较 均匀,分布窄。 1956年,Swarc 采用萘-钠引发体系,以 THF为溶剂进行苯乙烯阴离子聚合,首次发现 活性聚合物。
C4H9
Li
+
OC4H8
C4H9
+
[ Li
OC4H8 ]
4. 活性阴离子聚合
机理
阴离子聚合的特点: 快引发,慢增长,无终止和无转移。 (1)引发反应 阴离子聚合的引发活性种可以是离子对和自由 离子。这与溶剂的极性有关。 极性溶剂:自由离子;非极性溶剂:离子对, 也有同时存在的情况。 (2)增长反应 在增长反应中,单体的加成方向受离子对的限 制,产物的立构规整性较自由基聚合强,但不能控 制。
离子聚合和配位(聚丙烯)

HX CC
HH
CH2
C
H
间同立构高分子
非极性溶剂中:链增长活性中心与抗衡阳离子表现为紧 密离子对,相互间作用较强,单体与链增长活性中心加 成是主要受这种相互作用的影响,有利于获得全同立构 高分子。以烷基锂引发的甲基丙烯酸甲酯的阴离子聚合 为例,一般认为其机理如下:
于阴离子的进攻,另一方面,形成的碳阴离子活性中心由于
取代基的共轭效应而稳定,因而易阴离子聚合:
H2C CH X
降低电子云密度,易 与富电性活性种结合
H R CH 2 C
X
分散负电性,稳定活性中心
H2C CH X: -NO2, -CN, -COOR, -Ph, -CH=CH2 X
但对于一些同时具有给电子p-π共轭效应的吸电子取代基单 体,由于p-π给电子共轭效应减弱了吸电子诱导效应对双键 电子云密度的降低程度,因而不易受阴离子的进攻,不易 阴离子聚合。如:
Ziegler-Natta催化剂的乙烯的配位聚合则可在低(中)压 条件下进行,不易向高分子链转移,得到的是线形高分子,分 子链之间堆砌较紧密,密度大,常称高密度聚乙烯(HDPE)。
紧密离子对
溶剂分离离子对 自由离子
离解程度增加
反应活性增加
阴 离 子 聚 合 单体
阴离子聚合单体必须含有能使链增长活性 中心稳定化的吸电子基团,主要包括带吸电子 取代基的乙烯基单体、一些羰基化合物、异氰 酸酯类和一些杂环化合物。
(1)带吸电子取代基的乙烯基单体
一方面,吸电子性能能使双基上电子云密度降低,有利
自由基、阴阳离子、配位聚合

配位聚合:配位聚合反应的活性中心既不是 带独电子的游离基,也不是带正或负电荷的 离子,而是引发剂中含有烷基的过渡金属元 素的空的 d 轨道,单体能在空 d 轨道上配位 而被活化,随后烷基及双键上的Π 电子对发生 移位,使链增长,所以叫配位聚合。
配位聚合的特点
1、单体π电子进入亲电性金属空轨道,配位形成 π络合物; 2 、活性中心是阴离子性质的,故可称为配位阴 离子聚合; 3、反应经四元环过渡态的插入过程; 4 、通过一级插入或二级插入,可形成立构规整 聚合物; 5 、调节催化剂中配位体的数量,可以改变催化 性能达到调节聚合物立构规整性的目的。
温度对聚合速率的影响
K与温度T的关系遵循Arrhenius方程,即
自 由 基 聚 合
k Ae
E
RT
(3-39)
总速率常数k与各基元速率常数间的关系:
kd k kp k t
1
2
(3-40) (3-41)
E (E p Et / 2) Ed / 2
2014-12-19 9
k Ae
( Ep1\ 2 Et 1/ 2 Ed )
RT
Ed:125kJ/mol
EP:29kJ/mol
Et:17kJ/mol 则有 E=83kJ/mol
E为正值:温度升高,速率常数增大 E值越小,聚合速率越大
E值越大,温度对聚合速率影响就越显著
2014-12-19 10
温度对聚合度的影响
自由基不稳定 , 倾向于相互结合 电子配对稳定化;或夺取其它化 活性中心
碳阴离子:具有未成键的电子 对,仍占据sp3 轨道。其构型与 四价碳一样 , 为四面体的锥形 结构。未共享电子对占据四面 体的一个顶点,由于中心碳原 子含有未共享电子对,因此任 何使碳阴离子电子云密度降低 的结构均会使碳阴离子得稳定 性增加。从诱导效应看,吸电 子基团的增加有利于碳阴离子 的稳定。
聚合反应

n
X
n
单体相对分子质量
K
2 p
而平均聚合度可表示为: 1 不考虑链转移反应--X
n
M
K tc
1 X
n0
2 K td R p
C s XA / M
2 考虑链转移反应---
1 X
n
[XA]为链转移剂浓度 Cs为链转移常数
Cs=Ktr/Kp
反应条件对平均相对分子质量的影响
自由基聚合反应 阳离子聚合反应
加聚反应
由一个活性中 心引发单体聚 合,聚合物通 过单体连锁反 应生成
阴离子聚合反应
配位聚合反应
加聚反应与缩聚反应的不同
加聚反应
1.大多是不可逆 2.链式反应 3.链增长通过单体加在活性中心
缩聚反应
1.一般是可逆的 2.逐步反应 3.增长反应是聚合体与聚合体,聚 合物与单体的反应 4.单体浓度在反应初期即迅速下降 4.单体浓度逐渐减少 并趋于0 5.反应过程中相对分子质量逐渐增 5.迅速生成高相对分子质量聚合物, 大 相对分子质量为定值 6.反应时间增加、产率增加,相对 6.反应时间增加、产率变化不大, 相对分子质量变大 分子质量变化不大
改善聚合物的耐水解性能,热降解性能。
5. 改变溶解性能—制备水溶性成膜物,引入含有羧基的单体。 6. 成膜物的功能化—含有机锡单体共聚,得到具有防污能力
2.酚醛树脂
最早用于涂料的合成树脂。 与环氧树脂并用制备抗腐性能优良的涂料。 酚醛树脂由酚和甲醛缩合而成 一般塑料工业上用酚醛树脂主要两种
OH OH H O H 2C + HCHO 过量 n CH2 OH
热固性树脂-立索尔 带有较多羟甲基,M较低
配位聚合(3)

真正的催化剂并不是两个组分简单络合, 而是经熟化过程才产生高效催化活性, 有复杂的烷基化还原反应。
TiCl 4 + Al(C 2H5)3 C2H5TiCl 3 TiCl 3 + Al(C 2H5)3 C2H5TiCl 2
(C2H5)2AlCl + C 2H5TiCl 3 TiCl 3 + C2H5 (C2H5)2AlCl + C 2H5TiCl 2 TiCl 2 + C2H5
③ 第三组分
例 胺类、醚和一些含磷的化合物,如 N(C4H9)3以B: 来表示,对各种铝的化合 物具有络合能力,但络合能力的程度不 同,有下列络合稳定顺序:
B:→AlCl3 > B:→AlRCl2 > B:→AlR2Cl >B:→AlR3
③ 第三组分 当烷基铝化合物在催化剂形成过程 中,进行了烷基化还原反应后:
Ziegler-Natta非均相催化剂生成时, 只有表面的催化剂能形成聚合催化活性 中心,颗粒内部都不起作用,浪费了催 化剂的用量
使用超细 颗粒载体 催化剂高度分 散在载体表面
高效催化剂
④ 高效催化剂载体
超 细 颗 粒 载 体 ---- 例 如 Mg(OH)Cl 、 MgC12 、Mg(OH)2 等颗粒,使新生成的催 化剂高度分散在载体表面, 催化剂的活性表面由原来的1~5m2/g, 增加到75~200m2/g,产生所谓高效催化剂。 这种催化剂每克钛可聚合得3×l05克聚丙 烯,甚至更多。不用载体得3×l03g/gTi , 聚合物含催化剂量很少,不需后处理清除 催化剂残留物 而且立构规整度提高到95%以上,催化 剂的稳定性提高,寿命增长。
天然产物纤维素和淀粉,两种聚合 物的结构单元都是葡萄糖单元,只是立 体构型不同,其性质相差极大。
配位聚合-阴离子聚合-阳离子聚合-自由基聚合活性中心结构的特征

• 催化剂内部结构、配位状态都很复杂,dZ2电 子云的密度受四个角上的配位原子的影响,使
引发基本身的活性不一样,所以聚合物的分子
量分布较宽
Thank you!
温度的影响
对聚合速率的影响
综合速率常数
kR =
ki kp kt
kR=AA iA tpe-(Ei+Ep-Et)/RT
E i+ E p -E t=2 1 ~ 4 1 .8 k J/m o l
综合活化能为正值时,温度降低,聚合速率减小 综合活化能为负值时,温度降低,聚合速率加快 综合活化能的绝对值较小,温度影响也较小
6
对聚合度的影响
Xn =
kP [M] kt
kP Xn = ktr,M
kXn=A Atpe-(Ep-Et)/RT kXn=AtA r,M p e-(Ep-Etr,m)/RT
EXn=Ep-Et
EXn=Ep-Etr,M
Et 或 Etr,M 一般总大于Ep,综合活化能为负值,为 -12.5 ~ -29 kJ / mol
因此,聚合度随温度降低而增大
这是阳离子聚合在较低温度下进行聚合的原因.
7
配位聚合机理
——单体分子的C=C双键先在过渡金属催化剂的活性中心的空 位上配位,形成某种形式的络合物,随后单体分子相继插入过 渡金属-碳键中进行增长。
配位聚合
• 单体:α-烯烃、二烯烃等
Mw/Mn2
• 催化剂:Ziegler-Natta催化剂; 带dZ2轨道,或 f 轨道的金属
自由基聚合基本原理及其特点
——共价键均裂产生自由基,成为活性中心引发 聚合反应。
R-R
R+R
R +nM
Polymer
4.3 离子键聚合与配位聚合

反应通式为
HMnM (CR) + M
转移速率为:
特点:
ktr,m
M n+1 + HM (CR)
Rtr,m = ktr,m [HM (CR) ] [M]
向单体转移是主要的链终止方式之一 向单体转移常数CM,约为10-2~10-4,比自由基聚合(10-4~10-5) 大,易发生转移反应 是控制分子量的主要因素,也是阳离子聚合必须低温反应的原因
共引发剂的活性视引发剂不同而不同
如异丁烯聚合,BF3为引发剂,共引发剂的活性: 水 :乙酸 :甲醇= 50 :1. 5 :1
16
对于多数聚合,引发剂与共引发剂有一最佳比,在此条件下, Rp最快,分子量最大
原因:
过量的共引发剂,如水是链转移剂,使链终止,分子量降低
CH 3 CH2 C (BF3OH) CH 3 + H2O CH2 CH 3 C CH 3 OH + H (BF3OH)
Cl
HSO4- H2PO4-的亲核性稍差,可得到低聚体 HClO4,CF3COOH,CCl3COOH的酸根较弱,可生成高聚物
13
2. Lewis酸引发
能吸收电子云的分子或原子团称为路易斯酸
F-C反应中的各种金属卤化物,都是电子的接受体,称Lewis酸 从工业角度看,是阳离子聚合最重要的引发剂
Lewis酸包括: 金属卤化物: BF3 , AlCl3, SnCl4 , TiCl4, SbCl5, PCl5, ZnCl2 金属卤氧化物: POCl3,CrO2Cl,SOCl2,VOCl3
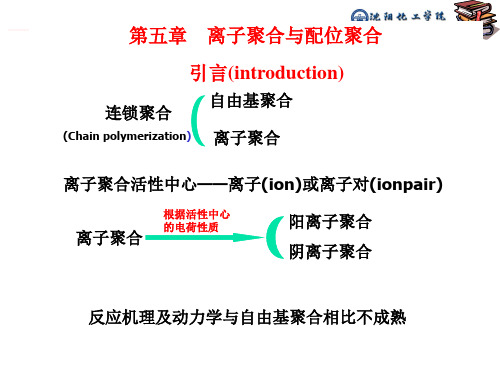
逐步聚合
连锁聚合
自由基聚合
阳离子聚合
阴离子聚合 配位离子聚合
引 言
• 离子聚合的理论研究始于50年代; 1953年,Ziegler齐格勒在常温低压下制得PE; 1956年,Szwarc兹瓦克发现了“活性聚合物”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章离子聚合与配位聚合生产工艺共价键均相断裂产生两个自由基,非均相断裂则产生离子。
离子聚合反应:乙烯基单体、二烯烃单体以及一些杂环化合物在某些离子的作用下进行的聚合反应称为离子聚合反应。
根据增长链链端离子所带电荷的性质,分为:阳离子聚合反应和阴离子聚合反应。
配位聚合反应:由配位聚合催化剂引发乙烯基单体,二烯烃单体进行空间定向聚合,是一类特殊的离子聚合反应体系,称之为配位阴离子聚合反应,简称配位聚合反应。
配位聚合催化剂:由过度金属卤化物与有机金属化合物组成的络合型聚合催化剂体系,由于属于配位络合结构,所以称为配位聚合催化剂。
第一节离子聚合反应及其工业应用一、阳离子聚合反应及其工业应用1、阳离子聚合反应阳离子聚合反应是乙烯基单体或某些杂环单体如环醚、环缩醛、环亚胺、环硫醚、内酰胺、内酯等在阳离子引发剂(或称催化剂)作用下生成相应离子进行聚合的反应。
例如:乙烯基单体在阳离子引发剂作用下进行的阳离子聚合反应为:链引发链增长链转移与终止向单体链转移由于阳离子增长链末端带有正电荷,所以具有亲核性的单体或碱性单体易于发生阳离子聚合反应,但容易从单体分子中夺取质子而发生向单体链转移的副反应或与亲核杂质反应终止。
即使在很低的温度下,也容易发生链转移反应,因而不易得到高分子量产品。
所以工业上用异丁烯和少量异戊二烯经阳离子聚合反应生产丁基橡胶时聚合温度须低至—100℃。
氧正离子、硫正离子等的活性低于碳正离子,所以杂环单体经阳离子聚合反应生产高分子量聚合物可在65℃以上进行。
2、工业应用高分子合成工业中应用阳离子聚合反应生产的聚合物主要品种如下:聚异丁烯:异丁烯在阳离子引发剂AlCl3、BF3等作用下聚合,由于聚合反应条件、反应温度、单体浓度、是否加有链转移剂等的不同而得到不同分子量的产品,因而具有不同的用途。
低分子量聚异丁烯(分子量<5万),为高粘度流体,主要用作机油添加剂、粘合剂等。
高分子量聚异丁烯为弹性体用作密封材料和蜡的添加剂或作为屋面油毡。
异丁烯与少量异戊二烯的共聚物称作丁基橡胶,其聚合度为5万~50万。
所用引发剂为AlCl3,溶剂为二氯甲烷,于173K聚合而得。
聚甲醛:由三聚甲醛与少量二氧五环经阳离子引发剂AlCl3、BF3等引发聚合。
用作热熔粘合剂、橡胶配合剂等。
聚乙烯亚胺:主要是环乙胺、环丙胺等经阳离子聚合反应生成聚乙烯亚胺均聚物或共聚物,它是高度分支的高聚物。
用作絮凝剂、粘合剂、涂料以及表面活性剂等。
3、阳离子聚合得到的特殊聚合物可合成分子量较狭窄和可控制分子量的聚合物。
在适当引发剂作用下阳离子增长链可以表现为“活性’’增长链,从而有控制的合成适当分子量及分子量分布的聚合物。
可以进行活性阳离子聚合反应的单体有:乙烯基醚类单体、异丁烯,苯乙烯及其衍生物等,其中以乙烯基醚类单体最为重要。
具有功能性悬挂基团的聚合物,为梳形结构。
二、阴离子聚合反应及其工业应用1、阴离子聚合反应可以发生阴离子聚合的单体主要有两类:一是乙烯基或二烯烃单体,它们须带有可使负电荷稳定的吸电子取代基;二是环状单体如内酰胺、内酯、环氧杂烷、异氰酯等。
阴离子聚合引发剂为碱、路易士碱和碱金属、金属羰基化合物、胺、磷化氢以及格式试剂等。
阴离子聚合通常在极性溶剂中如四氢呋喃、乙二醇甲醚、吡啶等进行。
这种情况下,对应阳离子的影响可减少。
阴离子聚合反应历程包括链引发与链增长,根据需要,链终止可以避免。
反应历程链引发链增长链终止2、阴离子聚合的主要特点链增长反应:链增长反应是通过单体插入到离子对中间完成的。
离子对的存在形式对聚合速率、聚合度和结构均有影响。
溶剂以及溶剂中的少量杂质影响反应速度和链增长模式。
例如有机锂引发丁二烯和异戊二烯阴离子聚合过程中,如在所用烃类溶剂中加入近于有机锂计算量的强溶剂四氢呋喃,则1,4加成反应明显降低,而有利于1,2或3,4加成反应。
丁二烯与异戊二烯阴离子聚合过程中无溶剂存在,而引发剂用量较低时,顺式-1,4产品含量最高。
3、工业应用(1)合成分子量甚为狭窄的聚合物(2)利用中聚合反应结束时需加入终止剂这一特点,合成具有适当功能团端基的聚合物。
如加入特殊试剂合成链端具有-OH、-COOH、-SH等功能基团的聚合物。
(3)利用先后加入不同种类单体进行阴离子聚合的方法合成AB型、ABA型以及多嵌段、星形、梳形等不同形式的嵌段共聚物。
热塑性橡胶的生产是工业上重要成就。
第二节配位聚合反应及其工业应用1. 概述定义:配位聚合反应是烯烃单体的碳-碳双键与引发剂活性中心的过渡元素原子的空轨道配位,然后发生位移使单体分子插入到金属-碳之间进行链增长的一类聚合反应。
创始人:齐格勒(Ziegler)与纳塔(Natta)主要贡献:实现了难于进行自由基聚合的丙烯的工业化生产;实现了乙烯的低压聚合等。
开辟了新的聚合领域。
应用:合成树脂工业中高密度聚乙烯(HDPE)、聚丙烯及其共聚物;合成橡胶工业中顺丁橡胶、合成天然橡胶以及乙丙橡胶都是经配位聚合反应进行生产的。
配位聚合的特点a. 单体首先与亲电性金属配位形成络合物。
b. 反应具有阴离子性质。
α碳原子的亲核进攻插入反应包括两个同时进行的化学过程。
2、聚合物的立体异构由于分子中的原子或基团的空间构型和构象不同而产生。
立体异构包括构象异构和构型异构。
构象异构是原子或基团绕C—C单键内旋转而产生的;构型异构是原子或基团在大分子中不同的空间排列所产生的。
构型异构有手性异构和几何异构两种。
手性异构又称对映异构,是由手性中心产生的光学异构体R(右)型和S(左)型。
几何异构是由双键引起的顺式(Z)和反式(E)顺反异构。
手性异构(1)全同立构高分子(isotactic polymer):主链上的C*的立体构型全部为R型或S型。
(2)间同立构高分子(syndiotactic polymer ):主链上的C*的立体构型各不相同, R 型与S 型相间连接。
全同和间同立构聚合物统称为有规立构聚合物。
(3)无规立构高分子(atactic polymer ):主链上的C*的立体构型紊乱无规则连接。
几何异构共轭双烯单体聚合时可形成结构不同的单体单元。
顺式1,4-加成结构 反式1,4-加成结构3、立构规整性聚合物的性能-烯烃聚合物聚合物的立构规整性影响聚合物的结晶能力。
聚合物的立构规整性好,分子排列有序,有利于结晶。
高结晶度导致高熔点、高强度、高耐溶剂性。
如:无规PP ,非结晶聚合物,蜡状粘滞体,用途不大。
全同PP 和间同PP ,是高度结晶材料,具有高强度、高硬度、高耐溶剂性,用作塑料和合成纤维。
全同PP 的Tm 为175 ℃,可耐蒸汽消毒,比重0.90。
二烯烃聚合物如丁二烯聚合物: 1, 2聚合物都具有较高的熔点。
全同 Tm = 128℃;间同 Tm = 156℃。
1, 4聚合物,反式1, 4聚合物,Tg = -80℃, Tm =148℃,是较硬的低弹性材料;顺CH 2CH CH 23CH CH 2CH33CH 2CH CH 2CH 3CH CH 2CH CH 3CH 3CH 2CHCH 3CH 2CH CH 2CH 3CH CH 2CH CH 3CH 3CH 2CHCH 3HHHHH HH HH式1, 4聚合物,Tg = -108℃, Tm = 2 ℃,是弹性优异的橡胶 。
对于合成橡胶,希望得到高顺式结构。
立构规整度聚合物的立构规整性用立构规整度表征。
立构规整度:是立构规整聚合物占总聚合物的分数。
是评价聚合物性能、引发剂定向聚合能力的一个重要指标。
全同聚丙烯的立构规整度(全同指数、等规度)常用沸腾正庚烷的萃取剩余物所占百分数表示。
4. 齐格勒-纳塔(Ziegler-Natta)催化剂Zieler-Natta 催化剂指的是由IV~VIII 族过渡金属卤化物与 I~ III 族金属元素的有机金属化合物所组成的一类催化剂。
其通式可写为:常用的主催化剂:TiCl4。
TiCl3,VCl3,VOCl3,ZrCl3等,其中以TiCl3最常用; 助催化剂最有效的是一些金属离子半径小、带正电性的金属有机化合物,因为它们的配位能力强,易生成稳定的双金属活性中心。
如Be ,Mg ,Al 等金属的烷基化合物,其中以AlEt3最常用。
Al / Ti 的mol 比是决定引发剂性能的重要因素,适宜的Al / Ti 比为1. 5 ~ 2. 5。
评价Z-N 引发剂的依据:产物的立构规整度;产品质量;聚合速率;产品产量: g 产物/gTi 。
第三组分为了提高引发剂的定向能力和聚合速率,常加入第三组分(给电子试剂)——含N 、P 、O 、S 的化合物:六甲基磷酰胺 丁醚 叔胺第一代Z-N 催化剂,是用Al 还原TiCl 4其组成为3TiCl 3-AlCl 3/Al(C 2H 5)Cl ,其催化效率为1~5 kg PP/ g Ti ,等规指数仅88%~91%;第二代催化剂,是用TiCl 3取代3TiCl 3-AlCl 3与Al(C 2H 5)Cl 组成的催化剂,其催化效率提高到20 kg PP / g Ti ,等规指数高达95%;第三代引发剂,除添加第三组分外,还使用了载体,如:MgCl2或者Mg(OH)Cl 。
引发剂活性达到600~2000 kg / g Ti ,等规指数高达98%。
将主引发剂、共引发剂、第三组分进行组配,获得的引发剂数量可达数千种,现在泛指一大类引发剂。
(CH 3)2N 3P=O (C 4H 9)2O N(C 4H 9)3使用Z-N 引发剂注意的问题主引剂是卤化钛,性质非常活泼,在空气中吸湿后发烟、自燃,并可发生水解、醇解反应;助引发剂烷基铝,性质也极活泼,易水解,接触空气中氧和潮气迅速氧化、甚至燃烧、爆炸。
在保持和转移操作中必须在无氧干燥的N2中进行;在生产过程中,原料和设备要求除尽杂质,尤其是氧和水分;聚合完毕,工业上常用醇解法除去残留引发剂。
5、 配位聚合反应机理 α -烯烃的配位阴离子聚合配位聚合机理,特别是形成立构规整化的机理,一直是该领域最活跃、最引人注目的课题,至今没有能解释所有实验的统一理论,有两种理论获得大多数人的赞同。
(1)Natta 的双金属机理1959年由Natta 首先提出,以后得到一些人的支持,要点如下:引发剂的两组分首先起反应,形成含有两种金属的桥形络合物——聚合活性中心。
金属有机化合物化学吸附在氯化钛上进行反应,形成缺电子桥双金属络合物,成为活性种。
α-烯烃的富电子双键在亲电的过渡金属Ti 原子和增长链端(或烷基)间配位,生成π-络合物,在钛上引发。
缺电子的桥形络合物部分极化后,由配位后的单体和桥形配合物形成六元环过渡状态。
极化的单体插入Al -C 键后,六元环瓦解,重新生成四元环的缺电子桥形络合物。
由于聚合时首先是富电子的烯烃在钛上配位,Al —R 键断裂成R 碳离子接到单体的碳上,因此称作配位阴离子聚合机理。
