常见的人名反应
基础有机化学人名反应

引言概述:基础有机化学是研究有机化合物的物理性质、化学性质、结构和合成方法的科学。
在有机化学领域,人名反应是一种重要的化学反应类别。
人名反应是以其发现者或主要贡献者的名字来命名的有机化学反应。
本文将介绍几个常见的基础有机化学人名反应,包括居里尔莫梅托反应、格里尼亚反应、梅林反应、勒纳-约翰逊反应和沃尔弗-克希尔反应。
正文内容:一、居里尔莫梅托反应1.居里尔莫梅托反应的概述和历史背景2.反应机理和关键步骤的详细解释3.应用和实例:居里尔莫梅托反应在有机合成中的应用领域和反应条件4.优势和局限性:居里尔莫梅托反应的优势以及在特定情况下的局限性5.进一步发展和改进:对居里尔莫梅托反应的未来发展和改进的前景进行讨论二、格里尼亚反应1.格里尼亚反应的基本原理和应用2.反应机理和关键步骤的详细解释3.不同类型的格里尼亚试剂的制备方法和特点4.格里尼亚反应在有机合成中的应用实例5.格里尼亚反应的改进和未来发展方向三、梅林反应1.梅林反应的概述和历史背景2.反应机理和关键步骤的详细解释3.梅林反应在合成有机化合物和天然产物中的应用4.梅林反应与其他反应的比较和优势5.对梅林反应未来研究和改进的展望四、勒纳-约翰逊反应1.勒纳-约翰逊反应的基本原理和历史背景2.反应机理和关键步骤的详细解释3.不同类型的勒纳-约翰逊试剂的制备方法和特点4.勒纳-约翰逊反应在有机合成中的应用实例5.对勒纳-约翰逊反应的改进和发展方向的讨论五、沃尔弗-克希尔反应1.沃尔弗-克希尔反应的概述和历史背景2.反应机理和关键步骤的详细解释3.沃尔弗-克希尔反应在药物合成中的应用4.不同类型的沃尔弗-克希尔试剂的制备方法和特点5.对沃尔弗-克希尔反应的改进和未来发展前景的展望总结:基础有机化学的人名反应是有机化学领域中的重要组成部分,各个人名反应都有其独特的反应机理和应用领域。
本文详细介绍了居里尔莫梅托反应、格里尼亚反应、梅林反应、勒纳-约翰逊反应和沃尔弗-克希尔反应的概述、反应机理、应用和改进方向。
人名反应(类型整理)

人名反应1氧化:1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evans aldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应:Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正:不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应):从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。
人名反应(类型整理)

人名反应1氧化:1.Baeyer-Villiger 氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化: 醇在NCS/DMF 作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4 氧化成羰基化合物4.Criegee臭氧化: 烯烃臭氧化后水解成醛酮5.Dakin 反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin 过碘酸酯氧化: 仲醇由过碘酸酯氧化成酮7. Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8. Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4 氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt 氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO 氧化醇,形成醛酮10.Oppenauer氧化: 烷氧基催化的仲醇氧化成醛酮11. Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12. Rubottom氧化:烯醇硅烷经过m-CPBA 和K2CO3处理后α-羟基化13.Sarett 氧化: CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N 淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada 氧化:烷基氟硅烷被KF,H2O2,KHCO3 氧化成醇16.Wacker 氧化: Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie 去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na 单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro 歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble 吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN 在冰醋酸当中还原吲哚双键可以解决8.Gribble 二芳基酮还原:用NaBH4 在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9. Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley 还原:用Al(OPr')3/Pr 'O体H 系将酮还原为醇12.Midland 还原:用B-3-α-蒎烯-9-BBN 对酮进行不对称还原13. Noyori 不对称氢化:羰基在Ru(II)BINAP 络合物催化下发生不对称氢化还原14. Rosenmund还原:用BaSO4/毒化Pd 催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn 作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin 烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme 丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons 反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting 反应简单的多7.Julia-Lythgoe 成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α - 硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting 反应9.Ramberg-Backlund 烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting 反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联: 芳基炔合成,同Cadiot-Chodkiewicz 偶联Eglinton 反应:终端炔烃在化学计量 (常常过量) Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联: Cu 催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck 反应: Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck 反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck 反应Hiyama 交叉偶联反应:Pb 催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF 催化剂存在下发生的交叉偶联反应Kumada 交叉偶联( Kharasch交叉偶联) :Ni 和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd 催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4 产生的Ti(0) 处理得到双键,反应是一个单电子过程Negishi交叉偶联: Pd催化的有机Zn 和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应: Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille 偶联: Pd催化的有机Sn 和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki 偶联: Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann 反应:芳基碘代物在Cu 存在下的自偶联反应Wurtz 反应:烷基卤经Na或Mg 金属处理后形成碳碳单键Ymada 偶联试剂: 用二乙基氰基磷酸酯(EtO)2PO-CN 活化羧酸缩合反应:Aldol 缩合: 羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn 反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应: 羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合: 酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi 处理生成终端炔烃Darzen 缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann 缩合:分子内的Claisen缩合Evans aldol反应: 用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe 缩合(2-吡啶酮合成): 氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry 硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch 加成反应:过渡金属催化的CXCl3 对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich 缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael 加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama 醇醛缩合:Lewis 酸催化下的醛和硅基烯醇醚之间的Aldol 缩合Nozaki-Hiyama-KIshi 反应:Cr-Ni 双金属催化下的烯基卤对于醛的氧化还原加成Pechmann 缩合(香豆素合成):Lewis 酸促进的酸和β-酮酯缩合成为香豆素Perkin 反应:芳香醛和乙酐反应合成肉桂酸Prins 反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann 反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser 对Witting 反应的修正:不稳定的叶立德和醛发生的Witting 反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter 反应(Michael-Stetter 反应):从醛和α ,β-不饱和酮可以得到1,4-二羰基衍生物。
人名命名的化学反应

人名命名的化学反应
以下是一些以人名命名的化学反应的例子:
1. 阿尔多利反应(Aldol reaction),以俄国化学家阿尔多利(Aldol)的名字命名,描述了碳-碳键的形成,是有机合成中常用的反应之一。
2. 伯克利-哈特利反应(Berkeley-Hartley reaction),以美国化学家伯克利(Berkeley)和哈特利(Hartley)的名字命名,用于合成含有苯环的化合物。
3. 格里格纳德反应(Grignard reaction),以法国化学家格里格纳德(Grignard)的名字命名,该反应用于合成碳-碳键和碳-金属键,是有机合成中的重要工具。
4. 巴尔-温克勒反应(Balz-Schiemann reaction),以德国化学家巴尔(Balz)和温克勒(Schiemann)的名字命名,用于合成芳香胺的重要反应。
5. 诺贝尔反应(Nobel reaction),以瑞典化学家诺贝尔
(Nobel)的名字命名,描述了硝基化合物的还原反应。
这些人名命名的化学反应代表了不同领域中科学家的贡献,通过命名反应来纪念他们的工作。
这些反应在化学研究和有机合成中发挥着重要的作用,并且持续影响着化学领域的发展。
有机化学人名反应

取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成α-氨基吡啶,如果α位已被占据,则得γ-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯—巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)—巴赫曼(Bachmann)反应。
7,柯尔伯—施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯—施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔—悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔—悌曼(Reimer —Tiemann)反应。
药物合成反应重要人名反应

1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃;2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃;3.Gattermann反应:将上面改为铜粉和氢卤酸;4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解有时在氟化钠或铜盐存在下加热,就可以制得较好收率的氟代芳烃;5.Williamson合成:醇在碱钠,氢氧化钠,氢氧化钾存在下与卤代烃反应生成醚;6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺;7.Delepine反应:用卤代烃与环六亚甲基四胺乌洛托品反应得季铵盐,然后水解可得伯胺;8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺;9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物;10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基;11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上;12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯;方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮;14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应;15.Vilsmeier-Haack反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下,在芳核或杂环上引入甲酰基;16.Rimer-Tiemann反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应;17.Claisen反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合;若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应;18.Aldol缩合:含有α-活泼氢原子的醛或酮,在碱或酸的催化下发生自身缩合,或与令一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物;该类化合物易脱水生成α,β-不饱和醛酮;19.Claisen-Schimidt反应:芳醛与含有α-活泼氢的醛、酮之间的缩合;芳醛和脂肪醛、酮在碱催化下缩合生成β-不饱和醛酮的就反应;20.Tollens缩合:甲醛在碱的催化下,可与含有α-活性氢的醛、酮进行醛醇缩合,在醛、酮的α-碳原子上引入羟甲基,产物是β-羟基醛或其脱水物——α,β-不饱和醛酮;21.Cannizzaro反应:22.Robinson环和:酯环酮与α,β-不饱和酮的共轭加成产物所发生的分子内缩合反应,可以再原来环结构基础上在引入一个环;23.Prins反应:烯烃与甲醛或其他醛在酸催化下加成而得1,3-丙二醇或其环状缩醛1,3-二氧六环及α-烯醇的反应;安息香缩合:芳醛在含水乙醇中,以氰化钾为催化剂,加热后发生双分子缩合生成α-羟基酮的反应;24.Reformatsky反应:醛或酮与α-卤代酸酯在金属锌粉存在下缩合而得β-羟基酸酯或脱水得α,β-不饱和酸酯的反应;25.Grignard反应:由有机卤素化合物卤代烃、活性卤代芳烃等与金属镁在无水乙醚存在下生成格式试剂,后者在与羰基化合物醛、酮等反应而得相应的醇类的反应;26.Blanc反应:芳烃在甲醛、氯化氢及无水二氯化锌三氯化铝、四氯化锡或质子酸等缩合剂的存在下,在芳环上引入卤烷基--CH2Cl的反应;27.Mannich反应:具有活性氢的化合物与甲醛或其他醛、胺进行缩合,生成胺甲基衍生物的反应;28.Pictet-Spengler反应:β-芳乙胺与羰基化合物在酸性溶液中缩合生成1,2,3,4-四氢异喹啉的反应;29.Strecker反应:脂肪族或芳香族醛、酮类与氰化氢和过量氨或胺类作用生成α-氨基腈,再经酸或碱水解得到dl-α-氨基酸类的反应;30.Michael反应:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合,生成β-羰烷基类化合物;31.Wittig反应:醛或酮与含磷试剂——烃代亚甲基三苯膦反应,醛、酮分子中的羰基的氧原子被亚甲基或取代亚甲基所取代,生成相应的稀类化合物及氧化三苯膦,此类反应称为羰基稀化反应;32.Horner反应:利用膦酸酯与醛、酮类化合物在碱存在下作用生成烯烃的反应;33.Knoevenagel反应:凡具有活性亚甲基的化合物在氨、胺或其羧酸盐的催化下,与醛、酮发生醛醇型缩合,脱水得α,β-不饱和化合物的反应;34.Stobbe反应:丁二酸酯或α-烃基取代的丁二酸酯在碱性试剂存在下,与羰基化合物进行缩合而得α-烷烃或芳烃亚甲基丁二酸单酯的反应;常用碱性试剂有醇钠,叔丁醇钾,氰化钠和三苯甲烷钠等35.Perkin反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成β-芳基丙烯酸类化合物的反应;36.Darzens缩合:醛或酮与α-卤代酸酯在碱催化下缩合生成α,β-环氧羧酸酯的反应;37.Diels-Alder反应:共轭二烯烃与烯烃、炔烃进行环加成,生成环己烯衍生物的反应;38.Wagner-Meerwein重排:在质子酸或lewis酸催化下生成的碳正离子中,烷基、芳基、或氢从一个碳原子通过过渡态,迁移至相邻带正电荷碳原子的反应;39.Pinacol重排:在酸催化下,邻二叔醇失去一分子水,重排成醛或酮的反应;40.二苯基乙二酮-二苯基乙醇酸型重排:α-二酮用强碱处理发生重排,生成α-羟基乙酸盐;41.Fovorski重排:α-卤代酮在碱氢氧化钠,醇钠,HNRR’催化下脱去卤原子,重排为羧酸或其衍生物的反应;42.Wolff重排:α-重氮酮经加热、光解或在某些金属等催化剂作用下脱去一分子氮气后重排成烯酮的反应;烯酮经进一步反应,生成羧酸、酯、酰胺或酮;43.Arndt-Eistert反应:酰氯与重氮甲烷反应得α-重氮酮,再经Wolff重排,生成比原来酰氯多一个碳原子的羧酸;44.Beckmann重排:醛肟与酮肟在酸催化剂作用下重排成取代酰胺的反应;45.Hofmann重排:氮上无取代基的酰胺用卤素溴或氯及碱处理,脱羧生成伯胺的反应;由于产物比反应物少一个碳原子,所以又称为Hofmann降解;46.Curtius重排:酰基叠氮化合物加热分解生成异腈酸酯的反应;47.Schmidt反应:在酸催化下,酸和酮或醛与氨或叠氮化钠反应生成伯胺、酰胺或腈的反应;48.Baeyer-Villiger氧化:在酸催化下,醛或酮与过氧酸作用,在烃基与羰基之间插入氧生成酯的反应;49.Stevens重排:α-位上具有吸电子基Z的季铵盐在强碱作用下,脱去一个α活泼氢生成叶立德,然后季氮上的烃基进行分子内1,2-迁移,生成叔胺的反应;50.Sommelet-Hauser重排:苄基季铵盐在强碱催化下,重排成邻位烃基取代的苄基叔胺的反应;51.Wittig重排:醚类化合物经强碱处理,分子中一个烃基发生迁移,生成醇的反应;52.Claisen重排:烯醇或酚的烯丙基醚加热,通过3,3-σ迁移使烯丙基自氧原子迁移到碳原子上的反应;53.Cope重排:1,5-二稀连二烯丙基经过3,3-σ迁移,异构化成另一双烯丙基衍生物的反应;54.Fischer吲哚合成:醛或酮的芳腙在适当催化剂存在下,脱氨基生成吲哚类化合物的反应;55.Oppenauer氧化:仲醇与丙酮在烷氧基铝存在下一起回流,将仲醇氧化成酮;56.Dakin反应:在芳香醛中,当醛基的邻、对位有羟基等供电子基团时,与有机过氧酸反应,醛基经甲酸酯阶段,最后转换成羟基;57.Sharpless环氧化反应:58.Wacker反应:在氯化钯、氯化铜存在下,利用空气中的氧气使烯烃转化成醛或酮的过程;59.Birch还原:芳香族化合物在液氨中用钠还原,生成非共轭二烯的反应;60.Clemmensen反应:在酸性条件下,用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基的反应;61.Wolff-кижер-黄鸣龙还原反应:醛酮在强碱条件下,与水合肼缩合成腙,进而放氮分解转化成甲基和亚甲基的反应;62.Meerwein-Ponndorf-Verley反应:将醛、酮等羰基化合物和异丙醇铝在异丙醇中共热,可还原得到相应的醇,同时将异丙醇氧化成丙酮;63.Leuckart反应:在甲酸及其衍生物存在下,羰基化合物与氨、胺的还原胺化反应;64.Rosenmund反应:酰卤在适当的反应条件下,用催化氢化或金属氢化物选择性的还原为醛的反应;65.Bouveault-Blanc反应:将羧酸酯用金属钠和无水醇直接还原生成相应的伯醇,主要用于高级脂肪酸酯的还原;66.偶姻缩合:羧酸酯在惰性溶剂如醚、甲苯、二甲苯中与金属钠发生还原偶联反应,生成α羟基酮;67.脱苄反应:苄基或取代苄基与氧、氮或硫连接生成的醇、醚、酯、苄胺、硫醚等,均可以通过氢解反应脱去苄基生成相应的烃、醇、酸、胺等类化合物;68.Heck反应:卤代烃、苯甲酰氯或芳基重氮盐等与乙烯基化合物的C-C偶联反应;69.Suzuki交叉偶联反应:钯催化的有机硼化合物与卤代烃生成不对称联芳烃;。
100种有机化学人名反应

C6H5-NH2 + 2FeCl3 + 2H2O。
当某些盐(FeCl2、FeCl3、FeSO4、CaCl2等)存在时,所用酸无论是过量还是少量,甚
至在中性溶液中都能够进行这种还原。此方法适用于绝大部分各种不同结构的芳香族化
合物,有时也用来还原脂肪族硝基化合物。
4.
Beckmann重排
CH3 CHO
CrO2Cl2
芳醛。
如果分子中有多个甲基,只可氧
化一个,这是本反应的特征。
27. Favorskii重排
α-卤代酮用碱处理,消除卤素重排得羧酸:
X-CH2-COR + NaOH R-CH2-COOH + NaX环状α-卤代酮也可得到羧酸,
O
R
OC2H5 H5C2O R
13. Chichibabin胺化反应
含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应,
生成氨基衍生物。产率一般为
50%~
100%。
H2O
NaNH2溶剂
105-110℃, 66-76%
N N NHNa
有游离羟基的碳原子之间的碳链就断裂,得到定量的醛酮类。此法用于研究醇类结构及
制备醛酮类且产率很高。
OO
OH OH
OH OH
RCHO +R'CHO
+Pb(AcO)4
Pb(AcO)4
+
+
RHC CHR'
R2C CR' RR' R'
COORC CH
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I 〉R′Br〉R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a—卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应.当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷R’X的烷基和亚磷酸三烷基酯(RO)3P 的烷基相同(即R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2和次亚膦酸酯R2POR' 也能发生该类反应,例如:反应机理一般认为是按S N2 进行的分子内重排反应:反应实例二、Arndt-Eister反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸.反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer--—-Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O—O键异裂.因此,这是一个重排反应具有光学活性的3-—-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸.反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
常见的人名反应

54OC3H2C2H=1CH2
CH3O
6
CH3O
OH CH2 CH=CH2
Claisen酯缩合反应
O CH3C OCH2CH3
CH3CH2ONa
OO CH3C CH2 C OCH2CH3
Claisen-Schmidt 反应
一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或 酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应, 并失水得到α,β-不饱和醛或酮:
NH2
O
O
CHCH3 + 2 HC H + HCOH
CH3
N CH3 CH CH3
Etard 芳基侧链氧化反应
O
CH3 CrO2Cl2 H2O
CH
F: Favorskii α-卤代酮重排
α -卤代酮在氢氧化钠水溶液中加热重排生成含相同碳 原子数的羧酸;如为环状α -卤代酮,则导致环缩小
O Cl R1 C C - R3
NaOH
不溶解
不反应
Hoesch 芳烃酰基化反应
O
+ RCN ZnCl2
CR
HCl
Hoffmann 酰胺重排降解反应 酰胺用溴(或氯)在碱性条件下处理转变为少一 个碳原子的伯胺:
O RCNH2 + Br2 + KOH
RNH2
Hoffmann 消除反应
CH3I
N CH3 H
N+ CH3 I
CH3 CH3
CHCOOEt
O + ClCH2COOEt NaOEt
CHCOOEt O
Delepine 制备纯伯胺的反应 Delepine 反应是由活化卤代烃和六次甲 基四胺(乌洛托品)的反应,也是制备 伯胺的方法之一
有机化学人名反应

有机化学人名反应取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成?-氨基吡啶,如果?位已被占据,则得?-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯―巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)―巴赫曼(Bachmann)反应。
7,柯尔伯―施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯―施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔―悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔―悌曼(Reimer ―Tiemann)反应。
100种有机化学人名反应

120~200℃时热解,顺利产生烯烃,相应醇和氧硫
化碳。黄原酸酯在热解前制备不须离析除黄原酸酯外,其他的酯氨基甲酸酯,碳
酸酯和羧酸酯热解。特别是使用大分子量的羧酸酯(棕榈酸酯)的烯烃提供了有
利条件。因为这些酯本身沸点高,而热解温度较低(约
300℃),在液相中简单加热即可。
250℃
Cl OCH2CH=CH2
;
Cl 醚分子中,
如临位未被取代则不起重排反应,产生复杂的热分解作用。此反应是在苯环引入丙基的
简易方法,因为烯丙基可还原成丙基。
16. Claisen缩合反应(P352~354)
17. Claisen-Schmidt反应(P287)
N+
*
H CH3
CH3 △
H3C
*
CH3
CH2 +(CH3)2NOH
O
H5C6
C6H5
20. Criegee氧化法
乙二醇类在稀醋酸或苯溶液中,室温时用四乙酸铅进行很温和的氧化,两个相连的各带
有游离羟基的碳原子之间的碳链就断裂,得到定量的醛酮类。此法用于研究醇类结构及
此法用来合成呋喃类化合物,在吡啶或氨存在下,α
-氯化羰基化合物或α
,β-氯醚类与
1,3-二羰基化合物发生缩合反应,生成呋喃类化合物。
R C O H2C COOR'
O
COOR'
R
吡啶或氨
-H2O, -HCl
CH2
+
OC
Cl CH3
CH3
解,可得醛类化合物,
R’MgX中
常见人名反应及其机理

常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1,(1在氧化银催化下与水共热,得到酰基卡宾(2,(2发生重排得烯酮(3,(3与水反应生成酸,若与醇或氨(胺反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
常见的人名反应
+
RCl
AlCl3
R
Friedel-Crafts酰基化反应
芳烃与酰基化试剂如酰卤、酸酐、羧酸、 烯酮等在Lewis酸(通常用无水三氯化铝)催 化下发生酰基化反应,得到芳香酮:
O RC X
+
AlCl3
O CR
Fries 酚酯重排
酚酯在Lewis酸存在下加热,可发生酰基重排反应, 生成邻羟基和对羟基芳酮的混合物。重排可以 在硝基苯、硝基甲烷等溶剂中进行,也可以不 用溶剂直接加热进行。
R C N OH
Ph C N CH3 OH
R'
H+
HO C N R
PCl5
R'
O C N R
O C N Ph
R' H
CH3
ethyl ether
H
Beyer 喹啉合成法
NH2 O O + R'C H + RC CH3 HCl NH R' N H2 R
O NH CHCH2 C R R'
R'
R
O ' RC H + O RC CH3 NH R' OH O R' CH = CH C R + NH R'
Etard 芳基侧链氧化反应
CH3
CrO2Cl2
H2O
O CH
F: Favorskii α-卤代酮重排 α -卤代酮在氢氧化钠水溶液中加热重排生成含相同碳 原子数的羧酸;如为环状α -卤代酮,则导致环缩小
1
R
O Cl 3 C C-R RR1 3 C C-R R
2
Br O CH3 C C CH3 C2H5ONa CH3 EtOEt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ag2O
N+ CH3 OH
CH3 CH3
N CH3 CH3
Howorth 多核芳烃的合成
+ 浓H2SO4
O
O
O AlCl3
O
HOC
O
Zn-Hg
HCl C O
Zn-Hg HCl
Se
HOC O
Hunsdiecker 银盐脱羧基卤代物
干燥的羧酸银盐在四氯化碳中与卤 素一起加热放出二氧化碳,生成比 原羧酸少一个碳原子的卤代烃:
COEt
O
ACH2R + C C Y OH
CH C C H
Y
A,Y=CHO, NO2, CO2R, CN, C=O
N: Norrish 羰基化合物的光化学裂解 饱和羰基化合物的光解反应过程有两种类型,Norrish I型 和Norrish II型裂解。 Norrish I型的特点是光解时羰基与 αβ-碳之间的键断裂,形成酰基自由基和烃基自由基:
CH3
C O CH3
Criegee 邻二醇四醋酸铅氧化裂介
R1
R4
CC
R2
R3
Pb(OAc)4
R1 C
O
R4 +
C
O
R2
R3
D: Darzen 醛酮与α卤代酯的缩合反应
ClCH2COOEt NaOEt
R R'
Cl C- CHCOOEt O-
CH-COOEt Cl
O + R C R'
R R'
C-
O
CHCOOEt
O + ClCH2COOEt NaOEt
CHCOOEt O
Delepine 制备纯伯胺的反应 Delepine 反应是由活化卤代烃和六次甲 基四胺(乌洛托品)的反应,也是制备 伯胺的方法之一
RCH2X + (CH2)6 N4
HCl /C2H5OH H2O
RCH2NH3X
活性卤代烃有
CH2X X=Br I
NH2
O
O
CHCH3 + 2 HC H + HCOH
CH3
N CH3 CH CH3
Etard 芳基侧链氧化反应
O
CH3 CrO2Cl2 H2O
CH
F: Favorskii α-卤代酮重排
α -卤代酮在氢氧化钠水溶液中加热重排生成含相同碳 原子数的羧酸;如为环状α -卤代酮,则导致环缩小
O Cl R1 C C - R3
烯丙基芳基醚在高温(200°C)下可以重排,生成 烯丙基酚
54OC3H2C2H=1CH2
CH3O
6
CH3O
OH CH2 CH=CH2
Claisen酯缩合反应
O CH3C OCH2CH3
CH3CH2ONa
OO CH3C CH2 C OCH2CH3
Claisen-Schmidt 反应
一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或 酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应, 并失水得到α,β-不饱和醛或酮:
O C
NH C
O
KOH
O C
NK + RI C
O
O C
NR C O
HCl P RNH2 +
NaOH P
RNH2 +
NH2NH2 RNH2 +
COOH COOH
COONa COONa
O C NH C NH O
Gattermann重氮基置换反应
重氮盐用新制的铜粉代替亚铜盐,与浓盐酸或 氢溴酸发生置换反应得到氯代或溴代芳烃:
+
N2X CuCl
X
Gattermann-Koch芳烃甲酰化反应
芳香烃与等分子的一氧化碳及氯化氢气体在 加压和催化剂(三氯化铝及氯化亚铜)存在下反 应,生成芳香醛:
O
+ CO + HCl AlCl3
CH
Cu2Cl2
Grignard 试剂及其反应
R MgX + C Y
C YMgX H2O R
C
YH R
3RCH-CHR' + 2MnO2 +2KOH OH OH
Baeyer-Villiger 重排反应
O
O
R C R' + R2C OOH
H+
O R C OR
OH O R C OOC R2
H+
R'
OH R C O+
R'
OH R C OR'
+
O C CH3 CF3COOOH
O O CCH3
Beckmann重排反应
R R + 2CO2 + H2 + 2H2O
Kolbe-Schmitt 水杨酸类合成反应 酚钠和二氧化碳在加压下于125-150 ºC反应, 生成邻羟基苯甲酸,同时有少量对羟基苯甲 酸生成
OH NaOH
ONa 0.5MPa
+ CO2 150oC
OH CO2Na HCl
OH CO2H
L: Leuckart 胺烷基化反应
第七章 常见的人名反应
A:
Arndt-Eistert 反应
O + CH2N2
-N2
O CH2
O CH2 N=N
O
O
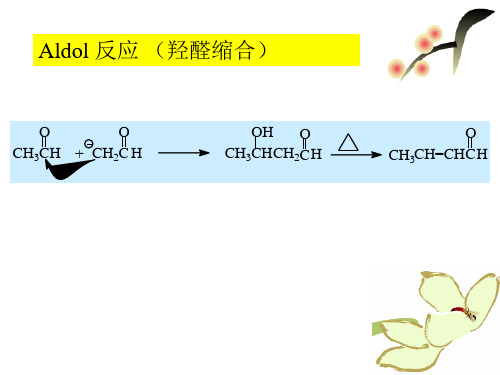
Aldol 反应 (羟醛缩合)
O
O
CH3CH + ቤተ መጻሕፍቲ ባይዱH2C H
OH O CH3CHCH2C H
O CH3CH=CHCH
B:
Baeyer 反应(高锰酸钾使不饱和双键变 色反应)
RCH=CHR' + 2KMnO4 + 4H2O
O RCOR' + NH2OH
OH RC N OH
P2O5
R N=C=O
H2O R NH2
M: Malaprade高碘酸氧化邻二醇
R CH CH R' + HIO4 OH OH
O
O
RC H + R'CH + H2O + HIO3
Mannich胺甲基化反应
含有α-活泼氢的酮与甲醛及胺(伯胺、仲胺 或氨)反应,结果一个α-活泼氢被胺甲基取 代,此反应又称为胺甲基化反应,所得产 物称为Mannich碱。
O RC CH2X
CH2 CH CH2X
RC = C CH2 X
Demjanov-Tiffeneau环扩大(缩小)反应
环烷基甲胺或环烷基胺与亚硝酸反应,生成环扩 大与环缩小的产物。如环丁基甲胺或环丁胺与亚 硝酸反应,除得到相应的醇外,还有其它包括重 排的反应产物:
CH2 NH2 OH
HNO2
OH CH2
+
Mg(OH)X
C=Y 表示: C=O, C=S, C=O, N=O,C=N
H: Harries 烯烃臭氧化作用
H
H
R C=C R’
O3
H OO H R C O C R’
O
O
Zn H2O
RC H + R’C H
Hell-Volhard-Zelinski α-卤代反应
O RCH2COH PCl3
O R CHC OH
O RCCH3
O + HC H
+ NH
R' R''
H2O
O
R'
RC CH2CH2 N R''
Meerwein-Ponndorf反应 醛或酮与异丙醇铝在异丙醇溶液中加热,还原成相 应的醇,而异丙醇则氧化为丙酮,将生成的丙酮由 平衡物中慢慢蒸出来,使反应朝产物方向进行。这 个反应相当于的逆向反应。
O
OH
O
RCOAg + Br2
RBr
K: Knoevenagel醇醛缩合反应
含活泼亚甲基的化合物与醛或酮在弱碱性 催化剂(氨、伯胺、仲胺、吡啶等有机碱)存 在下缩合得到α,β-不饱和化合物。
O
X碱
RCR' + CH2
Y
RC C X R' Y
X Y 为吸电子基团= CHO、CN、NO2、COR、COOR、SO2R 等
重排
O
Dieckmann分子内酯-酯缩合
COOEt (CH2 )5
COOEt
NaOEt
O -COOEt
Diels-Alder 反应
含有一个活泼的双键或叁键的化合物(亲双烯 体)与共轭二烯类化合物(双烯体)发生1,4-加成, 生成六员环状化合物
O
O
+
CH
CH
E: Escgweuker-Clarke胺甲基化作用
+ RCl
AlCl3
R
Friedel-Crafts酰基化反应
芳烃与酰基化试剂如酰卤、酸酐、羧酸、 烯酮等在Lewis酸(通常用无水三氯化铝)催 化下发生酰基化反应,得到芳香酮:
O + RCX AlCl3
O CR
Fries 酚酯重排
酚酯在Lewis酸存在下加热,可发生酰基重排反应, 生成邻羟基和对羟基芳酮的混合物。重排可以 在硝基苯、硝基甲烷等溶剂中进行,也可以不 用溶剂直接加热进行。
RC R' + CH3CHCH3
Al(OCH
CH3 CH3
)
3
OH RC R'
O + CH3CCH3
Michael 亲核亚甲基加成反应 一个亲电的共轭体系和一个亲核的碳负 离子进行共轭加成,称为Micheal加成
O
OO
RC CH CH2 + CH3C CH2 C OEt
