土壤中硫酸根的测定(精)
硫酸根离子精确检测方法

2.重量法.原理概要样品溶液调至弱酸性,加入氯化钡溶液生成硫酸钡沉淀,沉淀经过滤、洗涤、烘干、称重,计算硫酸根含量。
.主要试剂和仪器主要试剂氯化钡:/L溶液;配制:称取氯化钡,溶于500mL水中,室温放置24h,使用前过滤;盐酸:2mol/L溶液;甲基红:%溶液。
仪器一般实验室仪器。
.过程简述吸取一定量样品溶液〔见附录A(补充件)〕,置于400mL烧杯中,加水至150mL,加2滴甲基红指示剂,滴加2mol/L盐酸至溶液恰呈红色,加热至近沸,迅速加入40mL(硫酸根含量>%时加入60mL)/L氯化钡热溶液,剧烈搅拌2min,冷却至室温,再加少许氯化钡溶液检查沉淀是否完全,用预先在120℃烘至恒重的4号玻璃坩埚抽滤,先将上层清液倾入坩埚内,用水将杯内沉淀洗涤数次,然后将杯内沉淀全部移入坩埚内,继续用水洗涤沉淀数次,至滤液中不含氯离子(硝酸介质中硝酸银检验)。
以少量水冲洗坩埚外壁后,置电烘箱内于120±2℃烘1h后取出。
在干燥器中冷却至室温,称重。
以后每次烘30min,直至两次称重之差不超过视为恒重。
.结果计算硫酸根含量按式(1)计算。
硫酸根(%)=(G1-G2)× ×100 (1)W式中:G1——玻璃坩埚加硫酸钡质量,g;G2——玻璃坩埚质量,g;W——所取样品质量,g;——硫酸钡换算为硫酸根的系数。
.允许差允许差见表1。
表 1硫酸根,%允许差,%<~<~.分析次数和报告值同一实验室取双样进行平行测定,其测定值之差超过允许差时应重测,平行测定值之差如不超过允许差取测定值的平均值作为报告值。
3.容量法(EDTA络合滴定法).原理概要氯化钡与样品中硫酸根生成难溶的硫酸钡沉淀,过剩的钡离子用EDTA 标准溶液滴定,间接测定硫酸根。
主要试剂和仪器主要试剂氧化锌;标准溶液。
称取于800℃灼烧恒重的氧化锌,置于150mL烧杯中,用少量水润湿,滴加盐酸(1∶2)至全部溶解,移入500mL容量瓶,加水稀释至刻度,摇匀;氨-氯化铵缓冲溶液(pH≈10);称取20g氯化铵,以无二氧化碳水溶解,加入100mL 25%氨水,用水稀释至1l铬黑T:%溶液;称取铬黑T和2g盐酸羟胺,溶于无水乙醇中,用无水乙醇稀释至100mL,贮于棕色瓶内;乙二胺四乙酸二钠(EDTA):/L标准溶液;配制:称取40g二水合乙二胺四乙酸二钠,溶于不含二氧化碳水中,稀释至5l,混匀,贮于棕色瓶中备用;标定:吸取氧化锌标准溶液,置于150mL烧杯中,加入5mL氨性缓冲溶液,4滴铬黑T指示剂,然后用/LEDTA标准溶液滴定至溶液由酒红色变为亮蓝色为止;计算:EDTA标准溶液对硫酸根的滴定度按式(2)计算。
硫酸根测定方法范文

硫酸根测定方法范文硫酸根离子(SO4²⁻)是一种常见的无机阴离子,其测定方法主要根据硫酸根离子与其他离子或化合物的反应特性实现。
下面将介绍几种主要的硫酸根离子测定方法。
一、沉淀法硫酸根离子可以与钡离子反应生成不溶性的硫酸钡沉淀(BaSO4)。
该反应是重力沉淀法测定硫酸根离子的常用方法。
1.取一定体积的待测溶液,加入适量的钡离子溶液,使两者摩尔比为1:1,充分混合。
2.等待一段时间,以使生成的硫酸钡沉淀充分沉淀。
3.通过过滤将沉淀分离,并用去离子水洗涤沉淀。
4.将沉淀样品烘干或煅烧,得到硫酸钡的质量,从而计算出硫酸根离子的浓度。
二、电位滴定法电位滴定法是一种精确快速的测定硫酸根离子浓度的方法,基于硫酸根离子与过量的钡离子在其中一酸性条件下的滴定反应。
1.准备滴定溶液:将硫酸根离子样品与过量的硫酸钡溶液混合,在弱酸性pH条件下保持溶液的pH值。
2.使用钡离子电极和甘汞电极进行电位检测,开始滴定过程。
3.滴定时,向待测溶液中滴定硫酸根离子标准溶液,直到检测到电位滴定曲线的终点。
4.根据滴定曲线的终点测得的体积及硫酸根离子标准溶液的浓度,计算出待测溶液中硫酸根离子的浓度。
三、紫外可见光谱法硫酸根离子在紫外可见光谱下有显著的吸收峰,可以利用其吸收性质进行定量测定。
1.准备硫酸根离子样品的溶液,调节其浓度在检测范围之内。
2. 在紫外可见光谱仪上选择合适的波长(如260 nm)。
3.将样品放入光学池中,从零点开始记录光谱曲线。
4.根据紫外吸收峰的强度,在一定范围内进行工作曲线的测定,并计算出样品中硫酸根离子的浓度。
四、离子色谱法离子色谱法是一种高灵敏度、高分辨率的测定离子浓度的方法,也适用于硫酸根离子的测定。
1.准备硫酸根离子样品的溶液,并适当稀释。
2.设置离子色谱仪的工作参数,如流速、柱温等。
3.将样品注入离子色谱仪并进行分析,通过检测器检测出硫酸根离子的峰面积或峰高。
4.通过标准曲线测得硫酸根离子的浓度。
离子色谱法测定土壤浸提液中硫酸根离子

离子色谱法测定土壤浸提液中硫酸根离子
赵卓玲
【期刊名称】《中国科技信息》
【年(卷),期】2023()3
【摘要】硫酸盐类,对土壤和水体有一定危害。
环境中有许多金属离子,如Ca、Mg、K、Na、Ba、Sr、Pb、Fe、Al、Cu可以与硫酸根结合成稳定的硫酸盐。
大气中硫酸盐形成的气溶胶随降水到达地面以后,破坏土壤结构,降低土壤肥力,引起土壤酸碱度失衡。
加之,长期大量不合理地施用含有硫酸钾、硫酸铵的化肥都会使土壤的酸
度有不同程度的增大。
土壤中硫酸根离子的含量达到一定浓度不仅会影响作物生长,还可能会腐蚀混凝土、钢筋以及埋藏于地下的管道设施等,对建筑物损害极大。
【总页数】3页(P73-75)
【作者】赵卓玲
【作者单位】河北省煤田地质局新能源地质队水土实验室
【正文语种】中文
【中图分类】S15
【相关文献】
1.应用高压液相色谱法测定糖液(浆,蜜)中氯离子和硫酸根离子的研究
2.离子交
换分离——离子色谱法测定造币镀液及其废液中氯离子及硫酸根3.超声提取-离子色谱法测定土壤易溶盐中的氯离子和硫酸根离子4.离子色谱法测定土壤中氯离子、硫酸根离子、硝酸根离子5.离子色谱法和毛细管电泳法测定土壤中氯离子、硫酸
根及其差异性
因版权原因,仅展示原文概要,查看原文内容请购买。
水溶性盐分硫酸根的测定 容量法

FHZDZTR0076 土壤 水溶性盐分硫酸根的测定 容量法F-HZ-DZ-TR-0076土壤—水溶性盐分(硫酸根)的测定—容量法1 范围本方法适用于土壤中等含量水溶性盐分(硫酸根)的测定,适宜测定范围为20µg/mL~300 µg/mL 。
2 原理先用过量的氯化钡溶液使土样水浸出液中的硫酸根沉淀完全,过量的钡离子连同浸出液中原有的钙和镁离子,在pH10条件下,用EDTA 标准溶液滴定,由沉淀消耗的钡离子量计算硫酸根量。
加入一定量镁离子,可使滴定终点清晰。
3 试剂3.1 盐酸溶液,1+4。
3.2 氯化铵-氢氧化铵缓冲溶液:pH10,称取67.5g 氯化铵,溶于水中,加入570mL 新开瓶的氢氧化铵(ρ 0.90g/mL ),再加水稀释至1000mL 。
防止吸收空气中的二氧化碳,最好贮存于塑料瓶中。
3.3 EDTA 标准溶液:0.0200mol/L ,称取已在80℃烘干2h 的乙二胺四乙酸二钠7.4450g (EDTA ,Na 2H 2C 10H 12O 2N 2·2H 2O ),精确至0.0001g ,溶于1000mL 水中。
3.4 钡镁混合溶液:称取1.22g 氯化钡(BaCl 2·2H 2O)和1.02g 氯化镁(MgCl 2·6H 2O)溶于水,再加水稀释至500mL 。
此溶液钡和镁离子浓度种各为0.01mol/L ,每mL 约可沉淀1000µg 硫酸根。
3.5 酸性铬蓝K-萘酚绿B 指示剂:先将50g 烘干的氯化钠研细,再分别将0.5g 酸性铬蓝K 和1.0g 萘酚绿B 研细,然后将三者混合均匀,贮于棕色瓶中,保存于干燥器中。
3.6 氯化钡溶液:称取5g 氯化钡溶于100mL 水中。
3.7 盐酸溶液,1+1。
3.8 硫酸根标准溶液:500µg/mL ,称取0.2268g 硫酸钾(K 2SO 4),精确至0.0001g ,加水溶解,再加水稀释至250mL 。
土壤中硫酸根离子的测定

土壤中硫酸根离子的测定在农业生产及土壤肥力研究中,对土壤中硫酸根离子的测定具有重要的意义,因此研究其分析测定方法及处理过程十分重要。
一、硫酸根离子的分析测定方法1、硫酸根含量的比色分析方法和光谱分析方法硫酸根的比色分析方法是根据硫酸根的溶解度而选择不同的试剂,将土壤硫酸根进行比色分析。
基于测定结果,采用光谱分析方法测定硫酸根含量,以便识别不同类型的硫酸根,进而确定残留土壤硫酸根的水合特性、影响强度及速率等。
2、表面传感技术表面传感技术是一种新型的硫酸根含量测定方法,它主要是利用Coulomb力和表面印迹法,将土壤中的硫酸根与表面探测器表面的电场进行作用,从而实现从溶液中分离硫酸根的目的。
3、微生物分析方法微生物分析方法是一种基于微生物的分析方法,它采用特定的微生物种群及其相关酶活性指标进行测定,从而可以鉴定出土壤中特定类型的硫酸根及其组分。
二、测定土壤硫酸根的处理过程1、采集土壤样品采集的土壤样品必须是新鲜的、未受污染的,以确保测定的结果准确可靠。
采集的土壤样品应符合标准,其中包括水分含量、粒径等相关参数的控制。
2、提取土壤中的硫酸根提取土壤中的硫酸根含量,可采用典型的溶剂法,如用水、乙醇、丙酮等进行提取,一般使用1:1的液固比,然后通过搅拌和蒸馏等方式,实现提取硫酸根的目的。
3、分析测定硫酸根含量根据硫酸根含量的不同,采用相应的分析测定方法,如比色分析法、光谱分析法、表面传感技术等进行测定,最后根据测定结果,进行数据处理及分析,从而得出土壤中硫酸根的含量。
三、土壤硫酸根的管理及保护1、控制土壤养分的滥用滥用氮、磷、钾肥料可能会导致土壤中硫酸根的浓度升高,以致旱地肥力变差,影响农作物的生长发育,因而在使用肥料时应注意肥料的控制和施用措施,保护土壤的肥力。
2、减少土壤的污染工业污染及化学污染是土壤中硫酸根含量出现异常升高的主要原因,因此需要实施合理的环境保护措施,减少土壤污染,以保护土壤中硫酸根的稳定性及肥力水平。
检验硫酸根离子的操作方法

检验硫酸根离子的操作方法硫酸根离子(SO42-)是一种常见的阴离子,广泛存在于天然水体、土壤和许多化合物中。
检验硫酸根离子的方法主要包括利用酸碱中和反应、沉淀反应和电化学法等。
下面将介绍一些常用的操作方法。
1.酸碱中和反应法硫酸根离子是一种酸性离子,在酸性溶液中能与鹼合成相应的盐。
这种方法主要是通过添加碱溶液与硫酸根离子发生中和反应,生成可溶性的盐类,然后通过沉淀产物或者回归生成硫酸根离子。
实验步骤:(1)取少量待检测物质溶解于适量的水中,得到待测溶液。
(2)加入酸性指示剂(如酚酞),溶液变红,表示酸性反应。
(3)缓慢滴加碱溶液(如氢氧化钠溶液),同时观察溶液的颜色变化。
(4)当溶液由红色逐渐转变为橙黄色,表示硫酸根离子已中和完全。
(5)记录滴加的碱溶液体积。
2.沉淀反应法硫酸根离子与钙离子(Ca2+)可以发生反应生成难溶性的硫酸钙(CaSO4)沉淀。
利用这个特性,可以通过观察沉淀形成与否来检验硫酸根离子的存在。
实验步骤:(1)取待检测物溶液,加入几滴酸性指示剂(如酚酞),溶液变红,表示酸性反应。
(2)缓慢滴加氯化钙溶液,同时观察溶液变化。
(3)当溶液中出现白色沉淀,停止滴加。
(4)记录滴加的氯化钙溶液体积,并记录观察到的沉淀形成。
(5)通过标准曲线或者计算公式可以计算出待检测溶液中硫酸根离子的浓度。
3.电化学法硫酸根离子可以通过电化学方法检测。
这种方法主要是通过电化学电位测量的原理,利用稳定的电极反应对硫酸根离子进行定量分析。
实验步骤:(1)准备好电化学实验所需的电极、电解质溶液和电位计等设备。
(2)将待检测溶液与电解质混合,形成电解质溶液。
(3)将电极浸入待检测溶液中,确保电极完全浸入且不产生电位漂移。
(4)使用电位计测量溶液的电位变化,计算硫酸根离子的浓度。
(5)确保实验室环境稳定,避免外界干扰对实验结果的影响。
总结:。
土壤硫酸根的测定

土壤硫酸根的测定A 硫酸钡比浊法1 方法提要在一定条件下,向试液中加入氯化钡晶粒,使与硫酸根作用形成的硫酸钡沉淀分散成为较稳定的悬浊液,用分光光度计测定浊度(吸收值)。
同条件下绘制校准曲线,由未知悬浊液的浊度查曲线,即可求得硫酸根浓度。
2 适用范围本方法适用于硫酸根浓度小于40mg ·L -1的待测液中硫酸根的测定。
3 主要仪器设备3.1分光光度计;3.2量勺(盛1.0g 氯化钡)。
4 试剂4.1 氯化钡晶粒:将氯化钡(BaCl 2·2H 2O)磨细过筛,取粒度为0.25~0.5mm 之间的晶粒备用;4.2 稳定剂:称取75.0g 氯化钠溶于300mL 水中,加30mL 浓盐酸(密度1.19)和100mL 乙醇(95%),再加入50mL 甘油,充分混合均匀;4.3 硫酸根标准溶液[ρ(SO 42-)=100 μg ·mL -1]:称取经110℃烘4h 的硫酸钾(优级纯)0.1814g 溶于水,定容至1L 。
5分析步骤吸取土壤浸出液(见土壤水溶性盐的提取)25.00mL (硫酸根浓度在40mg ·L -1以上者,应减少吸取量,并用水稀释至25.00mL),放入100mL 烧杯中。
加入1.0mL 稳定剂,杯内放一磁搅拌棒,放在磁力搅拌器上定速搅拌,并加入1.0g 氯化钡晶粒(可用量勺量取),立即计时,在恒定速度下搅拌1min (±5s ),静置4min 后,将上述浊液在15min 内在分光光度计上于波长420nm 处进行比浊。
用同一待测液25.00mL ,加1.0mL 稳定剂(不加氯化钡)为参比液调零。
校准曲线的绘制:分别吸取100μg ·mL -1硫酸根标准溶液0,2.00,4.00,8.00,12.00,16.00,20.00mL 于50mL 容量瓶中,用水定容。
即为0,4,8,l6,24,32,40μg ·mL -1硫酸根标准系列溶液。
硫酸根离子精确检测方法

硫酸根离子精确检测方法The manuscript was revised on the evening of 20212.重量法.原理概要样品溶液调至弱酸性,加入氯化钡溶液生成硫酸钡沉淀,沉淀经过滤、洗涤、烘干、称重,计算硫酸根含量。
.主要试剂和仪器主要试剂氯化钡:/L溶液;配制:称取氯化钡,溶于500mL水中,室温放置24h,使用前过滤;盐酸:2mol/L溶液;甲基红:%溶液。
仪器一般实验室仪器。
.过程简述吸取一定量样品溶液〔见附录A(补充件)〕,置于400mL烧杯中,加水至150mL,加2滴甲基红指示剂,滴加2mol/L盐酸至溶液恰呈红色,加热至近沸,迅速加入40mL(硫酸根含量>%时加入60mL)/L氯化钡热溶液,剧烈搅拌2min,冷却至室温,再加少许氯化钡溶液检查沉淀是否完全,用预先在120℃烘至恒重的4号玻璃坩埚抽滤,先将上层清液倾入坩埚内,用水将杯内沉淀洗涤数次,然后将杯内沉淀全部移入坩埚内,继续用水洗涤沉淀数次,至滤液中不含氯离子(硝酸介质中硝酸银检验)。
以少量水冲洗坩埚外壁后,置电烘箱内于120±2℃烘1h后取出。
在干燥器中冷却至室温,称重。
以后每次烘30min,直至两次称重之差不超过视为恒重。
.结果计算硫酸根含量按式(1)计算。
硫酸根(%)=(G1-G2)× ×100 (1)W式中:G1——玻璃坩埚加硫酸钡质量,g;G2——玻璃坩埚质量,g;W——所取样品质量,g;——硫酸钡换算为硫酸根的系数。
.允许差允许差见表1。
表 1硫酸根,%允许差,%<~<~.分析次数和报告值同一实验室取双样进行平行测定,其测定值之差超过允许差时应重测,平行测定值之差如不超过允许差取测定值的平均值作为报告值。
3.容量法(EDTA络合滴定法).原理概要氯化钡与样品中硫酸根生成难溶的硫酸钡沉淀,过剩的钡离子用EDTA标准溶液滴定,间接测定硫酸根。
主要试剂和仪器主要试剂氧化锌;标准溶液。
硫酸根离子的检验及有关应用

的准确性和灵敏度。
使用高纯度试剂
选用高纯度的试剂,减少杂质 对实验结果的影响。
引入校正因子
针对可能存在的系统误差,引 入校正因子进行修正,提高结 果的准确性。
应用先进技术
采用如光谱法、电化学法等先 进技术,提高硫酸根离子检验
的灵敏度和准确性。
THANKS
实验步骤与操作注意事项
01
操作注意事项
02
1. 在实验过程中,要保持实验环境的清洁和整洁,避免杂质的
干扰。
2. 准确称取试样和滴定剂,避免误差的产生。
03
实验步骤与操作注意事项
3. 在滴定过程中,要控制滴定速度,使反应充分进行。 4. 滴定终点要准确判断,避免过早或过晚停止滴定。
结果计算与误差分析
实验步骤与操作注意事项
1. 避免污染
实验过程中需保持清洁,避免杂质对实验结果的影响。
2. 控制实验条件
保持恒定的温度、湿度等实验条件,以获得准确可靠的数据。
3. 正确使用仪器
按照仪器操作规程进行操作,避免损坏仪器或影响实验结果。
结果解读与局限性讨论
结果解读
根据光谱比对结果,判断样品中是否含有硫酸根 离子。若样品光谱与标准光谱一致,则表明样品 中含有硫酸根离子;若不一致,则表明样品中不 含或含有其他离子。
干扰物质排除技巧分享
沉淀法
利用沉淀反应将干扰物质 与硫酸根离子分离,如加 入氯化钡生成硫酸钡沉淀 。
掩蔽法
加入掩蔽剂与干扰物质形 成络合物,使其暂时失去 干扰能力,如加入酒石酸 钾钠掩蔽铁离子。
离子交换法
利用离子交换树脂将硫酸 根离子与其他离子分离, 达到排除干扰的目的。
水溶性盐分硫酸根的测定 比浊法

FHZDZTR0077 土壤 水溶性盐分硫酸根的测定 比浊法F-HZ-DZ-TR-0077土壤—水溶性盐分(硫酸根)的测定—比浊法1 范围本方法适用于土壤低含量水溶性盐分(硫酸根)的测定,适宜测定范围为小于40µg/mL 。
2 原理在一定条件下,在土样水浸出液中加入氯化钡晶粒,使与硫酸根形成的硫酸钡沉淀分散成较稳定的悬浊液,用分光光度计或比浊计测定其浊度(吸光值),测得硫酸根量。
3 试剂3.1 硫酸根标准溶液:称取已在110℃烘4h 的硫酸钾0.1814g(K 2SO 4),精确至0.0001g ,溶于水,再加水稀释至1000mL 。
此溶液1mL 含100µg 硫酸根。
3.2 稳定剂:称取75.0g 氯化钠溶于300mL 水中,加入30mL 盐酸(ρ1.19g/mL)和100mL 无水乙醇,再加入50mL 甘油,混合均匀。
3.3 氯化钡晶粒:将氯化钡(BaCl 2·2H 2O)晶粒磨细,过筛,取粒度为0.25mm~0.5mm 之间的晶粒备用。
4 仪器4.1 分光光度计或比浊计。
4.2 锥形瓶,50mL 。
4.3 容量瓶,25mL 。
5 操作步骤5.1 待测液的制备:称取通过2mm 筛孔的风干土样50.000g(精确至0.001g)置于干燥的500mL 锥形瓶中,加入250.00mL 无二氧化碳的水,加塞,放在振荡机上振荡3min ,然后干过滤或离心分离,取得清亮的待测浸出溶液。
也可以吸取水溶性盐分(全盐量)的测定—质量法待测液制备得到的清亮溶液测定。
同时做空白试验。
5.2 根据预测结果[见F-HZ-DZ-TR-0076土壤水溶性盐分(硫酸根)的测定(容量法)5.2],吸取25.00mL 浸出液(硫酸根量在40mg/L 以上者应减少吸取量,并用水准确稀释至25.00mL)置于50mL 锥形瓶中,加入1.00mL 稳定剂和1.00g 氯化钡晶粒,立即转动锥形瓶至晶粒完全溶解为止。
NYT 1121.18-2006 土壤 硫酸根离子 方法证实
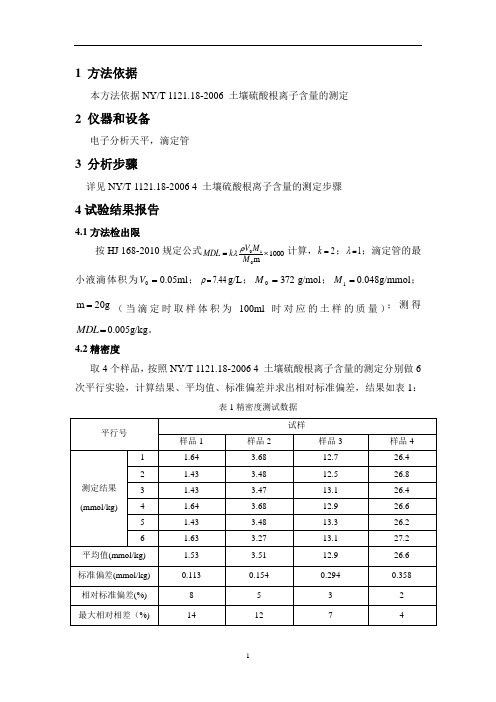
1 方法依据本方法依据NY/T 1121.18-2006 土壤硫酸根离子含量的测定2 仪器和设备电子分析天平,滴定管3 分析步骤详见NY/T 1121.18-2006 4 土壤硫酸根离子含量的测定步骤4试验结果报告4.1方法检出限按HJ 168-2010规定公式1000m010⨯=M M V k MDL ρλ计算,2=k ;1=λ;滴定管的最小液滴体积为=0V 0.05ml ;44.7=ρg/L ;3720=M g/mol ;=1M 0.048g/mmol ;g 20m =(当滴定时取样体积为100ml 时对应的土样的质量);测得=MDL 0.005g/kg 。
4.2精密度取4个样品,按照NY/T 1121.18-2006 4 土壤硫酸根离子含量的测定分别做6次平行实验,计算结果、平均值、标准偏差并求出相对标准偏差,结果如表1:表1精密度测试数据4.3准确度取2个有证标准物质,分别做6次平行实验,计算平均值,最大相对误差,检测结果见表2。
表2 有证标准物质测试数据5结论5.1检出限实验室检出限0.005g/kg。
5.2精密度样品1六次平行测定测得平均值为1.53mmol/kg,最大相对相差为14%,标准中要求测定值<2.5mmol/kg 时,相对相差为<20%;样品2六次平行测定测得平均值为 3.51mmol/kg,最大相对相差为12%,标准中要求测定值为2.5-5.0mmol/kg 时,相对相差为<15%;样品3六次平行测定测得平均值为12.9mmol/kg,最大相对相差为7%,标准中要求测定值为5.0-25mmol/kg 时,相对相差为<10%;样品4六次平行测定测得平均值为26.6mmol/kg,最大相对相差为4%,标准中要求测定值>25mmol/kg 时,相对相差为<5%。
5.3准确度有证标准物质GBW07412a(ASA-1a)和GBW07414a(ASA-3a) 单次测定结果均在标准值范围内。
硫酸根的测定(铬酸钡分光光度法)

硫酸根的测定(铬酸钡分光光度法)
1、硫酸根的测定(铬酸钡分光光度法)
1.1试剂
①铬酸钡悬浊液:称取97.20g铬酸钾(K2CrO4)与122.20g氯化钡(BaCl 22H2O)分别溶于1L的蒸馏水中,加热至沸腾。
将两溶液倾入一个3L烧杯内,此时生成的黄色的铬酸钡沉淀。
待沉淀下降以后,倾出上层清液,然后每次用约1L蒸馏水洗涤沉淀,共约洗涤5次左右。
最后加蒸馏水至1L,使之成悬浊液,每次使用前混匀,每5mL铬酸钡悬浊液可以沉淀240mg硫酸根。
②氨水溶液:氨水与水等体积混合。
③盐酸溶液:量取210mL浓盐酸,并用蒸馏水稀释至1000mL,此时溶液的浓度为2.5mol/L。
④硫酸盐标准溶液:称取1.4786g无水硫酸钠,溶于少量水,至于1000mL容量瓶中稀释至标线。
(此点,可以考虑用14.7860g无水硫酸钠,1mL含有10mg的硫酸根)
1.2仪器
比色管、锥形瓶、加热及过滤装置、分光光度计。
1.3标线的制定
①取150mL锥形瓶9个,分别加入0、0.1、0.5、1、2.5、
5、10、15、20mL硫酸根标准溶液,分别加水至50mL。
②向标准溶液中加入1mL2.5mol/L的盐酸溶液,加热煮沸5分钟左右,取下以后各加入5mL铬酸钡浊液,再煮沸5分钟左右。
③取下锥形瓶,稍冷却后,逐滴加入氨水至呈柠檬黄色,再多加2滴。
④冷却以后,用慢性滤纸过滤,滤液收集于50mL比色管内,用蒸馏水洗涤锥形瓶及滤纸三次,滤纸收集于比色管中,用蒸馏水稀释至标线。
⑤在420nm波长,用10mm比色皿测量吸光度,绘制标准曲线。
1 / 11 / 1。
土壤中硫酸根离子的测定

土壤中硫酸根离子的测定孙好芬;巫崇婷;黄振;赵炳谚;刘宇【摘要】硫酸根离子的测定有多种方法.为了快速准确大量地测定土壤中硫酸根离子的含量,本文采用分光光度法对土壤中微量的硫酸根离子进行测定,获得了有意义的实验结果,于420 nm波长处,硫酸根浓度在1.00~40.00 μg·mL-1范围内与硫酸钡吸光度呈线性关系,回归方程y=0.0079x+0.0069, R2=0.9994;加标回收率达95%;值得指出的是温度对稳定剂的影响较为突出.该方法操作简单,实用性、可行性强.%Sulfate ions are measured in a variety of ways. For fast and accurately determining sulfate ion in soil, a new method, spectrophotometric method for the determination of trace sulfate ions in soil, obtained meaningful experimental results. Sulfate content indicated a linear relationship with absorption of sulfate in 1.00~40.00 μg·mL-1at 420 nm. The linear equation was y=0.0079x+0.0069 and the correlation coefficient was 0.9994, the recoveries were 95%. It was worth mentioning that this experiment explored temperature was the important influencing factor of the stabilizer,and the method was more simple,practicable and feasible.【期刊名称】《广州化工》【年(卷),期】2018(046)009【总页数】3页(P83-85)【关键词】硫酸根离子;测定;分光光度法;表面活性稳定剂【作者】孙好芬;巫崇婷;黄振;赵炳谚;刘宇【作者单位】青岛理工大学环境与市政学院,山东青岛 266033;青岛理工大学环境与市政学院,山东青岛 266033;青岛理工大学环境与市政学院,山东青岛 266033;青岛理工大学环境与市政学院,山东青岛 266033;青岛理工大学环境与市政学院,山东青岛 266033【正文语种】中文【中图分类】X83;O65土壤中硫酸根离子的含量不仅会因土壤含盐量过多而影响作物生长,也会使埋藏于地下的管道设施产生严重的腐蚀而老化,造成重大的漏损事故。
硫酸根的测定方法

硫酸根的测定方法硫酸根离子(SO4 2-)是一种常见的无机离子,广泛存在于自然界中。
硫酸根的测定方法主要以化学分析为基础,使用稳定的反应体系实现测定目标。
以下将详细介绍几种常见的硫酸根测定方法。
1. 重量法测定硫酸根:重量法是一种快速和常用的测定硫酸根浓度的方法。
首先,将待测溶液中的硫酸根转化为沉淀形式,使用沉淀剂如钡离子(Ba2+)或铅离子(Pb2+)与硫酸根离子反应生成相应的沉淀物,如硫酸钡(BaSO4)或硫酸铅(PbSO4)。
具体实验过程如下:a. 将待测溶液定量转移到锥形瓶中。
b. 逐滴加入过量的沉淀剂,使得沉淀剂与硫酸根完全反应。
c. 定量地加入盐酸,以溶解未反应的沉淀。
d. 将反应溶液过滤,并将沉淀洗涤至无离子混入。
e. 干燥沉淀,并在有线铝片上称重。
f. 根据沉淀物的重量,计算出硫酸根离子的浓度。
2. 比色法测定硫酸根:比色法是通过测量某些化合物与硫酸根反应后产生的彩色产物溶液的吸光度来确定硫酸根离子的浓度。
根据反应所生成的比色物质不同,比色法主要包括紫外可见光谱法、原子吸收光谱法等。
紫外可见光谱法的实验步骤如下:a. 向待测溶液中加入某种反应试剂,如高氯酸钾(KClO3)或过氧化氢(H2O2),使得硫酸根与试剂反应生成染色阳离子,形成有颜色的化合物。
b. 通过紫外可见光谱仪测量溶液的吸光度。
c. 通过标准曲线或与已知浓度的标样进行比较,计算出硫酸根离子的浓度。
3. 离子选择性电极法测定硫酸根:离子选择性电极法是一种使用离子选择性电极测量溶液中硫酸根浓度的方法。
离子选择性电极是一种电化学传感器,具有特异性的选择离子感受子。
离子选择性电极法的实验步骤如下:a. 将硫酸根溶液与内标液混合。
b. 将混合液添加到装有硫酸根选择性电极的电池中。
c. 开始测量硫酸根浓度。
这种方法可快速、准确地测量硫酸根的浓度,但需要特殊的设备和技术。
总结起来,硫酸根的测定方法主要包括重量法、比色法和离子选择性电极法。
土壤硫酸根离子含量的测定

土壤硫酸根离子含量的测定2 办法提要在土壤浸出液中加入钡镁混合液,Ba2+将溶液中的SO42-彻低沉淀并过量。
过量的Ba2+和加入的Mg2+,连同浸出液中原有的Ca2+、Mg2+,在PH 10.0的条件下,以铬黑T为指示剂,用EDTA标准溶液滴定,由沉淀SO42-净消耗的Ba2+量,计算吸取的浸出液中SO42-量。
添加一定量的Mg2+,可使尽头清楚。
为了防治BaCO3沉淀生成,土壤浸出液必需酸化,同时加热至沸以赶去CO2,并趁热加入钡镁混合液,以促进BaSO4沉淀熟化。
吸取的土壤浸出液中SO42-量的相宜范围约为0.5~10.0mg,如SO42-浓度过大,应削减浸出液的用量。
3 试剂 3.1(1+1)盐酸溶液 3.2 钡镁混合液称取2.44g(BaC12·2H2O)和2.04g(MgC12·6H2O)溶于水,稀释至1L。
此溶液中Ba2+和Mg2+的浓度各为0.01mol/L,每毫升约可沉淀SO42- lmg。
3.3 pH 10氨缓冲溶液称取67.5g溶于去CO2水中,加入新开瓶的浓氨水(含NH3 25%)570mL,用水稀释至1L,贮于塑料瓶中,注重防治汲取空气中CO2。
3.4 0.02mol/L EDTA标准溶液称取7.440g,溶于水中,定容至1L。
称取0.25g(精确至0.0001g)于800℃灼烧至恒量的基准放入50mL烧杯中,用少量水潮湿,滴加6mol/L盐酸至样品溶解,移入250mL容量瓶中,定容。
取25.00mL,加入70mL水,用10%氨水中和至pH7~8,加10mL 氨-氯化铵缓冲溶液(pH10),加5滴铬黑T指示剂,用配置待标定的0.02mol/L溶液滴定至溶液由紫色变为纯蓝色,同时作空白实验。
标准溶液的精确浓度由式(1)计算:式中c—乙二胺四乙酸二钠标准溶液浓度,mol/L; m—称取的量,g; V1—溶液用量,mL; V2—空白实验溶液的用量,mL; 0.08138—的毫摩尔质量,g。
土壤溶液中低易溶盐中低硫酸根检测的探讨

土壤溶液中低易溶盐中低硫酸根检测的探讨摘要:参照标准方法(GB/T50123-2019)土壤易溶盐硫酸根含量的检测方法和地下水硫酸根的测试方法(DZ/T0064-2021)。
通过实验发现,按照土壤和水质测试中硫酸根检测方法对土壤中硫酸根存在几种情况,一种是低含量硫酸根,一种中含量硫酸根,一种是高含量硫酸根,分析这几种情况,可能出现测量误差大的状况,找出有效的解决方案,为提高监测结果准确性,更好地应用于实际工作提供参考。
关键词:易溶盐、EDTA、钙离子、镁离子、硫酸根离子。
硫化合物在自然界中普遍存在着,水、空气、土壤、岩层、建筑物和一些生活用品中都有。
对人的生活起到一定作用,在空气中可能就是酸雨的形成组成,在水中可能以H2S或者硫酸盐,一个是有毒有害气体,一种是难溶锅垢的组分,污染环境,危害人的生活和生体健康,土壤和水中的硫酸盐还对建筑物有腐蚀作用。
因此在环境污染和建筑工程中,硫酸根是一个重要指标。
检测硫酸根是必要的。
1实验方法现在针对土壤和水中硫酸根的检测方法进行探讨。
运用GB/T50123-2019中土壤易溶盐中硫酸根的检测方法及饮用水与地下水的硫酸根检测方法。
一种是重量法。
在取一定量土壤溶液或者水溶液,在酸性条件下,这里用盐酸酸化,加热煮沸,加10%一定量的氯化钡溶液沉淀酸根离子。
煮沸1分钟左右,取下,静置2小时,用定量滤纸过滤,用1%硝酸银检验过滤最后滤液是否还有氯离子,没有氯离子则洗涤干净了,取下滤纸和沉淀放入瓷坩埚中,一并放入马沸炉中灼烧,至800°C,保温1小时,取出,冷却2-3分钟,然后放入干燥器中冷却至室温,称量。
同时做空白试验。
然后计算硫酸根含量。
这个是经典方法,精度高。
可以用于校正其他方法测定的硫酸根。
一种是比色法,这里不多阐述。
另一种是EDTA滴定法。
它是:取一定体积的土壤溶液或者水溶液,同时空白同步,加25毫升纯净水,用盐酸酸化,加热,微沸后滴加一定体积的2.44%氯化钡和1.02%氯化镁混合溶液沉淀硫酸根,并不停震荡,煮沸一分钟,取下静置冷却2小时,后用EDTA在PH10的酸碱度下滴定多余的钡离子、钙离子和镁离子.由于土壤情况复杂,得出的结果千差万别,通过分析,可能出现三种情况。
土中硫酸根离子edta络合滴定测定法分析

土中硫酸根离子edta络合滴定测定法分析硫酸根离子EDTA络合滴定测定法(EDTA-ED)是一种常用的滴定测定法,用于测定土壤中硫酸根离子(SO42-)的含量。
EDTA-ED测定法对土壤中硫酸根离子含量有重要意义,因为土壤中硫酸根离子含量反映了土壤的离子平衡情况,并可以反映土壤的营养状态、有机物含量、有机酸含量等。
本文重点介绍与EDTA-ED滴定测定法相关的测定原理和实验操作。
一、EDTA-ED测定法原理
EDTA-ED测定法属于络合滴定测定法,它是利用硫酸根离子(SO42-)与络合剂EDTA结合形成络合物,然后用分光光度法或其它分析仪器(例如离子色谱、原子荧光等)来检测土壤中的硫酸根离子含量。
- 1 -。
硫酸根检验方法

硫酸根检验方法硫酸根是一种常见的化学物质,在实验室中常常需要对其进行检验。
本文将介绍几种常用的硫酸根检验方法,以供参考。
首先,最常用的硫酸根检验方法之一是铁盐法。
这种方法利用硫酸根与铁离子反应生成沉淀的特性来进行检验。
具体操作步骤如下,首先取少量待检样品溶液,加入少量硫酸根试剂,然后再加入适量的铁离子试剂。
如果生成了深棕色的沉淀,则可以初步判断样品中含有硫酸根。
这种方法简单易行,且具有较高的灵敏度,适用于一般实验室条件下的硫酸根检验。
其次,还可以利用巴比特试剂进行硫酸根的检验。
这种方法利用硫酸根与巴比特试剂反应生成浑浊的沉淀来进行检验。
具体操作步骤如下,首先取少量待检样品溶液,加入适量的巴比特试剂,摇匀后观察是否生成了浑浊的沉淀。
如果生成了沉淀,则可以初步判断样品中含有硫酸根。
这种方法操作简便,结果直观,适用于一般实验室条件下的快速硫酸根检验。
另外,还可以利用硫酸铅法进行硫酸根的检验。
这种方法利用硫酸根与硫酸铅反应生成白色沉淀来进行检验。
具体操作步骤如下,首先取少量待检样品溶液,加入适量的硫酸铅试剂,摇匀后观察是否生成了白色沉淀。
如果生成了沉淀,则可以初步判断样品中含有硫酸根。
这种方法操作简单,结果明显,适用于一般实验室条件下的硫酸根检验。
总之,硫酸根的检验方法有多种,可以根据实际情况选择合适的方法进行检验。
在进行硫酸根检验时,需要注意操作规范,避免交叉污染,保证实验结果的准确性。
希望本文介绍的硫酸根检验方法对您有所帮助。
土壤中硫酸根的测定(精)

什么BaSO4沉淀完毕后要放置一段时间才过滤?
答:Cl-、NO3-、ClO3- 等阴离子能形成钡盐与 BaSO4 共沉淀,H+、K+、Na+、Ca2+等可与SO42-参与共沉淀,所 以应在热的稀溶液中进行沉淀。 BaSO 4 沉淀作用完毕后,让沉淀和母液在一起放置
大 学 通 用 化 学 实 验 技 术
实验53 土壤中硫酸根的测定
53.1 实验目的
(1)通过实验进一步巩固分析天平的使用。 (2)掌握重量法的基本操作。
大 学 通 用 化 学 实 验 技 术
1/13
(3)了解晶形沉淀的沉淀条件。
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
wyuchemypb@
(3)沉淀硫酸根
滤 液
蒸发至30~40 mL
不断搅拌,滴加10%BaCl2 白色沉淀
无沉淀
静置,检验
往上层清液中滴加10%BaCl2
有沉淀
大 学 通 用 化 学 实 验 技 术
7/13
继续加BaCl2 水浴上继续加热15~20 min
静置2h,甚至过夜 慢速滤纸过滤 热水洗涤滤渣数次,至无Cl-为止 滤纸包(沉淀物和滤纸)
干燥器中冷却至室温,称量
800~850 ℃马弗炉中灼烧20 min
直至恒重
用相同试剂和滤纸同样处理,做空白试验,测得空白质量。
土 壤 中 硫 酸 根 的 测 定
根据BaCl2的质量计算100 g土样中SO42-的质量。 在线答疑:liu_rf1010@
wyuchemypb@
53.4 注意事项
( 1 )滤纸灰化时空气要充足,否则 BaSO4易被滤纸中的碳
水溶性盐分硫酸根的测定 质量法

FHZDZTR0078 土壤 水溶性盐分硫酸根的测定 质量法F-HZ-DZ-TR-0078土壤—水溶性盐分(硫酸根)的测定—质量法1 范围本方法适用于土壤高含量水溶性盐分(硫酸根)的测定,适宜测定范围为大于200µg/mL 。
2 原理在一定条件下,加氯化钡使土样水浸出液中的硫酸根生成硫酸钡沉,过滤,沉淀灼烧、称量,测得硫酸根量。
3 试剂3.1 氯化钡溶液:称取5g 氯化钡溶于100mL 水中。
3.2 硝酸银溶液:称取1.7g 硝酸银溶于100mL 水中,贮于棕色瓶中。
3.3 盐酸溶液,1+3。
4 仪器4.1 烧杯,250mL 。
4.2 瓷坩埚。
5 操作步骤5.1 待测液的制备:称取通过2mm 筛孔的风干土样50.000g(精确至0.001g)置于干燥的500mL 锥形瓶中,加入250.00mL 无二氧化碳的水,加塞,放在振荡机上振荡3min ,然后干过滤或离心分离,取得清亮的待测浸出溶液。
也可以吸取水溶性盐分(全盐量)的测定—质量法待测液制备得到的清亮溶液测定。
同时做空白试验。
5.2 根据预测结果[见F-HZ-DZ-TR-0076土壤水溶性盐分(硫酸根)的测定(容量法)5.1],吸取100.00mL 浸出液(硫酸根量在20mg 以上)置于250mL 烧杯中,加入3mL 盐酸(1+3)溶液,加热近沸。
逐滴加入氯化钡溶液,随加随搅拌,直至硫酸钡沉淀完全,再多加5mL 氯化钡溶液(总用量不超过15mL)。
置于水浴上保温1h ,取下,放置过夜。
同时做空白试验。
5.3 沉淀用慢速定量滤纸过滤,用热水洗净烧杯,再用热水洗净沉淀直至用硝酸银溶液检验无氯离子为止。
5.4 将沉淀和滤纸置于已灼烧恒量的瓷坩埚中,烘干后移入高温炉中,从低温升至800℃灼烧30min 。
取出,在干燥器中冷却后称量,再灼烧、称量直至恒量。
6 结果计算土壤水溶性盐分(硫酸根)量按(1)式或(2)式计算:硫酸根(SO )量(g/kg)=−2410004116.01××××Km t m ……(1) 硫酸根(SO )量(cmol/kg)=−24100480.0)g/kg (×硫酸根量……(2) 式中:m 1——硫酸钡沉淀质量,g ;t ——分取倍数(浸出液体积250mL/吸取溶液体积mL);m ——风干土样质量,g ;K ——风干土样换算成烘干土样的水分换算系数;0.4116——硫酸钡换算成硫酸根系数;0.0480——1/2硫酸根的摩尔质量,kg/mol 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大 学 通 用 化 学 实 验 技 术
4/13
直至恒重为止
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
2、试样的分析 (1)溶样
土壤试样
大 学 通 用 化 学 实 验 技 术
5/13
放入1L塑料瓶 加入500 mL蒸馏水溶解 摇动3分钟 减压抽滤 滤液贮存于500 mL试剂瓶中备用
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
BaSO4 BaO + SO3
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
53.5 问题讨论
( 1 )为什么沉淀 BaCl2 要在稀 HCl 溶液中进行? HCl 加过量对实验有何影响? ( 2 )为什么 BaSO4 沉淀反应需在热溶液中进行?为 什么BaSO4沉淀完毕后要放置一段时间才过滤? (3)为了使SO42-沉淀完全,必须加入过量沉淀剂,
实验53 土壤中硫酸根的测定
53.1 实验目的
(1)通过实验进一步巩固分析天平的使用。 (2)掌握重量法的基本操作。
大 学 通 用 化 学 实 验 技 术
1/13
(3)了解晶形沉淀的沉淀条件。
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
大 学 通 用 化 学 实 验 技 术
10/13
为什么又不能过量太多?
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
53.6 参考答案
(1)为什么沉淀BaCl2要在稀HCl溶液中进行?HCl
加过量对实验有何影响? 答:加入HCl溶液可防止CO32-、PO43-等与Ba2+生成沉
大 学 通 用 化 学 实 验 技 术
3/13
纸对沉淀的还原作用,应在空气流通下灼烧并防止滤纸
着火。 BaSO4 + 4C = BaS + 4CO
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
53.3 实验步骤
1、瓷坩埚的准备
大 学 通 用 化 学 实 验 技 术
11/13
淀共沉淀生成,同时,在盐酸中沉淀可以促使形成粗大 易于过滤的沉淀物。但酸可增大BaSO4的溶解度。
土 壤 中 硫 酸 根 的 测 定
53.4 注意事项
( 1 )滤纸灰化时空气要充足,否则 BaSO4易被滤纸中的碳
还原为黑色的BaS:
BaSO4 + 4C BaSO4 + 4 CO BaS + 4CO BaS + 4CO2
大 学 通 用 化 学 实 验 技 术
9/13
如有此情况,可加 2 ~ 3 滴 1:1 的 H2SO4 , 小心加热,冒烟后 重新灼烧。 (2)灼烧温度不能太高,若超过950℃,可能有部分BaSO4 分解:
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
wyuchemypb@
(4)灼烧
滤纸包(沉淀物和滤纸) 移入已恒重的瓷坩埚
在电炉上干燥、炭化、灰化
至呈灰白色 800~850 ℃马福炉中灼烧20 min
大 学 通 用 化 学 实 验 技 术
8/13
wyuchemypb@
(3)沉淀硫酸根
滤 液
蒸发至30~40 mL
不断搅拌,滴加10%BaCl2 白色沉淀
无沉淀
静置,检验
往上层清液ห้องสมุดไป่ตู้滴加10%BaCl2
有沉淀
大 学 通 用 化 学 实 验 技 术
7/13
继续加BaCl2 水浴上继续加热15~20 min
静置2h,甚至过夜 慢速滤纸过滤 热水洗涤滤渣数次,至无Cl-为止 滤纸包(沉淀物和滤纸)
在线答疑:liu_rf1010@
wyuchemypb@
土 壤 中 硫 酸 根 的 测 定
Cl- 、 NO3- 、 ClO3- 等阴离子能形成钡盐与 BaSO4 共沉 淀, H+ 、 K+ 、 Na+ 、 Ca2+ 等可与 SO42- 参与共沉淀,所以应 在热的稀溶液中进行沉淀。共沉淀中的包藏水含量可达 千分之几,应通过500℃以上灼烧除去。灼烧时须防止滤
干燥器中冷却至室温,称量
800~850 ℃马弗炉中灼烧20 min
直至恒重
用相同试剂和滤纸同样处理,做空白试验,测得空白质量。
土 壤 中 硫 酸 根 的 测 定
根据BaCl2的质量计算100 g土样中SO42-的质量。 在线答疑:liu_rf1010@
wyuchemypb@
2/13
在 HCl 酸性介质中进行沉淀,可防止 CO32- 、 PO43- 等与
Ba2+ 生成沉淀 , 但酸可增大 BaSO
4
的溶解度 ( 0.1mol· L-1
HCl 中为 1mg/100mL ; 0.5mol· L-1HCl 中为 4.7mg/100mL ), 故以 0.05mol· L-1HCl 浓度为宜。又有过量 Ba2+ 的同离子效 应存在,所以溶解度损失可忽略不计。
(2)除去SiO2
吸取50~100 mL滤液于300 mL烧杯 水浴上蒸干
残渣 加5 mLHCl溶液
蒸干 ,并继续加热1~2h
大 学 通 用 化 学 实 验 技 术
6/13
2 mL HCl和30 mL热水洗涤
慢速定量滤纸过滤 热水洗涤残渣数次 滤液
土 壤 中 硫 酸 根 的 测 定
在线答疑:liu_rf1010@
53.2 实验原理
在 HCl 酸性溶液中,用 BaCl2 为沉淀剂使硫酸根成为 BaSO4 晶形沉淀析出。经洗涤灼烧后称量 BaSO4 的质量。 BaSO4 溶解度受温度影响较小( 25℃100mL 水中溶解 0.25 mg,100℃时0.4mg),可用热水洗涤沉淀。
大 学 通 用 化 学 实 验 技 术
