溶液的配制及分析
溶液的配制及分析

溶质
V(aq) n(mol) C(mol/L)
20g NaOH 1L 0.5 0.5
80g NaOH 1L 2
2
98g 硫酸 500mL 1
2
49g 硫酸 100mL 0.5
5
1.12LHCl (S. T.P)
250mL 0.05
0.2
讨 论…
1、将342g蔗糖(C12H22O11)溶解在 1L水中,所得的溶液中溶质的物质的 量浓度是否为1mol/L?
例7:等体积的1mol/L的HCl与 0.5mol/L的HCl混合,求混合后溶液的 物质的量浓度(体积变化忽略不计)。
两种溶液混合后的浓度: C混 • V混 = C1 • V1 + C2 • V2 忽略体积变化时:
V混 = V1 + V2
不能忽略体积变化时:
V混 = (V1×ρ1 + V2×ρ2)/ρ混
4、有关气体溶解度等的计算 例8:在S.T.P 下,氨气与水以体积比 500∶1溶解,所得氨水密度为ρ,求C。
注:在有关氨水浓度的计算中,溶 质的 M 以17 g/mol 算。
练习:100mL 98%的浓硫酸, 密度为1.84g/mL, 稀释成 200mL。求C稀?
M(Na2CO3)=5.3g/106g•mol-1 =0.05mol c(Na2CO3)= n(Na2CO3)/V[Na2CO3(aq)] = 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度 为0.2mol/L。
例2:配制250mL1.6mol/LNaCl溶液, 需要NaCl的质量是多少? 解 : n(NaCl)= C(NaCl)·V[NaCl(aq)]
A、 50mL 1mol/L KCl溶液
溶液的配制及分析

=106g/mol×0.010mol=1.06g
天平、药匙
用托盘天平称量1.1gNa2CO3固体
可编辑ppt
6
一、配制一定物质的量浓度溶液
烧杯、玻璃棒
实验步骤及所用仪器: ⑶溶解
提问将:溶除质了烧倒杯入外小还烧需杯要,哪些加仪入器适?量的
蒸馏水搅拌溶解,冷还却需至室要温玻。璃棒进行搅拌
注意事若项将:热的溶液转入容量瓶,则会导致所配溶液浓 度 1.应在烧.杯中溶解,不能在容量瓶中溶解
若再加水至刻度线,则会可导编辑致ppt所配溶液浓度偏小。 11
一、配制一定物质的量浓度溶液
实验步骤及所用仪器: ⑻装瓶贴标签
容量瓶不能存放溶液, 把溶液转移到试剂瓶中,贴 标签,标明溶液名称和浓度。
可编辑ppt
12
【合作实验】
配制100mL 0.100 mol/L Na2CO3溶液
可编辑ppt
13
溶液的配制及分析
可编辑ppt
1
3.6%含 糖ຫໍສະໝຸດ 量1.5 mol/L可编辑ppt
2
一、配制一定物质的量浓度溶液
容量瓶
检漏
线
1. 构造:细颈、梨形、平底、有塞
2. 标注: ⑴一条刻度线 ⑵温度和容积
3⑶.容常量见瓶容使积用的规注格意:事1项0/:50/100/250/500/1000mL
①.按所配溶液的体积选择合适规格的容
可编辑ppt
4
配制一定物质的量浓度溶液步骤:
计算
称量
溶解
转移
洗涤
转移
定容
摇匀
装瓶贴签
可编辑ppt
5
一、配制一定物质的量浓度溶液
实验步骤n及(N所a2C用O仪3)=器c(N:a2CO3) ×V
溶液的配制及分析

小结: 离子的物质的量浓度只与溶液物质的 量浓度及每摩尔溶质在溶液中电离出离 子的多少有关,而与溶液的体积无关。
7
3. 注意事项:
①使用前检查是否漏液(装水盖塞 倒立 玻璃塞旋转180° 倒立) ②溶解或稀释的操作不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应 ④不能加入过冷或过热液体 ⑤只能配制容量瓶上规定的体积 正立
17
1、实验室欲配制0.5mol/L的NaOH溶液500ml,有
以下仪器:①烧杯;②100ml量筒;③100ml容量 瓶;④500ml容量瓶;⑤玻璃棒;⑥托盘天平 (带砝码)。 (1)配制时必须使用的仪器有 ①④⑤⑥ (填代 号),还缺少的仪器是 胶头滴管和药匙 。该实验中 两次用到玻璃棒,其作用分是 加速溶解 , 引流 。 (2)使用容量瓶前必须进行的一步操作是 检查是否漏液 。 (3)配制溶液时,一般可以分为以下几个步骤: ①称量;②计算;③溶解;④摇匀;⑤转移;⑥ 洗涤;⑦定容;⑧冷却。其正确的操作顺序 为 ②①③⑧⑤⑥⑦④ 。
溶液的配制及分析
• 一、物质的量浓度
• 二、一定物质的量浓度溶液的配制
1
课前提问
1、初中阶段溶液的组成是 。
2、溶液的浓度是用
表示。
3、溶解度的含义是
。
2
NaOH + HCl = NaCl + H2O
质量 关系
40 g
36.5g
58.5 g
18 g
物质的 1mol 量关系
1mol
1mo为2mol/L的硫酸溶 液500mL, 含硫酸的物质的量为__mol 。 1
(2)标准状况下,22.4L HCl 配成 0.5L 2 mol/L。 盐酸,其物质的量浓度为_____ (3)将40g NaOH 配成2L溶液,其物 质的量浓度为______mol/L 。 0. 5
《溶液的配制及分析》课件

在医学检验中的应用
血液分析:检 测血液中的各 种成分,如血 红蛋白、白细 胞、血小板等
尿液分析:检 测尿液中的各 种成分,如尿 糖、尿蛋白、
尿胆红素等
生化分析:检 测血液中的生 化指标,如血 糖、血脂、肝
功能等
免疫分析:检 测血液中的抗 体、抗原等, 如乙肝、丙肝、
艾滋病等
微生物分析: 检测血液中的 微生物,如细
溶解度:在一定温度下,某物质在100g溶剂中达到饱和状态时所能溶 解的最大质量
溶液的性质:溶液具有均一性、稳定性、流动性等特点
溶液的配制方法
确定溶液的 浓度和体积
称量溶质和 溶剂
将溶质放入 烧杯中,加 入溶剂
搅拌至溶质 完全溶解
转移至容量 瓶中,定容
摇匀,静置, 待溶液稳定 后使用
配制过程中的注意事项
在化学工业中的应用
质量控制:检测原料、中间产品和成品的质量 反应监控:监控化学反应的进行和产物的生成 工艺优化:优化生产工艺,提高生产效率和产品质量 环保监测:监测废水、废气等污染物的排放,确保环保达标
在食品工业中的应用
食品添加剂的检测: 如防腐剂、色素、 甜味剂等
食品成分的分析: 如蛋白质、脂肪、 糖类等
菌、病毒等
基因分析:检 测血液中的基 因突变,如肿 瘤基因、遗传
病基因等
05 溶液分析的发展趋势
新型分析方法的研发
纳米材料分析:利用纳米材料进行溶液分析,提高灵敏度和准确性 生物传感器技术:利用生物传感器进行溶液分析,提高检测速度和灵敏度 光谱分析技术:利用光谱分析技术进行溶液分析,提高检测速度和准确性 微流控技术:利用微流控技术进行溶液分析,提高检测速度和灵敏度
步骤:取一定量的样品,加入已知质量的试剂,反应后过滤、洗涤、干燥, 最后称量反应产物的质量
溶液的配制及分析

6
3、具体实验过程: 、具体实验过程: 实验所需仪器:托盘天平、药匙(固体溶质使用) 烧杯、玻璃棒、 实验所需仪器:托盘天平、药匙(固体溶质使用)、烧杯、玻璃棒、 容量瓶、胶头滴管、量筒(液体溶质使用) 容量瓶、胶头滴管、量筒(液体溶质使用)
7
四、物质的量浓度溶液的配制步骤
1.计算:需要称量的氯化钠的质量 计算: n=cv=0.200mol/L×250×10-3L=0.0500mol × × m=n×M= 0.0500mol ×58.5g/mol≈2.9g × 注意:中学化学托盘天平精确到0.1g,称取一定量固体不估读 。 注意:中学化学托盘天平精确到0.1g, 2.称量 2.称量 (1)使用前要调零; 使用前要调零 使用前要调零; (2)两个托盘上各放一张大小相同 两个托盘上各放一张大小相同 称量纸; 的称量纸; (3)称量时遵循左物右码的原则; 称量时遵循左物右码的原则; 称量时遵循左物右码的原则 (4)用镊子夹取砝码应按照从大到 用镊子夹取砝码应按照从大到 用镊子夹取砝码应按照 小的顺序; 小的顺序; (5)称量完毕应将砝码放回盒中, 称量完毕应将砝码放回盒中, 称量完毕应将砝码放回盒中 游码归零; 游码归零; 【思考】NaOH能否直接放在称量纸上称量?为什么?应如何操作? 思考】 能否直接放在称量纸上称量? 能否直接放在称量纸上称量 为什么?应如何操作? 8
9
4. 转移 (1)直接把烧杯中溶液倒入容量瓶中行吗 直接把烧杯中溶液倒入容量瓶中行吗? 直接把烧杯中溶液倒入容量瓶中行吗 (2)此时溶质是否完全被转移到容量瓶中? 此时溶质是否完全被转移到容量瓶中? 此时溶质是否完全被转移到容量瓶中 (3)应如何处理? 应如何处理? 应如何处理 5. 洗涤 用少量蒸馏水洗涤烧杯内壁和玻璃棒 用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次, 烧杯内壁 次 洗涤液要全部转移到容量瓶中。 洗涤液要全部转移到容量瓶中。 【思考】如果用量筒量取液体药品,量筒要 思考】如果用量筒量取液体药品, 洗涤吗? 洗涤吗? 6.定容 6.定容 向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用胶头滴管滴 胶头滴管滴 向容量瓶中加入蒸馏水,在距离刻度 时 改用胶头滴管 加蒸馏水至刻度线。 加蒸馏水至刻度线。 【思考】若定容时不小心液面超过了刻度线,怎么办? 思考】若定容时不小心液面超过了刻度线,怎么办?
溶液的配制及分析-PPT课件

练习:
⑴配制200mL0.1mol/L的NaCl溶液ቤተ መጻሕፍቲ ባይዱ需NaCl的 质量为多少克? 1.17g
⑵欲配制1mol/L的NaOH溶液250mL,完成下列 步骤: ①用天平称取NaOH固体___1_0__g ②将称好的NaOH固体放入___烧__杯____中加__少__量_ 蒸馏水将其溶解,待__冷__却___后,将溶液沿_玻__璃__棒__ 移入__2_5_0__mL的容量瓶中。 ③用少量蒸馏水冲洗__2_~_3___次,将冲洗液移入 _2_5_0_m__L_容__量__瓶___中,在操作过程中不能损失点滴 液体,否则会使溶液的浓度偏__低____(低或高)。18
想一想
已知37%的H2SO4溶液的密度 为1.28g/cm3,求其物质的量浓度.
19
溶质(其摩尔质量为M)的质量分数 为w ,密度为ρ的某溶液中,其溶质的 物质的量浓度的表达式:
c 1000mL • • w
M •1L
20
溶液的配制及分析
1
1、物质的量浓度 (1) 定义:以单位体积溶液中所含有的 溶质的物质的量来表示溶液的组成 (2) 单位:mol/L(或mol/m3) (3)公式:
2
CB
÷V ×V
N ÷NA
n ×M m
×NA ×Vm
÷Vm
÷M
×ρ
÷ρ
Vg
3
( 1 )将40gNaOH配成2L溶液,其物质的量浓度为
胶头滴管
15
以配制0.1mol/L的NaOH溶液为例,说明下列操作 对实验结果的影响
__
减小 减小 增大
减小
减小
__ 无影响 __ 偏小
__ 偏小
__
偏大
_
做溶液配制实验报告(3篇)

第1篇实验名称:溶液配制实验目的:1. 熟悉溶液配制的基本操作方法。
2. 掌握使用量筒、容量瓶、移液管等仪器进行溶液配制的技巧。
3. 了解溶液浓度、摩尔浓度等基本概念。
实验原理:溶液配制是指将溶质按照一定比例溶解在溶剂中,形成一定浓度的溶液。
溶液的浓度可以用质量浓度、摩尔浓度等表示。
在实验中,我们通过准确称量溶质的质量、量取溶剂的体积,利用容量瓶、移液管等仪器进行溶液的配制。
实验仪器与试剂:1. 仪器:电子天平、量筒、容量瓶、移液管、烧杯、玻璃棒、滴定管、洗瓶、滤纸等。
2. 试剂:氯化钠、蒸馏水、氢氧化钠、硫酸等。
实验步骤:1. 称取一定质量的溶质。
根据实验要求,使用电子天平准确称取所需质量的溶质。
2. 量取一定体积的溶剂。
使用量筒量取所需体积的溶剂,倒入烧杯中。
3. 将溶质加入溶剂中。
将称量好的溶质小心地加入烧杯中的溶剂中,用玻璃棒搅拌至完全溶解。
4. 调整溶液体积。
将溶解后的溶液转移到容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,将冲洗液一并转移到容量瓶中。
5. 定容。
向容量瓶中加入蒸馏水,至刻度线处。
用滴定管滴加蒸馏水,直至液面与刻度线相切。
6. 摇匀。
将容量瓶盖紧,倒置几次,使溶液混合均匀。
实验结果与分析:1. 实验结果:配制了一定浓度的溶液。
2. 结果分析:通过准确称量溶质的质量、量取溶剂的体积,以及使用容量瓶、移液管等仪器进行溶液的配制,成功配制了一定浓度的溶液。
实验讨论:1. 在溶液配制过程中,应注意避免溶质粘附在容器壁上,影响溶液的浓度。
2. 使用量筒、容量瓶、移液管等仪器时,要确保准确读取刻度,避免读数误差。
3. 在定容过程中,要注意液面与刻度线相切,避免液面高于刻度线。
实验总结:本次实验成功配制了一定浓度的溶液,掌握了溶液配制的基本操作方法。
通过实验,加深了对溶液浓度、摩尔浓度等基本概念的理解。
在实验过程中,需要注意操作细节,确保实验结果的准确性。
实验日期:____年__月__日实验人:____指导教师:____第2篇一、实验目的1. 熟悉溶液配制的基本操作方法。
溶液的配制及分析

溶液的配制及分析引言:溶液是化学实验中常见的一种状态,它由溶质和溶剂组成,并且可以用于实验室中的各种化学实验。
本文将介绍溶液的配制方法以及常用的溶液分析方法。
一、溶液的配制:1.质量配制法:根据所需溶质质量和溶液的浓度,称取溶质,并加入少量溶剂进行溶解,然后再加入足量的溶剂至所需体积。
这种方法适用于固体溶质的配制。
2.体积配制法:根据所需溶质质量和溶液的浓度,先将溶质称取至容量瓶中,然后加入少量溶剂进行溶解,最后加入足量的溶剂至刻度线。
这种方法适用于固体溶质和液体溶质的配制。
3.定容配制法:将一定体积的溶液配制至所需浓度。
首先称取所需溶质质量,并加入足量溶剂溶解,然后将溶液转移到容量瓶中,加入溶剂至刻度线。
这种方法适用于固体溶质和液体溶质的配制。
4.稀释法:将浓溶液稀释为所需浓度的溶液。
用浓溶液配制较小体积的溶液,然后将其加入稀释液中,搅拌均匀即可得到所需浓度的溶液。
二、溶液的分析:1.pH值的测定:测定溶液的pH值可以用来判断其酸碱性。
常用的方法有酸碱滴定法、玻色法、玻尔视域法等。
2.浓度的测定:常见的溶液浓度测定方法有重量法、体积法、比色法和化学分析法等。
其中,常用的浓度测定方法有酸碱滴定法、络合滴定法、氧化还原滴定法等。
3.离子浓度的测定:常见的离子浓度测定方法有电导法、滴定法、复合电极法、离子交换色谱法等。
其中,电导法是一种简便快捷的离子浓度测定方法。
4.溶液中其中一种特定物质的测定:比如溶解度的测定、吸收测定、荧光测定等。
这些测定方法主要应用光谱仪器进行测量。
结论:。
溶液的配制及分析

注意:n—溶质物质的量
V—溶液的体积
(V溶液≠V溶剂或V溶液≠V溶剂+V溶质)
• 1. 2molNaOH配成200mL溶液,其物质的 10 量浓度为____mol/L 。 • 2. 标准状况下,22.4LHCl溶于水配成0.5L 盐酸,其物质的量浓度为__mol/L 。 2 • 3. 物质的量浓度为2mol/L的硫酸溶液 1 500mL,含硫酸的物质的量为___mol 。 5 • 4. 10mol HCl能配成____L 物质的量浓度为 2mol/L的盐酸 ? • 5. 假设某矿泉水中K+含量为27.3mg/L,则该 矿泉水中钾离子的物质的量浓度为多少 mol/L? 0.0007mol/L
7、装瓶贴签 容量瓶中不能保存溶液,因此要把配制好的溶液转移到 试剂瓶中,贴好标签,注明溶液的名称和浓度。
分析并归纳配制一定物质的量浓度的溶液的注意事项 (1)使用前检漏;
(2)称量固体时精确到0.1g
(3)不能配制任意体积的溶液 (比如950mL某浓度溶液应选1000mL的容量瓶,确定溶质时,不能 按照950mL计算,要按照1000mL计算) (4)溶解后稀释不能用容量瓶 (5)溶液需冷却后才能移入容量瓶 (6)引流时,玻璃棒下端应伸到刻度线以下 (7)滴加蒸馏水时超刻度线必须重新配制 (8)摇匀后发现液面低于刻度线不能再加水 (9)不能长期存放溶液或进行反应
瓶。 如何将烧杯中的液体转移到容量瓶中?
玻璃棒引流
为什么要洗涤玻璃棒和烧杯?
确保溶质全部转移到容量瓶中,减 少实验误差
注意:①玻璃棒不与瓶口接触,防止溶液外流; ②玻璃棒一端应靠在刻度线以下,
(以免容量瓶管壁沾上原始浓溶液,使得定容后浓度变低)
5、定容(仪器:胶头滴管)
溶液的配制及分析

⑥往烧杯里加入适量蒸馏水,用玻璃棒搅拌,使其溶 解,并使其恢复至常温;
⑦用酒精灯加热使AgNO3溶解;
⑧将溶液沿玻璃棒注入______mL容量瓶中。 (1)请选择配制过程所必需的操作,并按操作先后顺序 的排列为____________。 (2)第④步和第⑧步中空白处应该填入的数字依次是
____________和_____________。
【解析】选C。根据题意,由c(Na+)=3 mol·L-1可计算
出c(Mg2+)=c(Cl-)=5 mol·L-1,再由电荷守恒规律得 c(SO42-)=4 mol·L-1。
2.(16分)现用质量分数为98%、密度为1.84 g·cm-3的
浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择 的仪器有:①玻璃棒 ⑤量筒 列问题: ⑥容量瓶 ②烧瓶 ⑦托盘天平 ③烧杯 ④胶头滴管 ⑧药匙。请回答下
【自主解答】配制溶液最主要仪器是容量瓶等,经计
算CuSO4·5H2O:25.0 g,然后考查具体操作的细节, 最后用胶头滴管定容。
答案:(1)托盘天平、烧杯、玻璃棒、500mL容量瓶、 胶头滴管 (3)托盘天平 (2)25.0 烧杯 玻璃棒
(4)玻璃棒
洗涤液
500 mL
容量瓶
容量瓶
玻璃棒
烧杯
(5)1 cm~2 cm (6)食指
(2)经计算需要CuSO4·5H2O:_________克;
(3)用_______量取CuSO4·5H2O并放入_______中,加 入适量水,用___________搅拌;
(4)把所得溶液沿______注入容积为_____的_____中, 并用适量水洗涤_______和______2~3次,把_____也
溶液的配制及分析
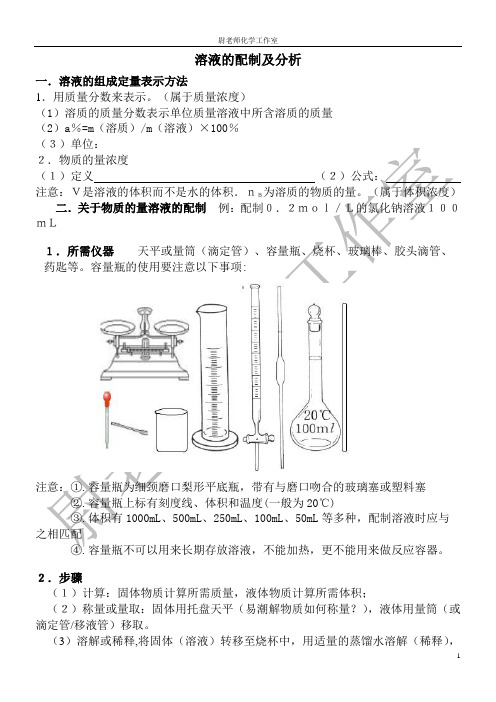
溶液的配制及分析一.溶液的组成定量表示方法1.用质量分数来表示。
(属于质量浓度)(1)溶质的质量分数表示单位质量溶液中所含溶质的质量(2)a%=m(溶质)/m(溶液)×100%(3)单位:2.物质的量浓度(1)定义(2)公式:注意:V是溶液的体积而不是水的体积.nB为溶质的物质的量。
(属于体积浓度)二.关于物质的量溶液的配制例:配制0.2mol/L的氯化钠溶液100mL1.所需仪器天平或量筒(滴定管)、容量瓶、烧杯、玻璃棒、胶头滴管、药匙等。
容量瓶的使用要注意以下事项:注意:①.容量瓶为细颈磨口梨形平底瓶,带有与磨口吻合的玻璃塞或塑料塞②.容量瓶上标有刻度线、体积和温度(一般为20℃)③.体积有1000mL、500mL、250mL、100mL、50mL等多种,配制溶液时应与之相匹配④.容量瓶不可以用来长期存放溶液,不能加热,更不能用来做反应容器。
2.步骤(1)计算:固体物质计算所需质量,液体物质计算所需体积;(2)称量或量取:固体用托盘天平(易潮解物质如何称量?),液体用量筒(或滴定管/移液管)移取。
(3)溶解或稀释,将固体(溶液)转移至烧杯中,用适量的蒸馏水溶解(稀释),冷却到室温(4)移液:将烧杯中的溶液有玻璃棒小心地引流到(适当规格的)容量瓶中:(5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。
(6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。
(7)倒转摇匀:盖好瓶塞,反复上下颠倒,摇匀。
烧杯中(2)配制一定量的溶液时,若取用5 mL浓盐酸,常用10 mL量筒而不用100 mL 量筒,为什么?三.关于溶液物质的量浓度的计算A基本类型:例.求500mL0.5mol/LNaOH溶液中含溶质的质量B.溶液物质的量浓度和溶质质量分数的换算m=cVM=1000Vρa %cM=1000ρa %强调:在此公式中,物质的量浓度(c)、溶质的质量分数(a%)、溶质的摩尔质量(M)和溶液密度(ρ),已知任何三个量,可计算第四个量。
化学溶液配制实验报告(3篇)

第1篇实验名称:化学溶液配制实验实验目的:1. 熟悉化学溶液的配制方法。
2. 掌握溶液浓度和体积的计算方法。
3. 培养实验操作技能,提高实验准确性。
实验原理:化学溶液的配制是通过溶解固体溶质于溶剂中,得到一定浓度的溶液。
根据摩尔浓度(M)的定义,溶液中溶质的摩尔数与溶液体积的比值即为溶液的摩尔浓度。
实验仪器与试剂:1. 仪器:天平、烧杯、玻璃棒、容量瓶、移液管、滴定管、量筒等。
2. 试剂:待配溶液(固体溶质)、溶剂(水或其他溶剂)、标准溶液(如NaOH标准溶液)等。
实验步骤:1. 计算所需溶液的浓度和体积。
2. 称量固体溶质,准确至0.01g。
3. 将固体溶质加入烧杯中,加入少量溶剂溶解。
4. 将溶液转移至容量瓶中,用溶剂洗涤烧杯和玻璃棒,并将洗涤液转移至容量瓶中。
5. 定容至刻度线,用滴定管加入适量标准溶液进行滴定。
6. 记录滴定数据,计算待配溶液的浓度。
实验数据及处理:1. 计算所需溶液的浓度和体积:设待配溶液的摩尔浓度为C,体积为V,所需固体溶质的质量为m,摩尔质量为M。
根据公式:C = m / (M V),可以计算出所需固体溶质的质量。
2. 称量固体溶质:称取固体溶质,准确至0.01g。
3. 溶解固体溶质:将固体溶质加入烧杯中,加入少量溶剂溶解。
4. 转移溶液:将溶液转移至容量瓶中,用溶剂洗涤烧杯和玻璃棒,并将洗涤液转移至容量瓶中。
5. 定容:定容至刻度线,用滴定管加入适量标准溶液进行滴定。
6. 记录滴定数据:记录滴定过程中消耗的标准溶液体积,以及滴定终点时的颜色变化。
7. 计算待配溶液的浓度:根据滴定数据,计算出待配溶液的浓度。
实验结果与分析:1. 通过实验,成功配制出所需浓度的溶液。
2. 实验过程中,注意了称量、溶解、转移等操作,确保了实验的准确性。
3. 通过滴定实验,验证了待配溶液的浓度。
实验结论:1. 本实验成功配制出所需浓度的溶液,实验结果符合预期。
2. 在实验过程中,掌握了化学溶液的配制方法,提高了实验操作技能。
溶液的配制及分析

m
÷M
×M
n
B
×NA
÷NA
N
×V(aq)
÷V(aq)
c (溶液)
1、将40g NaOH溶于2L水中配成溶液,其物 质的量浓度是0.5mol/L吗?
V指的是溶液体积,溶液的体积不等于
溶剂的体积。 2、从1L 1mol/LNaCl溶液中分别取出100mL、 10mL、1mL,取出的溶液中NaCl的物质的量 浓度及物质的量各是多少? 从一定物质的量浓度溶液中取出任意体积的溶液 1 1 1 c(mol/L) ,其 浓度 相同、所含溶质的 物质的量 不同。 0.1 0.01 0.001 __
量瓶中。
③用少量蒸馏水冲洗 2-3 次,将冲洗液移 容量瓶 入_______ 中,在操作过程中不能损失点 滴液体,否则会使溶液的浓度 偏低 (高 或低)。 ④向容量瓶内加水至刻度线 1-2厘米时,改 用 胶头滴管 小心地加水至溶液凹液面与 刻度线相切,若加水超过刻度线,会造 成溶液浓度偏 低 ,应该 重新配制。 ⑤最后盖好瓶盖, 摇匀 ,将配好的溶液移 入 试剂瓶 中并贴好标签。
溶 液 的 配 制 及 分 析
2NaOH+H2SO4=Na2SO4+2H2O
要中和0.2 mol的NaOH,需要多少mL的 要中和0.2 mol的NaOH,需要多少 molH2SO4? • NaOH+HCl=NaCl+H2O H2SO4溶液? 在初中阶段,用什么物理量来表示溶液的浓度? 溶质质量(g) 溶质的质量分数(%)= ×100% 溶液质量(g) H2SO4的质量分数为20%,需要多少克的H2SO4 溶液?49g
C(H+)=22/3mol/L
C3V3 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)
溶液的配制及分析

托盘天平
烧杯
冷却至室温 500
2~3
1~2 cm 与刻度线相切
凹液面
【特别提醒】 (1)配制一定物质的量浓度的溶液是将一定质量或体积
的溶质在选定的容量瓶中定容,不必计量水的用量。
(2)配制NaOH溶液时,必须用小烧杯快速称量NaOH固体,
不能将NaOH直接放在纸上,因NaOH固体易潮解,且易与
空气中的CO2反应。
(3)用玻璃棒向容量瓶引流时,玻璃棒下端应在容量瓶
的环形刻度线以下。
(4)容量瓶不能配制任意体积的溶液,不能溶解、稀释 和贮存液体,不能用作反应器。
【典题技法归纳】
下列说法正确的是
(
)
①配制
A.(2016·梧州模拟)可用 1 L 0.100 0 mol·L-1 NaCl溶液
B.(2015·安徽高考)可采用
第三单元
溶液的配制及分析
考点一 1.物质的量浓度: (1)含义。
物质的量浓度及有关计算 【核心知识通关】
物质的量
cB nB V
mol·L-1
(2)特点:对于某浓度的溶液,取出任意体积的溶液,其
不变 但所含溶质的_______ 物质的 浓度、密度、质量分数_____, 量 、_____ 质量 则因体积不同而改变。 ___
3 c2mol·L-1。 5 9.8c1 答案:(1) % 1
1 c2mol·L-1氨水的密度,等 5
(2) c1
2
(3)大于
大于
考点二
一定物质的量浓度溶液的配制及误差分析 【核心知识通关】
1.有关仪器的使用: 左盘 (1)托盘天平:称量前先调零,称量时药品放在_____, 右盘 读数精确到____g 0.1 。 砝码放在_____,
溶液的配制及分析

请填写下列空白:
(1)操作步骤的正确顺序为(填序号)__________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、
玻璃棒,还缺少的仪器是________、________、________。
(3)下列情况会使所配溶液浓度偏高的是(填序号)
。
a.某同学观察液面的情况如右图所示
b.没有进行上述的操作步骤D
溶解前小烧杯内有水
--
称量时间过长
减小 -
用滤纸称NaOH 向容量瓶注液时少量流出
减小 - 减小 -
未洗烧杯和玻璃棒
减小 -
未冷却至室温就注入定容 - 减小
定容时,水加多后用滴管吸出 减小 -
对c的影响
① ② ③ ④ ⑤ ⑥ ⑦
可能引起误差的一些操作 定容摇匀时液面下降再加水
过程分析
mV - 增大
【规律小结】 使用物质的量浓度的注意事项 ①物质的量浓度概念中的体积是溶液的体积(一般以升为单位),而不是溶 剂的体积。 ②溶质的量是用物质的量表示,而不是用质量表示。 ③从一定的物质的量浓度的溶液中取出任意体积的溶液,物质的量浓度 不变。 ④若物质的量浓度相同,体积不同时,则所含溶质物质的量也不同。 ⑤根据n=cV,在物质的量浓度相同、体积相同的溶液里,所含溶质物质 的量相同。但是溶质微粒的数目不一定相同。 ⑥用结晶水合物配制溶液时,其溶质不应包含结晶水。例如,25 g胆矾 (CuSO4·5H2O)溶于水后形成的溶液,溶质是CuSO4,而不是CuSO4·5H2O。
(2)俯视刻度线(图2)。恰好相反,刻度线高于液面的实际读数,使得加水 量偏小,浓度偏高。
如图为配制250 mL 0.2 mol·L-1Na2CO3溶液的示意图。
溶液的配制与分析

操作步骤
配制时,其正确的操作顺序是(字母表示,每个字母只能用一
次)________。
A.用 30 mL 水洗涤_______2~3 次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取
mL 2.4mol/L 的硫酸镁溶液,沿玻璃
棒倒入
中,再加入少量水(约 30 mL),用
(A )
解析 据混合后n(H2SO4)=n1(H2SO4)+n2(H2SO4),设取
混合前两硫酸溶液的体积为V
mL,则有c=
nH2SO4 V溶液
=
ρc11VV+ +ρ3 cρ22VV××1100--33=cρ1+1+cρ22ρ3,应选答案A。
解题指导 1在进行有关物质的量浓度计算时,要充分应 用溶质的物质的量、质量及溶液中的电荷守恒。2溶液稀 释混合时,溶液的体积一般不可直接相加,应用溶液的总质 量和密度来计算。
D .氢氧化钠溶液 E .饱和石灰水
2.常温下,向饱和石灰水中加入生石灰,恢复到室温, 下列说法正确的是( )
A. 溶解度降低
B. PH值增大
C. 钙离子浓度减少 D. 钙离子数目减少
E. 溶液质量减少。
三.溶液的组成
下列溶液中所含的微粒数从多到少的是 50mL 0.1 mol/L的乙醇溶液 40 mL 0.1 mol/L的醋酸溶液 30mL 0.1 mol/L的盐酸溶液 20mL 0.1 mol/L的氢氧化钠溶液 溶液导电能力从大到小的是
第三讲 溶液的配制与分析
考纲要求
1.了解溶液的含义 2.了解溶解度、饱和溶液的概念 3.了解溶液的组成,理解溶液中溶质的质量 分数、物质的量浓度的概念,并能进行有 关的计算。 4.掌握一定溶质质量分数、物质的量浓度溶 液的配制方法。
化学必修1溶液的配制及分析

氧化还原反应
氧化还原反应是指电子转移的反 应,其中氧化剂获得电子并还原 其他物质,而还原剂则失去电子
并被氧化。
氧化还原反应的标志是元素化合 价的升降。
氧化还原反应广泛应用于化学合 成、工业生产和环境保护等领域。
05
实验:溶液的配制与分析
实验目的与要求
01
02
03
04
掌握溶液配制的基本原理和方 法。
溶解误差
如果溶解不完全或不充分,会 影响溶液的浓度。
转移和定容误差
如果转移或定容不准确,会影 响溶液的浓度。
03
溶液的分析方法
酸碱滴定法
80%
原理
通过滴定实验,利用酸碱指示剂 颜色的变化来确定滴定终点,从 而计算出待测溶液的浓度。
100%
操作步骤
选择适当的指示剂,用标准溶液 滴定待测溶液,观察指示剂颜色 的变化,记录滴定终点时消耗的 标准溶液的体积。
溶液中的溶质和溶剂是相对而言的,通常把被溶解 的物质称为溶质,而把能溶解其他物质的物质称为 溶剂。
溶液的组成
溶液由溶质和溶剂组成,溶质 可以是固体、液体或气体,溶 剂也可以是固体、液体或气体 。
在一定温度和压力下,溶质在 溶剂中的溶解度是有限的,当 达到饱和状态时,溶质和溶剂 将形成均一稳定的混合物。
掌握溶液配制的基本原理和方 法。
掌握溶液配制的基本原理和方 法。
掌握溶液配制的基本原理和方 法。
实验操作步骤
01
02
03
04
05
1. 准备实验仪器 2. 称量与溶解 和试剂
3. 转移与定容
4. 测量与记录 5. 误差分析
容量瓶、天平、烧杯、量 筒、胶头滴管、蒸馏水、 待测物质等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液的配制及分析
周昌盛
一、教材分析
1、本节课在教材中的地位和作用
化学是一门以实验为基础的自然科学,化学实验一直是化学教学中的重要环节,也是培养和考察学生能力的重要部分,所以一定物质的量浓度溶液的配制这节课,不仅是本章知识的延伸,是本章的重点、难点、是整个高中化学中的一个重要的实验,是学生接触的第一个定量实验,其实验的准确性和规范性直接影响实验的精确程度。
因此,学习它对学生今后的学习和实验研究具有深远的意义。
2、教材目标的确立及确立依据
本节课是在学过了物质的量浓度的概念和意义的基础上,初步学会实验的方法和实验操作的基本技能,所以结合教材的具体内容、教学大纲和考试说明中的要求、结合学生实际情况,以培养学生实验能力为主,确实教学目标如下:
知识与技能:①使学生初步学会配制一定浓度溶液的方法和技能
②进一步学会容量瓶的使用方法
过程与方法:培养学生动手实验的操作能力和分析、解决问题的能力。
情感态度与价值观:培养学生注重实验,崇尚科学的认知态度。
3、教学重点、难点的确立及确立依据
根据本节课在教材中的地位和作用,根据教学目标,结合学生的具体情况,我确定教学重点为溶液配制的方法和过程,难点为培养学生实验操作的能力。
二、教学方法
基于上述分析,本节采用指导实验和演示实验相结合的教法,同时辅以启发式、对比式、分析讨论式等教学方法,多处问题的解决和实验操作由学生完成,调动积极性,发挥学生主体作用。
三、教学手段
演示实验、学生实验、投影
四、教学过程
1、复习:物质的量浓度的概念及表达式
2、启发式引出新课:500ml 0.1mol/L Na2CO3溶液的表示意义?
①体积为500ml 浓度为0.1mol/L
②溶液中含Na2CO3的物质的量为0.05mol,质
量为5.3g
问题:如果我们配制该溶液需要怎样做?
3、新课内容:
⑴指导阅读:同时指导学生注意实验操作程序和规范性。
⑵提出检查性问题:配制该溶液需要哪些仪器,有哪些操作步骤。
通过学生间讨论研究得出溶液配制的方法、步骤和所需仪器,调动学生积极思考,为亲手做实验做准备。
⑶提出讨论题:①容量瓶上为什么一定要注明温度?
②烧杯、玻璃棒为什么一定要洗涤二至三次?
③定容时,应平视液面最低处,仰视、俯视的错误操作
的结果是什么?
(深层思考、达到掌握、理解知识的目的,同时引起有意注意。
)
⑷教师介绍讲解:容量瓶的规格和使用方法。
⑸教师指导学生间配合完成实验:
分五步完成;
①检验各自实验桌上的容量瓶是否漏水,然后分别向容量瓶中
加水至接近刻度线,亲身感受平视、俯视、仰视时的体积变
化,然后汇报得出的结论,之后投影图片1配合图形讲解,
强化认识。
②用天平称量5.3g Na2CO3固体。
③溶解、转移、洗涤。
④定容、装瓶、贴标签。
⑤收拾实验桌上用品,摆放整齐,擦洗干净。
物质的量
⑹误差分析,从公式入手。
物质的量浓度=
溶液的体积
浓度与物质的量成正比,与体积成反比。
由感性认识到理性认识,重申实验规范操作的必要性。
⑺练习:下列情况对配制溶液的浓度有何影响。
1、用天平称量药品时,游码未放置零处。
2、溶液未经冷却移入容量瓶中。
3、定容时,仰视液面的最低点。
4、小结:实验步骤和注意点
5、作业:思考能造成浓度偏低的因素有哪些?
六、板书设计:
物质的量浓度
一定物质的量浓度溶液的配制
溶质为液体的溶液配制(溶液的稀释):
1、原理C1V1=C2V2
2、步骤:计算、称量、溶解、转移、洗涤、定容、摇匀、装瓶、贴标签
教案
课题:物质的量的浓度(第二课时)
教学目的:1、使学生初步学会配制一定的物质的量浓度溶液的方法和技能;
进一步学会容量瓶的使用方法。
2、培养学生动手实验的操作能力和分析解决问题的能力。
3、培养学生注重实验,崇尚科学的认知态度。
重点难点:一定物质的量浓度溶液的配制方法。
培养学生实验操作能力。
教学方法:指导实验与演示实验结合、启发、对比、讨论,。
教学用品;容量瓶(500ml)、烧杯、玻璃棒、胶头滴管、药匙、天平、滤纸、Na2CO3(固体)、蒸馏水。
教学过程:
一、复习:物质的量浓度的概念及表达式。
二、讨论式引出新课:500ml 0.1mol/L的Na2CO3溶液的表达意义是什么?
1、体积为500ml 浓度为0.1mol/L
2、溶液中含Na2CO3的物质的量为0.05mol。
质量的5.3g。
如果我们配制该溶液需要怎样做。
三、新课内容:
[阅读]指导阅读教材,同时指导学生注意实验操作程序和规范性。
[问题]提出检查性问题:1、实验操作需要哪些步骤。
2、用到哪些仪器,了解仪器的构造特点和使用方法。
通过学生间讨论研究得出溶液配制的方法、步骤和所需仪器。
[讲授]、容量瓶:展示不同规格容量瓶,注意观察形状和瓶上的标记。
介绍检验漏水方法和使用方法。
[设问]深层思考:1、为什么注明温度?
2、使用过程中要注意什么?为什么?
[讨论]提出讨论题:激发学生深层思考,同时提出问题引起注意。
1、配制溶液过程中,烧杯、玻璃棒为什么一定要洗涤二至三次。
2、定容操作时,应平视液面最低处与刻度线相切,仰视或俯视错误操作有什么影响?
[学生实验]分别向容量瓶中加水至接近刻度线,亲身感受平视、俯视、仰视。
从不同视角观察,液面与刻度线的位置关系,得出正确的结论。
[投影]配合图形讲解,突出实验操作规范性,同时认清错误操作造成的结果。
俯视
平视
仰视
[学生分步实验]1、检查实验桌上的容量瓶是否漏水。
2、用天平称量5.3g Na2CO3,注意天平使用方法。
3、溶解和转移,洗涤。
4、定容、装瓶、贴标签。
5、收拾实验桌面用品、摆放整齐、擦洗干净。
[概括性讲述]实验操作规范性,错误操作对浓度造成的影响。
[投影] 溶质的物质的量
物质的量浓度=
溶液的体积
由公式入手,浓度与物质的量成正比,与体积成反比。
只要造成溶质的物质的量或体积有误差,那么实验结果就有误差。
[思考]下列情况对配制溶液的浓度有何影响。
1、用天平称量药品时,游码未放置零处。
2、溶液未经冷却,移入容量瓶中。
3、定容时俯视液面最低处。
[总结]通过本节实验课,培养学生亲自动手的实验意识和实验操作能力,注意操作的准确性,从而养成科学的认知态度。
[作业]、思考:能造成浓度偏低的因素有哪些?。
