钠钾ATP酶的临床研究进展_刘晶
人红细胞Na +,K +-ATP酶活性测定法及临床应用

光 径 1c 以空 白转化 液调零 。K 值 法计 算 Hb m,
徐 彬 ( 天津 港 口医 院检 验科 , 津 天 30 5 ) 0 4 6 中图分类 号 : 4 6 1 2 文献 标 志码 : R 4. 1 A 文章 编号 :6 17 1 ( O 7 0 — 6 —3 1 7~ 4 4 2 O ) 50 70
近年 来 , 随着 细 胞分 子 等学 科 的进 展 , 们 已 人 认 识 到 细 胞 Na K ATP酶 的活 性 与具 有 重 要 , 一 生 理作用 的 Na 和 K 代 谢密 切相 关 , 因而 该 酶 引 起 了人们 越来 越多 的关注 n 。为此 , ] 笔者 建立 了简 便 易行 的 Na K+ ATP酶 活性 测定 法 , 测定 了 , _ 并 健 康人 和糖 尿病 患 者 R C膜 Na K AT B , 一 P酶 活 性 , 探讨 糖尿病 人该酶 活性 的变 化及 f 意义 。 来 临床 1 材 料与 方法
用 4 C 存 的冷生 理盐 水洗 3次 , 保 每次均 离心弃 去
上 层 液 体 , 压 积 R C O F , 0 9ml i HC 取 B I O 1加 . s Tr — 1 缓 冲液和 1g d 皂 素 1 l振 荡 , 之充分 溶血 。 /l 0 , 使 1 5 2 Hi N 测 定法 测 定 血 红蛋 白: 溶血 液 2 .. C 取 O l加 到 5ml , Hb转 化 液 中, 匀 , 置 5ri , 混 静 n 用 a 73 2 0分光 光 度计 测 定 5 0rf波长 下 的 吸光 度 值 4 r ll
反 应 酶 活性 的高 低 。
1 3 试 剂 .
机( 北京 医用离 心机 厂) ④B ; s型 电热三用 水 箱 ( 北 京 医疗设 备厂 ) 。
家蚕钠钾ATP酶及其基因和应用[发明专利]
![家蚕钠钾ATP酶及其基因和应用[发明专利]](https://img.taocdn.com/s3/m/353c1583783e0912a2162af9.png)
专利名称:家蚕钠钾ATP酶及其基因和应用专利类型:发明专利
发明人:赵萍,衣启营,王鑫,夏庆友,宋倩茹申请号:CN201410555339.8
申请日:20141016
公开号:CN104312993A
公开日:
20150128
专利内容由知识产权出版社提供
摘要:本发明公开了一种家蚕钠钾ATP酶及其基因和应用,家蚕钠钾ATP酶的氨基酸序列如SEQ ID NO.8所示或SEQ ID NO.8所示氨基酸序列经取代、缺失或添加至少一个氨基酸且来源于家蚕的具有钠钾ATP酶功能的酶,该酶具有四个钠、钾离子及ATP结合的保守的氨基酸位点,属于典型的P-type钠钾ATP酶,编码该酶的基因在家蚕五龄第3天的各个组织中均有表达,但钠钾ATP酶只在家蚕五龄三天的头部和表皮中有表达,经体外真核表达后发现钠钾ATP酶具有水解ATP酶活性,由于家蚕丝腺腔内金属离子交换是影响家蚕丝蛋白构象转换的重要影响因素,因此家蚕钠钾ATP酶功能研究对今后改良家蚕丝纤维具有重要的意义。
申请人:西南大学
地址:400715 重庆市北碚区天生路2号
国籍:CN
代理机构:北京同恒源知识产权代理有限公司
代理人:王贵君
更多信息请下载全文后查看。
钠钾ATP酶的临床研究进展_刘晶

代
医
Modern Medical Journal
学 2016 , Jun; 44 ( 6 ) : 914 -917
1, 599 older people[ J] . Neurology, 2014 , 82 : 326 -331. [ 30] GIANNAKOPOULOS P, GOLD G, KOVARI E, et al. Assessing the cognitive impact of Alzheimer disease pathology and vascular burden in the aging brain: the Geneva experience [ J] . Acta Neuropathol, 2007 , 113 : 1 -12. [ 31] TOMLINSON B E, BLESSED G, ROTH M. Observations on the brains of non-demented old people[J] . Neurol, 1968 , 7: 331 -356. [ 32] BENNETT D A, SCHNEIDER J A, ARVANITAKIS Z, et al. Neuropathology of older persons without cognitive impairment from two community-based studies[ J] . Neurology, 2006 , 66 : 1837 -1844. [ 33] MATTSSON N, BLENNOW K, ZETTERBERG H. Inter-laboratory variation in cerebrospinal fluid biomarkers for Alzheimer's disease: united we stand, divided we fall[ J] . Clin Chem Lab Med, 2010 , 48 ( 5 ) : 603 -607. [ 34] GIACOBINI E, GOLD G. Alzheimer disease therapy-moving from amyloid-beta to tau[ J] . Nat Rev Neurol, 2013 , 9 ( 12 ) : 677 -686. [ 35] THOMPSON P W, YE L, MORGENSTERN J L, et al. Interaction of the amyloid imaging tracer FDDNP with hallmark Alzheimer's disease pathologies[J] . Neurochem, 2009 , 109 ( 2 ) : 623 -630.
26429415_钠钾ATP酶与肿瘤研究进展

㊀基金项目:国家自然科学基金青年基金项目(No.81703562)㊀作者简介:张叶ꎬ女ꎬ研究方向:肿瘤免疫药理学ꎬE-mail:joyezhang313@163.com㊀通信作者:杨勇ꎬ男ꎬ博士研究生ꎬ教授ꎬ博士生导师ꎬ研究方向:肿瘤免疫药理学ꎬTel:139****3047ꎬE -mail:yy@cpu.edu.cn钠钾ATP酶与肿瘤研究进展张叶1ꎬ李娴静1ꎬ杨勇2(1.中国药科大学新药安全评价研究中心ꎬ江苏南京211198ꎻ2.中国药科大学基础医学与临床药学学院ꎬ江苏南京211198)摘要:钠钾三磷酸腺苷酶(Na+/K+-ATPaseꎬNKA)是一种跨质膜转运钠钾离子的离子泵ꎬ对维持细胞内外渗透压平衡至关重要ꎮ钠钾三磷酸腺苷酶是由α亚基(亚基α1~α4)和β亚基(亚基β1~β3)及调节亚基组成的多聚体ꎮ已发现钠钾三磷酸腺苷酶参与调节与肿瘤细胞存活相关多种信号通路ꎬ抑制肿瘤细胞增殖ꎮ钠钾三磷酸腺苷酶抑制剂可通过诱导肿瘤细胞自噬凋亡ꎬ阻滞细胞周期等发挥抗肿瘤作用ꎮ本文旨在综述钠钾三磷酸腺苷酶在肿瘤发展转移中的作用ꎬ提高对钠钾三磷酸腺苷酶作为肿瘤治疗的潜在靶标的认识ꎮ关键词:钠钾三磷酸腺苷酶ꎻ肿瘤ꎻ强心苷中图分类号:R730.231㊀文献标识码:A㊀文章编号:2095-5375(2021)11-0760-005doi:10.13506/j.cnki.jpr.2021.11.013ResearchprogressofNa+/K+-ATPaseandtumorZHANGYe1ꎬLIXianjing1ꎬYANGYong2(1.CenterforNewDrugSafetyEvaluationandResearchꎬChinaPharmaceuticalUniversityꎬNanjing211198ꎬChinaꎻ2.SchoolofBasicMedicineandClinicalPharmacyꎬChinaPharmaceuticalUniversityꎬNanjing211198ꎬChina)Abstract:Na+/K+-ATPaseisanionpumpthattransportssodiumandpotassiumionsacrosstheplasmamembraneꎬwhichisessentialformaintainingthebalanceofosmoticpressureinsideandoutsidethecell.Na+/K+-ATPaseisapolymercomposedofαsubunits(subunitsα1~α4)ꎬβsubunits(subunitsβ1~β3)andregulatorysubunits.IthasbeenfoundthatNa+/K+-ATPaseparticipatesintheregulationofmultiplesigNalpathwaysrelatedtotumorcellsurvivalꎬtherebyinhibitingtumorcellproliferation.Na+/K+-ATPaseinhibitorscanexertanti-tumoreffectsbyinducingautophagyandapoptosisoftumorcellsandblockingcellcycle.ThisarticleaimedtoreviewtheroleofNa+/K+-ATPaseintumordevelopmentandme ̄tastasisꎬandtoimprovetheunderstandingofNa+/K+-ATPaseasapotentialtargetfortumortherapy.Keywords:Na+/K+-ATPaseꎻTumorꎻCardiacglycosides㊀㊀对钠钾三磷酸腺苷酶(Na+/K+-ATPase)的研究始于1957年ꎬSkou教授发现Na+/K+-ATPase是调节离子进出细胞的一种方式ꎬ且该酶需要在钠离子和钾离子存在下发挥活性[1]ꎮ基于这一发现ꎬSkou教授荣获了1997年的诺贝尔化学奖ꎮ作为一种重要的离子泵ꎬNa+/K+-ATPase最重要的作用就是介导跨膜活性离子的转运[2]ꎮ作为P型ATPase家族(也被称为E1-E2ATPase)的一员ꎬNa+/K+-ATPase能利用ATP水解产生的磷酸基团进行α基团上天冬氨酸残基的磷酸化和去磷酸化反应ꎬ从而将特定离子转运进出细胞[3]ꎮP型ATPase按照保守序列可分为5个亚家族(PI~V)ꎬ其中PIIATP酶亚家族包括Na+/K+-ATPaseꎬ肌浆网Ca2+泵ꎬ胃内H+/K+-ATPase[4]ꎮ其中Na+/K+-ATPase和H+/K+-ATPase是唯一以逆向转运方式起作用的P型ATPaseꎮNa+/K+-AT ̄Pase作为主要的膜整合蛋白之一ꎬ能同时将3个Na+泵出细胞并将两个K+泵入细胞ꎬ维持细胞膜内外的钠钾离子浓度差ꎬ可调节跨膜电化学梯度ꎬ促进膜静息电位的形成ꎬ对质膜上其他反应的发生至关重要[5]ꎮ除了广为人知的离子泵的作用外ꎬNa+/K+-ATPase与其他膜蛋白及胞质蛋白的动态相互作用的报道越来越多ꎬ这种相互作用在细胞生物活动中至少发挥两种重要作用:①早期研究重点关注的Na+/K+-ATPase对胞内外离子浓度动态调节ꎬ包括Na+㊁K+㊁Ca2+ꎻ②通过与信号蛋白的直接相互作用ꎬ在细胞信号转导中发挥重要作用ꎬ或作为信号整合剂将特定膜组织区域内的影响因子和效应器侨联在一起ꎮ过去二十年的研究表明ꎬNa+/K+-ATPase的信号转导功能的改变参与了许多临床疾病如肥胖㊁高血压㊁肿瘤等的进展[6]ꎮNa+/K+-ATPase还被证明作为治疗尿毒症心肌病和组织纤维化的治疗靶标[7-8]ꎮ最近研究发现ꎬNa+/K+-ATPase在肿瘤中异常表达ꎬ且能通过调节各种与细胞存活和死亡相关途径在肿瘤的发生ꎬ增殖和转移中发挥作用[9-13]ꎮ强心苷是动植物来源的天然化合物ꎬ如洋地黄毒苷㊁地高辛㊁毒毛旋花子苷Kꎮ强心苷类药物作为Na+/K+-ATPase的天然抑制剂能抑制Na+/K+-ATPase的活性ꎮ该类药物临床一直用于心力衰竭和心律不齐等心血管类疾病的治疗ꎮ但最近研究发现ꎬ强心苷通过抑制Na+/K+-ATPase活性和其他机制发挥抗肿瘤活性ꎬ本文对Na+/K+-ATPase的抗肿瘤作用的研究进展ꎬNa+/K+-ATPase抑制剂(强心苷类药物等)作为肿瘤潜在治疗策略进行了报道ꎮ1㊀Na+/K+-ATPase的结构和功能特征Na+/K+-ATPase是由α和β亚基以及属于FXYD(苯丙氨酸-X-酪氨酸-天冬氨酸ꎬ简写F-X-Y-D)蛋白家族的调节亚基组成的异源寡聚体ꎮ通过分解ATP获得能量ꎬ进行Na+㊁K+逆浓度梯度的主动转运ꎬ即能把Na+从细胞内转运到细胞外ꎬ把K+从细胞外转运入细胞内ꎬ维持细胞膜内外的K+㊁Na+浓度差以及细胞内外液的渗透压稳定ꎮα亚基作为催化亚基由10个跨膜螺旋(M1~M10)组成ꎬ这些螺旋上有Na+和K+和其他配体的结合位点ꎬ包括3个胞质结构域:催化功能域(A)ꎬ核苷酸结合域(N)和参与ATP水解磷酸化结构域(P)[14-16]ꎮ其中ATP分子能与α亚基的N结构域结合ꎬATP发生水解产生的磷酸基团能与P结构上的天冬氨酸残基结合[17]ꎮ在人类中ꎬNa+/K+-ATPase的α亚基有四种不同的亚型:α1㊁α2㊁α3和α4ꎬ分别由α1多肽(ATP1A1)㊁α2多肽(ATP1A2)㊁α3多肽(ATP1A3)和α4多肽(ATP1A4)的4种不同的基因编码而成[18]ꎮATP1A1几乎在所有细胞中均等表达ꎬ而ATP1A2主要在骨骼㊁心脏㊁平滑肌㊁脑(主要在星形胶质细胞)㊁肺和脂肪组织中表达ꎮATP1A3主要在神经元和心脏中表达ꎮATP1A4仅在精子细胞中检测到ꎬ对于精子的活动性和男性生育能力至关重要[19]ꎮβ亚基是一种小型糖蛋白ꎬ最初被认为作为分子伴侣发挥作用ꎮNa+/K+-ATPase的β亚基不参与任何催化反应ꎬ它能与α亚基的M7和M10螺旋相互作用ꎬ调节α亚基中的离子运输ꎮβ亚基还可以帮助维持上皮细胞的极化和细胞的运动ꎮ抑制β亚基功能会导致促进细胞运动的紧密连接丧失ꎬ最终导致癌症转移[16]ꎮβ亚基包含3种不同的亚型ꎬ分别由β1多肽(ATP1B1)㊁β2多肽(ATP1B2)和β3多肽(ATP1B3)编码得到ꎮATP1B1存在于大多数组织中ꎬ与α亚基一起形成组织内最广泛表达的Na+/K+-ATPase亚型-α1β1复合体ꎮβ2存在于神经元ꎬ松果体ꎬ骨骼肌中ꎬ介导神经元与神经胶质细胞的相互作用ꎬ促进神经突触生长ꎮβ3在睾丸ꎬ肝脏ꎬ肺脏ꎬ肾脏中表达[20]ꎮγ亚基又被称为FXYD2ꎬ是由66~68个氨基酸组成的小分子多肽ꎮFXYD2是FXYD蛋白家族一员ꎬ该家族蛋白被证明可以调节催化亚基的活性ꎮ其中FXYD2被证明与离子通道的开放有关[21]ꎮ此外ꎬ还有文献报道FXYD2能调节α亚基配体的亲和力[22]ꎮ尽管FXYD2具有某些调节作用ꎬ但已发现Na+/K+-ATPase在没有γ亚基存在下也能正常工作[17]ꎮ如上文所说ꎬNa+/K+-ATPase除了进行Na+㊁K+的运输ꎬ参与和维持细胞膜内外的电化学梯度外ꎬ还能与邻近的膜蛋白相互作用形成信号复合体ꎬ进行细胞内的级联信号反应ꎬ传递信息ꎮ其中NKA/Src/ROS信号通路的激活导致氧化应激失衡ꎬ加剧肿瘤㊁动脉粥样硬化㊁糖尿病㊁慢性肾病等疾病发展[23-25]ꎮ此外越来越多的证据表明作为一种多功能蛋白ꎬNa+/K+-ATPase在细胞黏附复合物形成和维持中发挥的关键作用ꎮNa+/K+-ATPase能与许多信号分子和肌动蛋白细胞骨架结合ꎬ形成多蛋白复合物ꎬ促进细胞间紧密连接和独立连接的形成[26]ꎮ有学者解释称在细胞膜上存在两种Na+/K+-ATPase:一种是作为能量转换离子泵的经典酶池ꎬ另一种是局限于小窝的发挥信号传导功能的酶池[27]ꎮ在不同的细胞和组织中ꎬ这种信号体的组成以及结合的蛋白质可能是不同的ꎬ这就导致该信号体在不同组织中尤其是在正常和病理状态下ꎬ如癌症中发挥不同功能ꎮ2㊀Na+/K+-ATPase作为肿瘤治疗的潜在靶点与相应正常组织相比ꎬ在人类癌症中Na+/K+-ATPase各亚型表达水平发生改变[26]ꎬ许多有关Na+/K+-ATPase促癌作用的报道已证明与Na+/K+-ATPase的α和β亚基的差异表达相关ꎬ但与γ亚基没有关系ꎮ如α1亚基在包括非小细胞肺癌[28]㊁肾细胞癌[29]㊁胶质细胞瘤[30]和黑色素瘤[31]中表达上调ꎬ而α3亚基在结肠癌中表达上调[32]ꎮ相反的是ꎬα1亚基据报道在前列腺癌中表达下调[33]ꎬ因此ꎬNa+/K+-ATPase的α亚基代表了一些与不良预后相关的癌症类型的潜在新靶点ꎮ人A549非小细胞肺癌细胞中α1亚基的特异性敲除显著降低了它们的迁移和增殖ꎬ进一步表明α1亚基作为这种肿瘤的治疗靶标的潜在用途[28]ꎮ此外ꎬβ亚基不仅在Na+/K+-ATPase本身的调控中发挥重要作用ꎬ而且在抑制癌症转移和肿瘤发生的抗肿瘤作用中扮演重要角色ꎬ这一点现在被越来越多的人所了解ꎮβ亚基的表达量在肿瘤中也发生了变化ꎬ已经有许多报道证实Na+/K+-ATPase的β1亚基在人上皮癌细胞中表达下调ꎮEspineda等[34]指出ꎬ当肿瘤细胞下调β1表达时ꎬ会显著减少钙粘蛋白表达ꎬ这促使肿瘤细胞彼此相互分离ꎬ有利于它们的迁移和转移ꎮ因此ꎬβ1亚基的下调似乎是许多上皮癌细胞变得独立侵袭的必要条件ꎮ此外ꎬ有研究报道β亚基的表观遗传调控ꎬ即ATP1B1甲基化下调β亚基的表达能促进肾癌细胞的生长ꎬ强心苷类药物由于能抑制Na+/K+-ATPase活性而被证明对癌细胞具有抗增殖作用ꎮ除了已发表文章外ꎬ也有许多专利强调了Na+/K+-ATPase作为未来抗肿瘤靶点的可能性ꎬRajasekaran报告发现ꎬ膀胱癌早期阶段Na+/K+-ATPase蛋白的总体表达水平较低ꎬ随着肿瘤的进展ꎬ表达水平会增加ꎮα亚基高表达和β亚基低表达的患者有早期复发的高风险ꎻ而具有低表达α亚基和高表达β亚基的患者具有较长的无复发时间ꎬ这表明Na+/K+-ATPase的α和β亚基表达水平是膀胱癌患者复发时间的有效预测因子[35]ꎮ类似的ꎬ研究人员报道ꎬ在肾透明细胞癌中β亚基表达降低可能与肾透明细胞癌的侵袭性有关[36]ꎮ相比之下ꎬVentaNaMedicalSystems发现宫颈组织中Na+/K+-ATPaseβ1亚基表达的增加与宫颈从低度到高度发育不良直到宫颈癌的发病进展相关ꎬ可作为宫颈癌发病的生物标志物[37]ꎮ总之ꎬNa+/K+-ATPase的表达在大多数癌组织中发生改变似乎是非常明显的ꎬ因此可以作为一种有用的新的生物标志物和治疗靶点ꎮ3㊀Na+/K+-ATPase对肿瘤的促进作用由于存在结构上的突变以及酶活性的波动ꎬNa+/K+-ATPase参与一些疾病如糖尿病ꎬ阿尔茨海默病的发病机制[17]ꎬ最近ꎬ逐渐有报道发现Na+/K+-ATPase也参与促进肿瘤生长的部分机制ꎬ影响包括上皮间质细胞转化(EMT)㊁丝裂原活化蛋白激酶(MAPK)级联过程㊁磷酸肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路㊁胆固醇稳态等细胞过程和途径ꎮ上皮间质转化是肿瘤发展和侵袭的关键过程ꎬNa+/K+-ATPase的β亚基已被证明有助于调节特定细胞上皮极化的完整性ꎬ相邻的β亚基之间形成二聚体ꎬ通过β-β桥增强细胞间的黏附ꎮ当β亚基的表达增高时ꎬ钙黏蛋白(E-cad ̄herin)的活性降低ꎬ从而导致EMT和癌症的侵袭和转移[38]ꎮMAPK家族与细胞周期ꎬ增殖凋亡相关ꎬ研究发现ꎬ强心苷类药物G毒毛旋花苷能通过抑制v-src禽肉瘤Na+/K+-ATPase活性活化p38MAPKꎬ从而上调p53等转录因子的表达[39]ꎬ此外ꎬMAPK信号通路的激活还能促进核因子-κB(NF-κB)表达ꎬ从而激发Fas介导的细胞凋亡[40]ꎮPI3K/Akt/mTOR通路参与调节细胞增殖ꎬ凋亡和自噬ꎬBarwe等[41]发现PI3K的激活与Na+/K+-ATPase的α亚基的表达增加有关ꎬ即调节亚基p85结合到α亚基上富脯氨酸结构域从而促进PI3K活性上调ꎬ从而调节细胞自噬ꎬ促进肿瘤细胞存活ꎮ胆固醇也能与催化亚基-α亚基结合ꎬ两者的相互作用已被证明可以调节胆固醇的运输㊁合成和代谢ꎮα亚基能与小窝蛋白-1的N端结构域相互作用从而调节细胞膜上小窝蛋白-1和胆固醇的含量ꎬ钠钾泵表达降低破坏了对质膜上胆固醇运输和合成的调节ꎬNa+/K+-ATPase作为胆固醇代谢调节剂的作用可能是肿瘤生长如乳腺癌的关键因素[42-43]ꎮ此外ꎬ也有文献报道抑制Na+/K+-ATPase后影响细胞钙稳态ꎬ从而诱导肿瘤细胞的程序性死亡[44]ꎮ在耐药的胶质母细胞瘤细胞中ꎬ当G毒毛旋花苷上调ATP1A2和ATP1A3表达时ꎬ可使肿瘤细胞对化疗药物敏感ꎬ并诱导细胞坏死[45]ꎮ4㊀Na+/K+-ATPase抑制剂作为新型抗肿瘤药物的临床前研究4.1㊀强心苷类药物结构特征㊀强心苷类化合物包括强心甾和蟾蜍二烯内酯ꎬ是一类17位有内酯结构的甾体核结构ꎮ由于甾核骨架和17位内酯结构上取代基以及空间立体结构具有多样性ꎬ强心苷类药物具有多种类型[46]ꎬ其中最广为人知的有地高辛ꎬ洋地黄毒苷ꎬG毒毛旋花苷ꎬ夹竹桃苷等ꎮ自从1785年SirWilliamWithering出版«关于毛地黄的记述»开始ꎬ临床医生就使用洋地黄制剂来治疗水肿㊁心律不齐和慢性心力衰竭ꎮ强心苷类药物ꎬ尤其是洋地黄现在仍广泛用于治疗充血性心力衰竭和心律失常的正性肌力药物[47]ꎮ目前人们普遍认为强心苷类药物介导的效应主要是由该类药物与Na+/K+-ATPase相互作用并抑制Na+/K+-ATPase活性产生的[48]ꎮ4.2㊀强心苷类药物的抗肿瘤作用㊀近些年有关强心苷类药物抗肿瘤作用的报道显著增加ꎬ除了对肿瘤细胞有效的抗增殖作用之外ꎬ令人感兴趣的是它们在对正常细胞和肿瘤细胞表现出不同的作用ꎮ对于正常细胞ꎬ强心苷类药物是没有活性的ꎬ甚至表现出促增殖作用ꎬ但却能选择性诱导肿瘤细胞凋亡[26]ꎮJiang等[49]发现强心苷蟾毒灵能通过抑制p38MAPK信号通路在非小细胞肺癌细胞中展示出抗增殖活性ꎮ原海葱苷A是另一种强心苷ꎬ已被证明可以抑制胶质母细胞瘤增殖和诱导其凋亡ꎬ同时提高小鼠的存活率[50]ꎮ强心苷还能通过不同机制对乳腺癌的生长具有抑制作用ꎬKometiani等[51]发现G毒毛旋花苷通过抑制Na+/K+-ATPase介导的表皮生长因子受体(Src/EGFR)和p42/44丝裂原活化蛋白激酶的激活ꎬ调节p21Cip介导的通路ꎬ导致雌激素受体阴性的人乳腺癌细胞系MDA-MB-435的细胞周期阻滞ꎬ抑制细胞生长ꎮ4.3㊀新型Na+/K+-ATPase抑制剂的研究进展㊀除了大量关于新的潜在抗肿瘤强心苷的分离和鉴定的科学文献外ꎬ在强心苷结构基础上ꎬ设计优化新的Na+/K+-ATPase抑制剂和配体作为潜在抗肿瘤药物的报道也显著增加ꎮ在分析了Na+/K+-ATPase的结合口袋和具代表性的强心苷药物的结构特点后ꎬ有文献确定了导致抗肿瘤活性的关键Na+/K+-ATPase抑制剂结构特征:需有10位的醛基(-COH)ꎻ14位的-羟基(氢键供体基团)ꎬ环C和环D的顺式构型ꎻ和位于17位的强心甾或蟾蜍二烯内酯基团ꎬ这些是Na+/K+-ATPase抑制剂对肿瘤生长具有高抑制作用所必需的[26ꎬ52]ꎮ如Lefranc等[53]发现UNBS1450(一种新型的强心苷类药物)能显著降低胶质瘤细胞内ATP浓度ꎬ扰乱肌动蛋白细胞骨架ꎬ导致胶质瘤细胞自噬死亡ꎮPBI-05204作为一种夹竹桃苷的结构改造物ꎬ在与吉西他滨联合治疗后ꎬ不仅降低了夹竹桃苷的细胞毒性作用ꎬ还提高了吉西他滨的抗肿瘤活性[54]ꎮ5㊀讨论与展望Na+/K+-ATPase作为一种遍布全身的重要酶类ꎬ当结构功能发生改变时ꎬ会引起肿瘤等疾病ꎮNa+/K+-ATPase最初被定义为细胞渗透压调节器ꎬ但越来越多的研究证明它还能参与细胞内各种信号传导途径并调节它们的功能ꎮ近些年来逐渐有报道将其作为治疗癌症的潜在药物靶点ꎮ尽管Na+/K+-ATPase的整体表达被认为是癌症复发潜在风险预测因子ꎬ但预测方式具体还是表现在不同亚基的表达水平ꎮ如高表达α亚基低表达β亚基被认为是肿瘤复发的高风险因素ꎬ低α表达水平高β表达水平的患者肿瘤复发风险低ꎮα亚基作为信号传导元件ꎬ能调控影响肿瘤细胞生存和生长多种通路ꎬ越来越受到人们的关注ꎮ但有关β亚基在肿瘤调控中发挥的作用的研究较少ꎬβ亚基在抑制肿瘤细胞黏附和肿瘤发展中的作用也尚未清楚ꎬ未来对β亚基与肿瘤的关系的研究可能会揭示其与不同肿瘤的相关性ꎬ进一步揭示Na+/K+-ATPase在肿瘤进展中发挥的整体作用ꎮ尽管作为天然存在的Na+/K+-ATPase的抑制剂ꎬ强心苷类药物已经被用于治疗心功能不全很长一段时间了ꎬ但是它们在肿瘤治疗中的作用也是不可忽视的ꎮ了解强心苷在癌症发展和生长过程中的作用可以帮助我们进一步了解如何治疗癌症ꎮ最新研究认为强心苷类药物通过改变细胞内外的离子浓度来抑制Na+/K+-ATPase的功能ꎬ也许只是其众多抑制肿瘤生长的机制之一ꎮ研究发现ꎬ强心苷可通过内源性和外源性途径以及自噬途径触发癌细胞凋亡ꎬ可作为另一种抗肿瘤机制ꎮ有关强心苷类药物的抗肿瘤活性机制还需进一步研究ꎮ迄今为止ꎬ关于使用强心苷作为抗癌药物的所有公开临床数据都限于实体瘤ꎮ这些临床研究大多样本量较小ꎬ并且没有随机对照ꎬ因此ꎬ数据需进一步证实ꎮ系统药理学的方法能在分子和细胞水平上更好地理解强心苷如何杀死肿瘤细胞ꎬ这可能有助于确定强心苷干预的主要靶点和信号通路ꎮ参考文献:[1]㊀LÓPEZ-MARQUÉSRLꎬPOULSENLRꎬBAILLYAꎬetal.StructureandmechanismofATP-dependentphospholipidtrans ̄porters[J].BiochimBiophysActaꎬ2015ꎬ1850(3):461-475. [2]CUIXYꎬXIEZJ.ProteinInteractionandNa/K-ATPase-MediatedSignalTransduction[J].Moleculesꎬ2017ꎬ22(6):990. [3]GIACOMELLOMꎬDEMARIOAꎬSCARLATTICꎬetal.PlasmamembranecalciumATPasesandrelateddisorders[J].IntJBiochemCellBiolꎬ2013ꎬ45(3):753-762.[4]PALMGRENMGꎬNISSENP.P-typeATPases[J].AnnuRevBiophysꎬ2011(40):243-266.[5]VEDOVATONꎬGADSBYDC.RouteꎬmechanismꎬandimplicationsofprotonimportduringNa+/K+exchangebyNativeNa+/K+-ATPasepumps[J].JGenPhysiolꎬ2014ꎬ143(4):449-464.[6]SRIKANTHANKꎬSHAPIROJIꎬSODHIK.TheRoleofNa/K-ATPaseSignalinginOxidativeStressRelatedtoObesityandCar ̄diovascularDisease[J].Moleculesꎬ2016ꎬ21(9):1172. [7]WANGXꎬLIUJꎬDRUMMONDCAꎬetal.Sodiumpotassiuma ̄denosinetriphosphatase(Na/K-ATPase)asatherapeutictargetforuremiccardiomyopathy[J].ExpertOpinTherTargetsꎬ2017ꎬ21(5):531-541.[8]ORLOVSNꎬLAJꎬSMOLYANINOVALVꎬetal.Na+ꎬK+-ATPaseasaTargetforTreatmentofTissueFibrosis[J].CurrMedChemꎬ2019ꎬ26(3):564-575.[9]BABULAPꎬMASARIKMꎬADAMVꎬetal.FromNa+/K+-ATPaseandcardiacglycosidestocytotoxicityandcancertreatment[J].AnticancerAgentsMedChemꎬ2013ꎬ13(7):1069-1087. [10]SONGYꎬLEESYꎬKIMSꎬetal.InhibitorsofNa+/K+ATPaseex ̄hibitantitumoreffectsonmulticellulartumorspheroidsofhepato ̄cellularcarcinoma[J].SciRepꎬ2020ꎬ10(1):5318.[11]JUNGJꎬRYUSꎬKIIAꎬetal.SomeBiologicalConsequencesoftheInhibitionofNaꎬK-ATPasebyTranslationallyControlledTumorProtein(TCTP)[J].IntJMolSciꎬ2018ꎬ19(6):1657. [12]CHAKKOURMꎬKREYDIYYEHS.FTY720PUpregulatestheNa+/K+ATPaseinHepG2CellsbyActivatingS1PR3andInducingPGE2Release[J].CellPhysiolBiochemꎬ2019ꎬ53(3):518-531.[13]BANERJEEMꎬCUIXꎬLIZꎬetal.Na/K-ATPaseY260Phospho ̄rylation-mediatedSrcRegulationinControlofAerobicGlycolysisandTumorGrowth[J].SciRepꎬ2018ꎬ8(1):12322.[14]MORTHJPꎬPEDERSENBPꎬTOUSTRUP-JENSENMSꎬetal.Crystalstructureofthesodium-potassiumpump[J].Natureꎬ2007ꎬ450(7172):1043-1049.[15]MORTHJPꎬPOULSENHꎬTOUSTRUP-JENSENMSꎬetal.ThestructureoftheNa+ꎬK+-ATPaseandmappingofisoformdiffer ̄encesanddisease-relatedmutations[J].PhilosTransRSocLondBBiolSciꎬ2009ꎬ364(1514):217-227.[16]KANaIRꎬOGAWAHꎬVILSENBꎬetal.CrystalstructureofaNa+-boundNa+ꎬK+-ATPaseprecedingtheE1Pstate[J].Natureꎬ2013ꎬ502(7470):201-206.[17]DURLACHERCTꎬCHOWKꎬCHENXWꎬetal.TargetingNa+/K+-translocatingadenosinetriphosphataseincancertreatment[J].ClinExpPharmacolPhysiolꎬ2015ꎬ42(5):427-443.[18]SHINODATꎬOGAWAHꎬCORNELIUSFꎬetal.Crystalstructureofthesodium-potassiumpumpat2.4Aresolution[J].Natureꎬ2009ꎬ459(7245):446-450.[19]KAPLANJH.BiochemistryofNaꎬK-ATPase[J].AnnuRevBio ̄chemꎬ2002(71):511-535.[20]JIMENEZTꎬMCDERMOTTJPꎬSÁNCHEZGꎬetal.NaꎬK-ATPasealpha4isoformisessentialforspermfertility[J].ProcNatlAcadSciUSAꎬ2011ꎬ108(2):644-649.[21]CHEUNGJYꎬZHANGXQꎬSONGJꎬetal.CoordiNatedregulationofcardiacNa+/Ca2+exchangerandNa+-K+-ATPasebyphospholemman(FXYD1)[J].AdvExpMedBiolꎬ2013(961):175-190.[22]GEERINGK.FunctionofFXYDproteinsꎬregulatorsofNaꎬK-AT ̄Pase[J].JBioenergBiomembrꎬ2005ꎬ37(6):387-392.[23]MARCUSEAꎬTOKHTAEVAEꎬJIMENEZJLꎬetal.Helicobacterpyloriinfectionimpairschaperone-assistedmaturationofNa-K-ATPaseingastricepithelium[J].AmJPhysiolGastrointestLiverPhysiolꎬ2020ꎬ318(5):G931-G945.[24]BARTLETTDEꎬMILLERRBꎬTHIESFELDTSꎬetal.TheRoleofNa/K-ATPaseSignalinginOxidativeStressRelatedtoAging:Im ̄plicationsinObesityandCardiovascularDisease[J].IntJMolSciꎬ2018ꎬ19(7):2139.[25]MAXWELLKDꎬCHUANGJꎬCHAUDHRYMꎬetal.ThepotentialroleofNa-K-ATPaseanditssignalinginthedevelopmentofane ̄miainchronickidneydisease[J].AmJPhysiolReNalPhysiolꎬ2021ꎬ320(2):F234-F242.[26]MIJATOVICTꎬINGRASSIALꎬFACCHINIVꎬetal.Na+/K+-AT ̄Pasealphasubunitsasnewtargetsinanticancertherapy[J].ExpertOpinTherTargetsꎬ2008ꎬ12(11):1403-1417.[27]GABLEMEꎬABDALLAHSLꎬNaJJARSMꎬetal.Digitalis-in ̄ducedcellsigNalingbythesodiumpump:ontherelationofSrctoNa+/K+-ATPase[J].BiochemBiophysResCommunꎬ2014ꎬ446(4):1151-1154.[28]MIJATOVICTꎬROLANDIꎬVANQUAQUEBEKEEꎬetal.Theal ̄pha1subunitofthesodiumpumpcouldrepresentanoveltargettocombatnon-smallcelllungcancers[J].JPatholꎬ2007ꎬ212(2):170-179.[29]SELIGSONDBꎬRAJASEKARANSAꎬYUHꎬetal.NaꎬK-adeno ̄sinetriphosphatasealpha1-subunitpredictssurvivalofreNalclearcellcarcinoma[J].JUrolꎬ2008ꎬ179(1):338-345.[30]LEFRANCFꎬMIJATOVICTꎬKONDOYꎬetal.Targetingthealpha1subunitofthesodiumpumptocombatglioblastomacells[J].Neurosurgeryꎬ2008ꎬ62(1):211-221.[31]MATHIEUVꎬPIRKERCꎬMARTINDELASSALLEEꎬetal.Thesodiumpumpalpha1sub-unit:adiseaseprogression-relatedtargetformetastaticmelanomatreatment[J].JCellMolMedꎬ2009ꎬ13(9b):3960-3972.[32]SAKAIHꎬSUZUKITꎬMAEDAMꎬetal.Up-regulationofNa+ꎬK+-ATPasealpha3-isoformanddown-regulationofthealpha1-iso ̄forminhumancolorectalcancer[J].FEBSLettꎬ2004ꎬ563(1/2/3):151-154.[33]LIZꎬZHANGZꎬXIEJXꎬetal.Na/K-ATPasemimeticpNaKtidepeptideinhibitsthegrowthofhumancancercells[J].JBiolChemꎬ2011ꎬ286(37):32394-32403.[34]ESPINEDACEꎬCHANGJHꎬTWISSJꎬetal.RepressionofNaꎬK-ATPasebeta1-subunitbythetranscriptionfactorsNailincarci ̄noma[J].MolBiolCellꎬ2004ꎬ15(3):1364-1373.[35]RAJASEKARANAKꎬRAJASEKARANSA.UseofNaꎬK-ATPaseA-andB-subunitsinbladdercancerdetectionanddrugscreening:EP20030746670[P].2005-09-14.[36]RAJASEKARANAKꎬRAJASEKARANSAꎬBANDERNHꎬetal.Diagnosisofclearcelltyperenalcarcinoma:WO1999009205[P].1999-02-25.[37]NITTAHꎬGROGANTMꎬMILLERP.Na+ꎬK+-ATPaseexpressionincervicaldysplasiaandcancer:US7851145[P/OL].2010-12-14].[38]LAMOUILLESꎬXUJꎬDERYNCKR.Molecularmechanismsofep ̄ithelial-mesenchymaltransition[J].NatRevMolCellBiolꎬ2014ꎬ15(3):178-196.[39]YEQꎬLAIFꎬBANERJEEMꎬetal.Expressionofmutantα1Na/K-ATPasedefectiveinconformationaltransitionattenuatesSrc-me ̄diatedsigNaltransduction[J].JBiolChemꎬ2013ꎬ288(8):5803-5814.[40]LIULꎬZHAOXꎬPIERRESVꎬetal.AssociationofPI3K-Aktsig ̄nalingpathwaywithdigitalis-inducedhypertrophyofcardiacmyo ̄cytes[J].AmJPhysiolCellPhysiolꎬ2007ꎬ293(5):C1489-C1497.[41]BARWESPꎬANILKUMARGꎬMOONSYꎬetal.NovelroleforNaꎬK-ATPaseinphosphatidylinositol3-kinasesignalingandsuppressionofcellmotility[J].MolBiolCellꎬ2005ꎬ16(3):1082-1094.[42]CHENYꎬCAITꎬWANGHꎬetal.Regulationofintracellularcho ̄lesteroldistributionbyNa/K-ATPase[J].JBiolChemꎬ2009ꎬ284(22):14881-14890.[43]CHENYꎬLIXꎬYEQꎬetal.Regulationofalpha1Na/K-ATPaseexpressionbycholesterol[J].JBiolChemꎬ2011ꎬ286(17):15517-15524.[44]SILVAEꎬSOARES-DA-SILVAP.NewinsightsintotheregulationofNa+ꎬK+-ATPasebyouabain[J].IntRevCellMolBiolꎬ2012(294):99-132.[45]CHENDꎬSONGMꎬMOHAMADOꎬetal.InhibitionofNa+/K+-ATPaseinduceshybridcelldeathandenhancedsensitivitytochemotherapyinhumanglioblastomacells[J].BMCCancerꎬ2014(14):716.[46]MIJATOVICTꎬVANQUAQUEBEKEEꎬDELESTBꎬetal.Cardio ̄tonicsteroidsontheroadtoanti-cancertherapy[J].BiochimBio ̄physActaꎬ2007ꎬ1776(1):32-57.[47]RAHIMTOOLASH.Digitalistherapyforpatientsinclinicalheartfailure[J].Circulationꎬ2004ꎬ109(24):2942-6.[48]GHEORGHIADEMꎬADAMSJRKFꎬCOLUCCIWS.Digoxininthemanagementofcardiovasculardisorders[J].Circulationꎬ2004ꎬ109(24):2959-2964.[49]JIANGYꎬZHANGYꎬLUANJꎬetal.Effectsofbufalinonthepro ̄liferationofhumanlungcancercellsanditsmolecularmechanismsofaction[J].Cytotechnologyꎬ2010ꎬ62(6):573-583.[50]WOLLEDꎬLEESJꎬLIZꎬetal.Inhibitionofepidermalgrowthfac ̄torsignalingbythecardiacglycosideouabaininmedulloblastoma[J].CancerMedꎬ2014ꎬ3(5):1146-1158.[51]KOMETIANIPꎬLIULꎬASKARIA.Digitalis-inducedsignalingbyNa+/K+-ATPaseinhumanbreastcancercells[J].MolPharmacolꎬ2005ꎬ67(3):929-936.[52]MIJATOVICTꎬDUFRASNEFꎬKISSR.Cardiotonicsteroids-me ̄diatedtargetingoftheNa+/K+-ATPasetocombatchemoresistantcancers[J].CurrMedChemꎬ2012ꎬ19(5):627-646.[53]LEFRANCFꎬKISSR.Thesodiumpumpalpha1subunitasapo ̄tentialtargettocombatapoptosis-resistantglioblastomas[J].Neo ̄plasiaꎬ2008ꎬ10(3):198-206.[54]PANYꎬRHEAPꎬTANLꎬetal.PBI-05204ꎬasupercriticalCO2extractofNeriumoleanderꎬinhibitsgrowthofhumanpancreaticcancerviatargetingthePI3K/mTORpathway[J].InvestNewDrugsꎬ2015ꎬ33(2):271-279.。
微量热法研究Na +,K +—ATPase酶促反应

3mmo ・ 。Mg 冲 溶 液 环 境 条 件 下 Na l L_ C1缓 , K AT 的 米 氏 常 数 K 值 和 最 大 反 应 速 率 P
L Mg 1的缓 冲溶 液配 制 ) ~ C 中获 得 . 酶 反 应 在 精 密恒 温 水 槽 中 进 行 , 反应 温度 严 格 控 制在 3 . ℃ ( 1 或 2 .  ̄ 表 2 .反 应进 行 到 7O 表 ) 50 C( )
仪器 厂 ) .
1 .2 实 验 方 法
应 的重 要研 究 手 段 .其 中 , 的微 量 热 法 研 究 具 有 酶
很 大 的发 展 前 景 .而 运 用 微 量 热 法 研 究 Na K , ATP 酶 促 反应 则 没 有相 关 报道 . 本 文 采 用 L 2 0 间 歇 式 微 量 热 系 统 对 KB 1 7 Na K ATP , 酶促 反应 进 行 了热 动 力 学 研 究 , 得
摘 要 :首 次 用 微 量 热 方 法 研 究 丁 N . A 。催 化 A a K TP TP水 解 的 酶 促 反 应 .在 3 O 1 l. 5K.p H一 7 4的 .
1 0 mmo ・I Tr — I 1 0 nno ・ 0 I i HC . 0 ll l L~ N C .1 s a I 0 mmo ・ - C , l L K I 3 mmo ・ _ l L Mg 2 冲 溶 液 环 境 下 . 对 Cl 缓 用
品( 纯度 >9 6 .其余 所 用 试 剂 均 为 国 产 分析 纯 试 9/ 9)
剂 .实验 用水 均 为 二次 蒸 馏水 . L 20 KB 1 7间歇 式 微 量热 系 统 , UV一6 1分 光光 10
钠钾-ATP酶的结构

细胞内
Na+,K+-ATP酶的作用原理
经过研究表明,Na+,K+-ATP酶的作用过程实际上是其两 种构象(E1和E2)的相互转变
E1构象
E2构象
Na+,K+-ATP酶的作用原理
E1和E2构象的相互转变 1、由于ATP末端的磷酸基水解,使E1构象磷酸化,磷酸化 的酶的能量较高,所以能够自动转变为低能量状态的E2构 象,同时由亲Na+的转变为亲K+的构象,向细胞外释放3 个Na+,结合2个K+。 2、磷酸化的酶在膜外的K+的作用下,可以去磷酸化,携带2 个K+,由E2转变为E1构象,将K+释放到细胞内。
Na+,K+-ATP酶中的三个Na+结合位点
为什么是Na+亲和性的而不是K+亲和性的?
Na+,K+-ATP酶中的三个Na+结合位点
位点Ⅰ和Ⅱ之间的距离是 3.2-3.6Å(1Å=0.1nm), Na+离子半径=0.95Å K+ 离子半径=1.33Å 两个结合位点之间的距离 能够容下2个Na+,但是对 于2个K+来说就比较拥挤 了。
Na+,K+-ATP酶中的三个Na+结合位点
第二步:位点Ⅱ继续保持未定型状态,位点Ⅲ结合后天冬 氨酸804和808的羧基能协助第2个Na+的结合
Na+,K+-ATP酶中的三个Na+结合位点
• M6螺旋旋转后到达一个稳定的状态; • 第二个Na+与M6侧链的天冬氨酸804和808的羧基结合; • Na+结合到位点Ⅰ会将M4E末端细胞质上的丙氨酸323带 到位点Ⅰ和Ⅱ的Na+协调的位置,有助于位点Ⅱ形成。
全能抗体!膜蛋白内参抗体-钠钾ATP酶

全能抗体!膜蛋白内参抗体-钠钾ATP酶免疫印迹是确定样品(如组织匀浆,提取物)中特定蛋白质水平的常用方法。
内参抗体是指示在各个孔中的样品具有相等载量的重要参照。
内参抗体同样还可以指示免疫印迹过程中转膜的效率。
作为广大科研工作者接触最多的实验类型,WB,大家都知道全细胞裂解液,核蛋白,线粒体等等样品应该用什么做内参。
但是说到膜蛋白,似乎很多人都表示不清楚~
膜蛋白应该用什么做内参?
钠钾ATP酶(Sodium Potassium ATPase),钠钾泵(sodium potassium pump)又称钠泵或钠钾ATP酶,它会使细胞外的Na+浓度高于细胞内,当Na+顺着浓度差进入细胞时,会经由本体蛋白质的运载体将不易通过细胞膜的物质以共同运输的方式带入细胞。
此蛋白广泛存在于各类细胞的细胞膜上,被广泛用作为膜蛋白的内参。
目前市面上能提供的钠钾ATP酶抗体有国产分装或原产的,国产分装的钠钾ATP酶抗体在质量稳定性上有不足,并且经过分装以后,其效价也有损失。
而原产于国内实验室的钠钾ATP酶抗体有些具有较好的检测活性,在批次之间的稳定性上较难控制,而国内仅有的少量原产抗体也是多克隆抗体。
至于原装进口供应钠钾ATP酶抗体的进口品牌并不多,仅Abcam、Sigma等等几个品牌能够提供钠钾ATP酶抗体,但是其在性价比上远远不够。
与Abcam一样,Abbkine的钠钾ATP酶抗体的免疫原是钠钾ATP酶蛋白S16位点周围的多肽段免疫而来,经过不断筛选和优化,最终获得此成品,适用于大多数哺乳动物的钠钾ATP酶蛋白。
其价格低廉,其质量也经受过市场检验。
该抗体可以用于WB、IHC、IF、Elisa。
钠钾ATP酶的生物学功能与调节

钠钾ATP酶的生物学功能与调节钠钾ATP酶(Na+/K+-ATPase)是所有哺乳动物体内都存在的一种重要膜蛋白质,在其调节下运输的离子包括钠、钾、贝类阳离子和负离子,这种酶的生物学功能和调节功不可忽视。
本文将探讨该酶的功能和调节。
一、酶的功能钠钾ATP酶是一种消耗ATP的离子泵,用于维持细胞内和细胞外的离子浓度差异。
这种差异对于细胞生长、代谢、传递信号以及神经细胞、心肌细胞的正常功能等至关重要。
钠钾ATP酶由两种亚单位组成,α和β。
α亚单位为具有催化活性作用的蛋白质,是跨越细胞膜的导体。
β亚单位则参与调节酶的活性。
在细胞膜上,该酶的α亚单位存在于细胞的外层,β亚单位则位于细胞内的一端。
在酶的催化下,钠离子从细胞内向细胞外被转运,而钾离子则被转运到细胞内。
这种转运是为了维持正常的细胞内外钠离子和钾离子的浓度差异。
这种浓度差异对于神经细胞和心肌细胞的表现极为重要。
例如,当细胞的钠离子浓度高于正常时,人体的神经细胞和心肌细胞将被高度兴奋,这会导致人体出现抽搐和心律失常等症状。
二、调节酶的功能如前所述,钠钾ATP酶的β亚单位参与调节酶的活性。
这种调节包括上调或下调酶的活性。
1.下调酶的活性下行调节是酶被磷酸化所致。
β亚单位被ATP激酶磷酸化后,细胞的α亚单位结构发生了变化,这就导致了酶的活性下降。
这种下调作用被认为是神经系统抑制细胞兴奋性的机制。
2.上调酶的活性在一些情况下,钠钾ATP酶的活性可以被上调。
这种上调作用是通过β亚单位的解离效应所实现。
β亚单位与α亚单位结合,从而可以增加酶的活性。
这种上调作用被认为对于神经系统兴奋性的刺激是必要的控制机制。
三、控制酶活性的因素很多因素可以影响钠钾ATP酶的活性。
这些因素包括:1. 温度:该酶在一定的温度下具有最佳活性。
当温度过低或过高时,该酶的活性会受到影响。
2. pH值:环境的pH值对酶的活性有直接影响。
当pH值过高或过低时,该酶的活性会受到影响。
3. 离子浓度:离子的浓度对酶的活性也有影响。
【国家自然科学基金】_钠钾atp酶_基金支持热词逐年推荐_【万方软件创新助手】_20140730
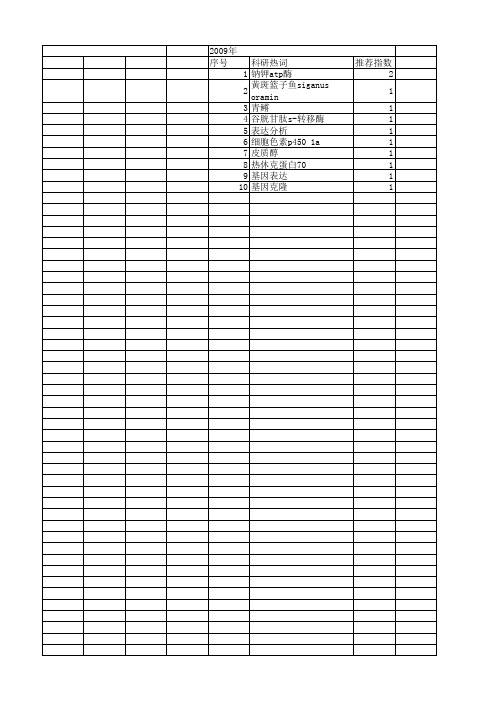
推荐指数 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
推荐指数 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2014年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
科研热词 麝香酮 铅 钠钾atp酶 钙离子 苯并[α ]芘 艾片 联合染毒 细胞膜电位 水迷宫 对接 哇巴因 分子动力学模拟 p区 mdck-mdr1 mdck ca^2+ atp酶 asp369
科研热词 钠钾atp酶 薯蓣皂苷元 缺氧再复氧 细胞周期 心肌细胞 心肌保护 rna干扰 hepg2细胞
推荐指数 1 1 1 1 1 1 1 1
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
科研热词 钠钾atp酶 哇巴因 雌激素受体 钠钾交换atp酶 脐静脉 细胞衰老 细胞膜 增殖 基因表达 凋亡 内皮细胞 乳腺癌细胞 rna,信使 mcf-7 jurkat细胞 ici182
推荐指数 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 780 1
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
科研热词 钠钾交换atp酶 钠钾atp酶 钙atp酶 蛋白免疫印迹法 背根神经节 细胞生长 盐度 病理学 生物蓄积量 环维黄杨星d 海水青鳉 强心甾类固醇 孵化率 基因表达 全氟辛烷磺酸(pfos) 信号转导 丙烯酰胺 na+-k+-atp酶
2009年 序号 1 2 3 4 5 6 7 8 9 10
科研热词 推荐指数 钠钾atp酶 2 黄斑篮子鱼siganus oramin 1 青鳉 1 谷胱甘肽s-转移酶 1 表达分析 1 细胞色素p450 1a 1 皮质醇 1 热休克蛋白70 1 基因表达 1 基因克隆 1
Na+-K+-ATP酶活性与阳虚证的内在联系探讨

不足而造成的脏腑功能 衰退 、 机体抵抗力 和应 变力下降 的病 证。从 内经《 素问 ・ 调经论》 中有 日: “ 阳虚则外寒 , 阴虚则 内 热, 阳盛则外热 , 阴盛则 内寒。 ” 而明 ・ 张介宾 《 景岳全书 ・ 杂 证谟 ・ 寒 热》 中对 阳虚体质 所表 现 的各种 寒象进 行 了概述 :
【 关键词 】 阳虚 ; N a 一 K 一 A T P 酶 ; 细胞 膜 ; 自由基 ; 能量代谢 【 中图分类号 】 R 2 — 0 3 【 文献标识码 】 A d o i : 1 0 . 3 9 6 9 / j . i s s n . 1 6 7 4 — 1 7 4 9 . 2 0 1 3 . 1 1 . 0 1 5
畏寒肢冷是机体寒热感觉最直观的表现 , 同样也是阳虚证
的主证之一。近年来有研究并探讨 阳虚证的实质可能是疾病造
作 者单位 : 6 5 0 0 2 1 云南 中医学院临床医学 院[潘 承政 (硕士研 究生 )] ; 云南省 中医医院呼吸科( 韦衮 政 ) 作者简介 : 潘承政( 1 9 8 4 一) , 2 0 1 1 级在读硕 士研究生 。研究 方
温煦功能的减退为主要表现, 五脏皆可有阳虚证 , 而 目前报道 的阳虚证研究多分单一脏腑 , 不同脏腑的阳
虚证之间其相关检测指标也不 同, 因此寻找一个五脏 阳虚证所共有的检测指标对 于探究中医阳虚证的本 质是十分有意义的。本文回顾分析 了近十几年来 国内 N a + _ K+ _ A T P酶活性与中医阳虚证相关的临床和 实验研究 , 力图从研究结果中探究两者之间是否有着某种内在的关联 l 生, 并对进一步的研究进行展望。
冲动 传导方面起着重要作用 。红 细胞产 能的 4 0 % 以上用
一种新型的钠钾ATP酶的检测方法[发明专利]
![一种新型的钠钾ATP酶的检测方法[发明专利]](https://img.taocdn.com/s3/m/2c865a6902d276a201292e98.png)
专利名称:一种新型的钠钾ATP酶的检测方法专利类型:发明专利
发明人:殷放宙,殷武,戴辉,李伟东,李林
申请号:CN202010570179.X
申请日:20200621
公开号:CN111678971A
公开日:
20200918
专利内容由知识产权出版社提供
摘要:目前用于评估钠钾ATP酶活性较为常用的方法为放射性示踪法或比色法。
但这两种方法均存在缺陷,前者需要使用放射性同位素,对实验环境要求高;后者则在检测准确度、灵敏度与重复性上相对较弱。
本发明引入一种新方法进行细胞钠钾ATP酶活性的检测,通过电感耦合等离子体质谱法(ICP‑MS)精确定量转运进细胞的铷离子,由此测得细胞内铷离子的转运率,进而评估钠钾ATP酶的活性。
此方法具有无放射性、可靠、准确等优点。
申请人:南京中医药大学
地址:210023 江苏省南京市仙林大道138号
国籍:CN
代理机构:江苏法德东恒律师事务所
代理人:胡玲
更多信息请下载全文后查看。
提取钠钾atp酶-概述说明以及解释

提取钠钾atp酶-概述说明以及解释1.引言1.1 概述概述钠钾ATP酶是一种重要的酶,它在细胞内扮演着至关重要的角色。
这种酶负责维持细胞内的钠和钾离子平衡,以及细胞膜的稳定性。
钠钾ATP 酶能够将细胞外的三个钠离子和两个钾离子转运到细胞内,同时通过水解ATP(三磷酸腺苷)来提供能量。
这个过程被称为钠钾泵。
钠钾ATP酶由多个亚基组成,包括α亚单位、β亚单位和γ亚单位等。
这些亚基之间相互作用形成复杂的结构,从而使酶具有高效率和高特异性。
钠钾ATP酶的结构和机制已经被广泛研究,并有助于我们更好地理解和探索细胞的运作机制。
钠钾ATP酶的重要性不仅体现在细胞内,而且对整个生物体的正常功能也至关重要。
在人体中,钠钾ATP酶主要分布在神经系统、心肌、肾脏和肌肉等组织中。
它通过维持细胞内外的离子浓度差,并参与神经传导、心肌收缩和肌肉运动等生理过程。
因此,钠钾ATP酶的功能紊乱或缺乏可能导致一系列疾病,包括神经系统疾病、心脏病和肌肉病等。
钠钾ATP酶的重要性和研究前景使得科学家们对其进行了广泛的研究。
近年来,研究人员通过结构生物学、生化学和遗传学等多种方法,揭示了钠钾ATP酶的结构和机制的许多细节。
这些研究为钠钾ATP酶的调控机制、药物研发和治疗疾病的指导奠定了基础。
综上所述,钠钾ATP酶作为一种重要的酶,在细胞内起着至关重要的作用。
它的结构和机制的研究不仅有助于我们更好地理解细胞的运作机制,还有望为疾病的治疗和药物研发提供新的思路和途径。
1.2文章结构文章结构部分的内容应包括对整篇文章的结构进行概述和分析,以帮助读者快速了解文章的组织和主要内容。
可以从以下方面展开描述:文章结构的概述:在这一部分,可以简要介绍文章的整体结构和分章节安排,以及每个章节的内容涵盖范围。
每个章节的内容描述:对于第一章节的“引言”,可以简单概述引言的作用和目的,引导读者进入文章的主题,并帮助读者理解文章的背景和重要性。
对于第二章节的“正文”,可以介绍正文部分的内容包括对钠钾ATP酶的定义和功能的详细解释,以及对其结构和机制的深入探讨。
钠钾ATP酶α1亚单位在肝癌细胞生长调节中的作用的开题报告

钠钾ATP酶α1亚单位在肝癌细胞生长调节中的作用的开题报告一、选题背景肝癌是世界范围内第五大癌症,且其发病率正在逐年上升。
目前,对于肝癌的治疗主要包括手术、化疗、放疗等方法,然而这些方法都存在着不少问题,比如创伤大、副作用明显、容易引起耐药性等。
因此,对于肝癌的研究还有很大的空间,特别是针对其发生机制的研究。
二、选题意义钠钾ATP酶α1亚单位是细胞膜上的一种酶,其功能包括调节细胞内外钠和钾的浓度等,它在肝癌的发生中扮演着重要的角色。
已有研究表明,是否能够控制钠钾ATP酶的活性,与肝癌的发生、发展密切相关。
因此,钠钾ATP酶α1亚单位在肝癌细胞生长调节中的研究具有重要的理论与实践意义。
三、研究目的本研究旨在通过体内和体外实验探讨钠钾ATP酶α1亚单位在肝癌细胞生长调节中的作用,以期深入了解其发生机制,为开发治疗肝癌的新方法提供实验依据。
四、研究内容与方法(1) 细胞培养。
选择肝癌细胞和正常细胞进行培养和初步筛选(2) RNAi基因沉默技术。
通过siRNA技术进行RNAi基因沉默(3) Western blot。
通过Western blot检测钠钾ATP酶α1亚单位的表达水平(4) CCK8细胞增殖试验。
通过CCK8试剂检测细胞增殖情况(5) 流式细胞术。
用荧光染料检测钠钾ATP酶α1亚单位表达的影响。
五、预期成果(1) 钠钾ATP酶α1亚单位在肝癌细胞生长中的作用经初步验证,可以更加深入地研究其发生机制。
(2) 如果钠钾ATP酶α1亚单位在肝癌细胞生长中扮演的角色得到证实,那么有望为肝癌治疗提供新的治疗思路。
(3) 其他一些可能的发现,将有助于深入了解钠钾ATP酶α1亚单位对肝癌发生的影响,有助于更好地防治肝癌等恶性疾病。
六、研究进展目前,本研究还停留在中期实验阶段,初步结果表明钠钾ATP酶α1亚单位在肝癌细胞生长中的作用得到了初步验证。
我们将进一步深入研究,力求为肝癌等恶性疾病的治疗贡献一份力量。
Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性影响因素的研究进展

Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性影响因素的研
究进展
李海英;赵娟;李海生
【期刊名称】《现代中西医结合杂志》
【年(卷),期】2008(017)009
【摘要】Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶是广泛分布在机体内的生物膜酶系统,它们对维持细胞的正常生理功能起着极其重要的作用。
Na+,K+-ATP酶是镶嵌在细胞质膜脂质双分子层中的一种蛋白质,具有载体和酶的活性,它们催化ATP水解供能,驱动Na+和K+于细胞膜两侧的对向运输,维持着细胞膜两侧的膜电位、调节细胞渗透压,为营养物质的吸收提供动力,并在神经和肌肉细胞的冲动传导等方面起着重要作用。
【总页数】2页(P1449-1450)
【作者】李海英;赵娟;李海生
【作者单位】天津武警医学院,天津300162;天津武警医学院,天津300162;天津武警医学院,天津300162
【正文语种】中文
【中图分类】R33
【相关文献】
1.久效磷对黄鳝过氧化氢酶和Na+, K+-ATP酶活性的影响 [J], 闫建国;汝少国;邴欣;王蔚
2.环孢素A预处理对离体大鼠心肌细胞凋亡及心脏乳酸脱氢酶和Na+,K+-ATP酶活性的影响 [J], 陈璐;赵鑫
3.盐度变化对多鳞四指马(鲅)幼鱼鳃丝Na+/K+-ATP酶及肝脏抗氧化酶活性的影响 [J], 张琴星;张涛;侯俊利;杨刚;杨阳;黄晓荣;刘鉴毅;章龙珍
4.镧对条纹锯(鮨)组织抗氧化酶及Na+/K+-ATP酶活性的影响 [J], 张清雯;陈超;陈建国;刘玲;赵亭亭;张庆文
5.盐度胁迫对红耳龟Na+/K+-ATP酶及消化酶活性的影响 [J], 张珂;洪美玲;史海涛;崔雪芹;江萌萌;林多丽
因版权原因,仅展示原文概要,查看原文内容请购买。
Na+、K+-ATP酶与晶状体

Na+、K+-ATP酶与晶状体
王睿;秦莉
【期刊名称】《眼科新进展》
【年(卷),期】2006(26)2
【摘要】Na+、K+-ATP酶是一种膜转运蛋白,对Na+、K+在细胞膜内外的分布
有重要作用.我们回顾了国内外相关文献,主要就Na+、K+-ATP酶在晶状体的分布、生理作用及其影响因素做一综述.
【总页数】3页(P150-152)
【作者】王睿;秦莉
【作者单位】710061,陕西省西安市,西安交通大学第一医院眼科;710061,陕西省西安市,西安交通大学第一医院眼科
【正文语种】中文
【中图分类】R776
【相关文献】
1.Na+,K+-ATP酶在晶状体内的表达、功能和调节 [J], 彭秀军
2.低盐胁迫对钝吻黄盖鲽幼鱼鳃Na+/K+-ATP酶、肝脏抗氧化酶和非特异免疫酶的影响 [J], 崔前进;陈冰;邱丽华;付旭;杨博学;韩雨哲;姜晨
3.低温胁迫对黄姑鱼(Nibea albiflora)抗氧化酶、Na+/-K+-ATP酶及Hsp70蛋白含量的影响 [J], 罗胜玉;徐冬冬;楼宝;陈睿毅;詹炜;毛国民
4.急性低盐度胁迫对可口革囊星虫存活、Na+/K+-ATP酶及磷酸酶活力的影响 [J], 游出超;董兰芳;曾梦清;蒋艳;许明珠;张琴
5.盐度胁迫对小黄鱼(Larimichthys polyactis)抗氧化酶、非特异性免疫酶和
Na+/K+-ATP酶活力的影响 [J], 王梦洁;储天琪;刘峰;詹炜;楼宝;徐万土
因版权原因,仅展示原文概要,查看原文内容请购买。
Na+,K+-ATP酶参与大鼠皮层神经元NMDA电流的调节

Na+,K+-ATP酶参与大鼠皮层神经元NMDA电流的调节刘倩;郭会彩;张丽男;王永利【期刊名称】《中国药理学通报》【年(卷),期】2011(27)1【摘要】目的观察Na+,K+-ATP酶是否参与神经元缺氧后兴奋性氨基酸电流的改变及其发生机制.方法利用全细胞脑片膜片钳技术,记录出生12~16 d的SD乳大鼠脑片皮层神经元在正常和缺氧时的NMDA电流,分别观察不同浓度的双氢哇巴因(dihydroouabain,DHO)对此电流的影响.结果无论在正常或缺氧条件下,不同浓度的DHO(10-11~10-3 mol·L-1)和矾酸钠(vanadate)均能浓度依赖性抑制皮层神经元的NMDA电流,然而,孵育不同浓度DHO后引起的NMDA电流密度在低氧时明显大于常氧时.结论提示神经元Na+,K+-ATP酶参与NMDA电流的调节,但低氧时主要由兴奋性氨基酸调节.%Aim To explore under normoxia and hypoxia conditions whether the Na+.K+-ATPase was involved in the change of the excitatory amino acid current in rat cortical neuron and its mechanism.Methods The whole-cell mode was used to examine NMDA current in rat brain slices by the patch clamp systems with infrared differential interference contrast ( IRDIC ) optics and to observe the effects of different concentrations of dihydroouabain ( DHO ) on NMDA current.Results Under either normoxia or hypoxia conditions.DHO and vanadate decreased the NMDA current in a concentration-dependent manner.However,NMDA current densities decreased by different concentrations of DHO were much larger under hypoxia than those undernormoxia.Conclusion The regulation of NMDA current of cortical neuron after hypoxia may depend mainly on the release of excitatory amino acid.not the function of the Na+ , K+ -ATPase.【总页数】5页(P117-121)【作者】刘倩;郭会彩;张丽男;王永利【作者单位】河北医科大学药理学教研室,河北,石家庄,050017;河北医科大学药理学教研室,河北,石家庄,050017;河北医科大学毒理学教研室,河北,石家庄,050017;河北医科大学药理学教研室,河北,石家庄,050017;河北医科大学药理学教研室,河北,石家庄,050017【正文语种】中文【中图分类】R-332;R322.81;R392.11;R345.6;R743.310.22;R845.22【相关文献】1.地高辛抑制豚鼠心室肌细胞Na+,K+-ATP酶和人胚肾上皮细胞系HERG钾通道电流 [J], 陈秋;韩圣娜;张雨;段彦彦;张莉蓉2.Na+,K+-ATP酶不参与慢性心衰豚鼠心肌细胞钙瞬变的减小 [J], 齐亚娟;白静;李吉和;李树民;郭会彩;刘雪莉;王永利3.Na+,K+-ATP酶在晶状体内的表达、功能和调节 [J], 彭秀军4.哇巴因特异性调节Na+/K+-ATP酶表达的实验研究 [J], 李庆安5.盐度对银鲳(Pampus argenteus)Na+/K+-ATP 酶活力及血清渗透压调节激素浓度的影响 [J], 张晨捷;彭士明;王建钢;施兆鸿因版权原因,仅展示原文概要,查看原文内容请购买。
心肌Na+,K+-ATP酶在抑郁症时的活性及mRNA表达

心肌Na+,K+-ATP酶在抑郁症时的活性及mRNA表达李素琴;孙东;马欣欣;李晓晶;卢振敏;师贵文;刘玉欣;董彬;刘杰;胡景荣【期刊名称】《河北医药》【年(卷),期】2009(31)12【摘要】目的探讨Na+,K+-ATP酶在抑郁症发病中的作用及其和单胺类神经递质之间的关系.方法对SD大鼠进行慢性随机刺激建立抑郁症模型,检测大鼠心肌Na+,K+-ATP酶的活性及mRNA表达,海马组织及血液中去甲肾上腺素(NA)和5-羟色胺代谢物5-羟吲哚乙酸(5-HIAA)水平.结果抑郁症大鼠心肌Na+,K+-ATP酶的转录水平下调(P<0.01);酶的活性明显降低(P<0.01);海马及血浆中的NA及5-HIAA水平显著下降(P<0.01).结论推测抑郁症时神经体液因素的变化可能是引起心肌细胞Na+,K+-ATP酶分子变化的原因之一,该酶在抑郁症的发病机制中有一定的生理和病理意义.【总页数】3页(P1422-1424)【作者】李素琴;孙东;马欣欣;李晓晶;卢振敏;师贵文;刘玉欣;董彬;刘杰;胡景荣【作者单位】050021,石家庄市,河北省疾病预防控制中心;河北省精神卫生中心;050021,石家庄市,河北省疾病预防控制中心;050021,石家庄市,河北省疾病预防控制中心;050021,石家庄市,河北省疾病预防控制中心;050021,石家庄市,河北省疾病预防控制中心;050021,石家庄市,河北省疾病预防控制中心;050021,石家庄市,河北省疾病预防控制中心;河北省精神卫生中心;河北省精神卫生中心【正文语种】中文【中图分类】R318;Q463【相关文献】1.地奥心血康对心肌缺血再灌犬心肌细胞膜Na+,K+-ATP酶活性与LPO含量影响[J], 刘睿智2.豚鼠内淋巴囊上皮细胞Na+,K+-ATP酶不同β亚基的mRNA表达 [J], 牟忠林;刘兆华;陈剑;万瑛;钟时勋3.Na+,K+-ATP酶不参与慢性心衰豚鼠心肌细胞钙瞬变的减小 [J], 齐亚娟;白静;李吉和;李树民;郭会彩;刘雪莉;王永利4.环孢素A预处理对离体大鼠心肌细胞凋亡及心脏乳酸脱氢酶和Na+,K+-ATP酶活性的影响 [J], 陈璐;赵鑫5.氯沙坦对原发性高血压大鼠早期肾脏皮质Na+,K+-ATP酶α1亚单位mRNA表达的影响 [J], 崔伟;范晓琴;黄炯媚;乔蕾;高原因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
体, 后来又发现了 γ 亚基的存在, 每个亚基具有多个亚 型并且各自发挥着不同的生理作用 。 α 亚基是催化酶 反应的亚基; β 亚基具有协助新合成的 α 亚基正确折 叠的功能, 从内质网转运到细胞质膜, 然后在细胞质膜 上稳定 α 亚基的蛋白构型以及调节 α 亚基的活性; γ 亚基也是调节亚基, 它与 β 亚基的作用不同, γ 亚基 不能单独作用于 α 亚基或者 β 亚基, 只能调节已结合 [2 ] 的 αβ 二聚体。 马立峰等 研究表明, 钠钾 ATP 酶不 但具有离子泵功能, 而且具有信号转导通路的作用, 进 而导致细胞的生长、 凋亡和相互融合。 钠钾 ATP 酶 α 亚基已经成为乳腺癌、 前列腺癌、 骨肉瘤等恶性肿瘤治 疗的新靶点。 1. 2 钠钾 ATP 酶的信号转导功能 钠钾 ATP 酶因在动物细胞的质膜上进行离子运
代
医
Modern Medical Journal
学 2016 , Jun; 44 ( 6 ) : 914 -917
1, 599 older people[ J] . Neurology, 2014 , 82 : 326 -331. [ 30] GIANNAKOPOULOS P, GOLD G, KOVARI E, et al. Assessing the cognitive impact of Alzheimer disease pathology and vascular burden in the aging brain: the Geneva experience [ J] . Acta Neuropathol, 2007 , 113 : 1 -12. [ 31] TOMLINSON B E, BLESSED G, ROTH M. Observations on the brains of non-demented old people[J] . Neurol, 1968 , 7: 331 -356. [ 32] BENNETT D A, SCHNEIDER J A, ARVANITAKIS Z, et al. Neuropathology of older persons without cognitive impairment from two community-based studies[ J] . Neurology, 2006 , 66 : 1837 -1844. [ 33] MATTSSON N, BLENNOW K, ZETTERBERG H. Inter-laboratory variation in cerebrospinal fluid biomarkers for Alzheimer's disease: united we stand, divided we fall[ J] . Clin Chem Lab Med, 2010 , 48 ( 5 ) : 603 -607. [ 34] GIACOBINI E, GOLD G. Alzheimer disease therapy-moving from amyloid-beta to tau[ J] . Nat Rev Neurol, 2013 , 9 ( 12 ) : 677 -686. [ 35] THOMPSON P W, YE L, MORGENSTERN J L, et al. Interaction of the amyloid imaging tracer FDDNP with hallmark Alzheimer's disease pathologies[J] . Neurochem, 2009 , 109 ( 2 ) : 623 -630.
刘晶, 等. 钠钾 ATP 酶的临床研究进展 酶释放的能量将 3 个钠离子泵出细胞外的同时将 2 个 钾离子泵入细胞内, 所以又称为钠泵或钠钾转运体。 钠钾 ATP 酶与钠离子、 钾离子结合, 通过改变本身构 象将物质运输过膜, 使细胞内保持较高浓度的钾离子, 细胞外保持较高浓度的钠离子, 维持正常情况下细胞 [1 ] 内外钠离子 1ʒ 10 及钾离子 30ʒ 1 的离子浓度梯度 。 用) ; ( 3 ) 胆固醇和鞘磷脂的抑制作用。
[7 ] 心剂类固醇 ) 。 Sanchez-Rodriguez 等 利用镧系元素 能量共振转移监测到外部有功能的钠钾 ATP 酶发生 [6 ]
输的功能而被人们所熟知。它将钠离子运输到细胞外 并将钾离子泵入细胞内, 从而保持电解质和体液平衡。 钠钾 ATP 酶除了基本的离子转运功能, 最近的研究表 明其额外的角色是信号转导和生物膜的结构 。 钠钾 ATP 酶亚基里半胱氨酸的谷胱甘肽化脂质体相位置的 出现是目前已知分子泵的结构。谷胱甘肽化依赖构象 的变化, 发生在钠钾 ATP 酶的催化循环中。 钠泵的循 环决定谷胱甘肽化, 半胱甘酸的谷胱甘肽化依赖于蛋 [3 ] 白质的构象状态 。 研究指出, 在生理条件下, 钠钾 ATP 酶的活动强烈依赖于周围的脂质环境, 因此特定的脂 Habeck 等 质可调节其活性, 它们之间的相互作用可能是环形的 , 取决于膜的物理性质或特定的跨膜域与相应的脂质之 间的相互结合。3 个影响钠钾 ATP 酶的特定脂质的相 互作用是可检测到的: ( 1 ) 钠钾 ATP 酶的热稳定性关 键取决于 18ʒ 0 /18 ʒ 1 磷脂酰丝氨酸 ( SOPS ) 和胆固醇 特异性的相互作用, 具有强烈的稳定放大作用 ( 即磷 脂酰丝氨酸 / 胆固醇的稳定作用) ; ( 2 ) 多于 60% 的不 饱和中性脂质能够刺激钠钾 ATP 酶, 脂质特异性表 18ʒ 0 /20ʒ 4 和 18ʒ 0 /22ʒ 6 磷脂酰乙醇胺 ( PE ) 是磷 明, 脂中效果最佳的( 即多不饱和磷脂酰乙醇胺的刺激作
现
· 914·
lary degeneration[ J] . Eur Neurosci, 2007 , 25 ( 1 ) : 59 -68. [ 23] PLANEL E, MIYASAKA T, LAUNEY T, et al. Alterations in glucose metabolism induce hypothermia leading to tau hyperphosphorylation through differential inhibition of kinase and phosphatase activities: implications for Alzheimer's disease [ J] . J Neurosci, 2004 , 24 ( 10 ) : 2401 -2411. [ 24] MACCIONI R B, CAMBIAZO V. Role of microtubule-associated proteins in the control of microtubule assembly [J] . Physiol Rev, 1995 , 75 : 835 -864. [ 25] PLOUFFE V, MOHAMED N V, RIVEST-McGRAW J, et al. Hyperphosphorylation and cleavage at D421 enhance tau secretion[ J] . PLoS One, 2012 , 7 ( 5 ) : e36873. [ 26] DICKSON D W, CRYSTAL H A, BEVONA C, et al. Correlations of synaptic and pathological markers with cognition of the elderly[ J] . Neurobiol Aging, 1995 , 16 : 285 -298. [ 27] ARRIAGADA P V, GROWDON J H, HEDLEY-WHYTE E T, et al. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease[J] . Neurology, 1992 , 42 : 631 -639. [ 28] HORVATH J, BURKHARD P R, HERRMANN F R, et al. Neuropathology of parkinsonism in patients with pure Alzheimer's disease[ J] . Alzheimer's Dis, 2014 , 39 : 115 -120. [ 29] KOVARI E, HERRMANN F R, BOURAS C, et al. Amyloid deposition is decreasing in aging brains: an autopsy study of
[收稿日期] 2016 -01 -13 [修回日期] 2016 -03 -26
节钠离子、 钾离子的跨膜转运, 在循环过程中水解 ATP
[作者简介] 刘晶( 1990), 在读硕士研究生。E-mail: 762655618@ qq. com 女, 河南驻马店人, [引文格式] 刘晶, J] . 现代医学, 2016 , 44 ( 6 ) : 914 -917. 陈复辉, 陈淑芳, 等. 钠钾 ATP 酶的临床研究进展[
· 综
· 述
钠钾 ATP 酶的临床研究进展
陈复辉, 陈淑芳, 刘沛 刘晶,
( 哈尔滨医科大学附属第二医院 呼吸科 , 黑龙江 哈尔滨 150086 )
[ 是存在于细胞膜上的一种膜蛋白, 具有调节细胞内外钠离子、 钾离子 摘要] 三磷酸腺苷酶即钠钾 ATP 酶, , , ATP 浓度梯度的作用 对人体的正常生理功能起着至关重要的作用 在本文中作者主要阐述钠钾 酶的结构、 功能, 并叙述钠钾 ATP 酶与全身各个脏器疾病的临床研究进展 , 为相关疾病的治疗提出新的思路。 [ 关键词] 钠钾 ATP 酶; 结构; 信号转导功能; 文献综述 [ 中图分类号] Q55 [ [ 文献标识码] A 文章编号]1671 -7562 ( 2016 ) 06 -0914 -04 doi: 10. 3969 / j. issn. 1671 -7562. 2016. 06. 040 钠钾 ATP 酶存在于真核细胞膜上, 主要功能为调
