17 药品群体不良反应事件报告表
药品不良反应事件报告表(附表1)
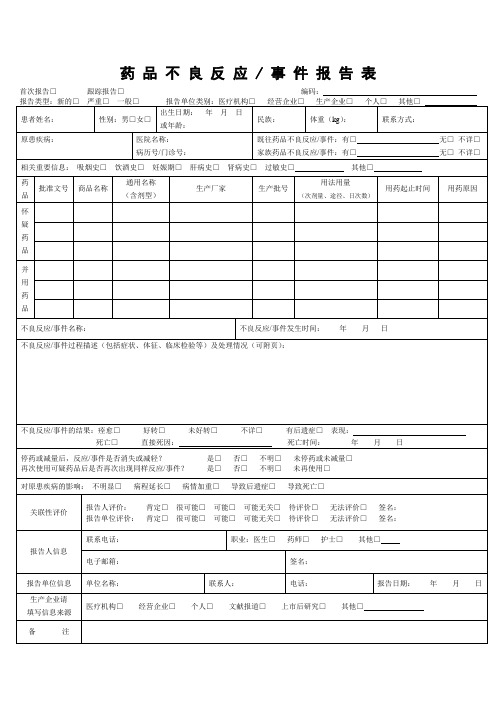
药品不良反应 / 事件报告表首次报告□跟踪报告□编码:
填写说明:
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品群体不良反应-事件报告表
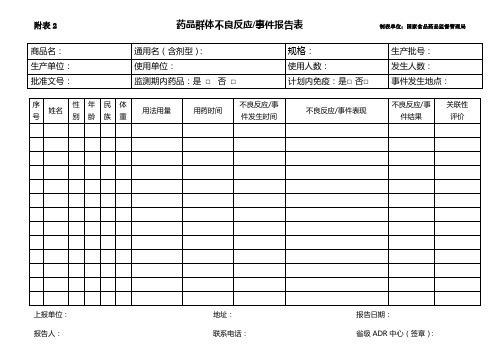
附表2药品群体不良反应/事件报告表制表单位:国家食品药品监督管理局
报告人:联系电话:省级ADR中心(签章):
附:1)其它相关资料请按附录C要求另附页报告;
2)典型病例请填写《药品不良反应/事件报告表》;
3)不良反应/事件结果指治愈、好转、有后遗症或死亡。
药品群体不良反应/事件报告要求
一、医疗卫生机构报告要求:
1.事件描述
①发生时间
②地点
③涉及药品名称
④药品不良反应/事件主要表现
⑤诊治过程
⑥转归情况
⑦在该地区是否为计划内免疫药品
2.典型病例详细填写《药品不良反应/事件报告表》
3.报告人及联系电话
二、药品生产企业报告要求:
1.事件发生、发展、处理等相关情况
2.药品说明书(进口药品须提供国外说明书)
3.质量检验报告
4.是否在监测期内(进口药是否为首次获准进口五年内)
5.注册、再注册时间
6.药品生产批件
7.执行标准
8.国内外药品安全性研究情况、国内外药品不良反应发生情况包括文献报道9.典型病例详细填写《药品不良反应/事件报告表》
10.报告人及联系电话
三、省、自治区、直辖市药品不良反应监测中心报告要求
1.组织填写《药品群体不良反应/事件报告表》
2.整理、分析收到材料
3.提出关联性评价意见
4.密切关注事件后续发展
5.事件过程详细调查报告(事件发生、发展、处理、结果等)。
药品不良反应事件报告表-制表单位国家食品药品监督管理局

附表 1 制表单位�国家食品药品监督管理局药品不良反应/ 事件报告表新的√□ 严重□一般□单位名称�医疗卫生机构□ 生产企业经营企业□ 个人□编码□□□□□□□□□□□□□□□□□□□部门�电话�报告日期2014联系方式年6 月10 日患者姓名:杨红性别�男□女√出生日期1968 年4 月18 日民族汉体重62(kg)家族药品不良反应/事件�有□无√□不详□既往药品不良反应/事件情况�有□ 无□√不详□不良反应/事件不良反应/事件发生时间�年病历号/门诊号�企业填写医院名称�名称�月日不良反应/事件过程描述�包括症状、体征、临床检验等�及处理情况�通用名称�含剂型�监商品名称* 生产厂家批号用法用量用药起止时间用药原因测期内品种用注明�怀疑药品并用药品不良反应/事件的结果�治愈□原患疾病�好转□有后遗症□ 表现�病情加重□死亡□ 直接死因�死亡时间�年月日对原患疾病的影响�不明显□病程延长□导致后遗症□表现�导致死亡□国内有无类似不良反应�包括文献报道��有□无□不详□国外有无类似不良反应�包括文献报道��有□ 无□ 不详□报告人�肯定□很可能□很可能□很可能□很可能□可能□可能无关□可能无关□可能无关□可能无关□待评价□待评价□待评价□待评价□无法评价□无法评价□无法评价□无法评价□签名�签名�报告单位�肯定□可能□关联性评价省级药品不良反应监测机构�国家药品不良反应监测中心�肯定□可能□签名�肯定□可能□签名�报告人职业�医疗机构��医生□药师□护士□其他□报告人职务职称�企业��报告人签名�◇不良反应/事件分析1. 用药与不良反应/事件的出现有无合理的时间关系�2. 反应是否符合该药已知的不良反应类型� 有□ 无□是□ 否□不明□3. 停药或减量后�反应/事件是否消失或减轻�4. 再次使用可疑药品后是否再次出现同样反应/事件�是□否□ 不明□ 未停药或未减量□ 是□ 否□ 不明□未再使用□5. 反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释�是□ 否□ 不明□◇严重药品不良反应/事件是指有下列情形之一者� ① 引起死亡□ □ □ □ □② 致畸、致癌或出生缺陷③ 对生命有危险并能够导致人体永久的或显著的伤残 ④ 对器官功能产生永久损伤 ⑤ 导致住院或住院时间延长◇编码规则�省(自治区、直辖市) 市�地区� 县�区� 单位 年代 流水号 □□□□□□□□□□□□□□□□□□□注�省�自治区、直辖市�、市�地区�、县�区�编码按中华人民共和国行政区划代码填写。
药品不良反应事件报告表

药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间: 年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
药品不良反应/事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
患者姓名:
性别:男□女□
出生日期:年 月 日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
既往药品不良反应/事件:有□无□不详□
家族药品不良反应/事件:有□无□不详□
关联性评价
报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息ቤተ መጻሕፍቲ ባይዱ
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
药品不良反应事件报告表

附表1
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应事件报告表

附表1
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应事件报告表及填写说明
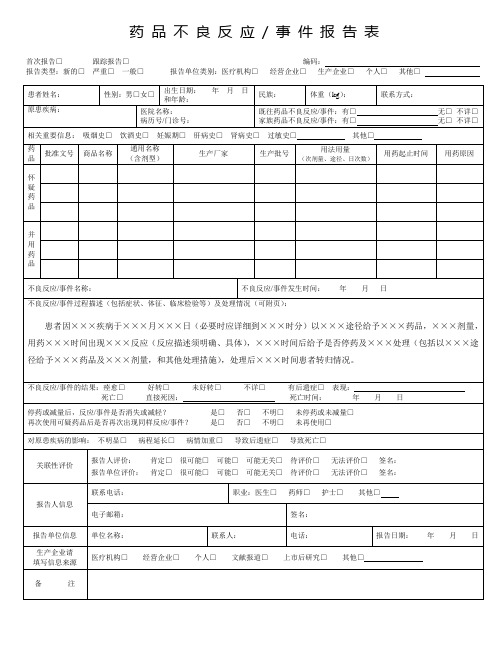
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□《药品不良反应/事件报告表》填写说明1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。
如果选择“有”,则在报告的空白处清晰叙述。
药品不良反应报告表

药品不良反应报告表目录1. 药品不良反应报告表简介1.1 药品不良反应报告表的背景1.2 药品不良反应报告表的重要性2. 药品不良反应报告表的填写要点2.1 填写表格的基本信息2.2 描述不良反应的具体情况2.3 包括患者信息和药品信息3. 填写药品不良反应报告表的流程3.1 如何收集信息3.2 如何准确记录不良反应3.3 如何提交报告4. 药品不良反应报告表的意义和作用4.1 保障患者安全4.2 提供数据支持医疗决策1. 药品不良反应报告表简介1.1 药品不良反应报告表的背景药品不良反应报告表是医疗机构和药企在接收到患者出现不良反应后,用来记录和汇总相关信息的重要工具。
1.2 药品不良反应报告表的重要性填写药品不良反应报告表能帮助医疗机构和药企及时掌握药品的安全性信息,保障患者的用药安全,同时为后续的医疗决策提供重要数据支持。
2. 药品不良反应报告表的填写要点2.1 填写表格的基本信息在填写药品不良反应报告表时,必须准确填写基本信息,包括患者的姓名、年龄,不良反应发生的时间和地点等。
2.2 描述不良反应的具体情况在报告表中要详细描述患者出现的不良反应症状,包括症状的严重程度、持续时间以及是否有其他可能导致该症状的因素。
2.3 包括患者信息和药品信息除了患者的个人信息外,还需记录患者的病史、用药史等相关信息,同时也要注明患者所使用的药品的具体信息,如药品名称、剂量等。
3. 填写药品不良反应报告表的流程3.1 如何收集信息在收集信息时,医务人员需要与患者或家属进行充分沟通,了解症状的具体表现以及用药情况等信息。
3.2 如何准确记录不良反应填写报告表时要准确、清晰地描述患者出现的不良反应症状,避免模糊不清或遗漏重要信息。
3.3 如何提交报告填写完药品不良反应报告表后,需要按照规定流程及时提交给相关部门,以便及时进行统计和分析。
4. 药品不良反应报告表的意义和作用4.1 保障患者安全通过及时报告药品不良反应,有助于医疗机构和药企及时发现并处理药品存在的安全风险,保护患者的用药安全。
药品不良反应事件报告表.doc

药品不良反应事件报告表药品不良反应/事件报告表患者姓名性别出生年月年龄民族体重原患疾病病历号/门诊号联系方式家族药品不良反应/事件不详无有既往药品不良反应/事件不详无有相关重要信息吸烟史饮酒史妊娠期肝病史肾病史过敏史其他怀疑用药序批准文号商品名称通用名称生产厂家生产批号用法用量用药起止时间用药原因备用量从剂型给药途径到用量从剂型给药途径到用量从剂型给药途径到并发用药序批准文号商品名称通用名称生产厂家生产批号用法用量用药起止时间用药原因备用量从剂型给药途径到用量从剂型给药途径到用量从剂型给药途径到不良反应/事件名称不良反应/事件发生时间不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)不良反应/事件的结果痊愈好转未好转不详有后遗症死亡停药或减量后反应/事件是否消失或减轻是否不明未停药或未减量再次使用可疑药品后是否再次出现同样反应/事件是否不明未再使用对原患疾病的影响不明显病程延长病情加重导致后遗症导致死亡关联性评价报告人肯定很可能可能可能无关待评价无法评价签名报告单位肯定很可能可能可能无关待评价无法评价签名报告人信息联系电话职业医生药师护士其他电子邮件签名备注报告单位信息单位名称联系人电话报告日期血常规检查平均红细胞容积MCV fl 尿素氮BUN mmol/L 血钠Na mmol/L 血红蛋白(Hbg)g/L 血小板计数109/L 尿酸UA umol/L 血氯化物Cl- mmol/L 红细胞(RBC)1012/L 血小板平均容积MPV fl 血脂分析酸碱度PH 白细胞(WBC)109/L 血小板分布宽度PDW 总胆固醇TCH mmol/L 氧分压PO2 mmHg 中性杆状核粒细胞肝功能高密度脂蛋白胆固醇mmol/L 二氧化碳分压mmHg 中性分叶核粒细胞直接胆红素测定umol/L 低密度脂蛋白胆固醇mmol/L 实际碳酸氢盐mmol/L 嗜酸性粒细胞间接胆红素测定umol/L 甘油三酯TG mmol/L 二氧化碳总量mmol/L 嗜碱性粒细胞谷丙转氨酶测定ALT U/L 生命体征全血剩余碱Beb mmol/L 淋巴细胞谷草转氨酶测定AST U/L 体温℃细胞外液剩余碱BEecf mmol/L 单核细胞总蛋白测定TP g/L 心率次标准碳酸氢根SBC mmol/L 网织红细胞百分数白蛋白测定(ALB)g/L 呼吸频率次阴离子间隙AG mmol/L 网织红细胞生成指数总胆红素测定umol/L 血压mmHg 氧饱和度SO2C 红细胞沉降率ESR mm/h 肾功能血气红细胞比容Hct L/L 肌酐Cr umol/L 血钾K mmol/L。
药物不良反应事件报告表

2.不良反应的具体表现:
3.不良反应的体征及相关检验结果:
4.处理:
5.不良反应治愈或好转的时间:
商品名称
生产厂家
批号
用法用量
用药起止时间
用药原因
怀
疑
药
品
并
用
药
品
不良反应/事件的结果:治愈□好转□有后遗症□表现: 死亡□直接死因:
其他□具体描述:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现: 导致死亡□
报告人签名:
药物不良反应/事件报告表
单位名称:部门:电话:报告日期: 年 月 日
患者姓名性别:男□女□来自年龄:民族体重
(kg)
联系方式
家族药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名 称:
不良反应/事件发生时间:
年 月日
病历号/门诊号
原患疾病:
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
2017药品不良反应报告样表

药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应表格

附表1
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应事件报告表

怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间: 年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
患者因患(原患疾病名称),于月日开始给予(药品通用名称),(给药途径),日次,一次(用法用量)。患者于月日点分(出现不良反应的时间)出现(不良反应的症状、体征),辅助检查结果:心率:次/分、血压:mmHg、呼吸:次/分、体温:℃(及其他相关检查结果如血常规、肝肾功能检查、心电图等)。月日点分,给予(出现不良反应后处置措施),患者于月日点分,不良反应症状(不良反应动态变化的症状、体征),患者于月日点分,不良反应症状(不良反应结果)。
不良反应/事件的结果:痊愈( )好转( )未好转( )不详( )有后遗症( )表现:
死亡( )直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是( )否( )不明( )未停药或未减量( )
再次使用可疑药品后是否再次出现同样反应/事件?是( )否( )不明( )未再使用( )
病的影响:不明显( )病程延长( )病情加重( )导致后遗症( )导致死亡( )
联系人:
电话:
报告日期:年 月 日
生产企业请
填写信息来源
医疗机构( )经营企业( )个人( )文献报道( )上市后研究( )其他( )
备注
1、请在所需项目的“( )”内插入“√”
2、不良反应事件名称:应填具体反应现象,例如:皮疹、胸闷
3、以上项目请务必填全
药品不良反应/事件报告表
首次报告( )跟踪报告( )报告科室:南区北区编码:
报告类型:新的( )严重( )一般( )报告单位类别:医疗机构( )经营企业( )生产企业( )个人( )其他( )
药品不良反应事件报告表模版

药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1、如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2、如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3、如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4、如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5、如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
大家应当按照规定时限完整的对药品不良反应进行上报。
附表药品不良反应 / 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□。
药品不良反应事件报告表
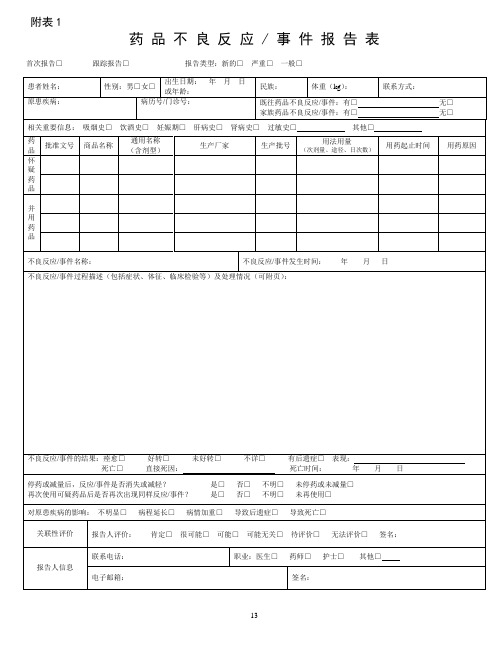
附表1
药品不良反应 / 事件报告表首次报告□跟踪报告□报告类型:新的□严重□一般□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应报告表填写范

报告类型:新的严重一般部门:电话:报告日期:年月日
患者姓名
性别:男女
年龄:
民族
联系方式:
体重(kg)
病历号
家族药品不良反应/事件:有无不详
既往药品不良反应/事件情况:有无不详
不良反应/事件名称:
不良反应/事件发生时间:月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
不良反应/事件的结果:治愈好转未好转不详有后遗症表现:
死亡直接死因:死亡时间:年 月 日
1.停药或减量后,反应/事件是否消失或减轻?是否不明未停药或未减量
2.再次使用可疑药品后是否再次出现同样反应/事件?是否不明未再使用
商品名称
通用名称(含剂型,监测期内品种用*注明)
生产厂家
批号
用法用量
用药起止时间
报告日期: 年 月 日
是否已报告给生产企业使用单位经营或进口单位
备注
若有疑问,请致电:临床药学63157964
用药原因
怀
疑
药
品
合并用药
关联性评价
报告人:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
姓名:
联系方式:
职业:医生药师护士其他
签名:
电子邮件:
如果不想您的个人信息共享给生产企业,请打√□
报告单位信息
单位名称:
联系人:
电话:
药品不良反应报告表

制表单位:国家食品药品监督管理局药品不良反应/ 事件报告表(医疗单位使用)
新的□严重□一般□编码:□□□□□□□□□□□□□□□□□□□
单位名称:科别:电话:报告日期:年月日
《药品不良反应报告表》填表说明
一、《药品不良反应报告表》是药品安全性监测工作的重要档案资料,需要
永久保存,务必要用钢笔填写。
填写的内容和字迹要清查、整洁;不用
不规范的符号、代号,不通用的缩写和草体签名。
二、编号一栏,由省、自治区、直辖市药品不良反应监测机构填写,按以下
排列方式:
省(自治区、医疗预防
直辖市)市(地区)县(区)保健机构年代流水号
□□□□□□□□□□□□□□□
注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和
国行政区划代码填写。
三、在表格相应的方框中,应填入√。
四、不良反应名称应填写不良反应中最主要的表现。
五、不良反应的表现,要求摘要描述,与可疑不良反应有关的临床检查结果
要尽可能明确填写。
六、如有两种怀疑引起不良反应的药品,可同时填上。
药品名称要填写完整,
不可用简称。
七、紧急情况,包括严重的,特别是致死的不良反应,应以最快通讯方式(包
括电话、传真、特快专递、E-mail等)将情况报告国家药品不良反应监
测中心。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品群体不良反应/事件报告表
上报单位:地址:报告日期:
报告人:联系电话:省级ADR中心(签章):附:1)其它相关资料请按附录C要求另附页报告;
2)典型病例请填写《药品不良反应/事件报告表》;
3)不良反应/事件结果指治愈、好转、有后遗症或死亡。
药品群体不良反应/事件报告要求
一、医疗卫生机构报告要求:
1.事件描述
①发生时间
②地点
③涉及药品名称
④药品不良反应/事件主要表现
⑤诊治过程
⑥转归情况
⑦在该地区是否为计划内免疫药品
2.典型病例详细填写《药品不良反应/事件报告表》
3.报告人及联系电话
二、药品生产企业报告要求:
1.事件发生、发展、处理等相关情况
2.药品说明书(进口药品须提供国外说明书)
3.质量检验报告
4.是否在监测期内(进口药是否为首次获准进口五年内)
5.注册、再注册时间
6.药品生产批件
7.执行标准
8.国内外药品安全性研究情况、国内外药品不良反应发生情况包括文献报道9.典型病例详细填写《药品不良反应/事件报告表》
10.报告人及联系电话
三、省、自治区、直辖市药品不良反应监测中心报告要求
1.组织填写《药品群体不良反应/事件报告表》
2.整理、分析收到材料
3.提出关联性评价意见
4.密切关注事件后续发展
5.事件过程详细调查报告(事件发生、发展、处理、结果等)。
