293t细胞转染效率不高的原因
293T细胞的培养[1]
![293T细胞的培养[1]](https://img.taocdn.com/s3/m/d6a8872378563c1ec5da50e2524de518964bd36d.png)
293T细胞的培养[1]293T细胞的培养293T细胞是由293细胞派生, 表达SV40大T抗原的人肾上皮细胞系, 被广泛应用于瞬时转染以过表达各种目标蛋白, 或是用以包装病毒。
293T为贴壁细胞, 这种细胞对培养基的营养成分要求并不高。
培养条件为: 完全培养基: 高糖DMEM, 10%胎牛血清; 冻存液: 胎牛血清或完全培养基, 10% DMSO。
传代方法为:1.吸掉293T细胞培养瓶内的培养液;2.吸取适量的无Ca 2+和Mg 2+的PBS, 轻轻把贴壁的细胞洗两遍;3.加少量的0.05%胰蛋白酶-EDTA (一般25 cm2的培养瓶加1 ml, 75 cm 2的培养瓶加2~3 ml), 放到培养箱温育20 s;4.细胞消化完毕, 加适量培养液终止消化, 并吹打细胞, 制成均匀的细胞悬液;5.加足量的培养液, 分装到新的培养瓶中。
值得注意的是, 293T细胞的贴壁性不强, 轻微的干扰就可能使它们脱落。
所以, 在更换新鲜培养液或者用PBS冲洗的时候应该小心地添加新的培液进去, 以液体不冲打到贴壁的细胞为好。
传代的时候, 只需要用0.05%胰蛋白酶-EDTA即可轻松把细胞消化下来, 不需要消化很长时间。
有些同学反映293T细胞容易结团不易被吹打开来。
如果遇到这样的情况可以在加了胰蛋白酶温育一段时间后即拿1 ml移液枪反复轻轻吹打, 直至肉眼看不到大的细胞块为止, 然后加适量的培养液混匀, 这时候在显微镜下观察, 可见大多数细胞都是单个的, 只有少量的2~3个细胞聚在一起。
一般293T细胞可以长在塑料的培养瓶底面上直到90%融合, 再以1∶4~1∶8的比率传代。
合适的传代周期为2~3天。
传代过程中,消化的时间越短越好, 显微镜下观察到80%细胞脱落即可加培养液中止。
完成传代后放入培养箱前,应该把培养瓶或培养皿沿X、Y轴方向水平移动几下, 防止细胞都聚在中间或者四周。
冷冻293T细胞的冻存液可以用95%小牛血清加5%二甲基亚砜, 复苏率很高。
细胞实验中常见问题

细胞实验中常见问题
一、细胞培养问题
1.1 细胞生长缓慢或停止生长:可能原因是营养物质不足、血清质量不佳、培养箱温度不稳定或CO2浓度不正确等。
1.2 细胞形态异常:可能是由于培养基问题、营养不足、感染或污染等原因。
1.3 细胞结块:可能是由于细胞密度过大或血清用量过多等原因。
二、细胞活性检测问题
2.1 实验结果不一致或不准确:可能是由于试剂问题、操作误差或实验条件不稳定等原因。
2.2 假阳性或假阴性结果:可能是由于抗体交叉反应、实验操作不当或细胞状态不佳等原因。
三、细胞转染问题
3.1 转染效率低:可能是由于转染方法不正确、转染试剂选择不当或细胞状态不佳等原因。
3.2 细胞毒性:可能是由于转染试剂用量过多或转染条件不适应等原因。
四、细胞计数与消化问题
4.1 细胞黏附性强,不易消化:可能是由于细胞类型或状态不适应于消化方法等原因
4.2 细胞碎片多,影响计数:可能是由于消化过度或消化不充分等原因。
五、细胞标记与染色问题
5.1 染色不均匀或不显色:可能是由于染色时间过短或过长、抗体浓度不当或细胞状态不佳等原因。
5.2 非特异性染色问题:可能是由于抗体交叉反应或抗体纯度不佳等原因。
六、细胞分型与鉴定问题
6.1 分型结果不准确:可能是由于抗体选择不当、操作误差或细胞状态不稳定等原因。
6.2 鉴别困难:可能是由于细胞分化程度高、抗原表达量低或鉴别方法不敏感等原因。
七、细胞感染与病毒问题
7.1 细菌污染:可能是由于培养基或细胞株本身带菌等原因。
7.2 支原体污染:可能是由于培养环境不洁净、操作过程中污染等原因。
1. 吉玛293T转染oligo效率评价步骤
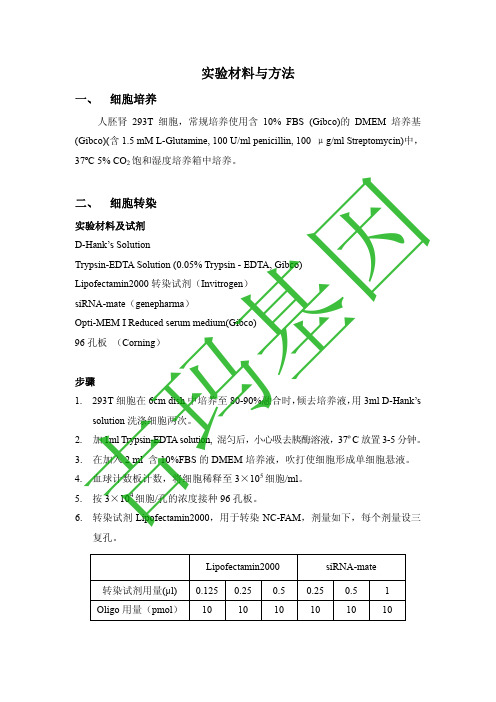
实验材料与方法一、 细胞培养人胚肾293T 细胞,常规培养使用含10% FBS (Gibco)的DMEM 培养基(Gibco)(含1.5 mM L-Glutamine, 100 U/ml penicillin, 100 μg/ml Streptomycin)中,37ºC 5% CO 2饱和湿度培养箱中培养。
二、 细胞转染实验材料及试剂D-Hank’s SolutionTrypsin-EDTA Solution (0.05% Trypsin - EDTA, Gibco)Lipofectamin2000转染试剂(Invitrogen )siRNA-mate (genepharma )Opti-MEM I Reduced serum medium(Gibco)96孔板 (Corning )步骤1. 293T 细胞在6cm dish 中培养至80-90%融合时,倾去培养液,用3ml D-Hank’s solution 洗涤细胞两次。
2. 加1ml Trypsin-EDTA solution, 混匀后,小心吸去胰酶溶液,37ºC 放置3-5分钟。
3. 在加入2 ml 含10%FBS 的DMEM 培养液,吹打使细胞形成单细胞悬液。
4. 血球计数板计数,将细胞稀释至3×105细胞/ml 。
5. 按3×104细胞/孔的浓度接种96孔板。
6. 转染试剂Lipofectamin2000,用于转染NC-FAM ,剂量如下,每个剂量设三复孔。
Lipofectamin2000 siRNA-mate 转染试剂用量(μl)0.1250.25 0.5 0.25 0.5 1 Oligo 用量(pmol )10 10 10 10 10 10 吉玛基因7. 每1 OD 260 oligo 用125 μl DEPC-H 2O 溶解,终浓度约为20 μM 。
8. 在1.5 ml EP 管中加入75 μl (25μl/well*3well )Opti-MEM I ,再加入根据上述表格算出的不同剂量的NC-FAM ,混匀;取另一1.5mlEP 管,加入75 μl (25μl/well*3well )Opti-MEM I ,加入根据上述表格算出的相应剂量的Lipofectamin2000或siRNA-mate ,混匀,室温放置5分钟后将两组管混合,室温放置20分钟。
293t细胞培养说明书

293T细胞培养说明书一、实验简介293T细胞是由肾脏细胞系统转染外源基因而产生的细胞系,具有较好的培养性和转染性。
因此,293T细胞常用于基因表达研究,尤其是蛋白表达和病毒载体的构建。
二、培养条件1. 培养基:293T细胞培养最常用的培养基是Dulbecco's Modified Eagle Medium (DMEM),其次是RPMI-1640培养基。
2. 氧气浓度:293T细胞培养一般需要一个较高的氧气浓度,如5%~10%。
3. 温度:293T细胞的培养温度一般为37℃。
4. 水分:293T细胞的培养液中的水分一般为95%~100%。
5. 添加物:293T细胞的培养液中通常会添加10%的牛血清,以促进细胞生长。
三、细胞培养步骤1. 将293T细胞从细胞库中取出,放入清洗后的培养皿中,以DMEM培养基浸泡;2. 将培养皿放入培养箱,调节温度为37℃,氧气浓度为5%~10%;3. 将添加10%牛血清放入培养液中,搅拌均匀;4. 用细胞活性检测试纸测定细胞活性;5. 根据细胞活性的变化情况,调整培养液中的水分,以维持细胞的生长;6. 将培养液更换,每1~2天更换一次;7. 定期观察细胞形态,记录细胞生长情况。
四、注意事项1. 在培养293T细胞时,需要注意细胞的温度、氧气浓度以及水分,以保证细胞的正常生长;2. 培养液的清洗和更换要及时,以保证细胞的正常生长;3. 在操作293T细胞时,一定要注意实验室的清洁卫生,以防止细胞的污染。
五、总结293T细胞培养是一种常用的培养方法,在培养293T细胞时,要注意培养液的温度、氧气浓度以及水分,并及时更换培养液,以保证细胞的正常生长。
在实验操作中,还要注意实验室的清洁卫生,以防止细胞的污染。
293、293T细胞培养及转染一点经验

qq :439572370HEK-293是用DMEM 培养基培养吗?
HEK-293细胞是我在锐赛生物实验室做项目时常培养的细胞,DMEM+10%血清+双抗+谷氨酰胺,这类的细胞贴壁性不是太强,所以不要消化过久,容易损伤细胞。
状态较好的293细胞
细胞生长较快,一般1:3~1:5传代,30%~50%融合度2-3
天即可长满。
细胞状态不好后会变瘦、产生大量黑点(细胞碎片)。
网友咨询:我们这里的293转染质粒效率一直不高,
各种方法均试过了,很少能达到50%,老板说他在
国外做293转染很容易达到80%以上。
我想问一下哪里有好的293细胞卖?非常感谢。
答:293系列的细胞都是非常好转染的:注意点:
1.转染前细胞的铺板密度、细胞状态
2.转染的时间
3.转染试剂与质粒的比值
干扰载体转染293T 细胞48h 的图片,供参考。
293T 细胞生长速度更快,形态较293A 细胞小,贴壁性比293
细胞弱很多,消化时间更要注意,没培养过的刚接手细胞要在注意留种的同时多试验消化几次,掌握经验值。
293
细胞常用于腺病毒包装、293T
细胞常用于慢病毒包装。
293t

293T细胞的培养关键词:293T细胞慢病毒包装培养 2011-10-28 18:14 来源:丁香园点击次数:5037包装细胞293T细胞的培养一、293T细胞的冻存1. 随着传代的次数增加,293T细胞会出现生长状态下降,出现突变等。
所以要在细胞购进时就进行大量冻存,以保证实验的稳定性和持续性。
2. 在细胞对数生长期进行冻存,增加细胞复苏成活率。
3. 倒去细胞上清液,加入D-Hank's液洗去残留的培养基。
4. 加入0.25%的胰酶,消化10-20s后倒去。
5. 镜下观察细胞变圆,细胞间间隙加大时,加入新鲜培养基吹打混匀。
6. 细胞计数。
7. 将细胞离心,1000rpm,2min。
8.根据计数结果加入细胞冻存液(70%完全培养基+ 20% FBS + 10% DMSO)重悬细胞,密度为3×106个/ml。
9. 分装进细胞冻存管,放入泡沫盒中,放入-80℃超低温冰箱。
10. 第二天将细胞放入液氮灌,并记录。
11. 复苏检测细胞存活率,细胞状态等,并记录。
二. 293T细胞的传代1. 当细胞生长至汇合率达到80~90%需要对细胞进行传代操作,以扩大细胞数量,维持细胞良好的生长状态。
2. 消化细胞,方法同上。
3. 细胞离心结束后,加入完全培养基重悬。
密度为3×105个/ml。
4. 分到10cm培养皿中,10ml/皿。
5. 放回37℃、3%CO和95%相对湿度的培养箱中培养。
2三. 293T细胞的复苏1. 当细胞传代次数过多(超过50代),细胞状态变差时或细胞出现污染事故时,需要丢弃并对开始冻存的细胞进行复苏。
2. 打开水浴锅,设置温度为40℃。
3. 查看细胞库记录,根据记录从液氮灌中取出冻存的细胞(需戴上棉手套,防止被冻伤),迅速丢入水浴锅中并快速晃动,在1~2 min内使细胞溶液完全溶解。
4. 将1ml细胞溶液加入9 ml完全培养基中并混匀后转入10cm培养皿。
和95%相对湿度的培养箱中培养。
细胞转染效率低的原因及解决方案

细胞转染效率低的原因及解决方案
细胞转染是细胞生物学和分子生物学的一种常用的技术手段。
而转染效率低下却是实验人员经常遇到的问题,尤其是原代细胞转染,转染难度更大。
现分享几个细胞转染实验常见的几个陷阱,望实验人员能够注意。
1.准备不足
做细胞转染的时候,在开展正式实验前要多做预试验,优化转染条件。
优化转染条件包括:转染试剂的用量、DNA密度、细胞密度、试剂和DNA混合孵育时间等等。
2.细胞污染
细胞污染也是造成细胞死亡,转染效率低下的一大原因。
首先,转染细胞用的质粒必须保证无菌。
而现在市场上的一般的质粒提取试剂盒都做不到绝对无菌。
分享一个小秘诀:将提完质粒后或者提的最后一步,用75%乙醇沉淀,这样就除菌了。
3.质粒质量问题
转染用的质粒首先要保证数量,一般为2μg以上。
质粒纯度不够或者含有细菌LPS或其他对细胞有毒害作用的物质,也会影响转染效率。
这个时候,就应该对质粒进行纯化和浓缩。
4.细胞状态不好
细胞状态不好,会导致转染效率低下。
一般进行转染的细胞应该处于对数生长期。
如果是贴壁细胞的话,贴壁率应该在70-80%;如果是悬浮细胞的话,应该是6×105个/孔(24孔板),一般是转染前一天换液,转染前用无血清培养基或PBS洗细胞一次。
5.转染试剂问题
脂质体试剂毒性较大,易造成细胞死亡和转染效率底下。
可选择非脂质体转染试剂,如Entranster试剂。
电转染实验效率低的原因有哪些?

电转染实验效率低的原因有哪些?
电转染实验效率低,可能是以下几点原因:
1. 不合适的电场强度
合适的电场强度对于电转染实验非常重要,电场强度不能过高,过高会增加细胞的死亡率;也不能过低,过低不能增加膜的通透性或在膜上形成小孔。
不同细胞系具有不同的最佳场强值,实验前应测定所转染细胞系的最佳电场强度。
2. 细胞选择错误
用于电转的细胞一般选取处于对数生长期的细胞(15代以内,传代后2d)。
因为处于对数生长期的细胞分裂旺盛,表面结构致密比稳定期的细胞差,电转后,细胞膜的恢复能力强,而且处于有丝分裂期的细胞更容易接受外源DNA.
3. 质粒质量不佳
应选择纯度高的质粒,首先DNA/RNA应该超纯(A260/A280>1.8),其次应不含内毒素,同时质粒应溶于双蒸水而不是TE 缓冲溶液。
另外,DNA浓度不宜过高。
4. 电转染试剂不合适
电击会对细胞造成一定程度的伤害,在转染试剂的选择上要注意,应选择具有细胞膜修复成分的电转染试剂,如Entranster-E,可将电击对细胞的损伤降到最低。
293细胞

293细胞比较容易转染,是一个很常用的表达研究外源基因的细胞株。
293细胞的一个衍生株:293T/17的转染效率更高,成为广大研究者研究基因功能的一个强大工具。
293细胞的缺陷是生长过程中贴壁强度比较小。
所以在实验过程中容易流失,从而影响实验结果。
如果一个实验室新得到的293细胞是邮寄得到的并且细胞在培养瓶中,就需要让细胞沉降几天时间,因为大量细胞会漂浮在培养液里。
293细胞系是原代人胚肾细胞转染5型腺病毒(Ad 5) DNA的永生化细胞,表达转染的腺病毒5的基因。
293细胞的缺陷是生长过程中贴壁强度比较小。
所以在实验过程中容易流失,从而影响实验结果。
如果一个实验室新得到的293细胞是邮寄得到的并且细胞在培养瓶中,就需要让细胞沉降几天时间,因为大量细胞会漂浮在培养液里。
来源:人体肾脏形态:上皮细胞生长特性:贴壁注释:该细胞含腺病毒5 DNA 。
培养液:MEM(含 2 mM L-谷氨酰胺和Earle's BSS,1.5 g/L NaHCO3, 0.1 mM 非必需氨基酸, 1.0 mM 丙酮酸钠),10% 马血清(热灭活)。
传代:吸去培养液。
用0.25% (w/) Trypsin- 0.53 mM EDTA洗一次,以去除血清(血清会抑制胰酶的活性)。
加2-3毫升Trypsin-EDTA,放在37℃培养箱内约5分钟,直到细胞全部脱落。
加6-8毫升培养液,用移液器把细胞吹散。
加适量的细胞到新的培养器皿中。
(以1:2到1:4为宜,传代期间培养液2-3天更换1次)冻存:95%培养液+5%DMSO冻存于液氮。
293A比较有意思了,是293中后来又建的细胞亚株,这个A是adhere的意思,就是说293倾向于形成单层细胞(monolayer),它比293好的地方是在做计算病毒数量的空斑试验(plaque assay)293A是均匀的一层,没有细胞重叠和细胞空隙(hole),就这个意思,这个A 所对的是293S(suspension).293T细胞表达E1A蛋白,S40大T抗原,含有S40复制起始点与启动子区的质粒可以复制。
293t细胞转染效率不高的原因

293t细胞转染效率不高的原因293T细胞作为常用的哺乳细胞转染系统,由于其易于扩增和高效的转染能力,广泛应用于病毒包装与表达、蛋白表达与纯化等实验中。
然而,有时候我们可能会发现293T细胞的转染效率不高,即使在优化实验条件下仍然无法达到较高的转染效果。
这可能与以下几个方面有关:1.细胞密度不适当:细胞密度过高或过低都会影响转染效率。
过高的细胞密度会导致细胞间相互竞争营养和空间,限制转染效率。
而过低的细胞密度则会导致细胞稀疏,降低获得稳定转染细胞株的可能性。
因此,在进行293T细胞转染时,应根据实验需要选择适当的细胞密度。
2.细胞状态与健康程度:细胞状态和健康程度是影响转染效率的重要因素。
293T细胞在连续传代过程中容易出现累积突变和异常,细胞健康状况下降,从而影响转染效率。
因此,及时检测细胞的健康状况,并选择健康的细胞进行转染是提高转染效率的关键。
3.质粒DNA质量:质粒DNA质量对转染效率有很大影响。
低质量的DNA容易被细胞酶降解,无法针对性地进入细胞核从而影响转染效果。
因此,在进行转染实验前,应使用纯化的高质量质粒DNA。
4.转染试剂的选择和质量:转染试剂的质量也是影响转染效率的重要因素。
不同的转染试剂具有不同的转染效率。
因此,在选择转染试剂时,应根据实验需求选择适当的试剂,并确保其质量良好。
5.转染条件的优化:除了细胞密度、质粒DNA质量和转染试剂等因素外,转染条件的优化也对转染效率至关重要。
包括质粒DNA浓度、转染试剂浓度、转染时间和转染温度等。
这些条件的不合理选择都可能对转染效率产生负面影响。
因此,在进行细胞转染实验时,应根据具体实验目的进行条件的优化。
6.筛选压力与条件:一些转染试剂可能对细胞有毒性,转染后会导致细胞死亡。
此时,可以考虑减少转染试剂的浓度或转染时间,减轻细胞的毒性压力。
此外,添加适当的筛选抗生素也有助于筛选转染细胞。
综上所述,影响293T细胞转染效率的因素较多,包括细胞密度、细胞健康状况、质粒DNA质量、转染试剂的选择和质量、转染条件的优化以及筛选压力与条件等。
进行转染实验时需要注意的因素

转染——让克隆的核酸进入真核细胞中,已经成为研究和控制真核细胞基因表达的重要手段。
比如表达纯化特定的蛋白;鉴定一个基因的生物学特性;突变分析;研究基因表达对细胞生长的影响,研究基因表达的调控机制等等,等等。
如今广义的转染不单包括了DNA、RNA,还有蛋白质等生物大分子。
很多因素会影响转染效率,细胞株本身啦,细胞培养环境啦,转染的DNA、RNA或者蛋白的质量和特性啦,转染方法啦,等等。
每个转染高手也必然有自己的独门心经,只可惜大家都为实验或者生活而疲于奔命,没有几个人愿意静下心情来仔细总结经验汇集成文字——那些曾经用无数失败的痛苦烦恼换回来的宝贵经验,那些曾经以为会永远铭刻于脑海的教训,随时间的流逝而终于渐渐褪色,到模糊。
即使偶尔有珠玉掩埋于浩瀚的口水中,也难以汇串成珠。
试剂盒的盛行,让实验更快,更简单,也更机械化,相信更多人更愿意先抓起Protocol 123地往下做,直到碰壁再苦思原因。
其实等碰得遍体鳞伤回头一看就会醒悟,很多坑,只要事前注意了就不会陷进去的。
DNA转染后,转入基因的表达可以在1-4天内检测到——仅有一部分转入细胞的DNA被转运到细胞核内进行转录并最终输出mRNA到细胞质进行蛋白合成。
几天内,大部分外源DNA 会被核酸酶降解或随细胞分裂而稀释;一周后就检测不到其存在了。
因此转染也可以分为瞬时转染和稳定转染。
瞬时转染(transient transfection)指的是转染的核酸不整合到染色体上,结果是短暂的高水平表达,可在24—96小时内检测表达效果,表达水平与位置无关,不会受到周围染色体元件的影响。
瞬时表达分析所需的人力和时间比稳定表达少,但因为DNA摄入效率和表达水平在不同实验中差异较大,不长久也不稳定。
超螺旋质粒转染更倾向于瞬时表达。
瞬时表达适合研究启动子等调控元件——不过,诱导型的启动子除外。
稳定转染,就是转染的质粒DNA整合到染色体上,或者相当于附加子(episome)可持续存在,使得转染的细胞可长期表达。
293t细胞表达蛋白条件

293t细胞表达蛋白条件293T细胞是一种常用于生物医学研究的细胞系,其特点是易于培养、转染效率高以及对多种病毒感染的敏感性。
因此,293T细胞被广泛用于表达外源蛋白和研究蛋白功能的实验中。
下面将介绍293T细胞表达蛋白的条件和相关注意事项。
一、细胞培养条件293T细胞的培养基选择常用的DMEM(Dulbecco's Modified Eagle Medium)培养基,其中添加10%胎牛血清(FBS)和1%青霉素/链霉素(Penicillin-Streptomycin)。
细胞应在37℃、5% CO2的恒温培养箱中培养。
二、转染条件293T细胞的转染效率高,常用的转染方法有磷酸钙共沉淀法、聚乙二醇共转染法和脂质体介导转染法等。
选择合适的转染方法需要根据实验目的和所需蛋白的性质来确定。
1. 磷酸钙共沉淀法:将目的蛋白的表达质粒与磷酸钙混合后加入293T细胞培养基中,经过一定时间的培养后,蛋白便可表达出来。
2. 聚乙二醇共转染法:将目的蛋白的表达质粒与聚乙二醇混合后加入293T细胞培养基中,经过一定时间的培养后,蛋白便可表达出来。
3. 脂质体介导转染法:将目的蛋白的表达质粒与脂质体混合后加入293T细胞培养基中,经过一定时间的培养后,蛋白便可表达出来。
三、表达蛋白的时间点和条件293T细胞表达外源蛋白的时间点和条件需要根据实验目的和所需蛋白的性质来确定。
一般情况下,培养细胞24-48小时后即可开始检测蛋白表达情况。
蛋白的表达水平可以通过Western blot、免疫荧光染色等方法进行检测。
四、相关注意事项1. 在进行293T细胞的培养和转染实验时,需采取无菌操作,以防止细菌和真菌的污染。
2. 在培养293T细胞时,应注意细胞的密度和培养时间。
细胞密度过高或培养时间过长会导致细胞凋亡或分化,影响蛋白的表达。
3. 选择合适的转染方法和转染试剂,以提高蛋白表达效率。
4. 在进行蛋白表达实验时,可以根据需要添加适当的药物,如蛋白酶抑制剂、翻译抑制剂等,以提高蛋白的稳定性和纯度。
293t细胞电转染条件

293t细胞电转染条件
293T 细胞电转染条件的成功率和效率往往受到多种因素的影响,包括转染试剂、细胞状态、电场强度、电脉冲时间、转染时间、转染浓度等等。
因此,不同的实验室可能会有不同的电转染条件,需要根据实际情况进行摸索和优化。
其中,细胞状态是影响电转染成功率的关键因素之一。
如果细胞状态不佳,例如饥饿、衰老或感染等情况,可能会影响转染效率和品质。
因此,在进行电转染之前,需要对细胞状态进行评估,并进行相应的处理,以提高转染成功率和效率。
此外,电场强度、电脉冲时间、转染时间等因素也会影响电转染的成功率和效率。
一般来说,较高的电场强度和较短的电脉冲时间可以提高转染效率,但过长的电脉冲时间可能会影响细胞状态和寿命。
同时,转染时间也需要根据具体的转染试剂和目标基因进行优化,以提高转染效率和品质。
总结起来,293T 细胞电转染条件需要进行充分的实验和摸索,
并结合具体情况进行优化和调整。
同时,需要注意保持实验的标准化和规范化,以确保实验结果的可靠性和可重复性。
293细胞

293细胞分为几种,文献上所提总是笼统的讲293细胞,可293有293A,还有293T,请问二者有什么区别,是否293A是用来包腺病毒的,293T是用来包慢病毒的,是否还有其他293细胞,比如293S293细胞比较容易转染,是一个很常用的表达研究外源基因的细胞株。
293细胞的一个衍生株:293T/17的转染效率更高,成为广大研究者研究基因功能的一个强大工具。
293细胞的缺陷是生长过程中贴壁强度比较小。
所以在实验过程中容易流失,从而影响实验结果。
如果一个实验室新得到的293细胞是邮寄得到的并且细胞在培养瓶中,就需要让细胞沉降几天时间,因为大量细胞会漂浮在培养液里。
293A比较有意思了,是293中后来又建的细胞亚株,这个A是adhere的意思,就是说293倾向于形成单层细胞(monolayer),它比293好的地方是在做计算病毒数量的空斑试验(plaqueassay)293A是均匀的一层,没有细胞重叠和细胞空隙(hole),就这个意思,这个A所对的是293S(suspension).293细胞系是原代人胚肾细胞转染5型腺病毒(Ad 5) DNA的永生化细胞,表达转染的腺病毒5的基因。
293T细胞表达E1A蛋白,S40大T抗原,含有S40复制起始点与启动子区的质粒可以复制。
293FT细胞能制造高滴度的慢病毒。
293A细胞来源于人肾纤维母细胞,组成性表达E1A 和E1B 蛋白。
293细胞分为几种,文献上所提总是笼统的讲293细胞,可293有293A,还有293T,请问二者有什么区别,是否293A是用来包腺病毒的,293T是用来包慢病毒的,是否还有其他293细胞,比如293S课题需要做腺病毒转染,看了initrogen的说明书上说用293A细胞。
在clontech的说明书上就是293细胞。
293细胞比较容易转染,是一个很常用的表达研究外源基因的细胞株。
293细胞的一个衍生株:293T/17的转染效率更高,成为广大研究者研究基因功能的一个强大工具。
293t细胞转染效率不高的原因

293t细胞转染效率不高的原因293T细胞是一种高度易转染的细胞系,常被广泛应用于基因工程和病毒产生等研究领域。
然而,存在的转染效率不高的原因有很多。
以下是一些可能的原因:1.细胞处于不适宜的生长状态:细胞的生长状态对转染效率有重要影响。
如细胞密度过高或过低,都可能导致转染效率下降。
因此,在进行细胞转染实验前,应首先进行适当的细胞培养和细胞数目的调整。
2.线粒体DNA的存在:293T细胞存在大量线粒体DNA,这可能会干扰转染过程中外源DNA的入胞。
线粒体DNA易聚集和形成不均一的DNA团,阻碍胞质内外DNA的传递。
因此,在进行转染前,应首先处理线粒体DNA,以提高转染效率。
3.DNA过多:过高的DNA浓度可能导致胞质内外DNA的堆积和聚集,阻碍DNA的入胞和表达。
较高的DNA浓度还可能导致细胞毒性和细胞死亡。
因此,在进行转染实验时,应注意控制适当的DNA浓度,以提高转染效率。
4.细胞的分裂状态:转染过程中,细胞分裂状态对转染效率有重要影响。
通常细胞在分裂期转染效率较高,而在静止期转染效率较低。
因此,在进行转染实验前,应选择适当的时间点,以提高细胞的分裂状态。
5.DNA结构和质量:DNA结构和质量对转染效率有影响。
大分子量的DNA可能较难进入细胞内,并且易形成复杂的DNA-蛋白质结构。
此外,存在的DNA损伤或降解也会降低转染效率。
因此,在进行转染实验前,应注意使用高质量的DNA,并确保其结构的完整性。
6.载体选择:载体的选择也可能影响转染效率。
一些载体在293T细胞中的转染效率较高,而其他载体则较低。
载体的选择应根据具体实验要求、细胞系的特点以及文献报道等因素进行考虑。
7.转染方法的选择:不同的转染方法对转染效率有重要影响。
经典的钙磷转染法可能存在对细胞毒性较高以及较低的转染效率等问题。
因此,可以尝试使用其他转染方法,如改进的磷脂体转染法、电穿孔法、聚合物介导的转染法等,以提高转染效率。
综上所述,293T细胞转染效率不高可能涉及细胞状态、DNA质量和结构、载体选择、转染方法等多个方面的原因。
293t细胞的生长特点

293t细胞的生长特点293T细胞是一种广泛应用于生命科学研究的细胞系,其生长特点具有以下几个方面:1. 快速增殖能力:293T细胞具有较高的增殖速度,通常在培养基中可以迅速扩增。
这是因为293T细胞具有较高的代谢活性和细胞分裂速度,能够快速进行DNA合成和细胞分裂,导致细胞数量快速增加。
2. 具有较强的黏附能力:293T细胞具有良好的附着性,可以牢固地附着在培养基或培养器皿表面。
这种黏附能力使得293T细胞在培养过程中不易脱落,有利于细胞的稳定生长。
3. 高度依赖血清因子:293T细胞对培养基中的血清因子依赖性较高。
血清中含有丰富的营养物质和生长因子,可以提供293T细胞所需的营养和生长信号,促进其快速增殖和生长。
因此,在培养293T细胞时,通常需要添加适量的胎牛血清或胎牛血清替代物。
4. 较低的密度限制:293T细胞具有较低的密度限制,可以在相对较高的细胞密度下进行培养。
这意味着在培养293T细胞时,可以将较多的细胞接种到培养器皿中,从而提高细胞的产量和培养效率。
5. 对培养条件的敏感性:293T细胞对培养条件的敏感性较高,包括培养基的组成、温度、CO2浓度等因素。
不同的培养条件可能对293T细胞的生长和功能产生影响,因此,在培养293T细胞时需要对培养条件进行优化和调整,以获得最佳的细胞生长和表达效果。
293T细胞具有快速增殖能力、黏附能力强、依赖血清因子、较低的密度限制以及对培养条件敏感等生长特点。
这些特点使得293T细胞成为广泛应用于生命科学研究中的重要细胞系,尤其在基因工程和蛋白质表达方面具有重要的应用价值。
通过深入了解293T细胞的生长特点,并合理优化培养条件,可以提高细胞的生长和表达效率,为相关研究工作的顺利进行提供有力支持。
293t细胞电转染条件(一)

293t细胞电转染条件(一)293T细胞电转染条件在分子生物学中,293T细胞是常用的细胞系之一,特别适用于表达外源蛋白质或进行蛋白质亚细胞定位研究。
电转染是293T细胞中常用的基因转染方法之一,下面列出了电转染293T细胞的条件。
1. 细胞培养•293T细胞应在37℃、5% CO2下培养•培养基建议使用高糖DMEM(Dulbecco’s modified eagle’s medium)或高糖MEM(Minimum essential medium)等,含10%胎牛血清(FBS)和1%万能抗生素•细胞密度建议在80%以上2. 电转染条件•500 µl DMEM培养基中添加10 µg DNA(含目的基因),同时加入125 µl电转染缓冲液(如polyethylenimine(PEI)缓冲液等)•在室温下孵育20-30分钟•向细胞中加入转染混合液,并轻轻摇晃培养皿,均匀涂抹转染混合液•培养24-72小时后,进行蛋白质表达或其他实验操作3. 注意事项•电转染前将细胞培养至80%以上,以确保细胞数量充足•电转染前,DNA和缓冲液需充分混合,在室温下孵育至少20分钟,使DNA与缓冲液充分结合•电转染前,转染混合液需要先在6孔板或12孔板中进行前行测定,以确定最佳转染量和细胞存活率以上是电转染293T细胞的条件,希望能为进行293T细胞研究的科研工作者提供帮助。
4. 电转染试剂选择电转染293T细胞需要使用特定的试剂,下面列出了一些常见的试剂以及注意事项:•Polyethylenimine(PEI): 可以快速高效地转染293T细胞,但需要注意浓度不要过高,否则会导致细胞死亡。
•Lipofectamine 2000: 能够高效转染293T细胞,同时对细胞毒性较小,但需要注意用量不要过高。
•Calcium phosphate(CaPO4):转染成功率较PEI和Lipofectamine 2000稍低,但毒性较小,适用于一些特殊的实验操作。
293t过表达蛋白

293t过表达蛋白293T细胞是一种常用的哺乳动物细胞系,广泛应用于生物学研究和生物技术领域。
它来源于人胚肾组织中的上皮细胞,并经过对T抗原的转染而得名。
293T细胞不仅具有良好的细胞生长特性,还能够高效地表达外源蛋白。
本文将重点介绍293T细胞过表达蛋白的原理、方法及应用。
一、293T细胞的特点293T细胞是一种非肿瘤性细胞系,具有良好的生长特性和较高的转染效率。
相比于其他细胞系,293T细胞的细胞密度可以达到较高水平,细胞生长周期较短,易于培养和扩增。
此外,293T细胞在转染外源DNA时表现出较高的转染效率,是进行蛋白过表达的理想细胞模型。
二、293T细胞过表达蛋白的原理293T细胞过表达蛋白的原理是通过转染外源DNA进入293T细胞,使其在细胞内产生目标蛋白的大量表达。
一般采用质粒转染的方法,将包含目标蛋白编码序列的质粒DNA导入到293T细胞中。
293T细胞具有较高的转染效率,可以较快地将目标蛋白表达到较高水平。
三、293T细胞过表达蛋白的方法1. 质粒转染法:将目标蛋白编码序列插入适当的质粒载体中,通过转染将质粒导入293T细胞中。
转染后,通过培养293T细胞,利用细胞内的转录和翻译系统,使目标蛋白得以表达。
2. 病毒载体转染法:将目标蛋白编码序列插入适当的病毒载体中,然后将病毒载体转染至293T细胞中。
病毒载体转染法可以提高目标蛋白的表达效率,并且可以选择适当的病毒载体来调控蛋白表达的时机和水平。
3. 电穿孔法:通过电脉冲的作用,使293T细胞膜发生临时的孔洞,使质粒DNA能够进入细胞内。
电穿孔法是一种高效的转染方法,适用于293T细胞的质粒转染。
四、293T细胞过表达蛋白的应用1. 功能研究:利用293T细胞过表达蛋白的方法,可以对目标蛋白的功能进行研究。
通过过表达目标蛋白,可以观察其对细胞生长、分化、凋亡等生物学过程的影响,揭示其相关的分子机制。
2. 药物筛选:利用293T细胞过表达蛋白的方法,可以对药物的靶点进行筛选和验证。
293t细胞细胞形态特点

293t细胞细胞形态特点
293T细胞细胞形态特点
293T细胞是一种哺乳动物细胞,具有良好的特性,可以用于转染和表达研究。
它具有较大的心脏形态,外观类似于小型椭圆形,具有中心凸起的表面,表面由许多小型淡斑组成,它们是细胞膜上的微小空间。
它的染色体被聚集在一起,形成一个分裂的褶皱状染色体。
293T细胞的细胞膜多层结构特征表明,它的粘附性强,形成强大的细胞墙结构,并具有较高的防御能力,可以阻止寄生虫、病毒和内部机制的潜在入侵。
此外,293T细胞具有良好的增殖能力,使其成为生物实验和技术研究的理想材料。
它以非常稳定的方式增殖,具有高度的可操作性,能够极大地提高研究的效率,并且可以很好地向外界传递信息。
同时,293T细胞具有良好的克隆能力,能够自行生成相同的基因组。
它还具有良好的适应性,可以适应不同的环境,使用起来非常灵活。
此外,它也可以用于转染,有助于基因治疗研究,可以很好地实现基因调节。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
293t细胞转染效率不高的原因
1.细胞状态问题:细胞的健康状态是影响转染效率的重要因素。
在转染前,293t细胞应处于对转染条件最为适合的生长状态。
不适当的细胞密度、细胞健康程度不佳或细胞老化等都会降低细胞的转染效率。
因此,在进行转染前应严格控制细胞的生长条件,例如,将293t细胞保持在对数生长期,确保细胞的健康状态。
2. 转染条件问题:转染时使用的转染试剂和转染方式会直接影响转染效率。
对于293t细胞,常见的转染试剂包括聚合物转染试剂(如聚乙烯醇,PEI)和脂质体转染试剂(如Lipofectamine系列)。
不同的转染试剂和转染方式具有不同的适用范围,需要根据具体的实验目的选择最合适的转染试剂和转染方式。
此外,转染试剂的浓度和转染时间也是影响转染效率的重要因素,需要进行优化。
3. 基因表达载体问题:转染效率也受到基因表达载体的选择和构建的影响。
“293t”代表的是人胚肾293细胞系,通常在293t细胞中进行的转染是为了进行基因表达。
选择合适的基因表达载体对于高效转染
293t细胞至关重要。
常见的基因表达载体包括携带启动子、报告基因和靶基因的质粒,例如pcDNA3.1、pCMV-Tag1A等。
此外,质粒的纯度和浓度也会影响转染效率,要保证质粒具有足够的纯度和浓度。
4.细胞特性问题:293t细胞在某些抗体和抑制剂的影响下可能会表现出较低的转染效率。
例如,有报道指出,加入一些非离子性均一剂(如聚乙二醇)能够导致293t细胞的转染效率显著下降。
因此,在进行转染实验时,应该了解并考虑特定细胞系的特性,并选择合适的实验条件。
综上所述,要提高293t细胞的转染效率,需要优化细胞状态、转染条件、基因表达载体选择和细胞特性等方面的因素。
通过综合考虑这些因素并进行合理的优化,可以显著提高293t细胞的转染效率。
