胆固醇杂质-标准品
食品中胆固醇含量测定方法的研究与比较_丁卓平

由于深加工食品中模板含量少,需要利用高效的或
methodologies available[J].Trends in Food science and
特殊的 D N A 提取方法,以提取到其中微量的 D N A 。针
technology, 1999, (9): 380-388.
对不同的深加工食品,需要设计不同的模板提取方法。 [4] Georg A S Challenges For methods to detect genetically modi-
酸性溶液和弱碱性水溶液等。经过多次有机溶剂提取, [1] D N A 大量损失;并且在酸碱和加热等提取条件下,使
D N A 断裂成小片段。对于经过提纯的食品或食品原料, [2] 如大豆精炼油、大豆异黄酮、大豆卵磷脂、大豆蛋白
等,模板 D N A 有二个显著特点:其一是含量少,其二 [3] 是片段小。
The Determination of the Cholesterol Concentration in the Food Product and the Study of the Method
DING Zhuo-pua,HE Yu,ZHAO Dong-yan (College of Food Science,SFU, Shanghai 200090, China)
130 2004, Vol. 25, No. 1
食品科学
※分析检验
3 讨 论
样品中十几个拷贝的 D N A 模板;用 P C R 方法检测 N O S ,
大豆异黄酮的提取,主要根据被提取物的性质及伴 存杂质的情况来选择合适的提取用溶剂。对大豆异黄酮 的甙类成分,一般用乙酸乙酯、丙酮、乙醇、甲醇、 水或某些极性较大的混合溶剂,甙元用极性较小的溶 剂,如乙醚、氯仿、乙酸乙酯等来提取。在综合提取
胆固醇含量检测

法测定鸡蛋中胆固醇含量一、原理当固醇类化合物与酸作用时,可脱水并发生聚合反应,产生颜色物质。
因此可先对食品样品进行皂化和提取,用硫磷铁试剂作为显色剂,测定食品中胆固醇的含量。
在样品的冰乙酸提取液中加磷硫铁试剂,胆固醇与试剂反应产生紫红色化合物,颜色的深浅与胆固醇的量成正比,可用分光光度计在波长560nm•处测定。
二、实验仪器及试材1.仪器:分光光度计、水浴锅2.试剂:本实验用水均需用蒸馏水或去离子水。
试剂纯度均为分析纯。
(1)石油醚(沸点30-60℃)、无水乙醇、冰乙酸。
(2)50%氢氧化钾溶液:称取50g氢氧化钾,用蒸馏水溶解,并稀释至100mL。
(3)25%氯化钠溶液:称取25g氯化钠,用蒸馏水溶解,并稀释至100mL。
(4)10% 三氯化铁溶液:将10g FeCl3·6 H2O溶于磷酸中,定容至100 mL,储于棕色瓶中,冷藏保存。
(5)磷硫铁试剂:取10% 三氯化铁溶液1.5mL于100mL棕色容量瓶内,加浓硫酸定容至刻度。
(6)胆固醇标准储液:准确称取胆固醇100mg,溶于冰乙酸中,定容至100mL。
(7)胆固醇标准溶液:临用前将储液用冰乙酸稀释10倍。
三、实验方法与步骤1.样品胆固醇提取准确称取充分混匀的鸡蛋约0.20g于25mL具塞比色管中,加入0.5mL50%氢氧化钾溶液和4.5mL无水乙醇,振荡混匀,在80℃恒温水浴中皂化20min。
皂化时每隔5min振摇一次使皂化完全。
皂化完毕,取出比色管,冷却。
加入3mL 25%氯化钠溶液后再加入10mL石油醚,盖紧玻璃塞,振摇1min,静置分层。
取上层石油醚液1mL,置于25mL具塞比色管内,在65℃水浴中让石油醚自然挥发干,加入4mL冰乙酸,轻摇使胆固醇溶解,待测。
2.样品和标准胆固醇含量测定另取两支25mL具塞比色管,一支(空白管)加入4mL冰乙酸,一支(标准管)加入1mL胆固醇标准溶液(0.1mg/mL)和3mL冰乙酸。
包括样品管,各管分别加入2mL磷硫铁试剂,混匀,25℃放置20min后在560nm波长下比色。
鸡蛋胆固醇含量测定方法比较研究

鸡蛋胆固醇含量测定方法比较研究吴超;李润航;于中英;娄玉杰【摘要】试验随机选取了中华绿蛋鸡产的绿壳蛋和依莎褐蛋鸡产的褐壳鸡蛋各20枚,采用邻苯二甲醛分光光度计比色法和气相色谱法,测定鸡蛋中胆固醇的含量,比较两种方法在测定鸡蛋胆固醇含量上的差异.结果表明,用邻苯二甲醛比色法测得褐壳蛋蛋黄胆固醇含量176.79 mg/枚,浓度为13.35mg/g.用气相色谱法测得胆固醇含量142.74 mg/枚,浓度为9.69mg/g,二种方法测定的结果差异显著(P<0.05).用邻苯二甲醛比色法测得绿壳蛋蛋黄胆固醇含量158.12mg/枚,浓度为10.65 mg/g.用气相色谱法测得胆固醇含量128.70 mg/枚,浓度为8.54 mg/g,二种方法测定的结果差异显著(P<0.05).【期刊名称】《家畜生态学报》【年(卷),期】2013(034)011【总页数】4页(P57-60)【关键词】胆固醇;比色法;气相色谱;鸡蛋【作者】吴超;李润航;于中英;娄玉杰【作者单位】吉林农业大学动物科学技术学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118【正文语种】中文【中图分类】S811.6在人们健康意识不断增强的今天,胆固醇往往片面的被认为是对人体有害的物质,但实际上,胆固醇是动物细胞各种膜结构及神经髓鞘的重要组成部分,可调节肠胃消化道中膳食脂肪的吸收,是胆汁酸、类固醇激素及维生素D3的前体,具有重要的生理功能[7],但如果摄入量过多,可形成高血脂症,引起动脉粥样硬化,进而诱发冠心病、高血压等一系列心脑血管疾病[1-4]。
研究表明,来源于鸡蛋中的胆固醇与来源于其他原料的胆固醇相比更易导致人体血清胆固醇水平的提高[5-6]。
鸡蛋中的胆固醇总量在100~270 mg范围内变动[7],为满足不同人群的需要,低胆固醇鸡蛋备受人们的关注,因而鸡蛋中胆固醇含量测定的方法及准确性是评定其营养价值的重要参数。
普利莱组织游离胆固醇酶法测定试剂盒使用说明书

组织游离胆固醇酶法测定(Tissue free cholesterol ) E1016描述:在实体组织和细胞内,胆固醇酯既是构成细胞质膜的成分,也是细胞内脂滴的主要组分。
细胞内胆固醇过度聚集与动脉粥样硬化泡沫细胞形成密切相关。
实体组织和细胞的胆固醇测定远比血液胆固醇测定复杂。
本试剂盒避免了有毒的有机溶剂抽提、繁杂的氮气吹干和脂质复溶等步骤,采用高效能试剂裂解细胞和提取胆固醇,优化了酶学反应和操作步骤,简单易行,灵敏度高,线性范围20~5000 µmol/L。
原理:本试剂盒采用WHO、中国《全国临床检验操作规程》推荐的酶学方法,结合经典GPO Trinder酶学反应1,2,原理如下:(1) 胆固醇酯酶分解胆固醇酯为游离胆固醇。
(2) 胆固醇氧化酶将游离胆固醇氧化,反应过程产生过氧化氢。
(3) 在过氧化物酶催化下进行生色反应,在550nm有最大吸收峰,光密度值与胆固醇浓度成正比。
参考文献1.Trinder P. Ann. Clin. Biochem. 1969, 6: 24-27.Barham D and Trinder P. Analyst. 1972, 97: 142-145适于测定样品:(1) 动物实体组织(2) 培养细胞组成(105次微板测定或30次1 ml比色杯测定):(1)裂解液100 ml (2)R1试剂16 ml (3)R2试剂4 ml (4)5 mmol/L胆固醇标准品0.5 ml储存:4 ºC保存6个月有效所需设备:酶标仪、生化分析仪或721、722型可见光分光光度计。
最佳工作波长550nm,如无此波长建议优先选用570nm、次选530、490nm。
操作步骤;一. 组织细胞裂解:裂解前,组织或细胞用PBS洗涤2次去除残存血液或培养基血清,以免影响胆固醇测定。
1)培养细胞裂解:消化、离心收集细胞或直接在培养皿内裂解。
通常6孔板单孔约2x106个细胞,75cm2瓶约1x107细胞。
低密度脂蛋白胆固醇一步法参考标准

低密度脂蛋白胆固醇一步法参考标准低密度脂蛋白胆固醇(LDL-C)是指血液中低密度脂蛋白(LDL)中的胆固醇含量。
通过测量LDL-C水平,可以评估患者的心血管健康状况,并作为冠心病风险的一个重要指标。
制定一份可靠的一步法参考标准对于临床落实LDL-C检测具有重要意义。
一、背景介绍LDL-C水平的测定是衡量冠心病风险的重要方法之一。
目前,常用的LDL-C测定方法有直接测定法和间接测定法。
直接测定法仪器昂贵,操作复杂,且不适用于大规模筛查。
间接测定法则是根据临床化学方法测量总胆固醇(TC)、甘油三酯(TG)和高密度脂蛋白胆固醇(HDL-C)来推算LDL-C水平。
虽然间接测定法的成本相对较低且易于实施,但其精确性和准确性存在一定的局限性。
需要建立一种准确可靠的一步法参考标准来测定LDL-C水平。
二、方法步骤1. 标本制备收集患者静脉血样本后,采用抗凝剂处理,离心分离血清。
然后将血清分装于干净无菌的离心管中,封闭后冷藏储存,避免血清发生冻融过程。
2. 试剂准备准备所需的试剂,包括LDL-C试剂盒、标准品和质控品。
试剂盒和盒内试剂应根据说明书进行稳定保存。
3. 校准与质控根据试剂盒说明书进行标准品的稀释和质控品的制备。
严格按照规定的浓度进行稀释,并保证每次使用前充分搅拌均匀。
4. 仪器校准与准备根据所使用的仪器说明书,进行仪器的校准和准备工作。
确保仪器状态良好,参数设置正确。
5. 检测操作将标本从冷藏处取出并平衡到室温,避免温度的影响。
根据试剂盒的使用说明书,按照操作流程进行检测。
6. 数据分析与结果判读根据仪器测定结果,进行数据分析和结果判读。
根据参比范围和患者信息,将测定结果转换为LDL-C浓度。
三、质量控制为确保检测结果可靠性和准确性,需进行质量控制措施。
1. 校准控制:根据试剂盒要求,校准试剂和质控品,定期检验校正仪器参数,确保测量结果符合标准要求。
2. 质控品测试:每个测试批次前后,使用质控品进行测试,确认仪器状态良好,测试结果在可接受的范围内。
总胆固醇(CHOL)测定试剂盒(CHOD—PAP法)产品技术要求derui

总胆固醇(CHOL)测定试剂盒
2、性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白吸光度
试剂以蒸馏水为空白时,在波长500~550 nm,光径1.0 cm,温度37℃条件下,吸光度≤0.080。
2.3分析灵敏度
试剂盒测试0.5 mmol/L被测物时,吸光度变化值≥0.002。
2.4线性范围
2.4.1试剂盒在0.5~19.6mmol/L区间(范围)内,其回归系数r≥0.990。
2.4.2相对偏差或绝对偏差应符合表3 要求。
表3 相对偏差或绝对偏差
2.5精密度
2.5.1试剂盒批内精密度CV 值应≤4.0%。
2.5.2试剂盒批间相对极差(R)应≤6.0%。
2.6准确度
使用具有溯源性的标准品进行测定,实测值与标示值的相对偏差应在±10.0% 内。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。
GC-MS测定血清胆固醇及其标志物前处理条件正交试验优化研究

GC-MS测定血清胆固醇及其标志物前处理条件正交试验优化研究张钰;王栋芳;曹冰;罗世恒;刘雅琼;黄宁华;闫赖赖;王京宇【摘要】采用正交试验优化 GC-MS测定血清胆固醇及其标志物的样品前处理条件,并对最优试验方案进行方法学评价。
采用 L16(211)正交设计对影响 GC-MS 测定血清胆固醇及其标志物前处理的3个关键步骤共7个因素———皂化(KOH-乙醇浓度、皂化温度和时间)、萃取(正己烷用量)和衍生化(衍生化温度、时间和用量)进行优化。
得到最优前处理条件组合如下:KOH-乙醇溶液浓度为1 mol·L-1;皂化温度70℃;皂化时间60 min;萃取剂用量2 mL;衍生化温度70℃;衍生化时间60 min;衍生化试剂用量100μL。
所建方法准确性和精密性良好,方法学评价指标优于文献报道。
%The obj ective is to use orthogonal experiment to optimize the pretreatment on the determination of serum cholesterol and its markers by GC-MS.And then the method is evaluated in a methodological perspective.The methodis to Use L16 (211 )or-thogonal experiment design to observe the influence of three key steps,althogether seven factors of pretreatment,which are sa-ponification (KOH ethanol solution concentration,temperature and time),extraction (dose)and derivatization (temperature , time and dose).As for the results,the conditions of optimal pretreatment are as follows:the ethanol solution is 1 mol·L-1 KOH,the saponification temperature is 70 ℃;the saponifica tion time is 60 min;the Solvent quantity is 2 mL;the derivatization temperature is 70 ℃;the derivatization time is 60 min,and the derivatization agent is 100μL.Through the optimization by or-thogonal design andmethodological evaluation,the determination of serum cholesterol and its markers by GC-MS is excellent in terms of accuracy and precision,and methodological evaluation indexes are better than those reported in other papers.【期刊名称】《光谱学与光谱分析》【年(卷),期】2016(036)005【总页数】6页(P1488-1493)【关键词】GC-MS;正交试验;胆固醇;标志物;前处理【作者】张钰;王栋芳;曹冰;罗世恒;刘雅琼;黄宁华;闫赖赖;王京宇【作者单位】北京大学公共卫生学院,北京 100191;北京大学公共卫生学院,北京 100191;北京大学公共卫生学院,北京 100191;岛津企业管理中国有限公司,北京 100020;北京大学公共卫生学院,北京 100191;北京大学公共卫生学院,北京 100191;北京大学公共卫生学院,北京 100191;北京大学公共卫生学院,北京100191【正文语种】中文【中图分类】R113胆固醇是机体内重要的代谢组分之一,与人体健康和疾病密切相关。
HPLC-ELSD测定鸡蛋中胆固醇的含量

HPLC-ELSD测定鸡蛋中胆固醇的含量王术玲;郑夏生;黄敏娜;黄孟秋;冯燕兰;梁亮【摘要】应用高效液相色谱-蒸发光散射检测器(HPLC-ELSD)对不同种类鸡蛋中胆固醇的含量进行测定.采用C18色谱柱为固定相,以甲醇为流动相,流速为1 mL·min-1,柱温为25℃;蒸发光散射检测器的氮气流速为2 L·min-1,漂移管温度为85℃.结果表明,胆固醇进样量在4.008~40.080 μg范围内,其对数与峰面积的对数呈良好的线性关系,相关系数R=0.9991,低、中、高三个浓度回收率为95.4%~99.1%.该方法操作简便、快速,精密度好,结果准确可靠.【期刊名称】《化学与生物工程》【年(卷),期】2009(026)003【总页数】3页(P76-78)【关键词】高效液相色谱-蒸发光散射检测器;鸡蛋;胆固醇;含量测定【作者】王术玲;郑夏生;黄敏娜;黄孟秋;冯燕兰;梁亮【作者单位】广州中医药大学,广东,广州,510006;广州中医药大学,广东,广州,510006;广州中医药大学,广东,广州,510006;广州中医药大学,广东,广州,510006;广州中医药大学,广东,广州,510006;广州中医药大学,广东,广州,510006【正文语种】中文【中图分类】O657.72胆固醇是环戊烷骈多氢菲的衍生物,亦称“胆甾醇”,是动物体内维持正常生理活动所必需的最重要的固醇,通常以游离状态或酯化状态存在于动物组织中[1]。
但是人体内过多的胆固醇将引起高血脂,进而引发动脉粥样硬化、高血压、冠心病等一系列心血管疾病[2],因此控制饮食中胆固醇摄入量非常必要。
鸡蛋中含有大量的胆固醇,是人体摄入胆固醇的重要途径。
对于鸡蛋中胆固醇含量的测定,文献报道多以在208 nm波长处紫外检测为主,对流动相的要求高,且样品中高紫外吸收物质的干扰大,易造成基线不稳,如果梯度洗脱则会引起基线漂移,使得胆固醇定量难度较大[3]。
血脂四项实验室检测方法

血脂四项实验室检测方法血脂四项实验室检测是指检测血液中的总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的含量,用于评估血脂水平和心血管疾病的风险。
下面将详细介绍血脂四项的实验室检测方法。
一、总胆固醇(TC)检测方法:1.试剂与仪器准备:质控品、标准品、血清分析试剂盒、全自动生化分析仪。
2.样本处理:将待测血清标本离心,用无菌管吸取上清液,将其转移到分析管中。
3.加样:根据试剂盒说明,加入足量的试剂,轻轻摇晃均匀。
4.反应:根据试剂盒说明,在恒温箱中将标本与试剂充分反应。
5.测定:使用全自动生化分析仪测定样本的吸光度,并根据标曲计算出样本中总胆固醇的浓度。
二、甘油三酯(TG)检测方法:1.试剂与仪器准备:质控品、标准品、血清分析试剂盒、全自动生化分析仪。
2.样本处理:待测血清标本离心,用无菌吸管吸取上清液,转移到分析管中。
3.加样:根据试剂盒说明,加入足量的试剂,轻轻摇晃均匀。
4.反应:在恒温箱中将标本与试剂充分反应,使甘油三酯被分解成甘油和游离脂肪酸。
5.测定:使用全自动生化分析仪测定样本的吸光度,并根据标曲计算出样本中甘油三酯的浓度。
三、高密度脂蛋白胆固醇(HDL-C)检测方法:1.试剂与仪器准备:质控品、标准品、血清分析试剂盒、全自动生化分析仪。
2.样本处理:待测血清标本离心,用无菌吸管吸取上清液,转移到分析管中。
3.加样:根据试剂盒说明,加入足量的试剂,轻轻摇晃均匀。
4.反应:在恒温箱中将标本与试剂充分反应,使高密度脂蛋白与其他成分分离开来。
5.测定:使用全自动生化分析仪测定样本的吸光度,并根据标准曲线计算出样本中高密度脂蛋白胆固醇的浓度。
四、低密度脂蛋白胆固醇(LDL-C)检测方法:1.试剂与仪器准备:质控品、标准品、血清分析试剂盒、全自动生化分析仪。
2.样本处理:待测血清标本离心,用无菌吸管吸取上清液,转移到分析管中。
3.加样:根据试剂盒说明,加入足量的试剂,轻轻摇晃均匀。
鸭蛋黄渣中胆固醇的提取及GC_MS含量测定_马萍

$ !"#
!"# 、 $% , 提取, 提取时间分别为 ! 、 提取次数分别为 & 、 ’、 # 次。提取条件根据正交实验设计表 ( 表 !) 进行 组合。 !"$"$"$( 离心( 每次搅拌结束后进行离心分离, 收集 合并上清液。 !"$"$"&( 浓缩( 将提取液在水浴锅中 )#* 水浴, 尽量 蒸发丙酮, 直至浓缩至原体积的 ! + !, 左右。 !"$"$"’( 除杂( 将以上浓缩液中加入约 !, 倍体积的 -#. 工业乙醇, 然后 )#* 加热回流 &,/01 。 !"$"$"#( 过 滤 ( 液, 弃滤渣。 !"$"$")( 结 晶 ( 将 上 述 回 流 后 的 液 体 过 滤, 收集滤 将 滤 液 放 于 , 2 #* 处 冷 却, 收集结
,"$#// 0"<" , ; 膜厚 ,"! !/ ) 载气为高纯氦; 柱流量为 !"$/5 + /01 ; 进样口温度 &,,* ; 程序升温条件: 起始 温度 -,* , 保 持 !/01 ; 以 &,* + /01 的 速 率 升 至 &$,* , 保持 &/01 ; 进样方式采用不分流进样, 进样量 为 ! !5。 !"$"’"$( 质谱条件 ( => 电离方式, 电子能量为 3,?@, 离子源温度 $&,* , 四级杆温度 !#,* , 质量扫描范围 #,2)#,A , 传输线温度为 $4,* 。 !"$"’"&( 待测液制备( 称取干燥后的胆固醇 ,"#/7, 定 容到 !,,/5 的正己烷溶液中, 过 ,"’# !/ 滤膜待用。 !"$"#( 计算方法( 自动进样器进样, $、 ’、 分别吸取 ! 、 4、 !,/7 + 5 的胆固醇标准溶液 ! !5 进样, 通过全扫描 方式得到总离子流图, 选择丰度较高, 质量数较大的作 &)4 、 $’! 作 为定性和定量的碎片离子。选择 / + B &4) 、 / + B&4) 为定性离子, 作为定量离子, 外标法定量。
血清胆固醇标准参考物质的研制_王抒

清标准参考物质定值的方法, 以进一步保证定 值结果的可靠性( 表4) 。
表3 本室用 A L BK 法测定 CDC 参考血清的结果( mmol/ L )
CDC 编号
MQ 5 Q 15 Q 18 LG LF LH
CDC 胆固醇定值
1. 33 4. 65 7. 14 4. 37 6. 13 3. 98
本室测定值
五、与国外参考血清核对 采用 NI ST SR M 909冻干 人血清 及6份 CDC 参考 血清。
结果
一、参考血清在保存中的稳定性 1. 于分装后7天及 90天将保存 于37℃、室
温、4℃及- 20℃的血清分别作细菌培养, 结果 全部阴性。将4℃、- 20℃保存3年的血清抽样培 养, 无菌生长。
的准确性, 为便于作国际间和地区间的横向比 较及前瞻性研究, 有必要在我国尽快建立和推 行胆固醇测定标准化分析体系。我们在推荐用
中华医学检验杂志1996年7月第19卷第4期
·2 17 ·
高效液相色谱( HPL C) 测定胆固醇[ 2] 代替 A L BK 法作为我国的参考方法[ 3] 的基础上, 还研制 了血清胆固醇标准参考物质( 以下简称参考血 清) , 已由国家技术监督局批准为血清胆固醇国 家一级标准( GBW 09138, 1994) 。现将我们的研 制工作报告如下。
2. 外观观察: 37℃及室温存放半年、4℃存 放3年后液体清澈透明, - 20℃存放融化后稍混 浊。7 天内 反复 冻融多 次后 浊度 不再 增加 。
3. 不同温度下的稳定性观察: 每次每种温 度取10支作分析, 酶法测 定。结果见表1。可见 37℃21天、室温90天、4℃和- 20℃3年以内胆固 醇定值变动< 1% 。
Key words Cholester ol Refer ence standards
血脂各个项目的不同测定方法

血清脂类测定血浆中的脂类包括胆固醇、胆固醇脂、甘油三酯、磷脂和非酯化脂肪酸等。
目前,对有关脂类代谢疾患的诊断和治疗过程,均必须检测血浆〔清〕中的脂类,通过其含量的变化,对临床疾患提供协助诊断的依据。
有关医学科研工作,脂类的定量检测也是一项必备的研究工程。
1.胆固醇测定血浆中胆固醇及其酯的含量检测,从方法学上可分为两大类:一类是化学法包括抽提法和直截了当测定法,这类方法目前仍在沿用;另一类是酶法测定,方法敏感特异快速,并能自动化分析,已常规应用。
化学测定法种类多,由于显色反响的特异性不同,其结果有一定的差异。
目前公认的参考方法是Abell-Kendall(L-B反响)法。
另外,三氯化铁-硫酸反响法〔Zak法〕具有显色稳定法、操作简便、灵敏度约5倍于L-B反响法,胆固醇酯与游离胆固醇显色程度比立接近等优点,缺点是特异性差,干扰因素比L-B法多,如冰醋酸中含有的乙醛酸,血清样品中的血红蛋白,胆红素以及硫酸的质量等因素均可碍事Zak方法的正确性,Zak法更适合于科研使用。
酶法测定血清胆固醇的方法已被广泛采纳,国产试剂已能满足临床的需要。
胆固醇测定用的标准品,按美国国家标准局〔NBS〕出品纯度达99.8%,是国际公认的参考物,国内李健斋等已纯化制成符合这一要求的胆固醇纯品,已供临床检测血清胆固醇使用。
2.甘油三酯测定血浆甘油三酯的测定,目前多以化学法和酶法定量。
化学法测定甘油三酯是以脂蛋白变性,水解成甘油,并以甘油为计算依据。
酶法是以特异酶水解甘油三酯,除往脂肪酸,再测定甘油,方法特异,正确而快速,临床广为应用。
目前甘油三酯测定的方法要紧以定量甘油为依据,然而血清样品中存在有游离甘油,如何从反响过程中的总甘油中减往游离甘油,多年来一直在研究讨论这一咨询题。
假设不减往,其测定值将会高于血清样品中的真值,要是要减往,就必须先测出血清样品中的游离甘油,甘油三酯的测定方法将增加一个繁杂的步骤,实际工作中难以做到。
总胆固醇检测试剂盒说明书
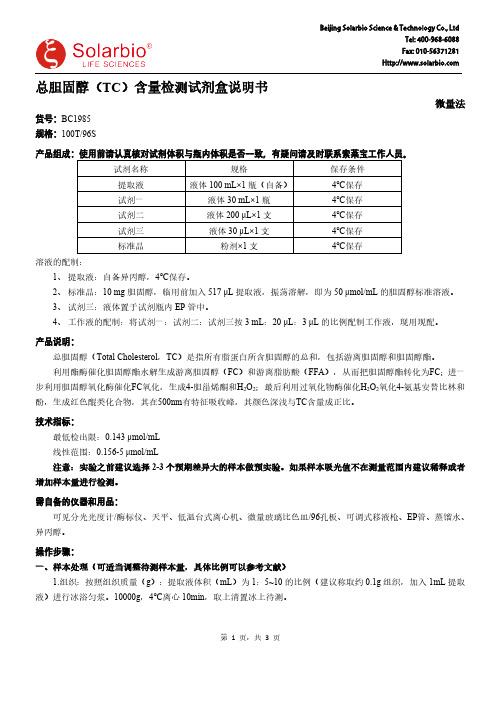
总胆固醇(TC )含量检测试剂盒说明书微量法货号:BC1985规格:100T/96S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件提取液液体100 mL×1瓶(自备)4℃保存试剂一液体30 mL×1瓶4℃保存试剂二液体200 μL×1支4℃保存试剂三液体30 μL×1支4℃保存标准品粉剂×1支4℃保存溶液的配制:1、提取液:自备异丙醇,4℃保存。
2、标准品:10 mg 胆固醇,临用前加入517 μL 提取液,振荡溶解,即为50 μmol/mL 的胆固醇标准溶液。
3、试剂三:液体置于试剂瓶内EP 管中。
4、工作液的配制:将试剂一:试剂二:试剂三按3 mL :20 μL :3 μL 的比例配制工作液,现用现配。
产品说明:总胆固醇(Total Cholesterol ,TC )是指所有脂蛋白所含胆固醇的总和,包括游离胆固醇和胆固醇酯。
利用酯酶催化胆固醇酯水解生成游离胆固醇(FC )和游离脂肪酸(FFA ),从而把胆固醇酯转化为FC ;进一步利用胆固醇氧化酶催化FC 氧化,生成4-胆甾烯酮和H 2O 2;最后利用过氧化物酶催化H 2O 2氧化4-氨基安替比林和酚,生成红色醌类化合物,其在500nm 有特征吸收峰,其颜色深浅与TC 含量成正比。
技术指标:最低检出限:0.143 μmol/mL 线性范围:0.156-5 μmol/mL注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、天平、低温台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、EP 管、蒸馏水、异丙醇。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1.组织:按照组织质量(g ):提取液体积(mL )为1:5~10的比例(建议称取约0.1g 组织,加入1mL 提取液)进行冰浴匀浆。
胆固醇质量标准

胆固醇质量标准
一、含量
胆固醇的含量应不低于98%。
其中,游离胆固醇应不低于95%。
二、纯度
胆固醇的纯度应达到99%以上,其中杂质含量不得超过1%。
三、颗粒度
胆固醇颗粒应均匀,肉眼观察无杂质。
颗粒度应符合一定的标准,以保证在使用时能达到最佳的分散效果。
四、稳定性
胆固醇应具有一定的稳定性,在室温下不应在短期内出现结晶或沉淀。
在长时间储存时,其物理性质和化学性质不应发生明显变化。
五、生物学安全性
胆固醇应无生物毒性,不应含有对人体健康造成危害的物质。
在用于人体时应经过严格的生物学安全性检测。
六、杂质含量
胆固醇中的杂质含量应尽可能低,以保证其安全性和有效性。
主要的杂质包括游离脂肪酸、一氧化碳、水分、重金属等。
七、生产工艺控制
胆固醇的生产工艺应保证其质量和安全性。
生产过程中的温度、压力、流量等参数应严格控制,以保证产品的稳定性和一致性。
同时,生产工艺应具有可重复性,以确保批量产品的质量一致。
八、检测方法
胆固醇的质量检测应采用准确、可靠的检测方法。
常用的检测方法包括高效液相色谱法、气相色谱法、质谱法等。
在检测过程中,应注意控制实验条件和操作方法,以保证检测结果的准确性和可靠性。
血清总胆固醇的测定实验报告

血清总胆固醇的测定实验报告实验报告
实验目的:
测定血清总胆固醇的浓度。
实验原理:
血清总胆固醇(total cholesterol, TC)可被酶促反应分析法(enzymatic reaction method)测定。
在反应液中加入胆固醇酯酶和胆固醇氧化酶,使血清中的TC被水解成自由胆固醇和酯化胆固醇,同时释放出的氢过氧化物(H2O2)与4-氨基安替比林(4-AAP)和3,5-二溴-4-硝基苯磺酸(DHNS)在高温下作用形成紫色化合物,其吸光度与TC的浓度成正比。
实验原料:
1. TC标准品(10.0 mmol/L)
2. 4-AAP(0.5 mmol/L)
3. DHNS(0.65 mmol/L)
4. 胆固醇酯酶
5. 胆固醇氧化酶
6. 磷酸盐缓冲液(pH
7.4)
实验步骤:
1. 取血清标本1.0 mL,并用离心机离心10分钟,除去沉淀后得到澄清的血清。
2. 取1.0 mL澄清的血清加入10 μL胆固醇酯酶,放置于37℃恒温槽中加水浴反应30分钟。
3. 倒入10 μL胆固醇氧化酶,再加入2.0 mL磷酸盐缓冲液(pH 7.4),混匀。
4. 加入15 μL4-AAP和15 μLDHNS,混匀后在37℃恒温槽中加水浴反应10分钟。
5. 记录吸光度(A)值,以TC标准品作为对照,计算出血清中TC的浓度。
实验结果:
本实验测定血清总胆固醇的浓度为X mmol/L。
实验结论:
采用酶促反应分析法测定血清总胆固醇的浓度,结果可靠,该方法操作简便,对临床诊断有参考意义。
血清胆固醇测定操作流程

血清胆固醇测定操作流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!血清胆固醇测定是一种常见的临床检验项目,用于评估人体血液中胆固醇的含量。
细胞胆固醇实验报告单

细胞胆固醇实验报告单实验名称:细胞胆固醇实验实验目的:1. 探究胆固醇对细胞膜稳定性的影响;2. 研究不同胆固醇浓度对细胞膜渗透性的影响;3. 分析细胞膜中胆固醇含量的变化对细胞生理功能的影响。
实验器材:1. 小鼠细胞培养物;2. 胆固醇标准品;3. 细胞培养培养基;4. 培养皿;5. 传代培养瓶;6. 显微镜;7. pH计;8. 离心机;9. 超速离心机。
实验步骤:1. 准备细胞培养物:将小鼠细胞培养物接种在培养皿中,使用细胞培养基进行培养,并放置于恒温恒湿培养箱中,控制温度为37℃,湿度为5% CO2。
等待细胞扩张至足够数量,达到紧密排列状态。
2. 添加不同浓度胆固醇:将胆固醇标准品和细胞培养基按一定比例混合,制备不同浓度(如0.1mg/mL、0.2mg/mL、0.5mg/mL等)的胆固醇溶液。
将细胞培养物分别加入不同浓度胆固醇溶液中,与细胞体外培养。
3. 培养细胞:继续将培养皿放置于恒温恒湿培养箱中,培养时间可根据需要设定,一般为48小时。
4. 观察细胞变化:使用显微镜观察细胞形态的变化,记录细胞的大小、形状、数量等指标,并与未加入胆固醇的细胞进行比较,分析胆固醇对细胞形态的影响。
5. 检测细胞膜渗透性:利用pH计或其他相关方法,测定细胞培养基中的pH值,可以直接反映细胞膜的渗透性。
将不同浓度胆固醇处理的细胞培养物与未处理的细胞培养物进行比较,分析胆固醇对细胞膜渗透性的影响。
6. 细胞膜胆固醇含量检测:使用超速离心机将处理后的细胞培养物离心,将沉淀提取出来,采用适当的分析方法(如高效液相色谱法)测定细胞膜中胆固醇的含量。
7. 数据分析:对实验结果进行统计学分析,根据观察到的细胞形态变化、细胞膜渗透性和胆固醇含量的变化,分析胆固醇对细胞的影响,并给出相应的解释。
预期结果:1. 随着胆固醇浓度的增加,细胞形态可能发生改变,体积增大,形状变得不规则,甚至出现细胞膜破裂现象。
2. 细胞膜渗透性可能会增加,导致细胞内部物质的丢失和外界物质的渗入,可能出现细胞死亡等现象。
