高一化学第一章打开原子世界的大门总结
高一化学必修一第一单元知识点总结

高一化学必修一第一单元知识点总结一、概览高一化学必修一第一单元是化学学习的基础,为学生们打开了探索化学世界的门户。
本单元的知识点总结涉及了化学的基本概念、理论和实验基础,为学生后续深入学习化学知识打下坚实的基础。
本单元的重点在于原子和分子的概念。
学生需要理解原子是构成物质的基本单位,包括质子、中子和电子的组成及其相互作用。
分子则是由两个或多个原子通过化学键连接而成的,其性质和结构决定了物质的性质。
这些基础概念的掌握对于理解化学反应的本质至关重要。
本单元还涉及了元素周期表的应用。
元素周期表是化学学习的重要工具,学生需要掌握如何根据元素在周期表中的位置,推断其原子结构、性质和化学反应。
这对于预测未知元素的性质以及理解元素之间的相互作用具有重要意义。
化学反应的类型也是本单元的重点内容。
学生需要了解常见的化学反应类型,如化合反应、分解反应、置换反应等,并理解其反应机理。
这些反应类型的掌握有助于理解化学反应的过程和结果,为后续的化学学习打下基础。
实验基础也是本单元不可或缺的部分。
化学是一门实验科学,学生需要通过实验来验证理论知识,并培养实验技能和科学素养。
本单元的实验基础包括实验室安全规则、实验仪器的使用以及基本的实验操作等。
高一化学必修一第一单元的知识点总结是化学学习的基础,涉及面广且深入。
学生需要认真掌握这些知识点,为后续深入学习化学打下坚实的基础。
1. 介绍化学的重要性和学习化学对于高中生的意义。
作为一门研究物质组成、结构、性质以及变化规律的基础自然科学,在高一的学习旅程中占据了举足轻重的地位。
对于刚刚踏入高中校门的学生来说,掌握化学的基础知识不仅是对学业的要求,更是对未来个人发展的有力投资。
化学的重要性不言而喻。
在现代社会,化学知识已经渗透到我们生活的方方面面。
从医药研发、材料科学到环境保护、能源利用,无一不依赖于化学的进步。
化学知识不仅帮助我们理解自然界的奥秘,还为众多行业的创新和发展提供了源源不断的动力。
化学必修一第一章归纳与整理

化学必修一第一章归纳与整理
哎呀呀,化学必修一第一章?这可太有意思啦!
刚接触这第一章的时候,我就像走进了一个全新的奇妙世界。
里面的知识就像一个个神秘的小宝藏,等着我去挖掘。
你知道吗?物质的分类就像给不同的小伙伴分组一样。
纯净物就像是班级里那些性格单纯、特点鲜明的同学,而混合物呢,就像一群性格各异、热闹非凡的小伙伴凑在一起。
单质像是独树一帜的小英雄,化合物则像一个团结协作的小团队。
这难道不好玩吗?
再说说分散系。
胶体那部分简直让我大开眼界!胶体就好像是一群小精灵,它们在光的照耀下能展现出独特的丁达尔效应,那一道道明亮的光路,难道不像精灵们在跳舞时留下的美丽轨迹吗?
还有电解质和非电解质,这可让我费了不少脑筋。
电解质就像勇敢的战士,在水溶液中或者熔融状态下能够冲锋陷阵,导电前行。
而非电解质呢,就像是胆小的旁观者,只能在一旁默默看着。
老师在课堂上讲的时候,同学们也都特别积极。
“老师,这个我不太懂!”“老师,那个能再解释一下吗?”大家七嘴八舌的,课堂可热闹啦!
我同桌还跟我打趣说:“这化学知识比迷宫还难走呢!”我就反驳他:“那咱们就当探险家,把这迷宫给走通!”
学完这一章,我算是明白了,化学世界就像一个巨大的游乐场,每一个知识点都是一个好玩的游乐项目。
虽然有时候会遇到难题,就像在游乐场里迷路一样,但是只要我们努力探索,总会找到出路,玩得开心!
总之,化学必修一第一章虽然有挑战,但更多的是乐趣和惊喜。
我已经迫不及待地想要继续探索后面的章节啦!。
高三化学上册《打开原子世界的大门》知识点总结

高三化学上册《打开原子世界的大门》知识点总结.1从葡萄干面包模型到原子结构的行星模型.2原子结构和相对原子质量.3揭开原子核外电子运动的面纱.对原子结构认识的历程:古典原子论:惠施、墨子、德谟克利特;近代原子论:道尔顿;葡萄干面包模型:汤姆孙;原子结构行星模型:卢瑟福;电子云模型:波尔。
——了解2.重要人物及成就:道尔顿(原子论)、汤姆孙(发现电子及葡萄干面包模型)、伦琴(X射线)、贝克勒尔(元素的放射放射性现象)、卢瑟福(α粒子的散射实验及原子结构行星模型)。
3.原子的构成;(看第一章例题)原子核的组成:质子数、中子数、质量数三者关系;原子、离子中质子数和电子数的关系;①原子原子核质子(每个质子带一个单位正电荷)——质子数决定元数种类AZX(+)中子(不带电)质子与中子数共同决定原子种类核外电子(-)(带一个单位负电荷)对中性原子:核电荷数=质子数=核外电子数=原子序数对阳离子:核电荷数=质子数>核外电子数,∴电子数=质子数-阳离子所带电荷数如:ZAn+e=Z-n,Z=e+n对阴离子:核电荷数=质子数<核外电子数,∴电子数=质子数+阴离子所带电荷数如:ZBm+e=Z+m,Z=e-m②质量数(A)=质子数(Z)+中子数(N)。
即A=Z+N质量数(A)(原子核的相对质量取整数值被称为质量数)。
——将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值叫质量数。
4.知道同位素的概念和判断;同素异形体;(看第一章例题)同位素——质子数相同而中子数不同的同一元素的不同原子互称为同位素。
①同位素讨论对象是原子。
②同位素原子的化学性质几乎完全相同。
③在天然存在的某种元素里,不论是游离态还是化合态,也不论其如何不同,各种同位素所占的原子个数百分比保持不变。
(即丰度不变)(见1.2提纲)5.相对原子质量:原子的相对原子质量、元素的相对原子质量(简单计算);a(设某原子质量为ag)①同位素原子的相对原子质量m12c×1/2此相对质量不能代替元素的相对质量。
高一化学第一章知识点总结

高一化学第一章知识点总结好嘞,以下是为您总结的高一化学第一章的知识点:在我们开启高一化学这趟奇妙之旅时,第一章就像是一扇神秘的大门,里面藏着好多有趣又重要的知识。
首先,咱们来聊聊物质的分类。
这就好比把家里的东西整理归类一样。
比如,混合物就像是一个大杂烩,里面啥都有,像空气,那可是氮气、氧气、二氧化碳等等气体的大聚会。
而纯净物呢,就像是整理好的单一物品,比如氧气,纯纯的就是 O₂。
再来说说单质和化合物。
单质就像是独来独往的大侠,比如铁(Fe)、铜(Cu),它们自己就能闯荡江湖。
化合物则像是一个团队,由不同的元素紧密合作,像水(H₂O)就是氢(H)和氧(O)的完美组合。
说到分散系,那可有意思啦。
想象一下,你在厨房做一碗汤,里面的油花漂在上面,这就是乳浊液。
而如果是把盐溶解在水里,那就是溶液啦。
胶体呢,有点特别,就像清晨树林里的那一道道丁达尔效应的光,美丽又神奇。
还记得有一次我在实验室做实验,想要配置一种溶液,结果因为没搞清楚物质的分类,把混合物当成了纯净物,结果实验做得一塌糊涂。
这让我深刻地认识到,搞清楚物质的分类是多么重要!接下来是电解质和非电解质。
电解质就像是充满活力的运动员,在溶液中能自由地“奔跑”,产生离子。
像氯化钠(NaCl)溶解在水里,钠离子(Na⁺)和氯离子(Cl⁻)就欢快地跑出来了。
而非电解质呢,就比较“安静”,在溶液中它们可懒得动弹,比如酒精(C₂H₅OH)。
化学变化和物理变化也是很关键的知识点哦。
化学变化就像是变魔术,物质的本质发生了改变,生成了新的物质。
比如铁生锈,原本闪亮的铁变成了红褐色的铁锈。
物理变化呢,就像是给东西换个造型,本质不变。
像把冰块融化成水,还是 H₂O 。
还有物质的量,这可是个重要的概念。
想象一下,一堆小小的粒子,要怎么数清楚呢?这时候物质的量就来帮忙啦,它就像是一个大箩筐,把一定数目的粒子装在一起。
比如说 1mol 任何粒子所含的粒子数都约为 602×10²³个,这可真是个庞大的数字!有一次我去超市买糖果,售货员一颗颗地数太麻烦了,要是用物质的量的概念,直接说我要 1mol 的糖果,那得多方便呀,哈哈,当然这只是个玩笑,超市可不会这么卖。
化学高一第1章笔记(全部)

第一章打开原子世界大门§1.1 从葡萄干面包模型到原子结构的行星模型一、从古典原子论到葡萄干面包原子模型:1、古代对物质的认识:惠施:物质是无限可分的。
墨子:物质分割是有条件的,当物质不能被分割时,这种不能分割的部分称为“端”。
古希腊德谟克利特:物质只能分割到原子,提出原子是构成物质的最小微粒。
2、近代对原子的认识:(1)19世纪初,英国物理化学家道尔顿提出原子论:①化学元素由不可再分的微粒构成,这种微粒称为原子。
(不正确)②原子在一切化学变化中均保持其不可再分性。
(不正确)③同种元素的原子质量和性质相同,不同种元素的原子质量和性质不同。
(不正确)④构成化合物的原子按简单整数比结合。
(正确)注:③中,“同种元素的原子化学性质是相同的”这一句正确。
④中,“原子与原子之间结合时,都是以简单的整数比化合的”。
(2)20世纪初,汤姆孙发现电子,指出:原子中正电荷(当时没有质子概念)所带的电量与电子所带的负电荷电量相等。
提出葡萄干面包原子模型,认为原子中的正电荷均匀地分布在整个原子的球形体内,电子则均匀地分布在这些正电荷之间。
二、从X射线到元素放射性发现:1、德国物理学家伦琴发现X射线:X射线穿透力强。
2、法国物理学家贝克勒尔发现放射性:说明原子有一定结构。
3、英国物理学家卢瑟福发现两种辐射:α辐射和β辐射。
①α辐射是粒子流,是氦正离子(He2+)。
穿透力弱。
②β射射是电子流。
穿透力弱,穿透力较强。
③γ射线是电磁波。
穿透力强,穿透力很强。
三、原子结构的行星模型:单位换算:1纳米(nm)=10-9m英国物理学家卢瑟福提出原子结构行星模型:①实验现象和结果:绝大部分粒子能直线穿过金箔,说明原子一定是中空的,极少数的粒子能被金箔偏转,有的还被直接弹回来,说明在原子中存在着很小的带正电荷的核。
②行星模型:原子是由带正电荷的质量很集中的很小的原子核和在它周围运动着的带负电荷的电子组成。
§1.2 原子结构和相对原子质量一、原子的构成:1、原子的构成:原子(原子核+核外电子);原子核(质子+中子)a)氢原子(氕、 1 1H)核内无中子,它的其它同位素都有中子( 2 1H有1个中子, 3 1H有2个中子)。
高一化学必修一知识点:打开原子世界的大门

高一化学必修一知识点:打开原子世界的大门1.1从葡萄干面包模型到原子结构的行星模型1.2原子结构和相对原子质量1.3揭开原子核外电子运动的面纱1.对原子结构认识的历程:古典原子论:惠施、墨子、德谟克利特;近代原子论:道尔顿;葡萄干面包模型:汤姆孙;原子结构行星模型:卢瑟福;电子云模型:波尔。
了解2.重要人物及成就:道尔顿(原子论)、汤姆孙(发现电子及葡萄干面包模型)、伦琴(X射线)、贝克勒尔(元素的放射放射性现象)、卢瑟福(粒子的散射实验及原子结构行星模型)。
3.原子的构成;(看第一章例题)原子核的组成:质子数、中子数、质量数三者关系;原子、离子中质子数和电子数的关系;①原子原子核质子(每个质子带一个单位正电荷)质子数决定元数种类AZ X (+) 中子(不带电) 质子与中子数共同决定原子种类核外电子(-)(带一个单位负电荷)对中性原子:核电荷数= 质子数= 核外电子数= 原子序数对阳离子:核电荷数= 质子数核外电子数,电子数=质子数-阳离子所带电荷数如:ZAn+ e=Z-n,Z=e+n对阴离子:核电荷数= 质子数核外电子数,电子数=质子数+阴离子所带电荷数如:ZBm+ e=Z+m,Z=e-m ②质量数(A)= 质子数(Z)+ 中子数(N)。
即A = Z + N质量数(A) (原子核的相对质量取整数值被称为质量数)。
将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值叫质量数。
4.知道同位素的概念和判断;同素异形体;(看第一章例题)同位素质子数相同而中子数不同的同一元素的不同原子互称为同位素。
①同位素讨论对象是原子。
②同位素原子的化学性质几乎完全相同。
③在天然存在的某种元素里,不论是游离态还是化合态,也不论其来源如何不同,各种同位素所占的原子个数百分比保持不变。
(即丰度不变)(见1.2提纲)5.相对原子质量:原子的相对原子质量、元素的相对原子质量(简单计算);a(设某原子质量为a g)①同位素原子的相对原子质量m12c1/2 此相对质量不能代替元素的相对质量。
沪教版高中化学高一第一章

第一章打开原子世界的大门1.1从葡萄干面包模型到原子结构的行星模型【板书】第一章打开原子世界的大门1.1 从葡萄干面包模型到原子结构的行星模型【介绍】在古代,随着人类物质文明的不断发展,人们开始思考物质是怎样构成的。
惠施:“一尺之棰,日取其半,万世不竭!”——物质无限可分墨子:物质被分割是有条件的,若不存在被分割条件,就不能被分割!古希腊哲学家德谟克利特:最早提出了原子论,他认为物质是由许多微粒组成的,这些微粒叫“原子”,物质分割只能到原子为止。
原子,希腊文的原意就是不可分。
【过渡】人类对原子结构的探索还在继续,到了19世纪初,英国物理学家和化学家道尔顿经过试验和研究,把古代思辨、猜测的得到的原子假说发展成更为科学的原子理论。
【阅读】阅读教材第三页第5段,了解道尔顿提出的近代原子学说。
用你们已掌握的化学知识去分析一下道尔顿提出的原子学说是否合理?•*原子是可分的,只不过在化学反应条件下是不可再分的同一元素的原子在质量和物理性质可能不同,而化学性质相同不同元素化合时,元素的原子不一定按简单整数比结合成化合物【讲述】道尔顿的原子学说为近代化学的发展奠定了重要的基础。
但我们现在知道原子并不是实心、不能再分的小球,而在当时人们认识到这一点是因为1897年英国科学汤姆生在实验中发现了原子中存在带负电荷的电子。
电子的发现揭示了原子不是什么“不可分割的最小单元”,这是人类认识原子世界的开端。
【讲述】汤姆孙经过几年思索和研究,在1903年提出了一种葡萄干面包原子模型。
他认为整个原子中的正电荷是均匀分布在整个原子的球形体内,而电子则均匀地分布在这些正电荷之间,就好象葡萄干面包一样,因此称之为葡萄干面包原子模型。
汤姆孙因发现电子而获得1906年诺贝尔物理奖。
【过渡】虽然汤姆生的原子模型与我们现在知道的大不相同,但他毕竟指出了原子是可分的、有结构的,使人们对原子结构认识又进了一步。
人类对原子结构的探索有重要突破,是从发现X射线开始的。
第一章《打开原子世界的大门》第一节原子

几种原子的构成
原子种类 氢 碳 氧 钠 氯 质子数 1 6 8 11 17 中子数 0 6 8 12 18 核外电子数 1 6 8 11 17
从表中可以看出什么? 从表中可以看出什么? 1.不同种类的原子,质子数、电子数不同 不同种类的原子, 不同种类的原子 质子数、 2.质子数 核外电子数 核电荷数 质子数=核外电子数 质子数 核外电子数=核电荷数 3.不是所有的原子都有中子的 不是所有的原子都有中子的
不显电性
质量/kg 质量
9.109X10-31 1.673X10-27 1.675X10-27
相对质量①
1/1836
1.007
1.008
质量数
将原子核内所有的质子和中子的相对质量 取近似整数值加起来,所得的数值,叫质量数。 取近似整数值加起来,所得的数值,叫质量数。 质量数(A)= 质子数 质子数(Z)+ 中子数 中子数(N) 质量数
表示原子组成的一种方法
质量数 —— A 核电荷数 —— Z 核内质子数) (核内质子数)
X
——元素符号 元素符号
a——代表质量数; 代表质量数; 代表质量数 请看下列表示 b——代表质子数既核电荷数; 代表质子数既核电荷数; 代表质子数既核电荷数 +d 代表离子的所带电荷数; 代表离子的所带电荷数 a c+ a b c d e c——代表离子的所带电荷数; 代表化合价 各代表什 d——代表化合价 e b 么 e——代表原子个数 代表原子个数
古典原子论
战国 惠施(中国 中国) 惠施 中国 物质无限可分
战国 墨子(中国 中国) 墨子 中国 物质被分割是有条件的
道尔顿的原子模型
1803年,英国科学家道尔顿提出近代 年 英国科学家道尔顿提出近代 道尔顿 原子学说, 原子学说,他认为原子是微小的不可分割 的实心球体。 的实心球体。
第一章 打开原子世界的大门

第一章打开原子世界的大门
本章地位和作用:
本章作为重要的化学基础知识,对初高中化学学习起到一个承前启后的作用,一方面本章教学以初中原子结构知识为基础,另一方面又为更偏理性的化学学习,特别是为第三章的学习奠定基础。
本章是高中化学教材中对学生的科学精神和科学方法要求相对集中的一章,因为突出了科学精神和科学方法方面的教学要求,因此学生的学习方式应与初中学生习惯了的学习方式有所不同。
应克服对知识结论的死记硬背而不重视学习过程的现象,克服被动接受而不主动探究、主动实践的现象,为以后各章的学习奠定学习方式的基础。
本章改变了以往教材基础理论知识教学只重视理论本身的灌输,,而忽视知识与理论的发展过程的理念,在教材中充分展示科学概念和原理的演变与发展,并努力渗透科学精神和人文精神培养的要素,加强对学生科学态度和科学方法的
现代量子力学原子结构模型(电子云模型)①原子由原子核
和核外电子构成②电子运动的规律跟宏观物体运动的规律截
然不同;③对于多电子的原子,电子在核外一定的空间近似
于分层排布
小结:人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。
五.课后作业
补充内容:物质的量
本节地位和作用:
物质的量是整个高中化学中计算的基石,好比一座现代化的立交桥,四通八达,连接着整个化学教学,也可以很好的提高思维的质量和速度.由于新老教材的差异,这部分内容在二期课改中出现在初三内容中,但部分同学没学过,由于此内容在高一新教材中被删去,但其重要性不可忽视,故进行补充.。
高中化学第一册第一章打开原子世界的大门1.3揭开原子核外电子运动的面纱

原子核外电子的分层排布
1、原子核外电子的分层排布
原子核
电子层
+2
+10
He
核电荷数 Ne
该电子层 上的电子
+18
Ar
+1 +8
H O
+12
Mg
原子结构示意图
为了形象地表示原子的结构,人们就创
造了“原子结构示意图”这种特殊的图形。
第3层 第2层
原子核
第1层
原子核带正电
核电荷数
(为如了H形e象、地Ne表、示A原r等子)的结构,人们就创造了“原子结构示意图”这种特殊的图形。
2、活泼非金属元素易得电子变为带负电 (原如子H核e外、电Ne子、的A分r等层)排布
原1、子活最泼外金层属的元电素子易数失小电于子8变个为时带,正在电化荷学的反阳应离中子总是得到或失去电子而达到最外层8电子的稳定结构。 原(子如最 He外、层N的e、电A子r等数)小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。
1(、2)活泼不金稳属定元结素构易:失原电 子子容变易为失带去正电电子荷转的化阳或离容子易得到电子转化最外电子层上为8(有些为2)个电子的稳定结构。
1、原活子泼核金外属电元子素的易分失层 电排子布变为带正电荷的阳离子
2(、2)活泼不非稳金定属结元构素:易原得 子电容子易变失为去带电负子电转荷化的或阴容离易子得到电子转化最外电子层上为8(有些为2)个电子的稳定结构。
1、原子核外电子的分层排布
2+
为(了1)形稳象定地结表构示:原原子子的既结不构容,易人失们去就电创子造又了不“容原易子得结到构电示子意图”这种特殊的图形。
上海高一化学上册知识点复习

第一章打开原子世界的大门道尔顿——提出近代原子论和实心球模型,都是错误的汤姆孙:葡萄干面包原子模型;卢瑟福:原子结构行星模型质子决定元素种类;质子和中子决定原子种类;最外层电子数决定化学性质同位素:具有相同质子数和不同中子数的同一种元素的原子掌握原子结构示意图和电子式的书写熟练背出1-18号元素第二周期元素中,电子总数为10的小结1)分子ch4nh3h2ohfne(原子)2)离子阳离子Na+、Mg2+、Al3+、NH4+、H3O+、H2F+阴离子N3—、O2—、F—、OH—、NH2—3)注意 A. 11个质子10个电子有Na+NH4+H3O+H2F+B. 10个质子10个电子有ch4nh3h2ohfneC. 9个质子10个电子有F—OH—NH2—其中A、B、C具有相同的质子数和电子数的微粒,注意单核与多核之分别第二章_开发海水中的卤素资源_知识点梳理【知识梳理】一、氯气的化学性质氯的原子结构示意图为:,最外层有7个电子,故氯原子容易得到一个电子而达到8电子饱和结构,因此Cl2突出表现的化学性质是得电子的性质,即表现强氧化性,如Cl2能氧化:①金属(Na、Al、Fe、Cu等);②非金属(H2、P等);③某些化合物(Br-、I-、SO2、Fe2+、SO32-等)。
(1)跟金属反应2Na + Cl2点然2NaCl(产生白烟);Cu +Cl2点然CuCl2 (产生棕黄色的烟)2Fe +3Cl点然2FeCl3(产生棕色的烟,溶于水呈黄色)(2)跟非金属反应H2 +Cl2点燃或光照2HCl点燃:发出苍白火焰,瓶口有白雾;光照:会发生爆炸2P + 3Cl2点燃2PCl3(雾,Cl2不足);2P + 5Cl2点燃2PCl5(烟,Cl2充足)(3)与水反应:Cl2 +H2O=HCl+HClO(HClO是一种不稳定的弱酸,但具有强氧化性。
)【说明】a.氯水通常密封保存于棕色试剂瓶中(见光或受热易分解的物质均保存在棕色试剂瓶中)。
第一章 打开原子世界的大门

第一章打开原子世界的大门一、教学内容及学习水平1.1 从葡萄干面包原子模型到原子结构的行星模型1.1 连线,将下列哲学家与他们对应的观点连起来惠施物质分割有条件,分割到“端”后不可再分墨子物质是由极小的称为“原子”的微粒构成的德谟克利特物质是无限可分的内容水平 1.1.2 原子结构模型(A)具体要求列举古代哲学家对微观微粒认识的观点1.2 填表具体要求列举道尔顿、汤姆孙、卢瑟福在探究原子结构的过程中形成的主要观点1.3 19世纪末20世纪初首先发现原子具有可分性的科学家是()A.道尔顿B.汤姆孙C.卢瑟福D.德谟克利特内容水平 1.1.2 原子结构模型(A)具体要求列举道尔顿、汤姆孙、卢瑟福在探究原子结构的过程中形成的主要观点1.4下面是道尔顿古典原子理论的主要观点,在现在看来,说法还正确的是()化学元素均由不可再分的称为原子微粒构成;②原子在一切化学变化中均保持其不可再分性;③同一元素的原子在质量与性质上都相同,不同元素的原子在质量和性质上都不相同;④不同元素化合时,这些元素的原子按简单整数比例结合成化合物。
A.②③④B.③④C.无D.只有④内容水平 1.1.2 原子结构模型(A)具体要求列举道尔顿、汤姆孙、卢瑟福在探究原子结构的过程中形成的主要观点1.5 α粒子的散射实验表明,原子中存在()A.运动极快且带负电的电子B.质量较大而体积较小的核C.由质子和中子两种微粒构成的核D.做高速运动的原子核内容水平 1.1.2 原子结构模型(A)具体要求列举道尔顿、汤姆孙、卢瑟福在探究原子结构的过程中形成的主要观点1.6在探究原子结构的过程中,科学家使用的主要的科学方法是()A.实验法和想象法B.实验法和模型法C.推理法D.模型法内容水平 1.1.2 原子结构模型(A)具体要求列举道尔顿、汤姆孙、卢瑟福在探究原子结构的过程中形成的主要观点1.2 原子结构和相对原子质量2.1 填写原子的组成(带电)(带电)原子(不带电)(带电)内容水平 1.1.1原子和原子核的组成(A)具体要求说出原子、原子核的组成2.2下列微粒:①质子;②中子;③电子,在所有原子中均含有的微粒是()A.①②③B.仅①C.①和③D.①和②内容水平 1.1.1原子和原子核的组成(A)具体要求说出原子和原子核的组成2.3下列对于右方元素符号角标的说法中不正确的是()A.X原子的中子数为A-ZB.该元素的原子序数为ZC.若右上角标为2+,则表示该元素的离子带两个单位正电荷D.X原子的核外电子数为A-Z内容水平 1.1.4 质量数(A)具体要求说出质量数、质子数和中子数三者之间的关系2.4科学家发现了质子数为118,中子数为175的元素,该元素原子核内中子与核外电子数之差为()A.57B.47C.61D.293内容水平 1.1.4 质量数(A)具体要求说出质量数、质子数和中子数三者之间的关系2.5铯有两种放射性微粒13455Cs、13755Cs,下列说法正确的是()A13455Cs、13755Cs的性质都相同 B.13455Cs、13755Cs互为同位素C.13455Cs的电子数为79D.13455Cs、13755Cs互为同素异形体内容水平 1.1.3 同位素(B)具体要求比较属于同位素的不同原子2.6判断下列关于同位素说法不正确的是()A.同位素原子的物理性质不相同,化学性质也不相同B.同种元素的不同同位素原子的质量数一定不同C.氢元素有三种同位素D.具有相同质子数和不同中子数的同一种元素的原子互称为同位素内容水平 1.1.3 同位素(B)具体要求(1)复述同位素的概念(2)比较属于同位素的不同原子2.7下列各组物质中,互为同位素的是(),互为同素异形体的是()A.金刚石和C60B.37Cl和35ClC.D2和T2D.H218O和H216OE.O2和O3内容水平 1.1.3 同位素(B)具体要求比较属于同位素的不同原子2.8关于下列微粒的说法,正确的是()A. 40K和40Ca的中子数相同B. D218O的中子数为10C. H218O和H216O的质子数相同D. O2和O3的质量数相同内容水平 1.1.4 质量数(A)具体要求说出质量数、质子数和中子数三者之间的关系2.9一个氧原子的质量为m克,一个碳-12原子的质量为n克,则此氧原子的相对原子质量可表示为()A. B. C. D.2.10下列关于元素的说法正确的是()A.人们已经知道了118种元素,所以自然界中也有118种原子B.在天然存在的元素中,各种同位素所占的原子百分率是不断变化的C.元素的相对原子质量是它的各种同位素的相对原子质量根据其所占原子百分率计算而得的平均值D.某种元素的相对原子质量取整数,就是其质量数内容水平 1.1.5 元素的相对原子质量(A)具体要求说出元素相对原子质量的概念2.11氯元素有两种同位素分别是和,已知氯元素相对原子质量的计算式如下所示,填写表中空格写为(计算式中硼元素的相对原子质量用符号表示)。
高一化学第一学期第一章重点
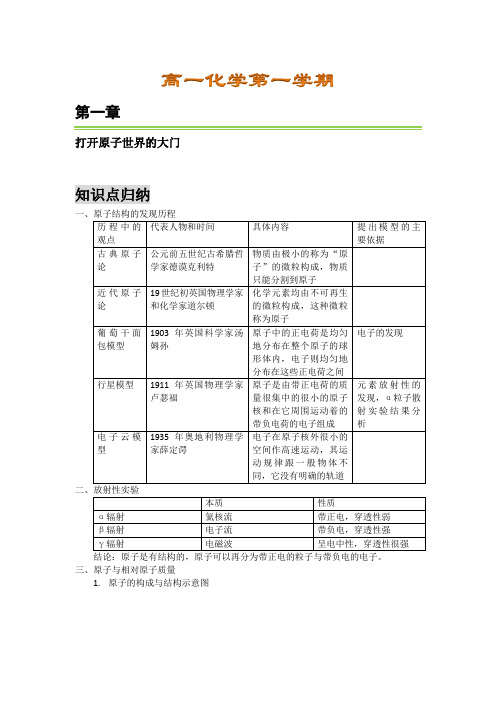
第一章打开原子世界的大门知识点归纳历程中的观点代表人物和时间具体内容提出模型的主要依据古典原子论公元前五世纪古希腊哲学家德谟克利特物质由极小的称为“原子”的微粒构成,物质只能分割到原子近代原子论19世纪初英国物理学家和化学家道尔顿化学元素均由不可再生的微粒构成,这种微粒称为原子葡萄干面包模型1903年英国科学家汤姆孙原子中的正电荷是均匀地分布在整个原子的球形体内,电子则均匀地分布在这些正电荷之间电子的发现行星模型1911年英国物理学家卢瑟福原子是由带正电荷的质量很集中的很小的原子核和在它周围运动着的带负电荷的电子组成元素放射性的发现,α粒子散射实验结果分析电子云模型1935年奥地利物理学家薛定谔电子在原子核外很小的空间作高速运动,其运动规律跟一般物体不同,它没有明确的轨道本质性质α辐射氦核流带正电,穿透性弱β辐射电子流带负电,穿透性强γ辐射电磁波呈电中性,穿透性很强三、原子与相对原子质量1.原子的构成与结构示意图1)微粒间的关系A.质子数=核电荷数=核外电子数=原子序数B.质量数=质子数+中子数=相对原子质量的近似值C.阳离子核外电子数=质子数 - 电荷数D.阴离子核外电子数=质子数+电荷数2)四决定a.质子数-决定元素的种类和“位置”b.中子数-决定原子的物性和质量数c.价电子-决定元素的化学性质d.质量数-决定原子的近似相对原子质量说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)2.同位素1)含义:具有相同质子数和不同中子数的同一种元素的原子互称为“同位素”。
2)性质:a、同一元素的各种同位素虽然质量不同,化学性质相同b、在天然存在的某种元素里不论是游离态还是化合态,各同位素所占原子百分率(丰度)不变3.元素的相对原子质量对于元素的相对原子质量是各种同位素相对原子质量根据其所占的原子百分率计算而得的平均值。
高一化学第一章知识点总结

高一化学第一章知识点总结化学是一门充满神奇和奥秘的学科,从我们周围的物质世界到微观的原子结构,化学为我们揭示了万物变化的规律。
在高一化学的第一章中,我们初步接触了化学的一些基本概念和原理,为后续的学习打下了坚实的基础。
下面就让我们一起来回顾一下这重要的第一章的知识点。
一、化学实验基本方法(一)化学实验安全进行化学实验时,安全是首要问题。
我们需要了解实验室的安全规则,比如:不能用手直接接触化学药品,不能在实验室里吃喝东西,要遵守实验操作的规程等等。
还要认识一些常见的危险化学品的标志,比如易燃、易爆、有毒、有腐蚀性的物质等。
在发生意外时,要知道如何处理,比如被酸或碱灼伤,要用大量水冲洗,然后涂上相应的药膏。
(二)混合物的分离和提纯1、过滤用于分离固体和液体混合物。
操作时要注意“一贴、二低、三靠”。
“一贴”是指滤纸紧贴漏斗内壁;“二低”是指滤纸边缘低于漏斗边缘,液面低于滤纸边缘;“三靠”是指烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸一边,漏斗下端紧靠烧杯内壁。
2、蒸发用于从溶液中提取溶质。
加热过程中要用玻璃棒不断搅拌,防止液体局部过热而飞溅。
当有大量晶体析出时,停止加热,利用余热蒸干。
3、蒸馏用于分离沸点不同的液体混合物。
蒸馏烧瓶中要加入沸石或碎瓷片,防止液体暴沸。
温度计的水银球要放在蒸馏烧瓶的支管口处,测量蒸汽的温度。
冷凝管中冷水从下口进,上口出。
4、萃取和分液萃取是利用溶质在两种互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从另一种溶剂中提取出来的方法。
分液是将两种互不相溶、密度也不相同的液体分离开的操作。
分液漏斗使用前要检漏。
二、化学计量在实验中的应用(一)物质的量物质的量是一个物理量,表示含有一定数目粒子的集合体,符号为n,单位是摩尔(mol)。
1 摩尔任何粒子的粒子数与 0012 kg 12C 中所含的碳原子数相同,约为 602×10²³,这个数叫做阿伏加德罗常数,符号为 NA。
高一化学知识总结

第一章打开原子世界的大门1.1 从葡萄干面包原子模型到原子结构的行星模型一、从古典原子论到葡萄干面包原子模型二、从X射线到放射性的发现三、原子结构的行星模型1.2 原子结构的相对原子质量一、原子的构成化合价±a质子Z个质量数A b±离子电荷原子原子核中子A-Z个X核外电子Z个质子数Z c原子个数核电荷数(Z)=核内质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)二、同位素元素:具有相同核电荷数(质子数)的同一类原子叫做元素同位素:具有相同质子数和不同中子数的同一种元素的原子互称为同位素(同位素原子核内的质子数、化学性质相同;中子数、原子的质量数不同)例:氢原子的同位素(1个质子):氕(H)无中子;氘(D、重氢)1个中子;氚(T、超重氢)2个中子大多数天然元素都有同位素,各种同位素所占的原子百分率一般是不变的。
放射性同位素的应用:探测金属器件缺陷、研究化学反应机理、育种、保存食物、治疗肿瘤三、相对原子质量相对原子质量:以一个碳—12原子质量的1/12作为标准,任何一个原子的真是质量跟一个碳—12原子质量的1/12的比值,成为该原子的相对原子质量。
元素的相对原子质量:它的各种同位素的相对原子质量,根据其所占的原子百分率(丰度)计算而得的平均值(A=A1*a1%+A2*a2%+…+An*an%)近似平均相对原子质量:用各种原子的质量数替换各种同位素的相对原子质量◇十字交叉法1.3 揭开原子核外电子运动的面纱一、原子结构示意图与电子式核外电子按能量高低由内层至外层分层排布(近核低、远核高),这种分层排布情况可用原子结构示意图来表示。
(◇熟记1到20号元素)第一电子层称为K层,依次为、L、M、N、O、P、Q。
元素的化学性质主要由原子的最外层电子数决定,常用小黑点或叉来表示元素原子的最外层上的电子,这种图式被称为电子式。
二、初步认识核外电子排布的规律1、各电子层最多可容纳的电子书为2n^2个(n表示电子层序数)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、原子结构学说的发展历程及原子结构模型的演变 1.古代朴素的原子观:我国战国时期的惠施认为物质是___________;我国战国时期的墨翟认 为物质___________;古希腊哲学家德谟克利特提出___________(原子是构成物质的微粒, 万物是由不可分割的原子构成的) 。 2.英国科学家___________提出近代原子学说——实心球模型: ①物质由原子组成; ②原子在化 学变化中不可再分割,它们在化学变化中保持本性不变。 3.英国科学家_______发现了______的存在,并由此提出了原子的“葡萄干面包”模型:原子的 正电荷均匀分布在整个原子的球体内,电子则均匀地分布在这些正电荷之间。 注: (1)德国物理学家威廉•康拉德•伦琴 1895 年发现了___________; (2)法国物理学家安东尼•亨利•贝克勒尔确认了铀盐和纯铀具有___________; 电子的发现和元素的放射性现象说明原子是可再分的。 4.英国物理学家_________提出了原子结构的行星式模型: 带负电的电子绕着带正电的原子核运 动,就像行星绕太阳运转一样。 卢瑟福的α 粒子散射实验
4
17.两种微粒含有相同的质子数和电子数,这两种微粒可能是___________________(填序号) ①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子; ④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子; ⑦两种不同阳离子;⑧两种不同阴离子; ⑨一种阴离子和一种阳离子. 18..用正确的序号填空:①12C、13C、14C; ③H2O 和 D2O;④CH3CH2OH 与 CH3OCH3; 互为同位素的是______________________; 互为同素异形体的是_________________; 互为同分异构体的是_________________; 互为同系物的是________________________. 19.已知 A、B、C、D 均是 1~20 号元素,核电荷数依次增大。其中 B、C、D 的内层电子数为 10,原子核外只有一个未成对电子.A 原子核外有 2 个未成对电子. (1)D 离子的电子式是_______________________; (2)C 原子的核外电子排布为_______________________; (3)B 离子的结构示意图是_______________________; (4)A 元素的元素符号为_______________________. 20.(1)已知 A.质子数,B.中子数,C.核外电子数,D.最外层电子数,用序号回答下列问题. ①原子种类由_________________决定; ②元素种类由_________________决定; ③元素的化合价由______________决定. 18 18 1 (2) 2.0g 由 1 该水分子的物质的量为___________, 含中子数为__________; 1 ������ 和 8 ������构成的水 1 ������ 2 8 ������, (3)核内中子数为 N 的 R2+,质量数为 A,则该离子的核外电子数为____________________ ②红磷和白磷; ⑤CH4 和 CH3CH3;
5
H2O⇌NH3•
ClO3+6HCl→K
D.2Na2O2+2H2
O→4NaOH+
7.某金属 R 原子的质量数为 54,已知 R 离子含有 28 个中子,23 个电子,由这种离子组成的化 合物的化学式正确的是( A.RCl2 B.R3O4 )
C.R(OH)3 D.HRO3
﹣
8.下列微粒中与 OH 具有相同质子数和电子数的是( A.Na+ B.NH4+ C.Ne D.F
﹣
数为( A.
) B. C. D.
11.关于等物质的量的 12C 和 14C 的叙述中正确的是__________________(填序号) ①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量; ⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成 CO2 时,消耗氧气的量相同;⑧几乎相 同的化学性质. 12.元素 X 形成的气态 X2 的分子共有三种,其相对分子质量依次为 158、160、162,此三种分 子的物质的量之比为 9:6:1,据此,下列说法中正确的是( A.X 有三种同位素 B.其中一种同位素的质量为 80 C.X2 的平均相对分子质量为 159 D.质量数为 79 的同位素的原子百分数为 50% 13.已知 X、Y 均为 1~18 号之间的元素,X、Y 可形成化合物 X2Y 和 X2Y2,又知 Y 的核电荷 数大于 X 的核电荷数,则两种元素的核电荷数之和为( A.19B.18 C.27 D.9 14.放射性同位素在许多方面均有重要应用,下列选项中可能用到放射性同位素的有( ①育种;②研究化学反应机理;③保存食物;④探测金属器件缺陷;⑤治疗肿瘤. A.只有①③⑤B.只有②④⑤ C.只有①②④ D.①②③④⑤ 15.在粒子 NH3D+中,电子数、质子数和中子数之比为( ) A.10:7:11 B.11:11:8 C.10:11:8 D.11:8:10 16.由 1-18 号非金属元素 X 和元素 Y 组成的化合物 Y2X3,已知 X 的原子序数为 n,则 Y 的原子 序数不可能是( ) A.n-3 B.n-1 C.n+5 D.n+2 ) ) )
A
1
ቤተ መጻሕፍቲ ባይዱ
4.构成原子或离子粒子间的数量关系 ①质量数(A)=质子数(Z)+中子数(N) ②原子中:核电荷数(Z)=质子数=原子序数=核外电子数 ③阳离子中:核电荷数(Z)=质子数=原子序数=核外电子数+离子电荷数 ④阴离子中:核电荷数(Z)=质子数=原子序数=核外电子数-离子电荷数 5.概念辨析:
概念 元素 核素 同素异形体 同位素 同分异构体 同系物 定义 存在范围 在同一类原子之间 在原子之间 在无机物单质之间 在原子之间 在有机物化合物之间 在有机物化合物之间
质子 Z个 原子核 原子 中子 (A-Z)个 核外电子 Z个
注:1897 年,英国物理学家___________发现了电子;1919 年,英国物理学家___________发现 了质子;1932 年,英国物理学家___________发现了中子。 3.质量数:忽略电子的质量,将原子核内所有的质子和中子相对质量取近似整数值,加起来所 得的数值,叫做质量数,用符号 A 表示( Z X) 。
6.相对原子质量: 12 ①原子的相对原子质量:该原子本身的质量与 C 原子质量的 1/12 的比值。 ②元素的相对原子质量: 该元素的各种同位素的_____________与其相应的原子百分比的乘积所 得的平均值。元素的相对原子质量就是指元素的平均相对原子质量。 ③元素的近似相对原子质量: 该元素的各种同位素的_________与其相应的原子百分比的乘积所 得的平均值。 注:原子的质量数≠原子的相对原子质量。 7.离子: 原子或原子团得失电子后形成的带电微粒称为离子。 带正电荷的离子称为__________, + 2+ 2+ + 2带负电荷的离子称为____________。常见离子符号:Na ,Cu ,Fe ,Cl ,NH4 ,OH ,SO4 . 三、核外电子排布规律 1.核外电子是按能量高低由里向外,分层排布的,从里到外依次是 K-L-M-N-O-P-Q„,且电子 能量依次增高。 2.各电子层最多容纳的电子数为_____________个; 3.最外层电子数不得超过_____________个,倒数第二层电子数不得超过_____________个, 倒数第三层电子数不得超过_____________个。 4.“8 电子稳定结构” :指的是粒子的最外层电子数为 8 的结构。 四、核外电子排布的表示方法: (1)原子结构示意图:用来表示元素原子核电荷数和核外电子按电子层排布情况的示意图。 分别写出钾和钙的原子结构示意图:_________、_______________ (2)电子式:元素的化学性质主要由原子的______________决定,我们常用小黑点(或ⅹ)来 表示原子的___________的电子。分别写出下列粒子的电子式: + + Na_________、Na __________、Cl__________、Cl __________、NH4 __________、OH _________
实验现象 绝大多数的α 粒子不发生偏转 少数α 粒子发生了较大偏转 极少数α 粒子反弹回来 实验结论
注: α 射线即为___________; 射线为波长短、 穿透力强的___________; 射线即为___________。 5.丹麦物理学家玻尔的原子结构轨道模型:他引入量子论观点,提出原子核外,电子不是随 意占据在原子核的周围,而是在固定的层面上运动,当电子从一个层面跃迁到另一个层面时, 原子便吸收或释放能量。 6.现代原子结构学说——电子云模型:用电子在给定时间内在空间的几率分布的图像来描述 电子的运动,这些图像就是电子云。电子出现几率密度大的地方,电子云“浓密”一些;几率 密度小的地方,电子云“稀薄”一些。但电子云的正确意义并不是说电子真的像云那样分散, 电子云只是一种几率云。 二、原子结构和相对原子质量 1.元素:具有相同核电荷数(即质子数)的同一类原子叫做元素。 质子数=___________=___________=___________ 2.原子的构成:
2
习题训练
1.下列各组粒子中质子数和电子数均相同的是() A.CH4、H2O、Na+ B.F2、Ar、HCl + + C.H3O 、NH4 、Na D.O2-、Mg2+、Ne 2.已知自然界氧的同位素有 16O、17O、18O,氢的同位素有 H、D、T,从水分子的原子组成来 看,自然界的水一共有() A.9 种 B.12 种 C.15 种 D.18 种 3.有一种新型分子 N60,形状类似于“分子足球”C60,下列说法正确的是() A.N60 的摩尔质量为 720 B.N60 和 14N 都是氮的同位素 C.N60 是一种新型化合物 D.N60 与 N2 互为同素异形体 3 4.某单质其密度为 5g/cm ,用 X 射线研究表明:在棱长为 1×10-7cm 的立方体中含有 20 个原 子,则此元素的原子相对质量最接近() A.32 B.65 C.120 D.150 5.下列说法不正确的是_____________________(填序号)①④⑤ ①质子数相同的粒子一定是同一种元素; ②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子; ③电子数相同的粒子不一定是同种元素; ④一种元素不可以形成不同的单质; ⑤某元素的相对原子质量取整数值就是质量数. 6.同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( A.2KMnO4+5H2 B.NH4Cl+ C.K O2+3H2SO4→K2SO4+2MnSO4+5 H2O+HCl Cl+3Cl2↑+3H2O O2↑ O2↑+8H2O )
