临床化学质控血清产品技术要求yuepu
临床生物化学检验质量控制流程图

临床生物化学检验质量控制流程临床生化检验室全面质量控制(TQC)是利用现代科学管理的方法和技术检测分析过程中的误差,控制与分析有关的各个环节,确保实验结果的准确可靠。
一、分析前质量保证(一) 人员的素质和稳定性凡进入生化专业的工作人员上岗前应培训,了解本专业的实验室工作流程,掌握各种设备的操作、维护、保养,熟练应用实验室LIS系统,掌握各项目检测原理及影响因素,熟练应用比对方法。
(二) 实验室的设置和工作环境实验室布局合理,环境整洁,仪器间应进行防尘处理,温度15~30°C,相对湿度<65%。
(三) 实验仪器的质量保证1. 分析仪器的性能检查1.1 波长校正在更换光源灯、重新安装、搬运或检修后,以及仪器工作不正常时,都要进行波长校正。
就是正常工作的仪器,每隔一个月也要检查一次,这样才能保证读数与通过样品的波长符合,保证仪器的最大灵敏度。
1.2 线性检查包括仪器线性及测定方法线性两个方面的检查。
线性误差表现为溶液的浓度与吸光度不成线性关系,出现正偏离或负偏离的现象。
这种偏离,一是溶液本身不符合比耳定律,此现象叫做化学偏离;二是仪器本身各种因素的影响,使吸光度测定值与浓度之间不成线性关系,这种现象叫做仪器偏离。
仪器偏离的因素很多,如杂光、有限宽带、检测器噪声、环境条件的变化、波长的变动、比色杯的误差、辐射光的非平行性、检测器本身的非线性等。
1.3 稳定性检查当电源电压在220~230V围变化时,仪器读数漂移不应超过透光度标尺上限值的±1.5%。
在电源电压不变的条件下,在3分钟其读数漂移不应超过标尺上限值的±0.5%。
1.4 重复性检查在波长、工作状态、电源电压、比色杯等合格的前提下,可进行重复性检查。
用重铬酸钾溶液(30、60、90、190mg/L)在波长440nm,将各浓度管连续测3~5次,各浓度管中最大差值误差小于1%T为合格。
1.5 灵敏度检查将重铬酸钾液配制成30和32.5mg/L及120和122.5mg/L的4种应用液(浓度差两组各为2.5mg/L)。
C—反应蛋白(CRP)质控品产品技术要求mairui
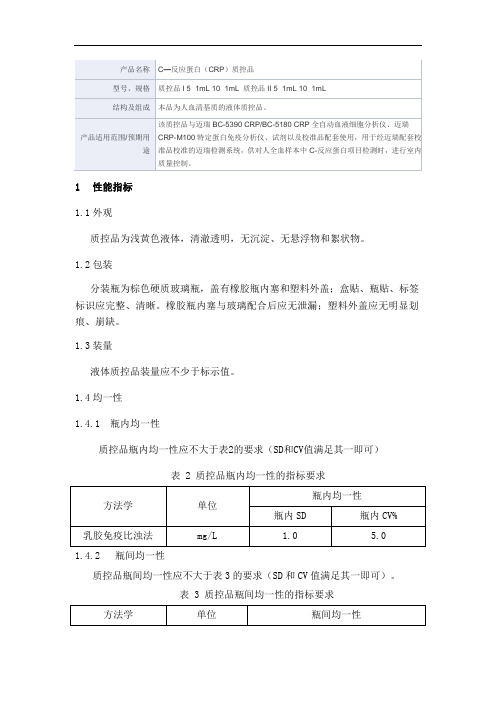
1性能指标
1.1外观
质控品为浅黄色液体,清澈透明,无沉淀、无悬浮物和絮状物。
1.2包装
分装瓶为棕色硬质玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
1.3装量
液体质控品装量应不少于标示值。
1.4均一性
1.4.1瓶内均一性
质控品瓶内均一性应不大于表2的要求(SD和CV值满足其一即可)
表 2 质控品瓶内均一性的指标要求
1.4.2瓶间均一性
质控品瓶间均一性应不大于表3的要求(SD和CV值满足其一即可)。
表 3 质控品瓶间均一性的指标要求
1.5参考值及参考范围
每批质控品均应提供本批产品的参考值和参考范围表。
经迈瑞校准品校准的血液细胞分析仪及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
1.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对质控品中HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
生化多项质控品产品技术要求

生化多项质控品
结构组成:
本质控品是以人血清为基质,并添加了特定项目的生物源性物质和化学成分,具体内容见下
预期用途:,用于以下生化项目的室内质量控制:肌酸激酶MB同工酶、腺苷脱氨酶、天门冬氨酸氨基转移酶线粒体同工酶、5'-核苷酸酶、甘氨酰脯氨酸二肽氨基肽酶、前白蛋白、糖化血红蛋白、N-乙酰-β-D-氨基葡萄糖苷酶、血管紧张素转化酶、同型半胱氨酸、超氧化物歧化酶。
2.1 外观和性状
2.1.1 外包装完整无破损;中文包装标签应清晰、准确、牢固。
2.1.2 本质控品应为红色冻干粉;复溶后应为红色液体,无浑浊,无未溶解物。
2.2 可接受区间/值
各项目在其测量系统上的测定结果应在可接受区间内。
2.3 均匀性
2.3.1 瓶内均匀性
)应不大于10%。
各项目的瓶内均匀性变异系数(CV
瓶内
2.3.2 瓶间均匀性
)应不大于10%。
各项目的瓶间均匀性变异系数(CV
瓶间
2.4 稳定性
2.4.1 复溶稳定性
复溶后的质控品密封保存于2 ℃~8 ℃、避光环境中,可稳定3天;复溶后的质控品密封保存于不高于-18℃、避光环境中,可稳定10天。
在稳定期内赋值结果的变化趋势不显著。
2.4.2 效期稳定性
质控品保存于2 ℃~8 ℃,有效期为24个月。
在有效期内赋值结果的变化趋势不显著。
临床化学试剂(盒)技术审评规范标准

临床化学体外诊断试剂(盒)产品技术审评规范(2011版)根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)的要求并结合临床化学体外诊断试剂(盒)产品的特点,为规范临床化学体外诊断试剂(盒)(以下简称试剂(盒))产品的技术审评工作,特制定本规范。
一、适用范围本规范适用于采用分光光度法原理,利用全自动、半自动仪器或分光光度计,在医学实验室进行临床化学项目定量检验所使用的体外诊断试剂(盒)。
依据《体外诊断试剂注册管理办法》(试行)临床化学体外诊断试剂(盒)管理类别为Ⅱ类。
二、技术审查要点(一)试剂(盒)命名的原则试剂(盒)名称由三部分组成:第一部分:被测物质的名称;第二部分:用途;如测定试剂盒;第三部分:方法或原理。
例:葡萄糖测定试剂盒(葡萄糖氧化酶法)(二)试剂(盒)的结构组成试剂(盒)的组成形式:单试剂,双试剂,多试剂;试剂盒的性状:干粉或液体。
(三)工作原理试剂(盒)通过各自不同的反应原理,最终以比色、免疫比浊或速率方法在具有分光光度系统的仪器上,利用Lamber-Beer定律,即物质对单色光吸收的强弱与吸光物质的浓度(c)和液层厚度(b)间的关系的定律,对被测物质进行定量分析。
(四)产品适用的相关标准试剂(盒)适用以下相关标准:1.GB/T 191-2008 包装储运图示标志;2.YY/T 0316-2008 医疗器械风险管理对医疗器械的应用;3.YY 0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号;注:以上标准适用最新版本。
(五)产品的预期用途试剂(盒)的预期用途应体现为对临床样本成分的定量测量。
(六)产品的主要技术指标1、外观目测检查,符合生产企业规定的正常外观要求。
(一般要求试剂无杂质、无絮状物,外包装完整无破损)。
2、净含量用通用量具测量,液体试剂的净含量应不少于标示值。
3、试剂空白3.1 试剂空白吸光度用指定空白样品测试试剂(盒),在测试主波长下,记录测试启动时的吸光度(A1)和约5分钟(T)后的吸光度(A2),A2测试结果即为试剂空白吸光度测定值,应符合生产企业给定范围。
临床化学校准血清产品技术要求乐普(北京)诊断技术

临床化学校准血清适用范围:与本公司生产的试剂盒配套使用,用于α-羟丁酸脱氢酶、白蛋白、碱性磷酸酶、丙氨酸氨基转移酶、α-淀粉酶、天门冬氨酸氨基转移酶、二氧化碳、总胆汁酸、直接胆红素、总胆红素、钙、胆固醇、胆碱酯酶、肌酸激酶、肌酐、谷氨酰氨基转移酶、葡萄糖、铁、乳酸脱氢酶、镁、无机磷、总蛋白、甘油三酯、尿素、尿酸、锌共26项检测系统的校准。
1.1 包装规格1×5mL;2×5mL;5×5mL;20×5mL。
1.2 主要组成成分冻干粉,单水平,人血清基质、防腐剂(0.1%)、冻干保护剂(2%)和稳定剂(0.1mol/L)。
具体项目及靶值范围见表1:表1 主要组成成分校准品靶值批特异,详见靶值单。
2.1 性状浅黄色至黄色冻干粉,复溶后为浅黄色至黄色透明液体。
2.2 水分含量采用烘干法进行测定,水分含量不超过3%。
2.3 量值溯源根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》中有关规定提供校准品的来源,赋值过程及测量不确定度等内容,具体项目及溯源信息见表2:表2 溯源信息2.4 赋值结果及其不确定度的表示方式赋值结果±扩展不确定度2.5 正确度使用该校准品校准后测量各项目的有证参考物质或制造商溯源文件声称的参考│≤1。
具体项目及参考物质信息见表3:物质,量值传递的正确度应符合│En表3 参考物质信息2.6 均匀性2.6.1 瓶内均匀性赋值结果的瓶内均匀性(变异系数)应不大于10%。
2.6.2 瓶间均匀性赋值结果的瓶间均匀性(变异系数)应不大于10%。
2.7 稳定性2.7.1 复溶稳定性本品复溶后,2~8℃可保持7天。
-20℃冰冻保持可稳定28天。
在稳定期内赋值结果的变化趋势不显著。
2.7.2 效期稳定性在2℃~8℃条件下贮存24个月,稳定期内赋值结果的变化趋势不显著。
临床试验产品技术要求

临床试验产品技术要求是指用于临床试验的药物、医疗器械或其他医疗设备的技术指标和要求。
这些产品在进入临床试验阶段之前,通常已经经过了一定的实验室研究和临床前试验,以确保其安全、有效和可控。
下面是对临床试验产品技术要求的详细阐述:药物技术要求:1. 成分和配方:药物应包含其说明书中所列出的所有成分,且配比应准确。
任何新的成分或改变的配方都应经过充分的实验室研究和临床前试验,以证明其安全性和有效性。
2. 质量控制:药物的生产过程应严格遵循质量控制系统,确保每个批次的产品都符合规定的质量标准。
这些标准可能包括纯度、有效性、安全性等方面的要求。
3. 稳定性:药物应具有确定的有效期,并在规定的条件下保持稳定。
生产商应提供药物在各种条件下的稳定性数据,以支持其在临床试验期间的存储和分发。
4. 剂型和剂量:药物应按照规定的形式和剂量进行生产和分发。
任何改变剂型或剂量的决定都应经过充分的实验室研究和临床前试验,以证明其对安全性和有效性的影响。
5. 临床前试验数据:药物在进入临床试验之前,应提供充分的临床前试验数据,包括实验室研究、动物试验和毒理学测试等方面的结果。
这些数据应足以支持其进入临床试验的申请。
医疗器械技术要求:1. 性能指标:医疗器械应符合规定的性能指标,包括精度、稳定性、耐用性等方面的要求。
这些指标应在设计和生产过程中得到充分考虑和验证。
2. 质量控制和测试:医疗器械的生产过程应严格遵循质量控制系统,确保每个批次的产品都符合规定的质量标准。
生产商应提供完整的测试报告和合格证明文件。
3. 适用范围和禁忌症:医疗器械的使用范围和禁忌症应在说明书和标签中明确说明。
任何改变适用范围或添加禁忌症的决定都应经过充分的实验室研究和临床前试验,以证明其对安全性和有效性的影响。
4. 临床前试验数据:医疗器械在进入临床试验之前,应提供充分的临床前试验数据,包括生物相容性、安全性和性能等方面的结果。
这些数据应足以支持其进入临床试验的申请。
临床化学脂类质控血清产品技术要求yuepu
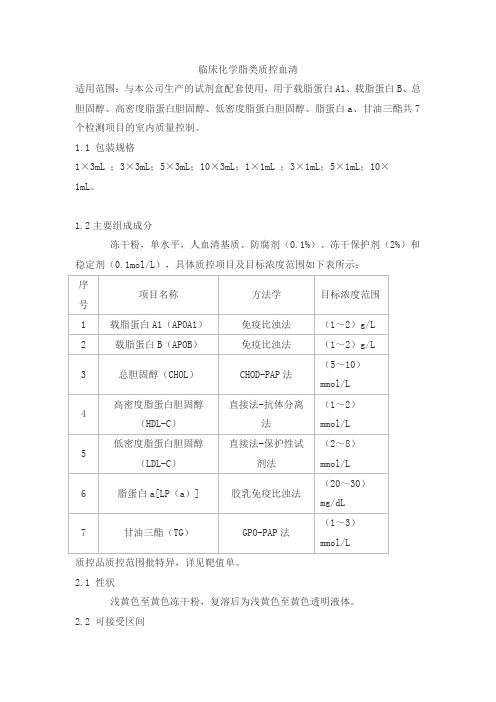
临床化学脂类质控血清
适用范围:与本公司生产的试剂盒配套使用,用于载脂蛋白A1、载脂蛋白B、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、脂蛋白a、甘油三酯共7个检测项目的室内质量控制。
1.1 包装规格
1×3mL ;3×3mL;5×3mL;10×3mL;1×1mL ;3×1mL;5×1mL;10×
1mL。
1.2主要组成成分
冻干粉,单水平,人血清基质、防腐剂(0.1%)、冻干保护剂(2%)和稳定剂(0.1mol/L),具体质控项目及目标浓度范围如下表所示:
质控品质控范围批特异,详见靶值单。
2.1 性状
浅黄色至黄色冻干粉,复溶后为浅黄色至黄色透明液体。
2.2 可接受区间
质控品各项目测值应在质控范围内。
2.3 瓶间均匀性
使用配套试剂盒测定,瓶间变异系数(CV)应不超过10%。
2.4 稳定性
2.4.1 效期稳定性
原包装试剂盒在2℃~8℃密封避光保存条件下有效期为36个月。
在稳定期内赋值结果的变化趋势不显著。
2.4.2 复溶稳定性
质控品复溶后在2℃~8℃密闭避光保存,稳定期为7天;-20℃冰冻保存稳定期为28天。
在稳定期内赋值结果的变化趋势不显著。
临床化学试剂(盒)技术审评规范

临床化学试剂(盒)技术审评规范临床化学体外诊断试剂(盒)产品技术审评规范(2011版)根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)的要求并结合临床化学体外诊断试剂(盒)产品的特点,为规范临床化学体外诊断试剂(盒)(以下简称试剂(盒))产品的技术审评工作,特制定本规范。
一、适用范围本规范适用于采用分光光度法原理,利用全自动、半自动仪器或分光光度计,在医学实验室进行临床化学项目定量检验所使用的体外诊断试剂(盒)。
依据《体外诊断试剂注册管理办法》(试行)临床化学体外诊断试剂(盒)管理类别为Ⅱ类。
二、技术审查要点(一)试剂(盒)命名的原则试剂(盒)名称由三部分组成:第一部分:被测物质的名称;第二部分:用途;如测定试剂盒;第三部分:方法或原理。
例:葡萄糖测定试剂盒(葡萄糖氧化酶法)(二)试剂(盒)的结构组成试剂(盒)的组成形式:单试剂,双试剂,多试剂;试剂盒的性状:干粉或液体。
(三)工作原理试剂(盒)通过各自不同的反应原理,最终以比色、免疫比浊或速率方法在具有分光光度系统的仪器上,利用Lamber-Beer定律,即物质对单色光吸收的强弱与吸光物质的浓度(c)和液层厚度(b)间的关系的定律,对被测物质进行定量分析。
(四)产品适用的相关标准试剂(盒)适用以下相关标准:1.GB/T 191-2008 包装储运图示标志;2.YY/T 0316-2008 医疗器械风险管理对医疗器械的应用;3.YY 0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号;注:以上标准适用最新版本。
(五)产品的预期用途试剂(盒)的预期用途应体现为对临床样本成分的定量测量。
(六)产品的主要技术指标1、外观目测检查,符合生产企业规定的正常外观要求。
(一般要求试剂无杂质、无絮状物,外包装完整无破损)。
2、净含量用通用量具测量,液体试剂的净含量应不少于标示值。
3、试剂空白3.1 试剂空白吸光度用指定空白样品测试试剂(盒),在测试主波长下,记录测试启动时的吸光度(A1)和约5分钟(T)后的吸光度(A2),A2测试结果即为试剂空白吸光度测定值,应符合生产企业给定范围。
质控血清靶值说明书

质控血清靶值说明书【产品名称】通用名称:质控血清英文名称:Assayed Human Multi-sera【包装规格】货号:HEl532规格:20×5 ml批次:909UE效期:2021-01-28【预期用途】该类质控血清可用在多种型号的全自动生化分析仪上对临床化学分析项目进行准确度的评价。
【检验原理】质控血清分为两个水平,水平2和水平3。
我们为所列分析物提供两个水平范围的靶值和参考范围。
该产品为水平3。
【主要组成成份】试剂成分:人血清基质【储存条件及有效期】1.试剂的稳定性开封:冷冻贮存( 2-8℃)。
复溶血清25℃稳定8小时,4℃稳定7天,-20℃冻时至少稳定1个月(见局限性)。
未开封:冷冻贮存( 2-8℃)。
每个独立试剂瓶都可稳定保存到有效期。
2.有效期:四年【适合机型】雅培AEROSET®、Bayer ADVIA l650®、雅培Architect c8000/ei8200®、BAYER RA500/1000/2000/XT/OPERA®、Bayer Ciba 550 Express®、COBAS INTEGRA®、COBAS MIRA®、DADE DIMENSION®、HITACHI SERIES®、JOHNSON AND JOHNSON VITROS®、Konelab 20/30/60®、OLYMPUS AU400/500/600/800®、SYNCHRON CX4/5/7/9/LX20、VITALAB SELECTRA®等全自动生化分析仪。
【检验方法】质控血清处于冻干状态。
1. 在20℃至25℃,使用5 m1蒸馏水将每瓶冻干血清复溶。
密封使用前静置30分钟。
轻微搅动使内容物完全溶解。
避免形成泡沫。
不可摇动。
2. 参考独立分析仪实际应用的质控范围。
生化类复合质控品产品技术要求中生北控

生化类复合质控品适用范围:本产品在临床医学上用于临床检验实验室中生化检测项目的室内质量控制,检测临床化学分析仪测定的准确度和精密度。
具体项目为:α1-酸性糖蛋白(AAG)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、碱性磷酸酶(ALP)、α-淀粉酶(AMY)、胰淀粉酶(P-AMY)、载脂蛋白A1(APOA1)、载脂蛋白B (APOB)、抗链球菌溶血素O(ASO)、天门冬氨酸氨基转移酶(AST)、钙(Ca)、C-反应蛋白(CRP)、超敏C-反应蛋白(HS-CRP)、氯(Cl)、胆碱酯酶(CHE)、胆固醇(CHO)、补体C3(C3)、补体C4(C4)、肌酸激酶(CK)、肌酸激酶MB同工酶(CK-MB)、酶法肌酐(CreE)、苦味酸法肌酐(CreK)、重氮盐法直接胆红素(D.Bili)、钒酸盐法直接胆红素(D.Bili)、铁蛋白(Ferritin)、葡萄糖(Glu-GOD)、葡萄糖(Glu-HK)、谷氨酸脱氢酶(GLDH)、γ-谷氨酰基转移酶(GGT)、a-羟丁酸脱氢酶(HBDH)、高密度脂蛋白胆固醇(HDL-C)、结合珠蛋白(HP)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M (IgM)、铁(Iron)、乳酸脱氢酶(LDH)、低密度脂蛋白胆固醇(LDL-C)、锂(Li)、脂肪酶(Lip)、镁(Mg)、磷(P)、钾(K)、前白蛋白(PA)、钠(Na)、重氮盐法总胆红素(T.Bili)、钒酸盐法总胆红素(T.Bili)、总蛋白(TP)、转铁蛋白(TF)、甘油三酯(TG)、尿素(Urea)、尿酸(UA)。
1.1规格冻干粉型5mL×1(水平1);3mL×1(水平1);5mL×1(水平2);3mL×1(水平2);5mL×2(水平1,水平2);5mL×6(水平1,水平2);3mL×2(水平1,水平2);3mL×6(水平1,水平2)。
质控血清靶值说明书

质控血清靶值说明书货号:HN1530 规格:20 x 5ml批号:1255UN 效期:2021-10-28【预期用途】该类质控血清可用在多种型号的全自动生化分析仪上对临床化学分析项目进行质量控制的评价。
【检验原理】质控血清分为两个水平,水平 2 和水平 3。
我们为所列分析物提供两个水平范围的靶值和参考范围。
该产品为水平 2。
【主要组成成份】试剂成分:人血清基质【储存条件及有效期】1. 试剂的稳定性开封:冷冻贮存( 2-8℃)。
复溶血清 25℃稳定 8 小时,4℃稳定 7 天,-20℃冻时至少稳定1 个月(见局限性)。
未开封:冷冻贮存( 2-8℃)。
每个独立试剂瓶都可稳定保存到有效期。
2. 有效期:四年。
【适合机型】雅培AEROSET®、Bayer ADVIA l650®、雅培Architect c8000/ei8200®、BAYERRA500/1000/2000/XT/OPERA®、Bayer Ciba 550 Express®、COBAS INTEGRA®、COBAS MIRA®、DADE DIMENSION®、HITACHI SERIES®、JOHNSON AND JOHNSON VITROS®、Konelab 20/30/60®、OLYMPUS AU400/500/600/800®、SYNCHRON CX4/5/7/9/LX20、VITALAB SELECTRA®等全自动生化分析仪。
【检验方法】质控血清处于冻干状态。
1. 在 20℃至 25℃,使用 5 m1 蒸馏水将每瓶冻干血清复溶。
密封使用前静置 30 分钟。
轻微搅动使内容物完全溶解。
避免形成泡沫。
不可摇动。
2. 参考独立分析仪实际应用的质控范围。
3. 冷冻任一未使用的原料。
重新使用前,将内容物完全混合。
【所需未提供的产品】容量吸管【赋值】提交给参考实验室的每批实验用人体血清根据国际参考标准进行赋值。
质控血清靶值说明书

质控血清靶值说明书【产品名称】通用名称:质控血清英文名称:Assayed Human Multi-sera【包装规格】货号:HNl530规格:20×5 ml批次:1282UN效期:2022-01-28【预期用途】该类质控血清可用在多种型号的全自动生化分析仪上对临床化学分析项目进行质量控制的评价。
【检验原理】质控血清分为两个水平,水平2和水平3。
我们为所列分析物提供两个水平范围的靶值和参考范围。
该产品为水平2。
【主要组成成份】试剂成分:人血清基质【储存条件及有效期】1. 试剂的稳定性开封:冷冻贮存( 2-8℃)。
复溶血清25℃稳定 8 小时,4℃稳定 7 天,-20℃冻时至少稳定 1 个月(见局限性)。
未开封:冷冻贮存( 2-8℃)。
每个独立试剂瓶都可稳定保存到有效期。
2. 有效期:四年。
【适合机型】雅培AEROSET®、Bayer ADVIA l650®、雅培Architect c8000/ei8200®、BAYER RA500/1000/2000/XT/OPERA®、Bayer Ciba 550 Express®、COBAS INTEGRA®、COBAS MIRA®、DADE DIMENSION®、HITACHI SERIES®、JOHNSON AND JOHNSON VITROS®、Konelab20/30/60®、OLYMPUS AU400/500/600/800®、SYNCHRON CX4/5/7/9/LX20、VITALAB SELECTRA®等全自动生化分析仪。
【检验方法】质控血清处于冻干状态。
1.在20℃至25℃,使用5 m1蒸馏水将每瓶冻干血清复溶。
密封使用前静置30分钟。
轻微搅动使内容物完全溶解。
避免形成泡沫。
不可摇动。
2.参考独立分析仪实际应用的质控范围。
质控血清的测定及质量控制

如何去评价分析中的质量控制呢?
性能评价
精密度 准确度 特异性 干扰因素 分析灵敏度 检验结果的报告范围 参考范围
室内质量控制 室间质量控制
检测前、检测中、检测后 卫生部室间质评
室内质控
检测和控制常规工作的精密度和准确度,提高 常规工作中天内和天间标本检测的一致性。
室内质控
质控血清
比例质控规则(m of n)L:常用(2 of 3)2s规则, 即连续的三个质控物测定值中有两个质控测定值超 过 x + 2s或x - 2s质控限。
Levey-Jennings质控图
多规则质控方法:
选择两个或多个质控规则,以提高误差检出概率和降低假 失控概率,多规则质控方法由Westgard等推荐使用。
医学检验专业人才应具备的素质内涵信息化时代对检验人员素质有了更高的要求检验医学仪器的发展新技术的应用信息技术与实验的结合这都给我们带来新的挑战而检验专业人员的基本素养是胜任检验工作的基本条件
质控血清的测定及质量控制
实验目的
掌握:质量控制的概念,分类及应用,质控血清 在临床生物化学质量控制中的应用。
熟悉:质控血清的种类,室内质控图的绘制及失 控分析。
了解:室内质控失控的处理。
临床检验质量控制
质量控制(quality control, QC)的目的就是检测 分析过程中的误差,控制与分析有关的各个环节, 确保实验结果的准确可靠。
临床检验质量控制
分析前:人员培训、实验室设置、实验仪器的质量保
6.不断吸取和应用新知识
临床检验的方法和检测项目不断更新,使得临床检验在 医学中的作用越来越显得重要,同时不但要保证质量,而且 要求开展更多更深层次的检验项目。
5‘-核苷酸酶质控品产品技术要求中生北控

5‘-核苷酸酶质控品
适用范围:本产品与本公司5’-核苷酸酶试剂盒配套使用,用于临床检验实验室内5’-核苷酸酶项目的质量控制。
1.1规格
冻干粉型: 1mL×1;3mL×1。
1.2规格划分说明
根据复溶体积划分规格。
1.3 主要组成成分
本产品以牛血清为基质,并添加了5’-核苷酸酶。
主要成分为5’-核苷酸酶,定值范围:60U/L~120U/L(每批定值)。
2.1 外观
质控品为白色冻干粉,复溶后为无色或浅黄色透明溶液,无混浊、无未溶解物,外包装完整无破损。
2.2 质控品定值有效性
测定结果应在质控范围内。
2.3 批内瓶间差
批内瓶间差的变异系数(CV)应≤5%。
2.4稳定性
2.4.1效期稳定性
原包装质控品在2℃~8℃避光贮存,有效期为12个月。
在质控品有效期满后3个月内,质控品性能应符合2.1、2.2、2.3要求。
2.4.2复溶稳定性
复溶后质控品,在2℃~8℃密闭避光保存,稳定期为5天;在-25℃~-15℃密闭避光保存,稳定期为35天。
在稳定期满后1天内,质控品性能应符合2.1、2.2、2.3要求。
生化类复合质控品产品技术要求zhongshengbeikong

生化类复合质控品适用范围:本产品在临床医学上用于临床检验实验室中生化检测项目的室内质量控制,检测临床化学分析仪测定的准确度和精密度。
具体项目为:α1-酸性糖蛋白(AAG)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、碱性磷酸酶(ALP)、α-淀粉酶(AMY)、胰淀粉酶(P-AMY)、载脂蛋白A1(APOA1)、载脂蛋白B (APOB)、抗链球菌溶血素O(ASO)、天门冬氨酸氨基转移酶(AST)、钙(Ca)、C-反应蛋白(CRP)、超敏C-反应蛋白(HS-CRP)、氯(Cl)、胆碱酯酶(CHE)、胆固醇(CHO)、补体C3(C3)、补体C4(C4)、肌酸激酶(CK)、肌酸激酶MB同工酶(CK-MB)、酶法肌酐(CreE)、苦味酸法肌酐(CreK)、重氮盐法直接胆红素(D.Bili)、钒酸盐法直接胆红素(D.Bili)、铁蛋白(Ferritin)、葡萄糖(Glu-GOD)、葡萄糖(Glu-HK)、谷氨酸脱氢酶(GLDH)、γ-谷氨酰基转移酶(GGT)、a-羟丁酸脱氢酶(HBDH)、高密度脂蛋白胆固醇(HDL-C)、结合珠蛋白(HP)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M (IgM)、铁(Iron)、乳酸脱氢酶(LDH)、低密度脂蛋白胆固醇(LDL-C)、锂(Li)、脂肪酶(Lip)、镁(Mg)、磷(P)、钾(K)、前白蛋白(PA)、钠(Na)、重氮盐法总胆红素(T.Bili)、钒酸盐法总胆红素(T.Bili)、总蛋白(TP)、转铁蛋白(TF)、甘油三酯(TG)、尿素(Urea)、尿酸(UA)。
1.1规格冻干粉型5mL×1(水平1);3mL×1(水平1);5mL×1(水平2);3mL×1(水平2);5mL×2(水平1,水平2);5mL×6(水平1,水平2);3mL×2(水平1,水平2);3mL×6(水平1,水平2)。
定值多项质控血清产品技术要求jiuqiang

定值多项质控血清适用范围:该产品与本公司生产的试剂盒配套使用,用于临床实验室内部的质量控制。
本产品所含项目为:白蛋白、总蛋白、胆汁酸、直接胆红素、总胆红素、肌酐、葡萄糖、尿素、尿酸、总胆固醇、甘油三酯、碱性磷酸酶、γ-谷氨酰转肽酶、胆碱酯酶、谷丙转氨酶、谷草转氨酶、肌酸激酶、α-羟丁酸脱氢酶、乳酸脱氢酶、α-淀粉酶、二氧化碳、钙、磷、镁、锌、铁。
1.1 包装规格见表1表1 包装规格1.2主要组成成分以人血清为基质的由正常/水平I与异常/水平II组成的冻干质控品。
主要组成见表2(其中水平I中各控制成分的浓度和活性通常在正常或参考值范围内,水平II中各控制成分的浓度和活性通常在病理或医学决定性水平范围内。
)表2主要组成成分注:不同批号质控品赋值有差异2.1 外观外包装盒应平整、无破损、文字和标识清晰;质控品为冻干粉,应密封、无泄漏;质控品复溶后应为黄色澄清透明液体,目测不得有沉淀及絮状悬浮物。
2.2 含水量冻干物水分含量:<5%。
2.3 赋值有效性测试待检质控品各个项目,测试结果均应落在标示值范围内。
2.4 瓶间精密度各项目的瓶间精密度不大于3%(其中天门冬氨酸氨基转移酶不大于5%;二氧化碳不大于5%;无机磷不大于8%)。
2.5 稳定性2.5.1 复溶稳定性复溶后质控品在2℃~8℃密封保存8h),复溶后质控品在2℃~8℃保存7天(CO2在生化分析仪上同时测试保存期末的质控品和新鲜的质控品,测试结果间的相对偏差不大于5%(其中总胆汁酸不大于3%;肌酐不大于4%;碱性磷酸酶不大于8%;锌不大于10%。
二氧化碳复溶后质控品在2℃~8℃密封保存8 h,在生化分析仪上同时测试保存期末的质控品和新鲜的质控品两个浓度水平,测试结果应不大于20%。
总胆红素、直接胆红素具有光敏性,建议血清避光保存,复溶后尽快使用。
)。
2.5.2 实时稳定性质控品在2℃~8℃储存条件下可保存36个月,在保存期末,同时测试到效期的质控品和-20℃保存的同批号质控品,测试结果间的相对偏差要求见下表。
血清七元素(铜、锌、钙、镁、铁、钾、钠)质控品产品技术要求bohui

血清七元素(铜、锌、钙、镁、铁、钾、钠)质控品适用范围:用于BH系列原子吸收光谱仪测定人体血清中铜、锌、钙、镁、铁、钾、钠元素含量时对分析方法进行质量控制的专用溶液。
1.1规格:1.0g×2支(液体)1.2主要组成成分:牛血清、铜、锌、钙、镁、铁、钾、钠溶液,具体浓度见表1。
表1 血清七元素质控品浓度的标称值(mg/L)编号铜(Cu)锌(Zn)钙(Ca)镁(Mg)铁(Fe)钾(K)钠(Na)1号 1.03 0.80 78.7 20.5 0.90 154 30602号 1.53 1.82 114.2 29.3 1.88 214 3510 2.1外观离心管应光滑,无毛刺等缺陷。
标签清晰完整不能有破损等缺陷,有少量沉淀或絮状物。
2.2装量:≥1.0g。
2.3准确性:±15%。
2.4批内差异:≤10%2.5稳定性质控品在冷冻环境(-20℃)下有效期为一年,在有效期后一个月内测量其性能应符合2.2、2.3、2.4的要求。
说明书中:【溯源性】铜(GBW080615)、锌(GBW08620)、钙(GBW(E)080118)、镁(GBW(E)080126)、铁(GBW080616)、钾(GBW(E)080125)、钠(GBW(E)080127)元素国家标准物质。
”变更为“说明书中:注:本质控品溯源至铜(GBW08615)、锌(GBW08620)、钙(GBW(E)080118)、镁(GBW(E)080126)、铁(GBW08616)、钾(GBW(E)080125)、钠(GBW(E)080127)元素国家标准物质。
产品技术要求中:附录A变更。
”;产品存储条件或者产品有效期:“产品储存条件:质控品在冷冻环境(0℃~-20℃)下,有效期为12个月。
”变更为“产品储存条件:质控品在(0℃~30℃)的环境下,有效期为6个月。
”。
(批准日期:20160824),对产品说明书和/或产品技术要求中文字的修改,但不涉及技术内容的变更:“说明书:【预期用途】用于BH系列原子吸收光谱仪测定人体血清中铜、锌、钙、镁、铁、钾、钠元素含量时对分析方法进行质量控制的专用溶液。
临床化学的控制品和校准品

临床化学的控制品和校准品在自动分光系统上使用的罗氏诊断方法的标准化和对控制品定值A. benozzi and H. Baier德国Penzberg的Roche诊断公司的标准化和质量保证部,在临床化学标准化和对校准品与控制品的定值上有30多年的经验。
以下我们介绍Roche诊断公司如何对相应产品进行定值(靶值设定)。
靶值设定:历史在1970年的早期,仅有4个内部实验室进行靶值的设定。
每个实验室在连续的4天内,用Eppendorf比色计对每个方法每天做双份测定。
共收集了32个数据。
取这些数据的算术均值设定为定值。
随着检验项目在临床化学实验室的增加,以及检验结果对患者疾病的诊断重要性的提高,对临床化学数据的质量即可靠性也越来越强调了。
“结果的可靠性”即结果的精密度和准确度。
在70年代的末期和80年代的开始,在德国还没有对靶值设定的最佳模式达成一致。
德国临床化学学会的中心参考学院(Central Reference Institution of the German Society for Clinical Chemistry)建议:由3个实验室对每个方法进行15次双份测定。
同时,医学实验室的标准化和文件(Standardixation and Documentation in medical Laboratory, INSTAND)建议:每个方法由15个实验室进行5个单次测定。
这些引起了控制血清制备厂商的极大兴趣,德国诊断厂商协会(German Diagnostics Manufacturers Association, VDGH)提出一个高效而可靠的定值测定模式,吸取了各个模式的优点。
“VDGH模式”要求每个方法至少由6个实验室做5个样品的测定。
这个6×5=30结果模式还要求同时进行“未知控制品”的检测。
只有负责靶值设定Roche诊断公司,知道“未知控制品”的定值。
所有被评估的参加实验室必须能回收这个值。
临床化学校准血清产品技术要求九强

临床化学校准血清适用范围:该产品与本公司生产的试剂盒配套使用,用于临床检测系统的校准。
本产品所含项目为:白蛋白、总蛋白、胆汁酸、直接胆红素、总胆红素、肌酐、葡萄糖、尿素、尿酸、总胆固醇、甘油三酯、碱性磷酸酶、γ-谷氨酰转肽酶、胆碱酯酶、谷丙转氨酶、谷草转氨酶、肌酸激酶、α-羟丁酸脱氢酶、乳酸脱氢酶、α-淀粉酶、二氧化碳、钙、磷、镁、锌、铁。
1.1 包装规格包装规格见表1。
表1 包装规格1.2主要组成成分以人血清为基质的(正常值与异常值)冻干粉组成。
主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品赋值有差异。
2.1 外观外包装盒应平整、无破损、文字和标识清晰;校准品为冻干粉,应密封、无泄漏;校准品复溶后应为黄色澄清透明液体,目测不得有沉淀及絮状悬浮物。
2.2 含水量冻干物水分含量:<5%。
2.3准确度采用上一级校准品校准适配的全自动生化分析仪,测试待检的校准品各个项目,测试结果与标示值的相对偏差不大于5%(其中碱性磷酸酶和二氧化碳不大于8%)。
2.4瓶间精密度各项目的瓶间精密度不大于3%(其中天冬门氨酸氨基转移酶不大于10%,二氧化碳不大于5%,锌不大于6%)。
2.5 稳定性2.5.1 复溶稳定性复溶后校准品在2℃~8℃密封保复溶后校准品在2℃~8℃保存7天(CO2存8h),在生化分析仪上同时测试保存期末的校准品和新鲜的校准品,测试结果间的相对偏差不大于5%(其中总胆汁酸不大于3%,肌酐不大于4%,碱性磷酸酶、天门冬氨酸氨基转移酶、锌不大于10%;注:总胆红素、直接胆红素具有光敏性,建议血清避光保存,复溶后尽快使用)。
2.5.2 实时稳定性校准品在2℃~8℃密封避光保存,有效期为24个月,在保存期末,同时测试到效期的校准品和-20℃冰冻保存的同批号的校准品,测试结果间的相对偏差不大于5%(其中碱性磷酸酶不大于6%,二氧化碳不大于15%,镁不大于8%)。
2.6 溯源性校准品各项目的赋值能溯源至参考物质或参考测量程序,具体见下表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床化学质控血清
适用范围:与本公司生产的试剂盒配套使用,用于α-羟丁酸脱氢酶、白蛋白、碱性磷酸酶、丙氨酸氨基转移酶、胰淀粉酶、淀粉酶、天门冬氨酸氨基转移酶、二氧化碳、总胆汁酸、直接胆红素、总胆红素、钙、总胆固醇、胆碱酯酶、肌酸激酶、肌酐、D-3羟丁酸、谷氨酰氨基转移酶、葡萄糖、铁、乳酸、亮氨酸氨基肽酶、乳酸脱氢酶、脂肪酶、镁、游离脂肪酸、无机磷、总蛋白、甘油三酯、尿素、尿酸、锌共32个检测项目的室内质量控制。
1.1 包装规格
1×5mL;6×5mL;10×5mL;20×
5mL。
1.2 主要组成成分
冻干粉,单水平,人血清基质、防腐剂(0.1%)、冻干保护剂(2%)和稳定剂(0.1mol/L),具体质控项目及目标浓度范围如下表所示:
质控品质控范围批特异,详见靶值单。
2.1 性状
浅黄色至黄色冻干粉,复溶后为浅黄色至黄色透明液体。
2.2 可接受区间
质控品各项目测值应在质控范围内。
2.3 瓶间均匀性
使用配套试剂盒测定,瓶间变异系数(CV)应不超过10%。
2.4 稳定性
2.4.1 效期稳定性
原包装试剂盒在2℃~8℃密封避光保存条件下有效期为36个月,在稳定期内赋值结果的变化趋势不显著。
2.4.2 复溶稳定性
质控品复溶后在2℃~8℃密闭避光保存,稳定期为7天;-20℃冰冻保存,稳定期为28天。
在稳定期内赋值结果的变化趋势不显著。
