AE附表1:急性药物性肝损伤因果关系评价(RUCAM)
最经典药物性肝病RUCAM量表

最经典药物性肝病RUCAM量表1994年公认的改良RUCAM量表是一种评估药物相关性肝损害的工具。
该量表考虑了多种因素,包括服药至发病时间、病程ALT峰值与正常上限之间的差值、危险因子、伴随用药、除外其他原因等。
其中,服药至发病时间和病程ALT峰值与正常上限之间的差值是评估药物相关性肝损害的重要指标。
对于肝细胞型胆汁淤积或混合型的药物相关性肝损害,如果反应前已开始服药或停药后超过30天,评价为无相关性。
如果服药至发病时间不相关,或者未知无法获得计算服药至发病时间,则无法评价。
初次治疗随后的治疗提示5~90天1~15天,可疑90天>15天。
从停药开始,可疑≤15天≤15天。
病程ALT峰值与正常上限之间的差值也是评估药物相关性肝损害的重要指标。
停药后,高度提示8天内降低>50%,提示30天内降低≥50%。
可疑在30天后不适用。
无结论没有相关资料或在30天后下降≥50%。
与药物作用相反30天后下降<50%或再升高。
如果药物仍在使用,则无结论所有情况。
危险因子包括酒精和年龄≥55岁。
如果有酒精或怀孕,则评价为+1,否则为0.如果年龄≥55岁,则评价为+1,否则为0.伴随用药也是评估药物相关性肝损害的重要指标。
如果伴随用药至发病时间不符合,则评价为无或不适用。
如果伴随用药至发病时间合适或提示,则评价为可疑。
如果伴随用药已知有肝毒性且至发病时间符合或提示,则评价为+2.如果有证据表明伴随用药至肝损,则评价为+3.除外其他原因也是评估药物相关性肝损害的重要指标。
如果近期有HAV感染、HBV感染和HSV感染,则需要排除。
如果有胆道梗阻、酗酒(AST/ALT≥2)或近期急性低血压或休克(特别有重大的心脏疾病),则需要排除一定数量的原因。
具体排除的数量根据不同情况而异,可以参考量表中的得分。
药物既往肝损报告也是评估药物相关性肝损害的指标之一。
如果药物反应在说明书中已标明,则评价为+2.如果有报道但未标明,则评价为+1.如果未报道过有反应,则评价为+3.最后,再用药反应也需要考虑。
RUCAM急性药物性肝损伤因果关系评分法

RUCAM急性药物性肝损害因果关系评分法计分项目肝细胞型胆汁淤积型或混合型初次用药非初次用药计分初次用药非初次用药计分服药至起病时间5~90 1~15 +2 5~90 1~90 +2 <5或>90 >15 +1 <5或>90 >90 +1 停药至起病时间≤15 ≤15 +1 ≤30 ≤30 +1 停药后病程ALT自峰值的降幅ALP或胆红素自峰值的降幅8d内下降≥50%ULN +3 <180d内下降≥50%ULN +230 d内下降≥50%ULN +2 <180d内下降<50%ULN +1>30 d后下降≥50%ULN 0 持续存在或升高或无资料0>30 d后下降<50%ULN -2危险因素有饮酒+1 有饮酒或妊娠+1 无饮酒0 无饮酒或妊娠0 年龄(岁)≥55 +1 ≥55 +1<55 0 <55 0 其他药物无合并用药,或缺少相关资料0 无合并用药,或缺少相关资料0有合并用药且时间具有提示性-1 有合并用药且时间具有提示性-1肝毒性药物且时间有提示性-2 肝毒性药物且时间有提示性-2有其他致肝损伤证据的药物(如再刺激反应阳性)-3 有其他致肝损伤证据的药物(如再刺激反应阳性)-3其他原因完全排除组I*及组Ⅱ** +2 完全排除组I*及组Ⅱ** +2 完全排除组I +1 完全排除组I +1排除组I中4~5项0 排除组I中4~5项0排除组I中不足4项-2 排除组I中不足4项-2非药物性因素高度可能-3 非药物性因素高度可能-3 既往信息药签中有相关记载+2 药签中有相关记载+2 有文献报告,但药签无相关说明+1 有文献报告,但药签无相关说明+1未知0 未知0 药物再刺激阳性+3 阳性+3 相容+1 相容+1阴性-2 阴性-2未做或无法判断0 未做或无法判断0 注:*组I包括HA V、HBV、HCV(急性)、胆道梗阻、酗酒、新近发生过低血压(休克肝);**组Ⅱ包括:CMV、EBV、疱疹病毒感染。
急性药物性肝损伤诊断方法及评价_任晓非

学学报 ( 医学版 ) , 2004 , 42 ( 3) : 317 . [ 10 ] 刘晓鸿 . 米非司酮在子宫内膜异位症中的研究及应用 [ J] . 安徽 医药 , 2004, 8 ( 6) : 464 - 5. [ 11 ] A ilaw ad iRK, Jobanputra S , K atariaM, et a. l Treat m en t of endom etri osis and ch ron ic pelv ic pain w ith p etrozole and noreth indron e acetate a p ilot study[ J] . Fertil S teri, l 2004 , 81 : 290 - 6. [ 12 ] Bu lun SE, Fang Z, I m ir G, et a. l A rom atase and endom etrios is [ J] . Sem in R ep rod M ed, 2004 , 22: 45 - 50 [ 13 ] H ef ler LA, G rm im C , V an trotsenburyM, et a. l R ole of the vaginally ad m in istered arom atase inh ib itor anastrozole in w omen w ith rectovaginal endometrios is : A p ilot study[ J]. Fertil Steri, l 2005 , 4( 84): 1033- 6 . [ 14 ] A bu JI , K on je J C. L euk otrienes in gynaecology: the hypoth et ical val ue of ant i- leukot riene therapy in dys m en orrhoea and endom etriosis [ J] . H um R eprodU pdate, 2000, 6( 2) : 200- 7 . [ 15 ] IraharaM, U emuraH, Y asu i T, et a. l Eff icacy of every other day ad m in istrat ion ofcon jugated equine estrogen and m edroxyprogesterone acetate on gonadotrop in releasing hor m one agonists treat m ent in w o m en w ith en dometrios is[ J] . G ynecol O bstet inves, t 2001 , 52( 4): 217- 22 . [ 16 ] X iao YH, Chen D P, Y an J H, et a. l M echan ism of act ion of t ripterygi um w ilford ii poly glycos ide on experi m en tal endom et rios is [ J] . E ur J G ynaecol O n co, l 2002 , 23 ( 1) : 63 - 9. [ 17 ] Cobellis L, R azz i S , Sm ione S , et a. l The treat m en t w ith a COX 2 specific inh ibitor is effect ive in the manage m ent of pain related to endom etriosis [ J]. Eur J O bstet G ynecol R eprod B io, l 2004 , 116( 1) : 100- 2 . ( 收稿日期 : 2007 - 12- 07)
roussel uclaf因果关系评价法(rucam)

roussel uclaf因果关系评价法(rucam)《roussel uclaf因果关系评价法(rucam)》一、引言roussel uclaf因果关系评价法(RUCAM)是一种用于评估药物引起的肝损伤的工具。
该方法于1993年由法国药业公司路赛制药(Roussel Uclaf)提出,并被世界卫生组织(WHO)和欧洲药品评估委员会(EMA)广泛采用。
本文将深入探讨RUCAM的原理、应用以及其在临床实践中的重要性。
二、原理及方法RUCAM基于一系列严格定义的评估指标,通过对患者个案的详细分析,对药物与肝损伤之间的因果关系进行评估。
该方法主要包括以下几个步骤:1. 确定患者暴露于药物的时间和剂量信息;2. 评估患者的临床症状和体征,包括肝功能异常、黄疸等;3. 排除其他可能引起肝损伤的原因,如病毒感染、酒精摄入等;4. 使用RUCAM的评分系统,将各项指标进行加权得分,以确定药物与肝损伤之间的可能因果关系。
三、应用范围RUCAM广泛应用于临床研究和药物监测中,可以帮助医生判断药物是否与患者肝损伤之间存在因果关系。
通过对药物的因果关系评估,医生可以更加准确地识别潜在的药物不良反应,并采取相应的治疗措施。
此外,RUCAM还可以用于药物的风险评估和药物监测,有助于提高药物的安全性和有效性。
四、临床实践中的重要性RUCAM在临床实践中扮演着重要的角色。
对于医生而言,准确评估药物与肝损伤之间的因果关系,可以帮助其更好地指导患者用药,减少不良反应发生的风险。
对于药品监管机构而言,RUCAM提供了一种科学、可靠的方法来评估药物的安全性,及时发现并解决药物不良反应问题,保障公众的用药安全。
五、结论总之,roussel uclaf因果关系评价法(RUCAM)是一种重要的工具,用于评估药物与肝损伤之间的因果关系。
准确评估药物的安全性对于医生、患者和药品监管机构都具有重要意义。
RUCAM的应用能够提高药物治疗的效果,并保障公众的用药安全。
药物性肝损伤诊断标准评分

药物性肝损伤诊断标准评分药物性肝损伤是指由于药物所致的肝脏损害,其临床表现多种多样,严重者可导致肝功能衰竭甚至死亡。
因此,对药物性肝损伤的诊断和评估显得尤为重要。
目前,临床上常用的药物性肝损伤诊断标准包括RUCAM评分、Naranjo评分、CIOMS评分等,其中RUCAM评分是目前最常用的评分标准之一。
RUCAM评分是由Schwarz等人于1990年提出的一种药物性肝损伤诊断标准,其包括了临床表现、实验室检查、病因学因素等多个方面的评分项目。
通过对患者的临床资料进行评分,可以得出药物性肝损伤的可能性,有助于临床医生进行诊断和处理。
RUCAM评分共包括了七个方面的评分项目,分别是肝损伤的临床特征、肝损伤的实验室检查、潜在的其他因素、药物的暴露时间、药物的再曝露、其他可能性、肝损伤的临床转归。
每个评分项目都有相应的评分标准,通过对这些评分项目的综合评估,可以对患者的药物性肝损伤进行评估和诊断。
在进行RUCAM评分时,首先需要对患者的临床表现进行评估,包括黄疸、肝功能异常、肝脏生化指标异常等。
其次,需要进行实验室检查,包括肝功能检查、病毒学检查、免疫学检查等,以排除其他可能的肝损伤原因。
同时,还需要了解患者的用药史和病史,对潜在的其他因素进行评估。
在评估药物的暴露时间和再曝露方面,需要了解患者用药的时间和用药的剂量等信息。
最后,需要对其他可能性进行排除,包括病毒性肝炎、酒精性肝损伤、自身免疫性肝病等。
通过对这些方面的评分,可以得出患者药物性肝损伤的可能性,有助于临床医生进行诊断和处理。
需要指出的是,RUCAM评分虽然是目前临床上常用的评分标准之一,但并不是绝对准确的诊断方法,仍然需要结合临床医生的临床经验和其他检查结果进行综合判断。
因此,在进行药物性肝损伤的诊断和评估时,需要综合考虑多方面的因素,以提高诊断的准确性和可靠性。
总之,药物性肝损伤的诊断和评估是一个复杂而又重要的工作,需要临床医生对患者的临床资料进行全面综合的评估。
急性药物性肝损伤诊治建议(草案)

盖住药物性肝损伤是指由药物本身或茸代谢产物引起 的肝脏损害,病程一般在 3 个月以内阳,胆计淤积型肝损伤
病理较 K. 可超过 1 年【~, 4] 如避免药物导盘肝脏损害所用 名闹革一致,建议茸用国际共识意见 [oj 规定的统一术语"肝
HBY、 HCY 、 HDY、 HEV) 、巨细胞病毒 <CMY) , EB 病毒、
加趋骨.因此,有必要提出我国急性药物性肝损伤撞治意且,
以期进一步现范相提高我国药物性府前的临床珍治水平,
一、急性药物性Ilf损伤的定义和分型
真珍断线索拥r. 1 是否完圭排除肝损伤的其他病因?应追问患者既往
有无肝脏或胆道援病史以及嗜酒虫。需通过多种检查手段,
仔细分析排除现症肝损也是否因为肝虫病毒〈包括HAY 、
性数据库贵料,尤其中草药刷保健药更难以获得有关药物不
良反应的妻照贤料.因此,对于肝毒性平明的可疑纯物,尚
需上网检章 .g 口j 能获得有关药物肝毒性的报道性信息,依
ALP 正常[1] 0 ⑥既往无府硬化.在 26 周内出现肝功能事化
此作为诊断药物性肝损伤的重要妻照信息.
(二〉临阵语断标准 在综合分析「述临床线章的基础上.对临床诊断药物相 关性肝损伤病例可作出 F 罗'I 3 种关联性评价 [10] I.诊断标准 z ①喜与药韧性肝损伤虫病规律相 致的
肝脏异常升高指标一般迅速恢复$再次服用该药后又出现肝
脏指标明显异常(再用药反应阳性l'时,后者是评价药物性
肝损伤关联性非常强的诊断依据.但应注意故意再用可疑肝 毒性药物是有害的。 11] ~此外.再用药并不屈、生导致肝损伤 里发 g 每种药物诱发肝损伤的潜伏期变化较大,i:J}从数天到
主要表现为 ALT 革平明匾升高,曹先于TB 在平升高和E 著大于 ALP 丹商事平,其临床睡断标准为血清 ALT 升高?i>
AE附表1:急性药物性肝损伤因果关系评价(RUCAM)
可疑
在30 d后不适用
180 d内下降<50%
+1
无结论
没有相关资料或在30 d后下降≥50%
不变、上升或没有资料
0
与药物作用相反
30 d后下降<50%或再升高
不适用
- 2
如果药物仍在使用
无结论
所有情况
所有情况
0
3.危险因素
酒精
酒精或怀孕
有
+1
无
0
患者年龄≥55岁
+1
患者年龄<55岁
0
4。伴随使用药物
无或伴随用药与发病时间不符
0
伴随用药使用时间与发病相符合
- 1
已知伴随用药有肝毒性并与发病时间相符合
— 2
有证据表明伴随用药至肝损(再次使用加重肝损或其他证明实验)
- 3
5.除外其他原因
(1)近期感染过甲肝病毒(抗HAV—IgM)或乙肝病毒(抗HBc—IgM)或丙肝病毒(抗HCV抗体)或其他非甲非乙型肝炎感染的证据;胆道梗阻(B超);酗酒(AST/ALT≥2).近期有急性高血压史(特别有重要的心脏疾病);尚无肝Fra bibliotek性报道0
7.再用药反应
阳性
单用该药物就使ALT升高≥2×ULN
单用该药物就使ALP或TBL升高≥2×ULN
+3
可疑
再用同药导致ALT升高≥2×ULN
再用同药ALP或TBL升高≥2×ULN
+1
阴性
再用同药ALT增加但低于ULN
再用同药ALP或TBL增加但低于ULN
-2
未作或不可判断
其他情况
其他情况
0
注:*慢代谢性药物除外。最后判定:>8分,非常可能;6~8分,很可能;3~5分,可能;1~2分,不太可能;≤0分,无关。
药物性肝损伤

药物性肝损伤(drug-induced liver injury,DILI),是指人体暴露于常规剂量或高剂量药物后,因药物本身或其代谢产物对肝脏的直接毒性,或人体对药物或其代谢产物产生过敏或代谢特异质反应,而导致的肝脏损伤,是肝生化异常的常见原因之一。
DILI约占药物不良反应的6%,是药物上市后被撤回的最常见原因。
推算年发病率约19/10万,发病率男、女相似,但随着年龄增长显著增加。
药物性肝病占社区急性肝炎或黄疸患者的5%,是急性肝功能衰竭的主要原因(在美国占50%以上,其中36%为非甾体类消炎药,特别是对乙酰氨基酚),DILI是不明原因肝损伤的常见原因,尤其是50岁以上患者。
DILI可区分为可预测性和不可预测性两种,前者主要是药物的直接毒性作用所致。
近年来,由于对新药的筛选越来越严格、对药物不良反应的监测更加严密,除非药物有特异作用且评价效益与风险时前者明显地占上风,否则不能上市,因此临床上直接肝细胞毒性药物引起肝损伤的比例下降。
大多数(>95%)药物性肝损伤系不可预测性,其发生机制又可以分为:代谢特异质(metabolic idiosyncrasy)和过敏特异体质(hypersensitive idiosyncrasy)两类,其特征如表1。
免疫特异质肝损伤机制过敏即免疫机制介导的肝损害有以下特点:(1)不可预测性;(2)仅发生在某些人或人群(特异体质),或有家族集聚现象;(3)与用药剂量和疗程无关;(4)在实验动物模型上常无法复制;(5)具有免疫异常的指征;(6)可有肝外组织器官损害的表现。
免疫介导相关的药物性肝损的通常临床依据为:(1)使用过某种药物后,出现发热、关节痛、皮疹等肝外表现;(2)血液学检查发现嗜酸性细胞增多、循环免疫复合物阳性、非器官特异性的自身抗体阳性(药物相关的自身抗体);(3)肝组织学检查表现为嗜酸性细胞浸润、肉芽肿形成等。
在这类肝损中,通常药物中间代谢物通过抗原提呈细胞(树突状细胞)作用,经I型组织相容性抗原激活特异性细胞毒性T细胞介导致肝细胞损伤。
RUCAM急性药物性肝损伤因果关系评分法

RUCAM急性药物性肝损害因果关系评分法计分项目肝细胞型胆汁淤积型或混合型初次用药非初次用药计分初次用药非初次用药计分服药至起病时间5~90 1~15 +2 5~90 1~90 +2 <5或>90 >15 +1 <5或>90 >90 +1 停药至起病时间≤15 ≤15 +1 ≤30 ≤30 +1 停药后病程ALT自峰值的降幅ALP或胆红素自峰值的降幅8d内下降≥50%ULN +3 <180d内下降≥50%ULN +230 d内下降≥50%ULN +2 <180d内下降<50%ULN +1>30 d后下降≥50%ULN 0 持续存在或升高或无资料0>30 d后下降<50%ULN -2危险因素有饮酒+1 有饮酒或妊娠+1 无饮酒0 无饮酒或妊娠0 年龄(岁)≥55 +1 ≥55 +1<55 0 <55 0 其他药物无合并用药,或缺少相关资料0 无合并用药,或缺少相关资料0有合并用药且时间具有提示性-1 有合并用药且时间具有提示性-1肝毒性药物且时间有提示性-2 肝毒性药物且时间有提示性-2有其他致肝损伤证据的药物(如再刺激反应阳性)-3 有其他致肝损伤证据的药物(如再刺激反应阳性)-3其他原因完全排除组I*及组Ⅱ** +2 完全排除组I*及组Ⅱ** +2 完全排除组I +1 完全排除组I +1排除组I中4~5项0 排除组I中4~5项0排除组I中不足4项-2 排除组I中不足4项-2非药物性因素高度可能-3 非药物性因素高度可能-3 既往信息药签中有相关记载+2 药签中有相关记载+2 有文献报告,但药签无相关说明+1 有文献报告,但药签无相关说明+1未知0 未知0 药物再刺激阳性+3 阳性+3 相容+1 相容+1阴性-2 阴性-2未做或无法判断0 未做或无法判断0 注:*组I包括HA V、HBV、HCV(急性)、胆道梗阻、酗酒、新近发生过低血压(休克肝);**组Ⅱ包括:CMV、EBV、疱疹病毒感染。
新功能上线RUCAM因果关系评估量表

新功能上线RUCAM因果关系评估量表
当前,药物性肝损伤(Drug-Induced Liver Injury, DILI)的诊断仍属于排他性诊断,需通过因果关系评估来确定肝损伤与可疑药物的相关程度。
RUCAM因果关系评估法由CIOMS在1989年⾸次推出,1993年修改完善,仍是⽬前设计最合理、要素最全⾯、操作最⽅便、诊断准确率相对较⾼的诊断⼯具。
优点是:
(1)不受年龄、性别和种族影响,可重复性相对较好;
(2)主次参数全⾯且相对合理客观:半定量诊断分析构架较为完整,也适合⾮肝病专业医⽣应⽤;
(3)对不同类型DILI的评分标准进⾏了区分。
缺点是:有些评分标准的界定较含糊,需要改进参数和权重,填表指导应更清楚完整。
或者
RUCAM量表从7个⽅⾯对药物与肝损伤的因果关系进⾏综合评估:
(1)⽤药史,
(2)病程长短和⽣化异常的动态特点,
(3)危险因素,
(4)合并应⽤的其他药物,
(5)⾮药物因素的排除或权重,以及⾎液⽣化异常⾮肝损伤因素的排除,
(6)药物以往的肝毒性信息,
(7)药物再激发反应。
根据评分结果将药物与肝损伤的因果相关性分为5级:
(1)极可能:>8分;
(2)很可能:6~8分;
(3)可能:3~5分;
(4)不太可能:1~2分;
(5)可排除:≦0分。
药物性肝损伤因果关系评估量表:RECAM将取代RUCAM

二'=>-?@ 量表 =>-?@ 量表评分区块'分值及流程见表%,%%-%
表!=>-?@ 量表评分流程图,%%-
区块
区块,##(和#<两个亚块均进行评分
#(用药开始至肝损伤发作天数加分开始服药的首日为第%天
%J !"&J#含$ %""("J#含$ (%"&"J#含$
&"J #<停药至肝损伤发作天数减分不服药首日为第%天估算半寿期或药代动力学效应%)J的长半寿期药物此项计"分
3种药物性肝损伤诊断评分系统的应用及比较

3种药物性肝损伤诊断评分系统的应用及比较徐琴;刘浩;张跃新【期刊名称】《中国药房》【年(卷),期】2016(27)26【摘要】目的:分析比较药物性肝损伤(DILI)因果关系评价表(RUCAM)、Maria标准及DDW-J标准3种评分系统诊断DILI的一致性,并进行应用评价。
方法:回顾性分析了RUCAM评分≥3分的122例药物性肝损伤患者的临床资料,分别应用Maria标准和DDW-J标准评分系统进行量化评分,采用χ2检验进行统计学分析。
结果:122例患者中,DDW-J标准评分提示“可能性”大和“有可能”者120例(98.4%),显著高于Maria标准评分提示为“有可能”者的58例(47.5%),差异有统计学意义(P<0.05),提示DDW-J标准较Maria标准更接近RUCAM评分结果。
结论:DDW-J标准评分系统优于Maria标准评分系统,且与RUCAM评分系统在诊断药物性肝损伤中的效果相近;RUCAM评分系统仍是目前较为准确、可操作性高的DILI诊断评价系统。
%OBJECTIVE:To analyze and compare the congruity between Maria and DDW-J standard and Roussel uclaf causali-ty assessment method(RUCAM)for diagnosing drug-induced liver injury(DILI),and evaluate its application. METHODS:In ret-rospective analysis,the clinical data of 122 patients with DILI with RUCAM≥3 scores was quantitatively scored by Maria and DDW-J standard,χ2 test was conducted for statistical analysis. RESULTS:Among the 122 cases,120 cases(98.4%)were classi-fied as“likely and possible”by DDW-J standard,which was significantly higher than the 58 cases(47.5%)thatclassified as“pos-sible”by Maria standard,with statistical significance;and compared with Maria standard,DDW-J standard was more closer to RU-CAM scoring results. CONCLUSIONS:DDW-J standard is superior to Maria standard,and close to RUCAM scoring results for DI-LI;RUCAM is still the DILI diagnostic evaluation system with high accuracy and operability.【总页数】3页(P3633-3635)【作者】徐琴;刘浩;张跃新【作者单位】新疆医科大学第一附属医院感染性疾病中心,乌鲁木齐 830054;新疆医科大学第一附属医院感染性疾病中心,乌鲁木齐 830054;新疆医科大学第一附属医院感染性疾病中心,乌鲁木齐 830054【正文语种】中文【中图分类】R952;R969.3【相关文献】1.Naranjo药物不良反应评分系统不适用药物性肝损伤因果评价 [J], 李继瑾2.药物性肝损伤诊断的因果评分系统 [J], 傅青春3.两种药物性肝损伤诊断评分标准的临床应用比较 [J], 董黛青;叶英;李家斌4.Maria评分系统对药物性肝损害诊断的临床应用初探 [J], 徐日安;梁列新5.药物性肝损伤诊断评分系统的比较及应用体会 [J], 高旭东;樊艳华因版权原因,仅展示原文概要,查看原文内容请购买。
RUCAM急性药物性肝损伤因果关系评分法

RUCAM急性药物性肝损伤因果关系评分法RUCAM急性药物性肝损害因果关系评分法计分项目肝细胞型胆汁淤积型或混合型初次用药非初次用药计分初次用药非初次用药计分服药至起病时间5~90 1~15 +2 5~90 1~90 +2 <5或>90 >15 +1 <5或>90 >90 +1 停药至起病时间≤15 ≤15 +1 ≤30 ≤30 +1 停药后病程ALT自峰值的降幅ALP或胆红素自峰值的降幅8d内下降≥50%ULN +3 <180d内下降≥50%ULN +230 d内下降≥50%ULN +2 <180d内下降<50%ULN +1>30 d后下降≥50%ULN 0 持续存在或升高或无资料0>30 d后下降<50%ULN -2危险因素有饮酒+1 有饮酒或妊娠+1 无饮酒0 无饮酒或妊娠0 年龄(岁)≥55 +1 ≥55 +1<55 0 <55 0 其他药物无合并用药,或缺少相关资料0 无合并用药,或缺少相关资料0有合并用药且时间具有提示性-1 有合并用药且时间具有提示性-1 肝毒性药物且时间有提示性-2 肝毒性药物且时间有提示性-2有其他致肝损伤证据的药物(如再刺激反应阳性)-3 有其他致肝损伤证据的药物(如再刺激反应阳性)-3其他原因完全排除组I*及组Ⅱ** +2 完全排除组I*及组Ⅱ** +2 完全排除组I +1 完全排除组I +1排除组I中4~5项0 排除组I中4~5项0排除组I中不足4项-2 排除组I中不足4项-2非药物性因素高度可能-3 非药物性因素高度可能-3 既往信息药签中有相关记载+2 药签中有相关记载+2 有文献报告,但药签无相关说明+1 有文献报告,但药签无相关说明+1未知0 未知0 药物再刺激阳性+3 阳性+3 相容+1 相容+1阴性-2 阴性-2未做或无法判断0 未做或无法判断0 注:*组I包括HA V、HBV、HCV(急性)、胆道梗阻、酗酒、新近发生过低血压(休克肝);**组Ⅱ包括:CMV、EBV、疱疹病毒感染。
RUCAM评分系统

指标评分1.药物治疗与症状出现的时间关系(1)初次治疗5-90天;后续治疗1-15天(2)初次治疗<5天或>90天;后续治疗>15天(3)停药时间;≦15天2.病程特点(1)停药后8天内ALT从峰值下降≧50%(2)停药后30天内ALT从峰值下降≧50%(3)持续用药ALT下降水平不确定3.危险因素(1)饮酒或妊娠(2)无饮酒或妊娠(3)年龄≧55岁(4)年龄<55岁4.伴随用药(1)伴随用药与发病时间符合(2)已知伴随用药的肝毒性且与发病时间符合(3)有伴随用药导致肝损伤的证据(如再用药反应等)5.除外其他非药物因素甲型、乙型或丙型病毒性肝炎;胆道阻塞;酒精性肝病(AST/ALT≧2);近期高血压或心脏病发作史;潜在其他疾病;CMV、EBV或HSV感染(1)除外以上所有因素(2)可除外4-5个因素(3)可除外1-4个因素(4)高度可能为非药物因素6.药物肝毒性的已知情况(1)在说明书中已注明(2)曾有报道但未在说明书中注明(3)无相关报告7.再用药反应(1)阳性(单纯用药后ALT升高>2倍正常值)(2)可疑阳性(ALT升高>2倍正常值。
但同时伴有其他因素)(3)阴性(ALT升高<2倍正常值)+2 +1 +1+3 +2 0+1 0 +1 0-1 -2 -32 1 -2 -32 1 021 -2(4)未再用药0注:最后判断:>8高度可能;6-8可能性大;3-5可能;1-2不大可能;≦0可除外Welcome !!! 欢迎您的下载,资料仅供参考!。
急性药物性肝损伤【30页】

病 因
上市应用的1100种以上的药物有潜在的肝毒性,很多药物的赋形剂、中草药以及保健药有导致肝损伤的可能。临床上引起药物性肝损伤常见的药物有抗结核药物、抗生素、激素及相关药物、抗肿瘤药物、中枢神经系统用药以及中草药。由中草药引起的肝损害呈逐年上升趋势,占所有药物性肝损伤的20%~30%。
发 病 机 制
诊 断Leabharlann 我国诊断标准:1、肝脏损害大多出现在用药后1~4周内,少数药物潜 伏期长。2、初发症状可能有发热、皮疹、瘙痒等过敏现象。3、周围血液中嗜酸粒细胞大于6%。4、肝内胆汁淤积或实质细胞损害等临床和病理征象。5、淋巴细胞转化试验或巨嗜细胞(白细胞)移动抑制试验阳性。6、肝炎病毒标志如HBsAg、抗-HBc抗体、抗HAV(IgM型)抗体、抗HCV抗体、抗HEV抗体等阴性。 7、偶然再次给药可诱发。 凡具备上述(1),加上(2)~(7)项条件中任2项,可考虑诊断为药物性肝损伤。
1项阴性 2 无 1
Ⅳ有意或无意再用药
在纳入分析的1022例急性药物性肝损伤报告病例中,82例因无法获得计算服药至发病时间而被认为无法评价,非常可能占16.8%,很可能占34.7%,可能占35.7%,绝大多数病例都处在可能和很可能的水平。
引起药物性肝损伤前五类的药物分别是抗结核药物、中药(包括各种中成药和中草药)、甲状腺机能亢进治疗用药、化疗药物和免疫调节剂。抗结核药物是最常见原因(229/1022,22.4%),其次是中药引起的肝损伤(190/1022,18.6%)。
Ⅲ肝外症状
出疹、发热、关节痛、白细胞减少、嗜酸细胞增多(>6%)
4项以上阴性 4
2 ~ 3项阳性 3
急性药物性肝损伤病因分析的关联性评价
非常可能 很可能 可能 不大可能 无关 无法评价 合计HC 144 274 288 36 4 55 801CS 19 58 71 8 0 26 182MIXED 9 23 6 0 0 1 39 172 355 365 44 4 82 1022
AE SAE ADR UADR SUSAR怎么区分

A E、S A E、A D R、U A D R、S U S A R怎么区分AE、SAE、ADR等是临床试验中重点记录和报告的事项,很多新手会感到困惑,今天我们就来一起探讨一下。
综合就是以下这张图:AE的定义:不良事件(AdverseEvent,AE):病人或临床试验受试者接受一种药品后出现的任何不良医学事件,但并不一定与治疗有因果关系。
在临床试验方案中,常用如下定义:自患者签署知情同意书入选试验开始到试验结束,期间发生的任何不良医学事件,无论与试验用药有无因果关系,均为不良事件。
ICH-GCP中的定义Adverseevent(AE):AnAEisanyuntowardmedicaloccurrenceinapatientorclini calinvestigationsubjectadministeredapharmaceuticalproductandthatdoesnotnecess arilyhaveacausalrelationshipwiththistreatment.AnAEcanthereforebeanyunfavorableandunintendedsign(includinganabnorm allaboratoryfinding),symptom,ordiseasetemporallyassociatedwiththeuseofamedicinal(investigational)product,whetherornotrelatedtothemedicinal(investigational)p roduct.1AE的分级和分类AE在程度上分为:Mild(轻度)、Moderate(中毒)、Severe(重度),是指AE引起的临床表现/症状之类的轻重,但要注意不能将Severe和SAE中的S(serious严重)混淆起来,SAE有它的标准。
可将AE分为严重不良事件、重要不良事件和非预期不良事件。
药物性肝损伤因果关系评估量表:RECAM将取代RUCAM?

药物性肝损伤因果关系评估量表:RECAM将取代RUCAM?赖荣陶;陈成伟;阳文新;于乐成【期刊名称】《肝脏》【年(卷),期】2022(27)7【摘要】Roussel Uclaf因果关系评估量表(RUCAM)量表是近30年来最受临床欢迎和肯定的药物性损伤(DILI)评估量表,其参数相对全面,操作界面相对友好,但也存在主观性较大、操作说明不够详细、与专家观点一致性不够高、某些参数的设置和评分标准缺乏循证医学证据、存在观察偏差等不足。
新近欧美部分学者提出了基于美国DILIN研究和西班牙DILI注册研究数据设计的"改良电子化因果关系评估量表"(RECAM),其保留了RUCAM的基本逻辑,但对具体内容和结构做了大幅改进,特别是将RUCAM的7类参数整合为RECAM的5个区块,剔除了RUCAM第3项(危险因素)和第4项(同时使用的药物),对第6项(药物既往肝毒性信息)采用LiverTox网站分类标准进行评分,对常见肝损伤病因的分层评估更详细,将再激发和肝活检等列为附加评估项。
RECAM评分等级:≥8分,极可能(highly likely/highly probable);7~4分,很可能(probable);3~-3分,可能(possible);≤-4分,不可能或排除(unlikely/excluded)。
初步研究显示,RECAM与RUCAM对诊断DILI至少一样有效,但RECAM在判断两极值方面优于RUCAM。
RECAM在临床上的适用性,以及是否可用于HDS所致肝损伤的评估,尚待论证。
【总页数】5页(P725-729)【作者】赖荣陶;陈成伟;阳文新;于乐成【作者单位】上海交通大学医学院附属瑞金医院感染科;解放军海军第九○五医院临床肝病研究中心;东部战区总医院急诊科;东部战区总医院感染科/肝病中心【正文语种】中文【中图分类】R57【相关文献】1.基于RUCAM量表的205例药物性肝损伤患者临床特点分析2.RUCAM和Maria诊断标准用于评估1352例中国人药物性肝损伤文献分析3.采用RUCAM 量表评价259例药物性肝损伤临床研究4.基于RUCAM评估量表的高龄老年药物性肝损伤162例临床分析5.基于RUCAM量表的ALL患儿化疗药物性肝损伤相关特征分析因版权原因,仅展示原文概要,查看原文内容请购买。
RUCAM量表(五个表)
0
4. 同时应用的药物/草药
无同时应用的药物/草药,或无信息
0
同时应用的药物/草药与肝损伤发病时间不相容
0
同时应用的药物/草药与肝损伤发病时间相容或提示
-1
已知同时应用的药物/草药具有肝毒性,且与肝损伤发病时间相容或提示
-2
有证据显示同时应用的药物/草药在本例起作用(再用药反应或确证试验阳性) -3
结果
□ □ □ □
□ □ □ □ □
RUCAM量表 – 1(C)
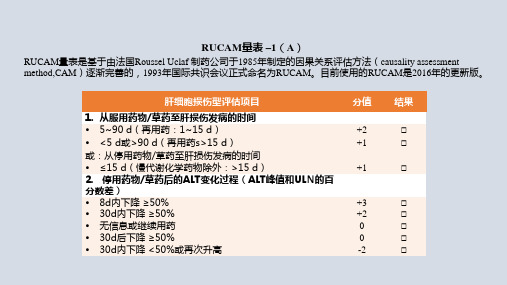
肝细胞损伤型评估项目
5. 其他肝损伤病因的检查 组Ⅰ(7类病因)
HAV感染:抗-HAV-IgM
HBV感染:HBsAg,抗-HBc IgM,HBV DNA HCV感染:抗-HCV,HCV RNA HEV感染:抗-HEV IgM,抗-HEV IgG,HEV RNA 肝胆超声波成像/肝血管彩色多普勒成像/腔内超声检查/CT/MRC 酒精中毒(AST/ALT ≥2) 近期有急性低血压病史(尤其是在有潜在心脏疾病时) 组Ⅱ(5类病因) 合并脓毒症、转移性恶性肿瘤、AIH、HBV、HCV、PBC、遗传性肝
RUCAM量表 –1(A)
RUCAM量表是基于由法国Roussel Uclaf 制药公司于1985年制定的因果关系评估方法(causality assessment method,CAM)逐渐完善的,1993年国际共识会议正式命名为RUCAM。目前使用的RUCAM是2016年的更新版。
肝细胞损伤型评估项目
病等 CMV感染:抗-CMV IgM,抗-CMV IgG,CMV-PCR EBV感染:抗-EBV IgM,抗-EBV IgG,EBV-PCR HSV感染:抗-HSV IgM,抗-HSV IgG,HSV-PCR VZV感染:抗-VZV IgM,抗-VZV IgG,VZV-PCR
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注:*慢代谢性药物除外。最后判定:>8分,非常可能;6~8分,很可能;3~5分,可能;1~2分,不太可能;≤0分,无关。
(2)重要疾病并发症;临床和(或)实验室提示CMV、EBV或疱疹病毒感染。
所有因素,包括(1)和(2)完全排除
+2
(1)中5个原因排除
+1
(1)中4~5个原因排除
0
(1)中少与4个原因排除
-2
高度怀疑非药物因素
-3
6.药物既往肝损害的报道
产品说明中有肝毒性报告
+2
有文献报道但产品说明中无相关信息
+1
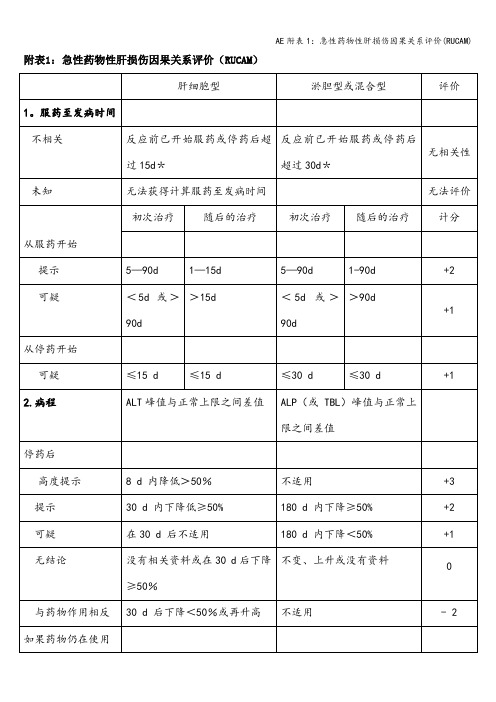
附表1:急性药物性肝损伤因果关系评价(RUCAM)
肝细胞型
淤胆型或混合型
评价
1.服药至发病时间
不相关
反应前已开始服药或停药后超过15d*
反应前已开始服药或停药后超过30d*
无相关性
未知
无法获得计算服药至发病时间
无法评价
初次治疗
随后的治疗
初次治疗
随后的治疗
计分
从服药开始
提示
5-90d
1-15d
5-90d
无或伴随用药与发病时间不符
0
伴随用药使用时间与发病相符合
- 1
已知伴随用药有肝பைடு நூலகம்性并与发病时间相符合
- 2
有证据表明伴随用药至肝损(再次使用加重肝损或其他证明实验)
- 3
5.除外其他原因
(1)近期感染过甲肝病毒(抗HAV-IgM)或乙肝病毒(抗HBc-IgM)或丙肝病毒(抗HCV抗体)或其他非甲非乙型肝炎感染的证据;胆道梗阻(B超);酗酒(AST/ALT≥2)。近期有急性高血压史(特别有重要的心脏疾病);
尚无肝毒性报道
0
7.再用药反应
阳性
单用该药物就使ALT升高≥2×ULN
单用该药物就使ALP或TBL升高≥2×ULN
+3
可疑
再用同药导致ALT升高≥2×ULN
再用同药ALP或TBL升高≥2×ULN
+1
阴性
再用同药ALT增加但低于ULN
再用同药ALP或TBL增加但低于ULN
-2
未作或不可判断
其他情况
其他情况
1-90d
+2
可疑
<5d或>90d
>15d
<5d或>90d
>90d
+1
从停药开始
可疑
≤15 d
≤15 d
≤30 d
≤30 d
+1
2.病程
ALT峰值与正常上限之间差值
ALP(或TBL)峰值与正常上限之间差值
停药后
高度提示
8 d内降低>50%
不适用
+3
提示
30 d内下降低≥50%
180 d内下降≥50%
+2
可疑
在30 d后不适用
180 d内下降<50%
+1
无结论
没有相关资料或在30 d后下降≥50%
不变、上升或没有资料
0
与药物作用相反
30 d后下降<50%或再升高
不适用
- 2
如果药物仍在使用
无结论
所有情况
所有情况
0
3.危险因素
酒精
酒精或怀孕
有
+1
无
0
患者年龄≥55岁
+1
患者年龄<55岁
0
4.伴随使用药物
