选修4练习化学平衡常数
高中化学选修4--化学平衡习题及答案解析

高中化学选修4--化学平衡习题及答案解析高中化学选修 4-化学平衡习题及答案解析一、单选题1、可逆反应 N₂(g) + 3H₂(g) ⇌ 2NH₃(g),在容积为 10L 的密闭容器中进行,开始时加入 2mol N₂和 6mol H₂,达平衡时,NH₃的浓度不可能达到()A 01mol/LB 02mol/LC 005mol/LD 015mol/L答案:B解析:假设 2mol N₂和 6mol H₂完全反应,生成 4mol NH₃,则NH₃的浓度为 04mol/L。
但这是一个可逆反应,不可能完全反应,所以 NH₃的浓度一定小于 04mol/L。
而 02mol/L 接近完全反应时的浓度,所以不可能达到。
2、一定条件下,将 NO₂与 SO₂以体积比 1:2 置于密闭容器中发生反应:NO₂(g) + SO₂(g) ⇌ SO₃(g) + NO(g) ,下列能说明反应达到平衡状态的是()A 体系压强保持不变B 混合气体颜色保持不变C SO₃和 NO 的体积比保持不变D 每消耗 1mol SO₃的同时生成 1mol NO₂答案:B解析:A 选项,该反应是一个气体分子总数不变的反应,压强始终不变,所以压强不变不能说明达到平衡状态。
B 选项,混合气体颜色不变,说明 NO₂的浓度不变,反应达到平衡状态。
C 选项,SO₃和 NO 都是生成物,且按照 1:1 生成,无论是否平衡,体积比始终保持不变,不能说明达到平衡。
D 选项,消耗 1mol SO₃的同时生成 1mol NO₂,都表示的是逆反应,不能说明正逆反应速率相等,不是平衡状态。
3、对于可逆反应:2A(g) + B(g) ⇌ 2C(g) △H < 0,下列各图正确的是()答案:A解析:A 选项,温度升高,平衡逆向移动,C 的百分含量降低,图像正确。
B 选项,增大压强,平衡正向移动,A 的转化率应该增大,图像错误。
C 选项,使用催化剂,只能改变反应速率,不能改变平衡状态,平衡时 C 的百分含量不变,图像错误。
2021年人教版高中化学选修4练习:第二章第三节第3课时代学平衡常数 Word版含答案

第二章化学反响速率和化学平衡第三节化学平衡第3课时代学平衡常数1.关于可逆反响:C(s)+CO 2(g)2CO(g),在必定温度下其平衡常数为K,下列条件的改动中能使K产生改动的是()A.将C(s)的表面积增大B.增大系统压强C.升高系统温度D.运用适宜的催化剂解析:平衡常数K只与温度有关,与浓度、压强、是否运用催化剂无关。
答案:C2.在必定条件下,有下列分子数之比相同的可逆反响,其平衡常数K值分别是①H 2+F22HF K=1047;②H2+Cl22HCl K=1017;③H 2+Br22HBr K=109;④H2+I22HI K=1。
比较K值巨细,可知各反响的正反响进行的程度由大到小的次序是()A.①②③④B.④②③①C.①④③②D.无法确认解析:化学平衡常数越大,表明该反响的正反响进行的程度越大,故A正确。
答案:A3.已知下列反响的平衡常数:①H 2(g)+S(s)H 2S(g),K1;②S(s)+O2(g)SO2(g),K2;则反响H2(g)+SO 2(g)O2(g)+H2S(g)的平衡常数是()A.K1+K2B.K1-K2C.K1×K2D.解析:K1=,K2=,第三个反响的平衡常数K3==×=K1×=。
答案:D4.关于反响2X(g)+Y(g)2Z(g),下列说法中正确的是()A.因为K=,跟着反响的进行,Z的浓度不断增大,X、Y的浓度不断减小,平衡常数不断增大B.当温度不变时,增大反响物的浓度,使K变小C.可逆反响到达平衡时,逆反响便当即中止了D.温度产生改动,上述反响的K值也产生改动解析:平衡常数K只与温度有关,D项正确。
答案:D5.在必定温度下的密闭容器中,参加1 mol CO和1 mol H 2O产生反响:CO(g)+H2O(g)CO2(g)+H2(g),到达平衡时测得n(H2)为0.5 mol,下列说法不正确的是() A.在该温度下平衡常数K=1B.平衡常数与反响温度无关C.CO的转化率为50%D.其他条件不变改动压强平衡不移动解析:由方程式及以上数据判别可得,A、C、D项均正确。
课时2.4 化学平衡常数及化学平衡计算-高二化学选修4精品讲义(人教版)

课时 2.4 化学平衡常数及化学平衡计算【学习目标】1、掌握化学平衡常数的书写及化学平衡常数的应用2、掌握化学平衡中三段式计算的方法 【主干知识梳理】一、化学平衡常数1、定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。
这个常数就是该反应的化学平衡常数(简称平衡常数),用K 表示2、表达式:对于可逆反应:m A(g)+n B(g)p C(g)+q D(g))()()()(B c A c D c C c K n m q p ••= (固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中) 3、化学平衡常数表示的意义(1)平衡常数数值的大小可以反映可逆反应进行的程度大小,K 值越大,反应进行越完全,反应物转化率越高,反之则越低(2)一般当K >105时,该反应进行得基本完全4、使用化学平衡常数应注意的问题(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关,与压强无关(2)反应物或生成物中有固体和纯液体存在时,由于其浓度可看做常数“1”而不代入公式CaCO 3(s)CaO(s)+CO 2(g) K== CO 2(g)+H 2(g) CO(g)+H 2O(l) K==(3)化学平衡常数是指某一具体反应的平衡常数。
若反应方向改变,则平衡常数改变。
若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变N 2+3H 22NH 3 K 1== 2NH 3N 2+3H 2 K 2== 21N 2+23H 2NH 3 K 3==5、化学平衡常数的应用(1)判断、比较可逆反应进行的程度:一般来说,一定温度下的一个具体的可逆反应:K 值 正反应进行的程度 平衡时生成物浓度 平衡时反应物浓度反应物转化率 越大 越大 越大 越小 越高越小 越小 越小 越大 越低(2) (3)判断正在进行的可逆反应是否达到平衡或反应进行的方向:对于可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度的任意时刻,反应物的浓度和生成物的浓度有如下关系:)()()()(B c A c D c C c Q n m q p c ••=,Q C 叫该反应的浓度商 ⎩⎪⎨⎪⎧Q c <K :反应向正反应方向进行,v 正>v 逆Q c =K :反应处于化学平衡状态,v 正=v 逆Q c >K :反应向逆反应方向进行,v 正<v 逆【练习1】1、判断正误(正确的打“√”,错误的打“×”)(1)平衡常数表达式中,可以是物质的任一浓度 ( )(2)催化剂能改变化学反应速率,也能改变化学平衡常数 ( )(3)化学平衡常数发生变化,化学平衡不一定发生移动 ( )(4)化学平衡发生移动,化学平衡常数不一定发生变化 ( )2、已知下列反应在某温度下的平衡常数:H 2(g)+S(s)H 2S(g) K 1 S(s)+O 2(g)SO 2(g) K 2则在该温度下反应H 2(g)+SO 2(g)O 2(g)+H 2S(g)的平衡常数为( )A .K 1+K 2B .K 1-K 2C .K 1×K 2D .K 1/K 23、在25 ℃时,密闭容器中X 、Y 、Z 三种气体的初始浓度和平衡浓度如下表,下列说法错误的是( )物质 X Y Z初始浓度/mol·L -1 0.1 0.2 0平衡浓度/mol·L -1 0.05 0.05 0.1A .反应达到平衡时,X 的转化率为50%B .反应可表示为X +3Y 2Z ,其平衡常数为1 600C .增大压强使平衡向生成Z 的方向移动,平衡常数增大D .改变温度可以改变此反应的平衡常数4、汽车尾气里含有的NO 气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N 2(g)+O 2(g)2NO(g) ΔH >0,已知该反应在2 404 ℃时,平衡常数K =6.4×10-3。
2019 2020第二学期人教版化学选修4同步测试23 第3课时 化学平衡常数答案解

:2019-2020学年第二学期人教版化学选修4——《化学平衡常数》同步测试一、选择题K=数衡常衡应达到化学平,平体1.某温度下气反2cc)A)·(B(的浓度增加。
下列说,恒容时,若温度适当降低,F2cc)(E)·F (法中正确的是Kcc.降低温度,正反应速率B增大(A)、 (B),A.增大增大.该反应的化学方程式为D C.该反应的焓变为负值2B(g)+F(g)A(g)2E(g)+K只随温度变化,不随浓度变化,故不正项,平衡常数解析 A项,降温,项,降低温度,正、逆反应速率均减小,不正确;C确;B则焓变为正值,表明平衡逆向移动,正反应是吸热反应,F浓度增大,F、B是生成物,E不正确;D项,根据化学平衡常数表达式可知A、为反应物,且对应指数为其化学方程式前的计量数,正确。
D答案K值与温度的平衡常数C(g)+D(g)+2.已知反应A(g)B(g)的关系如表所示。
830 ℃时,向一个2 L的密闭容器中充入0.20 molA和0.20 mol B,10 s时达到平衡。
下列说法不正确的是2001 830 700 温度./℃K0.41.7 1.0 值50% B的转化率为A.达到平衡后, B.增大压强,正、逆反应速率均加快 C.该反应为吸热反应,升高温度,平衡正向移动1-v s0.005 mol·LD.反应初始至平衡,A的平均反应速率·(A)=1-1-x,则: mol·L解析设平衡时 B减少的物质的量浓度为D(g)+ B(g)C(g) A(g) +xxxx)-1) 0.1 0.1 0 起始/(mol0 ·L-1/(mol变化·LxxK的转化率B,-1xxxx 0.1-平衡/(mol·L) 0.1-2解得,则平衡时=0.05故==1.02x)-(0.10.05项正确;增大压强,正、逆反应速率都增大,A=50%,=×100%0.1项正确;由表中数据可知,温度越高,平衡常数越小,说明升温平B项错误;反应初始至衡向逆反应方向移动,故正反应是放热反应,C1-L0.05 mol·1--1v L=0.005 mol·,s·D项正确。
高中化学 第二章 课下能力提升(九)化学平衡常数(含解析)新人教版选修4-新人教版高中选修4化学试题

化学平衡常数一、选择题1.已知下列反应的平衡常数:①H 2(g)+S(s)H 2S(g),K 1;②S(s)+O 2(g)SO 2(g),K 2;则反应H 2(g)+SO 2(g)O 2(g)+H 2S(g)的平衡常数是( )A .K 1+K 2B .K 1-K 2C .K 1×K 2 D.K 1K 2解析:选D K 1=c (H 2S)c (H 2),K 2=c (SO 2)c (O 2),第三个反应的平衡常数K 3=c (H 2S)·c (O 2)c (H 2)·c (SO 2)=c (H 2S)c (H 2)×1c (SO 2)c (O 2)=K 1×1K 2=K 1K 2。
2.已知830℃时,反应CO(g)+H 2O(g)H 2(g)+CO 2(g)的平衡常数K =1,将各物质按表中的物质的量(单位:mol)投入恒容容器中,则开始时反应逆向进行的是( )选项A B C D n (CO 2) 3 1 0 1 n (H 2) 2 1 0 1 n (CO) 1 2 3 0.5 n (H 2O)5232解析:选 A Q c (A)=2×31×5=1.2,Q c (B)=1×12×2=0.25,Q c (C)=0,Q c (D)=1×12×0.5=1。
Q c (B)、Q c (C)均小于平衡常数1,所以B 、C 两种情况下反应正向进行;Q c (D)=1,反应处于平衡状态;Q c (A)大于1,反应逆向进行。
3.在1 100 ℃时,一定容积的密闭容器中发生反应:FeO(s)+CO(g)Fe(s)+CO 2(g)ΔH =a kJ·mol -1(a >0),该温度下K =0.263,下列有关该反应的说法正确的是( )A .达到化学平衡状态时,若c (CO)=0.100 mol·L -1,则c (CO 2)=0.026 3 mol·L -1B .若要提高CO 的转化率,则可以加入过量FeOC .若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态D .若生成56 g Fe ,则吸收的热量小于a kJ 解析:选A 1 100 ℃时反应的平衡常数K =c (CO 2)c (CO)=0.263,故达到平衡时,若c (CO)=0.100 mol·L -1,则 c (CO 2)=0.026 3 mol·L -1,A 正确;加入FeO 对平衡移动无影响,B错误;因反应前后气体的物质的量不变,故反应过程中,容器内压强始终保持不变,C错误;根据热化学方程式意义可知:若生成56 g Fe,则吸收的热量为a kJ,D错误。
2018年人教版高中化学选修4导学案:2.3化学平衡 化学平衡常数含答案

第3课时 化学平衡常数1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
2.应用化学平衡常数判断可逆反应进行的程度、方向以及反应的热效应。
3.能够利用化学平衡常数进行简单的计算。
化学平衡常数1.含义在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,简称平衡常数,用符号K 表示。
2.表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),平衡常数的表达式为K =c p (C)·c q (D)c (A)·c (B)。
3.意义与影响因素(1)K 值越大,说明正反应进行的程度越大,反应物的转化率越大;反之,就转化得越不完全,转化率就越小。
(2)K 只受温度的影响,与反应物或生成物的浓度变化无关。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)化学平衡常数等于某一时刻生成物浓度幂之积与反应物浓度幂之积的比值。
( )(2)对于一个可逆反应,平衡正向移动时,平衡常数一定增大。
( )(3)升高温度,K 值增大,则正反应为吸热反应。
( )(4)K 值越大,表明可逆反应正向进行的程度越大。
( )(5)平衡常数的大小只与温度有关,而与浓度、压强、催化剂等无关。
( )答案:(1)× (2)× (3)√ (4)√ (5)√2.对于3Fe(s)+4H 2O(g)Fe 3O 4(s)+4H 2(g),反应的化学平衡常数的表达式为( ) A .K =c (Fe 3O 4)·c (H 2)c (Fe)·c (H 2O)B .K =c (Fe 3O 4)·c 4(H 2)c (Fe)·c 4(H 2O)C .K =c 4(H 2O)c 4(H 2)D .K =c 4(H 2)c 4(H 2O)解析:选D 。
平衡常数表达式中只表示出气体或溶液中溶质的浓度,而固体或纯液体不表示出来。
高二化学人教版选修4练习:第2章第3节第4课时化学平衡常数Word版含解析

第4课时化学平衡常数课后篇巩固提升基础巩固1•化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是()A. K越大,反应物的转化率越小B. K与反应物的浓度有关C. K与生成物的浓度有关D. K与温度有关K越大,反应物的转化率越大;一个确定的化学反应,其化学平衡常数只与反应体系的温度有关。
D2•某温度时,反应S02(g)+-02(g)—:S03(g)的平衡常数K=50。
在同一温度下,反应2SO3(g)- 2SO2(g)+O 2(g)的平衡常数K i应为()A. 2 500B.100■4・2C.4 >10D.2 XI0解析K= -------------- ,K i= ---------------- ,K i=一=4 X10 4。
答案C3•将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g) 2SO2(g)+O2(g)并达到平衡保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是()A. 平均相对分子质量B. SO3(g)的转化率C. -----D.解析|将题中反应过程进行如下分析,假设在原容器上增加一个相同的容器(两容器有隔板),保持温度不变,向增加的容器中充入相同体积的SO3(g),则可建立与原平衡一样的平衡,此时A、B、C、D各项的值均不变,然后抽掉隔板,将两容器压缩为一个容器大小,则压强增大,平衡逆向移动,气体的总物质的量减小,但总质量不变,因此平均相对分子质量增大;SO3(g)的转化率减小;c(SO2)、c(SO3)均增大, 但c(SO3)增大的程度比c(SO2)增大的程度大,则------ 增大;-------- 可看作该反应的平衡常数的倒数,而平衡常数只与温度有关,则不发生变化。
答案B4.汽车尾气净化中的一个反应如下:NO(g)+CO(g) —N2(g)+CO2(g)-1 △H=-373.4 kJ m o l在恒容的密闭容器中,反应达到平衡后,改变某一条件H,下列示意图正确的是(丿°温度f平林赵温度A高中化学二 C5.X Y Z ,X Y 1 1 , :^2Z(g),53 2, Y ( )A.33%B.40%C.50%D.66%X Y n, X xX(g) + 2Y(g)—2Z(g)/mol n n 0/mol x 2x 2x/mol n-x n-2x 2xY •,x=_n100%=66.7%匚D6. 830 K=1,, CO(g)+H 2O(g) H2(g)+CO 2(g)( :mol)5( )AB C Dn(CO2) 3 T0 1n(H2) 2 1 0 1n(CO) 1 2 3 0.5n(H2O) 5 2 3 2Q C,Q C(A)=1.2,Q C(B)=0.25,Q C(C)=0,Q C(D)=1Q c(B);Q C(D)=1, ;Q C(A) ___ A7. N2+3H2 '2NH3 N2+O2”="2NO (ig K)( )A.B.C.D.lg K ,A KlgK ,B ,C D口 D8.CO2(g)+H2(g) A. CO30 mL CO 20 mLH2CO(g)+H 2O(g)—( ) 40%,A ,C0,C,B,N0 ,DQ C(C)1, K, B CB. CO 25%C. 50%D.5CO xCO(g) + H2O(g) CO2(g)+H 2(g)30 mL 20 mL 0 0x x x x30 mL- x 20 mL-x x x20 mL- x=x, x=10 mLCO - 100%=40%,CO24100%=50%, —100% 33.3%,出0 ---------------- =249. H2(g)+l2(g),H2(1)0~2 min v(HI)= _________ K= _______⑵,HI(g)A.,H2(g)+l2(g)L:2HI(g) 2 , _____________ 2B.HIC.D. H2(1) H2(g) +“(g)”■2HI(g)/mol 0 0 1/mol 0.1 0.1 0.2/mol 0.1 0.1 0.80~2 min -1v(HI)=0.1 mol L K=64(2) HI 2 ,5HI H21 L,5 5;HI2(1)0.1 mol I -1・-1L min 64⑵B10. 830 K ,CO(g)+H 2O(g)- CO2(g)+H 2(g) H<01min-, , H2(g)+l2(g L2HI(g)2 mol HI 2 L (),, HI 2 ,H2(1) c(CO)=2 mol 1 1L- ,c(H2O)=3 mol L- ,4 s5 K= H2O⑵-1 0.5 mol L , 5)c(CO)=1 mol L-1,c(H2O)=2 mol L-1(CO 60%,, H2), v( ) _____________ v()((3)若降, K____ ⑴CO(g)+H2O(g广CO2(g)+H 2(g)高中化学起始浓度变化浓度1.2 1.2 1.2 1.2平衡浓度: 0.8 1.8 1.2 1.2该反应的平衡常数K = -------- =1,1 1V(H20)=-------------------- =0.3 mol L:s。
化学一轮复习活页训练选修四化学平衡常数(含答案解析)

第2课时化学平衡常数(时间:30分钟)考查点一化学平衡常数的应用1.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)NH3(g)+HI(g)②2HI(g)H2(g)+I2(g)达到平衡时,c(H2)=0。
5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( ).A.9 B.16 C.20 D.25解析本题综合考查平衡计算和化学平衡常数。
2HI(g)H2(g) +I2(g)平衡浓度/(mol·L-1) 4 0。
5 0.5转化浓度/(mol·L-1) 1 0.5 0。
5NH4I(s)NH3(g) +HI(g)转化浓度/(mol·L-1) 5 5平衡浓度/(mol·L-1) 5 4K=c(NH3)·c(HI)=5×4=20.答案C2.硫—碘循环分解水制氢主要涉及下列反应ⅠSO2+2H2O+I2===H2SO4+2HIⅡ2HI H2+I2Ⅲ2H2SO4===2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行b.反应Ⅰ中SO2氧化性比HI强c.循环过程中需补充H2Od.循环过程中产生1 mol O2的同时产生1 mol H2(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右上图所示.0~2 min内的平均反应速率v(HI)=________该温度下,H2(g)+I2(g)2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数b.HI的平衡浓度c.达到平衡的时间d.平衡时H2的体积分数解析(1)H2SO4在常温下很稳定,不易分解,这是常识,故a错;反应Ⅰ中SO2是还原剂,HI是还原产物,故还原性SO2>HI,则b错;将Ⅰ和Ⅱ分别乘以2和Ⅲ相加得:2H2O===2H2+O2,故c 正确,d错误。
化学平衡常数及化学平衡的有关计算-2021-2022学年高二化学选修4精品讲义
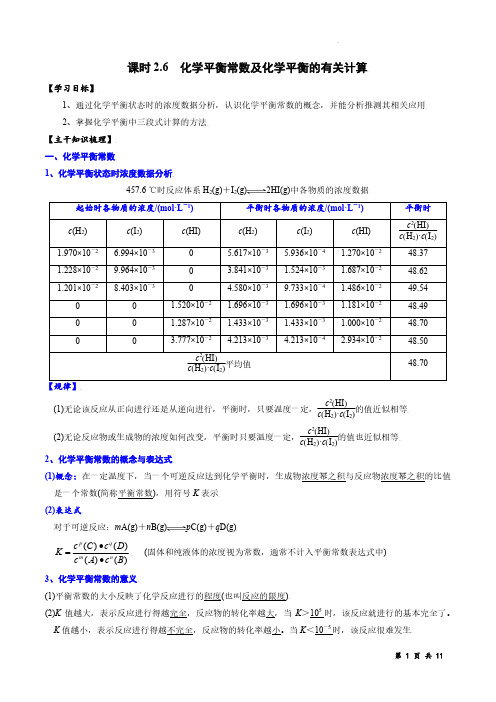
课时2.6 化学平衡常数及化学平衡的有关计算【学习目标】1、通过化学平衡状态时的浓度数据分析,认识化学平衡常数的概念,并能分析推测其相关应用2、掌握化学平衡中三段式计算的方法 【主干知识梳理】 一、化学平衡常数1、化学平衡状态时浓度数据分析457.6 ℃时反应体系H2(g)+I 2(g)2HI(g)中各物质的浓度数据【规律】(1)无论该反应从正向进行还是从逆向进行,平衡时,只要温度一定,c 2(HI )c (H 2)·c (I 2)的值近似相等(2)无论反应物或生成物的浓度如何改变,平衡时只要温度一定,c 2(HI )c (H 2)·c (I 2)的值也近似相等 2、化学平衡常数的概念与表达式(1)概念:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数(简称平衡常数),用符号K 表示 (2)表达式对于可逆反应:m A(g)+n B(g)p C(g)+q D(g))()()()(B c A c D c C c K n mq p ∙∙= (固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中) 3、化学平衡常数的意义(1)平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)(2)K 值越大,表示反应进行得越完全,反应物的转化率越大,当K >105时,该反应就进行的基本完全了。
K 值越小,表示反应进行得越不完全,反应物的转化率越小。
当K <10-5时,该反应很难发生4、化学平衡常数的影响因素(1)内因:不同的化学反应及方程式的书写形式是决定化学平衡常数的主要因素(2)外因:在化学方程式一定的情况下,K只受温度影响,与反应物或生成物的浓度无关,与压强无关5、化学平衡常数表达式的书写(1)在平衡常数表达式中,水(液态)的浓度、固体物质及纯液体的浓度不写如:Br2+H2O H++Br-+HBrO K=c(H+)·c(Br-)·c(HBrO)c(Br2)C(s)+H2O(g)CO(g)+H2(g))()()(22OHcHcCOcK⋅=(2)化学平衡常数表达式与化学方程式的书写有关。
化学平衡常数

2.2 化学反应的限度 第1课时 化学平衡常数每课一练(鲁科版选修4)1.下列说法可以充分说明P(g)+Q(g) R(g)+S(g),在恒温下已达平衡状态的是( )A .反应容器内压强不随时间变化B .P 和S 的生成速率相等C .反应容器中P 、Q 、R 、S 共存D .反应容器内总物质的量不随时间而变化解析:选B 。
对该反应来说,反应前后体积无变化,压强自始至平衡不变,容器内总物质的量不随时间而变,故A 、D 错,反应可逆,则任何状态下P 、Q 、R 、S 都共存,C 错。
B 表示v (正)=v (逆),正确。
2.(2010年枣庄高二质检)2000 K 时,反应CO(g)+12O 2(g)===CO 2(g)的平衡常数为K ,则相同温度下反应2CO 2(g)===2CO(g)+O 2的平衡常数为( )A.1K B .K 2 C.1K 2 D.1K 12解析:选C 。
因为本题给定的化学反应是原来化学反应的逆反应,各物质化学式前系数是原来化学方程式中各物质化学式前系数的2倍,因此其平衡常数是原来平衡常数的-2次方,因此C 应该是正确的。
3.在1000 K 时,已知反应Ni(s)+H 2O(g)NiO(s)+H 2(g)的平衡常数K =0.0059。
当水蒸气和氢气的物质的量浓度相等时,此反应( )A .已达平衡状态B .未达平衡状态,反应正向进行C .未达平衡状态,反应逆向进行D .无法确定解析:选C 。
Q =c (H 2)c (H 2O )=1,Q >K ,故反应未达平衡,向逆反应方向进行。
4.SO 2虽然是大气污染物,但也是重要的化工原料,综合的治理和应用SO 2会造福人类。
例如:二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。
综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO 2催化氧化生成SO 3:2SO 2(g)+O 2(g)催化剂△2SO 3(g)某温度下,SO 2的平衡转化率(α)与体系总压强(p )的关系如图所示。
(完整版)高中化学选修4化学平衡习题及答案解析

第三节化学平衡练习题一、选择题1.在一个密闭容器中进行反应:2SO 2(g)+O2(g) 2SO3(g)已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是()A.SO2为0.4mol/L,O2为0.2mol/LB.SO2为0.25mol/LC.SO2、SO3(g)均为0.15mol/LD.SO3(g)为0.4mol/L2.在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是()A. C生成的速率与C分解的速率相等B. A、B、C的浓度不再变化C. 单位时间生成n molA,同时生成3n molBD. A、B、C的分子数之比为1:3:23.可逆反应H 2(g)+I2(g) 2HI(g)达到平衡时的标志是()A. 混合气体密度恒定不变B. 混合气体的颜色不再改变C. H2、I2、HI的浓度相等D. I2在混合气体中体积分数不变4.在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是()A.混合气体的压强B.混合气体的密度C.C、D的物质的量的比值D.气体的总物质的量5.在一真空密闭容器中,通入一定量气体A.在一定条件下,发生如下反应:2A(g) B(g) + x C(g),反应达平衡时,测得容器内压强增大为P%,若此时A的转化率为a%,下列关系正确的是()A.若x=1,则P>a B.若x=2,则P<aC.若x=3,则P=a D.若x=4,则P≥a6.密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为()A.40%B.50%C.60%D.70%7.在1L的密闭容器中通入2molNH 3,在一定温度下发生下列反应:2NH3N2+3H2,达到平衡时,容器内N2的百分含量为a%。
2014-2015学年高中化学同步讲练:2.2.1 化学平衡常数2(鲁科版选修4)

第2节化学反应的限度第1课时化学平衡常数[学习目标定位] 1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式,知道化学平衡常数的影响因素。
2.能根据化学平衡常数表示的意义,判断反应进行的程度和方向。
1.化学平衡状态的概念:如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。
化学平衡研究的对象是可逆反应。
2.化学平衡状态的特征:(1)等:v正=v逆≠0。
(2)动:化学平衡状态是一种动态平衡。
达到平衡状态时,反应并没有停止,这时正反应和逆反应都依然在进行。
(3)定:反应物的浓度和生成物的浓度不再改变。
(4)变:外界条件(温度、浓度、压强等)一旦改变,化学平衡状态就会被破坏,并在新的条件下建立新的化学平衡。
3.一定温度下,在10 L密闭容器中加入5 mol SO 2和3 mol O2,当反应达到平衡时,有3 mol SO2发生了反应,则:(1)生成了________mol SO3。
(2)平衡时容器内气体的总物质的量为________。
(3)平衡时SO2的浓度是__________,O2的浓度是________________________________,SO3的浓度是__________。
答案(1)3(2)6.5 mol(3)0.2 mol·L-10.15 mol·L-10.3 mol·L-1探究点一 化学平衡常数的概念及其表达式1.二氧化氮、四氧化二氮的相互转化是一个可逆反应:2NO 2(g)N 2O 4(g),在298 K ,如果用不同起始浓度的二氧化氮或四氧化二氮进行反应,平衡后得到以下实验数据。
(1)请根据表中已知数据填写空格:①概念:在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度以化学计量数为指数的幂的乘积与反应物浓度以化学计量数为指数的幂的乘积的比值是一个常数。
人教版选修4第二章化学反应速率和化学平衡测验题

人教版选修4第二章《化学反应速率和化学平衡》测验题编题人颜秋生一、选择题(本题包括15小题,每小题4分,共60分。
每小题只有一个选项符合题意)1.在2A+B3C+4D反应中,表示该反应速率最快的是A.υ(A)=0.5 mol/(L·s)B.υ(B)=0.3 mol/(L·s)C.υ(C)=0.8 mol/(L·s)D.υ(D)=1 mol/(L·s)2.下列说法正确的是A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率3.过程的自发性的作用是A.判断过程的方向B.确定过程是否一定会发生C.判断过程发生的速率D.判断过程的热效应4.在2升的密闭容器中,发生以下反应:2A(g)+ B(g) 2C(g)+D(g) 。
若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是A. 1.6 molB. 2.8 molC. 2.4 molD. 1.2 mol(g)+B2(g)达到平衡状态的标志是5.一定条件下反应2AB(g) AA.单位时间内生成nmolA2,同时消耗2n molABB.容器内,3种气体AB、A2、B2共存C.AB的消耗速率等于A2的消耗速率D.容器中各组分的体积分数不随时间变化6.在一定温度不同压强(P<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是7.α1和α2分别为A 、B 在两个恒容容器中平衡体系A(g)2B(g)和2A(g)B(g)的转化率,在温度不变的情况下,均增加A 的物质的量,下列判断正确的是A .α1、α2均减小B .α1、α2均增大C .α1减小,α2增大D .α1增大,α2减小8.对可逆反应4NH 3(g )+ 5O 2(g4NO (g )+ 6H 2O (g ),下列叙述正确的是A .达到化学平衡时,4υ正(O 2)= 5υ逆(NO )B .若单位时间内生成x mol NO 的同时,消耗x mol NH 3 ,则反应达到平衡状态C .达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大D .化学反应速率关系是:2υ正(NH 3)= 3υ正(H 2O )9.已知反应A 2(g )+2B 2(g2(g )△H <0,下列说法正确的 A .升高温度,正向反应速率增加,逆向反应速率减小B .升高温度有利于反应速率增加,从而缩短达到平衡的时间C .达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D .达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动10.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验: (N 2O2NO 2 △H > 0)(a )将两容器置于沸水中加热(b )在活塞上都加2 kg 的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是 A .(a )甲>乙,(b )甲>乙 B .(a )甲>乙,(b )甲=乙 C .(a )甲<乙,(b )甲>乙 D .(a )甲>乙,(b )甲<乙11.有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g),ΔH <0。
化学平衡常数计算练习题

化学平衡常数计算练习题化学平衡常数是描述化学反应平衡程度的一个重要物化性质,它可以帮助我们了解反应体系中各组分的浓度变化情况。
在化学学习中,我们需要掌握计算化学平衡常数的方法。
下面将给出一些化学平衡常数计算的练习题,希望能够帮助大家更好地理解和应用这一概念。
1. 对于反应方程式:2A + 3B ⇌ 4C + 2D,其平衡常数Kc为1.5,求平衡时反应物A和B的浓度以及产物C和D的浓度。
解答:设A的初始浓度为x mol/L,B的初始浓度为y mol/L,C和D的初始浓度均为0 mol/L。
在平衡时,2A的浓度变为(2x - 4y) mol/L,3B的浓度变为(3y - 6x) mol/L,4C的浓度变为4x mol/L,2D的浓度变为2y mol/L。
根据平衡常数的定义:Kc = [(C^c)(D^d)] / [(A^a)(B^b)],代入已知值有:1.5 = [(4x)^4(2y)^2] / [(2x)^2(3y)^3]。
首先要注意平衡常数是在平衡时的浓度下求得的,所以平衡时的浓度要代入计算,即1.5 = [(4)^4(2)^2] / [(2)^2(3)^3],解方程可以得到x约等于0.405 mol/L,y约等于0.135 mol/L。
因此,平衡时反应物A和B的浓度分别为0.405 mol/L和0.135 mol/L,产物C和D的浓度分别为1.62 mol/L和0.27mol/L。
2. 对于反应方程式:N2(g) + 3H2(g) ⇌ 2NH3(g),其平衡常数Kp为0.003,求氨气NH3的分压比例。
解答:设初始时氮气N2的分压为P1,氢气H2的分压为P2,氨气NH3的分压为P3。
在平衡时,N2的分压变为(P1 - 2P3) atmos,H2的分压变为(P2 - 6P3) atmos,NH3的分压变为(2P3) atmos。
根据平衡常数的定义:Kp = [(P3^2)] / [(P1^1)(P2^3)],代入已知值有:0.003 =[(2P3)^2] / [(P1^1)(P2^3)]。
人教版2020年选修四化学配套练习之第四单元基础练习(原卷版)

人教版2020年选修四化学配套练习之第四单元基础练习(原卷版)一、单选题1.化学平衡常数(K)、弱酸的电离平衡常数(K a )、难溶物的溶度积常数(K sp )是判断物质性质或变化的重要的平衡常数。
下列关于这些常数的说法中,正确的是( ) A .平衡常数的大小与温度、浓度、压强、催化剂等有关 B .当温度升高时,弱酸的电离平衡常数K a 变小C .K sp (AgCl)>K sp (AgI) ,由此可以判断AgCl(s) + I -(aq)=AgI(s)+ Cl -(aq)能够发生D .K a (HCN)<K a (CH 3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强2.在下列各溶液中,离子一定能大量共存的是 A .强碱性溶液中: K +、2Mg+、Cl -、24SO -B .室温下,pH=1的盐酸中: Na +、3Fe +、3NO -、24SO -C .含有3Al +的溶液中: Na +、K +、23CO -、Cl - D .在强酸性或强碱性溶液中: Na +、K +、Cl -、23SiO -3.下列微粒半径大小比较正确的是( ) A .N a +<M 2g +<K +<2O - B .N a +>M 2g +>2S ->C l -C .Na >Mg >Al >SD .Cs <Rb<K <Na4.下列有关仪器的使用方法或实验操作正确的是A .配制一定物质的量浓度的溶液时,洗净的容量瓶要放进烘箱中烘干,以防溶液被稀释B .由CuSO 4溶液制备CuSO 4 • 5H 20的操作:将溶液蒸发至剩有少量液体时,停止加热C .酸碱滴定实验中,用待测溶液润洗锥形瓶,以减少实验误差D .中和热的测定实验中,要用环形玻璃搅拌棒搅拌,使反应更充分5.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。
”文中涉及的操作方法是 A .蒸馏 B .升华 C .干馏 D .萃取6.已知2 SO 2(g )+O 2(g )2SO 3(g ).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是()A.升高温度,可以加快反应速率B.在上述条件下,SO2不能完全转化为SO3C.使用催化剂是为了加快反应速率D.达到平衡时,SO2的浓度与SO3的浓度一定相等7.关于化学反应速率与平衡,下列说法不正确的是A.化学平衡理论是研究怎样使用有限原料多出产品B.化学反应速率理论是研究怎样提高原料转化率C.化学反应速率理论是研究怎样在一定时间内快出产品D.化学平衡理论是研究怎样使原料尽可能多地转化为产品8.已知使36g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s(+1/2O2(g(=CO(g(△H=-Q1kJ/mol(CO(g(+1/2O2(g(=CO2(g(△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是中正确的是()A.2Q2kJ B.Q2kJ C.3(Q1+Q2(kJ D.3Q1KJ9.用下列实验装置完成对应的实验,能达到实验目的的是A.测定氢气的生成速率B.称量氢氧化钠固体C.用氢氧化钠溶液滴定盐酸D.蒸干氯化铜溶液制氯化铜10.电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。
人教版选修4 第2章第3节 化学平衡(第2课时) 作业 (1)

第3节 化学平衡第2课时1.关于化学平衡常数的叙述正确的是( )A .温度一定,一个化学反应的平衡常数不是一个常数B .两种物质反应,不管怎样书写化学方程式,平衡常数不变C .温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数D .浓度商Q c <K 时,v 正<v 逆解析:选C 。
K 是温度的函数,平衡常数的表达式与化学方程式的书写方式有关。
正、逆反应的平衡常数互为倒数,如H 2(g)+I 2(g)2HI(g),K 正=c 2HIc H 2c I 2,K逆=c H 2c I 2c 2HI ,所以K 正=1K 逆。
浓度商Q <K ,未达到化学平衡状态,此时v 正>v 逆。
2.对于3Fe(s)+4H 2O(g)Fe 3O 4(s)+4H 2(g),反应的化学平衡常数的表达式为( )A .K =c Fe 3O 4·c H 2c Fe ·c H 2OB .K =c Fe 3O 4·c 4H 2c Fe ·c 4H 2OC .K =c 4H 2Oc 4H 2D .K =c 4H 2c 4H 2O解析:选D 。
固体不写入表达式中。
3.在一定温度下的密闭容器中存在如下反应:2SO 2(g)+O 2(g)催化剂△2SO 3(g),已知c (SO 2)始=0.4 mol ·L -1,c (O 2)始=1 mol ·L -1,经测定该反应在该温度下的平衡常数K =19,则此反应中SO 2的转化量为( ) A .0.24 mol ·L -1 B .0.28 mol ·L -1 C .0.32 mol ·L -1D .0.26 mol ·L -1 解析:选C 。
2SO 2(g)+O 2(g) 催化剂△2SO 3(g)起始量/mol ·L -1:0.4 1 0变化量/mol ·L -1:x 0.5x x平衡量/mol ·L -1:0.4-x 1-0.5x x由平衡常数的定义:K =c 2SO 3c 2SO 2·c O 2=x 20.4-x2·1-0.5x=19,解得x =0.32 mol ·L -1。
高中化学选修四第二章化学平衡常数习题

化学平衡常数一、基础练习1.关于化学平衡常数的叙述正确的是( )A.温度一定,一个化学反应的平衡常数不是一个常数B.两种物质反应,不管怎样书写化学方程式,平衡常数不变C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数D.浓度商Q c<K时,v正<v逆2.化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( ) A.K越大,反应物的转化率越小 B.K与反应物的浓度有关C.K与生成物的浓度有关 D.K与温度有关3.某温度下,可逆反应m A(g)+n B(g)p C(g)的平衡常数为K,下列对K的说法正确的是( )A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大B.若缩小反应器的容积,能使平衡正向移动,则K增大C.温度越高,K一定越大D.如果m+n=p,则K=14.当把晶体N2O4放入密闭容器中气化,并建立了N2O4(g) 2NO2(g)平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,其c2(NO2)c(N2O4)值 ( )A.变大B.不变 C.变小 D.无法确定5.将4 mol SO2与2 mol O2放入4 L的密闭容器中,在一定条件下反应达到平衡:2SO2+O 22SO3,测得平衡时SO3的浓度为0.5 mol·L-1。
则此条件下的平衡常数K为( )A.4 B.0.256.在一定温度下,反应12H2(g)+12X2(g)HX(g)的平衡常数为10。
若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于 ( ) A.5% B.17% C.25% D.33%7.在淀粉KI溶液中存在下列平衡:I2(aq)+I-(aq) I-3(aq)。
测得不同温度下该反应的平衡常数K如表所示:t/℃ 5 15 25 35 50K 1 100 841 689 533 409 下列说法正确的是 ( )A.反应I2(aq)+I-(aq) I-3(aq)的ΔH>0B.其他条件不变,升高温度,溶液中c(I-3)减小C.该反应的平衡常数表达式为K=c(I2)·c(I-)c(I-3)D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于6898.某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )A .该反应为吸热反应B .当反应达到平衡时,降低温度,A 的转化率减小C .升高温度平衡常数K 增大;压强增大,平衡向正反应方向移动D .加入催化剂,反应速率增大,E 1减小,E 2减小,反应热不变 9.已知反应①:CO(g)+CuO(s)CO 2(g)+Cu(s)和反应②:H 2(g)+CuO(s) Cu(s)+H 2O(g)在相同的某温度下的平衡常数分别为K 1和K 2,该温度下反应③:CO(g)+H 2O(g) CO 2(g)+H 2(g)的平衡常数为K 。
选修4练习化学平衡常数

课时跟踪检测(九)化学平衡常数1.下列关于平衡常数K的说法中,正确的是()①平衡常数K只与反应本身及温度有关②改变反应物浓度或生成物浓度都会改变平衡常数K③加入催化剂不改变平衡常数K④平衡常数K只与温度有关,与反应的本身及浓度、压强无关A.①②B.②③C.③④D.①③解析:选D平衡常数K是一个温度常数,只与反应本身及温度有关,催化剂不能改变化学平衡,故加入催化剂不改变平衡常数K。
2.可逆反应:C(s)+H2O(g)CO(g)+H2(g)在t℃下达到平衡,其平衡常数可表示为()A.K=c(C)·c(H2O)c(CO)·c(H2)B.K=c(CO)·c(H2)c(C)·c(H2O)C.K=c(H2O)c(CO)·c(H2)D.K=c(CO)·c(H2)c(H2O)解析:选D C是固体,它的浓度视为“1”,在平衡常数表达式中不出现。
3.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K值分别是①H2+F22HF K=1047②H2+Cl22HCl K=1017③H2+Br22HBr K=109④H2+I22HI K=1比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是()A.①②③④B.④②③①C.①④③②D.无法确定解析:选A化学平衡常数越大,表示该反应的正反应进行的程度越大,故A正确。
4.对于可逆反应:C(s)+CO2(g)2CO(g),在一定温度下其平衡常数为K。
下列条件的变化中,能使K值发生变化的是()A.将C(s)的表面积增大B.增大体系的压强C.升高体系的温度D.使用合适的催化剂解析:选C化学平衡常数只受温度的影响,温度变化,K值才发生变化;平衡常数的大小与浓度、压强以及是否使用催化剂无关。
5.某温度下气体反应达到化学平衡,平衡常数K =c (A )·c 2(B )c 2(E )·c (F ),恒容时,若温度适当降低,F 的浓度增加。
2019-2020学年人教版高中化学选修四同步导练习题:2--3 化学平衡常数跟踪训练

解析:(1)D为固体不能写入平衡常数的表达式中.K= 。2分钟内C的平均速率为v(C)= =0.6 mol/(L·min)。v(B)= v(C)=0.2 mol/(L·min)。(2)题给反应是气体分子数不变的反应.温度升高.平衡时混合气体的平均摩尔质量减小.则气体的质量减小.说明反应正向移动了.可判断该反应正反应为吸热反应。(3)由反应的特点可知.将容器体积缩小至1 L.平衡不移动.平衡时C的浓度加倍.即为2.4 mol/L。因温度不变.平衡常数不变。
答案:C
3.(20xx年临沂重点中学月考)已知下列反应的平衡常数:H2(g)+S(s) H2S(g).K1;S(s)+O2(g) SO2(g).K2;则反应H2(g)+SO2(g) O2(g)+H2S(g)的平衡常数是( )
A.K1+K2B.K1-K2
C.K1×K2D.K1/K2
解析:K1= .K2= .
2019-2020学年人教版高中化学选修四同步导练习题:2--3 化学平衡常数跟踪训练
编 辑:__________________
时 间:__________________
关于化学平衡常数的叙述中.正确的是( )
A.只与化学反应方程式本身和温度有关
B.只与反应的温度有关
C.与化学反应本身和温度有关.并且会受到起始浓度的影响
答案:(1) 0.2 mol/(L·min)
(2)吸热 (3)2.4 不变
K= .所以K= .D项正确。
答案:D
4.(20xx年安徽省××市模拟)反应Fe(s) +CO2(g) FeO(s)+CO(g).700℃时平衡常数为1.47.900℃时平衡常数为2.15。下列说法正确的是( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时跟踪检测(九)化学平衡常数1.下列关于平衡常数K的说法中,正确的是()①平衡常数K只与反应本身及温度有关②改变反应物浓度或生成物浓度都会改变平衡常数K③加入催化剂不改变平衡常数K④平衡常数K只与温度有关,与反应的本身及浓度、压强无关A.①②B.②③C.③④D.①③解析:选D平衡常数K是一个温度常数,只与反应本身及温度有关,催化剂不能改变化学平衡,故加入催化剂不改变平衡常数K。
2.可逆反应:C(s)+H2O(g)CO(g)+H2(g)在t℃下达到平衡,其平衡常数可表示为()A.K=c(C)·c(H2O)c(CO)·c(H2)B.K=c(CO)·c(H2)c(C)·c(H2O)C.K=c(H2O)c(CO)·c(H2)D.K=c(CO)·c(H2)c(H2O)解析:选D C是固体,它的浓度视为“1”,在平衡常数表达式中不出现。
3.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K值分别是①H2+F22HF K=1047②H2+Cl22HCl K=1017③H2+Br22HBr K=109④H2+I22HI K=1比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是()A.①②③④B.④②③①C.①④③②D.无法确定解析:选A化学平衡常数越大,表示该反应的正反应进行的程度越大,故A正确。
4.对于可逆反应:C(s)+CO2(g)2CO(g),在一定温度下其平衡常数为K。
下列条件的变化中,能使K值发生变化的是()A.将C(s)的表面积增大B.增大体系的压强C.升高体系的温度D.使用合适的催化剂解析:选C化学平衡常数只受温度的影响,温度变化,K值才发生变化;平衡常数的大小与浓度、压强以及是否使用催化剂无关。
5.某温度下气体反应达到化学平衡,平衡常数K =c (A )·c 2(B )c 2(E )·c (F ),恒容时,若温度适当降低,F 的浓度增加。
下列说法中正确的是( )A .增大c (A)、c (B),K 增大B .降低温度,正反应速率增大C .该反应的焓变为负值D .该反应的化学方程式为2E(g)+F(g)A(g)+2B(g)解析:选D A 项,平衡常数K 只随温度变化,不随浓度变化,故不正确;B 项,降低温度,正、逆反应速率均减小,不正确;C 项,降温,F 浓度增大,表明平衡逆向移动,正反应是吸热反应,则焓变为正值,不正确;D 项,根据化学平衡常数表达式可知A 、B 是生成物,E 、F 为反应物,且对应指数为其化学方程式前的计量数,正确。
6.将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应:①NH 4I(s)NH 3(g)+HI(g);②2HI(g)H 2(g)+I 2(g)。
达到平衡时,c (H 2)=0.5 mol·L -1,c (HI)=4 mol·L -1,则此温度下反应①的平衡常数为( )A .9B .16C .20D .25解析:选C 由H 2和HI 的平衡浓度可推算出①反应生成的HI 和NH 3的浓度都为 0.5 mol·L -1×2+4 mol·L -1=5 mol·L -1,由于NH 3没有转化,其平衡浓度仍为5 mol·L -1,而HI 的平衡浓度由题意可知为4 mol·L -1,则①的平衡常数K 1=c (NH 3)·c (HI)=5×4=20。
7.高温、催化剂条件下,某反应达到平衡,平衡常数K =c (CO )·c (H 2O )c (CO 2)·c (H 2)。
恒容时,温度升高,H 2浓度减小。
下列说法正确的是( )A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C .升高温度,逆反应速率减小D .该反应的化学方程式为CO +H 2O 催化剂高温CO 2+H 2解析:选A 因为该可逆反应的化学平衡常数K =c (CO )·c (H 2O )c (CO 2)·c (H 2),可得出该反应的化学方程式为CO 2(g)+H 2(g)催化剂高温CO(g)+H 2O(g),D 项错误;由于恒容时,温度升高,氢气浓度减小,说明平衡向正反应方向移动,故正反应为吸热反应,即焓变为正值,A 项正确;该反应为反应前后气体分子数不变的反应,恒温恒容下,如充入稀有气体使压强增大,H 2浓度不变,B 项错误;升高温度,正、逆反应速率都增大,C 项错误。
8.已知反应A(g)+B(g)C(g)+D(g)的平衡常数K 值与温度的关系如表所示。
830 ℃时,向一个2 L 的密闭容器中充入0.20 mol A 和0.20 mol B,10 s 时达到平衡。
下列说法不正确的是( )温度/℃ 700 830 1 200 K 值 1.7 1.0 0.4A .达到平衡后,B 的转化率为50%B .增大压强,正、逆反应速率均加快C .该反应为吸热反应,升高温度,平衡正向移动D .反应初始至平衡,A 的平均反应速率v (A)=0.005 mol·L -1·s -1解析:选C 设平衡时B 减少的物质的量浓度为x mol·L -1,则:A(g) + B(g)C(g)+D(g) 开始/(mol·L -1) 0.1 0.1 0 0变化/(mol·L -1) x x x x平衡/(mol·L -1) 0.1-x 0.1-x x x故K =x 2(0.1-x )2=1.0,解得x =0.05,则平衡时B 的转化率=0.050.1×100%=50%,A 项正确;增大压强,正、逆反应速率都增大,B 项正确;由表中数据可知,温度越高,平衡常数越小,说明升温平衡向逆反应方向移动,故正反应是放热反应,C 项错误;反应初始至平衡,v (A)=0.05 mol·L -110 s=0.005 mol·L -1·s -1,D 项正确。
9.某校课外活动小组利用NO 2与N 2O 4的反应来探究温度对化学平衡的影响。
已知: 2NO 2(g)N 2O 4(g) ΔH (298 K)=-52.7 kJ·mol -1 (1)该化学反应的平衡常数表达式为_______________________________________。
(2)该小组的同学取了两个水槽A 和B ,分别加入相同浓度的NO 2与N 2O 4的混合气体,中间用夹子夹紧,并将A 和B 浸入到已盛有水的两个水槽中(如下图所示),然后分别向两个水槽中加入浓硫酸和NH 4NO 3固体。
请回答:①A 中的现象为________________。
②由上述实验现象可知,降低温度,该反应化学平衡向____________(填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将________(填“增大”“减小”或“不变”)。
解析:(1)平衡常数表达式K =c (N 2O 4)/c 2(NO 2)。
(2)①浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO 2(g)N 2O 4(g)是放热反应,A 所在的水槽中,升高温度,平衡向逆反应方向移动,NO 2气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,NO 2浓度降低,气体颜色变浅 。
②由①知,降低温度,平衡向正反应方向移动。
③升高温度,平衡向逆反应方向移动,化学平衡常数减小。
答案:(1)K =c (N 2O 4)/c 2(NO 2)(2)①A 中气体的颜色加深 ②正 ③减小10.在一定温度下,发生反应:Fe 2O 3(s)+3CO(g)2Fe(s)+3CO 2(g)。
已知该反应在不同温度下的平衡常数如下表:温度/℃1 000 1 150 1 300 平衡常数64.0 50.7 42.9 请回答下列问题:(1)该反应的平衡常数表达式K =______,ΔH ______0(填“<”“>”或“=”)。
(2)在一个容积为10 L 的密闭容器中,1 000 ℃时加入Fe 、Fe 2O 3、CO 、CO 2各1.0 mol ,反应经过10 min 后达到平衡。
求该时间范围内反应的平均反应速率v (CO 2)=________,CO 的平衡转化率为________。
(3)1 000 ℃时,在(2)的平衡体系中,各加0.5 mol CO 和0.5 mol CO 2,v 正________v 逆(填“<”“>”或“=”),平衡向________移动(填“正向”“逆向”或“不”)。
解析:(1)反应Fe 2O 3(s)+3CO(g)2Fe(s)+3CO 2(g)的平衡常数K =c 3(CO 2)c 3(CO ),由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应, ΔH <0。
(2)设平衡时CO 的物质的量变化为n mol ,则Fe 2O 3(s)+3CO(g)2Fe(s)+3CO 2(g)开始(mol):1 1变化(mol):n 1+n平衡(mol):1-n1+n所以⎝⎛⎭⎪⎫1+nV3⎝⎛⎭⎪⎫1-nV3=64,解得n=0.6,所以v(CO2)=0.6 mol10 L10 min=0.006 mol·L-1·min-1,CO的平衡转化率为0.6 mol1 mol×100%=60%。
(3)1 000 ℃时,在(2)的平衡体系中,各加0.5 mol CO和0.5 mol CO2,CO的浓度为0.09 mol·L-1,CO2的浓度为0.21 mol·L-1,此时Q c=0.2130.093<64,平衡向正反应方向移动,v正>v逆。
答案:(1)c3(CO2)/c3(CO)<(2)0.006 mol·L-1·min-160%(3)>正向1.当把晶体N2O4放入密闭容器中汽化,并建立了N2O42NO2平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,其c2(NO2)c(N2O4)值()A.变大B.不变C.变小D.无法确定解析:选Bc2(NO2)c(N2O4)=K,温度不变,K不变。
2.已知下列反应的平衡常数:①H2(g)+S(s)H2S(g),K1;②S(s)+O2(g)SO2(g),K2;则反应H2(g)+SO2(g)O2(g)+H2S(g)的平衡常数是()A.K1+K2B.K1-K2C.K1×K2 D.K1K2解析:选D K1=c(H2S)c(H2),K2=c(SO2)c(O2)第三个反应的平衡常数K3=c(H2S)·c(O2)c(H2)·c(SO2)=c(H2S)c(H2)×1c(SO2)c(O2)=K1×1K2=K1K2。
