[理学]气体分子热运动速率
热学-第三章气体分子热运动速率和能量分布

得:dN m 4 e 得
N
kT 2
v dv
记忆这个公式分三部分: 第一部分,4v2dv是“球壳”的体积,而“球壳”全方位的高 度对称性正是分子热运动想各个方向几率均等的生动表现;
第二部分 ,
e
mv2 / 2kT
正是分子热运动速率取值不等几率的表现,值得注意,这个 指数衰减律的结果没有单位,mv2/2是分子热运动的动能,kT 既有能量的量纲,所以指数衰减的指数部分是热运动的动能 与体系能量状态特征量之比,对于大的速率,指数衰减的速 度比v2增加的速度快得多,二者共同影响的结果,分布函数 值必然较小。
vf v dv
Nvfvdv
(B)
v2
v1 v2 v1
vf v dv f v dv
(C)
v2
v1
(D)
v2 v1
vf v dv N
(B)
2.麦克斯韦速度分布律
在平衡态下,当气体分子间的相互作用可以 d v的分子 忽略时,分布在速度区间 v ~ v 数占总分子数的比率为
dω= 4πv2dv
麦克斯韦速率分布律
将dω=dvxdvydvz代入
dN m e N 2 kT
x y
3 2 2 2 m ( v v v 2 x y z) 2 2 kT
v dv dv dv x y z
麦克斯韦 速率分布 分布律
2 2 2 2 且: v v v v z
小球在伽 尔顿板中的分 布规律 .
统计规律 当小球数 N 足够大时小球的分布具有 统计规律. . . . . . . . . . 设 N i 为第 i格中的粒子数 .
热学-统计物理3 第3章 气体分子热运动速率和能量的统计分布律
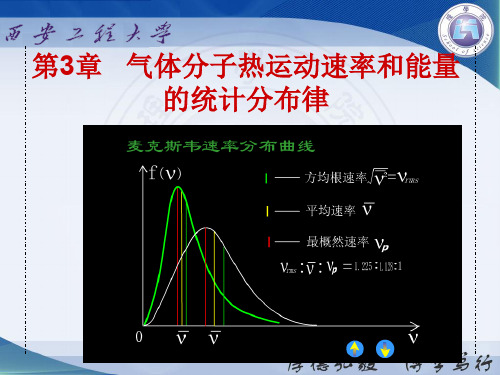
v v pv v 2
讨论
麦克斯韦速率分布中最概然速率 vp 的概念
下面哪种表述正确?
(A) vp 是气体分子中大部分分子所具有的速率. (B) vp 是速率最大的速度值. (C) vp 是麦克斯韦速率分布函数的最大值.
(D) 速率大小与最概然速率相近的气体分子的比 率最大.
例1 计算在 27 C 时,氢气和氧气分子的方均
M
3.方均根速率 v2
v2
N
0
v2dN N
0
v2Nf N
(v)dv
o
v
v2 v2 f (v)dv 4 ( m )3 2 e mv2 2kT v4dv
0
2 kT
0
v4ev2 dv 3
0
8 5
v2 3kT m
v2 3kT 3RT
2kT
v
麦克斯韦速率分布函数的物理意义: f (v) dNv
Nd v
既反映理想气体在热动平衡条件下,分布在速率 v 附近单
位速率区间内的分子数占总分子数的百分比,又表示任意
一分子的速率出现在 v附近单位速率区间内的概率。
如果以速率为横坐标轴,速率分布函数为纵坐标轴,画 出的一条表示f(v) —v之间关系的曲线,称为气体分子的麦 克斯韦速率分布曲线。 ,它形象地描绘出气体分子按速率 分布的情况。
大量分子的速率的算术平均值叫做分子的平均速率.
v
vNf (v)dv
0
vf (v)dv
v 4 (
m
)3 e2 mv2 2kT v2dv
N
0
0
分子平均运动速度

分子平均运动速度一、引言分子运动的速度是一个涉及分子物理学、化学和工程学等多个学科的重要概念。
它描述了分子在气体、液体或固体中的移动速度,揭示了分子的运动特性。
分子平均运动速度作为这一概念的核心,对于理解物质的热力学、传热和传质等过程至关重要。
本文将对分子平均运动速度的概念、影响因素、实验研究方法及其应用领域进行详细的探讨。
二、分子平均运动速度的定义分子平均运动速度是指在某一温度和压力下,单个分子在连续两次碰撞之间所移动的平均距离与所用的时间的比值。
这个速度通常以米每秒(m/s)为单位进行测量。
在理想气体中,分子平均运动速度与分子的动能和分子质量有关,其计算公式为:v=√(8kT/πm),其中k是玻尔兹曼常数,T是绝对温度,m是分子质量。
三、分子平均运动速度的影响因素分子平均运动速度受到多种因素的影响。
以下是一些主要的影响因素:1.温度:随着温度的升高,分子的平均动能增大,因此其平均运动速度也会相应增大。
2.分子质量:较轻的分子具有较大的动能,因此它们的平均运动速度通常更快。
相反,较重的分子具有较小的平均运动速度。
3.压力:在较高的压力下,分子间的碰撞频率增加,这可能会影响分子的平均运动速度。
4.分子间的相互作用:分子间的相互作用力,如范德华力、氢键等,也会影响分子的平均运动速度。
5.分子的扩散系数:扩散系数决定了分子在介质中的迁移能力,它与分子的平均运动速度密切相关。
四、实验研究与观测方法为了实际测量分子平均运动速度,研究者们采用了多种实验技术和观测方法。
以下是一些常用的方法:1.分子束实验:通过将一束单一种类的分子射入真空室,并观察这些分子的飞行路径和速度分布,可以测量分子的平均运动速度。
这种方法可以提供关于分子速度的详细信息。
2.粒子图像速度场仪(PIV):这是一种用于测量流体中粒子速度的激光诊断技术。
通过将小颗粒散布在流体中并使用高速摄像机记录它们的运动轨迹,可以测量流体的流速和分子的平均运动速度。
热力学-3.气体分子动理论速率与能量

1.59 RT M
一般用于计算分子运动的平均距离;
同理,方均根速率
v2 v2 f (v)dv
3kT
3RT 1.73 RT
0
m
M
M
方均根速率用来计算分子平均动能。
最概然速率
2kT 2RT
RT
vp
m
1.41
M
M
最概然速率用在讨论分子速率分布。
f(v)
O
vp v v2
•在气体动理论方面,他提出气体分子按 速率分布的统计规律。
1。由于分子受到频繁的碰撞,每个分子热运动的速率是变化的, 要某一分子具有多大的运动速率没有意义,所以只能估计在某 个速率间隔内出现的概率;
2。哪怕是相同的速率间隔,但是不同的速率附近,其概率是不 等的。
速率接近为0的可能性很小,速率非常大的可能性也很小, 而居中速率的可能性则较大。
f (v) dN Ndv
速率分布函数
理解分布函数的几个要点: 1.条件:一定温度(平衡态)和确定的气体系统,T和m是一定的;
2.范围:(速率v附近的)单位速率间隔,所以要除以dv; 3.数学形式:(分子数的)比例,局域分子数与总分子数之比。
f (v)dv dN N
N v1 v2
v2
f (v)dv
第三章 气体分子热运动 速率和能量的统计分布律
内容回顾
第一章 平衡态和温度 第二章 压强和温度的微观本质
平均效果
气体分子按速率分布的统计规律最早是由麦克斯韦于
1859年在概率论的基础上导出的,1877年玻耳兹曼由经典统 计力学中导出,1920年斯特恩从实验中证实了麦克斯韦分子 按速率分布的统计规律。
气体的分子速率计算

气体的分子速率计算气体的分子速率计算是物理学中的一个重要概念。
在研究气体行为、热力学性质以及化学反应时,了解气体分子的速率非常有帮助。
本文将介绍气体的分子速率计算的原理和方法。
首先,我们需要了解气体分子速率计算的基本参数。
分子速率通常用平均速率表示,即气体分子实际速率的平均值。
它与气体分子的质量和温度有关。
根据动能定理,气体分子的平均动能与温度成正比。
因此,当温度升高时,分子的平均动能也会增加。
而分子的动能与速率有直接的关系。
因此,当温度升高时,分子的平均速率也会增加。
根据理想气体状态方程,PV=nRT,其中P表示气体的压力,V表示气体的体积,n表示气体的物质量,R为气体常数,T表示气体的绝对温度。
根据这个方程,我们可以推导出气体分子的平均速率公式。
首先,我们需要考虑分子速率分布的相关概念。
根据玻尔兹曼分布定律,分子速率服从Maxwell-Boltzmann速率分布,其概率密度函数为f(v) = (m/2πkT)^(3/2) * 4πv^2e^(-mv^2/2kT),其中m表示气体分子的质量,k为玻尔兹曼常数,T为气体的绝对温度。
在这个速率分布中,v表示分子速率,f(v)表示该速率下分子的概率密度。
我们可以根据这个概率密度函数来计算平均速率。
首先,我们需要计算气体分子的平均速率的平方,即⟨v^2⟩。
在Maxwell-Boltzmann速率分布下,⟨v^2⟩= ∫(v^2)f(v)dv ,我们可以将此积分分解成三个积分:⟨v^2⟩= (∫v^4e^(-mv^2/2kT)dv) *(∫(m/2πkT)^(3/2)v^2e^(-mv^2/2kT)dv)。
对于第一个积分(∫v^4e^(-mv^2/2kT)dv),我们可以使用数值方法来计算。
而第二个积分(∫(m/2πk T)^(3/2)v^2e^(-mv^2/2kT)dv) 是一个常数,与速率分布无关。
因此,我们可以将这个常数用一个符号C来表示。
于是,我们有⟨v^2⟩= C * (∫v^4e^(-mv^2/2kT)dv) 。
热学第三章 气体分子速率和能量统计分布律

第三章 气体分子速率和能量统计分布律
概率统计基础知识
对于由大量分子 组成的热力学系 统从微观上加以 研究时,必须用 统计的方法 .
f (v) 4π(
m
)3
2
mv 2
e 2kT
v2
2πkT
dN 4π(
m
)3
2
mv 2
e 2kT
v2dv
N
2πkT
反映理想气体在热动平衡
波尔兹曼常量
f (v) dN Ndv
f (v)
条件下,气体分子按速率
分布的规律 .
o
v
三 三种统计速率
1)最概然速率 v p
f (v)
f max
df (v) 0 dv vvp
S
速率位于 v v dv内分子数:
o
v1 v2 v
dN Nf (v)dv
速率位于 v1
v2
区间的分子数
N
v2
v1
N
f
(v)dv
速率位于 v1 v2 区间的分子数占总数的百分比
S
N (v1 N
v2 )
v2
v1
f
(v)dv
例1
N 个假想的气体分子,其速率分布如图所示,(1)根据
N 和 v0 求 a 的值;(2)求速率在 2v0 到 3v0 间隔内的分子 数;(3)求分子的平均速率。 N f(v)
即:在任一瞬时,一个气体 分子在速度空间中与一个代
表点相对应,气体的N 个分子 对应有N 个代表点。这样就
气体分子的平均动能与速率分布

气体分子的平均动能与速率分布气体是一种物质的聚合态,由大量的分子组成。
这些分子可以自由运动,彼此之间只有微弱的相互作用力。
在气体分子中,分子之间的平均距离相较于分子的尺寸来说是非常大的,因此可以将气体看作是一个弛豫系统。
而气体分子的平均动能与速率分布是描述气体性质的关键因素。
首先,我们来探讨气体分子的平均动能。
根据气体分子的动能理论,气体分子的平均动能与其温度成正比。
这是因为温度是物体内部分子的热运动程度的度量。
对于气体分子,它们的速度与能量是紧密相关的。
速度较大的分子动能较高,速度较小的分子动能较低。
因此,我们可以得出结论:气体分子的平均动能与气体的温度相关,温度越高,分子的动能越大。
其次,我们来探讨气体分子的速率分布。
速率是描述物体运动的物理量,与速度密切相关。
对于气体分子,不同分子具有不同的速率。
有些分子的速率较大,有些分子的速率较小。
速率分布与分子的速度分布有关。
根据玻尔兹曼分布定律,气体分子的速度分布是服从一个特定的分布曲线的。
这个分布曲线被称为麦克斯韦分布曲线。
麦克斯韦分布曲线是由麦克斯韦速度分布定律给出的。
该定律说明了理想气体分子速度的概率密度函数与温度的关系。
根据麦克斯韦速度分布定律,分子的速度分布满足一个二次高斯分布,即分子速度的概率密度与速率的平方成正比。
在麦克斯韦分布曲线中,有两个重要的参数:平均速率和最概然速率。
平均速率是所有分子速率的平均值,它代表了气体中分子的整体运动情况。
最概然速率是速率分布曲线的峰值对应的速率值,它代表了大多数分子的速率。
根据麦克斯韦分布曲线的形状可知,最概然速率小于平均速率。
对于不同温度的气体,麦克斯韦分布曲线的形状会发生变化。
当温度升高时,曲线会向右扩展,说明分子速率的范围增加。
而当温度降低时,曲线会向左收缩,说明分子速率的范围减少。
同时,当温度升高时,最概然速率也会增加,表示大多数分子的速率增加。
这与我们之前得出的结论一致:温度升高,分子的动能增加,速率分布范围增大。
《分子的热运动》热运动速率分布

《分子的热运动》热运动速率分布在我们生活的这个世界里,物质的存在和变化都有着其内在的规律。
其中,分子的热运动就是一个非常重要的现象。
而分子热运动的速率分布,则是理解许多物理和化学过程的关键。
让我们先来想象一下,假如我们能够把自己缩小到分子的尺度,那会是怎样一番景象?我们会看到周围的分子都在不停地运动,就像一群没有指挥的舞者,各自以不同的速度和方向跳跃、旋转。
分子热运动的速率并不是均匀一致的,而是呈现出一定的分布规律。
这种分布与温度有着密切的关系。
温度越高,分子的平均动能就越大,运动速率也就越快。
为了更好地理解分子热运动速率分布,我们需要引入一个重要的概念——麦克斯韦速率分布函数。
它就像是一张地图,告诉我们在一定温度下,不同速率的分子所占的比例。
在低温时,分子的运动速率普遍较低。
大多数分子都慢悠悠地移动着,只有极少数分子具有较高的速率。
而随着温度的升高,情况就发生了明显的变化。
越来越多的分子获得了更高的能量,运动速率加快。
想象一下,在一个寒冷的冬天,室内的温度较低,空气分子的热运动相对缓慢。
我们可能不会感觉到强烈的空气流动。
但当夏天来临,温度升高,空气分子的热运动变得更加剧烈,我们就能更明显地感受到风的存在。
麦克斯韦速率分布函数呈现出一个独特的形状。
它有一个峰值,表示最概然速率,即在这个速率附近的分子数量最多。
同时,还有一个平均速率和方均根速率。
最概然速率是一个很有趣的概念。
它告诉我们在特定温度下,哪种速率的分子最常见。
比如说,在某个温度下,大多数氧气分子的运动速率接近最概然速率。
平均速率则是所有分子速率的平均值。
它能让我们对分子整体的运动速度有一个大致的了解。
方均根速率则与分子的动能有着更直接的关系。
通过计算方均根速率,我们可以更好地理解分子能量的分布情况。
分子热运动速率分布在许多领域都有着重要的应用。
在化学中,它有助于我们理解化学反应的速率和方向。
不同速率的分子在相互碰撞时,发生反应的可能性也不同。
气体分子的热运动与速度分布

气体分子的热运动与速度分布在我们的生活中,气体无处不在,无论是我们呼吸的空气,还是我们家中使用的燃气,都是由气体组成的。
那么,气体分子是如何运动的呢?它们的速度分布又是怎样的呢?让我们一起来探索气体分子的热运动和速度分布。
首先,让我们来了解一下气体分子的热运动。
气体分子无线自由运动着,距离彼此远去,而且它们之间的相互作用力较小。
这使得气体分子可以在容器中快速移动,并不断与容器壁碰撞。
这种热运动使得气体分子呈现出多种不同的运动方式,如直线运动、旋转运动和振动运动等。
可以说,气体分子的热运动是密不可分的。
接下来,我们来讨论气体分子的速度分布。
根据统计力学的理论推导,气体分子的速度分布服从麦克斯韦速度分布定律。
麦克斯韦速度分布定律告诉我们,在给定温度下,气体分子的速度可以呈现出一个特定的分布情况。
根据麦克斯韦速度分布定律,气体分子的速度分布呈现出高斯分布曲线。
也就是说,在给定温度下,大部分气体分子的速度集中在一个平均速度附近,而少部分气体分子的速度偏离平均速度。
这个平均速度可以由麦克斯韦-波尔兹曼速度分布定律计算得到。
麦克斯韦-波尔兹曼速度分布定律告诉我们,气体分子的平均速度与温度成正比。
具体地说,平均速度与平方根温度成正比,即$v_{avg} \propto \sqrt{T}$。
这意味着,温度越高,气体分子的平均速度也越高。
除了平均速度,气体分子的速度分布还涉及到速度的分散程度。
可以使用速度的标准差来度量速度的分散程度。
根据麦克斯韦速度分布定律,气体分子的速度标准差与平均速度成正比,即$\sigma \propto v_{avg}$。
这意味着,平均速度越高,气体分子的速度分散程度也越大。
此外,气体分子速度的分布还与气体分子的质量有关。
根据麦克斯韦-波尔兹曼速度分布定律,质量较大的分子相对运动较慢,质量较小的分子相对运动较快。
因此,在相同温度下,质量较大的气体分子的平均速度要比质量较小的分子的平均速度小。
热学(李椿章立源钱尚武)习题解答第三章气体分子热运动速率和能量的统计分布律

第 三 章 气体分子热运动速率和能量的统计分布律3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTm N V KTm∆⋅⋅⋅-22232)2(4ππ ∵ V p2= 2KTm ,代入上式△N=VV V ppe V V VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /402102827331.823≅⨯⨯⨯=- △V=1m/s (vv p =1.24)代入计算得:△N=1.86×10-3N 个3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。
气体分子热运动速率和能量的统计分布律

f (v)
dS
o v v dv
物理意义
表示在温度为 T 的平衡
状态下,速率在 v 附近单位
速率区间 的分子数占总数的
v 百分比 .
热学
3
dN f (v)dv dS N
表示速率在 v v dv
区间的分子数占总分子数的 百分比 .
归一化条件
N
0
dN N
0
f
(v)dv
1
f (v)
速率位于 v v dv 内分子数
热学
11
麦克斯韦(James Clerk
Maxwell 1831-1879)
1861年选为伦敦皇家学会会员。1865年春辞去教职回到家乡系统
地总结他的关于电磁学的研究成果,完成了电磁场理论的经典巨著
《论电和磁》,并于1873年出版,1871年受聘为剑桥大学新设立
的卡文迪什试验物理学教授,负责筹建著名的卡文迪什实验室,
麦克斯韦是19世纪伟大的英国物理学家、数 学家。1831年11月13日生于苏格兰的爱丁堡, 自幼聪颖,父亲是个知识渊博的律师,使麦克斯 韦从小受到良好的教育。10岁时进入爱丁堡中学 学习,14岁就在爱丁堡皇家学会会刊上发表了一 篇关于二次曲线作图问题的论文,已显露出出众 的才华。1847年进入爱丁堡大学学习数学和物 理。1850年转入剑桥大学三一学院数学系学习, 1854年以第二名的成绩获史密斯奖学金,毕业 留校任职两年。1856年在苏格兰阿伯丁的马里 沙耳任自然哲学教授。1860年到伦敦国王学院 任自然哲学和天文学教授。
vp
2kT m
2 RT M
v
8kT πm
v2 3kT m
热学
9
f (v)
气体分子的热运动

气体分子的热运动气体是一种经常出现在我们周围的物质,例如空气、氢气、氦气等。
它们都有一个共同的特点:分子间距离大,分子速度快,并且呈无规则的运动状态。
这种无规则的速度运动状态被称为热运动,而气体分子热运动的规律则是研究气体物理学中一个非常重要的领域。
气体分子热运动的规律可以用一些基本原理来解释。
首先,气体分子的热运动是与环境温度密切相关的。
当气体分子的热运动温度升高时,分子的平均速度也随之增加。
此外,气体分子的热运动是随机的。
分子的速度、方向都是不可预测的。
然而,当我们观察足够多的分子后,它们的平均行为却是可以预测的。
例如,我们知道气体分子在具有压强的容器中,会均匀地分布,并且会从高压区域向低压区域移动。
实际上,气体分子的热运动是一种很复杂的现象。
在分子间有吸引力或排斥力的情况下,分子的行为会更加复杂。
这种吸引力或排斥力的现象是由分子的化学特性决定的。
不同气体分子之间的化学特性也是不同的,因此它们的热运动规律也是不相同的。
除了温度、压强、化学特性等因素,气体分子的大小和形状也会影响它们的热运动规律。
例如,分子尺寸越大,它们的平均速度就会越慢,而分子尺寸越小时,其速度就会越快。
在气体物理学中,有一些重要的参数被用来描述气体分子的热运动性质。
其中最重要的是温度和压强。
温度是对气体分子平均动能的一种度量,而压强则是分子对容器壁施加的力量。
另一个重要的参数是分子的平均自由程。
这个参数是指分子在旅行过程中,与其他分子或容器壁碰撞的平均距离。
此外,还有一些其他的参数,例如分子的速率分布、平均速度、平均动能等,都可以用来描述气体分子的热运动规律。
气体分子的热运动规律不仅是气体物理学的核心,也是理解和解释许多现象的重要工具。
例如,我们可以利用气体分子的热运动,来解释为什么气体在高温下膨胀、为什么液化气罐在过热时会爆炸、为什么气压计可以测量气体压强等等。
总的来说,气体分子的热运动规律是一项非常重要的研究领域。
这种复杂的运动状态是由很多因素共同作用形成的,理解其中的原理和规律对于许多领域都具有重要的意义。
第三章气体分子热运动速率和能量的统计分布律

热学
14
讨论
麦克斯韦速率分布中最概然速率 vp 的概念
下面哪种表述正确?
(A) vp 是气体分子中大部分分子所具有的速率. (B) vp 是速率最大的速度值. (C) vp 是麦克斯韦速率分布函数的最大值.
(D) 速率大小与最概然速率相近的气体分子的比 率最大.
N
N
v
v f (v)dv
8kT
0
πm
v 1.60 kT 1.60 RT
f (v)
m
M
3)方均根速率 v2
o
v
v2
N
0
v2dN N
0
v2
Nf
N
(v)dv
v2 3kT m
热学
8
vp v v2
vrms
v2
3kT m
3RT M
v 1.60 kT 1.60 RT
m
M
vp
2kT m
为清楚起见 , 从正面来
观察。
铁钉
隔板
热学
28
统计规律和方法
伽尔顿板 再投入小球: 经一定段时间后 , 大量小
球落入狭槽。
分布情况:中间多,两边少。
重复几次 ,结果相似。
单个小球运动是随机的 , 大量小球运动分布是确定的。
大量偶然事件整体所遵 循的规律 —— 统计规律。
热学
小球数按空间 位置 分布曲线
v2
dN 4π(
m
)3
2
e
mv2 2 kT
v2
dv
N
2πkT
热学
5
反映理想气体在热动 平衡条件下,各速率区间 分子数占总分子数的百分
热力学理想气体的温度和分子速率

热力学理想气体的温度和分子速率热力学是研究物质在各种条件下热现象的科学。
而热力学理想气体则是理论模型中被广泛研究的对象。
在热力学理想气体中,温度和分子速率是两个重要的参数,它们之间存在着一定的关系。
本文将探讨热力学理想气体的温度与分子速率之间的关系。
1. 热力学理想气体的基本概念热力学理想气体是一个理想化的气体模型,假设气体分子之间没有相互作用,分子体积可以忽略不计。
这个模型简化了实际气体系统的复杂性,使得研究变得更加简便。
2. 温度的定义与热力学理想气体温度是一个描述物体热运动程度的物理量。
在热力学理想气体中,温度与分子的平均动能有关。
根据理想气体状态方程PV=nRT,其中P 为气体的压强,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的绝对温度。
从这个方程中可以看出,温度与分子的运动速率有关。
3. 分子速率的统计分布与温度热力学理想气体中,分子速率的分布符合麦克斯韦速率分布定律。
该定律表明,温度越高,分子速率分布图形越平缓,且高速分子占的比例越高;温度越低,分子速率分布图形越陡峭,且低速分子占的比例越高。
这是因为温度高时,气体内分子的动能更大,速率更高;而温度低时,分子动能较小,速率较低。
4. 温度与分子速率的关系根据麦克斯韦速率分布定律,可以推导出温度与分子速率之间的关系。
在热力学理想气体中,分子速率的平均值与温度成正比。
即温度升高,分子速率的平均值也随之增加;温度降低,分子速率的平均值也相应减小。
同时,温度还与分子速率的分布范围和峰值位置有关。
5. 热力学理想气体的温度测量在实际应用中,我们常常需要测量热力学理想气体的温度。
常见的温度测量方式有气压温标法和热力学温标法。
气压温标法利用气体的压强与温度之间的关系进行测量;热力学温标法则是利用两个系统之间的热平衡状态进行测量。
6. 应用和意义热力学理想气体的温度与分子速率的关系在许多领域中具有广泛的应用和意义。
例如在化学反应中,理解温度与分子速率的关系能够帮助我们理解反应速率与反应条件之间的联系。
§3.1 气体分子的速率分布

mv 2 Av 2 exp 2kT
可以通过归一化可求出系数 A 。
0
m v2 Av2 exp dv 1 2kT
m 3/ 2 A 4 ( ) 2kT
三、用麦克斯韦速率分布函数求平均值
(1) 平均速率
v vf (v)dv
1/ 2
mv i2 exp 2kT
dvi
其中i 可分别代表x、y、z。
x 方向速度分量的概率
分布曲线如图所示,它对 称于纵轴,图中打上斜线 狭条面积即
2 m vx dN (vx ) m 1/ 2 f (vx )dvx ( ) exp dvx N 2kT 2kT
v v2
v p : v : v 2 1 : 1.128: 1.224
四、 麦克斯韦速度分布
前面已指出,麦克斯韦是先导出速度分布,然后再 从速度分布得到速率分布的。
本节中介绍麦克斯韦速度分布。
为了说明速度分布的含义,先介绍速度空间的概念。
速度矢量
要描述气体分子的速度大小和方向,
需引入速度矢量这一概念.
§1 . 气体分子的速率分布律 大数分子无规则运动及它们之间频繁地相互碰撞;
分子以各种大小不同的速率随机地向各个方向运动;
在频繁的碰撞过程中,分子间不断交换动量和能量,使 每一分子的速度不断变化。
处于平衡态的气体,虽然每个分子在每一瞬时的 速度大小、方向都在随机地变化着,但是大多数分子 之间存在一种统计相关性,这种统计相关性表现为平 均说来气体分子的速率(指速度的大小)介于任何 v 到v + dv 的概率(即速率分布函数)是不会改变的。
右图示意表示了麦克斯韦速率
1.3分子运动速率分布规律

1.3 分子运动速率分布规律基础导学要点一、气体分子运动的特点(1)气体分子间的距离较大,使得分子间的相互作用力十分微弱,可认为分子间除碰撞外不存在相互作用力,分子在两次碰撞之间做匀速直线运动。
(2)分子间的碰撞十分频繁,使每个分子的速度大小和方向频繁地发生改变,造成气体分子的运动杂乱无章。
(3)大量气体分子的速率分布呈现“中间多、两头少”的规律。
当温度升高时,“中间多”的这一“高峰”向速率大的一方移动。
要点二、分子运动速率分布图像1.温度越高,分子热运动越剧烈.2.气体分子速率呈“中间多、两头少”的规律分布.当温度升高时,某一分子在某一时刻它的速率不一定增加,但大量分子的平均速率一定增加,而且“中间多”的分子速率值增加(如图所示).要点三、气体压强的微观解释1.气体压强的产生原因:大量气体分子不断撞击器壁的结果.2.气体的压强:器壁单位面积上受到的压力.3.微观解释:(1)某容器中气体分子的平均速率越大,单位时间内、单位面积上气体分子与器壁的碰撞对器壁的作用力越大.(2)容器中气体分子的数密度大,在单位时间内,与单位面积器壁碰撞的分子数就多,平均作用力也会较大.要点突破突破一:分子运动的性质自由性气体分子间距离比较大,分子间的作用力很弱,除相互碰撞或者跟器壁碰撞外,可以认为分子不受力而做匀速直线运动,因而气体会充满它能到达的整个空间无分子之间频繁地发生碰撞,使每个分子的速度大小和方向频繁地改变,分子的运动杂乱序性无章,在某一时刻,向着任何一个方向运动的分子都有,而且向着各个方向运动的气体分子数目几乎相等规律性气体分子的速率分布呈现出“中间多、两头少”的分布规律。
当温度升高时,速率大的分子数增多,速率小的分子数减少,分子的平均速率增大。
反之,分子的平均速率减小。
突破二:决定气体压强大小的因素(1)微观因素①与气体分子的数密度有关:气体分子数密度(即单位体积内气体分子的数目)越大,在单位时间内,与单位面积器壁碰撞的分子数就越多,气体压强就越大.①与气体分子的平均速率有关:气体的温度越高,气体分子的平均速率就越大,每个气体分子与器壁碰撞时(可视为弹性碰撞)给器壁的冲力就越大;从另一方面讲,分子的平均速率越大,在单位时间内器壁受气体分子撞击的次数就越多,累计冲力就越大,气体压强就越大.(2)宏观因素①与温度有关:体积一定时,温度越高,气体的压强越大.①与体积有关:温度一定时,体积越小,气体的压强越大.突破三:气体压强与大气压强的区别与联系典例精析题型一:气体分子运动的特点例一.以下说法正确的是()A.当两个分子间的距离为r0(平衡位置)时,分子势能最小且为零B.布朗运动反映了花粉小颗粒内部分子的无规则运动C.一定量的气体,在体积不变时,单位时间分子平均碰撞器壁的次数随着温度降低而减小D.液晶的光学性质不随温度、电磁作用变化而改变【答案】C【解析】A.当两个分子间的距离为r0(平衡位置)时,分子力为零,分子势能最小但不为0,所以A错误;B.布朗运动反映了液体分子的无规则运动,而不是花粉小颗粒内部分子运动,故B 错误;C.一定量的气体,温度降低,分子的运动的激烈程度减小,所以在体积不变时,单位时间分子平均碰撞器壁的次数随着温度降低而减小,所以C正确;D.温度、压力、电磁作用等可以改变液晶的光学性质,故D错误。
热学 (3 第三章 气体分子热运动速率和能量的统计分布率)

f ()d dN
N
dN
2
=
f
( )d
N 1
表示速率分布在→+d内的
分子数占总分子数的概率
表示速率分布在1→2内的分
子数占总分子数的概率
N
0
dN N
0
f
d
1
归一化条件
应注意的问题:
分布函数是一个统计结果,以上各种讨论都是建立在众多分子微 观运动基础上的,分子的数目越大,结论越正确。所以:
1、作速率分布曲线。 2、由N和vo求常数C。 3、求粒子的平均速率。 4、求粒子的方均根速率。
f (v)
C ( vo> v > 0) 0 ( v > vo )
f (v)
解:
f (v)dv
0
vo 0
Cdv
Cvo
1
C
C 1 vo
o
vo v
o f ()d o Cd C o2
3. 方均根速率
2
2
f
d
0
3
2
4
m
2 kT
2
e
m 2 2kT
4
d
3kT
3RT
0
mM
2 3kT 3RT
m
M
4. 三种速率的比较
最概然速率
p
2kT m
2RT M
平均速率
8kT 8RT m M
方均根速率
一、速率分布函数
气体分子处于无规则的热运动之中,由于碰撞,每个分子的速度都
第三章气体分子热运动速率

3.1 气体分子的速率分布律 3.2 用分子射线实验验证麦克斯韦速度分布律 3.3 玻尔兹曼分布律 重力场中微粒按高度的分布 3.4 能量按自由度均分定理
1
3.1 气体分子的速率分布律
统计规律性: 统计规律性: 分子运动论从物质微观结构出发, 分子运动论从物质微观结构出发,研究大量分子组成的 系统的热性质。其中个别分子的运动(在动力学支配下) 系统的热性质。其中个别分子的运动(在动力学支配下)是 无规则的 存在着极大的偶然性。但是, 无规则的,存在着极大的偶然性。但是,总体上却存在着确 定的规律性。(例 理想气体压强) 规律性。( 定的规律性。(例:理想气体压强) 人们把这种支配大量粒子综合性质和集体行为的规律性 称为统计规律性 统计规律性。 称为统计规律性。 气体中个别分子的速度具有怎样的数值和方向完全是偶 然的,但就大量分子的整体来看,在一定的条件下,气体分 然的,但就大量分子的整体来看,在一定的条件下, 子的速度分布也遵从一定的统计规律。 子的速度分布也遵从一定的统计规律。为研究气体分子速度 分布的定量规律,有必要介绍分布函数的概念。 分布函数的概念 分布的定量规律,有必要介绍分布函数的概念。
dNv m mv 2 2kT 2 v dv = 4π e N 2πkT
dNv = f (v)dv N
3 2
麦克斯韦速率分布函数
3 2
m mv 2 2kT 2 f (v) = 4π v e 2πkT
9
麦克斯韦速率分布曲线
f (v)
f (v)
O
v vp
v
10
麦克斯韦速率分布曲线
f (v)
N N N = ∴n f (v)dv= v1 V N V 表示分布在单位体积内, 表示分布在单位体积内,速率区间 v1 →v2
气体分子速率与温度关系

气体分子速率与温度关系在我们日常生活中,我们经常会涉及到气体这个物质状态。
气体是由无数个分子组成的,并且这些分子具有高度的热运动。
我们知道,温度是衡量物体热运动程度的物理量。
那么,气体分子的速率与温度之间是否存在关系呢?本文将介绍气体分子速率与温度之间的关系,并探讨其背后的物理原理。
首先,我们要了解气体分子的速率。
气体分子具有高速运动的特点,它们不断地做无规则的运动,沿着各个方向不断地碰撞。
这种高速运动的特点使得气体分子具有一定的动能。
动能是由分子的质量和速度共同决定的,即动能=1/2mv^2,其中m为分子的质量,v为分子的速度。
当气体受热时,温度升高,分子的平均动能也会增加。
这就是所谓的温度与气体分子速率之间的关系。
根据理论物理学中的理论,分子速率的平均值与温度之间存在直接的正比关系。
也就是说,温度越高,气体分子的速率也越高。
这样的关系可以通过动能定理来解释。
动能定理表明,当系统的温度升高时,系统的总动能会增加。
而气体分子的速率与其动能是直接相关的,因此气体分子的速率也随之增加。
换句话说,分子的动能增加导致了它们运动速率的增加。
此外,我们还可以通过碰撞理论来理解这个关系。
当气体分子受热时,它们的能量增加,运动速率也增加。
这样,分子之间的碰撞频率也会增加。
碰撞频率的增加意味着分子之间的平均自由程减小,即分子平均运动的距离减小。
因此,温度升高会导致分子速率的增加。
总结起来,气体分子速率与温度之间存在着直接的正比关系。
温度升高会使得气体分子的速率增加,从而使得它们的运动更加剧烈。
这个关系可以通过动能定理和碰撞理论来解释。
这个关系也为我们提供了一些应用。
例如,汽车引擎内燃烧时会产生大量的热能,从而使得气体分子的速率增加,增加了气体分子与汽缸内壁碰撞的频率。
这会使得汽车引擎的效率提高,使得汽车能够行驶更远的距离。
另外,气体分子速率与温度还与气体的压力有关。
根据理想气体状态方程PV=nRT,其中P为气体的压力,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
涨落现象 “涨落”现 象 ------测量值与统计值之间总有偏离 处在平衡态的系统的宏观量,如压强p,不随时 间改变, 但不能保证任何时刻大量分子撞击器壁的 情况完全一样, 分子数越多,涨落就越小。
飞镖
F(x)
分布曲线
伽耳顿板
从入口投入小球与钉碰撞 落入狭槽( 偶然 )
为清楚起见 , 从正面来观察。
N /( Nx)
O
x
x x
x
连续量的分布函数曲线
返回1 返回2
概率分布函数f(x),满足条件:
①
0 f ( x) 1, a x b
②
b
a
f ( x)dx 1
归一化条件
离散量与连续量的分布函数
三、统计平均值
对于离散型随机变量
统计平均值为
N1 x1 N 2 x 2 N k x k x N1 N 2 N k
N x
i 1 i
k
i
N
Ni xi Pi xi i 1 N i
k
方均值为
x
2 2 N x i i i 1 k k Ni 2 xi Pi xi2 i 1 N i 1 k
N
对于连续型随机变量 统计平均值为x xf ( x)dx
a
b
方均值为
x x f ( x)dx
—— 变量x可取某一区间内的一切数值。 随机变量x的概率密度:
dP ( x ) f ( x) dx
概率密度f(x)等于随机变量取值在单位间隔内的概率, 又称为概率分布函数(简称分布函数)。 分布函数
N 1 N 1 dN f (x) lim lim x 0 Nx N x 0 x N dx
铁钉
隔板
再投入小球: 经一定段时间后 , 大量小球落 入狭槽。 分布情况:中间多,两边少。 重复几次 ,结果相似。 单个小球运动是随机的 , 大量小球运动分布是确定的。 大量偶然事件整体所遵 循的规律 —— 统计规律。 小球数按空间 位置分布曲线
少数分子无规律性
大量分子的统计分布
统计规律性是对大量偶然事件整体起作用的规律, 它表现了这些事物整体的本质和必然的联系。对于 由大量分子组成的热力学系统从微观上加以研究时, 必须用统计的方法。 统计规律特点: (1)只对大量偶然的事件才有意义。 (2)它是不同于个体规律的整体规律(量变到质变)。 (3)大数量现象在一定宏观条件下的稳定性。 (4)统计规律是以动力学规律为基础的。 (5)永远伴随着涨落现象。
1、 离散型随机变量 表示方式
取值有限、分立
x1 , , xi , , xn P1 , , Pi , , Pn
Pi 为随机变量x的概率,满足条件: ① 0 P , i 1,2,... i 1
②
P 1
i
归一化条件
2、 连续型随机变量
取值无限、连续
分子射线的速率分布曲线
§1.气体分子的速率分布律
一、速率分布函数
1、速率分布函数的定义
平衡态下,气体分子速率v可以看做在0~∞之间连续分布的。 • 设系统的总分子数为: N
• 速率在v~v+dv之间的分子数:dN
• 速率在v~v+dv之间的分子数占系统总分子数的比率:dP=dN/N (对于任意一个分子来说,速率处于v~v+dv之间的概率)
D v 2s
令R以恒定的角速度转动较长的时间(一二十小时)。然 后取下玻璃板G,用测微光度计测定板上各处沉积的铋层的厚 度,找出铋层厚度随s变化的关系,从而确定铋分子按速率分 布的规律。
德国物理学家斯特恩(Sterm)最早于1920年做了分子射线 束实验以测定分子射线束中的分子速率分布曲线。 此处介绍朗缪尔(Langmuir)的实验装置。
PL lim
N
NL ( ) N
2、概率的基本性质
(1) 0 Pi 1 ,即事件i的概率只可能在0和1之间。 (2) 各种可能发生的事件的概率总和等于1.
N
P 1
i 1 i
归一化条件
3、等概率性
在掷骰子时,一般认为出现每一面向上的概率是相等的。 由此可总结出一条基本原理: 等概率性——在没有理由说明哪一事件出现概率更大些(或更 小些)情况下,每一事件出现的概率都应相等。
2 2 a
b
四、方差(涨落)
—— 表示随机变量x的取值在其统计平均值附近分散的程度。 (或描述x的取值在其统计平均值上下涨落的平均幅度。)
x 0
定义相对均方根偏差:
(x) 0
2
(x) rms
(x)
2
1/ 2
x
相对均方根偏差表示了随机变量在平均值附近分 散开分布的程度,也称为涨落、散度或散差。
S’ 分子源 狭缝屏
W
W’
P
淀积屏 速率筛
(装置置于真空之中)
实验装置
接抽气泵
Hg
金属蒸汽 狭 缝
l
l t v
显 示 屏
分子束中能穿过第一个凹槽的分子同时能第二个凹槽时,它的速 率v 满足如下关系:
v l
密勒-库什实验装置
分布曲线
只要调节不同的旋转角速度,就可以测出不同速率范围 Δv 内(凹槽有一定宽度)的分子射线强度,从而得到不同速 率范围的分子数比率。
3、概率的基本法则
(1)概率相加法则
—— n个互相排斥事件发生的总概率是每个事件发生概率之和。
(2)概率相乘法则 —— 同时或依次发生的,互不相关(相互统计独立)的事件 发生的概率等于各个事件概率之乘积。
二、随机变量
—— 如果一变量在一定条件下,能以确定的概率取各种不同 的数值,则该变量称为~。
概率论的基本知识
§1 气体分子的速率分布律 §2 用分子射线实验验证麦克斯韦速度分布律 §3 玻耳兹曼分布律 重力场中微粒按高度的分布
§4 能量按自由度均分定理
概率论的基本知识
一、概率的基本性质
1、概率的定义
概率是大量偶然事件从整体上反映出来的一种规律性。
若在相同条件下重复进行同一个试验,在总次数N足够多的 情况下(N→∞),计算所出现某一事件的次数NL,则这一 事件出现的百分比就是该事件出现的概率 :
§2
用分子射线实验验证麦克斯韦速度分布律
葛正权实验装置
分布曲线
D 铋分子由S3到达P’处所需时间为: t v
t 时间内R转过的角度为: 弧PP’长度:
设速率为v的分子沉积在P’处,s表示弧PP’长度,ω表示R的 角速度,D表示R的直径。
t
2
D 1 s D t 2 2
