第三章气体分子热运动速率
第三节 气体分子的速率分布

v v+ dv
v
示速率分布在v~v+ dv 中的
分子数与总分子数的比率 f
(v )dv
dN
N
(4)在v1~v2 区间内,曲线下的面积
f(v)
T
表示速率分布在v1~v2 之间的
分子数与总分子数的比率
v2 f (v)dv N
v1
N
O
v1 v2
v
( 速率分布曲线 )
(5)曲线下面的总面积, 等于分布在整个速率范围内所有各个速率
气体分子的速率分布
一、 速率分布函数
速率分布的概念 热运动中的分子的速率通过碰撞不断地改变,不可能逐个加
以描述, 要进行研究,就需要把分子的速率按大小划分成很多 个区间,然后确定各速率区间的分子数占总分子数的比例, 并研究随着速率区间的变化所引起的分子数相对比例的变 化.
速率
v1 ~ v2 v2 ~ v3 …
解: (1)由归一化条件,
0 f (v)dv 1
Nf(v) a
v0 a vdv 2v0 a dv
0 Nv0
N v0
O
a Nv0
v02 2
a N
v0
3 2
av0 N
1
a 2N 3v0
v0 2v0 v
(2) f (v) dNv Ndv
N dN 3v0 / 2
v0 / 2~3v0 / 2
0
0
2kT
8kT 1.59 RT
π
M
方均根速率
N
iv
2 i
v2 i
N
N
iv
2 i
v2 i
N
dNv f (v )dv N
v 2
热学-第三章气体分子热运动速率和能量分布

得:dN m 4 e 得
N
kT 2
v dv
记忆这个公式分三部分: 第一部分,4v2dv是“球壳”的体积,而“球壳”全方位的高 度对称性正是分子热运动想各个方向几率均等的生动表现;
第二部分 ,
e
mv2 / 2kT
正是分子热运动速率取值不等几率的表现,值得注意,这个 指数衰减律的结果没有单位,mv2/2是分子热运动的动能,kT 既有能量的量纲,所以指数衰减的指数部分是热运动的动能 与体系能量状态特征量之比,对于大的速率,指数衰减的速 度比v2增加的速度快得多,二者共同影响的结果,分布函数 值必然较小。
vf v dv
Nvfvdv
(B)
v2
v1 v2 v1
vf v dv f v dv
(C)
v2
v1
(D)
v2 v1
vf v dv N
(B)
2.麦克斯韦速度分布律
在平衡态下,当气体分子间的相互作用可以 d v的分子 忽略时,分布在速度区间 v ~ v 数占总分子数的比率为
dω= 4πv2dv
麦克斯韦速率分布律
将dω=dvxdvydvz代入
dN m e N 2 kT
x y
3 2 2 2 m ( v v v 2 x y z) 2 2 kT
v dv dv dv x y z
麦克斯韦 速率分布 分布律
2 2 2 2 且: v v v v z
小球在伽 尔顿板中的分 布规律 .
统计规律 当小球数 N 足够大时小球的分布具有 统计规律. . . . . . . . . . 设 N i 为第 i格中的粒子数 .
第 三 章 气体分子热运动速率和能量的统计分布律

第 三 章 气体分子热运动速率和能量的统计分布律3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTm N V KTm∆⋅⋅⋅-22232)2(4ππ ∵ V p2= 2KTm ,代入上式△N=VV V ppe V V VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /402102827331.823≅⨯⨯⨯=- △V=1m/s (vv p =1.24)代入计算得:△N=1.86×10-3N 个3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。
热学-统计物理3 第3章 气体分子热运动速率和能量的统计分布律
v v pv v 2
讨论
麦克斯韦速率分布中最概然速率 vp 的概念
下面哪种表述正确?
(A) vp 是气体分子中大部分分子所具有的速率. (B) vp 是速率最大的速度值. (C) vp 是麦克斯韦速率分布函数的最大值.
(D) 速率大小与最概然速率相近的气体分子的比 率最大.
例1 计算在 27 C 时,氢气和氧气分子的方均
M
3.方均根速率 v2
v2
N
0
v2dN N
0
v2Nf N
(v)dv
o
v
v2 v2 f (v)dv 4 ( m )3 2 e mv2 2kT v4dv
0
2 kT
0
v4ev2 dv 3
0
8 5
v2 3kT m
v2 3kT 3RT
2kT
v
麦克斯韦速率分布函数的物理意义: f (v) dNv
Nd v
既反映理想气体在热动平衡条件下,分布在速率 v 附近单
位速率区间内的分子数占总分子数的百分比,又表示任意
一分子的速率出现在 v附近单位速率区间内的概率。
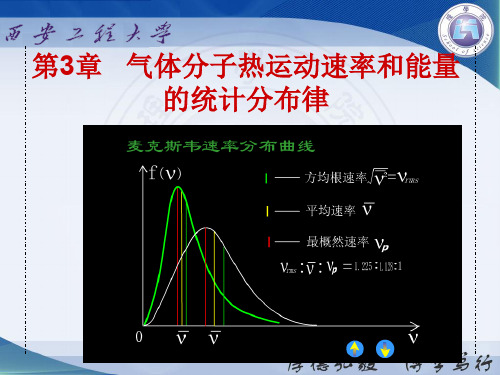
如果以速率为横坐标轴,速率分布函数为纵坐标轴,画 出的一条表示f(v) —v之间关系的曲线,称为气体分子的麦 克斯韦速率分布曲线。 ,它形象地描绘出气体分子按速率 分布的情况。
大量分子的速率的算术平均值叫做分子的平均速率.
v
vNf (v)dv
0
vf (v)dv
v 4 (
m
)3 e2 mv2 2kT v2dv
N
0
0
第三章 气体分子热运动速率和能量的统计分布规律

Ndv
2kT
1.麦克斯韦速率分布函数f()的物理意义
由 dN f (υ)dυ N
f (υ) dN Ndυ
f()表示:在速率附近的单位速率区间内的分子数占总 分子数的百分比。或分子速率出现在附近的单位速率区间内
的概率概率密度。
f (υ)dυ dN
N
—在速率区间 ~ +d 内的分子数占
例 (1) n f()d 的物理意义是什么?(n是分子的数密度)
(2) 写出速率不大于最可几速率p的分子数占总分子数
的百分比。
解 nf (υ)dυ Nf (υ)dυ dN
V
V
n f()d —表示单位体积中,速率在 ~+d 内的分子数。
(2) 写出速率不大于最可几速率p的分子数占总分子数的
dN v y N
g(y )dy
dNvz N
g(z )dz
(2)由独立概率相乘原理,粒子出现在x ~x+dx,y ~y+dy,z ~z+dz的
概率为:
dNv N
g(x )g(y )g(z )dxdydz
F • dxdydz
F就是速度分布函数
(3)由于粒子在任何方向上运动的概率相等,所以F应该与速度的方向 无关,应该是速度的大小的函数。
dNv N
1
3 3
e dv dv dv (vx2 vy2 vz2 ) / 2 xyz
转化成球坐标:
dvxdvydvz v2 sin dddv
vx2
v
2 y
vz2
v2
麦克斯韦速度分布:dNv 1 v2ev2 / 2 sin dddv N 3 3
分子热运动的速度和速率统计分布规律

f (v )
C
o
vo
v
解:
0
f (v)dv Cdv Cvo 1
0
vo
1 C vo
v vf (v)dv
0
vo
0
vo 1 v vo 2 2
2 o
2 vo Cvdv C 2
v v f (v)dv
2 2 0
voΒιβλιοθήκη 01 2 Cv dv vo 3
S1
Ag
例:利用麦克斯韦速率分布求:V
m 3 2 ) e 解: f (V ) 4π( 2πkT m 2 V 2 kT
p
V2 V
V2
kT 1.41 m
1.60 kT m
df (V ) 0 dV
2kT 2 RT Vp m M
8kT 8RT V πm πM
V V 2 f (V )dV
5
P 1.013 10 25 -3 N n 2.7 10 m -23 kT 1.38 10 273.15
M 28 10 kg mol
-3
-3
-1
M 28 10 -26 m 4.65 10 kg 23 N A 6.022 10
2 m N N e 2πkT
2 y
) g (v
2 z
)
2
+ v
2 y
g (v ) e
2 -av x
F (V ,V ,V ) Ae -aV
x y z
2
常数的确定:
---
F(v ,v ,v )dvdv dv 1
x y z x y z
热力学-3.气体分子动理论速率与能量

1.59 RT M
一般用于计算分子运动的平均距离;
同理,方均根速率
v2 v2 f (v)dv
3kT
3RT 1.73 RT
0
m
M
M
方均根速率用来计算分子平均动能。
最概然速率
2kT 2RT
RT
vp
m
1.41
M
M
最概然速率用在讨论分子速率分布。
f(v)
O
vp v v2
•在气体动理论方面,他提出气体分子按 速率分布的统计规律。
1。由于分子受到频繁的碰撞,每个分子热运动的速率是变化的, 要某一分子具有多大的运动速率没有意义,所以只能估计在某 个速率间隔内出现的概率;
2。哪怕是相同的速率间隔,但是不同的速率附近,其概率是不 等的。
速率接近为0的可能性很小,速率非常大的可能性也很小, 而居中速率的可能性则较大。
f (v) dN Ndv
速率分布函数
理解分布函数的几个要点: 1.条件:一定温度(平衡态)和确定的气体系统,T和m是一定的;
2.范围:(速率v附近的)单位速率间隔,所以要除以dv; 3.数学形式:(分子数的)比例,局域分子数与总分子数之比。
f (v)dv dN N
N v1 v2
v2
f (v)dv
第三章 气体分子热运动 速率和能量的统计分布律
内容回顾
第一章 平衡态和温度 第二章 压强和温度的微观本质
平均效果
气体分子按速率分布的统计规律最早是由麦克斯韦于
1859年在概率论的基础上导出的,1877年玻耳兹曼由经典统 计力学中导出,1920年斯特恩从实验中证实了麦克斯韦分子 按速率分布的统计规律。
热学[李椿 章立源 钱尚武]习题解答_第三章气体分子热运动速率与能量的统计分布律
![热学[李椿 章立源 钱尚武]习题解答_第三章气体分子热运动速率与能量的统计分布律](https://img.taocdn.com/s3/m/581192a543323968001c927e.png)
第 三 章 气体分子热运动速率和能量的统计分布律3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTm N V KTm∆⋅⋅⋅-22232)2(4ππ ∵ V p2= 2KTm ,代入上式 △N=VV V ppe V V VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /402102827331.823≅⨯⨯⨯=- △V=1m/s (vv p=)代入计算得:△N=×10-3N 个3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。
热学第三章 气体分子速率和能量统计分布律

第三章 气体分子速率和能量统计分布律
概率统计基础知识
对于由大量分子 组成的热力学系 统从微观上加以 研究时,必须用 统计的方法 .
f (v) 4π(
m
)3
2
mv 2
e 2kT
v2
2πkT
dN 4π(
m
)3
2
mv 2
e 2kT
v2dv
N
2πkT
反映理想气体在热动平衡
波尔兹曼常量
f (v) dN Ndv
f (v)
条件下,气体分子按速率
分布的规律 .
o
v
三 三种统计速率
1)最概然速率 v p
f (v)
f max
df (v) 0 dv vvp
S
速率位于 v v dv内分子数:
o
v1 v2 v
dN Nf (v)dv
速率位于 v1
v2
区间的分子数
N
v2
v1
N
f
(v)dv
速率位于 v1 v2 区间的分子数占总数的百分比
S
N (v1 N
v2 )
v2
v1
f
(v)dv
例1
N 个假想的气体分子,其速率分布如图所示,(1)根据
N 和 v0 求 a 的值;(2)求速率在 2v0 到 3v0 间隔内的分子 数;(3)求分子的平均速率。 N f(v)
即:在任一瞬时,一个气体 分子在速度空间中与一个代
表点相对应,气体的N 个分子 对应有N 个代表点。这样就
热学-第三章气体分子热运动速率和能量分布

等概率性
在平衡态下,系统从任意一个微观状态转移到另一个 微观状态的概率相等。
宏观态与微观态等概率性的意义
平衡态是系统内部最混乱的状态,即系统内部各个分 子运动状态的分布最均匀,没有明显的有序性。
热力学概率与宏观态的等概率性
热力学概率
宏观态等概率性与热力学概 率的关系
在平衡态下,系统处于各个宏观态的概率相等,即 热力学概率相等。
了解气体分子的能量分布和速度分布有助于深入理解热力学的基本原理,如温度 、内能、熵等概念。
03 气体分子的碰撞和动量传 递
气体分子间的碰撞频率
总结词
气体分子间的碰撞频率与气体分子的速度分布和分子间的距离有关,是气体分子热运动的重要参数。
详细描述
气体分子间的碰撞频率是指在单位时间内,两个分子相互碰撞的次数。由于气体分子的速度分布和分 子间的距离不同,碰撞频率也会有所差异。在理想气体中,碰撞频率可以用公式计算,它与气体分子 的平均自由程和分子速度有关。
定义
气体分子在热运动中具有的 平均能量是指所有气体分子 的总能量除以分子总数。
计算公式
平均能量 = (总能量) / (分子 总数)
影响因素
温度和物质的种类会影响气 体分子的平均能量。
气体分子的最可几能量
01
定义
气体分子在热运动中具有的最可 几能量是指一定温度下,占据一 定数量的分子的主要能量的值。
熵与自然过程的不可逆性
熵与自然过程的不可逆性密切相关,因为高熵状态对应于无序程度较高的状态,低熵状态对应于有序 程度较高的状态。
在自然过程中,由于熵增加原理的作用,系统总是向着高熵状态发展,即从有序向无序发展。因此,许 多自然过程都是不可逆的。
例如,物体受热会膨胀,但自发地收缩;化学反应会进行到底,但自发地逆向反应很困难;生物体衰老 和死亡后不能自发地恢复青春等。这些都是由于系统内部熵增加导致的不可逆过程。
大学物理第三章 分子动理论

乙
分子力的形成说明图
Epr
用分子力解释几个物理现象如物 质的三态等。
o
斥力 分子力
r0
r
引力
势能曲线
r
点评 相变与相变理论
物质的相态 固,液,气,等离子体
相变理论 相变温度 相变点 相变能 相变系数
第二节 理想气体的压强
气体对容器壁作用表现为气体的压强,此压强可以用气体动理 论加以微观解释。
本章研究内容:
1 宏观量 P,T与微观量间的统计关系.
2 微观量与微观量间的统计关系. 运用统计方法
名句赏析 小楼一夜听春雨, 深巷明朝卖杏花。
内容提要
宏观量压强和温度的微观解释 物质的内能 理想气体的速率分布规律 几个微观量的统计平均值
第一节 分子热运动的基本概念
一 分子运动论 1 宏观物体是由大量不停息地运动着的分子或原子组成的,称 为分子热运动。如在气体内部一分子一秒遭一百万次碰撞。1827年 被英国植物学家布朗证实:布朗运动,微粒受到周围分子的碰撞的 不平衡引起的。
第二编 热 学
返回
热学是研究热现象的规律。热现象是物质中大量分子热运 动的集体表现。本篇将介绍统计物理的基本概念和气体动理论的 基本内容以及热力学的基本规律。
气体动理论或称分子物理学的系统研究源于十八世纪以后, 伯努利,罗蒙罗索夫,道耳顿等开辟了奠基性的工作。十九世纪 六十年代,麦克斯韦,克劳修斯,玻耳兹曼等人在前人的基础上, 应用统计的方法,探索物质大量分子集体性质的一般统计规律, 从而阐明了热现象的本质。二十世纪初发展的量子理论,对上述 经典统计理论做了重要的修改和补充。
十八世纪初欧洲工业革命,尤其是蒸气机的应用,促进了热 力学的发展,建立了系统的计温学和量热学。经焦耳,迈尔,卡 诺等人系统的总结,建立了热力学第一定律。克劳修斯和开尔文 又独立的发现了热二律。形成了今天的热力学理论。
第3章 气体分子热运动速率和能量的统计分布

v vxi vy j vzk
速度空间体积元
速率分布是速度矢量大小被限制在一定区间
满足此条件的速度矢量其端点位于半径为 v,厚度为dv的球壳内
球壳体积为
17
用球壳体积
代替
并注意 v2 vx2 v2y vz2 得麦克斯韦速率分布
dN 4π(
n n 1 n
•分子数∆n 越大,涨落的百分数就越小,涨落现象越不显著。
• 麦克斯韦速率分布律只对大量分子组成的体系才成立。 9
三、用麦克斯韦速率分布函数求平均值
平均速率(算术平均值)
离散型
v v1N1 v2N2 viNi vnNn i viNi
N
N
连续型
N
v 0 vdN 0 vNf (v)dv
•当R 以一定的角速度转动,铋分子由S3到达G需用一段时间。 • 这段时间内R己转过一角度,铋分子不再沉积在板上P处。 • 不同速率的分子将沉积在不同的地方.速率大的分子由S3到G所需
的时间短,沉积在距P较近的地方,速率小的分子沉积在距P较远 的地方。
34
•设速率为 v的分子沉积在P’处以s 表示弧PP’的长度。 表示R的
N1, N2,…, Ni, …
小球在槽内的分配情况,称为一种分布。
总数足够大,槽内的小球的数目与小球总数之比
..........
.. . .
.......
. . .
. . .
. . .
. . .
. . .
. . .
. . .
. . .
. . .
. .
. . .
.
. . .
.
. . .
热学第三章

3/ 2
1
1
1
1/ 2
1
1/ 2
1
1 y m −2v2 / kT f (vy ) = e 2πkT 1 m −2vz2 / kT f (vz ) = e 2πkT 1/ 2
1/ 2
f (v) = f (vx ) f (vy ) f (vz )
积分公式:
translation rotation
2
如果某种气体的分子有t个平动自由度,r个转 动由度,s个振动自由度,则分子的平均平动 s t kT , kT 能,平均转动能和平均振动能就分别为 2 2 r 1 kT 和 2 ,而分子的平均总动能即为 (t + r + s)kT
2
注意:能量均分定理是一种统计规律。对于个别分子,在任一瞬时 它的各种形式动能不具有上述关系。大量粒子通过碰撞,使各种形 式的动能发生传递和转换,从而实现能量均分的统计结果。
e
v dv
m = 4π 2πkT 3RT = M v =
__ 2
3/ 2
∫
1 ∞ − mv2 / kT 4 2 0
e
v dv
3RT M
积分公式:
∫
∞
0
e
−λv2 3
1 v dv = 2 2λ
,
∫
∞
0
e
−λv2 4
v dv =
3 π 8 λ5
比较:
vp =
2RT M
, v=
8RT πM
§2 用分子射线实验验证麦克斯韦速度分布律(1)
一、分子射线
S 金属蒸气
S1
S2
准直器
§2 用分子射线实验验证麦克斯韦速度分布律(2)
第三章气体分子热运动速率和能量的统计分布律

热学
14
讨论
麦克斯韦速率分布中最概然速率 vp 的概念
下面哪种表述正确?
(A) vp 是气体分子中大部分分子所具有的速率. (B) vp 是速率最大的速度值. (C) vp 是麦克斯韦速率分布函数的最大值.
(D) 速率大小与最概然速率相近的气体分子的比 率最大.
N
N
v
v f (v)dv
8kT
0
πm
v 1.60 kT 1.60 RT
f (v)
m
M
3)方均根速率 v2
o
v
v2
N
0
v2dN N
0
v2
Nf
N
(v)dv
v2 3kT m
热学
8
vp v v2
vrms
v2
3kT m
3RT M
v 1.60 kT 1.60 RT
m
M
vp
2kT m
为清楚起见 , 从正面来
观察。
铁钉
隔板
热学
28
统计规律和方法
伽尔顿板 再投入小球: 经一定段时间后 , 大量小
球落入狭槽。
分布情况:中间多,两边少。
重复几次 ,结果相似。
单个小球运动是随机的 , 大量小球运动分布是确定的。
大量偶然事件整体所遵 循的规律 —— 统计规律。
热学
小球数按空间 位置 分布曲线
v2
dN 4π(
m
)3
2
e
mv2 2 kT
v2
dv
N
2πkT
热学
5
反映理想气体在热动 平衡条件下,各速率区间 分子数占总分子数的百分
§3.1 气体分子的速率分布

mv 2 Av 2 exp 2kT
可以通过归一化可求出系数 A 。
0
m v2 Av2 exp dv 1 2kT
m 3/ 2 A 4 ( ) 2kT
三、用麦克斯韦速率分布函数求平均值
(1) 平均速率
v vf (v)dv
1/ 2
mv i2 exp 2kT
dvi
其中i 可分别代表x、y、z。
x 方向速度分量的概率
分布曲线如图所示,它对 称于纵轴,图中打上斜线 狭条面积即
2 m vx dN (vx ) m 1/ 2 f (vx )dvx ( ) exp dvx N 2kT 2kT
v v2
v p : v : v 2 1 : 1.128: 1.224
四、 麦克斯韦速度分布
前面已指出,麦克斯韦是先导出速度分布,然后再 从速度分布得到速率分布的。
本节中介绍麦克斯韦速度分布。
为了说明速度分布的含义,先介绍速度空间的概念。
速度矢量
要描述气体分子的速度大小和方向,
需引入速度矢量这一概念.
§1 . 气体分子的速率分布律 大数分子无规则运动及它们之间频繁地相互碰撞;
分子以各种大小不同的速率随机地向各个方向运动;
在频繁的碰撞过程中,分子间不断交换动量和能量,使 每一分子的速度不断变化。
处于平衡态的气体,虽然每个分子在每一瞬时的 速度大小、方向都在随机地变化着,但是大多数分子 之间存在一种统计相关性,这种统计相关性表现为平 均说来气体分子的速率(指速度的大小)介于任何 v 到v + dv 的概率(即速率分布函数)是不会改变的。
右图示意表示了麦克斯韦速率
1.3分子运动速率分布规律

1.3 分子运动速率分布规律基础导学要点一、气体分子运动的特点(1)气体分子间的距离较大,使得分子间的相互作用力十分微弱,可认为分子间除碰撞外不存在相互作用力,分子在两次碰撞之间做匀速直线运动。
(2)分子间的碰撞十分频繁,使每个分子的速度大小和方向频繁地发生改变,造成气体分子的运动杂乱无章。
(3)大量气体分子的速率分布呈现“中间多、两头少”的规律。
当温度升高时,“中间多”的这一“高峰”向速率大的一方移动。
要点二、分子运动速率分布图像1.温度越高,分子热运动越剧烈.2.气体分子速率呈“中间多、两头少”的规律分布.当温度升高时,某一分子在某一时刻它的速率不一定增加,但大量分子的平均速率一定增加,而且“中间多”的分子速率值增加(如图所示).要点三、气体压强的微观解释1.气体压强的产生原因:大量气体分子不断撞击器壁的结果.2.气体的压强:器壁单位面积上受到的压力.3.微观解释:(1)某容器中气体分子的平均速率越大,单位时间内、单位面积上气体分子与器壁的碰撞对器壁的作用力越大.(2)容器中气体分子的数密度大,在单位时间内,与单位面积器壁碰撞的分子数就多,平均作用力也会较大.要点突破突破一:分子运动的性质自由性气体分子间距离比较大,分子间的作用力很弱,除相互碰撞或者跟器壁碰撞外,可以认为分子不受力而做匀速直线运动,因而气体会充满它能到达的整个空间无分子之间频繁地发生碰撞,使每个分子的速度大小和方向频繁地改变,分子的运动杂乱序性无章,在某一时刻,向着任何一个方向运动的分子都有,而且向着各个方向运动的气体分子数目几乎相等规律性气体分子的速率分布呈现出“中间多、两头少”的分布规律。
当温度升高时,速率大的分子数增多,速率小的分子数减少,分子的平均速率增大。
反之,分子的平均速率减小。
突破二:决定气体压强大小的因素(1)微观因素①与气体分子的数密度有关:气体分子数密度(即单位体积内气体分子的数目)越大,在单位时间内,与单位面积器壁碰撞的分子数就越多,气体压强就越大.①与气体分子的平均速率有关:气体的温度越高,气体分子的平均速率就越大,每个气体分子与器壁碰撞时(可视为弹性碰撞)给器壁的冲力就越大;从另一方面讲,分子的平均速率越大,在单位时间内器壁受气体分子撞击的次数就越多,累计冲力就越大,气体压强就越大.(2)宏观因素①与温度有关:体积一定时,温度越高,气体的压强越大.①与体积有关:温度一定时,体积越小,气体的压强越大.突破三:气体压强与大气压强的区别与联系典例精析题型一:气体分子运动的特点例一.以下说法正确的是()A.当两个分子间的距离为r0(平衡位置)时,分子势能最小且为零B.布朗运动反映了花粉小颗粒内部分子的无规则运动C.一定量的气体,在体积不变时,单位时间分子平均碰撞器壁的次数随着温度降低而减小D.液晶的光学性质不随温度、电磁作用变化而改变【答案】C【解析】A.当两个分子间的距离为r0(平衡位置)时,分子力为零,分子势能最小但不为0,所以A错误;B.布朗运动反映了液体分子的无规则运动,而不是花粉小颗粒内部分子运动,故B 错误;C.一定量的气体,温度降低,分子的运动的激烈程度减小,所以在体积不变时,单位时间分子平均碰撞器壁的次数随着温度降低而减小,所以C正确;D.温度、压力、电磁作用等可以改变液晶的光学性质,故D错误。
第三章 气体分子热运动速率和分布函数_电子教案白

第 一 节 气体分子的速率分布律
一、 速率分布函数 1.分子速率分布 平衡态下,分布在各速率区间内的分子数占总 分子数的百分率。令 N 为分子数,平衡态下在速率 v : v + dv 内
dN dN = f (v) dv ⇒ f (v) = Ndv N 2、物理意义:在速率 v 附近,单位速率间隔内出现的分子数占总
2
N = 2.6875 ×1019 个 ∆N = 2.484 ×1017
(2) v = vp=
2 kT m0
3
∆v =
− m0 v 2 2 kT
vp 100 4 −1 11 = 4π ( 2 ) 2 e N vp
例:理想气体,求 v = 的分子数的比值。
v 2 ∆v =
解: (1) f (v) =
dN 4πA 2 = v = kv 2 Ndv N
vF
(2)
∫
∞
0
f (v)dv = ∫
∞ 2
0
4π Av 2 vF 3 dv = 1 = 4π A N 3N
vF 2
A=
3N 4π vF 3
(3) v =
2
∫
0
v f (v)dv = ∫
0
2 vF 4π Av2 3 2 3v v dv = ∫ v 3 dv = vF 2 0 N vF 5
2 2 =1:2:4 ,则 p : p : p =? : v 2 2 : vC C B A B
1
解:
pA : pB : pC = nkTA : nkTB : nkTC
∵ (v ) : (v ) : (v ) =
1 2 2 A
1 2 2 B
热学 (3 第三章 气体分子热运动速率和能量的统计分布率)

f ()d dN
N
dN
2
=
f
( )d
N 1
表示速率分布在→+d内的
分子数占总分子数的概率
表示速率分布在1→2内的分
子数占总分子数的概率
N
0
dN N
0
f
d
1
归一化条件
应注意的问题:
分布函数是一个统计结果,以上各种讨论都是建立在众多分子微 观运动基础上的,分子的数目越大,结论越正确。所以:
1、作速率分布曲线。 2、由N和vo求常数C。 3、求粒子的平均速率。 4、求粒子的方均根速率。
f (v)
C ( vo> v > 0) 0 ( v > vo )
f (v)
解:
f (v)dv
0
vo 0
Cdv
Cvo
1
C
C 1 vo
o
vo v
o f ()d o Cd C o2
3. 方均根速率
2
2
f
d
0
3
2
4
m
2 kT
2
e
m 2 2kT
4
d
3kT
3RT
0
mM
2 3kT 3RT
m
M
4. 三种速率的比较
最概然速率
p
2kT m
2RT M
平均速率
8kT 8RT m M
方均根速率
一、速率分布函数
气体分子处于无规则的热运动之中,由于碰撞,每个分子的速度都
第三章 气体分子热运动速率和能量的统计分布

气体分子热运动速率 和能量的统计分布
1
第三章 气体分子热运动速率和能量的 统计分布
§1 气体分子的速率分布律 §2 用分子射线实验验证麦克斯韦速度分布律 §3 玻尔兹曼分布律 重力场中微粒按高度的分布 §4 能量按自由度均分定理
2
§1 气体分子的速率分布律
一、速率分布函数
设总分子数N,速率区间v ~ v+dv内分子数 dN占总 分子数的比率为: dN f (v)dv ,其中:
1mol理想气体内能为:
Um
1 2
(r
t
2s)RT
,因此:
CV ,m
1 2
(r
t
2s)R
只与自由度有关
单原子分子气体:
CV ,m
3 2
R
双原子分子气体:
7 CV ,m 2 R
35
五、经典理论的缺陷
CV ,m
根据经典理论:
7R 2
一切双原子分子CV,m相同
5R 2
CV,m与温度无关
3R 2
T/K
理论与实验的不符,根本在于它是建立在经典概念,即能量 连续分布的基础上的。只有用量子理论才能进行较完满的解释。
单位时间内碰到单位面积器壁上速度在vx~vx+dv之间的分子数为:
nvx
f
(vx )dvx
nvx
m
2kT
1/ 2
e dv mvx2 / 2kT x
单位时间内碰到单位面积器壁的总分子数为:
0 nvx f (vx )dvx
n
m
1/ 2
2kT
e v dv mvx2 / 2kT
0
xx
n
kT
气体分子在空间位 置不再呈均匀分布
第三章气体分子热运动速率

3.1 气体分子的速率分布律 3.2 用分子射线实验验证麦克斯韦速度分布律 3.3 玻尔兹曼分布律 重力场中微粒按高度的分布 3.4 能量按自由度均分定理
1
3.1 气体分子的速率分布律
统计规律性: 统计规律性: 分子运动论从物质微观结构出发, 分子运动论从物质微观结构出发,研究大量分子组成的 系统的热性质。其中个别分子的运动(在动力学支配下) 系统的热性质。其中个别分子的运动(在动力学支配下)是 无规则的 存在着极大的偶然性。但是, 无规则的,存在着极大的偶然性。但是,总体上却存在着确 定的规律性。(例 理想气体压强) 规律性。( 定的规律性。(例:理想气体压强) 人们把这种支配大量粒子综合性质和集体行为的规律性 称为统计规律性 统计规律性。 称为统计规律性。 气体中个别分子的速度具有怎样的数值和方向完全是偶 然的,但就大量分子的整体来看,在一定的条件下,气体分 然的,但就大量分子的整体来看,在一定的条件下, 子的速度分布也遵从一定的统计规律。 子的速度分布也遵从一定的统计规律。为研究气体分子速度 分布的定量规律,有必要介绍分布函数的概念。 分布函数的概念 分布的定量规律,有必要介绍分布函数的概念。
dNv m mv 2 2kT 2 v dv = 4π e N 2πkT
dNv = f (v)dv N
3 2
麦克斯韦速率分布函数
3 2
m mv 2 2kT 2 f (v) = 4π v e 2πkT
9
麦克斯韦速率分布曲线
f (v)
f (v)
O
v vp
v
10
麦克斯韦速率分布曲线
f (v)
N N N = ∴n f (v)dv= v1 V N V 表示分布在单位体积内, 表示分布在单位体积内,速率区间 v1 →v2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C
0
2021/3/31
v v 0崎山苑工作室
28
(2)常数 C 由归一化条件求得
0v0 f (v)dv 1
0v0 Cdv 1
C v0 1
C
1 v0
(3)平均速率:
v
2021/3/31
0
1
v0
vf (v)dv
v02 2
1 2
v0
崎山苑工作室
0v0
v
1 dv v0
29
例3. 由麦氏分布律导出理想气体分子按平动动能的分布律,并找
f vx ,vy ,vz
m e 2
m
vx2
v
2 y
vz2
2kT
2kT
2021/3/31
dvx、dvy、dvz为速度空间的一个体积元
崎山苑工作室
32
*速度空间(velocity space)的概念 v 表示分子的速度
以其分量vx、 vy、 vz为轴可构成一直角坐标系,
由此坐标系所确定的空间为速度空间。
崎山苑工作室
15
气体的三种统计速率
(1)最可几速率: 速率分布函数 f (v)中的极大值对应
的分子速率 v p 。
d f (v)
极值条件
0
f
(v)
4
dv
m
2kT
3
2
e
mv2 2kT
v
2
vp
2kT
m
2RT
1.41
RT
温度超高,vp越大;分子的质量越大, vp越小
2021/3/31
崎山苑工作室
h
dN(h) Nf (h)dh
h
hdN (h)
N
hNf (h)dh
N
hf (h)dh
2021/3/31
崎山苑工作室
5
推广至任一变量(物理量)x ,由分布函数f(x)求 平均值,有:
x
xdN
N
Nxf (x)dx
N
xf (x)dx
对具有统计性的系统来讲,总存在着确定的分 布函数f(x),因此,写出分布函数f(x)是研 究一个系统的关键之处,具有普遍的意义。
O
2021/3/31
v v p
v2
崎山苑工作室
v
23
同一气体不同温度下速率分布比较
f (v)
f (v ) p1
f (v ) p2
T1
T2
f (v ) p3
T1 T2 T3
温度越高,速率 大的分子数越多
T3
O
2021/3/31
v v v p1 p 2 崎p山3苑工作室
v
24
同一温度下不同种气体速率分布比较
f (h)dh 1
f(h)dh:高度在h与h+dh之间的概率
我们把 f(h)称为归一化分布函数。 f(h)表征在单位高度内,身高为 h 的人数占总 人数的比率。
2021/3/31
崎山苑工作室
4
f(h) f(h)为归一化分布函数
分布曲线
o h h+dh
高度在h与h+dh之间的人
数: N 个人的平均身高为
8
麦克斯韦速率分布律(Maxwell speed distribution law)
(一定条件下,速率分布函数的具体形式)
在平衡态下,当气体分子间的相互作用可以 忽略时,分布在任一速率区间 v~v+dv 的分子数占 总分子数的比率为
3
dN v 4 m 2 e mv 2 2kT v 2dv
N
2kT
f (v) dN , n N
Ndv
V
nf (v)dv dN
V
表示单位体积内分布在速率区间 v 内v的 dv
分子数。
2021/3/31
崎山苑工作室
12
f (v)为速率分布函数,n为分子数密度, 说明下式的物理意义:
(2)Nf (v)dv
f (v) dN Ndv
Nf (v)dv dN
RT
v 2
2021/3/31
崎山苑工作室
21
f (v)
方均根速率
O
v2
v
2021/3/31
崎山苑工作室
22
三种速率比较
f (v)
vp v v2
三种速率均与 T , m
成反比,但三者有一个确定 的比例关系;三种速率使用于 不同的场合。讨论速率分布 时用最可几速率;计算分子 运动的平均距离时用平均速 率;计算分子平均平动能时 用方均根速率。
2
e
99 100
2
1 50
1.66%
2021/3/31
崎山苑工作室
27
例2. 有N个粒子,其速率分布函数为
f (v) dN C Ndv
f (v) 0
(v0 v 0)
(v v0 )
求: (1)速率分布曲线(2)由v 0 求常数C
(3)粒子的平均速率
解(1)速率分布曲线 ( 见下图)
的分子数。
2021/3/31
崎山苑工作室
14
f (v)为速率分布函数,n为分子数密度, 说明下式的物理意义:
(4)
v2
v1
v2
v1
vf f
(v)dv (v)dv
N2
N1
vdN
N
N N
f (v) dN
N2 v dN
N1
Ndv N
表示速率在区间 (v1,内v2的) 分子的平均速率 。
2021/3/31
f (v)
分子数的比例;或分子速率位于
区间(v,内v 的d几v率) 。
O dvv v1 v2
v
速率在 (v1,区v2间) 内的分子数占总分子数的比例;
或分子速率位于 (v1, v区2 )间内的几率。
2021/3/31
崎山苑工作室
11
f (v)为速率分布函数,n为分子数密度, 说明下式的物理意义:
(1)nf (v)dv
2021/3/31
崎山苑工作室
6
速率分布函数
一定量的气体分子总数为N dNv表示速率分布在某区间 v~v+dv内的分子数, dNv/N表示分布在此区间内的分子数占总分子 数的比率(或百分比)。
dNv/N 是 v 的函数,在不同速率附近取相等的 区间,此比率一般不相等。
当速率区间足够小时(宏观小,微观大), dNv/N还应与区间大小成正比。
*麦克斯韦速度分布律指明了分子代表点在速度
空间体积元d= dvxdvydvz 中的分布情况。
*可由麦氏速度分布律推出麦氏速率分布律。
2021/3/31
崎山苑工作室
33
由图(b)可得:d 4v2dv v2 vx2 vy2 vz2
3
dN N
m
2kT
2
e m
v
2 x
v
2 y
v
2 z
2 kT
理论与实验符合得很好。
2021/3/31
崎山苑工作室
31
麦克斯韦速度分布律(Maxwell velocity distribution law)
上面讨论的是气体分子按速率分布的规律,对分子 速度的方向未作任何确定。下面进一步介绍气体分子按 速度分布的规律。
在平衡态下,当气体分子之间的相互作用可忽略时,速度
分量vx在区间vx~vx+dvx,vy 在区间vy~vy+dvy,vz在区间vz~vz+dvz
内的分子数占总分子数的比率为
3
dN vxvyvz N
m 2kT
2
e m vx2
v
2 y
vz2
2kT
dvx
dv y
dv z
麦克斯韦速度分布函数(Maxwell velocity distribution law) 3
麦克斯韦速率分布函数
3
f v 4 m 2 e mv 2 2kT v 2
2kT
2021/3/31
崎山苑工作室
9
麦克斯韦速率分布曲线
f (v)
f (v)
O v vp
v
2021/3/31
崎山苑工作室
10
麦克斯韦速率分布曲线
f (v)
面积f (v)d v d N N
速率在(v, v 面区d积v间)v内v12 的f (分v)子d数v 占 总NN
第三章 气体分子热运动速率 和能量的统计分布
3.1 气体分子的速率分布律
3.2 用分子射线实验验证麦克斯韦速度分布律
3.3 玻尔兹曼分布律 重力场中微粒按高度的分布
3.4 能量按自由度均分定理
2021/3/31
崎山苑工作室
1
3.1 气体分子的速率分布律
统计规律性: 分子运动论从物质微观结构出发,研究大量分子组
v
2021/3/31
崎山苑工作室
20
(3)方均根速率(root-mean-square speed):气体 分子速率平方的平均值的平方根。
v2
N v2dN
0
v2 f ( v )dv 3kT
dN N
0
m
3
f ( v ) Ndv fv2(v)
3mk4T
23mRkT T12.7e3
2 mv 2 kT
2021/3/31
崎山苑工作室
2
分布函数和平均值
偶然事件:大量出现不可预测的事件。多次重复 观察同样的事件,可获得该偶然事件的分布,从 而得到其统计规律。
例1:统计某城市中每个商店里职工的分布情况, 可用下列方法。
Ni 表示该城市中有i 个职工的商店数,称分布数。
