西南大学《中级无机化学》网上作业题及答案
中级无机课后习题答案

中级无机课后习题答案中级无机课后习题答案无机化学作为化学的一个重要分支,研究的是无机物质的性质、结构和反应。
在学习无机化学的过程中,课后习题是巩固知识、提高理解能力的重要方式。
本文将为大家提供一些中级无机课后习题的答案,希望能够帮助大家更好地掌握无机化学知识。
1. 铁和硫反应生成什么产物?请写出反应方程式。
答案:铁和硫反应生成硫化铁。
反应方程式为:Fe + S → FeS。
2. 硝酸和钠反应生成什么产物?请写出反应方程式。
答案:硝酸和钠反应生成亚硝酸钠和氧气。
反应方程式为:2Na + 2HNO3 →2NaNO2 + H2O + O2。
3. 氯气和钠反应生成什么产物?请写出反应方程式。
答案:氯气和钠反应生成氯化钠。
反应方程式为:2Na + Cl2 → 2NaCl。
4. 硫酸和钙反应生成什么产物?请写出反应方程式。
答案:硫酸和钙反应生成硫酸钙。
反应方程式为:Ca + H2SO4 → CaSO4 + H2。
5. 氯化钠和硫酸铜反应生成什么产物?请写出反应方程式。
答案:氯化钠和硫酸铜反应生成氯化铜和硫酸钠。
反应方程式为:CuSO4 +2NaCl → CuCl2 + Na2SO4。
6. 氢气和氧气反应生成什么产物?请写出反应方程式。
答案:氢气和氧气反应生成水。
反应方程式为:2H2 + O2 → 2H2O。
7. 氧化铁和铝反应生成什么产物?请写出反应方程式。
答案:氧化铁和铝反应生成铁和氧化铝。
反应方程式为:Fe2O3 + 2Al → 2Fe +Al2O3。
8. 硝酸和钾反应生成什么产物?请写出反应方程式。
答案:硝酸和钾反应生成亚硝酸钾和氧气。
反应方程式为:2K + 2HNO3 →2KNO2 + H2O + O2。
9. 硫酸和铝反应生成什么产物?请写出反应方程式。
答案:硫酸和铝反应生成硫酸铝和氢气。
反应方程式为:2Al + 3H2SO4 →Al2(SO4)3 + 3H2。
10. 氯化铜和铁反应生成什么产物?请写出反应方程式。
中级无机化学习题答案已打印

第一章、酸碱理论1.下列化合物中,哪些是路易斯酸,哪些是路易斯碱?BH4-,PH3,BeCl2,CO2,CO,Hg(NO3)2,SnCl2解答:路易斯酸BeCl2,CO2,CO,Hg(NO3)2,SnCl2路易斯碱PH3,CO,SnCl22.写出下列物种的共轭酸和共轭碱:NH2,NH2,H2O,HI,HSO4-解答:共轭酸共轭碱NH3:NH4+ NH2-NH2-:NH3NH2-H2O:H3O+OH-HI:I-HSO4-:H2SO4SO42-3.下列各对中哪一个酸性较强?并说明理由。
(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+(c) Si(OH)4 和Ge(OH)4 (d) HClO3和HClO4(e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4解答:(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+路易斯酸性:前者,中心离子电荷高,吸引电子能力大质子酸性:前者,中心离子电荷高,对O的极化能力大,H+易离解;(b)[Al(H2O)6]3+和[Ga(H2O)6]3+路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(c) Si(OH)4 和Ge(OH)4路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(d) HClO3和HClO4 (e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4均为后者,非羟基氧原子多,酸性越强。
4.应用Pauling规则,(1) 判断H3PO4(pKa=2.12)、H3PO3(pKa=1.80)和H3PO2(pKa=2.0)的结构;(2) 粗略估计H3PO4、H2PO4-和HPO42-的pKa值。
解答:(1)根据pKa值判断,应有相同非羟基氧原子。
(2)H3PO4:一个非羟基氧原子,pKa值约为2;H2PO4-pKa值增加5,约为7;HPO42-pKa约为12。
中级无机化学1-5章年习题答案

无机化学习题参考答案第一章1.4.解:〔1〕H 2O 22C〔2〕S 2O 32- 3v C 〔3〕N 2O (N -N -O 方式) v C ∞〔4〕Hg 2Cl 2h D ∞〔5〕H 2C=C=CH 2 2d D 〔6〕UOF 4 C 5v 〔7〕BF 4-d T 〔8〕SClF 54v C〔9〕反-Pt(NH 3)2Cl 22h D〔10〕PtCl 3(C 2H 4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
〔BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃〕2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和〔6配位〕,失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
〔只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用复原氯化法制备,这就不是脱水方法了〕。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期〔分裂能小〕第六周期〔分裂能大〕P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型〔两种构型〕 只有一种结构 〔P 代表PPh 3〕2.2 解 〔1〕MA 2B 4〔2〕MA 3B 3M A ABB M ABA BM ABAB M A AA Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
《中级无机化学》试题及答案
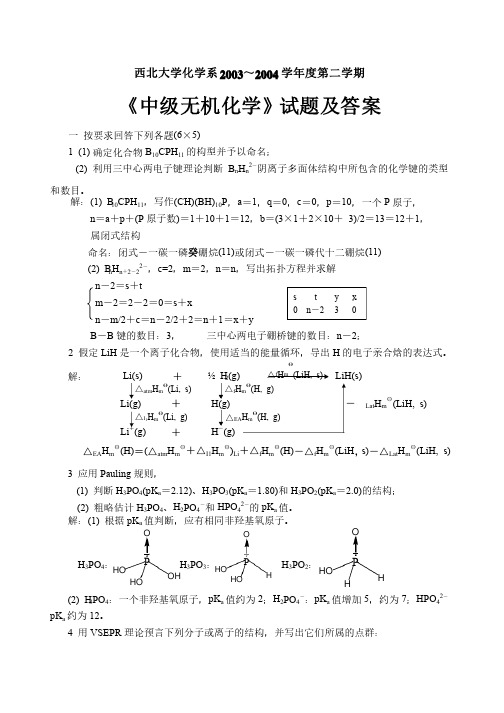
西北大学化学系2003~2004学年度第二学期《中级无机化学》试题及答案一 按要求回答下列各题(6×5)1 (1) 确定化合物B 10CPH 11的构型并予以命名;的构型并予以命名;(2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。
和数目。
解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子,原子,n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1,属闭式结构属闭式结构命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11)(2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解,写出拓扑方程并求解n -2=s +tm -2=2-2=0=s +xn -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2;2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。
解:解: Li(s) + ½ H 2(g)LiH(s) Li(g)+ H(g) -△Lat H m θ(LiH, s)Li +(g) + H -(g) △EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s) 3 应用Pauling 规则,规则,(1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构;的结构;(2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。
值。
解:(1) 根据pK a 值判断,应有相同非羟基氧原子。
中级无机化学试题及答案

中级无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,哪一个是过渡金属?A. 铁B. 碳C. 氧D. 钠答案:A2. 以下化合物中,哪一个是共价化合物?A. NaClB. HClC. MgOD. Fe答案:B3. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D4. 哪个元素的原子序数是26?A. 铁B. 钴C. 镍D. 锌答案:C5. 以下哪个元素是碱土金属?A. 锂B. 铍C. 钙D. 钡答案:C6. 哪种类型的键是离子键?A. NaCl中的键B. HCl中的键C. O2中的键D. C2H4中的键答案:A7. 以下哪个化合物是超酸?A. HClB. H2SO4C. H3PO4D. H2S答案:B8. 哪个元素属于卤素?A. 氟B. 氯C. 溴D. 碘答案:B答案:A, B, C, D9. 以下哪种化合物是金属有机化合物?A. 四氯化碳B. 四氯化钛C. 四氯化锆D. 四氯化铌答案:B10. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D二、填空题(每题2分,共20分)11. 过渡金属元素通常位于周期表的________区和________区。
答案:d区和f区12. 根据八隅体规则,碳原子最多可以形成________个共价键。
答案:413. 金属键是由________和________之间的相互作用形成的。
答案:金属离子和自由电子14. 元素周期表中,第________周期是最长的周期。
答案:六15. 元素的电负性越大,其非金属性越________。
答案:强16. 金属晶体的堆积方式主要有简单立方堆积、体心立方堆积和________堆积。
答案:面心立方17. 碱金属元素位于周期表的________族。
答案:一18. 元素的原子半径随着原子序数的增加而________(增大/减小)。
西南 中级无机化学作业4

第一种就是利用氯气氯化,先合成为四氯化钛,然后用镁热去还原,最后真空蒸馏得到海绵钛,这叫Kroll法,是目前最主流的方法
第二种同第一种一样,都是先得到四氯化钛,而后利用电解熔融四氯化钛得到海绵钛,这个目前已经工业化
第三种叫FFC法,又称剑桥法,直接电解二氧化钛得到海绵钛,目前工业化遇到很多问题
正确
做此题
客观题
判断题
判断方程式CrCl3+ 3Na + 6CO=3NaCl + Cr(CO)6是否正确。
正确
做此题
客观题
判断题
.判断方程式Fe(CO)5+ 3KOH=K[Fe(CO)4H] + K2CO3+ H2O是否正确。
正确
做此题
客观题
判断题
判断方程式BF3NMe3+ BCl3= Cl3BNMe3+ BF3是否正确。
正确
做此题
其他还有膜过滤法等等,鲜有半工业化报道
但是得到的海绵钛性能不符合工程材料要求,因此我们通过真空熔铸或者粉末冶金的方法获得致密钛,这样才能用于工程材料
未做作业
做此题
客观题
判断题
判断方程式Fe + 5C来自=Fe(CO)5是否正确。正确
做此题
客观题
判断题
判断方程式2CoCO3+ 8CO + 2H2=Co2(CO)8+ 2CO2+ 2H2O是否正确。
《中级无机化学》
题型
描述
题目
状态
操作
主观题
论述题
1.解释第3周期元素电离能的递变规律。
答:从左到右依次增大
西南大学网考中级无机化学答案参考

8:[单选题]下列元素第一电离能最大的是()。
A:BB:CC:ND:O参考答案:C9:[单选题]下列离子中,离子半径最小的是()。
A:Cl-B:Ca2+C:Sc3+D:Ti4+参考答案:D 10:[单选题]性质最相似的两个元素是()。
A:Zr 和HfB:Ru 和RhC:Mn 和MgD:Cu 和Cr 参考答案:A11:[多选题]下列性质相似的元素是()。
A:Al和BeB:B和AlC:B和SiD:Al和Ca参考答案:AC12:[单选题]估计Ru3(CO)12中共有()个M―M键A:1B:2C:3D:4参考答案:C1:[判断题]判断方程式B2H6 + 2N(CH3)3=2BH3N(CH3)3是否正确。
参考答案:正确2:[判断题]判断方程式SOCl2 +Cs2SO3=2CsCl+2SO2是否正确。
参考答案:正确3:[判断题]判断方程式SbF5 + KF= KSbF6 是否正确。
参考答案:正确4:[判断题]判断方程式Cr(CO)6 + C6H6=Cr(C6H6)(CO)3 + 3CO是否正确。
参考答案:正确5:[判断题] 判断方程式Mn2(CO)10 + Br2=2Mn(CO)5Br是否正确。
参考答案:正确6:[判断题]. 判断方程式Fe(CO)5 + 3KOH=K[Fe(CO)4H] + K2CO3 + H2O 是否正确。
参考答案:正确7:[判断题]判断方程式CrCl3 + 3Na + 6CO=3NaCl + Cr(CO)6是否正确。
参考答案:正确8:[判断题]判断方程式2CoCO3 + 8CO + 2H2=Co2(CO)8 + 2CO2 + 2H2O是否正确。
参考答案:正确9:[判断题]判断方程式Fe + 5CO=Fe(CO)5是否正确。
参考答案:正确10:[判断题]判断方程式BF3NMe3 + BCl3 = Cl3BNMe3 + BF3是否正确。
参考答案:正确11:[判断题].判断方程式F4SiNMe3 + BF3 = F3BNMe3 + SiF4 是否正确。
西南大学中级无机化学温习资料(改)

第一章酸碱理论与非水溶液化学>>学习单元1 酸碱概念一、NH4+的共轭碱是(B)。
(A) OH-(B) NH3(C)NH2-(D) NH2-提示:由质子理论定义: NH4+(酸) H++NH3(碱),故选B。
二、在反映BF3 + NH3 F3BNH3中,BF3为(D)。
(A) Arrhenius碱(B) Br nsted酸(C) Lewis碱(D) Lewis酸提示:B具有缺电子性,可以接受孤对电子,故为Lewis酸。
3、依照酸碱的溶剂理论,在液态 SO2体系中的碱是(B )。
(A) SOCl2(B) Na2SO3(C) Na2SO4(D) PCl3提示:2SO2 SO2+ SO32-,能生成溶剂阴离子的是Na2SO3,故选B。
为什么Fe3+与F-形成的配合物的稳定性大于Fe3+与Cl-形成的配合物的稳定性?酸碱概念:电负性较小的路易斯碱称为软碱;与软碱形成稳固配合物的路易斯酸为软酸。
电负性较大的路易斯碱称为硬碱硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反映最为稳固。
那个理论在有机化学和无;与硬碱形成稳固配合物的路易斯酸为硬酸。
硬”对应的是小的、高氧化态的粒子,这些粒子硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反映最为稳固。
那个理论在有机化学和无都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反映最为稳固。
那个理论在有机化学和无机化学均有应用。
酸碱反映实质:硬酸偏向于与硬碱反映(硬亲硬),软酸偏向于软碱反映(软亲软)。
Fe3++6F–=[FeF6]3-(硬-硬)Hg2++4I-=[HgI4]2-(软-软)Fe4++4:Cl–=[FeCl4]–(硬-软),故[FeCl4]–不稳定第一章酸碱理论与非水溶液化学>>学习单元2 酸碱强度一、填空题一、判定相对Lewis碱性(1)(H3Si)2O和(H3C)2O;(2)(H3Si)3N和(H3C)3N ;其中较强的是(1)__(H3C)2O __,(2)__(H3C)3N___。
中级无机化学习题(含答案)

(B) 对 B(CH3)3 的碱性较强:(1) Me3N,Et3N;(2) (2-CH3)C5H4N,(4-CH3)C5H4N;(Bu
丁基;C5H4N 吡啶) 答:(A) (1) BBr3;(2) BCl3;(3) B(n-Bu)3;(B) (1) Me3N;(2) (4-CH3)C5H4N 6. 解释酸性变化规律 HOI < HOBr < HOCl。
9. 比较下列每组两个化合物与乙醇形成氢键的能力:
2
(1) (H3Si)2O 和(H3CH2C)2O;(2) (H3Si)3N 和(H3C)3N 答:对同一种 H 给体(如乙醇)而言,Lewis 碱性越强形成的氢键也越强。因为 O 和 N 上
的电子可扩充到 Si 的空 d 轨道上,因此与 Si 结合的 O 和 N 较与 C 结合的 O 和 N 的
Lewis 碱性低,因而可以预期(1)中的乙醚和(2)中的三甲胺形成的氢键更强些。
10.比较 HCF3 与 HCH2NO2 的酸性强弱,叙述理由。 答:HCF3 酸性较弱。按照诱导效应似应是前者的酸性强,因为 3 个电负性很大的 F 使 C
原子上带很高的正电荷。然而 HCF3 失去质子形成的 CF3-基团 C 上的负电荷离域化程 度并不高,而在 HCH2NO2 失去质子形成的 CH2NO2-基团 C 上的负电荷可以向 NO2 基 团的*轨道离域而稳定。所以后者的酸性较强。
子是
,与 BF3 相结合的原子是
。
答:P,N
4. 按照质子亲和势增加的顺序将下列各碱 HS,F,I,NH2-排序为。 答: I- < F- < HS- < NH25 . 在下述各组化合物中按题目要求进行选择。
(A) 最强的 Lewis 酸:(1) BF3,BCl3,BBr3;(2) BeCl2,BCl3;(3) B(n-Bu)3,B(t-Bu)3;
西南大学《中级无机化学》网上作业及参考答案

=================================================================================================== 1:[论述题]参考答案:2:[多选题]A:形成缓冲溶液B:盐效应促使SnCl2溶解C:同离子效应D:阻止SnCl2水解参考答案:CD3:[单选题]A:Fe3+与F-形成配合物B:Fe3+与Cl-形成配合物C:Fe3+与Br-形成配合物D:Fe3+与I-形成配合物参考答案:A4:[单选题]A:HPO42-B:H3PO4C:PO43-参考答案:B5:[单选题]A:CO32-B:H2CO3C:没有共轭碱参考答案:A6:[单选题]=================================================================================================== A:LiFB:LiClC:LiBrD:Lii参考答案:D7:[单选题]A:大B:小C:相等参考答案:B8:[单选题]A:酸B:碱C:盐参考答案:B9:[单选题]HF、HCl、HBr、HI的酸性最强的为()。
A:HFB:HClC:HBrD:HI参考答案:D10:[单选题]硼酸H3BO3是一种()。
A:一元中强酸B:一元弱酸=================================================================================================== C:三元弱酸D:三元中强酸参考答案:B1:[单选题]A:Ba(OH)2B:La(OH)3C:Lu(OH)3D:Ce(OH)4参考答案:D2:[论述题]参考答案:3:[单选题]A:[ CrCl2(NH3)4]ClB:[ Cr(NH3)4]Cl3C:[ Cr(NH3)4Cl]Cl2D:[ Cr(NH3)4Cl3]参考答案:A4:[单选题]A:[Co (NH3)6]3+B:[Fe (H2O)6]2+C:[Fe (CN)6]3-D:[Cr(NH3)6]3+参考答案:B5:[单选题]=================================================================================================== A:二氯四氨合钴(III)配离子,6B:二氯•四氨合钴配离子,4C:二氯•四氨合钴(III)配离子,6D:四氨合钴(III)配离子,4;参考答案:C6:[单选题]A:e,t2gB:eg,tgC:e,t2;D:eg,t2g参考答案:D7:[单选题]A:P>ΔB:P<ΔC:P=Δ参考答案:A8:[单选题]A:SCN-B:NO2-C:SO42-D:H2N-CH2-CH2-HN2参考答案:D9:[单选题]A:平面正方形, 平面正方形=================================================================================================== B:正四面体, 正四面体C:正四面体, 平面正方形D:平面正方形,正四面体参考答案:C10:[多选题]A:sp3d2B:sp3C:d2sp3D:d4sp3参考答案:AB11:[单选题]A:2B:3C:4D:5E:6参考答案:A1:[单选题]A:顺式-[Pt(NH3)2Cl2]B:反式-[Pt(NH3)2Cl2]C:H2PtCl6D:PtCl4=================================================================================================== 参考答案:A2:[论述题]参考答案:3:[单选题]A:闭式B:巢式C:网式D:链式参考答案:B4:[单选题]A:PdCl2, CuCl2B:CuCl2; PdCl2,C:CuCl2; PbCl2,参考答案:A5:[单选题]A:B2H6B:B10H14C:B5H9参考答案:B6:[单选题]A:2B:3C:4D:1参考答案:B=================================================================================================== 7:[单选题]A:一氧化碳与金属能形成很强的化学键B:中心原子总是呈现出较低的氧化态C:大多数配合物服从有效原子序数规则D:以上三种参考答案:D8:[单选题]A:BB:CC:ND:O参考答案:C9:[单选题]A:Cl-B:Ca2+C:Sc3+D:Ti4+参考答案:D10:[单选题]A:Zr 和HfB:Ru 和RhC:Mn 和MgD:Cu 和Cr=================================================================================================== 参考答案:A11:[多选题]A:Al和BeB:B和AlC:B和SiD:Al和Ca参考答案:AC12:[单选题]A:1B:2C:3D:4参考答案:C1:[判断题]参考答案:正确2:[判断题]参考答案:正确3:[判断题]参考答案:正确4:[判断题]参考答案:正确5:[判断题]参考答案:正确6:[判断题]参考答案:正确7:[判断题]参考答案:正确8:[判断题]参考答案:正确9:[判断题]参考答案:正确=================================================================================================== 10:[判断题]参考答案:正确11:[判断题]参考答案:正确12:[论述题]参考答案:1:[单选题]A:TiB:NiC:HgD:W参考答案:B2:[单选题]A:Mg还原TiCl4制备TiB:热分解Cr2O3制备CrC:H2还原WO3制备WD:羰化法提纯Ni参考答案:B3:[单选题]A:NaB:FeC:AgD:W参考答案:D4:[单选题]A:Cr;W=================================================================================================== B:Cs,WC:Hg;CrD:Os,Mo。
中级无机化学习题和答案

中级无机化学习题第二章 对称性与群论基础1、利用Td 点群特征标表(右表)回答下列问题 (1)、群阶,对称操作类数,不可约表示数(2)、SO 42-离子中S 原子3p x 轨道及3d xy 轨道所属的不可约表示 (3)、可约表示Г(10,-2,2,0,0)中包括了哪些不可约表示?SO 42-离子是否表现为红外活性?SO 42-离子是否表现为拉曼活性的?解:(1)点群的阶h=8;对称操作类=5;不可约表示数=5(2)S 原子的P X 轨道所属不可约表示为T 2表示。
(3)()01231)2(811018111=⨯⨯+⨯-⨯+⨯⨯=⋅Γ⋅=∑iA g h a χ;同理 02=A a ;11=T a ;12=T a ;2=E a ;故可约表示E T T 221)0,0,2,2,10(⊕⊕=Γ-因T 2表示中包含(x,y,z )和 (xy,xz,yz),故既表现为红外活性又表现为拉曼活性。
2(1)、点群的阶,对称操作类数,不可约表示数(2)、NH 3分子中偶极矩所属的不可约表示(3)可约表示Г(6,0,2)中包括了哪些不可约表示? 解:(1)点群的阶h=6; 对称操作类=3;不可约表示数=3 (2)NH 3分子中偶极矩所属不可约表示为A 1表示 (3)()21231021616111=⨯⨯+⨯⨯+⨯⨯=⋅Γ⋅=∑iA g h a χ;同理 02=A a , 2=E a ; 故可约表示E A 221)2,0,6(⊕=Γ3.利用C 4v 点群特征标表(见下表)回答下列问题(1)、点群的阶,对称操作类数,不可约表示数 (2)、SF 5Cl 分子中S 原子Px 轨道所属的不可约表示 (3)、可约表示Г(4,0,0,-2,0)中包括了哪些不可约表示?4、 试用特征标表的分析MnO 4-的杂化方式。
(要求有分析的详细过程)。
第三章 配位化学基础1、配位体与中心金属离子的π 成键作用将影响配合物的分裂能,假定配位体的π 轨道能量低于中心金属离子的π 轨道,且已被电子所填满。
0049《中级无机化学》西南大学网络教育20年春季作业参考答案
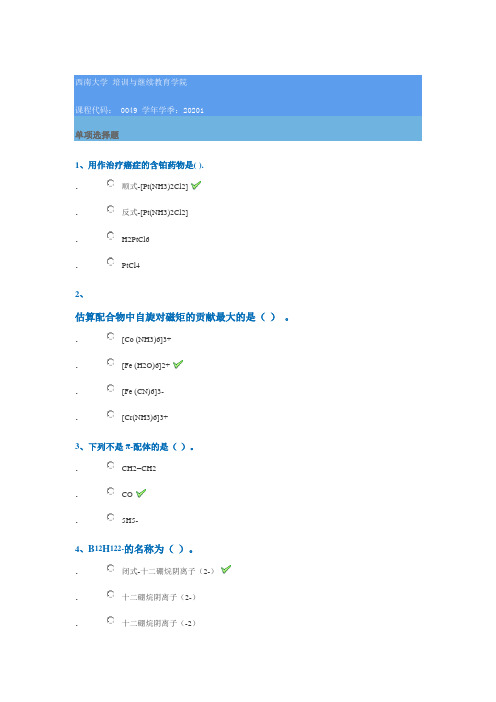
0049 20201单项选择题1、用作治疗癌症的含铂药物是( )..顺式-[Pt(NH3)2Cl2]. 反式-[Pt(NH3)2Cl2]. H2PtCl6 .PtCl42、估算配合物中自旋对磁矩的贡献最大的是( ) 。
. [Co (NH3)6]3+ . [Fe (H2O)6]2+. [Fe (CN)6]3- .[Cr(NH3)6]3+3、下列不是π-配体的是( )。
. CH2=CH2 . CO.5H5-4、B 12H 122-的名称为( )。
. 闭式-十二硼烷阴离子(2-). 十二硼烷阴离子(2-) .十二硼烷阴离子(-2).闭式-十二硼烷阴离子(-2)5、在单质金属中,导电性最好的是(),熔点最高的是()。
.Cs,W.Hg;Cr.Os,Mo。
.Ag,W6、估计Os3(CO)12中共有()个M—M键. 1. 2. 3. 47、在晶体场理论中,在八面体场中Oh场作用下d轨道分裂为()和()。
.e,t2g.eg,tg.e,t2;.eg,t2g8、硼酸H3BO3是一种()。
.一元中强酸.一元弱酸.三元弱酸.三元中强酸9、HOCl、HOBr、HOI的酸性最强的为()。
.HOCl.HOBr.HOI10、HCO3-的共轭酸为()。
.CO32-.H2CO3.没有共轭碱11、下列配合物中,没有反馈π键的是( )。
.[Pt(PPh3)4]2+.[Pt(C2H4)Cl3]-.[Co(CN)6]4-.[FeF6]3-12、人体血液中,负责输送氧气的金属蛋白是()。
.血红蛋白.细胞色素.铁贮存蛋白.肌红蛋白13、[Pt(NH3)4][PtCl6]和[Pt(NH3)4Cl2][PtCl4]互为()。
.电离异构体.键合异构体.配位异构体14、BF3、B6H6、Al2Cl6都是稳定的化合物,BH3、AlCl3则相对不稳定,其原因是()。
.前者形成大键,后者缺电子.前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子.前者缺电子,后者有多中心键.前者有配位键,后者缺电子15、下列配位体不属于π-配位体的是()。
(完整版)中级无机化学课后答案

1.试分析乙硼烷分子的结构,并指出它与乙烷结构有何不同。
解:乙硼烷和乙烷的分子式相似,但分子结构不同。
乙烷中每个C原子有4个价电子,以sp3杂化轨道分别与3个H原子及另一个C原子成键,达到8个电子结构;B原子只有三个价电子,为缺电子原子,故B2H6是缺电子化合物,B原子采取sp3杂化方式形成杂化轨道参与成键,每个B原子与两个H原子以正常的共价键相连接,并且两个BH2处于同一个平面上,另两个H原子则分别位于平面的上、下方,每个H原子连接两个B原子,形成两个“氢桥”键,又称“三中心二电子”键。
2.为什么CCl4遇水不水解而SiCl4, BCl3, NCl3却易水解
C 为第二周期元素只有2s2p 轨道可以成键,最大配位数为4,CCl4无空轨道可以接受水的配位,因而不水解。
Si 为第三周期元素,形成SiCl4后还有空的3d 轨道, d 轨道接受水分于中氧原子的孤对电子,形成配位键而发生水解BCl3分子中B 虽无空的价层 d 轨道,但B有空的P 轨道可以接受电子对因而易水解,NCl3无空的d 轨道或空的p 轨道,但分子中N 原子尚有孤对电子可以向水分子中氢配位而发生水解
3.什么是有机金属化合物?
金属有机化合物是指分子中至少含有一个金属-碳键(M-C键)的化合物,它们包括含M-C σ -键,M-Cnπ-键,ηη -M-Cn大π-键的化合物。
它们是一类特殊的配合物。
经典的配合物中虽然含有有机配体,但有机配体不是通过碳原子与金属成键,而是通过其他非金属原子形成配位键。
这一类化合物不应归为金属有机化合物。
硼酸是一元极弱酸,碳酸是二元弱酸。
《中级无机化学》习题1

《中级无机化学》习题1中级无机化学习题(一)1、[Pt(NH3)2(OH)2Cl2]可能存在的异构体为()A)6 B)3 C)4 D)52、根据酸碱质子理论,下列物质可作为碱的有()A)H2SO4B)[Co(H2O)5(OH)]2+C) [Fe(H2O)6]3+D) H3O+3、下列物质属于软酸的是()A)Fe3+B)Ag+C)NH3D)F-4、关于酸碱理论的描述,错误的是()A)阿仑尼乌斯提出酸碱电离理论B)乌萨诺维奇提出酸碱质子理论C)路易斯提出酸碱电子理论D)皮尔逊提出软硬酸碱理论5、酸在水中拉平到_________,而碱在水中拉平到___________6、冰醋酸可作为HClO4, HBr, H2SO4, HCl的___________溶剂。
7、由液氨的Ks,在液氨中碱性pH标度为多少?8、氨的自离解方程式为何?9、氨在醋酸中的反应方程形式为何?10、写出蔡斯盐的制备反应方程式11、用DCD模型说明蔡斯盐的结构有何特点?12、粗略估计H5IO6的pK1值13、试判断配离子[AuCl4] -(反磁性的)的几何构型和电子结构?14、已知配合物的中心原子为M,A、B、C为配位体,在具有化学式为MA2BC(四面体)的配合物中,几何异构体为多少?15、什么叫协同成键作用?16、CO是一种很不活泼的化合物,为什么它跟过渡金属原子能形成很强的配位键?配位原子是碳还是氧?为什么?17、为了使钒的羰基化合物符合EAN规则,它的最简单的分子应该是什么?为什么它实际上是不稳定的?18、为什么羰基配合物中过渡金属元素可以是零价甚至可以是负价?19、论在V(CO)6-, Cr(CO)6, Mn(CO)6+系列中,CO的伸缩振动频率的变化趋势。
20、金属原子簇合物与普通多核配合物有何区别?21、运用Wade规则,指出物B4C2H6种所属的结构类型22、运用Wade规则,指出物B3H8-种所属的结构类型23、运用Wade规则,指出物B4H10种所属的结构类型24、运用Wade规则,指出物B10H14种所属的结构类型25、为什么第七副族后的元素不易达到族号氧化态?26、过渡元素高价氧化态稳定存在的条件是什么?27、根据埃灵罕姆图,说明氧化物TiO2的热还原法,选用什么还原剂合适?28、根据埃灵罕姆图,说明氧化物Fe3O4的热还原法,选用什么还原剂合适?29、什么叫稀土元素?30、通常说的轻稀土元素是指哪些元素?31、镧系元素的原子的电子结构有哪些特点?32、试说明镧系元素的特征氧化态为+3,而镨却常呈现+4氧化态,铕又可呈现+2所化态?33、试说明镧系元素的特征氧化态为+3,而钕却常呈现+4氧化态,铥又可呈现+2所化态?34、镧系离子和d过渡金属离子的电子吸收光谱有何差异?说明原因。
西南大学网上作业题及参考答案

西南大学网上作业题及参考答案西南大学《社会科学研究方法》网上作业题及答案.doc 西南大学《色彩》网上作业题及答案.doc西南大学《人力资源开发与管理》网上作业题及答案.doc 西南大学《区域分析与规划》网上作业题及答案.doc西南大学《园艺植物研究法》网上作业题答案.doc西南大学《遗传学》网上作业题答案.doc西南大学《仪器分析》网上作业题答案.doc西南大学《消费者行为学》网上作业题答案.doc西南大学《西方经济学(下)》网上作业题答案.doc西南大学《文字设计》网上作业题答案.doc西南大学《外语教育技术》网上作业题答案.doc西南大学《外国音乐简史》网上作业题答案.doc西南大学《土地利用规划学》网上作业题答案.doc西南大学《土地规划学》网上作业题答案.doc西南大学《商务沟通》网上作业题答案.doc西南大学《论文写作》网上作业题答案.doc西南大学《旅游地理学》网上作业题答案.doc西南大学《合唱指挥常识》网上作业题答案.doc西南大学《歌剧艺术欣赏》网上作业题答案.doc西南大学《高效率教学》网上作业题答案.doc西南大学《儿童哲学》网上作业题答案.doc西南大学《动物生物学》网上作业题答案.doc西南大学《动物生物化学》网上作业题答案.doc西南大学《动物生理学》网上作业题答案.doc西南大学《邓小平教育思想》网上作业题答案.doc西南大学《财务会计》网上作业题答案.doc西南大学《中国教育哲学思想》网上作业题及答案.doc 西南大学《中国法制史》网上作业题答案.doc西南大学《中国法律思想史》网上作业题及答案.doc 西南大学《政治学与管理》网上作业题及答案.doc西南大学《政治学》网上作业题及答案.doc西南大学《证券学》网上作业题及答案.doc西南大学《影视摄影》网上作业题及答案.doc西南大学《英语阅读一》(高)网上作业题答案.doc西南大学《英语阅读四(高)》网上作业题及答案.doc 西南大学《英语阅读二》(高)网上作业题答案.doc西南大学《英语听说二》(专)网上作业题及答案.doc 西南大学《英语国家概况》网上作业题及答案.doc西南大学《房地产经营管理》网上作业题及答案.doc西南大学《房地产估价》网上作业题及答案.doc西南大学《电子政务》网上作业题及答案.doc西南大学《当代中国公共政策》网上作业题及答案.doc 西南大学《城市地理学》网上作业题及答案.doc西南大学《财务会计》网上作业题及答案.doc西南大学《办公自动化》网上作业题及答案.doc西南大学《班主任工作》网上作业题及答案.doc西南大学《课堂教学艺术》网上作业题及答案.doc西南大学《经济地理学》网上作业题及答案.doc西南大学《计算机图象处理基础》网上作业题及答案.doc 西南大学《计算机辅助设计》网上作业题及答案.doc西南大学《花卉栽培学概》网上作业题及答案.doc西南大学《果树栽培学概论》网上作业题及答案.doc西南大学《国际贸易》网上作业题及答案.doc西南大学《管理中的计算机应用》网上作业题及答案.doc 西南大学《管理学》网上作业题及答案.doc西南大学《古代文化》网上作业题及答案.doc西南大学《公务员制度》网上作业题及答案.doc西南大学《公文写作》网上作业题及答案.doc西南大学《工程地质》网上作业题及答案.doc西南大学《政治经济学》网上作业题及答案.doc西南大学《语文教学方法论》网上作业题及答案.doc西南大学《行政管理学》网上作业题及答案.doc西南大学《行政法与行政诉讼法》网上作业题及答案.doc 西南大学《小学数学教学方法》网上作业题及答案.doc 西南大学《系统工程》网上作业题及答案.doc西南大学《无土栽培》网上作业题及答案.doc西南大学《土地管理学基础》网上作业题及答案.doc西南大学《蔬菜栽培学概论》网上作业题及答案.doc西南大学《社会学》网上作业题及答案.doc西南大学《素描》网上作业题及答案.doc西南大学《思想政治教育学》网上作业题及答案.doc西南大学《数学分析选讲》网上作业题答案.doc西南大学《世界旅游市场》网上作业题及答案.doc西南大学《审计学》网上作业题及答案.doc西南大学《社会学概论》网上作业题答案.doc西南大学《社会心理学》网上作业题答案.doc西南大学《社会调查与研究方法》网上作业题答案.doc 西南大学《社会保障》网上作业题及答案.doc西南大学《商品流通企业会计》网上作业题及答案.doc 西南大学《商法学》[下]网上作业题及答案.doc西南大学《人力资源管理》网上作业题及答案.doc 西南大学《人口地理学》网上作业题及答案.doc西南大学《人格心理学》网上作业题及答案.doc西南大学《企业管理》网上作业题及答案.doc西南大学《普通心理学》网上作业题答案.doc西南大学《普通物理选讲一》网上作业题及答案.doc 西南大学《民间文学》网上作业题答案.doc西南大学《民法总论》网上作业题答案.doc西南大学《民法分论》网上作业题及答案.doc西南大学《艺术概论》网上作业题及答案.doc西南大学《形式逻辑》网上作业题及答案.doc西南大学《行政法学》网上作业题及答案.doc西南大学《刑法总论》网上作业题答案.doc西南大学《刑法分论》网上作业题及答案.doc西南大学《新税制》网上作业题及答案.doc西南大学《心理学》网上作业题及答案.doc西南大学《心理测量学》网上作业题及答案.doc西南大学《宪法学》网上作业题答案.doc西南大学《线性代数》网上作业题答案.doc西南大学《现代化学教学论》网上作业题答案.doc 西南大学《现代汉语下》网上作业题及答案.doc西南大学《现代汉语上》网上作业题答案.doc西南大学《现代汉语词汇》网上作业题答案.doc西南大学《西方哲学史》网上作业题及答案.doc西南大学《西方经济学》网上作业题及答案.doc西南大学《文字学》网上作业题及答案.doc西南大学《外国文学下》网上作业题及答案.doc西南大学《外国文学上》网上作业题及答案.doc西南大学《土地管理》网上作业题及答案.doc西南大学《统计学原理》网上作业题答案.doc西南大学《体育新闻》网上作业题及答案.doc西南大学《综合英语一》网上作业题答案.doc西南大学《综合英语四》网上作业题及答案.doc西南大学《综合英语七》网上作业题及答案.doc西南大学《综合英语二》网上作业题及答案.doc西南大学《专业英语》网上作业题答案.doc西南大学《中级无机化学》网上作业题答案.doc西南大学《中国新诗与中外文化》网上作业题答案.doc 西南大学《古代散文》网上作业题及答案.doc西南大学《公司法学》网上作业题答案.doc西南大学《公共事业管理导论》网上作业题答案.doc 西南大学《工程地质学》网上作业题及答案.doc西南大学《高等有机化学》网上作业题及答案.doc西南大学《分子生物学》网上作业题及答案.doc西南大学《房地产法》网上作业题及答案.doc西南大学《法理学》网上作业题答案.doc西南大学《电算化会计》网上作业题及答案.doc西南大学《道德》网上作业题及答案.doc西南大学《单片机及应用》网上作业题及答案.doc西南大学《大学英语二》网上作业题答案.doc西南大学《成本会计》网上作业题及答案.doc西南大学《财政学》网上作业题及答案.doc西南大学《财务会计学》网上作业题答案.doc西南大学《材料化学》网上作业题及答案.doc西南大学《标准日本语四》网上作业题及答案.doc西南大学《旅游政策与法规》网上作业题答案.doc西南大学《旅游英语上》网上作业题及答案.doc西南大学《旅游心理学》网上作业题答案.doc西南大学《旅游企业投资与管理》网上作业题及答案.doc 西南大学《旅游美学》网上作业题及答案.doc西南大学《旅游景区开发与管理》网上作业题及答案.doc 西南大学《旅游经济学》网上作业题及答案.doc西南大学《领导科学》网上作业题及答案.doc西南大学《课程论》网上作业题及答案.doc西南大学《经济法》网上作业题及答案.doc西南大学《金融理论与实务》网上作业题及答案.doc 西南大学《教育学》网上作业题及答案.doc西南大学《教育心理学》网上作业题答案.doc西南大学《教育统计学》网上作业题及答案.doc西南大学《教育生理学》网上作业题及答案.doc西南大学《教育社会学》网上作业题及答案.doc西南大学《教育科研方法》网上作业题及答案.doc西南大学《教育经济学》网上作业题及答案.doc西南大学《教育法学》网上作业题及答案.doc西南大学《教学论》网上作业题及答案.doc西南大学《计算机应用》网上作业题及答案.doc西南大学《计算机导论》网上作业题答案.doc西南大学《基础语法下》网上作业题及答案.doc西南大学《婚姻法》网上作业题及答案.doc西南大学《环境学概论》网上作业题及答案.doc西南大学《环境伦理学》网上作业题及答案.doc西南大学《化学实验教学研究》网上作业题及答案.doc 西南大学《合同法》网上作业题及答案.doc西南大学《美学原理》网上作业题及答案.doc西南大学《体育文献检索》网上作业题及答案.doc西南大学《体育社会学》网上作业题及答案.doc西南大学《体育公共关系》网上作业题及答案.doc西南大学《唐宋词研究》网上作业题答案.doc西南大学《微积分初步》网上作业题及答案.doc西南大学《网页设计》网上作业题及答案.doc西南大学《土木工程材料》网上作业题及答案.doc西南大学《土地资源学》网上作业题及答案.doc西南大学《土地制度与政策》网上作业题及答案.doc西南大学《土地管理学》网上作业题及答案.doc西南大学《土地法学》网上作业题及答案.doc西南大学《田间试验设计》网上作业题及答案.doc西南大学《天然药物化学》网上作业题及答案.doc西南大学《体育教育学(方法论)》网上作业题及答案.doc 西南大学《水力学》网上作业题及答案.doc西南大学《数学活动》网上作业题及答案.doc西南大学《蔬菜栽培学》网上作业题及答案.doc西南大学《市场营销》网上作业题及答案.doc西南大学《社会心理学》网上作业题及答案.doc西南大学《色彩构成》网上作业题及答案.doc西南大学《企业战略管理》网上作业题及答案.doc西南大学《普通测量学》网上作业题及答案.doc西南大学《盆景制作》网上作业题及答案.doc西南大学《民族民间音乐》网上作业题及答案.doc西南大学《面向对象程序设计》网上作业题及答案.doc西南大学《乐理》网上作业题及答案.doc西南大学《中学数学课堂教学设计》网上作业题及答案.doc 西南大学《中国音乐史》网上作业题及答案.doc西南大学《中国古代文学二》网上作业题及答案.doc西南大学《政府经济学》网上作业题及答案.doc西南大学《园艺产品营销学》网上作业题及答案.doc西南大学《园艺产品采后处理与商品化》网上作业题及答案.doc 西南大学《园林制图》网上作业题及答案.doc西南大学《园林艺术设计》网上作业题及答案.doc西南大学《园林苗圃学》网上作业题及答案.doc西南大学《园林建筑》网上作业题及答案.doc西南大学《园林工程概预算》网上作业题及答案.doc西南大学《园林工程初步》网上作业题及答案.doc西南大学《英语语法》网上作业题及答案.doc西南大学《英语写作》网上作业题及答案.doc西南大学《音乐》网上作业题及答案.doc西南大学《药物化学》网上作业题及答案.doc西南大学《遥感概论》网上作业题及答案.doc西南大学《学校心理学》网上作业题及答案.doc西南大学《学习心理学》网上作业题及答案.doc西南大学《信息安全》网上作业题及答案.doc西南大学《心理学教学法(方法论)》网上作业题及答案.doc西南大学《小学数学教育学》网上作业题及答案.doc西南大学《小学数学教学案例分析》网上作业题及答案.doc 西南大学《西方文学与文化》网上作业题及答案.doc西南大学《国际私法》网上作业题及答案.doc西南大学《国际经济法》网上作业题及答案.doc西南大学《管理学原理》网上作业题及答案.doc西南大学《管理思想史》网上作业题及答案.doc西南大学《学校管理学》网上作业题及答案.doc西南大学《学校德育》网上作业题及答案.doc西南大学《学前心理学》网上作业题及答案.doc西南大学《学前教育学》网上作业题及答案.doc西南大学《新文学思潮与流派》网上作业题答案.doc西南大学《线性代数》网上作业题及答案.doc西南大学《西方经济学(上)》网上作业题及答案.doc西南大学《物业管理》网上作业题及答案.doc西南大学《土地评价与管理》网上作业题答案.doc西南大学《非营利组织会计》网上作业题及答案.doc西南大学《房屋建筑学2》网上作业题及答案.doc西南大学《房屋建筑学1》网上作业题及答案.doc西南大学《法律逻辑》网上作业题及答案.doc西南大学《发展心理学》网上作业题及答案.doc西南大学《地理信息系统原理》网上作业题及答案.doc西南大学《当代西方经济思潮》网上作业题及答案.doc西南大学《大气》网上作业题及答案.doc西南大学《存在主义疗法》网上作业题及答案.doc西南大学《城市园林绿地规划》网上作业题及答案.doc西南大学《测量学》网上作业题及答案.doc西南大学《奥林匹克学》网上作业题及答案.doc西南大学《C语言》网上作业题及答案.doc西南大学《钢筋混凝土结构与砌体结构》网上作业题及答案.doc 西南大学《课堂教学技术(教学论)》网上作业题及答案.doc 西南大学《酒店房务管理》网上作业题及答案.doc西南大学《金融学》网上作业题及答案.doc西南大学《解剖》网上作业题及答案.doc西南大学《结构力学》网上作业题及答案.doc西南大学《教育心理学》网上作业题及答案.doc西南大学《建筑制图2》网上作业题及答案.doc西南大学《建筑制图1》网上作业题及答案.doc西南大学《建筑力学》网上作业题及答案.doc西南大学《建筑工程招投标与合同管理》网上作业题及答案.doc 西南大学《建筑给水排水工程》网上作业题及答案.doc西南大学《建筑CAD》网上作业题及答案.doc西南大学《计算机制图基础(CAD)》网上作业题及答案.doc西南大学《基础工程》网上作业题及答案.doc西南大学《化工制图》网上作业题及答案.doc西南大学《化工技术经济学》网上作业题及答案.doc西南大学《花卉学》网上作业题及答案.doc西南大学《果树栽培学》网上作业题及答案.doc西南大学《果树盆景盆栽技术》网上作业题及答案.doc 西南大学《国际投资》网上作业题及答案.doc西南大学《国际金融》网上作业题及答案.doc西南大学《管理哲学》网上作业题及答案.doc西南大学《公共关系》网上作业题及答案.doc西南大学《工程建设监理》网上作业题及答案.doc西南大学《歌词创作与鉴赏》网上作业题及答案.doc西南大学《文献检索与应用》网上作业题及答案.doc西南大学《杜甫研究》网上作业题及答案.doc西南大学《第四纪地质学》网上作业题及答案.doc西南大学《地理信息系统》网上作业题答案.doc西南大学《导游业务》网上作业题及答案.doc西南大学《当代世界政治与经济》网上作业题及答案.doc 西南大学《操作系统》网上作业题及答案.doc西南大学《标准日本语三》网上作业题及答案.doc西南大学《标准日本语二》网上作业题及答案.doc西南大学《比较文学》网上作业题答案.doc西南大学《体育产业学导论》网上作业题及答案.doc 西南大学《税收学》网上作业题及答案.doc西南大学《生物化学》网上作业题及答案.doc西南大学《区域经济学》网上作业题及答案.doc西南大学《欧洲文化入门》网上作业题及答案.doc西南大学《面向对象技术》网上作业题答案.doc西南大学《美国文学史及选读》网上作业题及答案.doc 西南大学《马克思主义哲学》网上作业题及答案.doc 西南大学《旅游商品学》网上作业题及答案.doc西南大学《旅行社经营管理》网上作业题及答案.doc 西南大学《科学教育》网上作业题及答案.doc西南大学《经济数学(下)》网上作业题及答案.doc西南大学《经济数学(上)》网上作业题及答案.doc西南大学《教育案例研究》网上作业题答案.doc西南大学《建筑工程制图》网上作业题及答案.doc西南大学《会计学基础》网上作业题答案.doc西南大学《会计核算》网上作业题及答案.doc西南大学《会计电算化》网上作业题及答案.doc西南大学《化工基础》网上作业题及答案.doc西南大学《古代汉语下》网上作业题及答案.doc西南大学《高数选讲》网上作业题及答案.doc西南大学《概率统计》网上作业题答案.doc西南大学《分析化学(定量)》网上作业题答案.doc西南大学《房屋建筑学》网上作业题及答案.doc西南大学《多媒体技术》网上作业题及答案.doc西南大学《综合自然地理学》网上作业题及答案.doc 西南大学《综合英语八》网上作业题及答案.doc西南大学《资产管理》网上作业题及答案.doc西南大学《中学英语教学法》网上作业题及答案.doc 西南大学《中华人民共和国史》网上作业题及答案.doc 西南大学《植物生物学》网上作业题及答案.doc西南大学《语言学导论》网上作业题及答案.doc西南大学《英语阅读二》网上作业题及答案.doc西南大学《英语文体学引论》网上作业题答案.doc西南大学《英语听力一》(高)网上作业题及答案.doc西南大学《英语听力三》(高)网上作业题及答案.doc西南大学《英语词汇学》网上作业题及答案.doc西南大学《英国文学史及选读》网上作业题及答案.doc 西南大学《汇编语言》网上作业题及答案.doc西南大学《环境化学》网上作业题答案.doc西南大学《数学教育学》网上作业题及答案.doc西南大学《营销学》网上作业题及答案.doc西南大学《音乐审美常识》网上作业题及答案.doc西南大学《学校体育学》网上作业题及答案.doc西南大学《行政论理学》网上作业题及答案.doc西南大学《行政管理案例分析》网上作业题及答案.doc 西南大学《刑事诉讼法》网上作业题及答案.doc西南大学《心理诊断学》网上作业题及答案.doc西南大学《项目投资与分析》网上作业题及答案.doc 西南大学《现代教育技术》网上作业题及答案.doc西南大学《现代教学技术》网上作业题及答案.doc西南大学《现代广告学》网上作业题及答案.doc西南大学《系统论》网上作业题及答案.doc西南大学《物流管理》网上作业题及答案.doc西南大学《物理教育学》(方法论)网上作业题答案.doc 西南大学《物理化学》网上作业题答案.doc西南大学《网络原理》网上作业题及答案.doc西南大学《外国民商法》网上作业题及答案.doc西南大学《土木工程施工技术》网上作业题及答案.doc 西南大学《土木工程概预算》网上作业题及答案.doc 西南大学《土力学》网上作业题及答案.doc西南大学《土地经济学》网上作业题及答案.doc西南大学《投资经济学》网上作业题及答案.doc西南大学《统计物理基础》网上作业题及答案.doc西南大学《天文概论》网上作业题及答案.doc西南大学《体育经济学》网上作业题及答案.doc西南大学《体育概论》网上作业题及答案.doc西南大学《特稀蔬菜概论》网上作业题及答案.doc西南大学《数字电路》网上作业题及答案.doc西南大学《数学物理方法》网上作业题答案.doc西南大学《园艺作物无公害生产》网上作业题及答案.doc西南大学《园艺植物育种理论及实践》网上作业题及答案.doc 西南大学《园艺植物生物技术》网上作业题及答案.doc西南大学《园艺植物化学调控》网上作业题及答案.doc西南大学《园林植物造景设计》网上作业题及答案.doc西南大学《园林植物配置》网上作业题及答案.doc西南大学《园林建筑设计与构造》网上作业题及答案.doc西南大学《园林工程》网上作业题及答案.doc西南大学《语言学概论》网上作业题答案.doc西南大学《思想政治教育教学方法论》网上作业题及答案.doc 西南大学《税务会计》网上作业题及答案.doc西南大学《数学建模》网上作业题及答案.doc西南大学《食用菌栽培学》网上作业题及答案.doc西南大学《化学与社会》网上作业题答案.doc西南大学《古代汉语上》网上作业题答案.doc西南大学《公关语言》网上作业题及答案.doc西南大学《公共关系学》网上作业题及答案.doc西南大学《工程概预算》网上作业题及答案.doc西南大学《歌剧艺术欣赏》网上作业题及答案.doc西南大学《高级财务会计》网上作业题及答案.doc西南大学《钢琴教学法》网上作业题及答案.doc西南大学《钢筋混凝土结构基本原理》网上作业题及答案.doc 西南大学《钢结构设计》网上作业题及答案.doc西南大学《钢结构基本原理》网上作业题及答案.doc西南大学《儿童心理障碍》网上作业题及答案.doc西南大学《电子商务概论》网上作业题及答案.doc西南大学《地理科学》网上作业题及答案.doc西南大学《地籍管理》网上作业题及答案.doc西南大学《邓小平理论》网上作业题及答案.doc西南大学《城市园林绿地规划设计》网上作业题及答案.doc 西南大学《草坪学》网上作业题及答案.doc西南大学《变态心理学》网上作业题及答案.doc西南大学《花卉栽培》网上作业题及答案.doc西南大学《国际法》网上作业题及答案.doc西南大学《观光农场经营管理》网上作业题及答案.doc西南大学《市场营销学》网上作业题及答案.doc西南大学《世界政治制度史》网上作业题及答案.doc西南大学《实验心理学》网上作业题答案.doc西南大学《生物学》网上作业题及答案.doc西南大学《生物工程》网上作业题及答案.doc西南大学《生态学》网上作业题及答案.doc西南大学《人力资源开发与管理》网上作业题答案.doc西南大学《企业管理学》网上作业题及答案.doc西南大学《普通物理选讲二》网上作业题及答案.doc西南大学《盆景装饰》网上作业题及答案.doc西南大学《暖通空调》网上作业题及答案.doc西南大学《毛泽东思想概论》网上作业题及答案.doc西南大学《马克思主义哲学》网上作业题答案.doc西南大学《旅游规划与开发》网上作业题及答案.doc西南大学《鲁迅研究》网上作业题及答案.doc西南大学《领导心理学》网上作业题答案.doc西南大学《理论力学》网上作业题答案.doc西南大学《乐理常识》网上作业题及答案.doc西南大学《跨文化交际》网上作业题及答案.doc西南大学《教育统计与测评》网上作业题及答案.doc西南大学《建设法规》网上作业题及答案.doc西南大学《基础教育阶段英语课程》网上作业题及答案.doc 西南大学《基础会计学》网上作业题及答案.doc。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[0049]《中级无机化学》网上作业题答案第一批次[单选题]Fe3+与F-、Cl-、Br-、I-形成配合物,其稳定性最大的是()。
A:Fe3+与F-形成配合物B:Fe3+与Cl-形成配合物C: Fe3+与Br-形成配合物D:Fe3+与I-形成配合物参考答案:A[多选题]实验室配制SnCl2溶液时,必须在少量盐酸中配制(而后稀释至所需浓度),才能得到澄清溶液,这是由于()A:形成缓冲溶液B:盐效应促使SnCl2溶解C:同离子效应D:阻止SnCl2水解参考答案:CD[单选题]硼酸H3BO3是一种()。
A:一元中强酸B:一元弱酸C:三元弱酸D:三元中强酸参考答案:B[单选题]HF、HCl、HBr、HI的酸性最强的为()。
A:HFB:HClC:HBrD:HI参考答案:D[单选题]以HF为溶剂,醋酸为()。
A:酸B:碱C:盐参考答案:B[单选题]在水中TlBr的溶解度比TlBr3的溶解度()。
A:大B:小C:相等参考答案:B[单选题]LiF、LiCl、LiBr、LiI在水中溶解度最大的为()。
A:LiFB:LiClC:LiBrD:Lii参考答案:D[单选题]HCO3-的共轭碱为()。
A:CO32-B:H2CO3C:没有共轭碱参考答案:A[单选题]H2PO4-的共轭酸为()。
A:HPO42-B:H3PO4C:PO43-参考答案:B[论述题]解释CF3COOH的酸性比CH3COOH的酸性强.参考答案:是因为F是电负性最高的元素,F原子的极强的吸电子能力以及羰基的诱导作用,使CF3COOH分子中羰基O原子的正电性增强,从而对H原子的吸引减弱而使其易于解离。
当H原子解离后,生成的阴离子CF3COO?中形成离域∏34,大大增加了该阴离子的稳定性。
因此CF3COOH具有很强的酸性。
[填空题]判断相对Lewis碱性(1) (H3Si)2O和(H3C)2O;其中较强的是。
参考答案:(H3C)2O第二批次[单选题][Co(NH3)4Cl2]+有( ) 种几何异构体。
A:2B:3C:4D:5E:6参考答案:A[填空题]配合物[Co(NH3)5Br]SO4中中心原子Co的配位数是()。
参考答案:6[多选题]采用下列杂化能形成外轨型配合物的有()。
A:sp3d2B:sp3C:d2sp3D:d4sp3参考答案:AB[单选题][ZnCl4]2-为()构型,[PtCl4]2-为()构型。
A:平面正方形, 平面正方形B:正四面体, 正四面体C:正四面体, 平面正方形D:平面正方形,正四面体参考答案:C[单选题]下列配体能作为螯合剂的是()。
A:SCN-B:NO2-C:SO42-D:H2N-CH2-CH2-HN2参考答案:D[单选题]在判别高低自旋构型的参数有Δ和P,若()时为高自旋,反之为低自旋。
A:P>ΔB:P<ΔC:P=Δ参考答案:A[单选题]在晶体场理论中,在八面体场中Oh场作用下d轨道分裂为()和()。
A:e,t2gB:eg,tgC:e,t2;D:eg,t2g参考答案:D[单选题][Co(NH3)4Cl2]+系统命名和配位数正确的是( )。
A:二氯四氨合钴(III)配离子,6B:二氯•四氨合钴配离子,4C:二氯•四氨合钴(III)配离子,6D:四氨合钴(III)配离子,4;参考答案:C[单选题]估算配合物中自旋对磁矩的贡献最大的是()。
A:[Co (NH3)6]3+B: [Fe (H2O)6]2+C:[Fe (CN)6]3-D:[Cr(NH3)6]3+参考答案:B[单选题]已知配合物Cr(NH3)4Cl3的水溶液具有与NaCl溶液类似的摩尔电导率,且0℃时,每摩尔该化合物可以形成一摩尔的AgCl沉淀,则该配合物的化学式为()A:[ CrCl2(NH3)4]ClB:[ Cr(NH3)4]Cl3C:[ Cr(NH3)4Cl]Cl2D:[ Cr(NH3)4Cl3]参考答案:A[填空题]第一过渡系列M2+的水合热峰值不在Ni2+处,而是在( ) 处,这可用( )效应解释。
参考答案:Cu2+,―泰勒[填空题]对配体L为P(CH3)3和P(t-Bu)3的配合物Mo(CO)3L3的合成而言,更易形成稳定配合物的配体是(),原因为()。
参考答案:P(CH3)3,空间排斥力较小[论述题]试从Jahn-Teller效应解释二价铜的化合物结构常常为4个短键,2个长键,近似为平面正方配位结构。
参考答案:假设e g轨道采取d1x2-y2、d2z2的结构,即d x2-y2轨道上短缺一个电子,那么在x-y平面上的电子云密度小于z轴上的电子云密度,中心离子对x-y平面上的4个配位体的吸引力大于对z 轴上的两个配位体的吸引。
则x-y轴方向上的键比z轴方向上的键短。
正八面体变成了拉长的八面体或四角双锥体。
畸变结果体系获得一个分裂参数β的稳定化能。
因为这时两个电子降低了β能量,一个电子能量升高了β。
因此六配位的Cu2+配合物具有两个较其它4个为长的键。
第三批次[单选题]估计Ru3(CO)12中共有()个M―M键A:1B:2C:3D:4参考答案:C[多选题]下列性质相似的元素是()。
A:Al和BeB:B和AlC:B和SiD:Al和Ca参考答案:AC[单选题]性质最相似的两个元素是()。
A:Zr 和 HfB:Ru 和 RhC:Mn 和 MgD:Cu 和 Cr参考答案:A[单选题]下列离子中,离子半径最小的是()。
A:Cl-B:Ca2+C:Sc3+D:Ti4+参考答案:D[单选题]下列元素第一电离能最大的是()。
A:BB:CC:ND:O参考答案:C[单选题]金属羰基配合物的特点有()。
A:一氧化碳与金属能形成很强的化学键B:中心原子总是呈现出较低的氧化态C:大多数配合物服从有效原子序数规则D:以上三种参考答案:D[填空题]在配位体CO、C5H5-、N2、C2H4、R3P中是π酸配位体者为()。
参考答案:CO、N2、R3P[单选题]NO是( )电子给予体。
A:2B:3C:4D:1参考答案:B[单选题]硼氢化物B2H6,B10H14,B5H9中酸性最强的是()。
A:B2H6B:B10H14C:B5H9参考答案:B[单选题]在直接氧化法自乙烯生产乙醛中( )为催化剂,( )为助催化剂。
A:PdCl2, CuCl2B:CuCl2; PdCl2,C:CuCl2; PbCl2,参考答案:A[单选题]B5H9属于()分子。
A:闭式B:巢式C:网式D:链式参考答案:B[论述题]为什么羰基配合物中过渡金属元素可以是零价如Fe(CO)5甚至可以是负价[Co(CO)4]- ?参考答案:由于CO 既可以给出电子对作为路易斯碱,与中心金属(或离子)形成σ配键,增大了中心金属的电子云密度;同时它又可以作为路易斯酸接受中心金属反馈于它的电子,从而分散中心金属的电子云密度,满足电中性原理。
所以羰基配合物中过渡金属元素可以是零价如Fe(CO)5甚至可以是负价[Co(CO)4]-。
第四批次[论述题]说明题:简述[Re2Cl8]2-的成键过程,并说明它的构象为什么是重叠式。
参考答案:35.doc[论述题]解释现象:Co(NH3)5F2+的稳定性大于Co(NH3)5I2+;Co(CN)5F3-的稳定小于Co(CN)5I3-。
参考答案:根据SHAB理论,硬-硬和软-软结合稳定。
其中酸或碱的硬度并非一成不变。
如硬酸可以由于若干软碱配体的存在而被软化。
因此,在Co(NH3)5F2+和Co(NH3)5I2+中,Co3+为硬酸,NH3和F-均为硬碱、I-较软。
因此有五个硬碱NH3存在时,F-配合物比I-配合物稳定;但在Co(CN)5F3-和Co(CN)5I3-中五个软碱CN-的存在使Co3+软化,从而使I-配合物稳定。
[论述题](CH3)3B和BCl3谁是更强的路易斯酸?参考答案:由于Cl的电负性大于-CH3,且为吸电子基,使中心原子硼具有更多的正电荷,路易斯酸性更大。
故BCl3为更强的路易斯酸。
[填空题]二茂铁比二茂钴稳定,原因是()。
参考答案:二茂铁(Cp2Fe)是18e,二茂钴(Cp2Co)是19e[判断题].判断方程式 F4SiNMe3 + BF3 = F3BNMe3 + SiF4 是否正确。
参考答案:正确[判断题]判断方程式 BF3NMe3 + BCl3 = Cl3BNMe3 + BF3是否正确。
参考答案:正确[判断题]判断方程式B2H6 + 2N(CH3)3=2BH3N(CH3)3是否正确。
参考答案:正确[判断题]判断方程式Fe + 5CO=Fe(CO)5是否正确。
参考答案:正确[判断题]判断方程式2CoCO3 + 8CO + 2H2=Co2(CO)8 + 2CO2 + 2H2O是否正确。
参考答案:正确[判断题]判断方程式CrCl3 + 3Na + 6CO=3NaCl + Cr(CO)6是否正确。
参考答案:正确[判断题]. 判断方程式Fe(CO)5 + 3KOH=K[Fe(CO)4H] + K2CO3 + H2O 是否正确。
参考答案:正确[判断题]判断方程式Mn2(CO)10 + Br2=2Mn(CO)5Br是否正确。
参考答案:正确[判断题]判断方程式Cr(CO)6 + C6H6=Cr(C6H6)(CO)3 + 3CO是否正确。
参考答案:正确[判断题]判断方程式SbF5 + KF= KSbF6是否正确。
参考答案:正确[判断题]判断方程式SOCl2 +Cs2SO3=2CsCl+2SO2是否正确。
参考答案:正确第五批次[单选题]在可见区La3+和Ce3+的颜色分别为()。
A:无色, 无色;B:绿色,无色;C:无色,粉红色D:绿色,粉红色参考答案:A[单选题]Pr的磷酸盐为Pr3(PO4)4,其最高氧化态氧化物的化学式是()A: Pr2O3B:Pr2OC:PrO2D:Pr3O4参考答案:C[判断题]BCl3易水解则明显是因为B的缺电子性。
参考答案:正确[判断题]Mo与单质F2反应的主要产物是MoF6。
参考答案:正确[单选题]下列哪种过渡金属具有低密度、高熔点和抗腐蚀的性质,而且强度高,能够制造军用飞机()。
A:水银B:钛C:钪D:铬参考答案:B[单选题]在酸性介质中,Cr2O72-的氧化性比MoO42-的氧化性()。
A:大B:小C:相等参考答案:A[单选题]在单质金属中,最硬的是(),熔点最高的是()。
A: Cr; WB:Cs, WC:Hg; CrD:Os, Mo。
参考答案:A[单选题]下列元素中,可形成多酸的是()。
A:NaB:FeC:AgD:W参考答案:D[单选题]下列提炼金属的方法,不可行的是()。
A:Mg还原TiCl4制备TiB:热分解Cr2O3制备CrC:H2还原WO3制备WD:羰化法提纯Ni参考答案:B[单选题]上述各金属中可用羰化法提纯的是()。
