硫的含氧化合物
硫及其化合物知识点讲解

硫及其化合物知识点讲解硫是一种常见的化学元素,位于周期表的第16组,原子序数为16,简写为S。
它的原子结构包含16个质子和16个电子。
硫存在于自然界中,以多种形式出现,包括自由元素、矿石和天然气等。
硫的物理性质:硫是一种黄色的非金属元素,它的晶体结构与钻石非常相似,是正交晶系。
硫的常见形式包括黄磺、火山硫和针硫。
它的熔点为115.2℃,沸点为444.674℃。
硫具有相对较高的电负性,属于半金属元素。
硫的化学性质:硫是一种化学活性较高的元素,它可以与许多其他元素发生反应。
硫可以与氧气反应形成二氧化硫(SO2),这是一种有毒气体,主要产生于燃烧过程中。
硫还可以与氢气反应生成硫化氢(H2S),这是一种具有强烈恶臭的气体。
硫还可以与金属反应生成硫化物,如铜与硫反应生成黄铜(Cu2S)。
硫还可以与氯反应生成硫氯化物,如硫与氯气反应生成硫四氯化物(SCl4)。
此外,硫还与氮、磷、碳等元素反应生成相应的硫化物、亚磷酸和硫醇等。
硫的化合物:硫化物是硫的主要化合物之一,它包括许多不同的化合物。
常见的硫化物包括硫化氢(H2S)、二硫化碳(CS2)和硫化铁(FeS)等。
硫化氢是一种无色有毒气体,广泛用于工业生产中。
硫化铁是一种黑色固体,是黄铁矿的主要成分。
硫醇是与硫原子直接连接的有机化合物,具有类似于醇的性质。
除了硫化物,硫还可以与氧形成氧化物。
最常见的氧化物是二氧化硫(SO2)和三氧化硫(SO3)。
二氧化硫是一种无色有毒气体,广泛用于工业生产和环境保护。
三氧化硫是一种无色液体或白色固体,具有强烈的腐蚀性。
硫在工业生产和农业中具有重要的应用。
硫化氢用于制造化学品、合成药品和硫化汞等。
硫在农业中用于制造硫肥,可以改善土壤的肥力。
总之,硫及其化合物是一种重要的元素和化学品,广泛应用于工业和农业领域。
了解硫的性质和化合物,有助于我们更好地理解和利用它们。
高一氧硫及其化合物知识点

高一氧硫及其化合物知识点一、氧化还原反应氧硫化物是由氧和硫的化合物组成。
在这些化合物中,氧与硫的氧化态是随着元素的化合形式而变化的。
氧的氧化态通常为-2,但在氧硫化物中,其氧化态会发生变化。
氧化还原反应是指化学反应中,物质的氧化态发生改变的过程。
当氧化剂得到电子并接受电通的时候,其氧化态会发生增加,而还原剂则会失去电子,其氧化态会减少。
二、高一氧硫的性质与应用1. 氧气氧气在化学反应中是一种重要的氧化剂。
它能与其他元素或化合物反应,使其氧化。
同时,氧气也是生物体呼吸过程中的必需物质。
2. 二氧化硫二氧化硫是一种无色气体,有刺激性气味。
它是高一氧硫化合物中常见的一种,也是被广泛应用的化合物之一。
二氧化硫的主要应用领域包括:- 工业:二氧化硫是制造硫酸的重要原料,广泛用于生产纸张、塑料、农药等产品。
- 食品:二氧化硫是一种食品添加剂,常被用于保鲜果蔬,防止其变色和腐烂。
- 环境保护:作为一种污染物,二氧化硫对环境有害。
因此,在燃煤和工业废气处理中,需要对二氧化硫进行净化处理,以减少其对大气的污染。
3. 三氧化硫三氧化硫是一种无色晶体,在空气中不稳定,会与水和氧反应。
它的主要应用是制造硫酸。
三氧化硫的制备方法包括:硫在高温下与氧反应,通过催化剂促使这个反应快速进行。
4. 亚硫酸亚硫酸是一种无色气体,呈强酸性,有刺激性气味。
它在一些化学反应中起着重要的作用。
亚硫酸的主要应用包括:- 漂白:亚硫酸是一种常用的漂白剂,广泛用于纺织品、纸张等行业。
- 消毒:亚硫酸也可以用于消毒,如清洁和消毒水。
- 食品加工:亚硫酸是一种食品添加剂,可用于保鲜、防腐和抗氧化。
5. 硫酸硫酸是一种无色液体,具有强酸性。
它是一种重要的化学品,广泛应用于各种工业中。
硫酸的主要应用领域包括:- 化肥:硫酸是制造化肥的重要原料,如硫酸铵、硫酸钾等。
- 汽车电池:硫酸被用作蓄电池中的电解液。
- 腐蚀剂:硫酸在工业中也用作腐蚀剂,用于清洗金属表面。
高三硫的氧化物知识点

高三硫的氧化物知识点硫的氧化物是指由硫和氧元素组成的化合物,常见的有硫化氢(H2S)、二氧化硫(SO2)和三氧化硫(SO3)。
下面将对这些硫的氧化物的特性、性质以及相关应用进行介绍。
1. 硫化氢(H2S)硫化氢是由硫和氢两个元素组成的化合物,化学式为H2S。
它是一种具有刺激性气味的无色气体,在自然界中存在于一些火山喷发、矿井和一些细菌的代谢过程中。
硫化氢可以被用于工业领域,例如制备化肥、漂白剂等。
此外,由于其具有毒性,硫化氢还被应用于环境保护、污水处理和工业安全领域。
2. 二氧化硫(SO2)二氧化硫是由硫和氧两个元素组成的化合物,化学式为SO2。
它是一种具有刺激性气味的无色气体,在自然界中存在于火山喷发、燃烧和一些工业过程中。
二氧化硫是大气污染的主要来源之一,在工业中主要用于制备硫酸和二硫化碳等化学物质。
此外,它也被用作食品添加剂,例如在葡萄酒生产过程中起到抗氧化和杀菌的作用。
3. 三氧化硫(SO3)三氧化硫是由硫和氧两个元素组成的化合物,化学式为SO3。
它是一种无色液体,可以迅速与水反应生成硫酸。
三氧化硫广泛应用于化工、冶金和制药工业中的硫酸生产过程中。
此外,三氧化硫还可以用于制备硫酸盐和硫酸酯等化学品。
总结:硫的氧化物包括硫化氢、二氧化硫和三氧化硫。
硫化氢是一种具有刺激性气味的无色气体,可应用于化肥制备和环境保护。
二氧化硫是一种具有刺激性气味的无色气体,主要用于硫酸制备和食品添加剂。
三氧化硫是一种无色液体,广泛应用于硫酸生产和制药工业中。
以上是关于高三硫的氧化物知识点的介绍。
通过了解这些知识点,我们可以更好地理解硫的氧化物的特性和应用领域。
在学习化学过程中,深化对硫的氧化物的认识,有助于我们更好地理解化学原理,并能够将其应用于实际生活和工作中。
硫知识点总结化学

硫知识点总结化学一、硫的常见性质硫是一种黄色的固体,具有特殊的气味。
在常温下为黄色结晶,熔点为115.21摄氏度,沸点为444.6摄氏度。
硫有很强的反应性,可以和多种元素和化合物发生化学反应。
而且,硫有着很高的电负性,与氧一样是一种典型的非金属元素。
硫的化学性质主要表现为它的强氧化性和还原性。
硫可以和氧气或卤素发生化学反应,形成相应的氧化物或卤化物。
例如,硫和氧气反应可以生成二氧化硫(SO2)和三氧化硫(SO3);硫和氯气反应可以生成氯化硫(S2Cl2)等。
此外,硫也可以和金属元素发生反应,形成硫化物。
硫化物通常具有特殊的性质,例如黑色的硫化铁(FeS)是一种常见的硫化物。
另外,硫还能和氢气发生反应,生成硫化氢(H2S),它是一种有毒的气体,具有刺激性臭味。
二、硫的化合物硫化氢是硫的重要化合物之一,它是一种常见的有毒气体,具有刺激性的臭味。
硫化氢在工业上广泛用于冶金和化工等领域,同时也是一种重要的腐蚀剂。
此外,硫化氢还被广泛用于生物燃料电池中,作为氢源的替代物。
硫酸是硫的另一种重要化合物,它是一种无色无味的液体,可以溶解在水中。
硫酸具有很高的酸度,可以和多种金属和碱发生化学反应。
硫酸广泛用于冶金、化工、制药和农业等领域,是一种重要的化工原料。
硫酸盐是硫的一类重要化合物,它们是硫酸的盐类衍生物,具有广泛的应用。
硫酸盐可以用于制造肥料、玻璃、橡胶、化学品等产品,同时也可以用于工业废水处理和环境保护等领域。
硫还可以形成与氧、氮、碳等元素的多种化合物,这些化合物在化学和工业领域中具有广泛的应用。
例如,硫氧化物、硫酸酯等。
三、硫的应用硫具有广泛的工业应用价值,主要用于制造硫酸、硫酸盐、硫化物等产品。
硫酸是一种常用的化工原料,可以用于制造肥料、玻璃、橡胶、医药品等产品。
硫酸盐也是一种重要的化工原料,广泛用于金属冶炼、电镀、化学纤维生产等行业。
此外,硫还可以用于生物医药领域。
硫化物有着很强的生物活性,可以用于制造抗菌药物、抗肿瘤药物等产品。
有机硫种类

有机硫是一类化合物,分子中含有硫原子,通常以“S”表示。
它有多种不同的类别和应用。
以下是一些常见的有机硫种类及其相关参考内容:1.二硫化物:二硫化物是一类含有两个硫原子的有机硫化合物,通常以“S-S”键连接。
这类化合物具有较强的还原性和稳定性,并且在药物、医药、农药等方面有重要应用。
例如,二硫化碳(CS2)可以用作溶剂和化学原料,二巯基二苄磷(DDVP)则是一种常用的杀虫剂。
2.硫醚:硫醚是一类含有硫原子的醚化合物,通常以R-S-R’表示,其中R和R’可以是任意有机基团。
硫醚具有较好的溶解性、化学稳定性和低毒性,因此广泛应用于有机合成、溶剂和化妆品等领域。
例如,在有机合成中,三丁基硫醚(TBBS)和二甲双硫醚(DMDS)是常用的硫化剂;在化妆品中,苯甲硫醚(Benzyl Methoxydibenzoylmethane)是一种常用的防晒剂。
3.硫胺类化合物:硫胺类化合物是一类含有硫原子和氨基的有机化合物,通常用于药物和抗生素的制备。
硫胺素(维生素B1)是一种重要的硫胺类化合物,具有促进细胞能量代谢和神经系统功能的作用。
4.亚硫酸酯:亚硫酸酯是一类含有硫原子和氧原子的有机化合物,通常以R-S(=O)-OR’表示。
亚硫酸酯具有较强的还原性和抗氧化性,广泛应用于染料、塑料和橡胶等行业。
例如,亚硫酸乙酯(Ethyl hydrogen sulfite)是一种常用的染料还原剂。
5.硫化物:硫化物是一类含有硫原子的有机化合物,通常以R-S-R’表示,其中R和R’可以是不同的有机基团。
硫化物具有较强的还原性和稳定性,广泛应用于有机合成和杂化材料等领域。
例如,乙二硫代乙苯(Bis-(2-ethylhexyl) Dithiophosphoric Acid)是一种常用的提取剂,在矿物提取过程中具有很高的选择性。
以上仅是有机硫的一些常见种类及其相关参考内容。
有机硫在化学、药物和材料等领域具有广泛的应用,其研究和开发仍有很大的发展空间。
化学高中关于硫知识点总结

化学高中关于硫知识点总结硫的原子结构是由16个质子和16个中子组成的,具有16个电子,其中有2个在1s轨道,2个在2s轨道,和4个在2p轨道上。
在化合物中,硫通常形成2-价和6-价的化合物,分别呈现为硫化物和硫酸盐的形式。
硫的化合价还有4-价和3-价的情况。
硫的物理性质硫是一种黄色的固体,它的熔点为115.21°C,沸点为444.6°C。
硫具有很高的密度,为2.07 g/cm³。
在常温下,硫的形态为Rhombic硫和Monoclinic硫,它们的结晶形态不同。
硫的蒸气呈蓝色,并且可以自发地凝结成S8环状分子。
硫的化学性质硫是一种活泼的非金属元素,在化学反应中常常表现出多种性质。
硫在空气中能够缓慢燃烧,生成二氧化硫(SO2)。
在高温下,硫可以和氢气反应生成硫化氢(H2S),并且可以和金属反应形成硫化物。
此外,硫还可以和氧、氮、卤素等元素发生化学反应。
硫的化合物硫和氧的化合物主要有硫酸(H2SO4)、亚硫酸(H2SO3)和二氧化硫(SO2)等。
在化工工业中,硫酸是一种重要的化学品,它被广泛应用于冶金、电镀、肥料和化工生产等领域。
硫酸是一种强酸,它能与金属氧化物反应生成相应的硫酸盐。
硫的应用硫在工业生产中有着广泛的用途。
例如,在石油加工中,硫酸和硫酸盐用于催化剂的生产和燃料的脱硫。
此外,硫还被用于制备硫化物、药物和染料等化工产品。
在农业中,硫酸盐可以用作土壤改良剂,促进作物生长。
在生物体内,硫是一种重要的营养元素,它存在于蛋白质、氨基酸和辅酶等生物分子中。
硫元素在生物体内的功能包括维持细胞膜的完整性、参与新陈代谢反应和调节酶的活性等。
在日常生活中,硫被用于制备药物、杀虫剂和抗菌剂等产品。
此外,硫还可以用于染料、油漆和橡胶制品的生产。
在化妆品和个人护理产品中,硫也被广泛应用于抗皮肤炎症和杀菌消毒等方面。
总的来说,硫是一种重要的化学元素,它在工业、农业、医药和化工等领域都有着广泛的应用。
硫氧化合物

硫氧化合物硫氧化合物是指以氧和硫共同组成的化合物,它是一类重要的无机化合物,在自然界和工业中都有着广泛的应用,因此,对硫氧化合物的研究受到了很多科学家的关注。
一、硫氧化合物的组成硫氧化合物主要由氧和硫共同组成,其中氧的主要形式有氧原子、氧分子和氧离子,硫的主要形式有硫原子、硫分子和硫离子。
硫氧化合物的结构可以分为单硫氧化物、双硫氧化物和多硫氧化物,它们之间的化学性质有明显的不同。
二、硫氧化合物的分类根据硫氧化合物的组成结构,可以将它们分为三类:1. 单硫氧化物:由一个硫原子和一个氧原子组成,如硫酸、硫化氢等;2. 双硫氧化物:由一个硫分子和一个氧原子组成,如硫酸钠、硫酸钙等;3. 多硫氧化物:由一个硫原子和多个氧原子组成,如硫酸铜、硫酸铁等。
三、硫氧化合物的特性1. 硫氧化合物具有极强的氧化性能,有着较强的毒性和腐蚀性,可以溶解金属离子,能够把金属离子氧化成金属氧化物。
2. 硫氧化合物具有很强的化学稳定性,能够耐高温和抗腐蚀,并能够抵抗酸和碱的腐蚀。
3. 硫氧化合物也具有一定的抗氧化性,能够延缓物质的氧化反应,从而降低物质的氧化损耗。
四、硫氧化合物的应用1. 硫氧化合物在工业生产中有着重要的作用,如用于硝酸钠的生产、氧化钠的生产、氯碱的生产以及染料、医药、农药、催化剂等的生产。
2. 硫氧化合物也可以用于污水处理,能够有效去除污水中的有机物和金属离子。
3. 在石油化工、冶金等火焰加热行业,硫氧化合物可以用作焰剂,能够增加火焰的温度,提高燃烧效率。
4. 硫氧化合物也可以用于抗菌和杀虫剂的生产,具有较强的毒性和杀菌能力,能够有效抑制有害生物的繁殖。
五、硫氧化合物的安全措施1. 在使用硫氧化合物的过程中,应该采取必要的安全措施,如采用酸抗性的工作服装及防护用具,避免接触过量的硫氧化合物。
2. 在进行实验操作时,应该严格按照安全操作规程进行,如禁止抽烟、喝酒和食用实验室内的物品,以防止火灾和意外事故的发生。
有机硫化合物

有机硫化合物
有机硫化合物(汉语拼音:Youji Liu Huahewu;英语:Organosulfur Compound),含碳硫键的有机化合物,存在于石油和动植物体内。
从数量上说,有机硫化合物仅次于含氧或含氮的有机化合物。
有机硫化合物可分为含二价硫的有机化合物和含高价(四价或六价)硫的有机化合物两大类。
第一类化合物多数与其相应的含氧化合物在结构和化学性质方面相似,个别的第二类化合物也有同样现象。
含二价硫的有机化合物包括:
①硫醇和硫酚,C2H5SH、C6H5SH。
②硫醚,CH3—S—CH3。
③二硫化物,CH3—S—S—CH3。
④多硫化物,CH3—S—S—S—CH3。
⑤环状硫化物,Y1503_1。
此外,还有含硫杂环化合物和硫代醛、酮、羧酸及其衍生物。
含高价硫的有机化合物包括:
很多合成的有机硫化合物可用作医药、农药、染料、溶剂、洗涤剂和橡胶硫化剂等。
2020高中化学硫的含氧化合物
有机物炭化:从纤维、糖中提取水。
C12H22O11
12 C + 11 H2O
D、强氧化性
与活波金属作用:
3 Zn + 4 H2SO4(浓) 3 ZnSO4 + S + H2O
4 Zn + 5 H2SO4(浓) 4 ZnSO4 + H2S + H2O
从结构上看,这个反应按下式进行:
O S OO
2-
S
I
+
2- I
O O
S
O
S
O
S
O
2-
+ 2I-
S
O S S OO
O
九、过硫酸及其盐
过二硫酸H2S2O8的制备: ● 实验室——氯磺酸HSO3Cl和无水过氧化氢反应。
HSO3Cl + HOOH 2 HSO3Cl + HOOH
HSO3·OOH + HCl HSO3·OO·SO3H + HCl
35
S
32
SO
2 3
沸 腾
35
S32
SO
2 3
H 35 S 32 SO 2
H2O
C、不稳定,在酸性条件下分解,只有pH>4.6时才不分解
D、是一种还原剂,也是一种络合剂
2Na2S2O3 + I2
Na2S4O6 + NaI
AgBr + 2Na2S2O3
Na3[Ag(S2O3)2] + NaBr
硫酸盐分解与温度的关系为: 同族,等价金属硫酸盐的热分解温度从上到下升高: MgSO4 (895 ℃)<CaSO4 (1 149 ℃)<SrSO4 (1 374 ℃)
硫氧化物

硫的氧化合物的总称
01 简介
03 用途 05 治理方法
目录
02 结构 04 污染危害
主要有二氧化硫和三氧化硫,都是呈酸性的气体,二氧化硫主要是燃烧煤所产生的大气污染物,易溶于水, 在一定条件下可氧化为三氧化硫,当二氧化硫溶于水中,会形成亚硫酸(酸雨的主要成分)。若把二氧化硫进一 步氧化,通常在催化剂如二氧化氮的存在下,便会生成硫酸。这就是对使用这些燃料作为能源的环境效果的担心 的原因之一。
简介
硫氧化物硫氧化物是硫的氧化合物的总称。通常硫有4种氧化物,即二氧化硫(SO2)、三氧化硫(SO3)、 硫酸酐、三氧化二硫(S2O3)、一氧化硫(SO);此外还有两种过氧化物:七氧化二硫(S2O7)和四氧化硫 (SO4)。在大气中比较重要的是SO2和SO3,其混合物用SOX表示。硫氧化物是全球硫循环中的重要化学物质。 它与水滴、粉尘并存于大气中,由于颗粒物(包括液态的与固态的)中铁、锰等起催化氧化作用,而形成硫酸雾, 严重时会发生煤烟型烟雾事件,如伦敦烟雾事件,或造成酸性降雨。SOX是大气污染、环境酸化的主要污染物。 化石燃料的燃烧和工业废气的排放物中均含有大量SOX。采用燃料脱硫、排烟脱硫等技术来降低或消除硫氧化物 (主要是SO2)的排放。也有用高烟囱扩散的方法,使排放源附近的SOX浓度降低,但这会污染远离污染源地区, 只是权宜之计。
用液态吸收剂吸收烟气中的SO2的方法。湿法排烟脱硫装置具有投资比较小、操作维护管理较容易、反应速 度快、脱硫效率高等优点,所以近年来兴建的大多是这种脱硫装置。湿法排烟脱硫根据使用吸收剂的种类或副产 物的不同可分为:氨吸收法、石灰石或石灰乳吸收法、氧化镁(MgO)吸收法、钠(钾)吸收法和氧化吸收法等。
二氧化硫还用来制备硫酸,首先转化成三氧化硫,然后再转化成发烟硫酸,最后转化成硫酸。这个过程中的 二氧化硫是含硫矿物与氧气反应产生的。把二氧化硫转化成硫酸的过程,称为接触法。
硫及硫的有关化合物知识点整理

硫及硫的有关化合物知识点整理硫是一种常见的化学元素,其化学符号为S,原子序数为16,原子量为32.06 g/mol。
硫的原子结构是2s²2p⁶3s²3p⁴。
硫在自然界中以多种形式存在,如硫矿石、硫化物和酸等。
以下是硫及其化合物的一些重要知识点:1.硫的性质:-硫是一种黄绿色的非金属元素,具有特殊的气味。
-硫是一种固体,在常温下比较容易溶于有机溶剂。
-硫的熔点为115.21°C,沸点为444.67°C。
2.硫的化合物:-硫氧化物(SOx):硫和氧元素的化合物,包括二氧化硫(SO₂)和三氧化硫(SO₃)。
它们是大气中的主要污染物之一,也是酸雨的成分之一-硫化物(S²⁻):硫与其他元素形成的化合物,如硫化铁(FeS₂)和硫化氢(H₂S)。
硫化物具有特殊的气味,并且有着多种应用,如冶金、材料科学和生物化学等领域。
-硫酸盐(SO₄²⁻):硫酸(H₂SO₄)是硫酸盐的最常见形式之一、硫酸是一种重要的化学品,广泛用于工业生产和实验室中。
-硫醇(R-SH):硫与有机化合物形成的化合物,常见于蛋白质分子中。
硫醇具有特殊的气味,并且具有一些重要的生物活性。
3.硫和环境:-温室效应:硫气体和硫化物是温室气体之一,在大气中可以产生温室效应,对地球的气候变化产生一定影响。
4.硫的应用:-农业:硫是植物生长和发育所必需的微量元素之一、硫营养对植物的生长和产量具有重要影响,可通过施用硫肥来改善土壤中的硫含量。
-化学工业:硫及其化合物广泛应用于化学工业生产过程中,如制造硫酸、硫酸盐、硫醇、硫醚等重要化学品。
-燃料工业:硫是许多燃料中的主要成分之一,如煤炭和原油。
硫的含量会对燃料的质量和环境影响产生一定影响。
-药学:硫化物和硫代谢产物在药学中有重要的应用,如抗生素、抗癌药物和其他药物中的活性成分之一以上是硫及其化合物的一些重要知识点。
硫的化学性质及应用非常广泛,对环境和人类生活产生着重要影响。
硫酸的相对分子质量

硫酸的相对分子质量是多少
硫酸的相对分子质量是98.078。
硫酸是一种无机化合物,化学式是H₂SO₄,是硫的最重要的含氧酸。
纯净的硫酸为无色油状液体,10.36℃时结晶,通常使用的是它的各种不同浓度的水溶液,用塔式法和接触法制取。
硫酸能和绝大多数金属发生反应。
高浓度的硫酸有强烈吸水性,可用作脱水剂,碳化木材、纸张、棉麻织物及生物皮肉等含碳水化合物的物质。
与水混合时,亦会放出大量热能。
其具有强烈的腐蚀性和氧化性,故需谨慎使用。
硫酸可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼以及染料等工业中。
常用作化学试剂,在有机合成中可用作脱水剂和磺化剂。
扩展资料
硫酸用于化学纤维以外的高分子化合物生产塑料等高分子化合物,在国民经济中越来越占有重要的地位。
每生产1t环氧树脂,需用硫酸2.68t,号称“塑料王”的聚四氟乙烯,每生产1t,需用硫酸1.32t;有机硅树胶、硅油、丁苯橡胶及丁腈橡胶等的生产,也都要使用硫酸。
用于染料工业几乎没有一种染料(或其中间体)的制备不需使用硫酸。
偶氮染料中间体的制备需要进行磺化反应,苯胺染料中间体的制备需要进行硝化反应,两者都需使用大量浓硫酸或发烟硫酸。
所以有些染料厂就设有硫酸车间,以配合需要。
用于日用品的生产生产合成洗涤剂需要用发烟硫酸和浓硫酸。
塑料的增塑剂(如苯二甲酸酐和苯二甲酸酯)、赛璐珞制品所需的原料硝化棉,都需要硫酸来制备。
玻璃纸、羊皮纸的制造,也需要使用硫酸。
此外,纺织印染工业、搪瓷工业、小五金工业、肥皂工业、人造香料工业等生产部门,也都需要使用硫酸。
硫化学知识点总结

硫化学知识点总结
硫是一种非金属元素,化学符号为S,原子序数为16,原子量为32.065。
硫在自然界中
以多种形式存在,包括硫化物、硫酸盐和元素硫。
硫化合物是硫的重要来源之一,它们在
化工、冶金、制药等领域有着广泛的应用。
以下是关于硫化学的一些重要知识点总结。
1. 硫的物理性质
硫是一种淡黄色固体,常温下为单质,有两种主要结构形式:单斜硫和正交硫。
单斜硫呈
黄绿色,在90°C以上时转变为正交硫,呈深黄色。
硫有独特的物理性质,比如能与铁、
铜等金属反应生成硫化物,能与氧气反应生成二氧化硫等。
2. 硫的化学性质
硫是一种活泼的非金属元素,能与大多数元素反应。
例如,硫能与氧气反应生成二氧化硫,与水反应生成亚硫酸,与氢气反应生成硫化氢等。
此外,硫还能形成多种氧化态的化合物,包括硫酸、亚硫酸、硫酸盐等。
3. 硫的化合物
硫与多种元素能形成化合物,其中最常见的是硫化物。
硫化物是硫与金属元素形成的一种
化合物,常见的有铁的硫化物、铜的硫化物、锌的硫化物等。
此外,硫还能与氧形成硫酸盐、与氢形成硫化氢等。
4. 硫的应用
硫在工业上有着广泛的应用,其中最重要的是用于制造硫酸。
硫酸是一种重要的化工原料,广泛用于电镀、造纸、肥料生产等领域。
此外,硫还用于制造草酸、硫酸镁、硫磺等产品。
总之,硫是一种重要的非金属元素,具有丰富的化学性质和广泛的应用价值。
对硫化学的
深入了解,有助于更好地利用和开发硫资源,推动相关产业的发展。
砜硫磺中的亚砜

砜硫磺中的亚砜
砜和亚砜是两种含有硫和氧的化合物类别。
砜通常是由硫醚氧化得到的,而亚砜则是这一氧化过程中的中间产物。
在化学结构上,砜和亚砜的通式分别为R—S(=O)₂—R′和R—S(=O)—R′,其中R和R′代表不同的基团。
这两种化合物在命名上遵循一定的规则。
根据IUPAC(国际纯粹与应用化学联合会)的建议,亚砜和砜的命名是通过在基团R′的前缀名称后面加上“亚磺酰基(sulfinyl)”或“磺酰基(sulfonyl)”,然后加上与R相对应的母体氢化物的名称来实现的。
另外,在官能团类别命名法中,通过在基团R和R′的前缀名称后面分别加上“亚砜(sulfoxide)”和“砜(sulfone)”来进行命名。
因此,如果“砜硫磺中的亚砜”指的是在砜类化合物中存在的亚砜成分,那么可以理解为在硫磺经过氧化过程生成砜的过程中,可能会形成亚砜作为中间产物。
然而,具体的存在形式和含量可能会因具体的化合物和反应条件而异。
请注意,化学领域的专业术语和命名规则可能较为复杂,因此建议查阅相关的专业文献或咨询化学专家以获取更详细和准确的信息。
硫醇和硫代硫酸钠反应

硫醇和硫代硫酸钠反应-概述说明以及解释1.引言1.1 概述硫醇和硫代硫酸钠反应是一种重要的有机合成反应,广泛应用于有机化学领域。
硫醇是一种含有硫原子的有机物,具有强烈的恶臭味道。
硫代硫酸钠是一种含有硫和氧原子的无机化合物,具有良好的溶解性和氧化性。
在硫醇和硫代硫酸钠反应中,硫醇的硫原子与硫代硫酸钠的硫原子发生亲核取代反应,生成硫代硫酸酯和硫化钠。
这种反应在有机合成中被广泛应用,可用于合成硫醇衍生物和其他有机硫化合物。
本文将探讨硫醇和硫代硫酸钠反应的性质、反应机理以及其在有机合成中的应用和影响因素,具有一定的研究价值和实用意义。
1.2 文章结构文章结构部分的内容应当包括对整篇文章的章节安排和内容脉络的描述。
在本文中,文章结构部分可以简要介绍整篇文章分为引言、正文和结论三个部分,其中引言部分将概述硫醇和硫代硫酸钠反应的背景和重要性,正文部分将详细介绍硫醇和硫代硫酸钠的性质以及它们的反应机理,结论部分将总结反应的应用、影响因素以及未来的发展方向。
通过此结构,读者可以清晰了解文章内容的组织和主要内容。
1.3 目的本文旨在深入探讨硫醇和硫代硫酸钠的反应机理,揭示其化学性质和反应过程。
通过对这两种化合物的性质进行分析,我们将探讨它们在化学反应中的作用和应用,以及了解反应的影响因素。
最终,我们希望为这一反应的研究提供一定的参考价值,并展望其在未来的发展前景。
} }}}请编写文章1.3 目的部分的内容2.正文2.1 硫醇的性质硫醇是一类含有硫原子的有机化合物,通常用R-SH表示,其中R代表有机基团。
硫醇在化学性质上具有一些独特的特点:1. 气味刺激:硫醇通常具有难闻的恶臭气味,这是由于硫原子的存在所导致的。
2. 不稳定性:由于硫醇中硫原子与氧原子有相似的电负性,硫醇很容易氧化为相应的二硫化物,因此硫醇在空气中很容易被氧化。
3. 溶解性:一般来说,硫醇在水中具有较好的溶解度,尤其是低分子量的硫醇,可以溶解于水中形成透明的溶液。
桥化合物的命名

桥化合物的命名
桥化合物在化学中扮演着连接不同分子或离子的重要角色,通过桥连接,不同的化合物可以形成稳定的结构或发生化学反应。
桥化合物的命名往往反映了其结构和性质,下面将介绍一些常见的桥化合物及其命名。
一、双桥合物
双桥合物是一类具有两个桥连接的化合物,常见的双桥合物包括双硫桥合物、双氧桥合物等。
其中,双硫桥合物是指两个硫原子共享一个或多个电子对而形成的桥连接,常见的双硫桥合物包括二硫化物和二硒化物等。
双氧桥合物则是指两个氧原子之间通过共价键或氢键形成的桥连接,常见的双氧桥合物包括过氧化物和过硒化物等。
二、硫氧化合物
硫氧化合物是一类含有硫和氧元素的化合物,常见的硫氧化合物包括硫醇、硫醚、硫醛等。
其中,硫醇是一类含有硫羟基的有机化合物,常用来进行亲核取代反应;硫醚是一类含有硫桥连接的有机化合物,常用来进行亲电取代反应;硫醛是一类含有硫羰基的有机化合物,常用来进行亲核加成反应。
三、氧氮化合物
氧氮化合物是一类含有氧和氮元素的化合物,常见的氧氮化合物包
括氨氧化物、氮氧化物等。
其中,氨氧化物是一类含有氮氧键的化合物,常用来进行还原反应;氮氧化物是一类含有氮和氧原子之间形成的桥连接,常用来进行氧化反应。
总的来说,桥化合物在化学中扮演着连接不同分子或离子的重要角色,通过桥连接,不同的化合物可以形成稳定的结构或发生化学反应。
桥化合物的命名往往反映了其结构和性质,了解桥化合物的命名规则有助于我们更好地理解化学反应的机理和规律。
希望本文对大家有所帮助,谢谢阅读!。
硫的化合价全部

硫的化合价全部
硫是一种常见的化学元素,其化合价的不同取决于其所形成的化合物。
硫的化合价有+6、+4、+2和-2四种。
硫的最常见的化合价是+6。
在+6化合价中,硫与氧元素形成的化合物最为典型。
硫的氧化物有多种,其中最重要的是二氧化硫(SO2)和三氧化硫(SO3)。
二氧化硫是一种无色气体,具有刺激性气味。
它主要用于工业生产和环境监测。
三氧化硫是一种无色晶体,可用作制造硫酸的原料。
硫的化合价+4通常出现在硫酸盐中。
硫酸盐是由硫酸根离子和金属离子或其他阳离子组成的化合物。
硫酸是一种常见的无机酸,其盐类广泛应用于农业、医药和工业领域。
硫酸盐的例子有硫酸钠(Na2SO4)和硫酸铜(CuSO4)。
硫的化合价+2常见于硫化物中。
硫化物是硫与其他元素形成的化合物。
其中最著名的是二硫化物(H2S),它是一种具有刺激性气味的无色气体。
硫化物在地质和化学工业中有重要的应用,例如矿石中的硫化物可以被提取出来用于生产硫酸。
硫的化合价-2通常出现在硫化氢(H2S)中。
硫化氢是一种具有刺激性气味的无色气体,也是硫的最重要的还原剂之一。
硫化氢广泛应用于化学实验室和工业生产中,用于金属清洗、催化剂制备和制备其他硫化物。
硫的化合价有+6、+4、+2和-2四种。
在不同的化合价下,硫形成了各种化合物,包括硫的氧化物、硫酸盐、硫化物和硫化氢。
这些化合物在工业生产、环境监测和化学实验室中有重要的应用。
了解硫的化合价及其相关化合物对于理解硫的化学性质及其应用具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在气相中 SO2 被氧化的过程极慢。 该过程可以用 V2O5 催化,其机理为 ① SO2 + V2O5 —— SO3 + 2 VO2 ② 4 VO2 + O2 —— 2 V2O5
EAθ/V
SO42-
0.172
0.449
H2SO3
S
0.357
从元素电势图上可以看出,在 酸中 S(IV)具有一定的氧化性。
sp2 杂化轨道中的单电子轨道, 与配体氧的 2 py 轨道成 σ键,确定 了分子平面及 “ V ” 字形结构。
中心的 3 pz 轨道和两个配体的 2 pz 轨道均垂直于分子平面,互相 重叠。
共有 4 个电子 —— 中心 2 个,
配体 1 2 个,在这 3 个 pz 轨道中 运动,形成 3 中心 4 电子大 键,
1. SO3 的结构 0℃ 时 SO3 是白色固体,m.p. 289.8 K, b.p. 317.8 K。
气态 SO3 分子呈平面三角形
中心 S 采取 sp2 杂化。 中心 S(VI)有 6 个价电子。 其中 3 个电子在 sp2 等性杂化 轨道中,与 O 之间成 键。
另外 3 个电子用以形成大 π 键, 3 个氧原子各提供 1 个电子。
4. 焦亚硫酸钠
NaHSO3 受热,分子间脱水得 焦亚硫酸钠 2 NaHSO3 ——△ — Na2S2O5 + H2O
焦亚硫酸钠 ,也称一缩二亚硫 酸钠。
缩水时氧化数不变, Na2S2O5 中的 S 的氧化数仍为 IV。
由于 NaHSO3 受热易缩水, 故不可能用加热的方法从溶液中 制备 NaHSO3。
HSO3-—— H+ + SO32- K 2 = 6.2 10-8
(1) 氧化 - 还原性质
EAθ/V
SO42-
0.172
0.449
H2SO3
S
0.357
EBθ/V
SO42-
0.93 SO32
0.59
S
0.70
亚硫酸和亚硫酸盐 在溶液中和 空气中均易被氧化成 Na2SO4。
2 Na2SO3 + O2 —— 2 Na2SO4 I2 + H2SO3 + H2O —— H2SO4 + 2 HI
端基氧
桥氧
前者与 S 形成较强的键。
2. 硫酸的分子结构 H2SO4 分子中原子的键联关系如图。
H2SO4 中心的硫采取 sp3 不等性杂化 sp3
不等性杂化
其中单电子的 sp3 杂化轨道 与 -OH 中的氧成σ键;
有对电子的 sp3 杂化轨道向 氧原子配位,成 σ 配位键。
氧原子中 p 轨道的对电子反馈入 硫的 3d 空轨道,形成 d-p 配键
当这种无色有机物中的 S(IV) 被氧化剂作用掉时,有机色素的颜色 恢复。
这种漂白作用不同于漂白粉的氧 化漂白作用。
小结 H2SO3( SO2 ) 是既有 氧化性又具有还原性,但以还原性 为主的二元中强酸。
3. SO2 和 H2SO3 的制法 (1)还原法
可以采用还原高氧化态物质生成 S(IV),例如用金属还原浓硫酸
15. 7 硫的含氧化合物
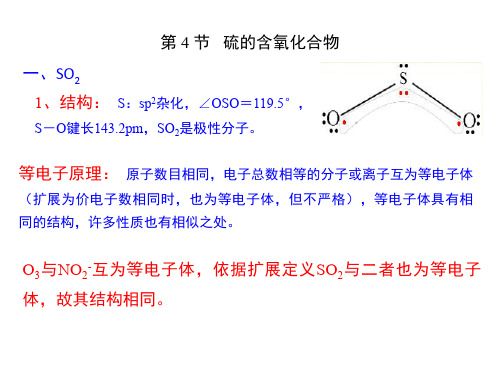
15. 7. 1 S(IV)的含氧化合物 1. SO2 的分子结构
SO2 的分子构型及成键情况 和 O3 相似。
SO2 分子中以硫原子为中心,两 个氧原子为配体。
价层电子总数 6 + 0 2 = 6
价层电子 3 对,价层电子对构型 为正三角形。
2 个配体,中心硫原子的杂化 方式为 sp2 不等性杂化。
0.93 SO32
0.59
S
0.70
从元素电势图上可看出,S(IV) 在酸、碱中均可歧化 。
3 H2SO3 —— 2 H2SO4 + S + H2O 4 Na2SO3 —— 3 Na2SO4 + Na2S
(2)漂白作用
SO2 溶于 H2O 后生成 H2SO3 , 它可以与有机色素加成为无色有机物, 因此有漂白作用。
故为
4
中心
6
电子大
键
6 4
。
6 4
使每个
分子和 三聚分子(SO3)3 两种形式存在。
(SO3)3 的键联关系如图
O
S
固体三氧化硫中,一种是三聚 体,一种是链状结构(SO3)n 。
O
S
在环三聚和链聚的两种结构
中,都至少有两种化学环境不同
的氧原子
2 H2SO4(浓)+ Zn —— SO2 + ZnSO4 + 2 H2O 2 H2SO4(浓)+ Cu —— SO2 + CuSO4 + 2 H2O
(2)氧化法 采用由低氧化态物质经氧化生 成 S(IV)价
① S + O2 —— SO2 ② 2 H2S + 3 O2 —— 2 SO2 + 2 H2O ③ 4 FeS2 + 11O2 —— 8 SO2 + 2 Fe2O3
一般认为脱水方式及焦亚硫酸 根的键联关系如下
另有研究工作表明,NaHSO3 溶 液中存在平衡
H — OSO2
H — SO3
并按如下方式脱水
15. 7. 2 S(VI)的含氧化合物
常见的 S(VI)的含氧化合物 主要有 SO3, SO3 溶于水形成的硫 酸 H2SO4,硫酸的衍生物,焦硫酸 及其盐。
(3)置换法 反应过程中 S 的氧化数不变 SO32- + 2 H+ —— SO2 + H2O
工业上制 SO2 ,天然硫矿多的 地方采用 (2)中的反应 ①。
在 FeS2 多的地方采用 (2)中 的反应 ③ 。
实验室制法多采用方法(3)。
另外用浓硫酸氧化单质硫,也 可以得到 SO2 2 H2SO4(浓)+ S —— SO2 + 2 H2O
表示成
。
2. SO2 和 H2SO3 的性质
SO2 无色,有刺激性气味; SO2 容易液化,沸点较高, -10℃ 左右。
SO2 分子有极性,1 体积 H2O 可溶 40 体积 SO2,得 H2SO3。
H2SO3 只存在于溶液中,至今 未制得 H2SO3 纯物质。
H2SO3 为二元中强酸
H2SO3 —— H+ + HSO3- K 1 = 1.3 10-2
且 S(IV)— S(0)的氧化性 比 S(VI)— S(0)要强些。
H2SO3 + 2 H2S —— 3 S + 3 H2O SO2 + 2 CO —铝—矾—土 S + 2 CO2 利用此反应,可在烟道气中回收硫。
EAθ/V
SO42-
0.172
0.449
H2SO3
S
0.357
EBθ/V
SO42-
