无机化学2017年南京航空航天大学硕士研究生考试真题
教育综合2017年南京航空航天大学硕士研究生考试真题

梦想不会辜负每一个努力的人
南京航空航天大学
2017年硕士研究生入学考试初试试题(A卷)科目代码:333
满分:150 分
科目名称:教育综合
注意:①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!
一、名词解释(共6题,每题5分,共30分)
1. 课程标准
2. 科举制度
3. 学习动机
4. 班级授课制
5. 最近发展区
6. 助产术(苏格拉底法)
二、简答题(共5题,可任选4题作答,每题10分,共40分)
1. 简述教育的基本要素
2. 简述教师劳动的特点
3. 简述学校德育的基本途径
4. 简述班集体的教育功能
5. 简述教学工作的基本环节
三、分析论述题(共5题,可任选4题作答,每题20分,共80分)
1. 论述建构主义学习理论的基本观点
2. 论述孔子因材施教思想及其教育影响
3. 结合经验,论述“理论联系实际”的教育教学原则
4. 结合经验论述教师的素养
5. 论述卢梭的自然教育思想
科目代码:010科目名称:教育综合第1页共1页。
2017年南京航空航天大学922研究生入学考试真题
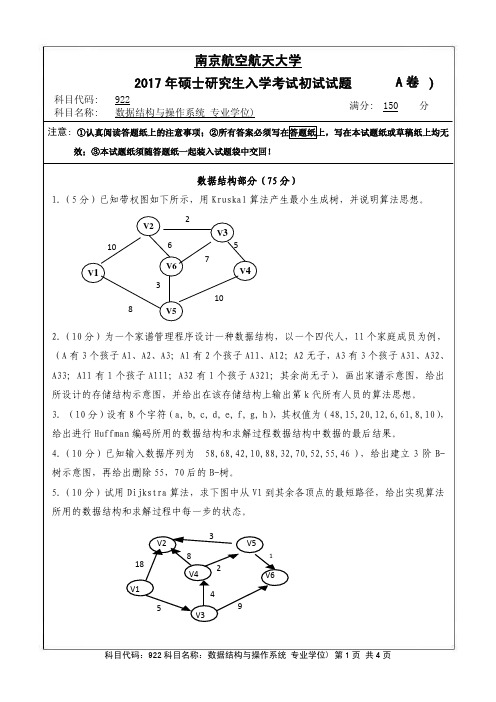
7. (9 分)一家四口人,儿子喜欢吃苹果,由父亲负责购买, 女儿喜欢吃橘子,由母亲负
责购买。父亲和母亲购买水果后放到家中的抽屉里,儿子和女儿从抽屉里取出水果。假设
抽屉只能容纳 20 个水果,同时只能一人开关, 用纪录型信号量同步父母子女四个进程。
科目代码:922 科目名称:数据结构与操作系统(专业学位) 第 4 页 共 4 页
(3).已经获得除( )以外的所有运行所需资源的进程处于就绪状态
A.存储器 B.打印机 C.CPU D.磁盘空间
(4).采用时间片轮转法调度是为了( )。
A.多个终端都能得到系统的及时响应 B.先来先服务
C.优先级较高的进程得到及时调度
D.需 CPU 最短的进程先做
(5).在一段时间内只允许一个进程访问的资源,称为( ) 。
A.初始化程序 B.原语 C.子程序 D.控制模块
科目代码:922 科目名称:数据结构与操作系统(专业学位) 第 2 页 共 4 页
(9). 在分段管理中( )。
A.以段为单位分配,每段是一个连续存储区 B.段与段之间必定不连续
C.段与段之间必定连续
D.每段是等长的
(10).通道是一种( )。
A.I/O 端口 B.数据通道 C.I/O 专用处理机 D.软件工具
5. (9 分)某分页系统,每个页面长为 1KB,某时刻该用户进程的页表如下:
页号
物理块号
是否在快表中
0
8
是
1
7
是
2
4
否
3
10
否
4
5
否
5
3
是
6
2
是
(1) 请写出分页系统的地址转换过程(3 分)
【2017南京航空航天大学考研真题】816专业课试卷
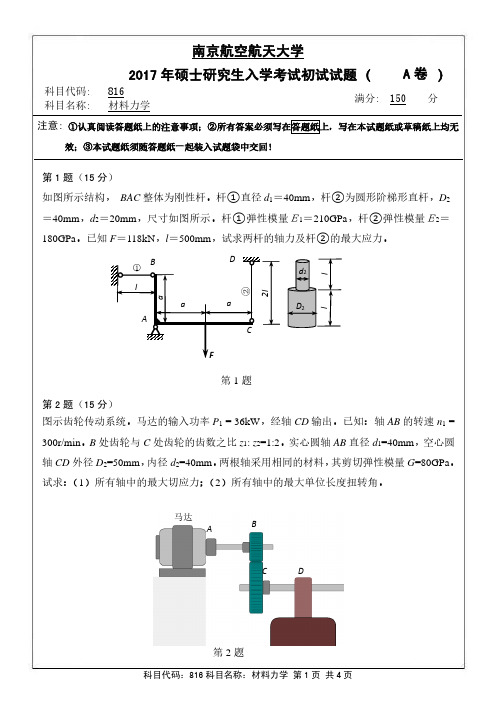
南京航空航天大学2017年硕士研究生入学考试初试试题(A 卷 )科目代码: 816满分: 150分科目名称:材料力学注意: ①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!第1题(15分)如图所示结构, BAC 整体为刚性杆。
杆①直径d 1=40mm ,杆②为圆形阶梯形直杆,D 2=40mm ,d 2=20mm ,尺寸如图所示。
杆①弹性模量E1=210GPa ,杆②弹性模量E2=180GPa 。
已知F =118kN ,l =500mm ,试求两杆的轴力及杆②的最大应力。
第1题 第2题(15分)图示齿轮传动系统。
马达的输入功率P 1 = 36kW ,经轴CD 输出。
已知:轴AB 的转速n 1 = 300r/min 。
B 处齿轮与C 处齿轮的齿数之比z 1: z 2=1:2。
实心圆轴AB 直径d 1=40mm ,空心圆轴CD 外径D 2=50mm ,内径d 2=40mm 。
两根轴采用相同的材料,其剪切弹性模量G =80GPa 。
试求:(1)所有轴中的最大切应力;(2)所有轴中的最大单位长度扭转角。
第2题马达ABC DAC①F2la aBl a②DllD 2d 2矩形截面梁的载荷和截面尺寸(单位:mm)如图所示。
材料的许用应力[σ]=160MPa ,[τ]= 50MPa 。
试:(1)求图示梁的剪力图和弯矩图;(2)校核其强度(考虑剪切强度)。
第3题第4题(20分)图示空心圆轴,外径R =20mm ,壁厚t =10mm ,长度l =0.8m ;AB 两端分别作用有集中力矩M e ,方向如图示。
已知:剪切模量G =77GPa ,泊松比μ = 0.3。
在表面某点C 放置一枚应变片,与表面纵线呈15o 角,加载后测得应变片的读数为 0.001。
求:所施加的力矩M e 。
15°M eCABltRM e第4题q =20kN/mABC3m1mz200yD1mF =100kN 10020kN ·m已知曲杆ABC 为圆截面杆。
物理化学2017年南京航空航天大学硕士研究生考试真题

南京航空航天大学2017年硕士研究生入学考试初试试题(A卷)科目代码:630满分:150 分科目名称:物理化学注意:①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!一、填空题(本题60分。
每空格1分)1.在理想气体模型中,分子间的相互作用力F、相互作用势能E都是_________的函数。
2.临界温度T c是气体能够液化所允许的__________(最高或者最低)温度,临界温度T c 时的饱和蒸气压称为__________。
3.今有20℃的乙烷和丁烷混合气体,充入体积为400 cm3的真空容器中,直至压力为101.325 kPa,测得混合气体的质量为0.7794 g,则乙烷的摩尔分数为__________,丁烷的摩尔分数为____________。
4.通常处理真实气体的pVT关系可用有一定物理模型的半经验方程,其中最具有代表的是___________方程,该方程中修正项分别代表___________和___________。
5.物理化学中按照系统内部物质变化的类型,将过程分为单纯pVT变化、____________和____________。
6.理想气体膨胀时,在恒温可逆过程中,系统对环境做功的绝对值比不可逆过程的要___________(大或小);气体被压缩时,在恒温可逆过程中,环境对系统做功比不可逆过程的要___________(大或小)。
7.节流膨胀是在____________条件下,气体的始末态压力分别保持恒定不变情况下的膨胀过程。
在室温和常压情况下,多数气体经过节流膨胀后产生____________(致冷效应或致热效应),而氢气等少数气体产生___________(致冷效应或致热效应)。
8.自发过程都是具有____________,都是热力学____________(可逆或不可逆)过程。
9.冬季利用热泵从室外273K的环境吸热,向室内291K的房间供热,若每分钟用100 kJ 的功开动热泵,则热泵每分钟向室内最多供热___________ kJ。
2015-2018年南京航空航天大学考研试题813无机化学

其原因是为了增大液体压力。 11. 在实验操作中,蒸发皿和启普发生器都可以用来加热液体。 12. 用 NaOH 标准溶液滴定 HCl 溶液至终点时,酚酞变红,放置一会后红色消失,原因是
溶液吸收了空气中的 CO2,碱性减弱。 13. 实验操作中,不慎把苯酚溅到手上,应立即用 70℃以上的热水冲洗。 14. 酸度计长期不用时,复合电极应如何保存 3mol/l KCl 溶液中。 15. 在符合朗伯一比尔定律的范围内,有色物质的浓度,最大吸收波长,吸光度三者的关系
H3PO4
的
K
θ a1
=
6.7 ×10−3
K
θ a2
=
6.2 ×10−8
K
θ a3
=
4.5 ×10−13
2. 某溶液中含 Cl-和 CrO42-,它们的浓度分别是 0.10 mol·L-1 和 0.0010 mol·L-1,通过计算证
明,逐滴加入 AgNO3 试剂,哪一种沉淀先析出。当第二种沉淀析出时,第一种离子是否被
南京航空航天大学
科目代码: 科目名称:
2015 年硕士研究生入学考试初试试题ď A 卷 Đ
813 无机化学
满分: 150 分
注意: ①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无
效;③本试题纸须随答题纸一起装入试题袋中交回!
一、填空题(20 分)
1. 按 试 剂 所 含 杂 质 的 多 少 , 我 国 通 用 试 剂 纯 度 的 等 级 标 准 分 为 四 级 , 分 别 为 优 质
纯、
、
、实验试剂。
2017年南京航空航天大学637研究生入学考试真题

1、信息源 2、知识地图 3、CIO 4、帕累托改进 5、信息福利 二、填空题:(每空 2 分,共 26 分。请将答案写在答题纸上。) 1、按信息载体划分,可以将信息资源分为 、缩微型、声像型和 信息资源。
2、根据世界知识产权组织统计,世界上每年发明创造成果信息的 90%-95%都能在 中 查到。
7、知识管理的主要流程包括知识生产、 、知识应用以及 。
8、 是指基于文学、艺术和科学作品依法产生的权利。
9、信息资源配置的基本原则包括:社会福利最大化原则、 原则、 原 则、市场手段和政府手段互补原则。
科目代码:637 科目名称:信息资源管理基础 第 1 页 共 2 页
三、简答题:(每题 8 分,共 64 分。请将答案写在答题纸上。) 1、请简述信息资源管理的主要手段。 2、数据挖掘系统具有哪些功能? 3、请简述信息系统的常见类型。 4、信息资源标准的内容主要包括哪两方面? 5、企业信息化的含义和基本任务是什么? 6、请阐述知识管理的主要内容。 7、请简述关于信息产品产权的制度安排的三种理论。 8、请简述四种信息资源质量的半定量评估方法。 四、论述题:(每题 20 分,共 40 分。请将答案写在答题纸上。) 1、请阐述信息采集的原则和策略并举例说明。 2、试论述在新的环境下信息资源管理技术方法发展的新趋势。
3、搜索引擎的结构主要包括搜索器、分析器、 、检索器、用户接口。
4、自动标引可分为 和自动赋词标引。
5、常见的信息系统开发方法主要有结构化系统开发方法、原型法、面向 的开发方法 以及计算机辅助开发方法等。
6、企业信息资源管理的发展过程可划分为文书管理阶段、 阶段、信息资 源管理阶段、商业竞争分析和竞争情报阶段、 阶段。
南京航空航天大学-2018年-硕士研究生入学考试初试试题(A卷)-813无机化学

科目代码:813科目名称:无机化学 第1页 共3页 南京航空航天大学 2018年硕士研究生入学考试初试试题( A 卷 ) 科目代码:813 满分: 150分 科目名称: 无机化学 注意: ①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!一、填空题(30分)1. 镧系与锕系元素水合离子的颜色是由________引起的。
2. 根据酸碱质子理论,HNO 3的共轭酸是 ,NH 2-的共轭碱是 。
3. 硫的同素异形体中,室温稳定态是________,每个硫原子以________杂化轨道成键。
4. 按离子极化作用大小排列 FeCl 3,FeCl 2,KCl ,CaCl 2____________________________。
5. 既可以用来鉴定Fe 3+,也可以用来鉴定Co 2+的试剂是________,既可以用来鉴定Fe 3+,也可以用来鉴定Cu 2+的试剂是________。
6. 在配离子[Fe(CN)6]3-中,中心离子以d 2sp 3杂化与配体形成配位键,那么配离子的空间构型为 。
7. 溶液与沉淀分离的方法常用 、 、 。
8. 化学元素中,第一电离能最小的是 ,最大的是 。
9. 已知反应 2N 2O 5(g) 4NO 2(g)+ O 2(g)的m r H ∆﹤0,则增加总压反应速率_____,平衡移动方向________,升高温度反应速率_____。
(填增大或减小;正向或逆向)10. 在ⅢA--Ⅴ A 各族中,第四到第六周期元素最高氧化态氧化物的水合物,酸性最强的是________,碱性最强的是________。
11. 白色的NH 4VO 3加热后变成棕色,是因为生成了 。
12. 金在王水中溶解的反应方程式为 。
13. 第81号元素的离子在水中较稳定的氧化态是 ,原因是 。
14. 320o C 下,一级反应)()()(2222g Cl g SO g Cl SO +→的半衰期为s 4105.4⨯,则16.2 h 后,剩余的SO 2Cl 2的质量分数是 。
[化学]南航无机化学考研真题4
![[化学]南航无机化学考研真题4](https://img.taocdn.com/s3/m/bec21d3ea8114431b90dd8f6.png)
大,A-B间成键电子对偏向A,从而
增大成键电子间的斥力,使其键角增 大。如:SbH3;AsH3;PH3;NH3为 91.3º ;91.8º ;93.3º ;107.3º
例1:在下列多对分子中,哪个分子 键角大?说明原因:
(1)HgCl2和BCl3
(2)CF4和PF3
(3) SiF4和SF6
(4)SnCl2和SCl2
二、键长 分子中成键原子和核间的平均距离 称为键长(也称为核间距)。在两个 确定原子之间,键长越短,则键越强 越牢固。 三、键角 1、分子中相邻两键之间的夹角称为 键角。键角是决定分子空间构型的主 要因素。
2、影响键角因素 (1)中心原子杂化类型: sp;sp2;sp3 ;sp3d2 等之间:180º ;120º ;109.5º ; 90º (2)中心原子孤对电子数:孤对越多, 键角越小 如sp3杂化CH4;NH3; OH2 键角依次为 :109.5º ;107.3º ; 104.5º (3)多重键 多重键所包含的电子越 多,斥力比单键大,使得分子内含多重键 的键角变大,单键间的键角变小,例如sp2 F 126 杂化的COF2: 108 C O
三、应用:
1. 增加化合物的稳定性
2. 例: O3 ( π34 ) ; CO2 ( 2 个 π34 ) ;
NO2(π33); NO3-(π46); CO32-(π46
)等.
1-6 等电子体原理
一、 概念:具有相同的通式AXm, 而且价电子总数相等的分子或离子具
有相同的结构特征(包括分子的立体
构型、化学键类型),这个原理称为 “等电子体原理”
C.H2S
3、比较NaCl、MgO、CuO、BaO, 哪一种离子晶体的熔点最高?
4、填空:阳离子的极化能力与 有关, 电荷越高,极化作用越 ,半径越大,极 化作用越 。半径越大,阳离子的变形性 越 ,阳离子电子构型以 和 变形性最 大, 次之,最差的为 。阴离子极化和 变形性对简单离子来说和阳离子类似,复 杂阴离子的变形性在电荷相等时,半径越 大则变形性越 ,相对复杂的阴离子变 形性较 ,中心原子氧化数越高,则整 个阴离子变形性越 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
南京航空航天大学
2017年硕士研究生入学考试初试试题(A卷)科目代码:813
满分:150 分
科目名称:无机化学
注意:①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!
一、判断题(填写√或╳,20分)
1. 隔离系统的热力学能恒定不变。
()
2. 温度不变时,系统既不吸热也不放热。
()
3. 冰在室温下自动溶化成水,是熵增起了主要作用。
()
4. H2S溶液中,c(H+) = 2 c(s2-) ()
5. 在氧化还原反应中,若两个电对的θE值相关越大,则反应进行得越快。
()
6. 共价键的键长等于成键原子共价半径之和。
()
7. 离子晶体具有脆性,是由于阳离子和阴离子交替排列,不能错位的缘故。
()
8. I-可被F e3+氧化,但加入F-后就不被Fe3+氧化。
()
9. 用浓氨水可检测氯气管道是否漏气。
()
10. 加热CuCl2・2H2O时得不到无水的CuCl2。
()
11. 焊接金属时,常用浓ZnCl2溶液处理金属表面。
()
12. 镧系元素的原子核都是稳定的,锕系都是放射性的。
()
13. 日常生活中,衣服上沾的铁锈可用高锰酸钾清洗。
()
14. Cr2(SO4)3和Na2S溶液反应的主要产物是Cr(OH)3和H2S。
()
15. 氨和空气的混合物在800 o C下通过铂铑丝网后,其主要产物为NO2。
()
16. 溶液与沉淀分离的方法常用过滤法、离心分离法、蒸发法。
()
17. 实验室常用的干燥剂变色硅胶失效后呈现红色。
()
18. 白色的NH4VO3加热后变成棕色,是因为生成了V2O5。
()
19. PCl4+的空间构型是正八面体。
()
20. Fe(OH)3、Al(OH)3、Cr(OH)3均是难溶的氢氧化物,分离它们必须利用它们的溶解性和氧化还原性。
()
二、填空题(20分)
1. 滴定时如酸溶液滴在锥形瓶内壁上,应用少量蒸馏水把酸溶液洗下,否则会导致实验结果 。
(填写偏高或偏低)
2. 碘化物溶液中加入氯水和CCl 4,经振荡后溶液颜色变为 色。
3. 在BN(立方),FeCo ,LiH ,BBr 3 四个晶体中,熔点最低的是 。
4. 用电对MnO 4-/Mn 2+,Cl 2/Cl -组成的原电池,其正极反应为 ,负极反应为 ,电池的电动势等于 ,电池符号为 。
(E θ(MnO 4-/Mn 2+)=1.51 V ,E θ(Cl 2/Cl -)=1.36 V )。
5. 锗、锡所呈现的化合价是四价比二价稳定,而铅所呈现的化合价则相反,二价比四价 。
(填写稳定或不稳定)
6. 六氰合铁(III )酸钾的化学式 ,该配合物中心离子为 ,配位体为 ,配位原子为 ,配位数为 。
7. 既可以用来鉴定Fe 3+,也可以用来鉴定Co 2+的试剂是________,既可以用来鉴定Fe 3+,也可以用来鉴定Cu 2+的试剂是________。
8. 在饱和的Hg 2(NO 3)溶液中,逐滴加入浓HCl ,开始有 色的 生成,继续加浓HCl 有 和 生成。
9. O 2的分子轨道排布式为 。
三、计算题(20分)
1. 铅酸蓄电池的电极反应为
负极:44b()(aq)()()2P s HSO PbSO s H aq e -+-−−→+++←−−
正极:2
244bO ()aq 3()2()2(l)P s HSO H aq e PbSO s H O -+-−−→++++←−−() (1) 计算铅蓄电池的标准电动势MF E θ.
(2) 如果将6个铅酸电池串联在一起,其总电动势为多少?
(3) 充电的电极反应如何?写出相应的反应方程式。
(4) 在使用过程中,可用测定硫酸密度的方法确定铅蓄电池是否需要充电,这是什么道理?充电时,需要新的浓度大的硫酸代替电池中的稀硫酸吗?为什么?
已知:222b /0.1266,(/) 1.458E P Pb V E PbO Pb V θθ++=-=()
824224() 1.810,() 1.010sp a K PbSO K H SO θθ--=⨯=⨯
2. 水杨酸(邻羟基苯甲酸)C 7H 4O 3H 2是二元弱酸。
25℃下,311006.1-⨯=θa K ,14210
6.3-⨯=θa K 。
有时可用它作为止痛药而代替阿司匹林(As-pirin),但它有较强的酸性,能引起胃出血。
计算0.065 mol·L 的C 7H 4O 3H 2溶液中平衡时各个物种的浓度和pH 值。
3. 某溶液里面含有Pb 2+和Zn 2+,两者的溶度均为0.1 mol·L -1,在室温下通入H 2S(g)使之成为饱和溶液,并加HCl 控制S 2-浓度。
为了使PbS 沉淀出来,而Zn 2+仍留在溶液中,则溶液中的H +浓度最低应是多少?此时溶液中的Pb 2+是否被沉淀完全?
已知θspa K (ZnS) = 2×10-2, θspa K (PbS)=3×
10-7
4. 反应2211()()()22
Cl g F g ClF g −−→+←−−,在298K 和398K 下,测得其标准平衡常数分别为9.3 ⨯ 109 和3.3 ⨯107。
(1)计算(298)r m G K θ∆;
(2)若298K~398K 范围内r m H θ∆,r m S θ∆基本不变,计算r m H θ∆、r m S θ∆
5. 当T 为298K 时,反应2N 2O(g)→2N 2(g)+O 2(g),164.1/r m H kJ mol θ∆=-,
240/Ea kJ mol =。
该反应可被氯气催化,催化反应 140/Ea kJ mol =,催化后反应的速率提高了多少倍?催化反应的逆反应活化能是多少?
四、根据题意回答问题(90分)
1. 那些因素影响化学反应速率?它们将如何影响?
2. 怎样由各基元反应求得复杂反应的总速率方程?
3. 举例说明下列概念有何区别,
(1)极性键和极性分子
(2)σ键和π键
4.原子为什么能发光?为什么说原子光谱是研究原子核外电子运动状态的实验基础?
5. 评论下列各种陈述:
(1)放热反应是自发的;
(2)根据ΔH=Qp ,由于H 是状态函数,所以Qp 也是状态函数。
6.试解释为什么室温下CCl4是液体,CH4及CF4是气体,CI4是固体?
7. 金属钠和镁条在空气中燃烧,把生成物均溶于水后得到的产物是否相同,如何鉴别?写出有关的反应方程式。
8. 试举例说明溶解沉淀的化学方法及原理
9. 有一无色晶体A,加入水中有白色沉淀B生成,过滤后,用pH试纸检查,发现滤液呈酸性,往其中加AgNO3溶液和稀硝酸,有白色沉淀C生成,B溶于盐酸,得无色透明A溶液,向其通入饱和H2S溶液,生成橙色沉淀D,离心分离出D后,将其分成四份,第一份加NaOH 溶液,沉淀溶解生成E与F的混合溶液,第二份加入Na2S溶液,沉淀溶解得F溶液,第三份中加入HCl沉淀溶解得G溶液。
并放出有臭蛋臭的气体H,第四份加多硫化胺,沉淀溶解,生成无色溶液I,向I溶液中加HCl,则析出橙色沉淀D,并产生气体H。
试指出A、B、C、D、E、F、G、H、I各为何物质。
