巴氏染色步骤
巴氏染色 ppt课件

简易EA染色结果
细胞核:呈蓝色
基底层、中层、表层角化前细胞质: 蓝绿色
表层细胞质:红色
挖空细胞辨认清晰
念珠细菌:紫红色 滴虫细胞质:浅绿色、细胞核深蓝 色 阴道杆菌:紫蓝色。
简易巴氏染色注意事项
固定:用95%酒精固定液固定的细胞学标本一定 使用湿固定法。制片制备完后,趁标本新鲜而又 湿润时,立即放入盛有95 %酒精的固定缸内。制 片在固定液内至少保持15-30min 。 湿固定的重要性:标本在新鲜时及时固定是保证 染色效果的重要因素。如苏木素对细胞核的染色, 巴氏染色中胞浆的特殊着色作用,均可因标本干 燥后固定而大受影响 。
氨基酸结构通式
氨基酸三维结构
巴氏染液原理
苏木素染色原理:苏木素是碱性染料,能与细胞核内的主 要化学成分脱氧核糖核酸结合而呈紫蓝色。
苏木素结构
墨水树
巴氏染液原理
桔黄G:是一种小分子染料,能够很快地作用于胞浆。
作用:使宫颈、阴道上皮中非正常角化细胞和角化型鳞癌 细胞的胞浆呈鲜艳的橘黄色。
桔黄G
简易巴氏染色步骤?将刚离心好的tct玻片放入95的酒精15min以上此步骤为湿固定tct玻片不能用吹风机吹干?70酒精15s?50酒精15s?自来水水洗?苏木素染色?1盐酸分化?05氨水蓝化?自来水洗?02磷钨酸水溶液1min?简易ea工作液5min?95酒精清洗?100酒精清洗简易巴氏染色?简易ea染色液的配置
精子形态学染色液(巴氏法)
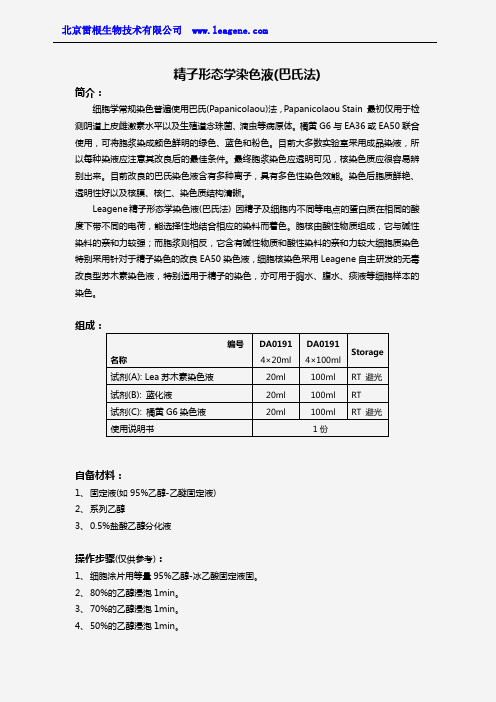
精子形态学染色液(巴氏法)简介:细胞学常规染色普遍使用巴氏(Papanicolaou)法,Papanicolaou Stain 最初仅用于检测阴道上皮雌激素水平以及生殖道念珠菌、滴虫等病原体。
橘黄G6与EA36或EA50联合使用,可将胞浆染成颜色鲜明的绿色、蓝色和粉色。
目前大多数实验室采用成品染液,所以每种染液应注意其改良后的最佳条件。
最终胞浆染色应透明可见,核染色质应很容易辨别出来。
目前改良的巴氏染色液含有多种离子,具有多色性染色效能。
染色后胞质鲜艳、透明性好以及核膜、核仁、染色质结构清晰。
Leagene 精子形态学染色液(巴氏法) 因精子及细胞内不同等电点的蛋白质在相同的酸度下带不同的电荷,能选择性地结合相应的染料而着色。
胞核由酸性物质组成,它与碱性染料的亲和力较强;而胞浆则相反,它含有碱性物质和酸性染料的亲和力较大细胞质染色特别采用针对于精子染色的改良EA50染色液,细胞核染色采用Leagene 自主研发的无毒改良型苏木素染色液,特别适用于精子的染色,亦可用于胸水、腹水、痰液等细胞样本的染色。
组成:自备材料:1、 固定液(如95%乙醇-乙醚固定液)2、 系列乙醇3、 0.5%盐酸乙醇分化液操作步骤(仅供参考):1、 细胞涂片用等量95%乙醇-冰乙酸固定液固。
2、 80%的乙醇浸泡1min 。
3、 70%的乙醇浸泡1min 。
4、 50%的乙醇浸泡1min 。
编号 名称DA0191 4×20ml DA0191 4×100ml Storage 试剂(A): Lea 苏木素染色液 20ml 100ml RT 避光 试剂(B): 蓝化液20ml 100ml RT 试剂(C): 橘黄G6染色液 20ml100ml RT 避光使用说明书1份5、 蒸馏水或自来水浸泡或冲洗。
6、Lea 苏木素染色液染色。
7、自来水冲洗。
8、盐酸乙醇分化液分化或盐酸水溶液分化。
9、自来水冲洗。
10、蓝化液中蓝化4min 。
巴氏染色原理

巴氏染色原理
巴氏染色原理是由德国微生物学家巴氏(F. Loeffler)和日本细菌学家小野寺(K. Kitasato)于1884年共同提出的。
该原理是指用一种特定的染色方法,可以
将细菌染色成蓝色或紫色,而其他组织则保持无色或染成红色。
这种染色方法在细菌学和病原微生物学研究中得到了广泛的应用。
巴氏染色原理的核心是利用染色剂与细菌细胞壁的特定化学成分之间的亲和作用,通过染色剂的作用,使细菌细胞壁吸附染色剂,从而使细菌呈现出特定的颜色。
这种染色方法的原理简单,操作方便,且染色效果稳定,因此被广泛应用于细菌学实验室中。
巴氏染色原理的具体步骤包括,将细菌涂片加热固定,然后用甲苯或其他溶剂
处理,使细菌细胞壁透明,接着用染色剂如甲基蓝或结晶紫染色,最后用水洗去余染色剂,晾干即可观察。
通过这种染色方法,可以清晰地观察到细菌的形态、结构和分布情况。
巴氏染色原理的应用不仅局限于细菌学领域,还广泛应用于医学临床诊断中。
通过染色技术,医生可以观察到患者体液或组织中的细菌、病毒等微生物,从而进行疾病的诊断和治疗。
比如在结核病的诊断中,巴氏染色方法可以帮助医生观察到结核杆菌的存在,从而进行准确的诊断。
总的来说,巴氏染色原理是一种简单而有效的细胞染色方法,通过对细菌细胞
壁的特定化学成分的染色作用,使细菌呈现出特定的颜色,从而方便观察和研究。
这种染色方法在细菌学和医学领域都有着重要的应用,对于微生物学研究和临床诊断都具有重要意义。
巴氏染色原理

巴氏染色原理
巴氏染色原理是一种用于细胞核的染色方法,由德国科学家巴氏于1882年首次提出。
该方法通过染色剂与细胞核中的染色质结合,使其显现出不同的颜色,从而帮助科研人员观察和研究细胞核的结构和功能。
巴氏染色原理在生物学、医学和生物技术领域具有重要的应用价值。
巴氏染色原理的基本步骤包括固定、染色和洗涤。
首先是固定,即利用甲醛等化学物质使细胞固定在载玻片上,保持其形态和结构不变。
接着是染色,通过染色剂如甲苯胺蓝、伊红等与细胞核中的染色质结合,使其显现出特定的颜色。
最后是洗涤,将载玻片在适当的溶液中洗涤,去除多余的染色剂,使细胞核清晰可见。
巴氏染色原理的应用范围非常广泛。
在医学领域,巴氏染色原理被用于研究疾病的发病机制和病理变化,如癌症细胞的形态学特征和染色体异常。
在生物技术领域,巴氏染色原理被应用于基因工程和细胞工程中,帮助科研人员观察和分析基因的表达和调控。
在生物学领域,巴氏染色原理被用于研究细胞核的结构和功能,如染色体的形态和数量。
巴氏染色原理的优点在于操作简便、成本低廉、结果清晰可见。
然而,也存在着一些局限性,如染色效果受到固定和染色条件的影响,染色质与其他细胞结构的区分度不高等。
总的来说,巴氏染色原理作为一种重要的细胞核染色方法,在生物学、医学和生物技术领域具有重要的应用价值。
随着科学技术的不断进步,相信巴氏染色原理将会在更多领域得到广泛应用,为人类健康和科学研究做出更大的贡献。
巴氏染色原理

巴氏染色原理
巴氏染色原理是一种常用的细胞染色技术,用来对细胞或组织进行染色。
该原理是基于酚醛固定的原理,通过将细胞或组织固定在玻片上,然后处理它们使得它们能够与染料发生反应。
巴氏染色的步骤如下:
1. 固定:将细胞或组织浸泡在酚醛液中,使其固定在玻片上。
酚醛能够保持细胞或组织的形状和某些结构的完整性。
2. 脱水:通过将样本逐渐浸泡在濃度递增的酒精溶液中,使其逐渐失去水分。
这样做是为了减少细胞或组织内的水分,以便尽可能地提高染料对细胞或组织的亲和力。
3. 渗透:将细胞或组织浸泡在骨胶液中,使其充分浸润。
骨胶液能够渗透到细胞或组织的内部,使得染料更容易地与它们发生反应。
4. 染色:将染料溶液滴在样本上,使其与细胞或组织结合。
染料能够结合到不同的细胞或组织结构中,从而显示出不同的颜色或形态。
5. 清洗:将多余的染料以及其他杂质通过浸泡在去离子水中进行清洗。
这样可以让染色的结果更加清晰。
6. 封片:在玻片上涂上封片剂,以保护样本并固定染料。
这样可以使染色的结果保持较长时间。
通过巴氏染色原理,我们可以对细胞或组织进行染色,并观察它们的结构,从而得到更多关于它们的信息。
这种染色方法在细胞学和组织学研究中广泛应用,为我们研究生物体内部的结构和功能提供了重要的工具。
巴氏染液SOP
1.目的用于测定人类精子形态。
2.范围适用于男性精子畸形率测定。
3.原理细胞中的细胞核是由酸性物质组成,它与碱性染料的亲和力较强;而细胞浆则相反,它含有碱性物质和酸性染料的亲和力较大。
巴氏染色液利用这一特性对细胞进行多色性染色,细胞经染色后能清晰地显示细胞的结构,胞质透亮鲜丽,各种颗粒分明,细胞核染色质非常清楚,从而较容易发现异常细胞。
通过巴氏染色可反映出细胞在炎症刺激下和癌变后的形态学变化,对早期发现和诊断一些病变和肿瘤具有较重要意义。
4.试剂4.1本试剂由珠海贝索生物技术有限公司提供【医疗器械生产企业许可证编号】粤食药监械生产许20010407号【医疗器械注册证书编号】粤珠食药监械(准)字2013第1400001号【产品标准编号】YZB/粤珠0010-2013【说明书批准日期】2013年1月23日4.2试剂盒组成应避免不同批次试剂盒中的各组分混用(型号EA36、EA50) 试剂组成规格 主要成分 苏木素(Harris )染液1vial ×250ml 苏木素 橘黄G 染液1vial ×250ml 橘黄G EA36染液或EA50染液1vial ×250ml 亮绿、曙红 4.3试剂储存及效期:4.3.1有效期:未开封试剂有效期为18个月,其中EA36染液,EA50染液最佳使用时间为启用后5个月内。
4.3.2储存条件:本试剂盒应贮存于相对湿度不大于80%,无腐蚀性气体和通风良好的5O C-30O C 室温环境。
题目:精子形态学巴氏染色标准操作规程 编号:JY-3-GC- 文件检审: 页数:3附件:0 发布部门:质量管理科首次发布日期:2015-08-01 版本号:02本版发布日期:2015-08-01拟定部门:检验科审核:分管院长批准:院长5.实验设备及材料5.1奥林巴斯CX31显微镜5.2精密移液器规格:5-50μl和200-1000μl5.3载玻片5.4生理盐水、盐酸5.5移液器吸头5.6酒精5.7染缸6.样本6.1采集方法:以手淫法采集禁欲2-7天精液于采样杯,注意收集完全。
什么是巴氏染色巴氏染色的操作方法

什么是巴氏染色巴氏染色的操作方法巴氏染色有4个步骤,分别是固定、核染色、胞浆染色和透明,那么你对巴氏染色了解多少呢?以下是由店铺整理关于什么是巴氏染色的内容,希望大家喜欢!巴氏染色的操作方法及注意事项染色有4个步骤:1、固定;2、核染色;3、胞浆染色;4、透明。
主要达到以下要求:1、核的结构清晰;2、透明度高;3、分色恰当。
固定固定的目的细胞制片的迅速固定是制片过程中关键的一步,否则会影响细胞学诊断的准确性。
对于不同的标本需要不同的固定方法。
最为常用的固定方法是95%酒精作为固定液的湿固定法。
酒精作为一种脱水剂能够防止细胞内的酶捋蛋白质分解而自容,并凝固细胞内的物质如蛋白质、脂肪和糖类等,使其保持与组织生活相仿的成分,从而使细胞各部分,尤其核染色质易于着色。
对于巴氏染色来说,酒精固定最为重要的。
如果酒精浓度不足引起的固定不佳,可造成细胞的人为变化,并可导致假阳性或假阴性的诊断。
1、固定方法湿固定法:作为用95%酒精固定液固定的细胞学标本一定使用湿固定法。
制片制备完后,趁标本新鲜而又湿润时,立即放入盛有95%酒精的固定缸内。
制片在固定液内至少保持15-30min。
固定时间通常不超过1周。
这种制片染色后,颜色鲜艳,结构清晰。
如果细胞制片需要送至另一实验室或邮寄他处染色时,可以固定15min后,把制片取出后立即密封的容器中或者使用甘油防止制片干燥。
因为无论固定前或固定后的制片,如果发生干燥后都会影响染色的效果。
2、固定注意事项固定液的过滤:为了防止细胞污染,凡是使用过的固定液,必须过滤后才能再使用。
使用过长的固定液,必须用酒精相对密度计测定,酒精浓度低于90%时应该及时更换新液。
湿固定的重要性:标本再新鲜时及时固定时保证染色效果的重要因素。
如苏木素对细胞核的染色,巴氏染色中胞浆的特殊着色作用,均可因标本干燥后固定而大受影响。
制片标本的邮寄:标本再固定15min后取出,立即加甘油数滴于制片上,装入密封的小盒中。
巴氏染色原理

巴氏染色原理巴氏染色原理是指在细胞学领域中,用来染色和观察细胞的一种特殊方法。
它是由德国生物学家巴氏发明的,因此得名。
巴氏染色原理在生物学研究中有着广泛的应用,尤其在细胞形态学和细胞遗传学研究中起着重要作用。
巴氏染色原理的基本原理是利用染色剂与细胞内的某些结构或成分发生特异性的化学结合,从而使这些结构或成分在显微镜下显现出不同的颜色和形态。
这种染色方法可以使细胞的各种结构和器官清晰可见,有利于观察和研究细胞的形态、结构和功能。
巴氏染色原理主要包括以下几个步骤,固定、染色、脱水、透明和封片。
首先是固定,即将待观察的细胞或组织用适当的方法固定在载玻片上,使其保持原有形态和结构。
然后是染色,利用染色剂对细胞进行染色,使细胞内的各种结构和器官显现出不同的颜色。
接着是脱水,将染色后的载玻片在酒精中逐渐脱水,使细胞内的水分逐渐被酒精取代。
然后是透明,将脱水后的载玻片在透明介质中浸泡,使细胞透明。
最后是封片,将载玻片用封片剂封好,以便长期保存和观察。
巴氏染色原理在细胞学和遗传学研究中有着重要的应用价值。
通过巴氏染色,可以观察和研究细胞的形态和结构,了解细胞的功能和代谢过程,揭示细胞的生理和生化特性。
同时,巴氏染色还可以用于观察染色体的形态和数量,研究细胞的遗传性状和变异规律,为遗传学研究提供重要依据。
除了在科学研究中的应用,巴氏染色原理还在医学诊断和临床治疗中有着重要的作用。
通过对患者组织和细胞的染色观察,可以帮助医生诊断疾病,判断病情和预后,指导临床治疗和药物选择。
总之,巴氏染色原理作为一种重要的细胞学染色方法,在生物学研究、医学诊断和临床治疗中发挥着重要的作用。
它为科学家研究细胞的形态和结构,揭示细胞的功能和遗传规律提供了重要工具,也为医生诊断疾病、指导治疗提供了重要依据。
巴氏染色原理的发展和应用将进一步推动细胞学和遗传学领域的发展,促进人类健康和生命科学的进步。
细胞涂片染色分析

细胞涂片染色分析学习细胞学时,对常规的技术环节曾作了大致总结,请指正:染色不良原因分析细胞涂片常规巴氏染色步骤及原理:具体步骤:1、涂片投入95%酒精固定液固定15分钟。
目的:细胞及胞内物质形态稳定(由半液态变为半固态),易于染色。
原因:固态比液态(流动性)更具稳定性,着色更迅速,染色效果也更稳定。
2、水洗用浓度由高到低的梯度酒精入水或直接自来水漂洗。
目的:脱醇—置换出细胞内酒精,以便使水溶性苏木素进入。
3、苏木(水溶液)染核时间灵活掌握,根据镜下观察染色效果确定。
4、水洗洗去过多残留苏木染液,5、碱水(饱和碳酸锂)返蓝目的:使苏木色精进一步形成,且使胞浆偏碱性,以便更好的与酸性染料结合。
6、水洗去多余碱水。
7、脱水用浓度由低到高的梯度酒精或直接由水进入95%酒精。
8、橘黄和EA(O—E染色)染胞浆操作:每次染后进入95% 酒精漂净多余染液,以保证不影响下一步。
9、无水酒精脱水——二甲苯透明——树胶封固。
可能出现误差的步骤:1、固定时间要求是:大于15 分钟,小于48小时。
如果制完片后马上进入水洗染色,固定效果必然欠佳。
2、水洗脱醇应保证足够的时间和换水次数,否则脱醇不彻底,会干扰水溶性苏木素进入细胞内进行染色反应。
3、苏木素的染色效果与本身的浓度、纯度,染色反应的速度直接相关。
此外,染色速度还受温度影响(温度越高,染色速度越快,效果越好)。
所以:本步骤注意事项为:苏木素的质量——每日过滤并加新液;天气温度(室温)的变化——调整时间,温高则时间短,温度低则时间长,皆以镜下观察的效果为准灵活掌握。
4、碱水返蓝:为水溶液,其浓度和纯度都会影响返蓝效果。
如果碱水使用时间过长,未及时更换,其浓度、纯度必然下降。
为加快速度或工作时间调整,玻片放入碱水中的时间常常偏长或偏短。
偏短——苏木色精形成不充分;偏长——涂片在水溶液中浸泡过久会影响细胞固定效果,从而影响染色效果。
以至于影响苏木素的显色效果和下一步胞浆染色效果。
巴氏染色的操作方法

巴氏染色的操作方法染色有4个步骤:1、固定;2、核染色;3、胞浆染色;4、透明。
主要满足以下要求:1。
核结构清晰;2.高透明度;3.适当的分色。
一、固定1、固定的目的细胞制备的快速固定是制备过程中的关键步骤,否则会影响细胞学诊断的准确性。
不同的标本需要不同的固定方法。
最常用的固定方法是以95%乙醇为固定液的湿固定法。
酒精作为一种脱水剂,可以防止细胞内的酶分解蛋白质和自足物质,并固化细胞内的蛋白质、脂肪和糖等物质,从而维持与组织生命相似的成分,从而使细胞的所有部分,尤其是核染色质,易于染色。
酒精固定对Pap染色最重要。
酒精浓度不足导致的固着不良可导致细胞的人为变化,并导致假阳性或假阴性诊断。
2.固定方法湿固定法:作为用95%酒精固定液固定的细胞学标本一定使用湿固定法。
制片制备完后,趁标本新鲜而又湿润时,立即放入盛有95%酒精的固定缸内。
制片在固定液内至少保持15-30min。
固定时间通常不超过1周。
这种制片染色后,颜色鲜艳,结构清晰。
如果细胞制剂需要送到另一个实验室或邮寄到其他地方进行染色,可以固定15分钟,取出制剂后立即放入密封容器中,或使用甘油防止制剂干燥。
因为无论固色前后,干燥都会影响染色效果。
3.固定注意事项固定液的过滤:为了防止细胞污染,凡是使用过的固定液,必须过滤后才能再使用。
使用过长的固定液,必须用酒精相对密度计测定,酒精浓度低于90%时应该及时更换新液。
湿固色的重要性:当试样再次新鲜时,及时固色是确保染色效果的重要因素。
例如,苏木精在细胞核上的染色,以及巴氏杀菌染色中细胞质的特殊染色效果,都会受到干燥后样本固定的极大影响。
制片标本的邮寄:标本再固定15min后取出,立即加甘油数滴于制片上,装入密封的小盒中。
实验室在收到标本后,先浸入95%酒精中,使甘油溶去,再进行染色。
二、核染色1.苏木精溶液的浸泡时间一般为3-5分钟,但必须根据气体温度和染色条件进行更改。
苏木精染料溶液在夏季放置时间较长或容易染色,且时间应缩短;冬季,新配制的苏木精染色液和长期使用的稀释苏木精溶液不易染色,应延长染色时间。
巴氏染色原理及操作步骤

巴氏染色原理及操作步骤巴氏染色法就是脱落细胞染色中最好得染色方法.苏木素染液,细胞核内得染色质主要就是去氧核糖核酸(DNA,DNA得双螺旋结构中,两条链上得磷酸基向外,带负电荷,呈酸性,很容易与带正电荷得苏木素精碱性染料以离子或氢键结合而被染色。
苏木精在碱性溶液中呈蓝色,所以细胞核被染成蓝色。
分化:苏木素染色之后,用水洗去未结合在细胞上得染液,但就是在细胞核中结合过多得染料与细胞浆中吸附得染料必须用分化液 1 %盐酸酒精脱去,才能保证细胞核与细胞浆染色得分明,把这个过程称为染色得分化作用.因酸能破坏苏木素得醌型结构,使色素与组织解离,分化不可过度。
蓝化:分化之后苏木素在酸性条件下处于红色离子状态,在碱性条件下处于蓝色离子状态,而呈蓝色,所以分化之后用水洗去酸而中止分化,再用弱碱性水使苏木精染上得细胞核变呈蓝色,称蓝化作用,一般多用自来水浸洗即可变蓝,也可用温水(50度温水最佳)变蓝。
E A50 染液得酸碱度对于巴氏染色得成功起着关键作用,EA50染液由伊红、亮绿、等染料配成。
伊红、亮绿、橘黄等属于酸性染料,在溶解媒中其发色团就是负离子部分,发色团可与蛋白质中带正电得氨基结合,从而就是胞浆显蓝色、绿色、橘黄色或红色,但蛋白质所带正负电荷得多少就是随溶液得PH值而改变得,在偏碱环境中,蛋白质得羧基游离增多(带负电),在偏酸环境中蛋白质氨基游离增多(带正电),磷钨酸在染色过程中,不但作为媒染剂可增加染料得着色力,同时磷钨酸与碳酸锂还就是一对弱酸弱碱,实际上就是一对缓冲剂,可中与分化及蓝化时可能留下得少量酸或碱,保证染色达到理想效果,其适用于上皮细胞及间皮组织得标本,就是阴道脱落细胞检查中最常用得染色方法,该染色法不但具有显示细胞核结构清晰、分色明显、透明度好、胞浆受色鲜艳等特点•巴氏染色法将胞核染为深蓝色;鳞状上皮底层、中层及表层角化前细胞胞质染绿色,表层不全角化细胞胞质染粉红色,完全角化细胞胞质呈桔黄色;细菌:灰色;滴虫:淡蓝灰色;黏液:淡蓝色或粉红色;中性粒细胞与淋巴细胞、吞噬细胞胞质均为蓝色;红细胞染粉红色;高分化鳞癌细胞可染成粉红色或桔黄色;腺癌胞质呈灰蓝色。
巴氏染液说明书

巴氏染液说明书全文共四篇示例,供读者参考第一篇示例:巴氏染液是一种用于细菌染色的染液,它是由德国微生物学家巴尔特洛米·奥古斯特·冯·巴尔蒂莫(Robert Koch)所发明的一种染色方法。
巴氏染液主要用于显微镜下观察分离出来的细菌,并加以染色,以便于观察和鉴定不同种类的细菌。
巴氏染液的配方主要包括三种成分:一是花青素染料,用于染色细菌的细胞壁;二是碘液,用于固定染色;三是含有碱性成分的溶液,用于除去细菌细胞的色素。
这三种成分的配比和使用方法对于染色效果至关重要,以下我们来详细介绍一下巴氏染液的制作和使用方法:一、制作巴氏染液配方:1.花青素染料:将适量的花青素染料溶解于无色无味的酒精中,使其充分溶解,成为染色液。
2.碘液:将适量的碘结晶溶解于无色的乙醇中,加入适量的甘油作为固定剂,充分搅拌溶解。
3.碱性溶液:将适量的氢氧化钠或氨水溶解于蒸馏水中,使其呈碱性状态,用于去色反应。
二、使用巴氏染液的步骤:1.将待染的玻璃载玻片上涂上待染的涂片物,如细菌培养物。
2.在玻片上滴上花青素染料液,使其充分覆盖待染的涂片物,静置数分钟,让染料充分渗入细菌细胞壁。
3.将碘液滴在染色后的玻片上,修饰几秒钟,然后用蒸馏水冲洗,固定染色。
4.滴上碱性溶液,静置片面上数分钟,然后用蒸馏水冲洗,直至不再有颜色流出。
5.待玻片干燥后,即可放入显微镜下观察分离出的细菌。
巴氏染液在细菌学研究中具有重要的应用意义,它能够让科学家们更清晰地观察和鉴定不同种类的细菌,为疾病的防治提供了重要的依据。
巴氏染液的制作和使用方法也并不复杂,只要按照正确的步骤和配方来进行操作,就可以得到理想的染色效果。
希望通过本文的介绍,大家对巴氏染液有了更深入的了解,能够在日常的实验工作中更加得心应手。
第二篇示例:巴氏染液是一种用于微生物检测的重要试剂,其原理是利用染色剂对生物样品进行染色,从而使微生物在显微镜下更容易被观察和分析。
巴氏染色步骤全版.doc

巴氏染色步骤
1.将涂片置于95%酒精固定15分钟以上。
2.水洗后,用苏木素染液3—5分钟,直到染色明显为止后用清水冲洗。
3.置于稀碳酸锂溶液1—2分钟。
使涂片返蓝后用水冲洗。
4.放入95%乙醇中脱水1分钟,水洗甩干。
5.在橘黄G6染色3分钟,水洗。
6.依次放入80%、95%、95%乙醇中各10秒、脱水。
7.水洗后放入EA36染液中染色5分钟左右,至胞浆着色鲜明为止,再水洗。
8.用95%酒精洗涤2—3次,再置于纯酒精中脱水
9.晾干或吹干后用树胶封片固定即可。
注:①一套染液可根据染色深浅情况更换,一般为3—5月更换一次
②更换染液时,苏木素及EA36染液可适量加入10ml冰醋酸,
③春冬两季及温度较低时,可适当延长染色时间。
快速染色法
苏木素色精染色液1-2min水洗晾干,苏木素分色液3s水洗晾干,苏木素返蓝液5s水洗晾干,苏木素多彩染液1-2min,水洗吹干,封片。
HE染色和巴氏染色法

HE染⾊和巴⽒染⾊法HE染⾊和巴⽒染⾊法普通染⾊⼜称常规染⾊或HE(Haematoxylin and eosin)染⾊。
它是病理技术中最常⽤的⼀种⽅法,通过它可以做出病理诊断和发现寻求别的辅助⽅法,以达到准确,完整的病理诊断。
⼀、染⾊⽬的病理学的所有切⽚,都必须通过⼀种以上的染料,通过各种不同的⽅法,将切⽚中各种不同的物质,在不同染液的作⽤下,将其显⽰出来,使之在光学显微镜下,能够完全的观看各种结构。
例如,HE染⾊,好质量的切⽚可以清晰地显⽰出许多不同的结构,细胞核着蓝⿊⾊,细胞浆着粉红⾊,软⾻着蓝⾊等。
清晰的结构为诊断提供可靠的依据,因此,染⾊技术也是病理技术中的重要组成部分,必须不断地总结,⽅能提⾼。
如果染⾊不好,切⽚染⾊⼀团糟,红蓝不分,结构不清,层次不明,影响了镜下的观察,直接影响了临床诊断,染⾊结果的好坏直接关系到诊断的准确性。
⼆、染⾊的作⽤1.化学作⽤:所有的染⾊液中,可把它们分为两种类型,⼀种为酸性,另⼀种为碱性。
酸性染料中有染⾊作⽤的为阴离⼦;碱性染料中有染⾊作⽤的为阳离⼦,每个细胞也存在着两种物质,细胞核含的是酸性物质,细胞浆含的是碱性物质。
在染⾊时,细胞核中的酸性物质与苏⽊素染液中的阳离⼦发⽣作⽤,细胞浆中的碱性物质与伊红染液中的阴离⼦发⽣作⽤,由于反应的部位不同,结果着⾊有异。
2.物理作⽤:在染⾊过程中,染液中的⾊素微粒⼦浸⼊到被染组织的粒⼦间隙内,此时,因受分⼦的引⼒作⽤,⾊素微粒⼦被吸附⽽着⾊。
由于各种组织有不同的吸附能⼒和不同的吸附程度,因此就可显出来不同的颜⾊来。
⼀般来说,染⾊的学说还有许多,但说服⼒强的仅有上述两种。
但不管怎么样解释,实际上完成的每⼀种染⾊,都与上述两种学说分不开,它们的作⽤是相辅相成,同时存在的。
三、染⾊⽅法及步骤1.⼈⼯苏⽊素,伊红染⾊法(HE法)(1)切⽚浸⼊⼆甲苯中5-10min;(2)切⽚浸⼊⼆甲苯中5-10min;(3)100%酒精1min。
TCT简易巴氏染色

简易巴氏染色法
简易EA染色液的配置:
亮绿S.F :0.72g 水溶性伊红:1.08g 蒸馏水:600ml 三者混合摇匀,让两种燃料充分溶解
0.2%磷钨酸:0.2g磷钨酸粉末100ml蒸馏水
巴氏染色步骤:
1、将刚离心好的TCT玻片放入95%的酒精15min以上(此步骤为湿固定,TCT玻片不能
用吹风机吹干)
2、70%酒精15s
3、50%酒精15s
4、自来水水洗
5、苏木素染色
6、1%盐酸分化
7、0.5%氨水蓝化
8、自来水洗
9、0.2%磷钨酸水溶液1Min
10、简易EA工作液5min
11、95%酒精清洗
12、100%酒精清洗
13、吹干,封片
简易EA染色结果:
鳞状上皮各层细胞质依分化程度不同而染成不同颜色,其中基底层、中层、表层角化前细胞质染成蓝绿色(深—浅),表层细胞质染成红色(浅—深)。
细胞核呈蓝色(基底层)---紫蓝色(中、表层)。
挖空细胞辨认清晰,念珠细菌呈紫红色,滴虫细胞质浅绿色、细胞核深蓝色,阴道杆菌呈紫蓝色。
简易EA染色液的使用:
0.2%的磷钨酸水溶液在染250张TCT后更换,每600mlEA可染8000张TCT片。
巴氏染色原理

巴氏染色原理巴氏染色原理是一种用于细胞观察和研究的重要技术,它是通过一系列的染色步骤将细胞的结构和组成可视化,从而帮助科研人员更好地理解细胞的功能和特性。
在生物学、医学和生物技术领域,巴氏染色原理被广泛应用,成为了研究细胞和组织的重要工具。
首先,巴氏染色原理的基本步骤包括固定、染色和观察。
固定是指将待观察的细胞或组织固定在载玻片上,以保持其形态和结构不变。
固定的方法有很多种,常用的包括甲醛固定和乙醇固定。
接下来是染色步骤,染色是通过染料将细胞或组织的特定结构染成不同的颜色,以便观察和分析。
最后是观察,通过显微镜观察染色后的细胞或组织,从而获取所需的信息。
巴氏染色原理的核心在于染色的选择和染色机理。
不同的染料对细胞或组织的不同结构有特异性的亲和作用,因此在染色过程中要选择合适的染料,以便清晰地显示出所需的结构。
同时,染色的机理也是非常重要的,了解染料与细胞或组织相互作用的原理,可以更好地控制染色的效果,提高观察的准确性和可靠性。
在实际的应用中,巴氏染色原理可以用于细胞形态学的研究,比如观察细胞的形状、大小、核的位置等;也可以用于研究细胞的生理功能,比如观察细胞内的器官、蛋白质或核酸的分布情况。
此外,巴氏染色原理还可以用于病理学的诊断,通过染色观察组织的形态和结构变化,帮助医生诊断疾病。
总的来说,巴氏染色原理是一种非常重要的细胞观察技术,它在生物学、医学和生物技术领域发挥着重要作用。
通过巴氏染色原理,我们可以更清晰地观察和了解细胞的结构和功能,为科学研究和医学诊断提供有力的支持。
希望本文能够帮助读者更好地理解巴氏染色原理,并在实践中取得更好的效果。
住院医师规范化培训考核项目操作标准:巴氏染色

项目
操作 准备
固定
操作 流程
核染色 胞浆染色
封片
操作后
效果评价
整体 评价
操作熟练 医技沟通
操作时间:10分钟
操作内容
评分
考评细则
固定液成分及浓度各3分, 使用95%的乙醇固定液进行湿固定15min 10 固定方法4分,不能说明的
不得分
清水浸洗固定液后,放入苏木素染色液 中3-5min,然后盐酸分化,45度热水返 蓝并观察染色效果。
30
浸洗10分,染色10分,分化 返蓝10分
浸入染色液中1min,逐级梯度乙醇脱水 并烘干。
20
浸染10分,脱水10分
浸入二甲苯中透明5秒,中性树胶封片 10 透明并封片操作各5分
细胞核效果 细胞浆效果 生物安全性操作规范 查对流程规范 器械整理
操作流畅,程序清楚,时间适宜 与技术员沟通有效,体现严谨细致
总 分:100分
5
细胞核染色层次、细节清 楚,否则不得分
5 染色层次清楚,否则不得分ຫໍສະໝຸດ 5 操作无误,不规范不得分
3 缺失该流程扣3分
2
归类器械,清理取材台,未 完成不得分
5
操作不流畅扣2分,超时扣2 分,程序颠倒扣1分
5 无医技沟通者扣5分
第 1 页,共 1 页
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巴氏染色步骤
1.将涂片置于95%酒精固定15分钟以上。
2.水洗后,用苏木素染液3—5分钟,直到染色明显为止后用清水冲洗。
3.置于稀碳酸锂溶液1—2分钟。
使涂片返蓝后用水冲洗。
4.放入95%乙醇中脱水1分钟,水洗甩干。
5.在橘黄G6染色3分钟,水洗。
6.依次放入80%、95%、95%乙醇中各10秒、脱水。
7.水洗后放入EA36染液中染色5分钟左右,至胞浆着色鲜明为止,再水洗。
8.用95%酒精洗涤2—3次,再置于纯酒精中脱水
9.晾干或吹干后用树胶封片固定即可。
注:①一套染液可根据染色深浅情况更换,一般为3—5月更换一次
②更换染液时,苏木素及EA36染液可适量加入10ml冰醋酸,
③春冬两季及温度较低时,可适当延长染色时间。
快速染色法
苏木素色精染色液1-2min水洗晾干,苏木素分色液3s水洗晾干,苏木素返蓝液5s水洗晾干,苏木素多彩染液1-2min,水洗吹干,封片。
