二组分金属相图的绘制.ppt
二组分金属固液相图的绘制

专业:材料化学学号:080240008实验人:胡文想同实验人:李会勇实验名称:物化实验气压:101.325Kpa 温度:25℃二组分金属固液相图的绘制实验目的1.掌握热分析法(步冷曲线法)测绘Bi-Sn二组分固-液相图的原理和方法。
2.了解简单二组分固-液相图的特点。
3.掌握KWL-07可控升降温电炉及SWKY-Ⅲ数字控温仪的使用方法。
实验原理热分析法则是观察被研究系统温度变化与相变化的关系,这是绘制金属相图最常用的实验方法。
其原理是将系统加热熔融,然后使其缓慢而均匀地冷却,每隔一定时间记录一次温度,绘制温度与时间关系曲线——步冷曲线。
若系统在均匀冷却过程中无相变化,其温度将随时间均匀下降。
若系统在均匀冷却过程中有相变化,由于体系产生的相变热与自然冷却时体系放出的热量相抵消,步冷曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成体系的相变温度。
二组分系统相图有多种类型,其步冷曲线也各不相同,但对于简单二组分凝聚系统,其步冷曲线有三种类型,见图II-7-1。
图II-7-1 生成简单低共熔混合物的二组分系统图II-7-1A为纯物质的步冷曲线。
冷却过程中无相变发生时,系统温度随时间均匀降低,至b点开始有固体析出,建立单组分两相平衡,f=0,温度不变,步冷曲线出现水平段bc,直至液体全部凝固(c点),温度又继续均匀下降。
水平段所对应的温度为纯凝固点。
图II-7-1B 为二组分混合物的步冷曲线。
冷却过程中无相变发生,系统温度随时间均匀降低,至b点开始有一种固体析出,随着该固体析出,液相组成不断变化,凝固点逐渐降低,到c点,两种固体同时析出,固液相组成不变,系统建立三相平衡,此时f=0,温度不随时间变化,步冷曲线出现水平段cd,当液体全部凝固(d点),温度又继续均匀下降。
水平段cd所对应的温度为二组分的低共熔点温度。
图II-7-1c 为二组分低共熔混合物的步冷曲线。
冷却过程中无相变发生,系统温度随时间均匀降低,至b点,两种固体按液相组成同时析出,系统建立三相平衡,f=0,温度不随时间变化,步冷曲线出现水平段bc,当液体全部凝固(c点),温度又继续均匀降低。
组分金属相图绘

组分金属相图绘————————————————————————————————作者:————————————————————————————————日期:实验五二组分金属相图的绘制【目的要求】1. 学会用热分析法测绘Sn-Bi二组分金属相图。
2. 了解纯物质和混合物步冷曲线的形状有何不同,其相变点的温度应如何确定。
3. 学会金属相图实验数据的采集,步冷曲线的绘制、相图曲线的绘制。
【实验原理】测绘金属相图常用的实验方法是热分析法,其原理是将一种金属或两种金属混合物熔融后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线称为步冷曲线。
当熔融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一平滑的步冷曲线;当体系内发生相变时,则因体系产生的相变热与自然冷却时体系放出的热量相抵消,步冷曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成体系的相变温度。
利用步冷曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。
二元简单低共熔体系的步冷曲线及相图如图2-5-1所示。
用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保证冷却速度足够慢才能得到较好的效果。
此外,在冷却过程中,一个新的固相出现以前,常常发生过冷现象,轻微过冷则有利于测量相变温度;但严重过冷现象,却会使转折点发生起伏,使相变温度的确定产生困难。
见图2-5-2。
遇此情况,可延长dc线与ab线相交,交点e即为转折点。
图1 根据步冷曲线绘制相图图2 有过冷现象时的步冷曲线【仪器试剂】电脑1台;立式加热炉1台;保温炉1台;调压器1台;镍铬-镍硅热电偶1副;不锈钢样品管6个。
Sn(C.P.);Bi(C.P.);石蜡油;【实验步骤】1. 样品配制用台称分别称取纯Sn、纯Bi各100g,另配制含锡20%、42%、60%、80%的铋锡混合物各100g,分别置于不锈钢样品管中,在样品中加入少量石蜡油。
实验七 Bi~Cd金属相图的绘制

实验七 Cd~Bi 二组分金属相图的测定一、实验目的1. 应用步冷曲线的方法绘制Cd~Bi 二组分体系的相图。
2 掌握热电偶温度计和毫伏电位计的基本原理和会用。
二、实验原理1mol 物质完全氧化时的反应热称为燃烧热。
所谓完全氧化是指C →CO 2(气),H 2→H 2O (液),S →SO 2(气),而N 、卤素、银等元素变为游离状态。
如在25℃苯甲酸的燃烧热为-3226.8kJ/mol :燃烧热可在恒容或恒压情况下测定。
由热力学第一定律可知:在不做非膨胀功情况下,恒容燃烧热Q v =△U ,恒压燃烧热Q p =△H 。
在氧弹热量计中测得燃烧热为Q v ,而一般热化学计算用Q p ,两者的关系为:Q p =Q v +△nRT (5.1)式中△n 为反应前后生成物和反应物中气体的摩尔数之差;R 为摩尔气体常数;T 为反应温度(K)。
氧弹热量计的基本原理是能量守恒定律。
样品完全燃烧后所释放的能量使得氧弹本身及其周围的介质和热量计附件的温度升高,则测量介质在燃烧前后体系温度的变化值,就可求算该样品的恒容燃烧热。
其关系式如下:(5.2) 式中m 样和M 样分别为样品的质量和摩尔质量;Q v 为样品的恒容燃烧热;m 铁和Q 铁是引燃铁丝的质量和单位质量燃烧热;m 水和C 水是以水作为测量介质时,水的质量和比热容;C 计称为热量计的水当量,即除水之外,热量计升高1℃所需的热量;△T 为样品燃烧前后水温的变化值。
三、仪器 试剂氧弹热量计 1套 万用表 1个 数字式精密温差测量仪 1台 台秤 1台 氧气钢瓶 1只 温度计(0~50℃) 1支T W T C C m Q m Q M m 计水水铁铁v 样样∆=∆+=--')(氧气减压阀1只小台钟1只压片机1台烧杯(1000mL) 1只电炉(500W) 1个电子天平1台塑料桶1个引燃铁丝直尺1把苯甲酸(分析纯)剪刀1把萘(分析纯)四、实验步骤1. 将热量计及其全部附件加以整理并洗净。
实验十二二组分金属相图

实验十二二组分金属相图一、实验目的用热分析法(步冷曲线法)测绘Bi-Sn二组分金属相图。
二、实验原理较为简单的二组分金属相图主要有三种:一种是液相完全互溶;凝固后,固相也能完全互溶成固体混合物的系统,最典型的为Cu-Ni系统;另一种是液相完全互溶而固相完全不互溶的系统,最典型的是Bi-Cd系统;还有一种是液相完全互溶,而固相是部分互溶的系统,如Pb-Sn系统,本实验研究的Bi-Sn系统就是这一种。
在低共熔温度下:Bi在固相Sn中最大溶解度为21%(质量百分数)。
热分析法(步冷曲线法)是绘制相图的基本方法之一。
它是利用金属及合金在加热和冷却过程中发生相变时,潜热的释出或吸收及热容的突变,来得到金属或合金中相转变温度的方法。
通常的做法是先将金属或合金全部熔化,然后让其在一定的环境中自行冷却,并在记录仪上自动画出(或人工画出)温度随时间变化的步冷曲线(见图12-1)。
当熔融的系统均匀冷却时,如果系统不发生相变,则系统的温度随时间的变化是均匀的,冷却速率较快(如图中ab线段);若在冷却过程中发生了相变.,由于在相变过程中伴随着放热效应,所以系统的温度随时间变化的速率发生改变,系统的冷却速率减慢,步冷曲线上出现转折(如图中b点)。
当熔液继续冷却到某一点时(如图中c点),此时熔液系统以低共熔混合物的固体析出。
在低共熔混合物全部凝固以前,系统温度保持不变,因此步冷曲线上出现水平线段(如图中cd线段);当熔液完全凝固后;温度才迅速下降(如图中de线段)。
由此可知,对组成一定的二组分低共熔混合物系统,可以根据它的步冷曲线得出有固体析出的温度和低共熔点温度。
根据一系列组成不同系统的步冷曲线的各转折点,即可画出二组分系统的相图(温度-组成图)。
不同组成熔液的步冷曲线对应的相图如图12-2所示。
用热分析法(步冷曲线法)绘制相图时,被测系统必须时时处于或接近相平衡状态,因此冷却速率要足够慢才能得到较好的结果。
三、仪器与试剂JXL-2型金属相图炉一台,微电脑温度控制仪一台,铂电阻温度计一支,玻璃样品管六支。
双金属相图的绘制
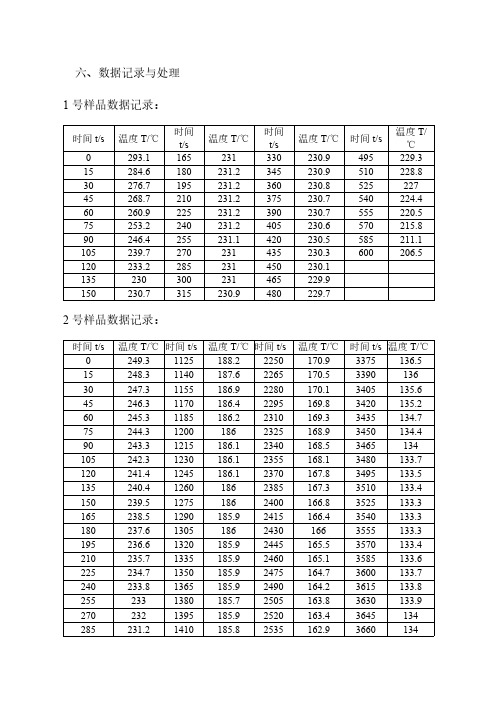
六、数据记录与处理1号样品数据记录:时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃0293.1165231330230.9495229.3 15284.6180231.2345230.9510228.8 30276.7195231.2360230.8525227 45268.7210231.2375230.7540224.4 60260.9225231.2390230.7555220.5 75253.2240231.2405230.6570215.8 90246.4255231.1420230.5585211.1 105239.7270231435230.3600206.5 120233.2285231450230.1135230300231465229.9150230.7315230.9480229.72号样品数据记录:时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃0249.31125188.22250170.93375136.5 15248.31140187.62265170.53390136 30247.31155186.92280170.13405135.6 45246.31170186.42295169.83420135.2 60245.31185186.22310169.33435134.7 75244.312001862325168.93450134.4 90243.31215186.12340168.53465134 105242.31230186.12355168.13480133.7 120241.41245186.12370167.83495133.5 135240.412601862385167.33510133.4 150239.512751862400166.83525133.3 165238.51290185.92415166.43540133.3 180237.6130518624301663555133.3 195236.61320185.92445165.53570133.4 210235.71335185.92460165.13585133.6 225234.71350185.92475164.73600133.7 240233.81365185.92490164.23615133.8 2552331380185.72505163.83630133.9 2702321395185.92520163.43645134 285231.21410185.82535162.93660134时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃300230.21425185.72550162.53675134.1 315229.31440185.725651623690134.2 330228.51455185.62580161.53705134.1 345226.61470185.52595161.23720134.2 360227.61485185.52610160.73735134.2 375225.81500185.42625160.23750134.1 3902251515185.32640159.83765134.2 4052241530185.22655159.33780134.2 420223.21545185.12670158.83795134.1 435222.41560184.92685158.43810134.2 450221.51575184.92700157.93825134.1 465220.71590184.82715157.43840134 480219.81605184.627301573855134.1 495218.91620184.42745156.53870134 510218.21635184.227601563885133.9 525217.516501842775155.63900134 540216.51665183.92790155.13915133.9 555215.71680183.72805154.63930133.8 570214.91695183.42820154.23945133.8 585214.11710183.22835153.73960133.7 600213.417251832850153.23975133.6 615212.51740182.82865152.83990133.7 630211.71755182.42880152.34005133.6 6452111770182.22895151.84020133.4 660210.21785181.92910151.44035133.5 675209.41800181.72925150.94050133.4 690208.71815181.42940149.54065133.2 705207.9183018129551494080133.2 720207.11845180.82970148.64095133 735206.41860180.52985148.14110132.8 750205.61875180.23000147.64125132.8 765204.91890179.83015147.24140132.6 780204.21905179.53030146.74155132.4 795203.41920179.23045146.24170132.3 810202.61935178.93060145.84185132.1 8252021950178.63075145.34200131.9 840201.21965178.33090144.84215131.7 855200.419801783105144.44230131.4 870199.81995177.63120143.94245131.1时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃885199.12010177.33135143.54260130.9 900198.32025176.931501434275130.4 915197.72040176.63165142.64290129.8 9301972055176.33180142.14305129.1 945196.32070175.93195141.74320128.3 960195.62085175.53210141.24335127.4 975194.92100175.23225140.84350126.6 990194.22115174.93240140.34365125.9 1005193.62130174.53255139.84380125 1020192.82145174.13270139.44395124.3 1035192.22160173.632851394410123.5 1050191.52175173.23300138.64425122.7 1065190.82190172.73315138.14440122 1080190.22205172.33330137.84455121.2 1095189.62220171.83345137.24470120.5 1110188.92235171.43360136.94485119.8 3号样品数据记录:时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃0211.7375134750134.31125133.5 15205390134765134.31140133.4 30200405134.1780134.31155133.3 45194.9420134.1795134.21170133.1 60190.1435134.1810134.21185133 75185.4450134.2825134.21200132.9 90181.1465134.2840134.21215132.7 105176.9480134.3855134.11230132.5 120173.1495134.3870134.11245132.2 135169.3510134.3885134.11260132 150165.7525134.3900134.11275131.6 165162.2540134.39151341290131.2 180159.1555134.39301341305130.8 195155.9570134.39451341320130.3 210152.8585134.39601341335129.8 225150600134.3975133.91350129.4 240147.1615134.3990133.91365128.9 255144.5630134.31005133.91380128.3 270141.9645134.31020133.81395127.4 285139.4660134.31035133.81410126.2时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃300137675134.31050133.81425124.8 315135690134.31065133.71440121.6 330134.1705134.31080133.71455117.5 345133.9720134.31095133.61470112.9 360133.9735134.31110133.61485108.44号样品数据记录:时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃0261.71095198.52190162.53285134.8 15260.21110198.22205161.93300134.7 30258.71125197.92220161.33315134.6 452571140197.62235160.83330134.6 60255.51155197.32250160.23345134.4 75253.911701972265159.63360134.3 90252.51185196.722801593375134.2 105250.91200196.42295158.53390134.1 120249.612151962310157.93405133.9 1352481230195.72325157.33420133.8 150246.61245195.32340156.73435133.7 165245.112601952355156.23450133.6 180243.81275194.52370155.73465133.5 195242.31290194.12385155.13480133.3 210240.91305193.72400154.63495133.2 225239.61320193.32415153.93510133.1 240238.21335192.92430153.43525133 255236.91350192.42445152.93540132.9 270235.513651922460152.33555132.8 285234.31380191.52475151.83570132.7 300233.11395191.12490151.23585132.6 315231.91410190.62505150.23600132.5 330230.91425190.22520149.63615132.4 345229.91440189.625351493630132.3 3602291455189.22550148.53645132.2 375228.11470188.72565147.93660132.1 390227.31485188.22580147.43675132 405226.41500187.82595146.93690131.9 420225.51515187.22610146.33705131.9 435224.71530186.72625145.83720131.8 450223.91545186.22640145.33735131.6时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃4652231560185.72655144.73750131.5 4802221575185.22670144.23765131.4 495221.21590184.72685143.63780131.3 510220.31605184.22700143.23795131.2 525219.51620183.62715142.83810131.1 540218.51635183.12730142.13825130.9 555217.61650182.52745141.63840130.8 570216.81665182.12760142.13855130.6 5852161680181.52775140.63870130.5 600215.116951812790140.13885130.4 615214.21710180.52805139.63900130.2 630213.41725179.828201393915130.1 645212.51740179.42835138.63930129.8 660211.71755178.82850138.13945129.6 675210.91770178.32865137.83960129.4 690210.11785177.72880137.33975129.1 705209.41800177.128951373990128.9 720208.61815176.62910136.74005128.6 7352081830176.12925136.44020128.3 750207.31845175.52940136.24035127.9 765206.71860174.92955135.94050127.4 780206.21875174.429701364065126.8 795205.71890173.92985136.14080126 810205.21905173.33000136.14095125.2 825204.71920172.73015136.24110124.3 840204.41935172.13030136.24125123.4 8552041950171.63045136.24140122.6 870203.71965171.13060136.24155121.6 885203.41980170.53075136.24170120.7 900203.21995169.93090136.14185119.8 915202.92010169.33105136.14200118.9 930202.62025168.831201364215118.3 945202.22040168.23135135.94230117.4 960201.72055167.63150135.74245116.6 975201.420701673165135.74260115.8 9902012085166.53180135.64275115 1005200.52100165.93195135.54290114.3 1020200.22115165.43210135.24275115 1035199.72130164.73225135.24290114.3 1050199.52145164.23240135.1时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃1065199.12160163.63255135.11080198.821751633270134.95号样品数据记录:时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃时间t/s温度T/℃0323.7330266.2660270.3990265.5 153********.2675270.31005265.1 30319.2360267.3690270.11020264.5 45316.5375267.97052701035263.8 60313.8390268.57202701050263.2 75305.5405269.1735269.91065262.5 90302.6420269.6750269.71080261.7 105300.2435270765269.61095260.8 120297.7450270.4780269.51110259.9 135295465270.5795269.31125258.9 150292.5480270.5810269.21140257.8 165290.3495270.58252691155256.6 180287.8510270.6840268.81170255.1 195285.6525270.6855268.61185253.4 210283.2540270.6870268.41200251.5 225281.1555270.6885268.11215249.1 240278.8570270.6900267.91230245.6 255276.5585270.5915267.61245241.9 270274.4600270.5930267.21260238.2 285272.2615270.5945266.91275234.5 300270.2630270.4960266.51290231.2 315268.2645270.4975266各样品的步冷曲线绘制如下根据各步冷曲线以及记录的数据求得不同组成的转折温度和平台温度如下:Bi的百分数1号(0%)2号(30%)3号(58%)4号(80%)5号(100%)转折温度T/℃186.28212.44平台温度T/℃230.9133.9134.1134.43269.67134.1根据上表绘制而组分金属(Bi&Sn)相图如下:。
7二组分低共熔体系相图的绘制PPT课件

(a)步冷曲线
(b)二元组分凝聚系统相图
热分析法绘制相图
用热分析法测绘相图时,被测体系必须时时处于或接近 相平衡状态,因此必须保证冷却速度足够慢才能得到较好的 效果。
仪器和试剂
电炉加热系统:可控升降温电炉 不锈钢样品管10只(1#为纯Bi 、 2#~ 9#为
含12.5%、25%、35%、45%、55%、65 %、75%、87.5%的Sn, 10#为纯Sn) 数字式控温仪; 热电偶一支
故控制好样品的降温速度很重要,开始降温时控制在4℃/min ~ 6℃/min。
思考题
1. 冷却曲线上的拐点是怎么来的? 2. 如果有两个样品,一个为纯金属A,另 一个为组成为低共熔体的合金(含A), 你如何通过冷却曲线对它们进行区分?
电炉加热到设定温度后,注意将控温仪加热关闭。 操做要小心烫伤。
数据处理
1. 根据记录的数据,以温度为纵坐标,时间为横坐标,作出各组分的 冷却曲线。
2. 找出各步冷曲线中拐点和平台对应的温度值。 3. 以温度为纵坐标,以物质组成为横坐标,绘出Sn—Bi金属相图。温 度换算(℃ K); (纯Bi:Tf = 271.4℃,纯Sn:Tf = 231.89 ℃) 4、对所作相图中进行相律分析,指出最低共熔点、最低共熔组成、各 区的相数和自由度数。
实验步骤
(1) 将样品管和热电偶都直接放入电炉加热管内(热 电偶不要插入样品管);
(2) 加热(控温仪置于“工作”档),至熔化(加热 到炉膛温度320℃。实际熔化温度是272℃左右,加热 到320℃是为了确保熔化完全);
温度不要超过370℃,否则会损坏热电偶 (3)热电偶插入样品管,自然冷却(控温仪置于“置 数”档),每隔30s 记一次温度,测至小于120℃ ; (4) 换样品,重新测量。
二组分合金系统相图的绘制

综合测试实验、目的要求1.用热分析步冷曲线法绘制铋-镉二组分金属相图2.掌握热分析法的测量技术二、基本原理较为简单的二组分金属相图主要有三种:一种是液相完全互溶,固相也完全互溶成固溶体的系统,最典型的为Cu-Ni 系统;一种是液相完全互溶而固相完全不互溶的系统,最典型的是Bi-Cd 系统;还有一种是液相完全互溶,固相是部分互溶的系统,如Pb-S n系统,本实验研究的是Bi-Cd系统。
热分析中的步冷曲线法是绘制相图的基本方法之一。
它是利用金属及合金在加热和冷却过程中发生相变时,热量的释放或吸收及热容的突变,得到金属或合金中相转变温度的方法。
本实验是先将金属或合金全部熔化,然后让其在一定的环境中冷却,并在电脑上自动画出温度随时间变化的关系曲线—步冷曲线(见图1)。
当熔融的系统均匀冷却时,如果系统不发生相变,则系统的温度随时间的变化是均匀的,冷却速率较快(如图1中ab线段);若在冷却过程中发生了析出固体的相变,由于在相变过程中伴随着放热效应,所以系统的温度随时间变化的速率发生改变,系统的冷却速率减慢,步冷曲线上出现转折(如图 1 中b 点)。
当熔液继续冷却到某一点时(如图1 中c 点),系统以低共熔混合物固体析出,在低共熔混合物全部凝固以前,系统温度保持不变,因此步冷曲线上出现水平线段(如图1中cd线段);当熔液完全凝固后,温度才迅速下降(如图1 中的线段)。
图1 步冷曲线图2 步冷曲线与相图由此可知,对组成一定的二组分低共熔混合物体系,可以根据它的步冷曲线得出有固体析出的温度和低共熔点温度。
根据一系列组成不同系统的步冷曲线的各转折点,即可画出二组分系统的相图(温度-组成图)。
不同组成熔液的步冷曲线对应的相图如图2 所示。
用步冷曲线法绘制相图时,被测系统必须时时处于接近相平衡状态,因此冷却速率要足够慢才能得到较好的结果。
三、仪器和试剂1.仪器:ZR-HX金属相图试验装置一套;电脑一台(四套公用)2.试剂:铋(分析纯、熔点为544.5 K)、镉(分析纯、熔点为594.1 K)四、实验步骤1.配制试样:配制含铋质量分数分别为20% 40% 60%、80%的Bi-Cd合金150g,再称纯Bi、纯Cd 各150 g,分别放入6个不锈钢试管中,上面滴入约1 mL的硅油。
实验五二组分金属相图的测绘

实验五二组分金属相图的测绘一、实验目的1、了解热分析的测量技术。
2、掌握热分析法绘制Pb-Sn合金相图的方法。
二、实验原理物质在不同的温度、压力和组成下,可以处于不同的状态。
研究多相平衡体系的状态如何随温度、压力、浓度而变化,并用几何图形表示出来,这种图形称为相图。
二组分体系的相图分为气-液体系和固-液体系两大类,本实验为后者也称凝聚体系,它受压力影响很小,其相图常用温度组成的平面图表示。
热分析法(步冷曲线法)是绘制相图的常用方法之一。
这种方法是通过观察体系在冷却(或加热)时温度随时间的变化关系,来判断有无相变的发生。
通常的做法是先将体系全部熔化,然后让其在一定环境中自行冷却;并每隔一定的时间(例如半分钟或一分钟)记录一次温度。
以温度(T)为纵坐标,时间(t)为横坐标,画出步冷曲线T-t图。
图4-1是二组分金属体系的一种常见类型的步冷曲线。
当体系均匀冷却时,如果体系不发生相变,则体系的温度随时间的变化将是均匀的,冷却也较快(如图中ab线段)。
若在冷却过程中发生了相变,由于在相变过程中伴随着热效应,所以体系温度随时间的变化速度将发生改变,体系的冷却速度减慢,步冷曲线就出现转折即拐点(如图中b点所示)。
当熔液继续冷却到某一点时(例如图中c点),由于此时熔液的组成已达到最低共熔混合物的组成,故有最低共熔混合物析出,在最低共熔混合物完全凝固以前,体系温度保持不变,因此步冷曲线出现水平线段即平台(如图中cd段)。
当熔液完全凝固后,温度才迅速下降(见图中de线段)。
由此可知,对组成一定的二组分低共熔混合物体系,可以根据步冷曲线,判断固体析出时的温度和最低共熔点的温度。
然后用温度作纵坐标,组成作横坐标绘制相图T-C图(见图4-2)。
本实验是利用“热分析法”测定一系列不同组成Pb-Sn混合物的步冷曲线,从而绘制出其二组分体系的金属相图。
由于这两种金属之任何一种都能溶解于另一种金属中,实际上是一个部分互溶的低共熔体系,但用一般的热分析方法,只能得到一相当于简单的低共熔混合物类型的相图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
确定产生困难。见下图。遇此情况,可延长dc线与ab线相 交,交点e即为转折点。
化学化工学院
实验14:二组分金属相图的绘制
严重过冷现象时的步冷曲线
化学化工学院
实验14:二组分金属相图的绘制 三、药品仪器
电脑1台;立式加热炉1台;保温炉1台;调压器1 台;镍铬-镍硅热电偶1副;不锈钢样品管6个。
利用步冷曲线所得到的一系列组成和所对应的相变温度数 据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温 度就可绘出相图。
化学化工学院
实验14:二组分金属相图的绘制
根据步冷曲线绘制相图
化学化工学院
实验14:二组分金属相图的绘制
用热分析法测绘相图时,被测体系必须时时处于或接 近相平衡状态,因此必须保证冷却速度足够慢才能得到较 好的效果。此外,在冷却过程中,一个新的固相出现以前, 常常发生过冷现象,轻微过冷则有利于测量相变温度
化学化工学院
化学化工学院
实验14:二组分金属相图的绘制
五、注意事项:
1.用电炉加热样品时,温度要适当,温度过高样品易氧化 变质;温度过低或加热时间不够则样品没有完全熔化,步 冷曲线转折点测不出。 2.热电偶热端插到样品中心部位,管内注入少量的石腊油, 热电偶浸入油中。搅拌时注意勿使热端离开样品,金属熔 化后常使热电偶玻璃套管浮起,这些因素都会导致测温点 变动。 3.在测定一样品时,可将另一待测样品放入加热炉内预热, 以便节约时间,体系有两个转折点,必须待第二个转折点 测完后方可停止实验。 4.电炉加热到设定温度后,注意将电炉电压调到零。
aO b c d e
A'
H
ቤተ መጻሕፍቲ ባይዱ
A
F C
B D D' E G
H 546 A 505 熔化物(单相) F
C
Sn(s)+熔化物
熔化物+Bi(s)
E
D Sn(s)+Bi(s)
G
Sn-Bi二元相图的绘制
化学化工学院
实验14:二组分金属相图的绘制 七、实验成败的关键
(1)温度要适当,温度过高样品易氧化变质;温度过低或加 热时间不够则样品没有全部融化,步冷曲线转折点测不出。 (2)热电偶热端应插到样品中心部位。将热电偶浸入油中。 搅拌时要注意勿使热端离开样品。 (3)合金有两个转折点,必须待第二个转折点测完后方可停 止实验;否则,须重新测定。
化学化工学院
实验14:二组分金属相图的绘制
2. 本实验所用体系为Sn-Bi、Cd-Bi或Pb-Zn等低熔点金属体 系,但它们的蒸气对人体健康有危害,因而要在样品上方覆 盖石墨粉或石蜡油,防止样品的挥发和氧化。 3. Bi-Sn相图是具有代表性的部分互溶固-液体系相图。这 种体系由三个两相区和一条三相共存线。但是两侧各有一个 固溶区,以Sn为只要成分的为α区,以Bi为主要成分的为β区。 一个相图的完整绘制,除了采用热分析法外,常需借助其它 技术。例如αβ相的存在和固溶区线的确定,可用金相显微镜、 x-射线衍射方法以及化学分析法等。
化学化工学院
实验14:二组分金属相图的绘制
六、数据处理
1. 根据记录的时间和温度绘制 步冷曲线图。
2. 找出各步冷曲线中拐点和 平台对应的温度值。
3. 以温度为纵坐标,以物质组成 为横坐标,绘出Sn—Bi金属相图。
化学化工学院
实验14:二组分金属相图的绘制
0.6Bi
1.0Sn
1.0Bi
0.3Bi 0.75Bi
实验14:二组分金属相图的绘制
一、实验目的
1. 学会用热分析法测绘Sn-Bi二组分金属相图。 2. 了解纯物质和混合物步冷曲线的形状有何不同,其相 变点的温度应如何确定。 3. 学会金属相图实验数据的采集,步冷曲线的绘制、相 图曲线的绘制。
化学化工学院
实验14:二组分金属相图的绘制
二、实验原理
将一种金属或两种金属混合物熔融后,使之均匀冷却,每 隔一定时间记录一次温度,表示温度与时间关系的曲线称步冷 曲线。当熔融体系在均匀冷却过程中无相变时,温度将连续均 匀下降得一平滑的步冷曲线;当体系内发生相变则因体系产生 的相变热与自然冷却时体系放出的热量相抵消,步冷曲线就会 出现转折或水平线段,转折点对应的温度,为该组成体系的相 变温度。
化学化工学院
实验14:二组分金属相图的绘制
八、实验讨论
1. 本实验的关键是步冷曲线上折变和水平线段是否明显。步冷 曲线上温度变化的速率取决于体系与环境间的温差、体系的热 容量、体系的热传导率等因素,若体系析出固体放出的热量抵 消散失热量的大部分,转折变化明显,否则就不明显。 故控制好样品的降温速度很重要,一般控制在6℃/min ~ 8℃/min,在冬季室温较低时,就需要给体系降温过程加以 一定的电压(约20V左右)来减缓降温速率。
化学化工学院
实验14:二组分金属相图的绘制
H
A 505
熔化物(单相)
546
熔化物+Bi(s)
固熔体+熔化物
固熔体
E
Sn(s)+Bi(s)
0
0.2 0.4
0.6
0.8
1.0
真实的Sn-Bi二元相图
化学化工学院
实验14:二组分金属相图的绘制
九、思考题
1. 对于不同成分的混合物的步冷曲线,其水平段有什么不 同?为什么? 2. 作相图还有哪些方法? 3. 作图时应注意那些问题? 4. 做好步冷曲线的关键是什么? 5. 是否可以用升温曲线来做相图? 6. 为什么要缓慢冷却合金做步冷曲线? 7.为什么样品中严防进入杂质?如果进入杂质则步冷曲线会 出现什么情况?
Sn(C.P.);Bi(C.P.);石蜡油;
化学化工学院
实验14:二组分金属相图的绘制 四、实验步骤
1.样品配制
用感量0.1g的台称分别称取纯Sn、纯Bi各50g,另配 制含锡20%、40%、60%、80%的铋锡混合物各50g,分 别置于坩埚中,在样品上方各覆盖一层石墨粉。
化学化工学院
实验14:二组分金属相图的绘制
2.绘制步冷曲线
(1) 将热电偶及测量仪器连接好。 (2) 将样品放入加热炉内加热。待样品熔化后停止加热, 用玻璃棒将样品搅匀,并在样品表面撒一层石墨粉,以防 止样品氧化。
(3) 将坩埚移至保温炉中冷却,热电偶的尖端应置于样品中 央。同时开启记录仪绘制步冷曲线,直至水平线段以下为止。
(4) 用上述方法绘制所有样品的步冷曲线。
