第17章 胺(一)
第17章 胺

环状胺通常按含氮杂环化合物的氢化衍生物命名。例如:
N H 四氢吡咯
N H 六氢吡啶
§ 17.2 一元胺的物理性质
化合物 熔点/℃ –93 –81 –83 –101 –50 –86 –104 –68 –96 –42 –40 –61 –59 –42 –115 –94 –117 –115 –6 –57 2 54 126 沸点/℃ –7 17 49 33 77.8 68 63 45 134 53 7 37 56 111 84 159 56 3.5 156 90 185 184 196 194 302 365
N-甲基-N-乙基异丁胺
在取代基前加N-(读作氮位),是为了明确取代基所在的位置。
结构比较复杂的胺,可以作为烃类的氨基衍生物命名。
(CH3)2CHCH2CHCH3 NH2 4-甲基-2-氨基戊烷 CH3CH2CHCH3 N(CH2CH3)2 2-(二乙胺基)-丁烷
季铵盐的命名与铵盐相似。
(CH3)4N+Cl氯化四甲铵 C6H5CH2N+C2H5)3Cl 氯化三乙基苄基铵
而芳香族胺的碱性则比氨弱。
17.3.1 脂肪胺
但仍然是弱碱
乙胺的碱性比氨强,这是因为C-N键是极化的,乙胺有偶极矩,方
向是由乙基指向氮原子。在乙胺的共轭酸——乙基铵离子中,氮原子上的正 电荷在偶极的影响下,部分分散到乙基中,使乙基铵离子比铵离子更稳定:
NH3 CH3CH2NH2 H NH3
+ +
H NH2CH2CH3
:
N H
N CH3 CH3 H
HNH=113°
苯胺分子中N原子更接近于平面结构,其杂化状态介于 sp3和sp2杂化之 间,更接近于sp2。这样才能使孤对电子对所在的轨道具有更多的p成分, 与苯环中π电子轨道重叠更多,使N-C具有部分双键的性质,因此,N-C 的键长比甲胺中的N-C键短。苯胺的结构用共振式表示更为恰当:
17胺

2. 1HNMR
RNH HCN H
δH :0.5~5(加入D2O后消失) α-H :2.7~3.1
H C C N H β-H :1.1~1.7 3. MS
南京大学基础学科教育学院
6
南京大学化学化工学院
1
基础有机化学
17.3 胺的化学性质
一、碱性
+ + .. H Cl
+ - NaOH
RNH2
RNH3 Cl
0~5OC
芳香重氮 b.芳 盐只能在 香族 低温下(5oc 重氮 以下)存 盐在 在,否则 有机 分解出N2 合成
中有
与脂肪2O胺类似
出现黄 广泛 色,油状 应用
N(CH3)2 HNO2 ON
N(CH3)2
绿色晶体 对位占据,则进邻位
物 出现绿色 晶体
南京大学基础学科教育学院
南京大学化学化工学院
基础有机化学
RR’R2N 叔胺
N H
H
RR’R2R3N+X季铵盐
南京大学基础学科教育学院
2
南京大学化学化工学院
基础有机化学
三、胺的命名
•简单的胺:用“胺”作官能团,把它所含烃基的名称和数目写 在前面,按简单到复杂先后列出,后面加上“胺”字。
N CH3
甲(基)乙(基)环丙胺
CH2CH3
•复杂的胺:作为烃类的衍生物来命名
基础有机化学
第十七章 胺
南京大学基础学科教育学院
1
南京大学化学化工学院
基础有机化学
17.1 胺的结构和命名 一、胺的结构
氨和胺分子呈角锥型,N:sp3 杂化 苯胺:N:接近sp3 杂化,形成p-π共轭体系
N
H
17章胺

(CH3)2CH CH2
N-甲基-N-乙基异丁胺
Organic Chem
2、比较复杂的胺,把胺 基当作取代基,烃基作为母体来命名
CH3CH CH2CH(CH3)2 NH2 2-氨基-4-甲基戊烷 CH3 N+ CH3 OHC2H5
CH3 N(C2H5)2 CH3CH2CH CHCH3 2-(N,N-二乙胺基)-3-甲基戊烷 氢氧化三甲乙胺
-H
CH3CH
CH2 H2O CH3CHCH3 OH CH3CHCH3
-H
Organic Chem
邻氨基醇的亚硝酸重排
OH NH2 O R C R' C R R'
HNO2 R'
R
C R
C R'
类似Pinacol重排
-H OH R C R C R' R' R OH R' C C R R'
Organic Chem
:N
O: ..
Organic Chem
伯胺与 HNO2 的反应的机理(重氮化反应)
NaNO2, HCl
H
RNH2
R N NCl
H O H N O + H2O NO
R+ + Cl- +N2
机理经过 碳正离子
H O NO +
H O H
NO
N RNH2
O RNH2 H NO
-H RNH NO
H RN
O N
CN,Ph-Cl等)测定确按此顺序) • 从溶剂效应看:N上取代基多,与H2O形成氢键少,与H+结合 形成铵离子后,溶剂化稳定作用弱,碱性减弱。
Organic Chem
第十七章胺1

CH3 C CH3 CH3
7、烯胺的生成及其反应
H C H C O + RNH2 H
H C H
H C H
C
NR
H2 C
C 亚胺
NR2
OH H
C H
H C H C O + R2NH
H
C OH
NR2
C 烯胺
NR2
生成烯胺的反应多用酸催化,二级胺常为:
O N H N H N H
烯胺的共振式有两种
R2N C C R2N C C 具有亲核性
NH 2
(CH3CO) 2O
NHCOCH 3
在乙酸中 NO 2 NH 2 NO 2
HNO 3
NHCOCH 3 NO 2 OH / H 2O
在乙酸酐中 (主要HNO 3
NH3HSO 4 2NaOH NO 2 H2O
+
H2C
CHCH2Cl
N CH2CH CH2
H3O
CH2CH CH2
+
O
N Cl
R
C
O C R
H3O
O CR
反应可看作是在醛酮的α-位的烃基化和酰基化,在合成上 有重要的应用。
O
例:试合成化合物
O + Br COOC2H5 C2H5ONa O
COOC2H5
O
COOC2H5
COOC2H5
有 机 化 学
第十七章
胺
一、分类、结构和命名
1、分类
氨 NH2R 伯胺
CH3 H3C C OH 叔丁醇(叔醇) CH3 H3C
NHR2 仲胺
NR3 叔胺
CH3 C NH2 叔丁胺(伯胺) CH3
第17章胺--

(2)霍夫曼消除的规律
霍夫曼规则:四级铵碱热解时,若有两种β-H可以发 生消除。总是优先消去取代较少的碳上的β-H。
ββ 2CH3CH2CH2CHCH3 OH-
N+(CH3)3
C2H5OK 130oC C2H5OH -2H+
2CH3CH2CH2CH=CH2 + CH3CH2CH=CHCH3 + 2N(CH3)3
17.4.2 胺与酸的成盐反应
胺有碱性,遇酸能形成盐。
RNH2 + CH3COOH CH3NH2 + HCl
CH3COO- +NH3R
+
CH3 NH3 Cl-
罗氏化学 出品
胺与无机酸成盐反应的应用
1. 用于分离提纯
HCl RNH2 不溶于水
RN+ H3Cl- NaOH RNH2 + H2O + NaCl
罗氏化学 出品
CF3 NH2
CF3 2,5-bis(trifluoromethyl)benzenamine
2,5-双(三氟甲基)苯胺
罗氏化学 出品
3. 胺盐和四级铵化合物的命名:
CH3NH2 HCl methylamine hydrochloride
甲胺盐酸盐
CH3CH2NH2 HOAc ethylamine acetate
N,4-二甲基-N-乙基苯胺
CH3 N(C2H5)2 CH3CH2CH CHCH3
N,N- diethyl-3-methyl-2-pentanamine N,N-二乙基-3-甲基-2-戊胺
NH2既可以作为取代基命名,也可以作为主官能团命名, 作为主官能团命名时,选含氮最长的碳链为母体,称某胺。 N上其它烃基为取代基,并用N定其位。
第十七章 胺

胺的光谱性质
红外光谱
N—H 伸缩带在3000-3500 cm-1之间
伯胺在这一区间有两个峰,一个是对称伸缩振动,一个
是非对称伸缩振动。
H
H
R
N H
R
N H
对称
非对称
17 - 19
红外光谱
伯胺有两个 N—H 伸缩峰, 仲胺有一个伸缩峰
RNH2
R2NH
17 - 20
1H-NMR谱
比较化学位移:
H3C
R +
•• – • • X • • ••
H
+ H3N
H + • •N H
R
17 - 36
H
1、氨或胺的烃基化
但实际上该法不实用,通常会得到伯胺、仲胺、 叔胺和季铵盐的混合物。
NH3
RX
RNH2
RX
R2NH RX
+ R4N
X
–
RX
R3N
17 - 37
2、脂肪伯胺的Gabriel合成法
只会生成伯胺,而没有其它胺类副产物 应用卤代烃的 SN2 反应形成 C—N 键 含氮的亲核试剂为 邻苯二甲酰亚胺钾 O – • •N • • O
示 例 O – • •N • • O O
• •N
K
+
+
C6H5CH2Cl DMF
CH2C6H5
(74%)
O
17 - 43
示 例 O NH +
C6H5CH2NH2 (97%) H2NNH2
NH
O O
• •N
CH2C6H5
O
17 - 44
3.含氮化合物的还原
几乎所有的含氮化合物都可以通过还原生成胺。 这些化合物可以是: 叠氮化合物 腈 硝基取代苯的衍生物
第十七章--胺

第三节 胺的物性
低级胺为气体或易挥发性液体; 高级胺为固体; 芳香胺为高沸点的液体或低熔点的固体; 胺具有特殊的气味; 胺能与水形成氢键; 一级胺和二级胺本身分子间也能形成氢键;
胺的反应
1. 胺的成盐反应 四级铵盐的应用 2. 四级铵碱和霍夫曼消除反应 3. 胺的酰化和兴斯堡反应 4. 胺的氧化和科普消除 5. 胺与亚硝酸的反应
CH3
Cl
NO2
NO2
pkb 8.50 8.90 9.30 10.02 13.0 13.82
二、胺与酸的成盐反应
胺有碱性,遇酸能形成盐。 RNH2 + CH3COOH
成盐反应的应用
CH3COO- +NH3R
1. 用于分离提纯
HCl RNH2
不溶于水
RN+ H3C-l NaOH RNH2 + H2O + NaCl
效的p-π共轭。
如果N原子上连有三个不同基团的化合物存在 着对映体,理论上可以分离出左旋体和右旋体。
C2H5 N H
CH3
N CH3 H
C2H5
但难以拆分,其原因在于简单胺的构型转化只需
25kJ/mol的能量,该转化经历一个平面过渡态而迅速
转化,过渡态的氮原子呈sp2杂化。
sp3
C2H5 N H
CH3
第八节 胺与亚硝酸的反应
一、 脂肪胺、芳香胺与亚硝酸的反应 ------重氮化反应
重氮化试剂: 亚硝酸(实际用的是NaNO2 +HCl or
NaNO2 + H2SO4)用量大于 1 mol
1. 伯胺与亚硝酸的反应
脂肪胺: 生成的重氮正离子不稳定,分解后生成碳正离子
第17章胺-精品文档
C H (C H 3 ) 2
C H (C H 3 ) 2
(2)化学还原
CH3 CH3 NO2 Fe E tO H , H C l h e at NH2 NH2
Sn、Fe/HCl
NO2
选择性还原试剂
硫化铵
硫氢化钠
硫化钠
还原剂计量: 二硝基化合物选择还原
p775
4. 腈及其它含氮化合物的还原
R C l + aC N N N i / H 2 R C H N H R C N 2 2 or L i A l H 4
O N N O
+ R N H + H O 2 2
O
氨基酸合成 p773
3. 硝基化合物还原
(1)催化氢化:污染少,逐步替代化学方法。中性条件下进行,
适于对含有对酸、碱敏感的官能团化合物进行还原
CH3 CH3 NO2 H 2, N i h e at , p re s s u re NH2
制备伯胺
Ni, Pd, Pt
5. 还原氨化——醛(酮)在氨存在下催化氢化生成 胺的反应(reductive amination)
RC O H (R') + NH 3 Ni/H 2 RC H NH 2 H (R')
NH RC H (R')
中间体
R
R ' C N R '' R '''
醛(酮)与伯胺的反应通过半缩胺 (亚胺)中间体发生,与仲胺的反应 则通过半缩胺(亚胺离子)
第十七章 胺(amines)
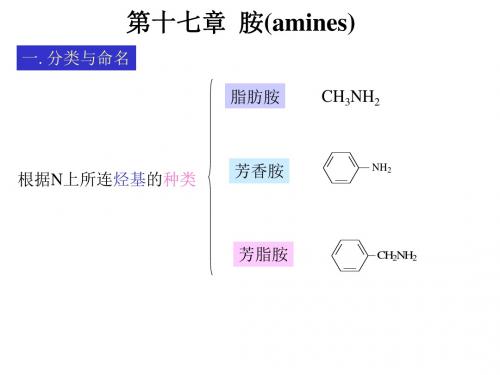
一. 分类与命名
脂肪胺 CH3NH2
根据N上所连烃基的种类
芳香胺
NH2
第十七章_胺

C H 2 H 3 CN C H 2 C HR O H
C H 3 H
( -消 除 )
C H 3 H 3 CN + C H 2 C HR
C H 3
2021/1/16
Hofmann消除的选择性 —— 主要生成取代基少的烯烃
'
H3CCH2 CH2 CH CH3
N(CH3)3 OH
H3CCH2 CH2 CH CH2 +
nh在乙酸中在乙酸酐中主要产物主要产物nh3磺化反应nh9601立体选择性很高第二节重氮化合物和偶氮化合物arnhcl重氮盐干燥时易爆炸与重氮盐稳定性有关的一些因素一芳香重氮盐重氮盐的反应还原反应1重氮盐的取代反应ararcnaroh离子性和自由基型反应1卤素或氰基取代经自由基机理
第十七章_胺
主要内容
( 两个峰,光、中) (强)
(宽、强)
二级胺 3300-3500
弱
(单峰)
2021/1/16
700-750 (弱)
NMR: —CH2—CH2—NH2
δ 1.1-1.7; 2.2-2.8;0.5-5ppm (与溶剂的性质,溶液浓度,温度有关,可影响H—键缔和)
MS:
R—NH2 —M+小 M+ 奇数个N ,M+奇数 Ar—NH2 M+大
CH3 C2H5 N CH2=CH—CH2 C6H5
CH3
N
C6H5
C2H5 CH2—CH=CH2
2021/1/16
2 、胺的物理性质
低级胺为气体或易挥发性液体; 高级胺为固体; 芳香胺为高沸点的液体或低熔点的固体; 胺具有特殊的气味; 胺能与水形成氢键; 一级胺和二级胺本身分子间也能形成氢键。
有机化学 第十七章 胺

邻苯二甲酰亚胺氮上的氢受到两个拉电子基团
影响呈现酸性(pKa8. 3),用K0H处理很容易生成相 应的钾盐。
该法除合成伯胺外,还用于合成α-氨基酸(参
阅第二十一章)。
三、硝基化合物还原 通过硝基化合物还原制备胺类是极为重要的方
法,因芳香硝基化合物很容易由芳烃硝化得到,因 此该法主要用于合成芳香伯胺。还原主要有催化氢 化和化学还原两种方式。
二、盖布瑞尔(Gabriel)合成 由卤代烃直接氨解制备伯胺时常会有仲、叔胺
生成,盖布瑞尔[S. Gabriel(1851—1924)出生于 德国,在Berlin大学获博士学位,而后在该校任化 学教授,主要在胺及氨基酸合成方面作出了贡献。] 提供了一个由卤代烃制备纯伯胺的好方法。邻苯二 甲酰亚胺的钾盐与卤代烃发生亲核取代反应,生成 N-取代亚胺后水解或肼解可获得高产率伯胺。
ቤተ መጻሕፍቲ ባይዱ
工业上由油脂水解得到高级脂肪酸(14.4节), 把该酸转化为酰胺,进而脱水生成腈,催化氢化可 得到长链伯胺(参看15. 3节)
2.酰胺还原
酰胺在醚中用LiAlH4处理可把羰基还原为亚甲 基获得较高产率的胺。氮上无取代基的酰胺可得到
伯胺,N-取代酰胺可得到仲、叔胺。
3.肟的还原 醛、酮与羟氨反应生成肟,肟是不饱和含氮化
17.4 胺的化学反应 由于胺中氮上具有孤对电子,使得它能在化学反
应中提供电子,体现了胺的一系列化学性质,如碱性、 亲核反应及氨基致活芳环上的亲电取代反应等。 一、碱性与成盐
1.碱性 按路易斯(Lewis)酸碱概念讲,反应中接受质子 或提供电子对的化合物为碱。由于胺中孤对电子的存 在,能从水中接受质子,故呈碱性。
七、曼尼希(Mannich)反应 具有α氢的酮与甲醛(或其他简单脂肪醛)及
第十七章 胺

NH2 NH2
130℃ , 13.6MPa
LiAlH4还 原
RC N
LiAlH4
H2O
RCH2NH2
CN CH3
LiAlH4 乙 醚
CH2NH2 CH3
Company Logo
17.3
胺的制备
2、酰胺的还原
O
R
C
NH2
LiAlH4
H2O
RCH2NH2
伯胺
O C N(CH3)2
LiAlH4 乙 醚
CH2 N(CH3)2
17.1
分类、结构与命名
(CH3)3N 三甲胺
NH2
CH3NHCH3 二甲胺
H2N CH2CH2 NH2 乙二胺
NH2 NH2
1,2,3-苯三胺
3、复杂的胺可看作烃基衍生物来命名,以烃基为母体
CH3CHCH2CHCH3
CH3 NH2
CH3CH2CHCH3
N(CH2CH3)2
2-氨基-4-甲基戊烷
H2N SO3H
..
IPh
C2H5 H2C CH CH2
Company Logo
17.1
三、命名
分类、结构与命名
1、简单的胺可用它所含的烃基命名——以胺为母体
H3C NH2
甲胺
NH2
环己基胺 苯胺
CH3 N
NH2
2、多烃基胺、多元胺
CH3
CH3NH CH2CH3 甲乙胺 或 N-甲基乙胺
N,N-二甲苯胺
Company Logo
Company Logo
17.3
胺的制备
一、 卤代烃的氨解
与胺中N上H原子被烃基取代的反应,称胺的烃基化反 应。当氨大过量时,产物以伯胺为主。
邢其毅《基础有机化学》笔记和课后习题(含考研真题)详解(胺)

第17章胺17.1 复习笔记一、胺的分类1.概念氨上的氢被烃基取代后的物质称为胺(amine)。
氨基(一NH2、--NHR、NR2,amino)是胺的官能团。
2.分类(1)根据胺分子中烃基的种类不同,可以分为脂肪胺(aliphatic amine)和芳香胺(aromatic amine)。
例如:CH3CH2NHCH3对甲基苯胺(芳香胺)甲基乙基胺(脂肪胺)(2)根据在氮上烃基取代的数目,胺可分为一级(伯)胺(primary amine)、二级(仲)胺(secondaryamine)、三级(叔)胺(tertiary amine)和四级(季)铵盐(quaternary ammonium salt)。
这里所指的一级、二级和三级胺是指氮与几个烃基相连,而不是烃基本身的结构。
二、胺的结构1.氨(1)氮是用sp3杂化轨道和其它原子成键的。
氨具有棱锥形的结构,氮用sp3杂化轨道与三个氢的S轨道重叠,形成三个sp3-s σ键,成棱锥体,氮上尚有一对孤电子,占据另一个sp3杂化轨道,处于棱锥体的顶端,类似第四个“基团”。
(2)氨的空间排布基本上近似碳的四面体结构,氮在四面体的中心。
2.胺(1)与氨的结构相似,在胺中,氮上的三个sp3杂化轨道与氢的s轨道或别的基团的碳的杂化轨道重叠,亦具有棱锥形的结构。
如图l7-l所示:氨的结构甲胺的结构三甲胺的结构图l7-l 氨及胺的结构(2)在苯胺中,氮仍是棱锥形的结构,H—N—H键角为ll3.9°,H—N—H平面与苯环平面交叉的角度为39.4°,如图l7-2所示:图17-2 苯胺的结构(3)胺对映体之间的互相转化,需要能量很低,故两个对映体在室温就可以很快地互相转化,见图17-3。
(4)在四级铵盐中,氮上的四个sp3杂化轨道都用于成键。
氮构型的翻转不易发生,可确实分离得到这种旋光相反的对映体,例如图17-4所示的化合物可以拆分为(+)及(-)光活体。
图17-3 胺的对映体及其相互转化图17-4 四级铵盐的对映体三、胺的物理性质(1)胺与氨,除前者易燃外,性质很相像。
十七章 胺

CH3
3.物理性质
氢氧化(2-羟乙基) 三甲铵(俗名胆碱)
10 胺、20胺能形成分子间氢键。(N-H···N)弱于(O-H···O)。
CH3CH2OCH2CH3 (CH3CH2)2NH CH3CH2CH2CH2OH
34.5oC
56oC
117oC
水溶性:C6-7溶水,胺较醇的水溶性略好
试推测 a. 相同分子量的伯、仲、叔胺的沸点顺序。
R2NH + HCl
R2NH2Cl 铵盐
碱性与结构的关系:
RNH2 > NH3
氮原子上的烃基越多应碱性越强,但在水溶液 中,由于溶剂化作用,碱性伯胺>仲胺 >叔胺
碱性强度:在水溶液中:仲胺 > 叔胺 > 伯胺 > 氨 烃基不同顺序不同:仲胺 >伯胺 >叔胺> 氨
H OH2 > CH3 N+ H OH2 > CH3 N+ H OH2
6) 酰胺的 Hofmann 降解
RCONH2 Br2-NaOH RNH2
CH3 C2H5
H
CCONH2 Br2-NaOH
CH3 C2H5
氮原子上连有四个不同基团的季铵化合物具有旋光性,
CH3
H5C2
N+ ph CH2CH=CH2
CH3
N+
ph
C2H5
CH2=CHCH2
• 芳香胺
N H 具有sp2 特征
H
2.命名 胺--amine
按氮原子上的基团命名,将烃基从简到繁列出.
CH3NH2
CH3NHC2H5
CH3 C2H5NCH2CH2CH3 (CH3CH2)3N
NH2
17章-胺-1

O CH3 C
H H+ R2N C H O CH3 C
+
CH2CH2N(C2H5)2 + H2O
H 机理:R2NH + C H O CH3 C
OH2
R2N+
CH2
亚胺离子 CH2CH2 NR2 + H+
CH2=N+R2
含活泼氢的化合物:醛,酮,酸,酯 都可以。
NO2 Fe +HCl
NO2 NH2 + H2 Pt,C2H5OH O C OC2H5 O C OC2H5
NH2
※ 选择性还原: 选择性还原: 二硝基化合物:用硫化铵、硫氢化铵或硫化钠等,可得只还原 二硝基化合物:用硫化铵、硫氢化铵或硫化钠等, 一个硝基的硝基胺。 一个硝基的硝基胺。
第十七章 胺
Hale Waihona Puke 10Mannich反应 甲基酮+甲醛+ Mannich反应(α甲基酮+甲醛+伯、仲胺盐,生成β氨基酮)的一 反应( 仲胺盐,生成β氨基酮) 个重要用途是用于生物碱的合成。 颠茄酮又称托品酮的合 个重要用途是用于生物碱的合成。如,颠茄酮又称托品酮的合 两步mannich反应 收率40%左右 反应, 左右): 成(两步mannich反应,收率40%左右):
五、Hofmann降解反应 Hofmann降解反应
O RCNH2 NaOH + Br2 RNH2
未取代的酰胺用溴的碱溶液处理时,反应中发生分子重排生成 未取代的酰胺用溴的碱溶液处理时, 伯胺的反应称之。 伯胺的反应称之。 13 第十七章 胺
如:
(CH3)3CCH2CONH2
第十七章 胺

O C N R
RNH2
O R'OH O C N R R'NH2 RNH C OR' O RNH C NHR'
七. Mannich 胺甲基化反应
O R C CH2 + HCHO + H N R" R' R" H O R C CH CH2 N R" R' R"
二、胺的化学性质
碱 性
官能团: NH2
亲核性
季铵碱的制备
+
2 [ (CH3)4N ] I
+ Ag2O
2 [ (CH3)4N ]+ OH
+
2 AgI
季铵碱
季铵碱是一个强碱,其碱性与NaOH或KOH相当。
(三)彻底甲基化和霍夫曼消去反应 1. 反应及历程
RCH2CH2NH2 3CH3I RCH2CH2N(CH3)3I
•季铵碱制备及Hofmann消除
I
+ N2 F + N2
N2 BF4
被-OH取代
N2 HSO4 + H2O
H+ △
+
OH + N2↑ + H2SO4
被H原子取代
H3PO2 + H 2O
ArN2C l
+
Ar H + H3PO3 + N2↑ + HC l Ar H + CH3CHO + N2↑ + H 2SO4
C2H5OH , △
OCH3
2) 与酰氯反应
O R C Cl + 2CH2N2 O R C CHN2 CH3Cl N2
第17章_材料有机化学胺

罗氏化学 出品
CH3
CH3
A
H3C
CH3
B
H3C
NH H3C
H3C N(CH3)2
H3C
H3C
H3C
N H
N H3C CH3
CH3
CH3
N H
罗氏化学 出品
CH3 N(CH3)2
17.7 胺的氧化和科普消除
1 氧化胺
(1)氧化胺的制备:
R3N
H2O2 or RCO3H
(2)性质:
R3N→O (R3N+-O-)
第 17 章 胺
罗氏化学 出品
17.1 胺的分类
本
17.2 胺的结构
章
17.3 胺的物理性质
提
胺的反应
纲
17.4 胺的成盐反应 四级铵盐的应用
17.5 四级铵碱和霍夫曼消除反应
17.6 胺的酰化、兴斯堡反应
17.7 胺的氧化和科普消除
17.8 胺与亚罗硝酸氏的化反学应出品17.9 重氮甲烷
本
胺的制备
CH3(CH2)7CN 95%
相转移催化剂的用处:提高产率、降低反应 温度、缩短反应时间。
罗氏化学 出品
(3)相转移催化剂的使用原理(参见第十章) 请同学分析下面的实例:
罗氏化学 出品
17.5 四级铵碱和霍夫曼消除反应
1 四级铵碱
2 霍夫曼消除反应 (1)定义 (2)霍夫曼消除的规律 (3)霍夫曼消除反应的机理 (4)霍夫曼消除反应的机理和霍夫曼规则的关系
胺的光谱特征
胺的红外和核磁共振谱见第5章。
罗氏化学 出品
胺的反应 17.4 胺的成盐反应 四级铵盐的应用
17.4.1 胺的碱性 17.4.2 胺与酸的成盐反应 17.4.3 四级铵盐及其相转移催化作用
第17章-胺

O N -K+ CH3CH2B r
O
O
O N CH2CH3 O
O H -/H 2 OFra bibliotekCOOCON HCH2CH3
COOCOO- + CH3CH2NH2
有时酰胺水解困难, 可采用肼解
O NR+NH2NH2.H2OC2H5OH O
氨基酸合成 p773
O
N
+ RNH2 + H2O
N
O
3. 硝基化合物还原
NH2 NH2
制备伯胺 Ni, Pd, Pt
Sn、Fe/HCl
选择性还原试剂
硫化铵
硫氢化钠
硫化钠
还原剂计量: 二硝基化合物选择还原
p775
4. 腈及其它含氮化合物的还原
R C l + aN N C
R C N
N i/H 2 or L iA lH 4
R C H 2N H 2
CON(CH3)2
LiAlH4 ether
CH2NH2 89%
CHO
CH3CH2NH2 LiBH3CN
CH2NHCH2CH3 89% N-benzylethanamine
O
(CH3)2NH
NaBH3CN
N(CH3)2
甲 酸 铵
: 提 供 氮、 作 为 还 原 剂
Leuckart反应——醛(酮)在高温下与甲酸铵 反应得一级胺的反应。
O CCH3
(CH3)2NH dimethyl amine
NH2
aniline 苯胺
NHCH3
N-methyl aniline
C H 3C H 2N H C HC H 2C H 2C H 2C H 2C H 3 C H 2C H 3
有机化学第十七章_胺

NO2 NH4SH
NO2 (还原一个硝基)
选择性还原
NO2
NO2 Zn 2 NaOH 氢化偶氮苯 NH NH
NH2
碱性还原:双分 碱性还原: 子偶联
•联苯胺重排: 联苯胺重排: 联苯胺重排 氢化偶氮苯在酸催化下, 二氨基联苯的反应。 氢化偶氮苯在酸催化下 生成 4,4-二氨基联苯的反应。 二氨基联苯的反应
N(CH3)2 Br
NCH3
HBr OH-
CrO3-
TM
用苯及不超过三个碳的有机物合成: 例:用苯及不超过三个碳的有机物合成: 用苯及不超过三个碳的有机物合成
3-(N-乙氨基 庚烷 乙氨基)庚烷 乙氨基
O NH
3-甲基 甲基-2-(N-甲氨基 戊烷 甲氨基)戊烷 甲基 甲氨基
O H2N COC2H5
CH3CCH2CCH3
4-亚氨基 戊酮 亚氨基-2-戊酮 亚氨基 [季铵化合物 季铵化合物] 季铵化合物
对氨基苯甲酸乙酯
将负离子和取代基的名称放在“ 将负离子和取代基的名称放在“铵”字前
第十七章 胺
本章目录
分类、 第一节 分类、结构和命名 第二节 物理性质和波谱性质 第三节 胺的制备 第四节 胺的化学反应 第五节 重氮化反应和重氮盐
分类、 第一节 分类、结构与命名
一、分类
NH3 氨 RNH2 1o胺 R2NH 2o胺 R3N 3o胺 R4N+X季铵盐 R4N+OH季铵碱
季铵化合物: 季铵化合物:氮原子上连有四个烃基的衍生物 氨基: 氨基:-NH2 ; 亚氨基: 亚氨基:-NH-
肟的还原(催化氢化、LiAlH4,Zn/HCl等) 肟的还原(催化氢化、 等
NOH Na, C2H5OH or LiAlH4 NH2
第17篇胺

ON
N+ O
O
N+ O
NO2
NO2
(1)
(2)
(2)比(1)的碱性强4万倍
具体分析时,既要考虑N上取代基的影响,也要 考虑苯环上取代基的影响。
二、胺的烷基化
或者Ag2O/H2O
(1) 作表面活性剂(洗涤剂、润湿剂、乳化剂、悬浮剂等)
肥皂 RCOO-Na+ 负性基团大
皂胺 R4N+Cl正性基团大
(2) 相转移催化剂(PTC-Phase Transfer Catalyst)
第17章
一、分类
1. 分类、结构及命名
芳香胺
脂肪胺
杂环芳香胺
杂环脂肪胺
二、结构
三、命名
介绍一个常用的四级铵盐:
(C2H5)3N + C6H5CH2Cl
[ (C2H5)3NCH2C6H5 ]+Cl -
TEBA (氯化三乙基苄基铵)
2. 物理性质和波谱性质
一、物理性质
氢键
二、波谱性质
一、卤代烃氨解
3 碱性还原剂:Na2S, NaHS, (NH4)2S, NH4HS, LiAlH4 ( NaBH4 和 B2H6 不能还原硝基)
碱性还原 联苯胺重排
四、腈及其他含氮化合物的还原
腈 酰胺
肟
常用还原剂:LiAlH4, B2H6, 催化氢化, Na +C2H5OH
适用于肟 的还原
CH2=CHCH2CN LiAlH4
(3)影响碱性强弱的因素: 电子效应:3o胺 > 2o胺 > 1o胺 空间效应:1o胺 > 2o胺 > 3o胺 溶剂化效应:NH3 > 1o胺 > 2o胺 > 3o胺
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O C N3
H2O
O C NH2
COOH Cl
+ NaN3
1) H2SO4 2) NaOH Cl
NH2
六. 布歇尔(Bucherer) 反应
OH
(NH4)2SO3 150 oC
NH2
压力NΒιβλιοθήκη 2(NH4)2SO3OH
七. 曼尼希(Mannich) 反应
具有α氢的酮与甲醛(或其他简单脂肪醛)及铵盐(伯、仲胺的盐)水
(与溶剂的性质,溶液浓度,温度等影响氢键缔合的 因素有关,可用D2O交换判定)
第三节. 胺的制法
一. 卤代烃氨解
一般在氨过量的情况下用于制备伯胺,伯胺是很好的亲核试 剂,可继续反应,生成仲胺和叔胺,因此往往得到混合物。
NH3 + R X RNH2 + NH4X RX R2NH + NH4X
RX 使用过量的氨, R3N + NH4X 可以得到伯胺为主的产物 控制条件,也可以得到某一胺为主的产物 RX R4N+X
已拆分出的对映体
二. 胺的命名
1. 以胺为官能团,加上与氮原子相连的烃基的名称和数目。(amine)
CH3
H3C N CH2CH3
CH3NH2
NH2
N CH2CH3
甲胺
苯胺
甲基乙基环丙胺
N-甲基-N-乙基苯胺
2. 结构复杂的胺,可以作为烃类的氨基衍生物来命名。(amino)
(CH3)2CHCH2CHCH3 NH2
4. 类似的反应: 酰氯与叠氮化钠作用及羧酸与叠氮酸反应均生成酰叠氮化合物。加热 后放出氮气生成胺类,前者叫克尔蒂斯重排,后者称施密特重排,这 是两个与霍夫曼重排类似的反应。
RCOCl + NaN3 R RCO2H + HN3 O C N N N
N2
R N
C
O
H2O R NH2
如:
O C Cl + NaN3
氨的用量对反应有什么影响?
RC=NH + RR'CHNH2 R' RR'CHNH2
NH3 +NH3
+H2 H2
(RR'CH)2NH
过量的氨防止羰基化合物与生成的伯胺反应继而被还原成仲胺。
C6H5CHO + NH3 1 1 1 0.5 H2/Ni 9.0 MPa C6H5CH2NH2 + (C6H5CH2)2NH 89.4% 80.8%
NH2NH2
+ RNH2
两个酰基做保护基,占据NH3中氮原子上两个价的位置,只留下一个 可供烃基取代的氢,烃化后再除去保护基,可得到伯胺。
仲胺:
CH3 SO2NHR 1) NaOH 2) R'X CH3 SO2NR R' NaOH, H2O RR'NH
对甲苯磺酰基把伯胺中氮原子上的一个价占据了, 只留下一个可供 取代的氢,烃化和水解后可以得到仲胺。
反应机理:
O R Br C NH2 O OH R C NH O Br2 R C NHBr OH R C N Br O
R N
C
O
H2O
R N
C OH
OH
R NH
C O
OH
异氰酸酯
R NH2
+
C O
O
RNH2
+ CO2
常用来制备仲碳或叔碳的一级胺。
2. 反应的立体化学:
H C6H5CH2 H3C (S)-(+)-2-甲基-3-苯基丙酰胺 C O CNH2 Br2, NaOH, H2O C6H5CH2 H3C (S)-(+)-2-氨基-1-苯丙烷 H C NH2
手性酰胺进行反应时,其手性碳构型不变,说明反应中生成了三元环 过渡态,该过渡态限制了手性碳构型转化的可能性,结果构型保持。
(迁移基团的构型保持不变,说明C-N 键的生成和C-C 键的断裂可
能是协同进行的。)
O H3C C2H5 C C H N Br H3C C2H5 O C C N H Br N H3C C2H5 C H C O
3) 还原肟得到伯胺
由醛酮制备伯胺
醛酮与羟胺反应生成肟,肟是不饱和含氮化合物,可通过催化氢化, LiAlH4,Zn /H+等方法还原,制备伯胺(高产率的合成仲碳第一胺)。 若用仲卤代烃氨解法,则会发生消除反应。
RR'C=O NH2OH RR'C=NOH H2/Cat or LiAlH4/Et2O or Na/ EtOH RR'CHNH2
RCl
+
Ni/ H2 NaCN RCN
或LiAlH4
RCH2NH2
如:
ClCH2(CH2)2CH2Cl
+ NaCN
Ni/ H2 NCCH2(CH2)2CH2CN
或LiAlH4
NH2CH2CH2(CH2)2CH2CH2NH2
F3C
LiAlH4/Et2O CH2CN H2O
F3C
CH2CH2NH2
2-(对三氟甲基苯基)乙胺 53%
H
O
胺的沸点比相应相对分子量的醇的低,但比烃、醚等非极性化合物的要高。 叔胺不能形成分子间氢键,其沸点低于相对分子质量相近的伯胺和仲胺, 而与相对分子质量相近的烷烃差不多。
第二节. 物理性质和波普性质
3. 极性:
CH3CH2 NH2 NH2
= 1.2D
= 1.3D
4. 溶解度: 低级胺溶于水,能和水形成氢键。
3) 与仲胺作用:
得到叔胺,中间产物为醇胺
N H
CH3CH2CH2CHO +
N
五. 霍夫曼(Hofmann) 重排及类似反应
1. 反应历程: 酰胺与次溴酸盐的碱溶液(或溴的碱溶液)作用时,放出CO2,生成 比酰胺少一个碳原子的一级胺的反应,又叫霍夫曼降解。
O R C NH2 + Br2 + NaOH H2O RNH2 + CO2 + 2NaBr
N
N NH2
催化氢化
3. 联苯胺重排
碱性条件下锌粉还原硝基苯可生成偶氢化氮苯,该产物用酸处理可 发生重排,主要生成联苯胺。
H N H N H+ H2N NH2
只要氢化偶氮苯对位无取代基,重排主要生成联苯胺型化合物。
四. 腈,酰胺和肟的还原 1) 还原腈得到伯胺 (催化加氢,LiAlH4) 腈由卤代烃制备,由不饱和的腈基还原,可制备多一个碳原子的胺。 催化加氢往往有仲胺的生成,一般需在过量氨存在的条件下进行。
2) 与伯胺作用:
得到仲胺,中间产物为席夫碱
(CH3)2CHCH=NCH2CH2CH2CH3
席夫碱
(CH3)2CHCHO + CH3CH2CH2CH2NH2
(CH3)2CHCH=NCH2CH2CH2CH3
H2/Ni
(CH3)2CHCH2NH(CH2)3CH3
OH CH3CH2CH2CH H2/Ni CH3CH2CH2CH2 N
氨的气味相似。如:三甲胺有很重的鱼腥味。
NH2CH2CH2CH2CH2NH2 有腐烂肉类的味道,被称为腐肉胺。
碳原子数相同的胺中有什么变化规律? 2. 沸点: 低级胺为气体或易挥发性液体,高级胺为固体。
伯胺的沸点高于非极性有机物,但低于相应的醇。胺分子间具有氢键, 但氮的电负性比氧小。
氢键
N
H
N
>
O
1.40A N
O
..
具有较多p成份 H N介于sp2~sp3杂化之间 H
142.5O
CH3
1.47A
O
N H
H
125O
对映异构现象
R3 N R2 R1 N R1 R2 R3
不 可 拆 分
ΔE = 25-38KJ/mol
N
N H3C
CH3
C2H5
CH3 CH3 N+ N+ C6H5 C6H5 C2H5 CH2CH=CH2 H2C=HCH2C
三元环过渡态
3. 重排基团活性: 芳香酰胺重排可得到芳胺,当酰胺芳环上连有不同取代基时,重排速 度就会受到影响。
O C NH2 Br2, NaOH, H2O NH2 G
G
G
N
C O
G = -OCH3 > -CH3 > -H > -Cl > -NO2
芳基重排三元环过渡态
给电子基团加速反应,拉电子基团使反应速度减慢。
三. 硝基化合物还原法 制备1º 胺
RNO2 还原剂 RNH2
1. 催化氢化: 常用的催化剂Ni, Pt, Pd中性还原剂.
NO2 + H2 Ni 压力 NH2
2. 化学还原法
a. 酸性还原剂(酸+金属):Fe+HCl, Zn+HCl (强), Sn+HCl
Fe NO2 HCl NH2
b. 选择性还原:Na2S,NaSH,(NH4)2S等硫化物
.8 N 0 0 1
H H H
.4 N 7 4 1
H3C
H
.0 N 7 4 1
H3C
CH3
107.3°
140.0
N
112.9°H
H H
105.9°
108.0°CH3
N H H
147.0
H3C
142.5°
125 °
在苯胺分子中,氮原子更接近于平面结构, 氮原子的杂化状态在sp3 与sp2 之间。且在苯胺分子中,C-N 的键长也比甲胺中的短。
四. 腈,酰胺和肟的还原 2) 还原酰胺可以分别得到1º , 2º和 3º 胺( LiAlH4) 酰胺在醚中用LiAlH4 处理,可把羰基还原为亚甲基获得较高产率的 胺。
