第一章 原子结构与性质高考真题分类汇编与解析
高考化学复习考点知识突破解析116:原子结构与性质(解析版)

高考化学复习考点知识突破解析原子结构与性质1.在基态多电子原子中,关于核外电子能量的叙述错误的是()A.最易失去的电子能量最高B.电离能最小的电子能量最高C.p轨道电子能量一定高于s轨道电子能量D.在离核最近区域内运动的电子能量最低【答案】C【解析】A.能量越高的电子通常离核越远,故最易失去的电子能量最高,A正确;B.电离能最小的电子只需要较少的能量即可脱离原子核的吸引,故其能量最高,B正确;C.p轨道电子能量不一定高于s轨道电子能量,同一能层的p轨道电子能量高于s 轨道电子能量,C不正确;D.根据能量最低原理可知,在离核最近区域内运动的电子能量最低,D正确。
综上所述,关于核外电子能量的叙述错误的是C。
2.下列有关元素锗及其化合物的叙述中正确的是A.锗的第一电离能高于碳而电负性低于碳B.四氯化锗与四氯化碳分子都是四面体构型C.二氧化锗与二氧化碳都是非极性的气体化合物D.锗和碳都存在具有原子晶体结构的单质【答案】BD【解析】碳和锗同主族,碳在第二周期,而锗在第四周期,锗是金属元素,故其第一电离能低于碳,A错;四氯化锗和四氯化碳都是分子晶体且构型相同,B对;金属的氧化物不是气体,C错;锗和碳都易于形成四个键,能形成原子晶体结构的单质,D对。
3.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。
完成下列填空:(1)铝原子核外电子云有______种不同的伸展方向,有_____种不同运动状态的电子。
(2)镓(Ga)与铝同族。
写出镓的氯化物和氨水反应的化学方程式_____。
【答案】(1)4 13 (2)GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓【解析】(1)铝原子核外电子云有s、p,分别有1种、3种,共有4中不同的伸展方向,其核外有13个电子,则有13种不同运动状态;(2)类似氯化铝与氨水反应,则镓的氯化物和氨水反应的化学方程式为GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓;4.下列叙述正确的有_______。
2020年高考化学名校试题专题汇编--原子结构与性质(详细解析)
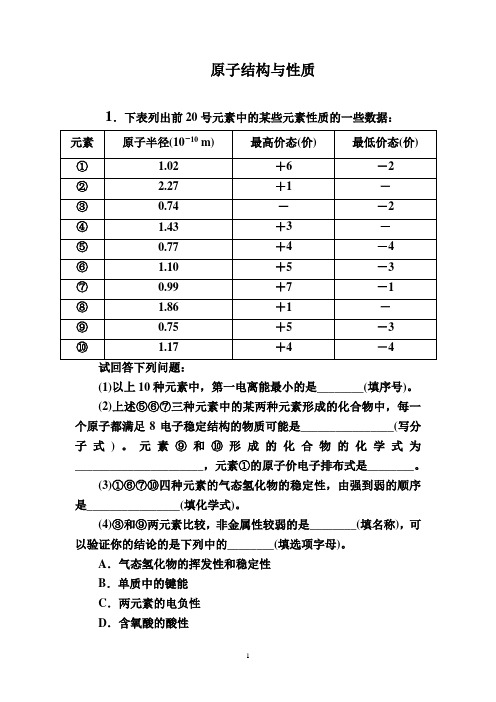
原子结构与性质1.下表列出前20号元素中的某些元素性质的一些数据:(1)以上10种元素中,第一电离能最小的是________(填序号)。
(2)上述⑤⑥⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是________________(写分子式)。
元素⑨和⑩形成的化合物的化学式为______________________,元素①的原子价电子排布式是________。
(3)①⑥⑦⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是________________(填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是________(填名称),可以验证你的结论的是下列中的________(填选项字母)。
A.气态氢化物的挥发性和稳定性B.单质中的键能C.两元素的电负性D.含氧酸的酸性E.氢化物中X—H键的键长(X代表③和⑨两元素)F.两单质在自然界的存在形式解析由题意可知,10种元素是前20号元素,根据表中数据,我们不难推出①S,②K,③O,④Al,⑤C,⑥P,⑦Cl,⑧Na,⑨N,⑩Si。
(1)在同一周期中,从第ⅠA族到第ⅦA族,元素的第一电离能呈增大趋势;同一主族中,从上向下,元素的第一电离能逐渐减小,故在10种元素中,第一电离能最小的是②K。
(2)C、P、Cl中的某两种元素形成的化合物中,PCl3或CCl4分子中的每一个原子都满足8电子稳定结构;根据化合价知氮和硅形成氮化硅Si3N4;硫元素的原子价电子排布式是3s23p4。
(3)元素的非金属性越强,形成气态氢化物越稳定,非金属性强弱为Cl>S>P>Si,故其氢化物稳定性为HCl>H2S>PH3>SiH4。
(4)氧元素和氮元素相比,非金属性较弱的是氮元素,可通过C、E验证。
答案(1)②(2)PCl3、CCl4Si3N43s23p4(3)HCl>H2S>PH3>SiH4(4)氮元素CE2.有A、B、C、D、E 五种短周期元素,其中A、B、C三种元素属于同一周期,A原子最外层p能级上的电子数等于次外层的电子总数,B原子最外层上有两个未成对的电子,D、E原子核内各自的质子数与中子数相等,B元素可分别与A、C、D、E元素形成RB2型化合物,且在DB2和EB2中,D元素与B元素的质量比为78,E元素与B元素的质量比为1。
高考化学一轮复习 专题6_1 原子结构与性质(讲)(含解析)1

专题6.1 原子结构与性质1、了解元素、核素和同位素的含义。
2、了解原子的构成;了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3、了解相对原子质量、相对分子质量的定义,并能进行有关的计算。
4、掌握1~18号元素的原子结构示意图的表示方法。
一、原子结构1、构成原子的微粒及作用 (1)原子构成微粒(2)符号c bd aeX++中各数字的含义(3)组成原子的各种微粒及相互关系 ①质子数(Z )= 核电荷数 = 原子序数 ②质量数(A )= 质子数(Z ) + 中子数(N ) ③阳离子的核外电子数=质子数-所带电荷数 ④阴离子的核外电子数=质子数+所带电荷数原子A Z X原子核核外电子质子(Z中子(A-Z 电子数(Z )个电子排布(分层排布)最外层电子数决定主族元素化学性质 原子结【特别提示】规避4个易失分点①任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子。
②有质子的微粒不一定有中子,如1H ,有质子的微粒不一定有电子,如H +。
③质子数相同的微粒不一定属于同一种元素,如F 与OH -。
④核外电子数相同的微粒,其质子数不一定相同,如Al 3+和Na +、F -等,NH +4与OH -等。
2、元素、核素、同位素的概念及相互关系3、几种“相对原子质量”(1)同位素的相对原子质量的计算式:M r = 一个同位素原子的质量一个12C 原子的质量×112(2)同位素的近似相对原子质量,数值上约等于该同位素原子的相对质量。
(3)元素的相对原子质量是根据各种同位素的相对原子质量和他们在自然界中所占的原子个数百分含量计算的结果。
Mr —=A×a%+ B×b%+ C×c%…… 【比较辨析】四“量”比较【典型例题1】【河北冀州中学2016届第二次月考】中国科学技术名词审定委员会确定第116号元素Lv 的名称为鉝。
关于Lv 293116的叙述错误的是 ( )A .原子序数116B .中子数177C .核外电子数116D .相对原子质量293 【答案】D【考点定位】考查元素符号各个角标的含义及相互关系的知识。
历年高考化学真题及答案详解:物质的结构与性质

专题二十七物质的结构与性质五年高考解读探究考试大纲一、原子结构与性质1.了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
二、分子结构与性质1.了解共价键的主要类型a键和竹键,能用键能、键长、键角等说明简单分子的某些性质。
2.了解简单配合物的成键情况。
3.了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。
4.了解化学键和分子间作用力的区别。
5.了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
三、晶体结构与性质1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
2.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
3.理解金属键的含义,能用金属键理论解释金属的一些物理性质。
4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
命题规律1.考查内容:2012年对原子结构与性质考查3次,如安徽理综25题等;对分手结构与性质考查4次,如山东理综32题、浙江自选15题等;对晶体结构与性质考查2次,如课标理综37题等。
2.题型赋分:对本专题的考查主要以填空题的形式出现,分值为8—15分。
3.能力层级:高考试题对本专题的考查为理解层级。
试题难度中等。
4.考查形式:与元素周期表、元素周期律紧密结合,以新材料的结构为背景考查考生的理解能力。
命题趋势1.热点预测:2013年高考仍将以元素周期表为基础,延续填空题的形式对结构知识进行系统考查。
分值为8^-15分。
2.趋势分析:2013年可能适当加大难度,会在晶胞结构方面进行加深,应予以关注。
高中物理原子结构专题(2017-2019)三年高考真题物理分类汇编(解析版)

专题14原子结构、原子核和波粒二象性1.〔2021新课标全国I卷〕氢原子能级示意图如下图.光子能量在 1.63 eV~3.10 eV的光为可见光.要使处于基态〔n=1〕的氢原子被激发后可辐射出可见光光子,最少应给氢原子提供的能量为£7cVA . 12.09 eVB . 10.20 eV C. 1.89 eV D , 1.5l eV【答案】A【解析】由题意可知,基态〔n=1〕氢原子被激发后,至少被激发到n=3能级后,跃迁才可能产生能量在1.63eV~3.10eV 的可见光.故AE =-1.51 -〔-13.60〕eV =12.09eV o故此题选A.2.〔2021新课标全国n卷〕太阳内部核反响的主要模式之一是质子一质子循环,循环的结果可表示为41HT4He+20e+2v,1H 和2He 的质量分另为m「=1.0078u 和m Of=4.0026u , 1u=931MeV/c2, c为光速.在4个1H转变成1个2He的过程中,释放的能量约为A. 8 MeVB. 16 MeVC. 26 MeV D . 52 MeV【答案】C2 E【解析】由AE =AmC2知AE =(4Mmp—m0f— 2me)c , im = —= c_ _ _ 6 _ 910 J- *1 0.9 10%931 109 ;06,忽略电子质量,那么:6△E =(4M1.0078u—4.0026u >c2定26MeV ,故C选项符合题意;3.〔2021天津卷〕如图为a、b、c三种光在同一光电效应装置中测得的光电流和电压的关系.由a、b、c组成的复色光通过三棱镜时,下述光路图中正确的选项是压越大说明光的频率越大,那么有三种光的频率V b AV cA V a,那么可知三种光的折射率的关系为n b > n c > R a,因此光穿过三棱镜时 b 光偏折最大,c 光次之,a 光最小,应选 C, ABD 错误.4.〔2021天津卷〕我国核聚变反响研究大科学装置人造太阳〞2021年获得重大突破,等离子体中央电子温度首次到达1亿度,为人类开发利用核聚变能源奠定了重要的技术根底.以下关于聚变的说法正确的A.核聚变比核裂变更为平安、清洁B.任何两个原子核都可以发生聚变C.两个轻核结合成质量较大的核,总质量较聚变前增加D.两个轻核结合成质量较大的核,核子的比结合能增加【答案】AD【解析】核聚变的最终产物时氨气无污染,而核裂变会产生固体核废料,因此核聚变更加清洁和平安,A 正确;发生核聚变需要在高温高压下进行,大核不能发生核聚变,故B 错误;核聚变反响会放出大量【解析】由光电效应的方程 E k = hv -W ,动能定理eU = E k ,两式联立可得hv W --—一,故截止电 e e的能量,根据质能关系可知反响会发生质量亏损,故C错误;因聚变反响放出能量,因此反响前的比结合能小于反响后的比结合能,故D正确.5.〔2021江苏卷〕100年前,卢瑟福用淞子轰击氮核打出了质子.后来,人们用瓶子轰击28Ni核也打出了质子:4He+20NiT 22Cu+1H +X ;该反响中的X是〔选填电子〞正电子〞或中子〞〕.此后,对原子核反响的持续研究为核能利用提供了可能. 目前人类获得核能的主要方式是〔选填核衰变〞核裂变"或核聚变〞〕.【答案】中子核裂变1【解析】由质量数和电荷数守恒得:X应为:0n即为中子,由于衰变是自发的,且周期与外界因素无关, 核聚变目前还无法限制,所以目前获得核能的主要方式是核裂变;6.〔2021江苏卷〕在焊接〞视网膜的眼科手术中,所用激光的波长入=6.4 X7im,每个激光脉冲的能量E=1.5 10-2J.求每个脉冲中的光子数目.〔普朗克常量h=6.63相-34Js,光速c=3X108m/s.计算结果保存一位有效数字〕【答案】光子能量;=hc ,光子数目n=-,代入数据得n=5 X1016 九zc【斛析】母个无子的目匕重为E°=hv = h—,每个激光脉冲的能量为E,所以每个脉冲中的光子个数为:九N ,联立且代入数据解得:N =5父1016个.E07.〔2021浙江选考〕处于较高能级的氢原子向较低能级跃迁时,能辐射出a、b两种可见光,a光照射某金属外表时有光电子逸出, b光照射该金属外表时没有光电子逸出,那么A.以相同的入射角射向一平行玻璃砖, a光的侧移量小于b光的B.垂直入射到同一单缝衍射装置, a光的衍射中央亮条纹宽度小于b光的C,a光和b光的频率之比可能是20/27D,a光子的动量大于b光子的【答案】BD【解析】根据题意可知a光频率低于b光频率,玻璃砖对a光的折射率大于对b光的折射率,b 光的折射率较小,以相同角度斜射到同一玻璃板透过平行外表后, b光的折射角较大,所以b 光侧移量小,即a光的侧移量大于b光的,A错误;频率越大,波长越小,通过同一单缝衍射装置时,中央亮条纹宽度越小, B正确;a光的频率大,故频率之比不可能为空,C错误;频27h .率越大,波长越小,即九a <,也,根据儿=一可知Pa > Pb , D正确.P【点睛】此题关键是知道光的频率越大,那么其波长越小,同一光学器件对其的折射率越大,通过同一单缝衍射装置时中央亮条纹宽度越小.8.〔2021浙江选考〕一个被原子核〔7Be〕俘获一个核外电子〔通常是最靠近原子核的K壳层的电子〕后发生衰变,生成一个锂核〔7Li〕,并放出一个不带电的质量接近零的中微子洋人们把这种衰变称为“K俘获〞.静止的被核发生零“K俘获〞,其核反响方程为:Be+teT ;Li+v e被原子的质量为MBe=7.016929u ,锂原子的质量为Mu=7.016004u, 1u相当于9.31 102MeV o以下说法正确的选项是A,中微子的质量数和电荷数均为零B.锂核〔7Li〕获得的动能约为0.86MeVC.中微子与锂核〔7Li 〕的动量之和等于反响前电子的动量D.中微子与锂核〔7Li 〕的能量之和等于反响前电子的能量【答案】AC【解析】反响方程为;Be+-0eT ;Li+V e,根据质量数和电荷数守恒可知中微子的质量数和电荷数均为零,A 正确;根据质能方程,质量减少 2.△m=〔7.016929u-7.016004尸9.31父10 MeV >0.86MeV ,为释放的核能,不是锂核获得的动能,B错误;衰变过程中内力远大于外力,故反响前后动量守恒,故中微子与锂核〔;Li 〕的动量之和等于反响前电子的动量, C正确;由于反响过程中存在质量亏损,所以中微子与锂核〔;Li 〕的能量之和小于反响前电子的能量, D错误.4,, 14 —17八、.,9.〔2021北京卷〕在核反响方程2He+ 7N t8O+X中,X表小的是A.质子B.中子C.电子D. “粒子【答案】A【解析】设X为:;Z X,根据核反响的质量数守恒:4+14=17+Z,那么:Z =1,电荷数守恒:2 + 7 = 8+A,1那么A =1 ,即X为:I H为质子,应选项A正确,BCD错误.点睛:此题考查了核反响方程式,要根据电荷数守恒、质量数守恒得出X的电荷数和质量数,从而确定X的种类.19 10.〔2021全国II卷〕用波长为300 nm的光照射锌板,电子逸出锌板外表的最大初动能为 1.28*10 J. 普朗克常量为6.63 x 10$4 J s,真空中的光速为3.00X 108msL能使锌产生光电效应的单色光的最低频率约为A. 1 x 1014HzB.8 1014HzC. 2 1015HzD.8 1015Hz【答案】B【解析】知道光电效应方程E k =h v -W O;知道逸出功W0 = hY0并结合两个公式求解.由光电效应方c程式得:Ek =h" -W0,得:W0 =h v — Ek =h—— Ek,刚好发生光电效应的临界频率为汽,那么W0 = hv0,九代入数据可得:V O =8父1014Hz ,故B正确.11.〔2021天津卷〕氢原子光谱在可见光区域内有四条谱线H「Hp、H ? H s,都是氢原子中电子从量子数n>2的能级跃迁到n=2的能级发出的光,它们在真空中的波长由长到短,可以判定A. H a对应的前后能级之差最小B.同一介质对Ha的折射率最大C.同一介质中H 6的传播速度最大D .用H 丫照射某一金属能发生光电效应,那么H B也一定能【答案】A【解析】根据h v = E m -E n分析前后能级差的大小;根据折射率与频率的关系分析折射率的大小;根g c据V =一判断传播速度的大小;根据发生光电效应现象的条件是入射光的频率大于该光的极限频率判断n是否会发生光电效应. 波长越大,频率越小,故Ha的频率最小,根据E = hv可知H &对应的能量最小,根据h v =E m -巳可知H 0对应的前后能级之差最小, A正确;H 0的频率最小,同一介质对应的折射c率最小,根据v =—可知Ha的传播速度最大,BC错误;Hy的波长小于H§的波长,故H?的频率大于Hp的频率,假设用Hy照射某一金属能发生光电效应,那么Hp不一定能,D错误.【点睛】光的波长越大,频率越小,同一介质对其的折射率越小,光子的能量越小.12.〔2021天津卷〕国家大科学过程一一中国散裂中子源〔CSNS〕于2021年8月28日首次打靶成功,获得中子束流,可以为诸多领域的研究和工业应用提供先进的研究平台,以下核反响中放出的粒子为中子的是14 17 . .............................A.7 N俘获一个a粒子,产生8.并放出一个粒子27 30 .............................B.13AI俘获一个a粒子,产生15P并放出一个粒子C.51B俘获一个质子,产生4 Be并放出一个粒子D.3Li俘获一个质子,产生3He并放出一个粒子【答案】B【解析】根据质量数和电荷数守恒可知四个核反响方程分别为74N +4 He T 87O +1 H、27 …4,> 30 _1 11 4,・8_ 7,. 6.. 4.. 3.. 7..13 AI +2 He T 15 P +o n、5 B +2 HeT 4 Be+3 Li , 3U +2 He T 2 He+3 Li ,故只有B 选项符合题意;【点睛】核反响过程中,质量数与核电荷数守恒,应用质量数与核电荷数守恒即可写出核反响方程式. 27…13.〔2021全国III卷〕1934年,约里奥吊里夫妇用a粒子轰击铝核13AI ,产生了第一个人工放射性核素27 .X:廿13AI T n+X.X的原子序数和质量数分别为A. 15 和28B. 15 和30C. 16 和30D. 17 和31【答案】B【解析】根据核反响遵循的质量数守恒和电荷数守恒可知, X的电荷数为2+13=15,质量数为4+27 1 =30,根据原子核的电荷数等于原子序数,可知X的原子序数为15,质量数为30,选项B正确.14.〔2021天津卷〕我国自主研发制造的国际热核聚变核心部件在国际上率先通过权威机构认证,这是我国对国际热核聚变工程的重大奉献.以下核反响方程中属于聚变反响的是2 3 4 1 14 4 17 1 IA. 1H +〔H T2He + 0n B, 7N +2He T 8O+1H4,, 27 A , 30 1 235 .. 1 144 89 1C. 2He 13AI 1 15P , 0nD. 92U 0n * 56Ba 36Kr 30n【答案】A2 一一3 一一4 一一1【解析】1H+〔H T2H e十0是一个笊核与一个瓶核结合成一个氨核,同时放出一个中子, 属于聚变反响,故A 正确;17N +4He T 17O +;H 是卢瑟福发现质子的核反响,他用“粒子轰击氮原子核,产生氧的同位素 一一氧17和一个质子,是人类第一次实现的原子核的人工转变,属于人工核反响,故…427301B 错误;2He +13AI t 15P 十 °n 是小居里夫妇用 “粒子轰击铝片时发现了放射性磷(磷 30),属于人2351144891工核反响,故C 错误;92U +°n T 56Ba + 36Kr +3.n 是一种典型的铀核裂变,属于裂变反响,故 D 错误.【名师点睛】此题的关键是知道核反响的分类,区别衰变和核反响.(2021新课标I 卷)大科学工程 人造太阳〞主要是将笊核聚变反响释放的能量用来发电.笊核聚变反 2・23・1231应万程是1H + 1 H-2He+o n .〔H 的质量为2.013 6 u, 2He 的质量为3.015 0 u, o n 的质量为1.008 7 u, 1 u=931 MeV/c2.笊核聚变反响中释放的核能约为 A.3.7 MeV B , 3.3 MeV C, 2.7 MeV D , 0.93 MeV【答案】B【解析】根据质能方程,释放的核能A E = Amc 2 , A m =2m H —m^ -m n = 0.003 5u ,那么2 2EE =0.0035ux931 MeV/c 2x c 2=3.2585MeV 也3.3MeV ,故 B 正确,ACD 错误.【名师点睛】此题考查质能方程,注意原子核的质量单位不是 k g,由质能方程求核能时要细心.(2021江苏卷)原子核的比结合能曲线如下图,根据该曲线,以下判断中正确的有4(A) 2He 核的结合能约为14 MeV (B) 2He 核比3Li 核更稳定(C)两个2H 核结合成4He 核时释放能量(D) 235U 核中核子的平均结合能比 36Kr 核中的大【答案】BC44・,【解析】由图知2He 核的比结合能约为 7 MeV,所以结合能约为 4X7=28 MeV,故A 错误;2 He 核比15.16.10 20 5tt 100 150 200 250:Li核的比结合能大,所以4He核比6Li核更稳定,B正确;两个2H核结合成4He核时,即由比结合能小的反响生成比结合能大的释放能量, C正确;由图知235U核中核子的平均结合能比36Kr核中的小, 所以D错误.【名师点睛】此题主要是要理解比结合能的含义,知道结合能与比结合能的区分与关系.以及在核反应过程中由比结合能小的反响生成比结合能大的要释放能量.17.〔2021新课标出卷〕在光电效应实验中,分别用频率为培、力的单色光a、b照射到同种金属上,测得相应的遏止电压分别为U a和U b、光电子的最大初动能分别为E ka和E kb.h为普朗克常量.以下说法正确的是A.假设w>也那么一■定有U a<U bB.假设汨> 那么一■定有E ka>E kbC.假设U a<U b,那么一定有E ka<E kbD.假设山> 场那么一■定有h ^a -E ka>h J D -E kb【答案】BC【解析】由爱因斯坦光电效应方程E km =hv —W,又由动能定理有E km =eU,当V a >九时,E ka > E^ ,U a >U b, A错误,B正确;假设U a <U b,那么有E ka < E kb , C正确;同种金属的逸出功不变,那么W=hv—E km不变,D错误.【名师点睛】此题主要考查光电效应.发生光电效应的条件是入射光的频率大于金属的极限频率,光的强弱只影响单位时间内发出光电子的数目;光电子的最大初动能和遏止电压由照射光的频率和金属的逸出功决定;逸出功由金属本身决定,与光的频率无关.18.〔2021北京卷〕2021年年初,我国研制的大连光源〞一一极紫外自由电子激光装置,发出了波长在1-900 nm 〔1 nm=10 m〕附近连续可调的世界上最强的极紫外激光脉冲.大连光源因其光子的能量大、密度高,可在能源利用、光刻技术、雾霾治理等领域的研究中发挥重要作用.一个处于极紫外波段的光子所具有的能量可以电离一个分子,但又不会把分子打碎.据此判断,能够电离一个分子的能量约为〔取普朗克常量h=6.6M0S4 J s,真空光速c=3M08m/s〕_ . _ _21 _ _ / ——18 . 八1 ——15 . _ / ——12 .A. 10 JB. 10 JC. 10 JD. 10 J【答案】Bhc【解析】一个处于极紫外波段的光子的能量约为 E = —%2父1078 J ,由题意可知,光子的能量应比电九离一个分子的能量稍大,因此数量级应相同,应选B o【名师点睛】根据题意可知光子的能量足以电离一个分子,因此该光子的能量应比该分子的电离能大, 同时又不能把分子打碎,因此两者能量具有相同的数量级,不能大太多.19. 〔2021新课标n 卷〕一静止的铀核放出一个 a 粒子衰变成社核,衰变方程为2;;U T 23;0Th+:He .下列说法正确的选项是A,衰变后社核的动能等于 a 粒子的动能B.衰变后社核的动量大小等于 a 粒子的动量大小C.铀核的半衰期等于其放出一个a 粒子所经历的时间D,衰变后“粒子与社核的质量之和等于衰变前铀核的质量【答案】B【解析】根据动量守恒定律可知,生成的社核的动量与a 粒子的动量等大反向,选项 B 正确;根据2E k=上一可知,衰变后社核的动能小于a 粒子的动能,选项 A 错误;铀核的半衰期等于一半数量的铀2m核衰变需要的时间,而放出一个 a 粒子所经历的时间是一个原子核衰变的时间,故两者不等,选项 C错误;由于该反响放出能量,由质能方程可知,衰变后a 粒子与社核的质量之和小于衰变前铀核的质量, 选项D 错误;应选B .【名师点睛】此题考查了原子核的反冲问题以及对半衰期的理解;对于有能量放出的核反响,质量数-一 一 1・・ 一 4・20 . 〔2021江苏卷〕质子〔i H 〕和a 粒子〔2H 〕被加速到相同动能时,质子的动量 〔选填 夭于、小于〞或 等于“〕a 粒子的动量,质子和 a 粒子的德布罗意波波长之比为 .【答案】小于 2:1【解析】动量与动能的关系: p 2 =2mEk ,又质子的质量小于 a 粒子的质量所以质子的动量小于 a 粒子的动量,且 坨=J m =1;根据h=~,可得质子和a 粒子的德布罗意波波长之比为2:1.P 2 , m 2 2 p【名师点睛】考查公式,动量与动能的关系以及物质的波的波长和公式,较容易.21 . 〔2021北京卷〕在磁感应强度为 B 的匀强磁场中,一个静止的放射性原子核发生了一次a 衰变.放射出的a 粒子〔4He 〕在与磁场垂直的平面内做圆周运动,其轨道半径为 Ro 以m 、q 分别表示a 粒子的质量和电荷量.守恒,但是质量不守恒;知道动量和动能的关系E k2P 2m(1)放射性原子核用A X 表示,新核的元素符号用 丫表示,写出该 “衰变的核反响方程. (2) a 粒子的圆周运动可以等效成一个环形电流,求圆周运动的周期和环形电流大小. (3)设该衰变过程释放的核能都转为为a 粒子和新核的动能,新核的质量为 M,求衰变过程的质量亏损Am .A A 4 4“衰变的核反响方程为Z X T Z ^Y +2He2(2)设a 粒子在磁场中做圆周运动的速度大小为v,由洛伦兹力提供向心力有 qvB = m--R.......................... 2市根据圆周运动的参量关系有 T =MRv得a 粒子在磁场中运动的周期 T =2变qB根据电流强度定义式,可得环形电流大小为। =?=〞■T 2 7ml.4 v 2qBR(3)由 qvB =m —,得 v = —m-设衰变后新核 Y 的速度大小为v',核反响前后系统动量守恒,有 Mv' mv=0........................................................................................ c 1 .c 1c 根据爱因斯坦质能方程和能量守恒定律有 Amc 2=1Mv 2+」mv 22 2____ 2解得」.:m =(M m)(qB R) 2mMc 2.................... A - 4说明:假设利用M =——m 解答,亦可.4【名师点睛】(1)无论哪种核反响方程,都必须遵循质量数、电荷数守恒.(2) a 衰变的生成物是两种带电荷量不同的带电粒子〞,反响前后系统动量守恒,因此反响后的两产物向相反方向运动,在匀强磁场中,受洛伦兹力作用将各自做匀速圆周运动,且两轨迹圆相外切,应 用洛伦兹力计算公式和向心力公式即可求解运动周期,根据电流强度的定义式可求解电流大小.【答案】(1)「X T号丫 +2He2 Tim⑵二q 2B 2 Tim____ 2(M +m)(qBR) \ 3 / 92mMc【解析】(1)根据核反响中质量数与电荷数守恒可知,该可得v .=mvMqBR M(3)核反响中释放的核能应利用爱因斯坦质能方程求解,在结合动量守恒定律与能量守恒定律即可解得质量亏损.。
高考化学总复习鸭部分物质结构与性质第1节原子结构与性质高考真题实践新人教版06123305.doc

第1节原子结构与性质1.[2017·高考全国卷Ⅲ,35(1)]研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH +H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
Co基态原子核外电子排布式为。
元素Mn与O中,第一电离能较大的是,基态原子核外未成对电子数较多的是。
解析:根据构造原理可写出Co基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。
O是非金属元素,而Mn是金属元素,前者易得电子而不易失电子,后者则反之,所以O的第一电离能大于Mn。
Mn和O的基态原子核外电子排布式分别为1s22s22p63s23p63d54s2、1s22s22p4,前者的3d轨道中5个电子均未成对,后者的2p轨道中有2个电子未成对,所以Mn的基态原子核外未成对电子数较多。
答案:1s22s22p63s23p63d74s2(或[Ar]3d74s2) O Mn2.[2016·高考全国卷Ⅰ,37(1)(4)]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
回答下列问题:(1)基态Ge原子的核外电子排布式为[Ar] ,有个未成对电子。
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。
Zn、Ge、O电负性由大至小的顺序是。
解析:(1)在元素周期表中,锗位于硅正下方,锗的原子序数为14+18=32,基态锗原子的核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,由于4p能级有3个能量相同的轨道,根据洪特规则,4p上2个电子分别占据两个轨道且自旋状态相同,故未成对电子数为2。
(2)锌、锗位于同周期,同一周期从左至右元素的电负性逐渐增大(稀有气体元素除外),而氧位于元素周期表右上角,电负性仅次于氟,由此得出氧、锗、锌的电负性依次减小。
答案:(1)3d104s24p2 2 (2)O>Ge>Zn3.[2016·高考全国卷Ⅲ,37(1)(2)]砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
【精选】高考化学新课标一轮集训:原子结构与性质(含解析)

精选高考化学复习资料A组双基题组1.下列各项叙述中,正确的是()A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同D.24Cr原子的电子排布式是1s22s22p63s23p63d44s2【解析】A项镁原子由基态转化为激发态,要吸收能量;价电子排布为5s25p1的元素位于第五周期第ⅢA族,是p区元素;原子轨道处于全空、全满或半充满状态时,能量最低,故24Cr原子的电子排布式应是1s22s22p63s23p63d54s1。
【答案】 C2.现有①、②、③三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3。
则下列有关比较中正确的是()A.第一电离能:③>②>①B.原子半径:③>②>①C.电负性:③>②>①D.最高正化合价:③>②>①【解析】由基态原子的电子排布式可知①、②、③分别为S、P、N。
P原子由于3p轨道处于半充满的稳定状态,故其第一电离能大于S,因此三者第一电离能大小关系为N>P>S;原子半径P最大;电负性:N>S>P;S的最高正化合价最高,为+6,N、P为+5。
【答案】 A3.(选修3P24T7改编)化合物YX2、ZX2中,X、Y、Z都是前三周期的元素,X与Y属于同一周期,Z是X的同族元素,Z元素核内有16个质子,Y元素最外层电子数是K层所能容纳的电子数的2倍。
(1)Y的电子排布图为_________________________________。
(2)X的价层电子排布式__________________________________。
(3)Z的原子结构示意图__________________________________。
高考物理新近代物理知识点之原子结构真题汇编含答案解析

高考物理新近代物理知识点之原子结构真题汇编含答案解析一、选择题1.下列有关四幅图的说法中,正确的是( )A.α粒子散射实验证实了汤姆逊原子枣糕模型的正确性B.在光颜色保持不变的情况下,入射光越强,饱和光电流越大C.放射线甲由α粒子组成,每个粒子带两个单位正电荷D.该链式反应属于原子核的聚变反应2.关于近代物理,下列说法正确的是()A.放射性元素的半衰期随温度的升高而变短B.α粒子散射实验证明了原子的核式结构C.α、β、γ射线比较,α射线的穿透能力最强D.光电效应现象揭示了光的波动性3.氢原子光谱在可见光区域内有四条谱线,都是氢原子中电子从量子数n>2的能级跃迁到n=2的能级发出的光,它们在真空中的波长由长到短,可以判定A.对应的前后能级之差最小B.同一介质对的折射率最大C.同一介质中的传播速度最大D.用照射某一金属能发生光电效应,则也一定能4.下列说法正确的是()A.“光电效应”现象表明光具有波动性B.电子的发现揭示了原子不是构成物质的最小微粒C.天然放射现象表明原子可以再分D.卢瑟福根据“α粒子散射”实验建立原子结构“枣糕模型”5.下列有关原子结构和原子核的认识,其中正确的是.A.γ射线是高速运动的电子流B.氢原子辐射光子后,其绕核运动的电子动能增大C.太阳辐射能量的主要来源是太阳中发生的重核裂变D.21083Bi的半衰期是5天,100克21083Bi经过10天后还剩下50克n=的激发态的氢原子,能够自发跃迁6.如图所示为氢原子的能级图,一群处于量子数4到较低的能量状态,并向外辐射光子.已知可见光的光子的能量范围为1.64~3.19 eV,锌板的逸出功为3.34 eV,则向外辐射的多种频率的光子中A.最多有4种频率的光子B.最多有3种频率的可见光C.能使锌板发生光电效应的最多有4种频率的光子D.能使锌板发射出来的光电子,其初动能的最大值为9.41 eV7.如图所示为氢原子的能级示意图,假设氢原子从n能级向较低的各能级跃迁的概率均为11 n-。
高考化学原子结构与性质一轮复习(解析版)

原子结构与性质一、单选题1.下列比较正确的是()①与冷水的反应速率:K>Na>Mg②热稳定性:HF>H2Se>H2S③结合质子的能力:CH3CH2O->CH3COO->HCO3-④离子半径:Cl->O2->Al3+A.①④B.②③C.②④D.①③【答案】A【解析】①金属性越强,与水反应越剧烈,金属性: K>Na>Mg,与冷水的反应速率: K>Na>Mg,故正确;②非金属性越强,气态氢化物越稳定,非金属性:F>S>Se,所以热稳定性: HF>H2S>H2Se,故错误;③酸性越弱,酸越难电离,对应的酸根离子越易结合氢离子,乙酸的酸性大于碳酸,乙醇为中性,所以结合质子的能力: CH3CH2O->HCO3->CH3COO-,故错误;④电子层数越多半径越大,核外电子数相同的,原子序数越大,半径越小, Cl-有3个电子层, O2-、Al3+有2个电子层,O的原子序数小所以O2-半径比Al3+大,所以离子半径: Cl->O2->Al3+,故正确;结合以上分析可知,只有所以正确的有①④;综上所述,本题正确选项A。
2.铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag =Tl+ +2Ag+ 且已知Ag++Fe2+=" Ag" + Fe3+ 则下列推断正确的是()A.Tl+最外层有3个电子B.氧化性:Tl3+ >Ag+>Fe3+C.还原性:Tl+>Ag D.铊位于第五周期IIIA族【答案】B【解析】A、铊(Tl)与铝同主族,主族元素原子最外层电子相同,选项A错误;B、Tl3++2Ag=Tl+ +2Ag+,且Ag++Fe2+=Ag+Fe3+,氧化剂Tl3+的氧化性大于氧化产物Ag+,氧化剂Ag+的氧化性大于氧化产物Fe3+,所以氧化性顺序为Tl3+>Ag+>Fe3+,选项B正确;C、Tl3++2Ag=Tl++2Ag+,反应中还原剂Ag的还原性大于还原产物Tl+,选项C错误;D、原子序数为81,和铝同主族,结合核外电子排布规律写出原子结构示意图判断,铊位于第六周期第ⅢA族,选项D错误;答案选B。
2024高考试题汇编——原子结构与性质原卷版 - 副本
2024高考专题汇编——原子结构与性质 考向1:原子结构、核外电子排布图(式)(2024上海卷2)1. 下列关于18F 与19F 说法正确的是 A. 是同种核素 B. 是同素异形体 C.19F 比18F 多一个电子 D.19F 比18F 多一个中子(2024甘肃卷2)2. 下列化学用语表述错误的是A. 2+Ca 和-Cl 的最外层电子排布图均为B. 3PH 和2H S 的电子式分别为和C. 2223CH =CHCH CH CH 的分子结构模型为D.126C 、136C 和146C 互为同位素(2024山东卷3)3.下列化学用语或图示正确的是A. 的系统命名:2-甲基苯酚B. 3O 分子的球棍模型:C. 激发态H 原子的轨道表示式:D. p-p π键形成的轨道重叠示意图:(2023湖南卷2)4. 下列化学用语表述错误的是 A. HClO 的电子式:B. 中子数为10的氧原子:188OC. NH 3分子的VSEPR 模型:D. 基态N 原子的价层电子排布图:(2023浙江卷1月3)5. 下列化学用语表示正确的是 A. 中子数为18的氯原子:3717Cl B. 碳的基态原子轨道表示式:C. 3BF 的空间结构:(平面三角形)D. HCl 的形成过程:(2023北京卷2)6. 下列化学用语或图示表达正确的是 A. NaCl 的电子式为Na Cl ::B. 3NH 的VSEPR 模型为C. z 2p 电子云图为D. 基态24Cr 原子的价层电子轨道表示式为(2023海南卷4)7. 下列有关元素单质或化合物的叙述正确的是 A. 4P 分子呈正四面体,键角为10928'︒ B. NaCl 焰色试验为黄色,与Cl 电子跃迁有关 C. Cu 基态原子核外电子排布符合构造原理 D. 2OF 是由极性键构成的极性分子 考向2:电负性、第一电离能变化规律考查(2024北京卷12)8.下列依据相关数据作出的推断中,不正确的是( ) A .依据相同温度下可逆反应的Q 与K 大小的比较,可推断反应进行的方向 B .依据一元弱酸的a K ,可推断它们同温度同浓度稀溶液的pH 大小C .依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大D .依据F Cl Br I 、、、的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱 (2024河北卷7)9.侯氏制碱法工艺流程中的主反应为32234QR+YW +XZ +W Z QWXZ +YW R =,其中W 、X 、Y 、Z 、Q 、R 分别代表相关化学元素。
高中化学第一章原子结构与性质测评含解析第二册

第一章测评(时间:90分钟满分:100分)可能用到的相对原子质量:H 1 C 12Si 28P 31Cl 35。
5一、选择题(本题包括10个小题,每小题只有一个选项符合题意。
每小题2分,共20分)1。
对充有氖气的霓虹灯管通电,灯管发出红色光。
产生这一现象的主要原因是()A。
电子由激发态向基态跃迁时以红光的形式释放能量B。
电子由基态向激发态跃迁时吸收除红光以外的光线C.氖原子获得电子后转变成发出红光的物质D.在电流的作用下,氖原子与构成灯管的物质发生反应灯管发出红色光的原因是电子从激发态(高能量态)跃迁到基态(低能量态)时释放的能量以红光的形式表现出来。
2.在学习核外电子排布知识时,甲、乙两小组对多电子原子能级的有关知识产生了分歧:甲组认为第三周期元素的基态原子中,不可能出现d电子,而乙组认为第三周期元素基态原子中一定有d电子,下列可作为甲组论据的是()A。
能量守恒原理B.泡利不相容原理C.洪特规则D。
3d能级能量比4s能级高3个电子层,因为3d能级能量比4s能级高,3d能级中的电子必然在4s能级填满电子后才能填充,故当填充3d能级时电子层已变为了4层.3.下列原子的价电子排布式或价电子轨道表示式中,①、②两种状态的能量符合E(①)>E(②)的是()A。
氮原子:B。
钠原子:①3s1②3p1C。
铬原子:①3d54s1②3d44s2D。
碳原子:项中,②状态2p能级半充满,能量相对较低.4。
原子序数为83的元素位于:①第五周期②第六周期③ⅣA族④ⅤA族⑤ⅡB族,其中正确的组合是()A.①④B。
②③C.②④D。
①⑤依据其原子结构示意图或电子排布式,根据电子层数确定其所在周期,根据最外层电子数确定其所在族,但用0族元素定位法更为方便,即根据与该元素原子序数最接近的0族元素的位置来确定。
与83号元素最邻近的0族元素为86号元素氡,83号元素比氡的原子序数小3,故该元素在周期表中的位置应该是氡左移3个格,即第六周期第ⅤA族。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选修三《物质结构与性质》高考考点真题分类汇编与解析第一章原子结构与性质一、原子结构1、原子结构,原子核外电子排布。
【2019新课标Ⅱ】(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
【答案】4s 4f5【解析】Fe为26号元素,Fe原子核外电子排布式为1s22s22p63s23p63d64s2,Fe原子失去1个电子使4s轨道为半充满状态,能量较低,故首先失去4s轨道电子;Sm的价电子排布式为4f66s2,失去3个电子变成Sm3+成为稳定状态,则应先失去能量较高的4s电子,所以Sm3+的价电子排布式为为4f5,故答案为:4s;4f5;【2019新课标Ⅲ】(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_________(填“相同”或“相反”)。
【答案】Mg 相反【解析】根据元素周期表和对角线原则可知与锂化学性质相似的是镁,镁的最外层电子数是2,占据s轨道,s轨道最多容纳2个电子,所以自旋方向相反。
【2019江苏】(1)Cu2+基态核外电子排布式为_______________________。
【答案】[Ar]3d9或1s22s22p63s23p63d9【解析】Cu位于第四周期IB族,其价电子排布式为3d104s1,因此Cu2+基态核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9;【2018新课标Ⅰ卷】(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.B.C.D.【答案】D C【解析】根据核外电子排布规律可知Li的基态核外电子排布式为1s22s1,则D中能量最低;选项C中有2个电子处于2p能级上,能量最高;【2018新课标Ⅱ卷】(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
【答案】哑铃(纺锤)【解析】基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,则其价层电子的电子排布图(轨道表达式)为;基态S原子的核外电子排布式为1s22s22p63s23p4,则电子占据最高能级是3p,其电子云轮廓图为哑铃(纺锤)形。
【2018新课标Ⅲ卷】(1)Zn原子核外电子排布式为________________。
【答案】[Ar]3d104s2【解析】Zn是第30号元素,所以核外电子排布式为[Ar]3d104s2。
【2018江苏卷】(2)Fe2+基态核外电子排布式为__________________。
【答案】[Ar]3d6或1s22s22p63s23p63d6【解析】Fe原子核外有26个电子,根据构造原理写出基态Fe的核外电子排布式,进一步写出Fe2+的核外电子排布式。
【2018海南卷】下列基态原子或离子的价层电子排布图正确的_____________。
【答案】CD【解析】电子排布应先排满低能轨道,再排满高能轨道,因此,B不符合题意,而失去电子时,应先失去高能轨道电子,故CD符合题意。
【2017江苏】(1)Fe3+基态核外电子排布式为____________________。
【答案】[Ar]3d5或1s22s22p63s23p63d5【解析】铁是26号,Fe3+基态核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5。
【2017新课标Ⅰ】(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm (填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5(2)基态K原子中,核外电子占据最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。
【答案】(1)A (2)N 球形【解析】(1)紫色波长400 nm~435 nm,因此选项A正确。
(2)K位于第四周期IA族,电子占据最高能层是第四层,即N层,最后一个电子填充在s 能级上,电子云轮廓图为球形;【2017新课标Ⅱ】(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
【答案】【解析】N原子位于第二周期第VA族,价电子是最外层电子,即电子排布图是;【2017新课标Ⅲ】(1)Co基态原子核外电子排布式为_____________。
元素Mn与O中,基态原子核外未成对电子数较多的是_________________。
【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2Mn【解析】Co是27号元素,位于元素周期表第4周期第VIII族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。
元素Mn与O中,O元素的基态原子价电子排布式为2s22p4,所以其核外未成对电子数是2,而Mn元素的基态原子价电子排布式为3d54s2,所以其核外未成对电子数是5,因此核外未成对电子数较多的是Mn。
【2016年高考新课标Ⅰ卷】(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
【答案】3d104s24p2;2;【解析】Ge是32号元素,与碳元素是同一主族的元素,在元素周期表中位于第四周期第IV A;基态Ge原子的核外电子排布式为[Ar] 4s24p2,也可写为3d104s24p2;在其原子的最外层的2个4s电子是成对电子,位于4s轨道,2个4p电子分别位于2个不同的4p轨道上,所以基态Ge原子有2个未成对的电子;【2016年高考新课标Ⅱ卷】(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
【答案】1s22s22p63s23p63d84s2或[Ar] 3d84s2 2【解析】镍是28号元素,位于第四周期,第Ⅷ族,根据核外电子排布规则,其基态原子的电子排布式为1s22s2 2p63s23p63d84s2,3d能级有5个轨道,这5个轨道先占满5个自旋方向相同的电子,再分别占据三个轨道,电子自旋方向相反,所以未成对的电子数为2。
【2016年高考新课标Ⅲ卷】(1)写出基态As原子的核外电子排布式_________________。
【答案】1s22s22p63s23p63d104s24p3;【解析】As的原子序数是33,则基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3。
【2015新课标Ⅰ卷理综化学】碳及其化合物广泛存在于自然界中,回答下列问题:(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。
在基态原子中,核外存在对自旋相反的电子。
【答案】电子云 2【解析】电子云是处于一定空间运动状态的电子在原子核外出现的概率密度分布的形象化的描述;C原子的核外有6个电子,电子排布为1s22s22p2,其中1s、2s上的2对电子的自旋方向相反,而2p轨道的电子的自旋方向相同。
【2015新课标Ⅱ卷理综化学】A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。
回答下列问题:(1)其中C原子的核外电子排布式为__________。
【答案】1s22s22p63s23p3(或[Ne] 3s23p3)【解析】略【2015福建理综化学】(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO 和H2.①基态Ni原子的电子排布式为_______,该元素位于元素周期表的第_____族。
【答案】1s22s22p63s23p63d84s2或[Ar] 3d84s2;VIII;【解析】28号元素Ni的基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar] 3d84s2;,该元素位于元素周期表的第四周期第VIII族。
【2015海南化学】(1)钒在元素周期表中的位置为,其价层电子排布图为。
【答案】第4周期ⅤB族,电子排布图。
【解析】钒的核电荷数为23,则可以推知钒在元素周期表中的位置为第4周期VB族,其电子排布式为1s22s22p63s23p63d34s2,其价层电子排布式为3d34s2,则电子排布图为。
综上所述,本题答案是:第四周期第ⅤB族;。
2、微粒半径比较【2019新课标Ⅱ】(3)比较离子半径:F−__________O2−(填“大于”等于”或“小于”)。
【答案】小于【解析】F-和O2-的核外电子排布相同,核电荷数越大,则半径越小,故半径:F-<O2-,故答案为:小于;【2018新课标Ⅰ卷】(2)Li+与H−具有相同的电子构型,r(Li+)小于r(H−),原因是______。
【答案】Li+核电荷数较大【解析】由于锂的核电荷数较大,原子核对最外层电子的吸引力较大,因此Li+半径小于H -;【2016年高考新课标Ⅲ卷】(2)根据元素周期律,原子半径Ga_____________As,【答案】大于【解析】根据元素周期律,同周期自左向右原子半径逐渐减小,则原子半径Ga大于As。
3、电离能【错误提醒】解答此类问题时要注意审题,题目所要求的是否为第一电离能;如果是不同微粒第一电离能的比较按照金属性及非金属性强弱顺序及特殊规律;如果非指定第一电离能要注意题目隐含条件,原子的电离能或者离子的电离能。
【2019新课标1】(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
A.B.C.D.【答案】 A【解析】A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高; B. [Ne] 3s2属于基态Mg原子,其失去一个电子变为基态Mg+;C. [Ne] 3s13p1属于激发态Mg原子,其失去一个电子所需能量低于基态Mg原子;D.[Ne] 3p1属于激发态Mg+,其失去一个电子所需能量低于基态Mg+,综上所述,电离最外层一个电子所需能量最大的是[Ne]3s1,答案选A;【2018新课标Ⅰ卷】(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。
第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。
原因是________________。
【答案】大于Zn核外电子排布为全满稳定结构,较难失电子【解析】Zn的第一电离能应该高于Cu的第一电离能,原因是,Zn的核外电子排布已经达到了每个能级都是全满的稳定结构,所以失电子比较困难。
同时也可以考虑到Zn最外层上是一对电子,而Cu的最外层是一个电子,Zn电离最外层一个电子还要拆开电子对,额外吸收能量。
