03_SDS-PAGE分离胶配方表
SDS-PAGE分离胶配方表-及其原理

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDS-PAGE分离胶-浓缩胶配方
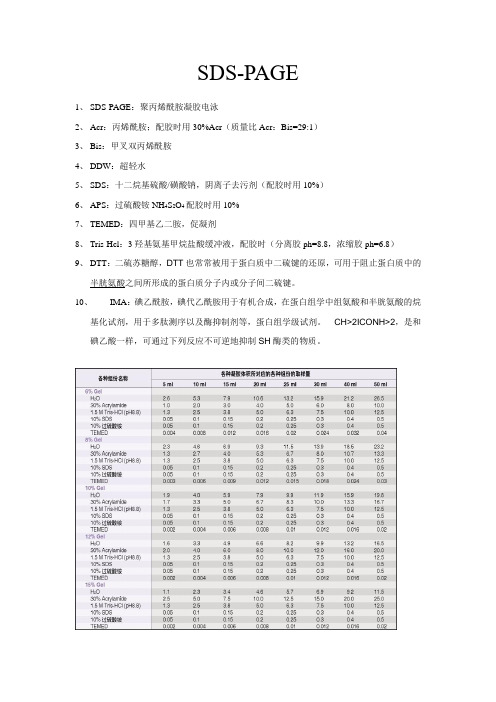
SDS-PAGE1、SDS-PAGE:聚丙烯酰胺凝胶电泳2、Acr:丙烯酰胺;配胶时用30%Acr(质量比Acr:Bis=29:1)3、Bis:甲叉双丙烯酰胺4、DDW:超轻水5、SDS:十二烷基硫酸/磺酸钠,阴离子去污剂(配胶时用10%)6、APS:过硫酸铵NH4S2O4配胶时用10%7、TEMED:四甲基乙二胺,促凝剂8、Tris-Hcl:3羟基氨基甲烷盐酸缓冲液,配胶时(分离胶ph=8.8,浓缩胶ph=6.8)9、DTT:二硫苏糖醇,DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA:碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH酶类的物质。
1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶(也称堆积胶、积层胶或上层胶):TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
SDS-PAGE分离胶配方表-及其原理之欧阳化创编

SDSPAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDSPAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl -,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDS-PAGE分离胶配方表-及其原理

SDSPAGE电泳原理:之宇文皓月创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据分歧蛋白质分子所带电荷的差别及分子大小的分歧所发生的分歧迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子概况活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超出其自己原有的电荷,掩盖了各种蛋白分子间天然的电荷差别。
因此,各种蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDSPAGE 可设法将电泳时蛋白质电荷差别这一因素除去或减小到可以略而不计的程度,因此经常使用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采取垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDS-PAGE分离胶-浓缩胶配方

SDS-PAGE1、SDS-PAGE :聚丙烯酰胺凝胶电泳2、Acr :丙烯酰胺;配胶时用30%Acr (质量比Acr :Bis=29:1)3、Bis :甲叉双丙烯酰胺4、DDW :超轻水5、SDS :十二烷基硫酸/磺酸钠,阴离子去污剂(配胶时用10%)6、APS :过硫酸铵NH 4S 2O 4配胶时用10%7、TEMED :四甲基乙二胺,促凝剂8、Tris-Hcl :3羟基氨基甲烷盐酸缓冲液,配胶时(分离胶ph=8.8,浓缩胶ph=6.8) 9、DTT :二硫苏糖醇,DTT 也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA :碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH 酶类的物质。
5酣TO mlmt 20ml30祝4Qmd50ml6%Bd叫匸2.6 5.3 7.9 10.6 132 15.9 21.2 26.5 30%Atiylamde10 2.0 3.0 4.0 50 60 ao 10.0 15M Trls-HCl (pHS.Sl 1.3 2.5 33 5,0 6.3 7.5 100 125 lO^iSDSC05 01 015 0.2 025 03 04 0.5 10%过谦酸霰 CQ5 01 015 12 025 03 04 05 TEMED CO3400080G123.0160020C240032 004 8%姑2.3 4S S.93.3 11.5 13.S 18.5 232 30%Acrylamde 13 2.7 40 5.3 S.7 a.o 107 13^ 15M Trls-HCII'pHS S'I 1.3 2.5 38 5.0 63 75 100 1£.5 ItPiSDSC.05 0.1 0.16 X 0.25 0.3 0.4 0.5 彳贰过砺酸鞍COS QJ 0.S5 0.2 Q25 03 04 05 TEMEO C00300060W9D.01200t50G18 0024003 io^GelHiO19 4,0 5.9 7.9 &9 11S 159 19S Acryiamde 17 33 6.0 S.7 a.a too 13J 167 15M Trls-HCIipHsB) 13 25 3.8 5.0 63 7.5 W.O 1?5 I^SDSC.05 0.1 0.15 3.2 0.25 0.3 0.4 0.5 1贰■过硫股牧 C0501 0.15 £1.2 025 03 04 05 TEMED C(X)20034 0006 3.0C® 0.01 0012 0016 002 12%GalH J O16 33 49 5.e &2 $= 132 165 30陽3.0 40 SO B.O 100 12Q 160 20£l 1.5M Tris-HCI(pHS 印 13 25 30 5.0 6-3 75 100 1^5It^iSDSC.05 0.1 0.36 J 总 0.25 0.3 0.4 0.5 过硫鞭较C05 0.1 0.15 tl.2 025 03 Q4 05 TEMED CO320004 ooosO.OCf i0.01 0C12 0016 002 15%*l甌11 23 34 4-a 6 37 6.& 9? 11.5 30%A trylamde 2S SO 7.S 1U.0 125 150 2Q0 25a 15Ml Tris-HCIipHs 印 13 2.5 3.8 5.0 S3 7.5 100 125 10%SDSC.05 0.1 0.15 3.2 0.25 0.3 0.4 0.5 过盘盤钮COS 01 015 0.2 025 0.3 04 05 TEMEDCO^0004OOOSO.OCfl0010C12001E0.021)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE 的分离胶(即下层胶):Sap QFS f/cD时爭尸。
SDS-PAGE分离胶配方表-及其原理

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=,pK a=只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDS-PAGE分离胶配方表-及其原理

SDSPAGE电泳原理:之阿布丰王创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据分歧蛋白质分子所带电荷的差别及分子大小的分歧所发生的分歧迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子概况活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超出其自己原有的电荷,掩盖了各种蛋白分子间天然的电荷差别。
因此,各种蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDSPAGE 可设法将电泳时蛋白质电荷差别这一因素除去或减小到可以略而不计的程度,因此经常使用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采取垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDS-PAGE分离胶配方表-及其原理

SDSPAGE电泳原理:之吉白夕凡创作聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据分歧蛋白质分子所带电荷的差别及分子大小的分歧所发生的分歧迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子概况活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超出其自己原有的电荷,掩盖了各种蛋白分子间天然的电荷差别。
因此,各种蛋白质SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDSPAGE 可设法将电泳时蛋白质电荷差别这一因素除去或减小到可以略而不计的程度,因此经常使用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采取垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分离胶缓冲液(Tris—HCl,pH8.8),两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=6.0,pK a=9.7)只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDSPAGE分离胶配方表及其原理

S D S P A G E分离胶配方表及其原理The Standardization Office was revised on the afternoon of December 13, 2020SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
SDSPAGE分离胶配方表及其原理

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺简称Acr 和交联剂N;N’—亚甲基双丙烯酰胺简称Bis在催化剂作用下;聚合交联而成的具有网状立体结构的凝胶;并以此为支持物进行电泳..聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带;如果分离纯化的样品中只含有同一种蛋白质;蛋白质样品电泳后;就应只分离出一条区带..SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键;并按一定的比例和蛋白质分子结合成复合物;使蛋白质带负电荷的量远远超过其本身原有的电荷;掩盖了各种蛋白分子间天然的电荷差异..因此;各种蛋白质-SDS 复合物在电泳时的迁移率;不再受原有电荷和分子形状的影响;而只是棒长的函数..这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳简称SDS—PAGE..由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度;因此常用来鉴定蛋白质分离样品的纯化程度;如果被鉴定的蛋白质样品很纯;只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质;那么SDS—PAGE 后;就只出现一条蛋白质区带..TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合..过硫酸铵AP:提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基..SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统..本实验采用垂直板状不连续系统..所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成..1.蛋白样品浓缩效应在不连续电泳系统中;含有上、下槽缓冲液Tris—Gly;pH8.3、浓缩胶缓冲液Tris—HCl;pH6.8、分离胶缓冲液Tris—HCl;pH8.8;两种凝胶的浓度即孔径也不相同..在这种条件下;缓冲系统中的HCl 几乎全部解离成Cl-;两槽中的Gly pI=6.0;pK a=9.7只有很少部分解离成Gly 的负离子;而酸性蛋白质也可解离出负离子..这些离子在电泳时都向正极移动..C1—速度最快先导离子;其次为蛋白质;Gly 负离子最慢尾随离子..由于C1—很快超过蛋白离子;因此在其后面形成一个电导较低、电位梯度较陡的区域;该区电位梯度最高;这是在电泳过程中形成的电位梯度的不连续性;导致蛋白质和Gly 离子加快移动;结果使蛋白质在进入分离胶之前;快、慢离子之间浓缩成一薄层;有利于提高电泳的分辨率..2.分子筛效应蛋白质离子进入分离胶后;条件有很大变化..由于其pH 升高电泳进行时常超过9.0;使Gly 解离成负离子的效应增加;同时因凝胶的浓度升高;蛋白质的泳动受到影响;迁移率急剧下降..此两项变化;使Gly 的移动超过蛋白质;上述的高电压梯度不复存在;蛋白质便在一个较均一的pH 和电压梯度环境中;按其分子的大小移动..分离胶的孔径有一定的大小;对不同相对分子质量的蛋白质来说;通过时受到的阻滞程度不同;即使净电荷相等的颗粒;也会由于这种分子筛的效应;把不同大小的蛋白质相互分开..SDS-PAGE电泳胶配制:SDS-PAGE试剂配制:。
(完整版)SDS-PAGE分离胶-浓缩胶配方

SDS-PAGE1、SDS-PAGE:聚丙烯酰胺凝胶电泳2、Acr:丙烯酰胺;配胶时用30%Acr(质量比Acr:Bis=29:1)3、Bis:甲叉双丙烯酰胺4、DDW:超轻水5、SDS:十二烷基硫酸/磺酸钠,阴离子去污剂(配胶时用10%)6、APS:过硫酸铵NH4S2O4配胶时用10%7、TEMED:四甲基乙二胺,促凝剂8、Tris-Hcl:3羟基氨基甲烷盐酸缓冲液,配胶时(分离胶ph=8.8,浓缩胶ph=6.8)9、DTT:二硫苏糖醇,DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA:碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH酶类的物质。
1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶(也称堆积胶、积层胶或上层胶):TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
SDS-PAGE分离胶配方表-及其原理

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=,pK a=只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDS-PAGE分离胶配方表
生物秀-专心做生物 www.bbioo.com 生物秀论坛—学术交流、资源共享与互助社区 http:// bbs.bbioo.com 生物部落—生物医药人网络家园 http:// Home.bbioo.com 生物百科—生命科学第一百科 http:// Baike.bbioo.com 生物秀知道—生命科学问题解决之道! http:// Ask.bbioo.com 易生物-领先的生物医药商务平台
0;</4, G> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ H> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ BA> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ BC> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ BF> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ 0;52817.:-0;</-693 F ^] zw~ ywx yw{ xwx} xwx} xwxx| zw{ yw{ yw{ xwx} xwx} xwxx{ yw, yw* yw{ xwx} xwx} xwxxz yw~ zwx yw{ xwx} xwx} xwxxz ywy zw} yw{ xwx} xwx} xwxxz BA ^] }w{ zwx zw} xwy xwy xwxx+ |w~ zw* zw} xwy xwy xwxx~ |wx {w{ zw} xwy xwy xwxx| {w{ |wx zw} xwy xwy xwxx| zw{ }wx zw} xwy xwy xwxx| BF ^] *w, {wx {w+ xwy} xwy} xwxyz ~w, |wx {w+ xwy} xwy} xwxx, }w, }wx {w+ xwy} xwy} xwxx~ |w, ~wx {w+ xwy} xwy} xwxx~ {w| *w} {w+ xwy} xwy} xwxx~ CA ^] yxw~ |wx }wx xwz xwz xwxy~ ,w{ }w{ }wx xwz xwz xwxyz *w, ~w* }wx xwz xwz xwxx+ ~w~ +wx }wx xwz xwz xwxx+ |w~ yxwx }wx xwz xwz xwxx+ CF ^] y{wz }wx ~w{ xwz} xwz} xwxz yyw} ~w* ~w{ xwz} xwz} xwxy} ,w, +w{ ~w{ xwz} xwz} xwxy +wz yxwx ~w{ xwz} xwz} xwxy }w* yzw} ~w{ xwz} xwz} xwxy DA ^] y}w, ~wx *w} xw{ xw{ xwxz| y{w, +wx *w} xw{ xw{ xwxy+ yyw, yxwx *w} xw{ xw{ xwxyz ,w, yzwx *w} xw{ xw{ xwxyz ~w, y}wx *w} xw{ xw{ xwxyz EA ^] zywz +wx yxwx xw| xw| xwx{z y+w} yxw* yxwx xw| xw| xwxz| y}w, y{w{ yxwx xw| xw| xwxy~ y{wz y~wx yxwx xw| xw| xwxy~ ,wz zxwx yxwx xw| xw| xwxy~ FA ^] z~w} yxwx yzw} xw} xw} xwx| z{wz y{w{ yzw} xw} xw} xwx{ y,w+ y~w* yzw} xw} xw} xwxz y~w} zxwx yzw} xw} xw} xwxz yyw} z}wx yzw} xw} xw} xwxz
SDS-PAGE配胶说明书
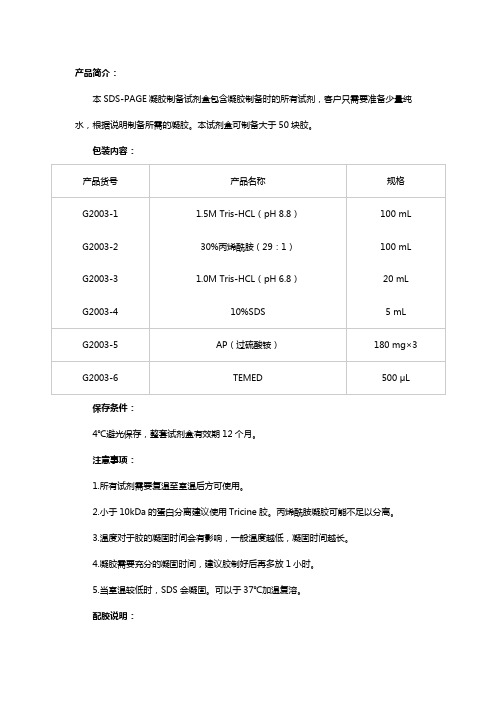
5
6
7.5
9
10
1.5M Tris-HCL(pH8.8)/mL
3.75
3.75
3.75
3.75
3.75
3.75
10%SDS/μL
150
150
150
150
150
150
AP(过硫酸铵)/μL
150
150
150
150
150
150
TEMED/μL
7.5
7.5
7.5
7.5
7.5
7.5
总体积/mL
15(两块)
3.温度对于胶的凝固时间会有影响,一般温度越低,凝固时间越长。
4.凝胶需要充分的凝固时间,建议胶制好后再多放1小时。
5.当室温较低时,SDS会凝固。可以于37℃加温复溶。
配胶说明:
1.AP需加1800μL水溶解。溶解后的AP如不能很快用完,请于-20℃分装保存,有效期1个月。如放4℃保存,有效期一周。
1.0M Tris-HCL(pH 6.8)
20 mL
G2003-4
10%SDS
5 mL
G2003-5
AP(过硫酸铵)
180 mg×3
G2003-6
TEMED
500 μL
保存条件:
4℃避光保存,整套试剂盒有效期12个月。
注意事项:
1.所有试剂需要复温至室温后方可使用。
2.小于10kDa的蛋白分离建议使用Tricine胶。丙烯酰胺凝胶可能不足以分离。
2.蛋白分子量与凝胶浓度,如下表:
蛋白质分子量范围(kDa)
适宜的凝胶浓度(%)
<10
15-20
10-40
12-15
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
*VXQXUX KPTVMLOSTRTNW LJVJRTN TSRPSM+[ccaI@@ddd?cX\XbX?Y`^?Y_
�NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ H> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ BA> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ BC> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ BF> NZ] 1z3 {xs -7>@;6<:89 yw} 2 5>:?v1.; t=1+w+u yxs 4/4 yxs ABCD 5020/ 0;52817.:-0;</-693 F ^] zw~ ywx yw{ xwx} xwx} xwxx| zw{ yw{ yw{ xwx} xwx} xwxx{ yw, yw* yw{ xwx} xwx} xwxxz yw~ zwx yw{ xwx} xwx} xwxxz ywy zw} yw{ xwx} xwx} xwxxz BA ^] }w{ zwx zw} xwy xwy xwxx+ |w~ zw* zw} xwy xwy xwxx~ |wx {w{ zw} xwy xwy xwxx| {w{ |wx zw} xwy xwy xwxx| zw{ }wx zw} xwy xwy xwxx| BF ^] *w, {wx {w+ xwy} xwy} xwxyz ~w, |wx {w+ xwy} xwy} xwxx, }w, }wx {w+ xwy} xwy} xwxx~ |w, ~wx {w+ xwy} xwy} xwxx~ {w| *w} {w+ xwy} xwy} xwxx~ CA ^] yxw~ |wx }wx xwz xwz xwxy~ ,w{ }w{ }wx xwz xwz xwxyz *w, ~w* }wx xwz xwz xwxx+ ~w~ +wx }wx xwz xwz xwxx+ |w~ yxwx }wx xwz xwz xwxx+ CF ^] y{wz }wx ~w{ xwz} xwz} xwxz yyw} ~w* ~w{ xwz} xwz} xwxy} ,w, +w{ ~w{ xwz} xwz} xwxy +wz yxwx ~w{ xwz} xwz} xwxy }w* yzw} ~w{ xwz} xwz} xwxy DA ^] y}w, ~wx *w} xw{ xw{ xwxz| y{w, +wx *w} xw{ xw{ xwxy+ yyw, yxwx *w} xw{ xw{ xwxyz ,w, yzwx *w} xw{ xw{ xwxyz ~w, y}wx *w} xw{ xw{ xwxyz EA ^] zywz +wx yxwx xw| xw| xwx{z y+w} yxw* yxwx xw| xw| xwxz| y}w, y{w{ yxwx xw| xw| xwxy~ y{wz y~wx yxwx xw| xw| xwxy~ ,wz zxwx yxwx xw| xw| xwxy~ FA ^] z~w} yxwx yzw} xw} xw} xwx| z{wz y{w{ yzw} xw} xw} xwx{ y,w+ y~w* yzw} xw} xw} xwxz y~w} zxwx yzw} xw} xw} xwxz yyw} z}wx yzw} xw} xw} xwxz
