溶液的蒸气压
液体饱和蒸汽压

液体饱和蒸汽压
饱和蒸气压是与系统压强、温度有关的状态函数,用于描述系统的气化难易程度。
在密闭条件下,一定的温度下,与固体或液体处于相平衡的蒸气所具有的压强称为饱和蒸气压。
同一物质在不同温度下有不同的饱和蒸气压,并随着温度的升高而增大。
纯溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于液态的饱和蒸气压。
饱和蒸气压是液体的一项重要物理性质,液体的沸点、液体混合物的相对挥发度等都与之有关。
在实际应用中,饱和蒸气压可用于计算化学平衡、液体分离和气体吸收等过程。
37度水溶液的气体分压计算和饱和蒸气压

37度的水溶液是指溶剂为水,温度为37摄氏度的水溶液。
在这样的条件下,溶质会影响水溶液的性质,包括饱和蒸气压和气体分压等重要参数。
以下将详细介绍37度水溶液的气体分压计算和饱和蒸气压。
1. 37度水溶液的饱和蒸气压饱和蒸气压是指在一定温度下,液体表面和气体之间达到动态平衡时,气体对液体施加的压力。
对于37度的水溶液,其饱和蒸气压取决于水的温度和溶质的种类。
根据饱和蒸气压的定义,可以通过实验测定或计算得到37度水溶液的饱和蒸气压。
2. 37度水溶液中气体的分压计算在37度水溶液中,溶解的气体会对水溶液的性质产生影响。
其中,气体的分压是一个重要的参数。
根据理想气体的定律和亨利定律,可以计算37度水溶液中气体的分压。
这一过程需要考虑溶质的种类、气体的溶解度以及温度等因素。
3. 37度水溶液的饱和蒸气压和气体分压的应用饱和蒸气压和气体分压是研究和应用37度水溶液的重要理论基础。
这些参数对液相-气相平衡、化学反应、气体吸收等过程都具有重要意义。
在工程实践和科学研究中,人们可以利用这些参数来设计和优化反应设备,控制气体溶解的过程,并预测溶液中气体的行为。
4. 37度水溶液的实验测定和理论计算为了得到37度水溶液的饱和蒸气压和气体分压等参数,可以通过实验测定和理论计算两种途径。
通过对37度水溶液进行实验测定,可以得到真实的饱和蒸气压和气体分压数据。
而利用理论计算,则可以基于气液平衡的基本原理,通过数学模型和计算方法来估算这些参数。
5. 结论在研究37度水溶液的气体分压和饱和蒸气压时,需要综合考虑温度、溶质的种类、气体的溶解度等多种因素。
通过实验测定和理论计算,可以得到37度水溶液中气体的分压和饱和蒸气压等重要参数。
这些参数对于深入理解水溶液系统的性质,以及在工程实践和科学研究中的应用均具有重要意义。
在37度水溶液的研究过程中,对饱和蒸气压和气体分压的测定和计算需要进行严谨的实验设计和理论分析。
实验测定是得到37度水溶液饱和蒸气压和气体分压参数的重要手段之一。
溶液的蒸气压、凝固点、沸点和渗透压

二、溶液的蒸气压、凝固点、沸点和渗透压1. 溶液的蒸气压下降当一种不挥发的溶质溶解于溶剂后.溶液表面的溶剂分子数目由于溶质分子的存在而减少,因此蒸发出的溶剂分子数目比纯溶剂时少,即溶液的蒸气压比纯溶剂时的蒸气压的线低。
他们的查称为蒸气压下降。
ΔP=P-P A=X B P AA某些固体物质,如氯化钙、五氧化二磷等,常用作干燥剂。
这是由于它们的强吸水性使其在空气中易潮解成饱和水溶液,其蒸气压比空气中水蒸气的压力小,从而使空气中的水蒸气不断凝结进入“溶液”。
浓硫酸也可用作液体干燥剂。
2. 溶液的凝固点下降从图可以看出.在零度时水和冰的蒸气压相等(0.61kPa),此时水、劝和水蒸气三相达到平衡,o℃即为水的凝固点。
由于水溶液是溶剂水中加入了箔质,它的蒸气压曲线下降,冰的蒸气压曲线没有变化,造成溶液的蒸气压低了:助的蒸气压,冰与溶液不能共存。
如果在溶液中放人冰,冰就融化。
所以只有在更低的温皮下才能使溶液的蒸气压与冰的蒸气压相等。
这就是溶液的凝固点下降。
Δt=k凝m凝溶液凝固点下降应用很广。
在汽车、坦克的水箱(散热器)中常加人防冻剂乙二酵、酒精、甘油等,其中以乙二醇为优,因为它具有高沸点、高化学稳定性以及从木溶液中结出时形成淤泥状而不是块状冰特点;在水泥砂浆中加入食盐或氯化钙,能防止冬季产生冰冻现象。
在制冷过程中,用无机盐水溶液作裁冷剂或用冰—无机盐水溶液(共晶冰)作蓄冷剂.使其更适用于低温制冷装置。
3. 溶液的沸点上升图中aa’,ac’,bb’线分别表示水、冰和溶液的蒸气压与温度的关系。
当液体的蒸气压等于外界压力时,液体就沸腾,这时的温度称为沸点。
纯水在100℃时的蒸气压等于101.3kPa(等于外界压力),故水的沸点是100℃。
水中加入难挥发的溶质后,由于溶液的蒸气压曲线下降,只有在更高的温度下才能使它的蒸气压达到101.3kPa而汤踢。
这就是沸点上升的原因。
实验证明,难挥发物质溶液的拂点总是高于纯溶剂的沸点。
溶液的蒸气压、凝固点、沸点和渗透压资料讲解

溶液的蒸气压、凝固点、沸点和渗透压二、溶液的蒸气压、凝固点、沸点和渗透压1. 溶液的蒸气压下降当一种不挥发的溶质溶解于溶剂后.溶液表面的溶剂分子数目由于溶质分子的存在而减少,因此蒸发出的溶剂分子数目比纯溶剂时少,即溶液的蒸气压比纯溶剂时的蒸气压的线低。
他们的查称为蒸气压下降。
ΔP=PA -PA=XBPA某些固体物质,如氯化钙、五氧化二磷等,常用作干燥剂。
这是由于它们的强吸水性使其在空气中易潮解成饱和水溶液,其蒸气压比空气中水蒸气的压力小,从而使空气中的水蒸气不断凝结进入“溶液”。
浓硫酸也可用作液体干燥剂。
2. 溶液的凝固点下降从图可以看出.在零度时水和冰的蒸气压相等(0.61kPa),此时水、劝和水蒸气三相达到平衡,o℃即为水的凝固点。
由于水溶液是溶剂水中加入了箔质,它的蒸气压曲线下降,冰的蒸气压曲线没有变化,造成溶液的蒸气压低了:助的蒸气压,冰与溶液不能共存。
如果在溶液中放人冰,冰就融化。
所以只有在更低的温皮下才能使溶液的蒸气压与冰的蒸气压相等。
这就是溶液的凝固点下降。
Δt凝=k凝m溶液凝固点下降应用很广。
在汽车、坦克的水箱(散热器)中常加人防冻剂乙二酵、酒精、甘油等,其中以乙二醇为优,因为它具有高沸点、高化学稳定性以及从木溶液中结出时形成淤泥状而不是块状冰特点;在水泥砂浆中加入食盐或氯化钙,能防止冬季产生冰冻现象。
在制冷过程中,用无机盐水溶液作裁冷剂或用冰—无机盐水溶液(共晶冰)作蓄冷剂.使其更适用于低温制冷装置。
3. 溶液的沸点上升图中aa’,ac’,bb’线分别表示水、冰和溶液的蒸气压与温度的关系。
当液体的蒸气压等于外界压力时,液体就沸腾,这时的温度称为沸点。
纯水在100℃时的蒸气压等于101.3kPa(等于外界压力),故水的沸点是100℃。
水中加入难挥发的溶质后,由于溶液的蒸气压曲线下降,只有在更高的温度下才能使它的蒸气压达到101.3kPa而汤踢。
这就是沸点上升的原因。
实验证明,难挥发物质溶液的拂点总是高于纯溶剂的沸点。
溶液的蒸气压

打破引力為吸熱 > 引力形成為放熱 故為吸熱
24
對拉午耳呈現負偏差-1
A及B的分壓都比總壓低 當A-B分子比相同的A-A或B-B分子 間吸引力強時發生此狀況。
25
對拉午耳呈現負偏差-2
因A-B間引力強而與在理想溶液時比較, 使A和B逸出氣相更難。故混合時體積 會壓縮,此乃A-B間存在強大吸引力。
溶液的蒸氣壓
課程大綱
溶液的蒸氣壓 理想溶液
2
溶液的蒸氣壓(一)
純溶劑在開口的容器中,液體分子會 不斷的以混亂的方式做分子運動,有 些分子具有較高的動能,有些分子的 動能較低。在液面上,當分子動能大 於與鄰近分子間的引力時,分子就會 離開液面而擴散到氣相中,稱為蒸發。
3
溶液的蒸氣壓(二)
在密閉容器中的液體,起初的蒸發速 率很快,蒸發到氣相的分子愈來愈多, 有些分子會再凝結變成液態,最後達 到 蒸發速率 = 凝結速率 時,液體表 面的蒸氣濃度就不再改變,此時蒸氣 的壓力稱為該液體在該溫度之蒸氣 壓。加圖在視訊
P P PA P P x P (1 xA ) P x
0 A 0 A 0 A A 0 A
0 A B
結論:溶質的存在降低了溶劑的飽和蒸氣壓, 而蒸氣壓下降量由溶質的濃度決定,與溶質的 本性無關。
14
拉午耳定律的應用
可藉由已知條件,求溶質的分子量(MB)
WA MA WA MA
WB MB
147.4 148.9
90.1 18 90.1 2 18 MB
M B 39.3g / m ol
17
拉午耳定律的應用
若溶質為電解質,則解離度為
溶液的蒸气压凝固点沸点和渗透压
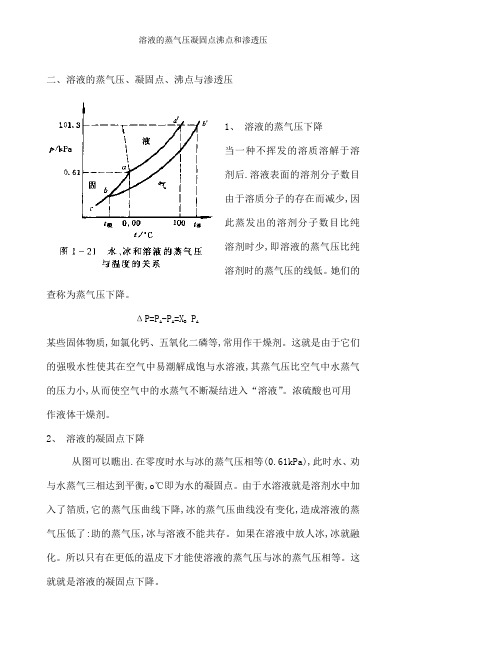
二、溶液的蒸气压、凝固点、沸点与渗透压1、溶液的蒸气压下降当一种不挥发的溶质溶解于溶剂后.溶液表面的溶剂分子数目由于溶质分子的存在而减少,因此蒸发出的溶剂分子数目比纯溶剂时少,即溶液的蒸气压比纯溶剂时的蒸气压的线低。
她们的查称为蒸气压下降。
ΔP=PA -PA=XBPA某些固体物质,如氯化钙、五氧化二磷等,常用作干燥剂。
这就是由于它们的强吸水性使其在空气中易潮解成饱与水溶液,其蒸气压比空气中水蒸气的压力小,从而使空气中的水蒸气不断凝结进入“溶液”。
浓硫酸也可用作液体干燥剂。
2、溶液的凝固点下降从图可以瞧出.在零度时水与冰的蒸气压相等(0.61kPa),此时水、劝与水蒸气三相达到平衡,o℃即为水的凝固点。
由于水溶液就是溶剂水中加入了箔质,它的蒸气压曲线下降,冰的蒸气压曲线没有变化,造成溶液的蒸气压低了:助的蒸气压,冰与溶液不能共存。
如果在溶液中放人冰,冰就融化。
所以只有在更低的温皮下才能使溶液的蒸气压与冰的蒸气压相等。
这就就是溶液的凝固点下降。
Δt凝=k凝m溶液凝固点下降应用很广。
在汽车、坦克的水箱(散热器)中常加人防冻剂乙二酵、酒精、甘油等,其中以乙二醇为优,因为它具有高沸点、高化学稳定性以及从木溶液中结出时形成淤泥状而不就是块状冰特点;在水泥砂浆中加入食盐或氯化钙,能防止冬季产生冰冻现象。
在制冷过程中,用无机盐水溶液作裁冷剂或用冰—无机盐水溶液(共晶冰)作蓄冷剂.使其更适用于低温制冷装置。
3、溶液的沸点上升图中aa’,ac’,bb’线分别表示水、冰与溶液的蒸气压与温度的关系。
当液体的蒸气压等于外界压力时,液体就沸腾,这时的温度称为沸点。
纯水在100℃时的蒸气压等于101、3kPa(等于外界压力),故水的沸点就是100℃。
水中加入难挥发的溶质后,由于溶液的蒸气压曲线下降,只有在更高的温度下才能使它的蒸气压达到101.3kPa而汤踢。
这就就是沸点上升的原因。
实验证明,难挥发物质溶液的拂点总就是高于纯溶剂的沸点。
蒸气压计算

蒸气压计算你是否有过这样的经验:将一瓶水放到烈日下暴晒几小时,然后打开瓶盖时会听到很小的“嘶嘶”声?这是所谓的“蒸气压”原理导致的。
在化学中,蒸气压是密封容器中的物质蒸发时,也就是转化为气体时对容器壁施加的压力。
[1]要计算特定温度下的蒸气压,需要使用克劳修斯-克拉珀龙方程:ln(P1/P2) = (ΔH vap/R)((1/T2) - (1/T1))。
你也可以使用拉乌尔定律来计算蒸气压:P溶液=P溶剂X溶剂。
使用克劳修斯-克拉珀龙方程写出克劳修斯-克拉珀龙方程。
根据蒸气压随时间的变化率来计算蒸气压的公式被称为克劳修斯-克拉珀龙方程,它以物理学家鲁道夫•克劳修斯和伯诺瓦•保罗常使用的就是这一公式。
公式写作:ln(P1/P2) = (ΔH vap/R)((1/T2) -(1/T1))。
其中,各变量的含义如下:ΔH vap:液体的汽化焓。
这个值通常可以在化学课本后的表格中查到。
R:理想气体常数,即8.314 J/(K × Mol)。
T1:蒸气压已知时的温度,或起始温度。
T2:求蒸气压时的温度,或最终温度。
P1和P2:温度为T1和T2时的蒸气压。
2将已知值代入公式中。
由于克劳修斯-克拉珀龙方程有很多不同的变量,所以看上去有些复杂,但掌握了正确的信息后,方程其实并不难。
最基础的蒸气压问题会给出两个温度值和一个压力值,或给出两个压力值和一个温度值。
有了这些已知条件后,解题就很简单了。
例如,假设题目告诉我们,温度为295 K时,装满液体的容器的蒸气压为1个标准大气压(atm)。
题目问:“温度为393 K时,蒸气压等于多少?”我们已知两个温度值和一个压力值,所以可以使用克劳修斯-克拉珀龙方程来求出另一个压力值。
将已知值代入变量中,得到ln(1/P2) = (ΔH vap/R)((1/393) - (1/295))。
注意,克劳修斯-克拉珀龙方程必须使用开尔文温度值。
而压力值可以使用任意单位,只要P1和P2保持统一即可。
溶液的蒸气压

分散质粒子直径:
d<1nm
分子、离子分散系 真溶液
单相
d=1~100nm 胶体分散系
高分子溶液 单相
胶体
多相
d>100nm
粗分散系
悬浊液、乳浊液 多相
1.2.2 溶液浓度的表示方法(溶质/溶剂、溶质/溶液)
1.2.2.1 物质的量浓度cB=
nB V
单位:mol·L-1
基Hale Waihona Puke 单元• 物质的量:系统中所含基本单元的量。单位:mol
1231溶液的蒸气压下降1溶液的蒸气压2溶液的蒸气压下降2降低原因3拉乌尔定律一定温度下难挥发非电解质稀溶液的蒸气压下降与溶液的质量摩尔浓度成正比而与溶质的本性无1232溶液的沸点升高为溶剂的沸点升高常数单位kkgmol1难挥发非电解质稀溶液的沸点升高与溶液的质量摩尔浓度成正比而与溶质的本性无关
1.1.2 液体
1.3.3.2 动力学性质——布朗运动
(1)胶体粒子不断受到分散剂粒子在各个方向上的不均匀的 碰撞;
(2)分子热运动。
1.3.3.3 电学性质
(1)电泳:在电场作用下,分散质粒子在分散剂中的定 向移动。
(2)电渗:分散质被固定,分散剂在电场中的定向移动。 用电泳、电渗的方向(正好相反)可判断胶粒带电的性质。 (3)原因:a、固体胶核的吸附作用
△Tb Tb Tbo Kb bB
• Kb为溶剂的沸点升高常数,单位K∙kg∙mol-1
• 难挥发、非电解质、稀溶液的沸点升高与溶液的质量摩尔 浓度成正比,而与溶质的本性无关。
• 例:
1.2.3.3 溶液的凝固点降低
• (1)凝固点(Tf) p冰 =p液体时,系统达固-液两
• 相平衡,此时系统对应的温度。
溶液的饱和蒸气压溶液的饱和蒸气压

依數性質
式中m為溶質的重量莫耳濃度,即一公斤 溶劑中所含溶質的莫耳數
Kb稱為莫耳沸點上升常數,不同的溶劑其 莫耳沸點上升常數不同
常見溶劑的正常沸點、 Kb
凝固點下降ΔTf
式中m為溶質的重量莫耳濃度 Kf為溶劑的莫耳凝固點下降常數,不同的溶
劑具有特定的Kf值
常見溶劑的凝固點、Kf值
例題 3-4
真溶液、膠體溶液及懸浮液
各種溶液的實例
廷得耳效應
膠體溶液能顯現廷得耳效應(圖右:氫氧化鐵的 膠體溶液)
真溶液(圖左:硝酸鐵的水溶液)則無此現象。
布朗運動
分散質的表面經常帶電荷
膠體溶液分散質的表面經常帶有相同的電荷, 彼此排斥無法凝聚下來。
膠體溶液,加入電解質→凝聚析出
豆漿為膠體溶液
pxapp1xbppppxbppxbp溶液蒸氣壓的下降量和溶質的莫耳分率成正比含非揮發性溶質的水溶液其蒸氣壓比水降低在溫度t時蒸氣壓下降的量為p溶液形成時不放熱也不吸熱蒸氣壓大小遵循拉午耳定律由于此一特性理想溶液的體積具有加成性即混合後兩種分子間的引力等于混合前各物種單獨存在時分子間的引力溶液形成時不放熱也不吸熱溶劑與溶質分子間的作用力和溶劑與溶劑或溶質與溶質分子間的作用力相等溶液的蒸氣壓與其濃度間的關係若能符合拉午耳定律該溶液稱為理想溶液非理想溶液會發生放熱或吸熱現象混合後體積亦無加成性不遵循拉午耳定律一般實際的溶液多屬此a對拉午耳定律呈現正偏差吸熱能量變化變大v溶液v溶質v溶劑體積混合後引力變小引力升高p溶液poaxapobxb蒸氣壓正偏差b對拉午耳定律呈現負偏差放熱能量變化變小v溶液v溶質v溶劑體積混合後引力變大引力降低p溶液poaxapobxb蒸氣壓負偏差34溶液的依數性質在半透膜兩邊水分子穿透半透膜的速率不同低濃度溶液高濃度溶液高濃度溶液低濃度溶液施加外加壓力滲透逆滲透外加壓力在稀薄溶液中滲透壓的大小與溶質的莫耳數n和絕對溫度t成正比與溶液的體積v成反比而與溶質和溶劑的種類無關
溶液和纯溶剂的蒸气压

溶液和纯溶剂的蒸气压
溶液与纯溶剂的蒸气压
溶液与纯溶剂的蒸气压是有所区别的,蒸气压是表征溶液蒸发性的一个重要指标。
蒸汽压主要是受蒸汽分子之间的弹性相互作用,分子中电荷分布引起的共振作用,疏水相互作用以及与杂质物质之间的亲和性相互作用而控制。
从物理及化学凝聚性角度来看,纯溶剂的蒸气压是由分子间的弹性相互作用而形成的,它不受其它物质的影响,蒸气压可以表征溶质的新陈代谢及毒性特性。
而溶液的蒸汽压则受它的构成物多种相互作用而不断地改变,溶液的蒸汽压与纯溶剂的蒸汽压有一定的差异。
一般来说,溶液的蒸汽压小于纯溶剂的蒸汽压,其差值越大,溶液的稀释程度越大。
因此,研究和比较溶液与纯溶剂的蒸汽压,对认知溶液中物质之间相互作用和蒸腾特性也有重要作用,这也是衡量溶度的重要参考指标。
此外,蒸汽压对精密定制和控制温度、浓度以及移动的重要性也不容忽视。
氢氧化钠溶液饱和蒸气压

氢氧化钠溶液饱和蒸气压
氢氧化钠(NaOH)溶液的饱和蒸气压是一个复杂的问题,因为它涉及到溶剂(水)和溶质(NaOH)之间的相互作用。
一般来说,饱和蒸气压是指在一定温度下,液体表面上的蒸气和液体中的分子达到动态平衡时的压强。
对于NaOH溶液来说,由于NaOH是一种电解质,其溶解过程涉及离子化和水合作用,这使得饱和蒸气压的计算更加复杂。
一种近似的方法是利用溶液的渗透压来估计饱和蒸气压。
根据渗透压的定义,溶液的渗透压取决于溶质的摩尔浓度。
然而,由于NaOH是一种强碱,它在水中完全离解成Na+和OH-离子,因此其摩尔浓度并不直接反映溶质的实际浓度。
因此,单纯利用摩尔浓度来估算NaOH溶液的饱和蒸气压并不准确。
另一种方法是通过实验测定得到NaOH溶液的饱和蒸气压。
这需要在实验室条件下,利用适当的仪器和技术来测量NaOH溶液在一定温度下的蒸气压。
通过一系列实验数据的积累和分析,可以得到NaOH溶液在不同温度下的饱和蒸气压的大致数值。
总的来说,NaOH溶液的饱和蒸气压是一个复杂而且需要实验数
据支持的问题。
需要综合考虑溶质的性质、溶剂的性质以及温度等因素,才能得到准确的结果。
希望这些信息能够帮助你更好地理解NaOH溶液的饱和蒸气压。
气体溶液中的摩尔分数与蒸气压

气体溶液中的摩尔分数与蒸气压在化学领域中,我们经常会遇到气体溶液这个概念。
气体溶液是指气体分子溶解在液体或固体中形成的混合物。
而在气体溶液中,摩尔分数与蒸气压之间存在着密切的关系。
首先,我们来了解一下摩尔分数的概念。
摩尔分数是指某一组分在溶液中所占的摩尔数与总摩尔数之比。
在气体溶液中,摩尔分数可以用来表示溶解气体的浓度。
假设气体A和气体B分别是气体溶液中的两种组分,它们的摩尔分数分别为xA和xB,那么xA + xB = 1。
摩尔分数与蒸气压之间的关系可以通过瑞利定律来描述。
瑞利定律指出,溶液中每个组分的蒸气压与其摩尔分数成正比。
换句话说,摩尔分数越高,蒸气压也越高。
这是因为在气体溶液中,溶质分子会与溶剂分子发生相互作用,使得溶质分子的动能减小,从而降低了溶质分子的蒸发速率。
而当溶质分子的摩尔分数增加时,相互作用的程度也随之增强,导致蒸发速率进一步降低,从而使得溶液的蒸气压降低。
除了摩尔分数,温度也是影响气体溶液中蒸气压的重要因素。
根据麦克斯韦-玻尔兹曼分布定律,气体分子的速度与温度成正比。
当温度升高时,气体分子的动能增加,蒸发速率也随之增加,从而导致溶液的蒸气压增加。
因此,在相同的摩尔分数下,温度越高,溶液的蒸气压也越高。
此外,溶液中溶质分子之间的相互作用力也会对蒸气压产生影响。
如果溶质分子之间存在较强的相互作用力,那么溶质分子的蒸发速率将减小,从而导致溶液的蒸气压降低。
相反,如果溶质分子之间的相互作用力较弱,蒸发速率将增加,溶液的蒸气压也会增加。
总之,气体溶液中的摩尔分数与蒸气压之间存在着密切的关系。
摩尔分数越高,蒸气压也越高。
而温度和溶质分子之间的相互作用力也会对蒸气压产生影响。
这些因素相互作用,共同决定了气体溶液中的蒸气压。
通过了解气体溶液中摩尔分数与蒸气压的关系,我们可以更好地理解和预测气体溶液的行为。
这对于许多实际应用来说都是非常重要的,例如在化学工业中的溶液制备和分离过程中,以及在环境科学中对气体溶液的传输和转化过程的研究中。
水溶液的饱和蒸气压

《水溶液的饱和蒸气压之妙趣》
嘿ห้องสมุดไป่ตู้朋友们!今天咱来聊聊水溶液的饱和蒸气压。
你看啊,这水溶液就像是一个小小的奇妙世界。在这个世界里,饱和蒸气压就像是一个神秘的力量在悄悄运作着。
想象一下,水在锅里煮着,热气腾腾往上冒,这其实就和饱和蒸气压有点关系呢。当水达到一定温度,它就开始欢腾起来,水分子们变得特别活跃,就像一群调皮的小孩子,急着往外跑。
咱平常生活里也能感受到它的存在哦。比如,夏天的时候,从冰箱里拿出一瓶冰镇饮料,不一会儿瓶子外面就布满了小水珠。这就是因为周围空气中的水蒸气遇到冷的瓶子,达到了饱和状态,凝结成了小水珠。这其实就是饱和蒸气压在“搞鬼”呢。
还有啊,有时候我们会发现,衣服洗完晾晒在外面,即使天气很好,也不是一下子就干得透透的。这也是因为水在慢慢蒸发的过程中,会受到饱和蒸气压的影响。它就像一个“小管家”,控制着水蒸发的速度。
在大自然里,饱和蒸气压也起着重要的作用呢。比如在湖边或者海边,水和空气之间的这种奇妙互动一直都在进行着。
要是饱和蒸气压变得不一样了,那可就有很多有趣的现象发生啦。比如,在高海拔地区,因为气压比较低,水的饱和蒸气压也会发生变化,所以水的沸点就会降低。这就是为什么在山上煮东西感觉煮不熟的原因。
再说说湿度吧,湿度其实也和饱和蒸气压有关。当空气中的水蒸气接近饱和状态时,我们就会感觉很潮湿;而当它离饱和状态还远着呢,我们就会感觉比较干燥。
总之呢,水溶液的饱和蒸气压可不是个简单的东西,它就像一个隐藏在我们生活中的小魔法师,悄悄地影响着我们的生活。我们要好好去了解它,感受它的奇妙之处。这样,我们就能更好地理解周围的世界,也能更好地应对生活中的各种小状况啦!
这就是我对水溶液的饱和蒸气压的看法啦,它真的很有意思,值得我们好好琢磨琢磨。
溶液蒸气压或凝固点大小的排序

溶液蒸气压或凝固点大小的排序溶液蒸气压和凝固点是研究溶液性质的两个重要指标。
本文将根据这两个指标的大小对溶液进行排序,以便更好地了解溶液的性质。
一、溶液蒸气压的大小排序溶液蒸气压是指溶液在一定温度下蒸气与溶液之间的平衡压强。
蒸气压的大小取决于溶质的性质和溶液的浓度。
下面是几种常见溶液的蒸气压大小排序:1. 纯溶剂:纯溶剂的蒸气压最大,因为溶质的存在会降低溶液的蒸气压。
2. 非电解质溶液:非电解质溶液的蒸气压比纯溶剂的蒸气压要小。
这是因为溶质会占据溶剂的一部分空间,导致溶液分子的逸出速率降低,从而降低蒸气压。
3. 弱电解质溶液:弱电解质溶液的蒸气压也比纯溶剂的蒸气压要小。
弱电解质在溶液中只部分离解,形成溶质分子和离子。
这些离子会占据溶液中的一部分空间,从而降低溶液的蒸气压。
4. 强电解质溶液:强电解质溶液的蒸气压最小。
强电解质在溶液中完全离解成离子,导致溶质分子的逸出速率非常低,从而使溶液的蒸气压非常小。
二、凝固点的大小排序凝固点是指溶液在降温过程中开始凝固的温度。
凝固点的大小取决于溶质的性质和溶液的浓度。
下面是几种常见溶液的凝固点大小排序:1. 纯溶剂:纯溶剂的凝固点最低,因为溶质的存在会干扰溶液分子的排列,从而提高溶液的凝固点。
2. 非电解质溶液:非电解质溶液的凝固点比纯溶剂的凝固点要高。
这是因为溶质分子会干扰溶液分子的排列,使得分子间的相互作用增强,从而提高凝固点。
3. 弱电解质溶液:弱电解质溶液的凝固点也比纯溶剂的凝固点要高。
虽然弱电解质在溶液中只部分离解,但离解的离子会干扰溶液分子的排列,导致凝固点升高。
4. 强电解质溶液:强电解质溶液的凝固点最高。
强电解质在溶液中完全离解成离子,这些离子会干扰溶液分子的排列,使得分子间的相互作用增强,从而提高凝固点。
溶液的蒸气压和凝固点大小可以反映溶质在溶液中的浓度和性质。
通过对溶液蒸气压和凝固点的排序,可以了解溶液的物理和化学性质,为溶液的应用提供参考。
溶液蒸汽压计算

溶液蒸汽压计算
溶液的蒸汽压是指溶液中的溶质和溶剂在温度保持不变的情况下,所能承受的蒸气压力。
蒸汽压是由两部分组成的,一部分是溶质的蒸气压力,另一部分是溶剂的蒸气压力。
蒸汽压的大小取决于溶液的浓度和温度。
随着溶液的浓度增加,溶液的蒸汽压会升高。
反之,随着溶液的浓度降低,溶液的蒸汽压也会降低。
同样,随着溶液的温度升高,溶液的蒸汽压也会升高。
我们可以使用理想溶液理论来计算溶液的蒸汽压。
根据这个理论,溶液的蒸汽压可以用如下公式计算:
Ps = Xs * Ps + (1 - Xs) * Psolvent
其中,Ps 表示溶液的蒸汽压,Xs 表示溶质的质量分数,Ps 表示溶质的蒸气压力,Psolvent 表示溶剂的蒸气压力。
我们还可以使用非理想溶液理论来计算溶液的蒸汽压。
根据这个理论,溶液的蒸汽压可以用如下公式计算:
Ps = Xs * Ps + (1 - Xs) * Psolvent + (Xs * (1 - Xs) * B)
其中,B 表示溶质和溶剂之间的交换作用常数。
这个公式可以更精确地计算溶液的蒸汽压,尤其是在溶液的浓度和温度较大的时候。
我们还可以使用摩尔定律来计算溶液的蒸汽压。
根据摩尔定律,溶液的蒸汽压可以用如下公式计算:
Ps = P*s * Xs
其中,P*s 表示溶质的蒸气压力,Xs 表示溶质的摩尔浓度。
在实际应用中,我们可以根据溶液的浓度和温度,选择合适的理论来计算溶液的蒸汽压。
通过对比计算结果和实际测得的值,我们还可以判断哪种理论更加精确。
溶液蒸气压或凝固点大小的排序

溶液蒸气压或凝固点大小的排序溶液蒸气压和凝固点是物质性质的重要指标,它们在化学和物理学中具有广泛的应用。
溶液蒸气压是指溶液在一定温度下蒸发的能力,而凝固点是指溶液在一定温度下从液态变为固态的温度。
本文将分别从溶液蒸气压和凝固点两个方面进行探讨,并对一些常见物质的溶液蒸气压和凝固点进行比较。
一、溶液蒸气压1. 溶液蒸气压的基本概念和影响因素溶液蒸气压是指溶液中溶质分子蒸发成气体分子所产生的压强。
溶液蒸气压与溶质的性质、溶剂的性质、温度等因素有关。
一般来说,溶质分子越活跃,溶剂分子间的作用力越小,溶液蒸气压就越高。
而温度的升高也会增加溶液蒸气压。
2. 溶液蒸气压的应用溶液蒸气压的大小对于一些化学和生物过程具有重要影响。
例如,饮料中的二氧化碳溶于水中形成碳酸饮料,其溶液蒸气压决定了饮料的起泡性质;药物在体内的溶解度和吸收速度也与其溶液蒸气压有关。
二、凝固点1. 凝固点的概念和影响因素凝固点是指物质从液态变为固态的温度。
固体的凝固点取决于其分子间的作用力和结构。
一般来说,分子间的作用力越强,结构越有序,凝固点就越高。
而杂质的存在也会降低溶液的凝固点。
2. 凝固点的应用凝固点的大小对于一些物质的纯度和结晶性质有一定的指示作用。
例如,纯净的水的凝固点约为0℃,而含有杂质的水的凝固点则会降低。
利用这一特性,可以通过测量凝固点来判断溶液中的杂质浓度。
三、溶液蒸气压和凝固点的比较1. 溶液蒸气压和凝固点的联系溶液蒸气压和凝固点都是与物质的相变性质相关的指标。
溶液蒸气压与溶解度和饱和度有关,而凝固点与纯度和结晶性质有关。
在一些情况下,溶液蒸气压的增大可能导致凝固点的降低。
2. 溶液蒸气压和凝固点的实验比较对于一些常见物质,可以进行溶液蒸气压和凝固点的实验比较。
例如,纯水的蒸气压随温度的升高而增大,而凝固点随温度的降低而降低。
相比之下,食盐溶液的蒸气压较低,凝固点较高。
这是因为食盐的溶解度较小,分子间的作用力较强,导致溶液蒸气压较低,凝固点较高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.2.3.1 溶液的蒸气压下降
(1)溶液的蒸气压
(2)溶液的蒸气压下降
p<p* △p=p* -p
(2)降低原因
(3)拉乌尔定律
• a:一定温度下,难挥发、
• 非电解质、稀溶液的
p=p*χA
b:双组分 • •
χA =1-χB p=p* -p*χB △p= p*χB
c:
B
nB nA nB
nB nA
凝固点:液体蒸气压等于固体蒸气压时系统对应的温度。 (此时固、液两相达到平衡)
1.1.3 固体
1.1.4 水的相图:了解DA、DB和DC线 1.1.5 等离子体
1.2 溶液
1.2.1 分散系的概念
1.分散系:一种或几种物质分散在另一种物质中
构成的混合系统。=分散质+分散剂
2.分散系的分类
聚集状态:
△Tb Tb Tbo Kb bB
• Kb为溶剂的沸点升高常数,单位K∙kg∙mol-1
• 难挥发、非电解质、稀溶液的沸点升高与溶液的质量摩尔 浓度成正比,而与溶质的本性无关。
• 例:
1.2.3.3 溶液的凝固点降低
• (1)凝固点(Tf) p冰 =p液体时,系统达固-液两
• 相平衡,此时系统对应的温度。
分散质粒子直径:
d<1nm
分子、离子分散系 真溶液
单相
d=1~100nm 胶体分散系
高分子溶液 单相
胶体
多相
d>100nm
粗分散系
悬浊液、乳浊液 多相
1.2.2 溶液浓度的表示方法(溶质/溶剂、溶质/溶液)
1.2.2.1 物质的量浓度cB=
nB V
单位:mol·L-1
基本单元
• 物质的量:系统中所含基本单元的量。单位:mol
单位:mol·kg-1
1.2.2.3 摩尔分数χB=
nB n
单位:1
B
nB nA nB
A
nA nA nB
i 1
1.2.2.4 质量分数ωB=
mB m
单位:1,(或mg·kg-1)
1.2.3稀溶液的依数性(重点)
依数性:只与溶液中溶质粒子数量(浓度)有关而与
•
溶质本性无关的性质。
•
扩散。稀-浓
• (2)原因:
• (3)渗透平衡:
• (4)渗透压:
• (5)条件:半透膜、浓度差
• (6)计算:
• 例: • 渗透压与生命现象、反渗透 • 技术、电解质的依数性
nB V
RT
cB RT
bB RT
mB / M B RT
V
MB
mB RT
V
1.2.4 强电解质溶液简介
1.1.2 液体
系统:研究的对象。 相:系统中物理性质和化学性质完全相同的均匀部分
称为相,相与相之间存在明显的界面。例: 1.1.2.1 液体的蒸气压 液化
气化与蒸发: 相变: 相平衡: 饱和蒸气压:
影响蒸气压的因素:分子间力、温度(蒸气压曲线)
1.1.2.2 液体的沸点和凝固点
沸点:液体的蒸气压等于外界压力时系统对应的温度。(此 时系统达气液两相平衡)
1. 强电解质的表观电离度 2. 离子氛: 3. 活度、活度系数:
c
离子浓度越大,离子电荷越高,离子间的
牵制作用越强, 越小;溶液无限稀时,活
度系数等于1。
1.3 胶体
(1)物质存在的特殊形式 (2)d 1~100nm,超微多相系统,分散程度高,表面大
1.3.1 吸附作用
吸附:物质在固体表面自动聚集的过程 吸附剂: 吸附质: 特点:吸附剂表面积越大,吸附能力越强。 1.3.1.1分子吸附(非电解质或弱电解质)规律:相似相吸 1.3.1.2离子吸附(电解质溶液)
b、固体胶核表面基团的离解作用 (4)应用:生物大分子的分离、鉴定。
1.3.4 胶团结构
• • 胶核:
[(AgI)m·nAg+(n-x)NO3-]x+xNO3-
• 电位离子:
•电位离子和反离子的确定:
• 电位离子:与胶核组成相关且溶液中浓度较大者。
• 反离子:与电位离子符号相反,且溶液中浓度较大者。
1.3.3.2 动力学性质——布朗运动
(1)胶体粒子不断受到分散剂粒子在各个方向上的不均匀的 碰撞;
(2)分子热运动。
1.3.3.3 电学性质
(1)电泳:在电场作用下,分散质粒子在分散剂中的定 向移动。
(2)电渗:分散质被固定,分散剂在电场中的定向移动。 用电泳、电渗的方向(正好相反)可判断胶粒带电的性质。 (3)原因:a、固体胶核的吸附作用
nB mA / M A
nB mB
MA
bB M A 103
△ p p*bB M A 103 KbB
• 一定温度下,难挥发、非电解质、稀溶液的蒸气压下 降与溶液的质量摩尔浓度成正比,而与溶质的本性无 关。
1.2.3.2 溶液的沸点升高
• (1)溶液的沸(Tb ) • p蒸 =p外时,此时溶液系统 • 对应的温度。 • (2)溶液的沸点升高
(1)离子选择吸附——规律: (2)离子交换吸附——能力:浓度、电荷、水
合半径
1.3.2 溶胶的制备 1.3.2.1 分散法:大——小
研磨法、超声波法、胶溶法、电弧法 1.3.2.2 凝聚法:小——大
物理凝聚法、化学凝聚法
1.3.3 溶胶的性质
1.3.3.1 光学性质 原因:d>λ 反射或折射。 d<λ 散射:光波绕过粒子向各个方向发 散,使每个微粒看上去象在发光。 d<<λ 散射极弱,发生透射。
• (2)溶液的凝固点降低
△Tf Tfo Tf K f bB
• Kf为溶剂的凝固点降低常数, • 单位K∙kg∙mol-1
• 难挥发、非电解质、稀溶液的凝固点降低与溶 液的质量摩尔浓度成正比,而与溶质的本性无 关。
• 例:植物的防寒抗旱功能
1.2.3.4 渗透压
• (1)渗透现象:溶剂分子通过半透膜向溶液
• 例:
• 1.3.5 溶胶的稳定性与聚沉
• 1.3.5.1 溶胶的稳定性
• (胶粒有巨大的表面,互相吸附聚集变大而沉淀)
(1)胶粒的电荷;(2)溶剂化膜;(3) 布朗运动
• 1.3.5.2 溶胶的聚沉:胶粒聚集成大颗粒而
沉降的过程。
• 基本单元:系统中原子、离子、分子或它们的特定组合。
•
2NaOH + H2SO4
Na2SO4 + 2H2O
1 n( 1 B) n(B) an(aB) aa
1 c( 1 B) c(B) an(aB) aa
M ( 1 B) M (B)
a
a
1.2.2.2 质量摩尔浓度bB=
nB mA
