化学动力学第六章链反应动力学
化学反应动力学中的链反应

化学反应动力学中的链反应链反应是化学反应动力学中一种重要的反应形式,它的特点是反应过程中某些反应物通过与另外一些物质形成中间自由基,进而引发其他分子的反应。
本文将从链反应的概念、特点、应用以及相关反应机理等方面进行介绍。
一、概念与特点链反应是指在化学反应中,某些反应物的分子内部发生裂解,产生带有未成对电子的自由基,并通过这些自由基的引发作用,引起其它分子发生裂解和重新组合,从而产生更多的自由基参与反应的过程。
具体来说,链反应包括三个基本步骤:自由基的生成、自由基的传递和自由基的终止。
其中,自由基的生成是指反应物之间发生裂解生成自由基的过程,自由基的传递是指反应过程中自由基之间相互转移的过程,自由基的终止是指自由基与其他分子及反应产物相互作用而终止反应的过程。
链反应的特点是具有放热性和反应速度快的特点。
因为链反应中产生的自由基数量相当大,它们的活性也非常高,因而可以引发大量的反应,从而导致反应速度非常快。
此外,链反应还具有一定的连锁反应性质,即一个分子的反应产物同时也是下一个分子的反应物,从而使得反应过程呈现出连锁反应的模式。
二、应用链反应在工业及生产领域中被广泛应用,如聚合反应、燃烧反应、聚合物的制备、有机合成等等。
其中,聚合反应是最常见的应用之一。
在聚合反应中,通过在反应体系中引入适当的引发剂,以引发自由基反应,从而实现对分子间化学键的断裂和重新组合,从而形成大分子聚合物。
此外,链反应还可以应用于燃烧反应中。
在燃烧反应中,碳氢化合物燃烧产生的自由基开始反应链式反应,生成CO2和H2O等反应产物。
不同的燃烧反应具有不同的反应特点和反应动力学机制,但都与链反应密不可分。
三、反应机理链反应机理是链反应研究的关键问题之一。
目前,对于链反应机理的认识已经相当深入和广泛。
根据文献报道,链反应机理主要包括以下环节:1. 自由基的产生和发展机制。
在链反应中,自由基的产生和发展是整个反应过程的关键步骤。
自由基在分子内部形成的同时,也可能由较小的分子化合物所提供。
第六章-化学反应动力学习题解答

第六章 化学反应动力学思考题解答一、是非题(判断下列说法是否正确,并说明理由)1. 错2. 对3. 错4. 错5. 错6. 错7. 对8. 对9.错 10. 对 二、选择题1. B2. A.3. B.4. D. 5 .C 6.D. 7. A. 8. B 9. B. 10. C.习题解答1.请根据质量作用定律,写出下列各基元反应或复合反应中Ad d c t与各物质浓度的关系。
(1)2A + B 2P k−−→ (2)A + 2B P + 2S k−−→ (3)22A + M A M k−−→+ (4)2A B (5)2A 2B+D B+A 2D(6)解:(1)2A A B d 2d c kc c t -= (2)2A A Bd d c kc c t -=(3)2A A M d 2d c kc c t -= (4)2A 2B 1A d 2+2d c k c k c t -=- (5)222A 1B D 1A 2A B 2D d 2+2+d c k c c k c k c c k c t ---=--(6)A 1A 2A 3C d d ck c k c k c t-=+-2.某人工放射性元素放出α粒子,半衰期为15min 。
试问多长时间后该试样能分解掉80%。
解:由题意得该反应为一级反应,符合一级反应的条件,则112ln 2t k =得 1k = ln 215=0.0462mol -1 由积分定义式 1ln ak t a x=- 令0.8xy a==得 11ln 1k t y =- 则 t=34.84mink 1 k-1 k 1 k-1 k k3.反应25222N O (g)4NO (g)O (g)−−→+,在318K 下测得N 2O 5的浓度如下: t /min 0 20 40 60 80 100 120 140 160 c /mol·m -317.69.735.462.951.670.940.500.280.16求该反应的级数和速率常数及半衰期。
化学反应动力学

化学反应动力学是研究化学反应速率和反应机理的科学。
它涉及如何测量反应速率、如何确定反应速率和温度、浓度、催化剂等因素之间的关系,以及理解化学反应背后的分子层面的过程。
反应动力学对于了解和控制化学反应过程具有重要意义。
化学反应速率是指单位时间内反应物消失的量或产物生成的量。
反应速率取决于多个因素,包括反应物的浓度、温度、压力、催化剂的存在、表面积等。
反应速率通常用初始速率表示,即在反应初期的速率。
初始速率是浓度变化最大的时刻。
化学反应速率的测量可以通过测量反应物质的浓度随时间的变化来实现。
例如,连续测量反应物质浓度的变化,可以绘制一个浓度随时间变化的曲线,然后计算不同时间点的反应速率。
化学反应速率与温度的关系遵循阿伦尼乌斯方程,即速率常数随温度的升高而增加。
这是因为随着温度的升高,分子的平均动能增加,与之相应的碰撞数和能量达到活化能的分子也就增加了。
因此,反应速率随着温度的升高而增加。
实验测定反应速率与温度的关系可以用活化能表达式来描述,即阿伦尼乌斯方程。
活化能是指克服反应物分子间相互作用所需的最小能量,只有具备活化能的反应物分子才能发生碰撞并转化为产物。
活化能越低,反应速率越快。
化学反应速率还受到反应物浓度和催化剂的影响。
浓度与反应速率之间遵循速率方程。
一般来说,反应物的浓度越高,反应速率越快,因为高浓度会导致反应物分子之间的碰撞频率增加。
催化剂是能够改变反应过程路径的物质,它通过提供一个不同的反应机制,降低反应的活化能,从而增加反应速率。
催化剂本身在反应中不消耗,并且可以多次重复使用。
了解化学反应动力学有助于人们更好地理解和控制各种化学反应过程。
在工业领域,反应速率的控制和优化对于增加产量、减少生产成本至关重要。
在生物体内,许多生化反应也遵循化学反应动力学的规律。
对于药物研发和生物催化等领域,了解化学反应动力学有助于提高疗效和效率。
总之,化学反应动力学研究化学反应速率和反应机理的科学,它涉及测量反应速率、确定反应速率与温度、浓度、催化剂等因素的关系,以及理解反应背后的分子层面过程。
化学动力学-连串反应PPT课件

连串反应 ——一个反应的某产物是另一个非逆向反应
的反应物,如此组合的反应称为连串反应
C6H6 Cl2 C6H5Cl HCl C6H5Cl Cl2 C6H4Cl2 HCl C6H4Cl2 Cl2 C6H3Cl3 HCl
………………
一级连串反应
两个单向连续的一级反应
t=0
A k1B k2 C
k2cB
0 cB
C ek2t
C积分常数
令C=C(t),并将 cB C(t ) ek2t 代入原方程
dcB dt
k2cB
k1cA0 ek1t
dC(t ) ek2t dt
k2C(t )ek2t
k1cA0 ek1t
dC (t ) dt
k c e(k2 k1 )t 1 A0
C(t)
k c e(k2 k1 )t 1 A0 k2 k1
cA0
0
0
dcB
dt
r
(i B
)vi
i 1
t=t cA
cB
cC
v1 v2
vA
dcA dt
v1
k1cA
vB
dcB dt
v1 v2
k1cA
k2cB
vC
dcC dt
v2
k2cB
cA
c e k1t A0
dcB dt
k2cB
k1cA0e k1 t
cA cB cC cA0
积分形式
cA
c e k1t A0
cB
cA0
k1 k2 k1
(e k1t
ek2t )
cC
cA0 1
k2e k1 t k2
k1e k2 t k1
化学反应动力学 教学课件 第六章 势能面和反应途径

ZZe2 Ze2 e2
R
,i ri
r ij ij
35
37
§6. 6 化学反响守恒规那么 一、分子的对称性
分子对称性是通过对称操作和对称元素描 述的。 对称操作:每一次操作都能够产生一个与 原来图形等价的图形,经过一次或连续几 次操作都能够使图形完全复原。 对称元素:对分子几何图形施行操作时所 依赖的几何要素(点、线、面及其集合)。
T : 分子的总状态函数,或分子波函数。
T T(r,R) r:n 个电子的坐标。
R:m 个原子核的坐标。
34
TH ˆNˆT : 核T ˆN 动 能T ˆe 算 符V ,(rT,ˆR N)22 m12
Tˆe
:电子动能算符,Tˆe
2
2
i
m1ei2
其中:i2 x2i2 y2i2 z2i2
V (r,R )V N N V N eV ee
FuncLtEiPon(sL〕ondon-Eyring-Polanyi ) 法 1、London方程
V Q A B Q B C Q C A
1 2JA BJBC 2JB C JC2 A JC A JAB 2 1 /2
QAB、QBC、QCA为相应粒子对之间的库仑积分。 JAB、JBC、JCA为相应粒子对之间的交换积分。
能的绝对值。 10
分子间作用势通常用 Lennard-Jone 12-6 关系 式表达:
V(r)4126 (1)
r r V(r) r 图: V(r)
0 rm
r
11
据
dV (r) 0
dr
可得: rm = 21/6
(2)
将〔2〕代入〔1〕,得:
V(r)4126 (1)
第六章 链反应1

象,Bodenstein引入了化学反应链的概念。1918年奈斯特
(Nernst)提出了生成HCl的化学链锁反应机理。
E 25.1KJ mol Cl 2 H 2 HCl H KJ Q 4.18 mol E 0 H Cl 2 HCl Cl KJ Q 188 mol H H M H M
2br原子重化合m可为任何其他物质无支直链brhbrbrbr反应器内链中心的分布规律在链锁反应中无论以哪种形式存在的链中心都具有一定的平动能量因而象任何分子一样会在体系中扩散倘若反应器器壁只能使链终止不能使链再生则链中心在反应器内的浓度在接近器壁处将很小向内逐渐增大到反应器中心处或反应器轴线区域达最大
子由下式形成: H2 α →2H 式中符号 H2→H2++e →概括了一系列的反应:
H2++H2→H3++H
H3++e→3H或H2+H 这些氢原子然后作为链中心完成仲—正氢的自旋异构化反 应: H+P-H2→O-H2+H
⑶催化和副催化反应作为链中心的来源:如果反应物分子 结构牢固,较难断裂形成自由基,则可在该反应中加一个 催化剂,此催化剂有一弱的价键容易裂开成为活性部分而 引发作用。例如,过氧化二苯甲酰作为催化剂易于分解成
在反应过程中,并非每个中间物CH3OOH 分子都经裂解发 生退化分支,只有很少部分的CH3OOH 发生这种退化分支。
㈡ 链锁反应的特征:
链锁反应在许多方面不同于上述几章讨论的普通反应,下 述差异往往能够用作区别于其他反映的判据。
1. 几率因素的差异。链锁反应的几率因素P一般是远大于1的, 换句话说,当发现一反应的P因素很大时,则反应可能有链锁式
第六章化学动力学

νY νZ
11.1.8
因此得到一个结论:不同物质的消耗速率或生成速率,与该 物质的化学计量系数的绝对值成正比。
例如反应:2NO2 2NO O2
其反应物消耗速率为:
vNO2
பைடு நூலகம்
dcNO2 dt
其产物生成速率为 v
dc
NO
NO
dt
或
vO2
dco2 dt
三者关系: v dcNO2 dcNO dcO2 2dt 2dt dt
A+B → L+M
研究内容: (1) 化学变化的方向和限度问题 (2) 化学反应的速率和机理问题 (3) 物质的性质与其结构之间的关系问题
化学动力学(chemical kinetics)是研究化学反应的速率和机 理的科学, 是物理化学的一个重要组成部分。
化学反应的 两个基本问题
在指定条件下 反应进行的方向和限度
表示一个化学反应的反应速率与浓度等参数间的关系式称 为速率方程式,也往往称为微分式;表示浓度与时间等参数间 的关系式,称为动力学方程,也往往称为积分式。
1. 反应速率的定义
若某反应的计量方程: a A b B c C d D
以代数方程表示其总的计量式:0 vBB
B
一般只表示初始反应物与最终产物间的计量关系,不出 现反应中间物。若存在中间物,而且在反应进行中,中间物 浓度逐步增加,则由于中间物浓度积累,将与总的计量式不 符。这一类反应被称为依时计量学反应,若某反应没有中间 物,或它的浓度不大,可忽略不计,则在整个反应过程中均 符合一定的计量式,此类反应被称为非依时计量学反应。
•
def
v
ξ
V
1 vB V
d nB dt
物理化学第六章习题答案讲解

第六章化学动力学(三)计算题1. 293K时,敌敌畏在酸性介质中水解反应的速率常数为0.01127d-1。
若敌敌畏水解为一级反应,试求其水解反应的半衰期。
=ln2/ k =0.6931/0.01127d-1=61.5d解:t1/22.某人工放射性元素放出a粒子的半衰期为15h。
求该试样分解速率常数和分解80%所需的时间。
解:= 0.6931/15h=0.04621h-1放射性元素分解为一级反应,k=ln2/t1/2t=-ln(1-x)/k=-ln(1-0.8)/0.04621h-1=34.83h二级反应规律3. 某溶液含有NaOH 和CH3CO2C2H5,浓度均为0.0100mol ·dm-3。
在308.2K时,反应经600s 后有55.0% 的分解。
已知该皂化反应为二级反应。
在该温下,计算:(1) 反应速率常数?(2) 1200s能分解多少?(3) 分解50.0%的时间?(c A解:(1) 反应为 NaOH +CH 3CO 2C 2H 5 → CH 3CO 2Na + C 2H 5OH 该反应为二级且初浓度相同,故有 -d c A /d t =kc A 2 , c A =c A0(1-x ), 积分后得k = (1/t )(1/c A -1/c A0) = x /tc A0(1-x )=0.550/[600s ×0.0100mol ·dm -3×(1-0.550)]=0.204 dm 3·mol -1·s -1(2) x =1/(1+1/ktc A0) = 1/[1+1/( 0.204 dm 3·mol -1·s -1×1200s ×0.0100mol ·dm -3)]= 0.710 =71.0%(3) t 1/2= 1/kc A0 = 1/( 0.204 dm 3·mol -1·s -1×0.0100mol ·dm -3) = 490s4. 溶液反应 A + 2B → 2C + 2D 的速率方程为 -d c B /d t =kc A c B 。
第六章 化学动力学基础.

第六章 化学动力学基础首 页 习题解析本章练习本章练习答案章后习题答案习题解析 [TOP]例13-1在酸的存在下蔗糖的反应中,偏光计的读数αt 如下: t/(min)0 30 90 150 330 630 ∞ αt46.5741.0030.7522.002.75-10.00-18.75这个反应是一级反应,求反应速率常数。
解1 对一级反应,不仅反应物的浓度本身,如果有和浓度成比例的量,则可以用来代替浓度。
αt是蔗糖溶液的偏振面转过的角度,在t = 0时溶液中只存在蔗糖,在t = ∞时蔗糖应该完全消失,而在公式ln c A =ln c A0-kt 中,和c A0成比例的量是α0-α∞,和c A 成比例的量是αt -α∞,因此可以用ln(αt -α∞)=ln(α0-α∞)-kt 计算各时刻的k 。
min 100.375.1800.4175.1857.46ln min 30131-⨯=++=kmin 101.375.1875.3075.1857.46ln min 90132-⨯=++=kmin 102.375.1800.2275.1857.46ln min 150133-⨯=++=kmin 104.375.1875.275.1857.46ln min 330134-⨯=++=kmin 102.375.1800.1275.1857.46ln min 630135-⨯=+-+=kmin 102.35354321-⨯=++++=k k k k k k解2 采用作图法,以lg(αt -α∞)对t 作图,得一直线,其斜率b = -k /2.303。
t /min3090150330630αt -α∞65.32 59.75 47.50 40.75 21.50 8.75 lg(αt -α∞)1.8151.7761.6771.6101.3320.942则k = -2.303⨯b 又b = - 0.00139,所以 k = 2.303⨯0.00139 = 3.20⨯10-3min -1例13-2尿素的水解反应为CO(NH 2)2 + H 2O −→2NH 3 + CO 225︒C 无酶存在时,反应的活化能为120k J ⋅ mol -1,当有尿素酶存在时,反应的活化能降为46 k J ⋅ mol -1,反应速率为无酶存在时的9.4⨯1012倍,试计算无酶存在时,温度要升到何值才能达到酶催化时的速率?解 浓度一定时,反应速率之比也即速率常数之比KT K T K T T T T T R E 775298298K mol J 1031.8mol J 1204.9ln ln104.922211312112121212=⎪⎪⎭⎫ ⎝⎛⨯-⋅⋅⨯⋅=⨯-=⨯=----解得k k k k k k 12a 10)(例13-3科学工作者已经研制出人造血红细胞。
无机化学 第六章 化学动力学.

3. 实验测得aA + bB →cC + dD的动力学方程式为 r=kca(A)cb(B) ,下列说法错误的是( )
A. 该反应是基元反应 B. 反应级数为a+b C. 对反应物A是a级 D.对反应物 B是b级
4. 已知某反应是放热反应,如果升高温度,则( )
A. k增加,Kθ减小
B. k,Kθ均增加
6. 催化剂可以使反应的( )
A. Kθ增大
B. 反应自由能增大
C. 活化能改变
D. 反应焓减小
7. 反应2NO(g) + Br2(g) →2NOBr(g)的反应历程是: (1) NO(g) + Br2(g) →2NOBr2(g) 快 (2) NO(g) + NOBr2(g) →2NOBr2(g) 慢,则该反应对NO的反应 级数为( )
三、速率常数
速率方程中的 k 称为速率常数,物理意义是速率方程式 中各种物质浓度均为1 mol/L时的反应速率。
速率常数的量纲由速率方程确定,总反应级数不同,单位 不同。
速率常数越大,表明反应进行得越快。但应注意,两个反 应级数不同的反应,对比速率常数的大小是毫无意义的。
速率常数的大小取决于反应物的本质,而与浓度无关。 速率常数是温度的函数,当其他条件相同时,T 升高,则 k 增大。
第6章 化学动力学 6-1 化学反应速率
1. 平均速率: 指反应进程中某时间间隔(t)内反应物浓度的减少或生成
物浓度的增加来表示: r ≡ ︱cB / t︱ 或:r ≡ (1/B )cB / t
2. 瞬时速率
指某一瞬时(时刻)的速率,即时间间隔无限小,t→0时的 平均速率。
r ≡ ︱dcB / dt︱或 r ≡ (1/B )dcB / dt
化学反应动力学知识点总结

6 化学反应动力学6.1本章重点与难点热力学只能预言在给定的条件下,反应发生的可能性,即在给定的条件下,反应能不能发生,发生到什么的程度。
而要把可能性变成现实性,就需要化学动力学的知识,化学动力学的基本任务:一是研究反应的速率以及各种因素(如分子结构、温度、压力、浓度、介质、催化剂等)对反应速率的影响,从而给人们提供选择反应条件,使化学反应按我们所希望的速率进行。
化学动力学的基本任务之二是研究反应历程一即反应物究竟按什么途径,经过哪些步骤,才转化为最终产物。
6.2学习中应掌握以下主要内容:掌握等容反应速率的表示法以及基元反应、复杂反应、反应分子数、反应级数、反应速率方程式等基本概念;简单级数反应(零级、一级、二级反应)的速率公式和它的特征,并能由实验数据确定简单反应的级数。
对三种复杂反应(对峙反应、平行反应和连续反应)要掌控其各自的特点并能对比较简单的反应能写出反应速率与浓度关系的微分式;明确温度、活化能对反应速率的影响、理解,阿化尼乌斯经验式中各项的含意,计算Ea 。
掌握链反应的特点,会应用稳态近似、平衡假设等近处理方法。
6.3基本内容化学动力学的研究内容化学动力学是研究化学反应过程的速率,化学反应过程中诸内因(结构、性质等)和外因(浓度、温度、催化剂、辐射等)对反应速率(包括方向变化)的影响以及探讨能够解释这种反应速率规律的可能机理,为最优化提供理论根据,以满足生产和科学技术的要求。
化学动力学的发展经历了从现象的观察到理论的分析,从宏观的测量到微观的探索。
化学动力学与化学热力学化学动力学和化学热力学都是物理化学两大重要分支学科,它们各有不同的研究内容。
化学热力学的任务是讨论化学过程中能量转化的衡算以及解决在一定条件下进行某一化学反应的方向和限度问题。
它讨论体系的平衡性质,不考虑时间因素和过程细节。
而化学动力学研究完成化学反应过程所需时间、影响条件以及实现这一过程的具体步骤(机理)。
化学热力学只回答化学反应的可能性问题;而化学动力学才回答化学反应的现实性问题。
物理化学-第六章化学动力学

dc A k c A cB dt
dc A 2 k cA dt
依此类推,对于基元反应: aA+bB+… 其速率方程应当是:
…+yY+zZ
dc A a b k cA cB ... dt
基元反应的速率与各反应物浓度的幂乘积成正比,其中各 浓度的方次为反应方程中相应组分的分子个数。此即是质量作 用定律。 速率方程中的比例常数 k,叫做反应速率常数。它与温度 有关,与浓度无关。它是各反应物均为单位浓度时的反应速率。 它表示了反应的能力大小,同一温度下,对于不同反应,k 越 大,反应越快。
9
4. 化学反应速率的曲线表示方法
在浓度随时间变化的图 上,在时间t 时,作交点 的切线,就得到 t 时刻的 瞬时速率。
反应刚开始,速率大, 然后不断减小,体现了 反应速率变化的实际情 况。
10
rA rD rG rH d 以反应进度定义的速率为r, 表示为 r Vdt a d g h
k1k3 cI2 cH2 k总cI2 cH2 k2
k(速率常数或速率系数):速率方程中的比例系数,是一个与浓 度无关的量。 k1、k2、k3: 各基元反应的速率常数; k 总:为总包反应的速率常数(速率系数)。
23
对某基元反应A+2D G, 由质量作用定律可得:
2 r kcAcD
k: 反应速率常数 H2+I2 2HI
k1 k2
对总包反应, 例如: (1)
(2)
可分解为两步基元反应:
I2+M(高能)
H2+2I
k3
2I+M(低能)
2HI r1 = k1cI2cM
快
慢
化学动力学 (6)
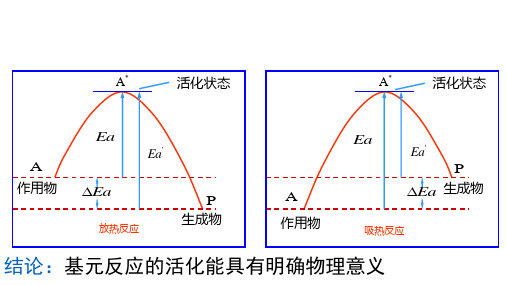
有自由基参加的反应,活化能较小。
(3)
Cl2 M 2Cl M Ea EClCl
(4)
Cl Cl M Cl 2 M Ea 0
自由基复合反应不必吸取能量。如果自由基处于激发 态,还会放出能量,使活化能出现负值。
11.8 链反应(Chain reaction)
五.
“活化能”对“速率系数随温度变化”的影响
活化能更高 活化能较低
以 lnk 对 1/T 作图, Ea 直线斜率为 R
lnk/[k]
1
活化能较高
从图上可看出: (1) :
Ea (3) Ea (2) Ea (1)
3
1 T /K
2
(2)对同一反应, k 随T 的变化在低温区 比较敏感。例如2。 T/K lnk 376 463 10 20 1倍 1000 2000 100 200 1倍 (3)对不同反应,Ea 大,k随T的变化也大, 如 Ea (3) Ea (2)
用稳态近似法求碘原子浓度
1 d[I] I2 +M 2I · +M (1)快平衡 k1 [I 2 ][M]-k-1 [I]2 [M]-k2 [H 2 ][I]2 0 2 dt H2 + 2I · 2HI (2)慢反应 k [I ][ M] 2 1 2 [ I] k [M] k [H ] 1 2 2 k k [ H ][ I ][ M ] 2 2 2 r k [H ][ I] 1 2 2 2 k [M] k [H ] 1 2 2
Ea RT
2
d ln k dT
d ln k R d(1/ T )
后来又提出了三参量公式:
k BT
m
式中B,m 和 E 都与温度无关。
第六章 化学反应动力学

υA
υB
υY
υZ
A、B的消耗速率 Y、Z的生成速率
即: v ? ? vA ? ? vB ? vL ? vM
?A ?B ?L ?M
?结论:不同物质的消耗速率或生成速率,与该物质 的化学计量系数的绝对值成正比。
例如:
N2(g) ? 3H2 (g) ? 2NH3 (g)
反应物消耗速率为 :
vN2
?
?
dcN2 dt
② 反应的 t1/2与cA,0 成反比
1 t1/ 2 ? kcA,0
③ 1/cA~t 为直线关系, 1/cA
由直线的斜率可求 k。
t
(2) 有两种反应物的情况 aA+bB ? 产物
若实验确定其微分速率方程为
?
d cA dt
?
k A cAcB
积分求解需找出 cA与cB的关系,分如下几种 情况考虑:
(i) a=b,且cA,0= cB,0 ,则任意时刻 cA= cB ,于
υA
?
?
dcA dt
?
kc
0
A
?
k
积分:
? ? ?
d c C A
C A ,0
A
?
ktBiblioteka dt0cA,0 ? cA ? kt
动力学特征
(1) k 的单位是:浓度 ?时间-1; (2) cA与 t 成线性关系; (3) t1/2 = cA,0 /2k,半衰期正比于反应物的初浓
度,即 t1/2∝cA,0 。
各级反应的动力学特征可作为确定反应级数的依据
1 H 2 ? 2 O 2 ? H 2O (l)
需一定的 T,p和催化剂
点火,加温或催化剂
化学动力学发展简史
化学反应的动力学方程

化学反应的动力学方程是描述化学反应速率和反应物浓度之间关系的方程。
动力学方程对于理解和预测化学反应的速度以及反应机制非常重要。
在化学反应中,反应物浓度的变化会影响反应速率,而动力学方程则可以通过定量关系来描述这种变化。
动力学方程通常采用速率常数来描述反应速率与反应物浓度的关系。
对于一个简单的反应A + B -> C,动力学方程可以写为:v = k[A]^m[B]^n其中v表示反应速率,k是速率常数,[A]和[B]分别表示反应物A和B的浓度,m和n是反应的反应级数。
动力学方程中的反应级数反映了反应物对于速率的影响程度。
反应级数可以通过实验数据来确定,实验中测量不同浓度条件下的反应速率,然后根据数据进行回归分析得到反应级数。
当反应级数为1时,反应速率正比于反应物浓度的一阶反应。
而当反应级数为2时,反应速率正比于反应物浓度的平方,称为二阶反应。
还有一些特殊情况,如零阶反应和分数阶反应。
动力学方程的推导基于反应速率的微分形式。
考虑一个简单的一阶反应 A -> B,反应速率v可以表示为:v = -d[A]/dt = k[A]其中d[A]/dt表示A的浓度随时间的变化率。
反应速率正比于A的浓度,且反应速率常数k描述了反应的快慢程度。
将上述微分方程进行积分,可以得到反应物浓度随时间的变化规律:[A] = [A]₀e^{-kt}其中[A]₀表示初始浓度,t表示时间。
这个方程描述了一阶反应的反应物浓度随时间的指数衰减规律。
同样的,对于一个二阶反应,动力学方程可以类似推导。
动力学方程的使用可以帮助我们理解反应速率的影响因素,如温度、浓度、催化剂等。
在实际应用中,动力学方程可以用于反应速率的预测和优化,帮助我们控制和调节化学反应的速度和效果。
总结起来,化学反应的动力学方程是描述化学反应速率和反应物浓度之间关系的方程。
通过动力学方程,我们可以了解反应速率与反应物浓度之间的定量关系,进而预测和优化化学反应的速度和效果。
物理化学6.动力学

表示反应速率与浓度之间关系的速率方程微分式:
A
- dc A dt
= kcAnA cBnB cCnc
表示反应浓度与时间关系的速率方程积分式:
cB = f(t)
一、零级反应 Zeroth order reaction
2A B P = kcA2 cB
A B + C P = kcAcBcC
反应级数和反应分子数的关系:
1)无论是基元反应还是非基元反应的速率方程, 各物质浓度的幂的代数和均称为反应级数; 2)对于基元反应,反应级数等于反应分子数,也 等于反应计量系数之和;反应级数只能是简单的 正整数; 3)对于非基元反应,没有分子数的概念,反应级 数不一定等于其计量系数之和。
aA 产物
微分式:
A
dcA dt
kAcA
cA cA0
1 cA
dcA
t 0
kAdt
(6-7)
积分式:
ln cA0 kt cA
cA cA,0ekt (6-8)
ln cA kt ln cA0
组分A的转化率
def
x = c c- c A
A0
A
A0
代入上式得积分式的另一种形式:
反应速率与物质浓度无关的反应称为零级反应
aA 产物
微分式:
A
dcA dt
dx dt
kA
dc cA
cA0
A
kA
t 0
dt
积分式:
cA0 cA kt
化学反应动力学-第六章- 液相反应动力学

上一内容
下一内容
返回
(二)非惰性溶剂中的应用
当液相分子反应在非惰性溶剂中进行时,溶剂分 子将或多或少地影响反应物分子的性质,有时甚 至与之发生一定作用,例如溶剂化作用等。这样 将使反应的活化能发生变化,改变原反应的反应 速率。
上一内容
下一内容
返回
液相分子反应在非惰性溶剂中所具有的共同特点
当改换溶剂时,反应速率将有明显的变化, 溶剂对反应的指前因子和活化能均有显著的影 响。例如环戊二烯与苯醌的反应(见表),在不 同溶剂中进行反应时,其指前因子和活化能的 数值发生变化。此类情况出现时,采用碰撞理 论进行动力学处理会有非常大的偏差,需改用 过渡状态理论加以分析和处理。
一. 液相反应的分类
液相分子反应
一般液相反应 液相自由基反应
液相反应
液相离子反应
液相催化反应
上一内容
下一内容
返回
二、液相反应的典型特征
• 在溶液反应中,溶剂是大量的,溶剂分子环 绕在反应物分子周围,好像一个笼把反应物 围在中间,使同一笼中的反应物分子进行多 次碰撞,其碰撞频率并不低于气相反应中的 碰撞频率,因而发生反应的机会也较多。
对”发生反应的速率常数。
上一内容
下一内容
返回
假定经过一定时间,“作用分子对”的浓度达 到了 dc(AB)
稳定,则: dt k1(扩)cAcB k1(扩)c(AB) k2c(AB) 0
因此, “作c用(AB分) 子 对k1(”扩)c的AcB稳定浓度是:
k1(扩) k2
r
反应速率为:
上一内容
下一内容
返回
►可见,对于液相分子反应也会出现扩散步骤和 化学反应步骤混合控制的情况。
链反应_精品文档

1. 链反应(chain reactions)
“链反应”: 有“自由基”(free radical )或原子参加的综合复合 反应
“自由基”: 具有未成对电子,化学活泼性很高的原子或原
子基团,不能长时期独立存在。如: H·HO· CH3· CH3CO·(乙酰基)
其中“ ·”表示未成对电子。NO, NO2等虽具有未成 对电子,但不具有很高的化学活泼性,能长时期独 立存在,所以不叫自由基。
§11.9 链反应
1. 链反应
2. 直链反应(H2和Cl2反应的历程) ——稳态近似法
3. 支链反应——H2和O2反应的历程
链反应(Chain Reaction)
化学反应动力学研究的大师谢苗诺夫
Nikolay Semyonov 1896~ 1986
尼古拉依·尼古拉那维奇·谢苗诺夫是杰出的 苏联化学家、是苏联建国后第一个获得诺贝尔 奖的学者。
2.直链反应(straight chain reaction)
HCl气相合成反应是典型的直链反应,
①Cl2 k1 Cl Cl ②Cl H2 k2 HCl H ③H Cl2 k3 HCl Cl ④2Cl M k4 Cl2 M
r1 k1[Cl2 ] r2 k2[Cl][ H2 ] r3 k3[H][Cl2]
r1 r4
k1[Cl2 ] k4[Cl]2
[Cl]
k1 k4
[Cl2
1/ ]
2
d[ HCl ] dt
2r2
2k2[H2 ][Cl]
2k2
k1 k4
1
/
2
[
H
2
][Cl2
]1
/
2
k[H2 ][Cl2 ]1/2
化学反应中的反应机制和化学动力学

化学反应中的反应机制和化学动力学化学反应是化学变化的基本形式之一,化学反应中的反应机制和化学动力学是深入研究和探索化学反应的必要手段。
在这篇文章中,我们将深入探讨化学反应中的反应机制和化学动力学,并讲述它们对于化学反应的影响和意义。
一、反应机制反应机制是指化学反应中原子、离子或分子发生转变的步骤和路径。
化学反应中的反应机制普遍存在于多种化学反应之中,如氧化还原反应、酸碱反应和还原反应等,是研究和预测化学反应的基础。
化学反应中的反应机制通常可以分为三类:1、单分子反应机制单分子反应机制指的是仅一个分子参与反应的反应机制。
典型的单分子反应机制包括放射性衰变、分子解离、气体分子的碰撞等。
这类反应的反应速率常数随温度的升高而增加。
2、协同反应机制协同反应机制是指两个或多个分子同时参与反应的反应机制,经常出现在化学反应过程中。
典型的协同反应机制包括酸碱中和反应、金属离子的配位反应等。
这类反应的反应速率常数受到阳离子浓度、反应物浓度、温度等因素的影响。
3、链式反应机制链式反应机制通常为三步反应过程:引发步、传递步和终止步。
引发步往往是通过引入一些能量如光、温度、电场、热源等引起的,然后通过继续反应,形成一个或多个反应物和产物的中间体,最终通过终止步来结束整个反应。
典型的链式反应机制包括自由基链反应、籽粒机理反应等。
链式反应机制的速率常数受到質子浓度或负离子浓度、温度、辐射照度等因素的影响。
二、化学动力学化学动力学是研究化学反应速率和其随反应物浓度的变化关系的科学,是研究化学反应速率和反应体系物质转化规律的基础。
化学动力学可用来探索反应机制、确认反应路径和预测化学反应研究的趋势。
化学反应速率通常由它们的速率常数决定,而速率常数则与反应动力学方程式相关。
化学反应速率常数的变化与反应物浓度、表面积、温度等因素有关。
化学动力学通常表现为化学反应速率的变化,可以用反应物消失或产物增加的速率来描述化学反应的进程。
化学动力学还可以用来预测、控制和改进化学反应的产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ddC tOkCH3CHO1/2
当n=3/2时,断链方式:CH3+CH3→C2H6
dC dtH4k'CH3CHO3/2
第七节 支链反应
直链反应: 支链反应:在链传递过程中一个旧的自由基的小事往往伴随2个或更多个新
的自由基的产生,是一个自由基数目迅速增殖的过程。反应以爆 炸的形式发生。
1. 引发反应 有机物分子在其最弱的链上产生原始自由基。
2. 持续反应——链传递 原始自由基中的一个自母体分子夺取H形成一个饱和分子和一个外自由基。
3. 断链反应——链中止 自由基复合或歧化
引发: 持续:
断链:
M1 k 1R1+M2 R 1+M 1 k 2 R 1H +R 2 R2 k 3R1+M3 R1+R2 k 4M4
1/2
1/2
2k3k2kk k3 1 5B B rr22 k4H H 2 B rB r22k2k k 11 5 kk43H H B 2 B r2 rB r21/2A 1 H B 2H B B B rr2 2r1 /2
1/ 2
A
2k2
k1 k5
B k4 k3
∴得证
附:H2+X2 → 2HX反应历程的比较
链引发 支链反应步骤 链传递
链中止
2. 链传递:
CH3+CH3CHO→CH4+CH3CO CH3CO→CH3+CO
3. 推测链终止反应: 引发反应一般为一级,总级数为1/2或3/2时: n=1/2时,为SS简单断链或RSM三体断链 n=3/2时,为SS简单断链。
R——简单自由基。S——含2个以上自由基,M——阻化剂。 乙醛热解无需阻化剂,因而不会采用RSM断链方式。
第六章 链反应动力学
第一节 链反应的类型和特征
一. 链反应的类型 1. 直链反应
在反应传递过程中,每一步基元反应只产生一个活性中间体,反应按 直链传递下去,没有分支连锁。链反应中最简单的一类。
2. 稀有分支链反应
在化学传递过程中,有个别步的基元反应产生了二个或多个活性中 间体,使反应直链传递的同时又产生了分支链。
④
(H+H → H2 )
d d C t l 2 k 1 C l 2 M k 2 C l H 2 k 3 C l 2 H 2 2 k 4 C l 2 M 0(5)
dd H tk2C lH 2k3H C l20 (6)
(6)代入(5)得: 2k1C l2M 2k4C l2M
R2
k1 M1 2k4 R1
(3)
(3)代入(2)得 反应速率
R1
k1k4
k12k428k1k2k3k4 4k2k4
r
d[M1] dt
k1[M1 ]
k 2 [M 1 ][R 1 ]
k1[M1 ] k2[M 1 ] k1k4
k12
k
2 4
8 k1k 2 k 3 k 4
4k2k4
5k1k2k4 k[M1]
对HBr合成反应 H2+Br2 → 2HBr可能的反应机理:
链引发: Br2 k 12Br
链传递: B rH 2 k 2 H B rH
HB r2 k 3 H B rH
H H B r k 4 H 2B r
链中止:2Brk 5Br2
试用稳态理论证实:在473~573K范围内,下式中A, B与T有关。
讨论: H2+X2 → 2HX计量方程相同,但机理不同,影响因素是什么?
dH dtClkH2Cl212
书P275表
1
d HBr
dt
AH2 Br2 2 HBr
1 B Br2
dHI
dt
kH2I2
H2+I2 2HI I 2 2 I 2I+H2 2HI
第四节 链式热解
主要历程——Rich-Herfeld历程:
例:HCl的合成反应历程:HCl:H2+Cl2 → 2HCl
链引发: Cl2+M k1 2Cl+M E1=242.7 kJ·mol-1
①
链传递: Cl+H2 k2 HCl+H E2=25.1 kJ·mol-1
②
H+Cl2 k3 HCl+Cl E3=8.4 kJ·mol-1
③
链中止: Cl+Cl+M k4 Cl2+M E4=0 kJ·mol-1
1
Cl
k1 k
4
Cl2
2
(7)
结论:(1)
H
k2 k
3
H2 Cl2
Cl
(8)
r d 2 H d C tl 1 2 k 2 C lH 2 k 3 H C l2
1
=
1 2 k2H 2 k k 1 4C l2 k3C l2k k 3 2 C H l2 2
k k 1 4C l2 = k2
M 反 应 物 分 子 RM自 由 基
断链:
R M nM k 3 R M n 1
RMi 自由基
R M PR M Q k 4 R 2M P Q
根据稳态近似: dd R tk1Ik2RM 0
(1)
d R d t M k 2 R M k 3 R M M k 4 R M n 1 R M n 0
(2)
d R d M t2 k 3 R M M k 3 R M 2 M k 4 R M 2 n 1 R M n 0(3)
d R d M tn k 3 R M n - 1 M k 3 R M n M k 4 R M n n 1 R M n 0 (4)
(1)+(2)+(3)+……+(4)得:
rkC 6H 5C H C2H AB 12 N
第六节 直链反应历程的推测
乙醛热解,总级数有1/2和3/2两种。 CH3CHO→CH4+CO
1. 推测链引发方式: 可以是:一级←压力高,温度低,分子内部自由度大(6以上原子组成的分子)
二级←双原子分子解离
CH3CHO原子数6,C-C键最弱,因此一级引发是可能的。 链引发: CH3CHO→CH3+CHO
R——自由基 M——分子
利用稳态近似法,活性中间体:R1,R2
d d R t1 k 1 M 1 k 2 R 1 M 1 k 3 R 2 k 4 R 1 R 2 0 (1)
d d R t2 k 2 R 1 M 1 k 3 R 2 k 4 R 1 R 2 0
(2)
(1)+(2)得 k1M 12k4R 1R 2
(3) = (1)+(2)
Br
(k1 k5
Br2 )1/2
1/ 2
(4)=(3)代入(1):
H
k2
k1 k5
Br2
H2
k3 Br2 k4 HBr
r H B r d H d t B r k 2 B r H 2 k 3 H B r 2 k 4 H H B r 2 k 3 H B r 2
l
r n0
反应速率 引发速率
n 0 原 始 生 成 自 由 基 速 率
对HCl的合成反应 rk2(k 1/k4)1 /2 [H 2][C l]1 /2
n0d[dC tl]2k1[Cl2][M]
l
k2[H2]
2(k1k4)1/2[Cl2]1/2[M]
l
k
H2
1
Cl2 2
第三节:H2+Br2的反应机理
k1 k4
2
H2
Cl2
1
2
(2) n=1.5级,对H2为1级,对Cl2为0.5级。
1
(3)
k
k2
k1 k4
2
(4)E aE 21 2(E 1E 4)14 .5k6Jm 1ol
(5)如取反应物
H2:Cl2=1:1,则根据(8)式: H
k2 Cl
k3
Hk2 eE2E3/RT0.001 (设T = 300 K) Cl k3
k1Ik4RM nRM n0
n1
n1
k1Ik4
2
RMn
0
n1
பைடு நூலகம் ∴
n1
RMn
k1 k4
1/2
I
聚合反应速率方程
r
dM
dt
k2
RMk3RMMk3RM2M
k3MRMn n1
1
k3
k1 k4
2 MI12
∴聚合反应对单体是一级,对引发剂I是0.5级,总n=1.5级。
例:苯乙烯C6H5CH=CH2(M)在溶剂中的加成聚合可用ABN(I)引发
1
d
HBr
dt
AH2 Br2 2 HBr
1 B Br2
证明:活性中间体为H和Br
(1) d d H t k 2 B r H 2 k 3 H B r 2 k 4 H H B r 0
(2)
d d B t r 2 k 1 B r 2 k 2 H 2 B r 2 k 3 H B r 2 k 4 H H B r 2 k 5 B r 2 0
k12
k
2 4
4k2k4
8 k1k 2 k 3 k 4
[M1]
一般是一级反应。
第五节 链转移
聚合反应历程:
引发:
I k 1R
I 一 种 引 发 剂 ( 非 反 应 物 )
RM k 2 RM
R 引 发 剂 产 生 的 自 由 基
持续:
RM +M k 3 RM 2 R M 2M k 3 R M 3
H0.01Cl
[H]只有[Cl]的千分之一,说明H的反应活性强于Cl,也因此在断链反应 中, H+H+M→H2+M的反应不起重要作用。
