无机化学(2)氮族元素ppt
合集下载
无机化学课件氮族元素

(iii) 王水的氧化性:浓HNO3:浓HCl为3:1 叫做 王水,它的氧化性比硝酸更强,可溶解金、铂等不活 泼金属(实际上是多种氧化剂+配位剂Clˉ在起作用)
D.硝化反应—— 与有机化合物发生反应,生成 硝基化合物(RNO2).
硝酸盐NO3ˉ: (i) 结构: 正三角形,sp2杂化,有个大π36键
盐溶液显酸性(水解) 与碱溶液的反应:
NH4+ + OH- == NH3 + H2O
(iii) NH4+ 的鉴别: A. 若NH4+量多,可用加强碱加热,用湿润的蓝 色石蕊试纸(变兰)检验气体;
B. 若NH4+量少,加Nessler试剂(K2[HgI4]的KOH 溶液)检验(通常为红棕色)
NH4+ + [HgI4]2- + OH-
白磷、红磷的物理性质
白磷
红磷
色、态
白色蜡状
红棕色粉末
溶解性 毒性
着火点
不溶于水,溶于CS2 剧毒
40℃ , 易自燃
不溶于水和CS2 无毒 240℃
保存 用途 分子结构
相互转化
密封,保存于冷水中
密封,防止吸湿
制高纯度磷酸
制安全火柴、火药
P4 正四面体 键角60°
结构复杂
白磷
隔绝空气加热到260℃ 红磷
氨气的化学性质:
可发生三类反应:
A. 加合反应:NH3作为一种典型的Lewis碱,可与许多 金属离子(如Ag+、Cu2+、Co3+、Ni2+)形成配合物;与某些盐 晶体加合(如8NH3+CaCl2 → CaCl2·8NH3 )
B. 取代反应:NH3中的氢可被活泼的金属取代生成氨 基化合物(-NH2)和氢气。
氮族元素PPT课件全文

NH2OH可与醛、酮形成肟,是聚酰胺纤维和尼龙的中间体
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
无机化学教学15章氮族元素PPT课件

THANKS FOR WATCHING
感谢您的观看
应;而一氧化氮与氢气反应生成氨气,氮元素从+2价降低到-3价,发
生还原反应。
氮族元素的配位反应
01
02
03
配位键的形成
氮族元素可以与配位体形 成配位键,如氮元素与氢 离子形成配位键。
配位反应的规律
配位反应遵循电子配对原 则,即电子总数为偶数的 电子对。
配位反应的实例
硫酸铵与氢氧化钡反应生 成硫酸钡沉淀和氨气,其 中硫酸根离子中的硫与氢 离子形成配位键。
砷在历史上曾用于制造杀 虫剂、防腐剂和颜料等, 但现在已被禁止或限制使 用,因为其具有剧毒性和 致癌性。
无机化学教学15章氮族元 素ppt课件
02 氮族元素的物理性质
氮族元素的原子结构
氮族元素位于元素周期表第VA 族,包括氮(N)、磷(P)、
砷(As)、锑(Sb)和铋 (Bi)。
氮族元素的原子结构特点是价电 子数为5,最外层电子排布为 ns²np³。
总结
磷的含氧酸和含氧酸盐是无机化学中重要的化合物,它们在自然界 中广泛存在,并具有多种应用,如磷肥可用于农业生产。
砷的含氧酸和含氧酸盐
含氧酸
砷酸、亚砷酸、次砷酸等。
含氧酸盐
砷酸盐、亚砷酸盐、次砷酸盐等。
总结
砷的含氧酸和含氧酸盐在无机化学中具有一定的研究价值, 它们在自然界中广泛存在,并具有潜在的应用前景,如砷 化合物在药物和农药等领域的应用。
由于价电子数相同,氮族元素的 原子半径相近,具有相似的电子
结构和性质。
氮族元素的单质和化合物
氮族元素的单质包括氮气、磷 单质、砷单质等。
氮族元素的化合物种类繁多, 包括氧化物、氢化物、含氧酸 及其盐等。
氮族元素精选教学PPT课件

2.最高价均为+5价,最高价氧化物通式为R2O5,对应水 化物通式为HRO3或H3RO4。
3.均有+3价化合物。其氧化物为R2O3,对应水化物为 HRO2或H3RO3。
4.气态氢化物通式为RH3。
特殊性 :
1.氮元素最高价含氧酸写法为HNO3,其余为 H3RO4。
2.+5价氮元素有较强氧化性,+5价磷元素 则不显氧化性。
假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。
假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤?
3.氮元素的变价最多,其氧化物种类最多, 五种正价,但有六种氧化物。
(三)氮族元素的单质物理性质及递变规律
第一节 氮和磷
(一)氮的存在 1.
2.N2的工业制法: (1)物理方法:
(2)化学方法:
(二)氮气的物理性质: 无色无味,难溶于水,比空气稍轻。
(三)氮气的化学性质
2.氮气的化学性质
氮族元素
(一)氮族元素的名称符号及在周期表中的位置
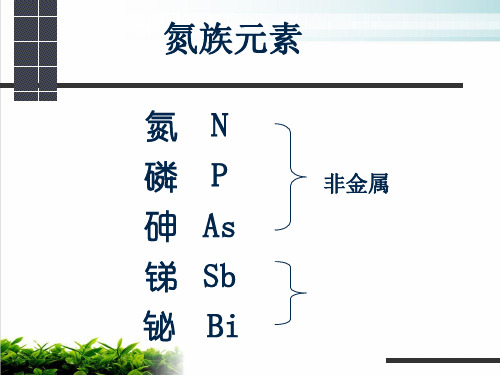
氮族元包括氮(N)、磷(P)、砷(As)、锑(Sb)、 鉍(Bi)五种元素,在周期表中位于VA族。
(二)氮族元素的相似性、递变性、特殊性
相似性
1.最外电子层上均有5个电子,能获得3个电子,在与 金属、氢气反应时显-3价,有氧化性,在与O2反应时显 正价,有还原性。
《氮族元素》PPT课件 (2)

• 实验证明,氮分子与过渡金属形成的化学键,不 仅有经典的σ配位键,还有π反馈键,导致氮分 子的三键被削弱,氮分子被活化。
16-2-2 氮的氢化物
氨是最重要的氮肥,是产量最大的化工产品之一 一、氨
制备
773K, 30~70MPa
N2+H2
Fe触媒
NH3
工业制法 哈伯法
哈伯获得1918年诺贝尔化学奖
《氮族元素》PPT课件 (2)
16-1、元素的基本性质
性质
原子序数
原子量
共价半径/pm 离子 M3半径 M3+ /pm M5+
第一电离势
(KJ/mol) 第一电子亲和
势(KJ/mol) 电负性
N 7 14.01 70 171 16 13
1402
-7
3.04
P 15 30.97 110 212 44 35
△
(火山爆发) (NH4)2Cr2O7
N2 ↑+ Cr2O3+4H2O
(除N2中的NH3) 2NH3+3CuO △ 3Cu+N2↑+3H2O
8NH3+3Br2(aq)△ N2↑+6NH4Br
2NaN3
△ 3N2 ↑+2Na(l)
极纯的 N2
工业制法:分馏空气。
性质
物理 性质
ห้องสมุดไป่ตู้
无色、无味的气体,难溶于水, 熔点:63K, 沸点:77K,较低, 临界温度126K,因此难 液化,只有在加压和极低温度下才能得到 液氮,作致冷剂,呈惰性.
的稀溶液均呈淡蓝色,因含有”氨合电子“,所以有顺 磁性、导电性和强还原性。
2、化学性 质
还原性
3Cl2+2NH3
N2↑+6HCl 检验Cl2管道是否漏气
16-2-2 氮的氢化物
氨是最重要的氮肥,是产量最大的化工产品之一 一、氨
制备
773K, 30~70MPa
N2+H2
Fe触媒
NH3
工业制法 哈伯法
哈伯获得1918年诺贝尔化学奖
《氮族元素》PPT课件 (2)
16-1、元素的基本性质
性质
原子序数
原子量
共价半径/pm 离子 M3半径 M3+ /pm M5+
第一电离势
(KJ/mol) 第一电子亲和
势(KJ/mol) 电负性
N 7 14.01 70 171 16 13
1402
-7
3.04
P 15 30.97 110 212 44 35
△
(火山爆发) (NH4)2Cr2O7
N2 ↑+ Cr2O3+4H2O
(除N2中的NH3) 2NH3+3CuO △ 3Cu+N2↑+3H2O
8NH3+3Br2(aq)△ N2↑+6NH4Br
2NaN3
△ 3N2 ↑+2Na(l)
极纯的 N2
工业制法:分馏空气。
性质
物理 性质
ห้องสมุดไป่ตู้
无色、无味的气体,难溶于水, 熔点:63K, 沸点:77K,较低, 临界温度126K,因此难 液化,只有在加压和极低温度下才能得到 液氮,作致冷剂,呈惰性.
的稀溶液均呈淡蓝色,因含有”氨合电子“,所以有顺 磁性、导电性和强还原性。
2、化学性 质
还原性
3Cl2+2NH3
N2↑+6HCl 检验Cl2管道是否漏气
氮族元素PPT课件

(一) 氨和铵盐
1、 氨的制备
工业制备:ຫໍສະໝຸດ 催化剂N2 + 3 H2 高温、高压 2 NH3
300×105~700×105 Pa,约400~450 ℃
实验室制备: 2 NH4Cl(s) + Ca(OH)2(s) △ CaCl2(s) + 2 NH3↑+ 2 H2O
Mg3N2 + 6 H2O = 3 Mg(OH)2 + 2 NH3↑
氮元素
(二)联氨(肼)
2、 联氨的制备
2 NH3 + C1O- = N2H4 + C1- + H2O (NH2)2CO + NaClO + 2 NaOH = N2H4 + NaCl +
高温高压 与氢气反应: N2 + 3 H2 催 化 剂 2 NH3
与氧气反应: 与金属反应:
放电
N2 + O2
2 NO
250℃ 6 Li + N2 △ 2 Li3N
(IA 族)
3 Ca + N2 = Ca3N2 (IIA 族)
氮元素
(三)N2 的制备
1、工业制备 液体空气分馏,氮气先逸出
150×105 Pa 左右压强下钢瓶运输和使用
氮元素
2 、 氨分子的结构
不等性 sp3 杂化,有一对孤电子对 , 分子呈三角锥形结构,键角变小至 10718’ 。
3、 氨的物理性质
气态:常温常压下是具有刺激性气味的无色气体 溶液:在 20℃ 时 l dm3 水可溶解 700 dm3 氨 液态:2NH3 NH4+ + NH2-
KӨ = 1.9 10-33(-55 ℃)
氮族元素PPT课件

1、物理性质:晶体、易溶于水 2、化学性质:(写出方程式)
(1)受热分解
NH4Cl
NH3 ↑+ HCl↑
(2)与碱的反应
NH4+ + OH- NH3↑+H2O
2020年10月2日
12
检验NH4+
3、检验NH4+的方法: 与NaOH溶液共热, 并用湿润的红色石蕊试纸检验
2020年10月2日
13
一氧化氮NO和二氧化氮NO2
汇报人:XXX 汇报日期:20XX年10月10日
29
氮和氮的化合物
2020年10月2日
1
氮和氮的化合物 复习课
一、氮族元素原子结构及对应单 质和化合物性质递变规律
1、氮族元素有: N、P、As、Sb、Bi
2020年10月2日
2
氮族元素递变规律
2、性质递变规律:(从上到下) a、单质的熔沸点:
递增(Sb、Bi例外) b、元素的金属性、非金属性:
5
氮气的性质
2、N2能与哪些物质反应?
N2 +3H2
2NH3
N2 + O2
2NO
3Mg+N2
2020年10月2日
MgN2
6
氨气的结构
NH3:
1、结构: 三角锥形,
极性 键构成的 极性 分子,
电子式:
结构式 。
2020年10月2日
7
氨气的物理性质
2、物理性质:
无 色 刺激性气味的气体、
易 液化 极易 溶于水,
C+4HNO3(浓)= CO2↑+2NO2↑+2H2O
2020年10月2日
20
硝酸的强氧化性 浓硝酸为什么呈黄色?
第15章-氮族元素ppt课件

NH 4Cl NaNO 2 NaCl 2H2O N2
杂质:NH3 ,NO ,O2 , H2O等
(NH4 )2 Cr2O7 (s) N2 (g) Cr2O3 4H2O
8NH3 3Br2(aq) N2(g) 6NH4Br 2NH3 2CuO(s) N2(g) 3H2O 3Cu
2Na 2NH3 350 C 2NaNH2 H2 2Mg 2NH3 Mg3N2 3H2
K3[Cr(CN)6 ] 3K 液氨 K6[Cr(CN)6 ] K2[M(CN)4 ] 2K 液氨 K4[M(CN)4] (M Ni, Pd, Pt)
4. 氨 参 与 的主要 化 学 反 应
a. 配 位 反 应 : NH3 是Lewis碱
F3B + :NH3 = F3B:NH3
NH3 + HCl → NH4Cl
Zn2 2NH2 Zn(NH2 )2 2NH2 Zn(NH2 )42
3. 形成氨合电子
活泼的碱金属或碱土金属液氨稀溶液呈蓝色, 浓溶液呈青铜色;溶液的导电能力强于任何电解质 溶液,类似金属,顺磁性,强还原性。
M1+(x+y)NH3 =M1(NH3)+y +e(NH3)x-(蓝色) M2+(2x+y)NH3 =M2(NH3)2+y +2e(NH3)x-(蓝色)
N2 具有很高的稳定性, 实验表明3000℃时 只有0.1%N2 解离.
N2 分子是已知的双原子分子中最稳定的.
15-1-2 N2的化学性质
一. 与活泼金属形成晶格能大的离子型化合物
室温下,N2 仅能与Li反应: 6Li + N2 = 2Li3N
( 有实际意义的反应温度为250℃)
ⅡA族金属都要在加热条件下才能形成氮化物:
第 15 章 氮族元素
杂质:NH3 ,NO ,O2 , H2O等
(NH4 )2 Cr2O7 (s) N2 (g) Cr2O3 4H2O
8NH3 3Br2(aq) N2(g) 6NH4Br 2NH3 2CuO(s) N2(g) 3H2O 3Cu
2Na 2NH3 350 C 2NaNH2 H2 2Mg 2NH3 Mg3N2 3H2
K3[Cr(CN)6 ] 3K 液氨 K6[Cr(CN)6 ] K2[M(CN)4 ] 2K 液氨 K4[M(CN)4] (M Ni, Pd, Pt)
4. 氨 参 与 的主要 化 学 反 应
a. 配 位 反 应 : NH3 是Lewis碱
F3B + :NH3 = F3B:NH3
NH3 + HCl → NH4Cl
Zn2 2NH2 Zn(NH2 )2 2NH2 Zn(NH2 )42
3. 形成氨合电子
活泼的碱金属或碱土金属液氨稀溶液呈蓝色, 浓溶液呈青铜色;溶液的导电能力强于任何电解质 溶液,类似金属,顺磁性,强还原性。
M1+(x+y)NH3 =M1(NH3)+y +e(NH3)x-(蓝色) M2+(2x+y)NH3 =M2(NH3)2+y +2e(NH3)x-(蓝色)
N2 具有很高的稳定性, 实验表明3000℃时 只有0.1%N2 解离.
N2 分子是已知的双原子分子中最稳定的.
15-1-2 N2的化学性质
一. 与活泼金属形成晶格能大的离子型化合物
室温下,N2 仅能与Li反应: 6Li + N2 = 2Li3N
( 有实际意义的反应温度为250℃)
ⅡA族金属都要在加热条件下才能形成氮化物:
第 15 章 氮族元素
《氮族元素》PPT2 人教版
作业
教材第八页 一。1、3、4、7、9 二。1、2、3、4、6
(第二课时)
思考题
如何区别二氧化氮气体和溴蒸气?
水溶法、硝酸银溶液试验法、萃取法
湿润的KI一淀粉试纸?
二、磷
磷有多种同素异形体,其中主要的是白磷和红磷。
蜡状固体 白色或黄色
粉末状固体 红色
1.82
2.34
剧毒
无毒
不溶于水,易溶于CS2 不溶于水和CS2
1、五氧化二磷 (P2O5)
P2O5 + 3H2O(热)= 2H3PO4 P2O5 是白色固体,强吸湿性,是非氧化性酸性干燥剂
2、磷酸
1 、)磷酸的物理性质:无色透明晶体,熔点42.35oC, 有吸湿性,易溶于水。 2 、)化学性质: 磷酸稳定,不易分解。高沸点、中强 酸,具有酸的通性。
作业
1、阅读材料《砷的发现》和《自然界中氮循环》 2、课本第8页一。5、6 二。5、7 三 四
并倒立于水槽中,充分反应后,剩余气体的体积为原体 积的几分之几?
将充满NO2和NO混合气体 的试管倒立于水槽中,充分反 应后,若水升到1/4处,则原混合气体中NO2和NO 体积
比为多少?
将充满NO2和O2的混合气体的试管倒立于水中,若试管
的容积为10ml ,充分反应后剩余气体1ml ,求原混合气体中 的体积各为多少ml?
•
3.安南提交的报告如果能够得以通过 ,日本 就有希 望获得 常任理 事国席 位。对 此,曾 经深受 日本军 国主义 之害的 中、韩 等邻国 存有很 深的疑 虑。
•
4.娄机为人正直。关心国事。做皇太 子老师 时,向 皇太子 陈说正 直道理 ,并上 密奏章 陈述 将帅专权,对军纪的管理松懈,不 训练检 阅军队 。
《氮族元素》PPT课件

OH
OH
焦磷酸 四元酸
Kθ a1
3.0×10-2
06.01.2021
P
HO
H
HO
亚磷酸 二元酸
5.0×10-2
整理ppt
P
H
H
HO
次磷酸 一元酸
1.0×10-2
17
T26.怎样鉴别磷酸盐、焦磷酸盐和偏磷酸盐?(思考)
加AgNO3溶液,都有沉淀,但颜色不同:
Ag3PO4
Ag4P2O7
AgPO3
黄
白色 白色
2NH3 + ClO- = N2H4 + Cl- + H2O 在催化剂作用下,H2还原NO2得到NH2OH(s)
液氨溶解活泼金属生成蓝色溶液: Na →Na+ + e- Na+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金
16
T24.画出H3PO4的结构式,说明磷与非羟基氧的成键特征。(P681)
O
P
HO OH
OH
三元酸
氢键
两个d←pπ键
Kθ a1
=7.6×10-3
属于中强酸,无氧化性。
T25.分别画出H4P2O7、H3PO3、H3PO2的结构式,指出各是几元
酸,比较酸性的强弱。(p682-688)
O
O
O
O
HO P O P OH
属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。
T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659)
T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
无机化学(2)氮族元素ppt

本章要求: 1.掌握N2、NO、NO2的结构和实验室制法。 2.掌握NH3的结构、性质、制法和铵盐的性 质。了解氨的衍生物的性质。 3.掌握HNO2及其盐的性质;HNO3及其盐 的结构、性质;硝酸盐热分解的一般规律。 4. 掌握P4、P4O6、P4O10和H3PO4的结构、制 备、性质及用途。磷酸盐的溶解性。了解次磷酸、 亚磷酸、焦磷酸、偏磷酸结构式的书写、命名和 主要性质以及卤化磷的水解性。 5.了解砷、锑、铋及其氧化物(氢氧化物)、 硫化物、硫代酸盐的性质。了解本族元素从氮到 铋稳定氧化态的递变规律和惰性电子对效应。
与两个氧原子p轨道形成三个原子四个电子的Л 键Л 34。
原子六电子的离域Л 键Л 46。
在NO3-离子中,每个键角为120°,N-O键长为121pm
介于单键键长(143pm)和双键键长(119 pm)之间。
九、单质磷
主要有三种同素异形体:白磷(有叫黄磷)、红磷和黑磷。
白磷剧毒,误食0.1g就能致死,皮肤接触到单质磷 也会引起中毒!白磷不溶于水,易溶于CS2。 磷在低于673K的蒸汽中或在二硫化碳溶液中以四面 体状的P4分子存在。分子中P-P-P键角是60°,比纯p
N呈最低氧化数-3(还原反应) N连接有3个H(取代反应)
(1)加合反应 如:NH3 + H2O ==NH3.H2O ==NH4+ + OH加H+生成铵盐; 加OH- 释放NH3 :实验室制NH3、鉴定
NH4+盐
Ag+ + 2NH3 ─→[Ag(NH3)2]+
Cu2+ + 4NH3 ─→[Cu(NH3)4]2+
八、硝酸及其盐 1、HNO3 制备:工业:氨氧化法 实验室:NaNO3 + H2SO4(浓) →NaHSO4 + HNO3 性质: ①纯HNO3为无色液体,具有挥发性,强酸性 ②受热或光照分解:4HNO3 4NO2↑+ O2↑+ 2H2O (NO2又可溶于HNO中 ,使之呈黄─→棕色) ③强氧化性: a. 非金属 + HNO3 → 非金属含氧酸 + NO↑(Cl2、O2除外) 如:3C + 4HNO3 ─→ 3CO2↑+ 4NO↑+ 2H2O 3P + 5HNO3 + 2H2O ─→ 3H3PO4 + 5NO↑ S + 2HNO3 ─→ H2SO4 + 2NO↑ 3I2 + 10HNO3 ─→ 6HIO3 + 10NO↑+ 2H2O
与两个氧原子p轨道形成三个原子四个电子的Л 键Л 34。
原子六电子的离域Л 键Л 46。
在NO3-离子中,每个键角为120°,N-O键长为121pm
介于单键键长(143pm)和双键键长(119 pm)之间。
九、单质磷
主要有三种同素异形体:白磷(有叫黄磷)、红磷和黑磷。
白磷剧毒,误食0.1g就能致死,皮肤接触到单质磷 也会引起中毒!白磷不溶于水,易溶于CS2。 磷在低于673K的蒸汽中或在二硫化碳溶液中以四面 体状的P4分子存在。分子中P-P-P键角是60°,比纯p
N呈最低氧化数-3(还原反应) N连接有3个H(取代反应)
(1)加合反应 如:NH3 + H2O ==NH3.H2O ==NH4+ + OH加H+生成铵盐; 加OH- 释放NH3 :实验室制NH3、鉴定
NH4+盐
Ag+ + 2NH3 ─→[Ag(NH3)2]+
Cu2+ + 4NH3 ─→[Cu(NH3)4]2+
八、硝酸及其盐 1、HNO3 制备:工业:氨氧化法 实验室:NaNO3 + H2SO4(浓) →NaHSO4 + HNO3 性质: ①纯HNO3为无色液体,具有挥发性,强酸性 ②受热或光照分解:4HNO3 4NO2↑+ O2↑+ 2H2O (NO2又可溶于HNO中 ,使之呈黄─→棕色) ③强氧化性: a. 非金属 + HNO3 → 非金属含氧酸 + NO↑(Cl2、O2除外) 如:3C + 4HNO3 ─→ 3CO2↑+ 4NO↑+ 2H2O 3P + 5HNO3 + 2H2O ─→ 3H3PO4 + 5NO↑ S + 2HNO3 ─→ H2SO4 + 2NO↑ 3I2 + 10HNO3 ─→ 6HIO3 + 10NO↑+ 2H2O
氮族元素PPT教学课件

• 2.花卉配置:花境中花卉的配置应考虑色彩、姿 态、体型及数量的调和与对比,整体构图又必须 是完整的。还要求一年中有季节变化,并且维护 省工。
• 3.适宜种类:几乎所有的露地花卉都可以布置花 境,尤其宿根和球根花卉。
(三)花丛及花群
• 1. 含义:花丛和花群大小不拘,简繁均宜, 株少为丛,丛连成群。
• 3.形式: • 有单独、连续带状及成群组合等类型。
• 4.图案:内部花卉所组成的纹样多采用对称 的图案。外形多样。
• 5.色彩:要求经常保持鲜艳的色彩和整齐的 轮廓。
• 6.植物种类: • (1)多选用植株低矮、生长整齐、花期集中、
株丛紧密而花色艳丽的种类。
• (2)一般还要求便于经常更换及移栽布置。 • (3)常选用一、二年生花卉。
7.花坛分类
• 按植物材料的组合分也可分为毛毡花坛和 花丛花坛。
• (1)毛毡花坛:
• 是以不开花的五色草和少量的观叶为主的 小形草花和盆花组成的花坛。
• 适合于表现花坛平面图案的变化 • 如:五色苋类、三色堇、雏菊、半支莲等。
• (2)花丛花坛:
• 是以开花时整体的效果为主,表现出不同 花卉的种或品种的群体及相互配合所显示 的绚丽色彩与优美外貌。
氮族元素
(一)氮族元素的名称符号及在周期表中的位置
氮族元包括氮(N)、磷(P)、砷(As)、锑(Sb)、 鉍(Bi)五种元素,在周期表中位于VA族。
(二)氮族元素的相似性、递变性、特殊性
相似性
1.最外电子层上均有5个电子,能获得3个电子,在与 金属、氢气反应时显-3价,有氧化性,在与O2反应时显 正价,有还原性。
• 如我国常布置成“盆景式”花台,以松、 竹、梅、杜鹃、牡丹等为主,配饰山石小 草,重姿态风韵,不在于色彩的华丽。
• 3.适宜种类:几乎所有的露地花卉都可以布置花 境,尤其宿根和球根花卉。
(三)花丛及花群
• 1. 含义:花丛和花群大小不拘,简繁均宜, 株少为丛,丛连成群。
• 3.形式: • 有单独、连续带状及成群组合等类型。
• 4.图案:内部花卉所组成的纹样多采用对称 的图案。外形多样。
• 5.色彩:要求经常保持鲜艳的色彩和整齐的 轮廓。
• 6.植物种类: • (1)多选用植株低矮、生长整齐、花期集中、
株丛紧密而花色艳丽的种类。
• (2)一般还要求便于经常更换及移栽布置。 • (3)常选用一、二年生花卉。
7.花坛分类
• 按植物材料的组合分也可分为毛毡花坛和 花丛花坛。
• (1)毛毡花坛:
• 是以不开花的五色草和少量的观叶为主的 小形草花和盆花组成的花坛。
• 适合于表现花坛平面图案的变化 • 如:五色苋类、三色堇、雏菊、半支莲等。
• (2)花丛花坛:
• 是以开花时整体的效果为主,表现出不同 花卉的种或品种的群体及相互配合所显示 的绚丽色彩与优美外貌。
氮族元素
(一)氮族元素的名称符号及在周期表中的位置
氮族元包括氮(N)、磷(P)、砷(As)、锑(Sb)、 鉍(Bi)五种元素,在周期表中位于VA族。
(二)氮族元素的相似性、递变性、特殊性
相似性
1.最外电子层上均有5个电子,能获得3个电子,在与 金属、氢气反应时显-3价,有氧化性,在与O2反应时显 正价,有还原性。
• 如我国常布置成“盆景式”花台,以松、 竹、梅、杜鹃、牡丹等为主,配饰山石小 草,重姿态风韵,不在于色彩的华丽。
氮族元素基础知识要点课件

氮族元素的化合物
• 氨气(NH3) • 硝酸(HNO3) • 亚硝酸(HNO2) • 氮氧化物(NOx)
氮气的制备和应用
1
制备方法
氮气可以通过加热含氮化合物(如氨)并与空气中的氧反应,或者通过液态空气分离 获得。
2
工业应用
氮气广泛用于保护食品、制造电子产品、灭火和制造氨肥料等工业应用。
3
实验室应用
氮族元素基础知识要点 ppt课件
本课件介绍氮族元素的基础知识要点,包括原子结构和周期表中的位置,氮 族元素的常见性质,以及氮族元素在生活中的重要应用。
原子结构和周期表
原子结构
周期表
氮族元素的原子结构包括核子、 原子核和电子云,这些结构决 定了元素的化学性质。
氮族元素在周期表中位于第15 族,具有相似的电子排布和化 学性质。
氮气被用于实验室中的反应保护、干燥溶剂和制备高纯度化合物。
氮族元素室气体的 一种,对全球气候变暖 起着重要作用。
2 水体富营养化
氮肥的过度使用导致农 业污染,水体富营养化 对水生生物造成危害。
3 酸雨形成
氮氧化物和硫氧化物共 同导致酸雨的形成,对 植被和环境造成破坏。
不活泼
氮族元素在常温下较为稳定,不与大多数物 质发生反应,适合作为惰性气体使用。
氮族元素的重要应用
肥料生产
氮族元素广泛用于农业肥料的 制造,促进植物生长和提高农 作物产量。
液态氮的应用
液态氮被用于制冷冻藏食品、 保护生命器官和制造高温超导 体等领域。
爆炸物制造
一些氮族元素化合物具有爆炸 性,被广泛用于炸药和火箭推 进剂的制造。
氮分子
氮分子由两个氮原子通过共享 电子形成,具有较高的稳定性 和广泛的应用。
大学化学《无机化学-氮族元素》课件

13.2 氮的氢化物 1.氨 (NH3)
.. (1)结构:
N
107.3o
N:sp3杂化,三角锥形
H
Hห้องสมุดไป่ตู้
H
(2) 制备:
实验室:
2NH 4Cl Ca(OH) 2 CaCl 2 2H 2O 2NH 3 (g)
工 业: N2 3H2 450~5 00C 30MPa Fe2NH3
(3)NH3的性质:
(4)用碱吸收
2NO 2 2NaOH NaNO 3 NaNO 2 H2O
13.5 氮的含氧酸及其盐 1.亚硝酸
结构:
N:sp2杂化后
π
制备:NaNO2 H2SO 4 冷 NaHSO 4 HNO2
NO NO2 H2O 冷冻2HNO2
性质:(1)不稳定
2HNO 2 H2O N2O3
(2)弱酸
(蓝色)
H2O NO NO 2
HNO2 H NO2 _
Ka 7.210_ 4
2HNO2 + 2I- + 2H+ == 2NO + I2+ 2H2O 5NO2 - + 2MnO4-+ 6H+ == 5NO3- + 2Mn2+ + 3H2O
NO2-+Cl2+H2O == 2H++ 2Cl-+NO3-
a 易溶于水,易形成一元弱碱
NH3 H2O
NH3 H2O
NH 4
_
OH
b 强还原性
4NH3 3O2 (纯) 2N2 6H2O 4NH3 5O2 (空气) Pt 4NO 6H2O
c 加合反应
H NH3 NH4 Ag NH3 [Ag(NH3 )2 ]
《氮族元素》课件

例如,氨气与氯化银反应可以生成氯氨络合物,这是配位反应。
03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
氮族元素PPT2 人教版

其根治方法是杜绝向大气中排放氮氧化物和碳氧化物。
一、氮气
3、氮气的用途
(1)合成氨、制硝酸、制氮肥、炸药;
(2)做保护气:焊接金属、填充灯泡、保存食品;
(4)高科技领域:用液氮制造低温环境,使有 些超导材料获得超导性能。
(3)医学上,液氮做7、9 二。1、2、3、4、6
粉末状固体
红色 2.34 无毒
不溶于水和CS2
40℃,易自燃
240℃,不自燃
二、磷
磷的化学性质:
(1)磷与氧气反应: (2)磷与氯气反应: (3)白磷
隔绝空气加热到260 ℃ 加热到416 ℃升华后,冷凝
红磷
二、磷
磷的贮存和用途
白磷 红磷
密闭保存
贮 存
用 途
密闭容器,量少时保存 在水中
制高纯度磷酸、制燃烧 制高纯度磷酸、制农药、 弹、烟雾弹 安全火柴
作业
1、阅读材料《砷的发现》和《自然界中氮循环》 2、课本第8页一。5、6 二。5、7 三 四
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基 11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。 53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。 36、失败者任其失败,成功者创造成功。 37、世上没有绝望的处境,只有对处境绝望的人。 38、天助自助者,你要你就能。 39、我自信,故我成功;我行,我一定能行。 40、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 41、从现在开始,不要未语泪先流。 75、自己选择的路,跪着也要走完。
一、氮气
3、氮气的用途
(1)合成氨、制硝酸、制氮肥、炸药;
(2)做保护气:焊接金属、填充灯泡、保存食品;
(4)高科技领域:用液氮制造低温环境,使有 些超导材料获得超导性能。
(3)医学上,液氮做7、9 二。1、2、3、4、6
粉末状固体
红色 2.34 无毒
不溶于水和CS2
40℃,易自燃
240℃,不自燃
二、磷
磷的化学性质:
(1)磷与氧气反应: (2)磷与氯气反应: (3)白磷
隔绝空气加热到260 ℃ 加热到416 ℃升华后,冷凝
红磷
二、磷
磷的贮存和用途
白磷 红磷
密闭保存
贮 存
用 途
密闭容器,量少时保存 在水中
制高纯度磷酸、制燃烧 制高纯度磷酸、制农药、 弹、烟雾弹 安全火柴
作业
1、阅读材料《砷的发现》和《自然界中氮循环》 2、课本第8页一。5、6 二。5、7 三 四
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基 11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。 53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。 36、失败者任其失败,成功者创造成功。 37、世上没有绝望的处境,只有对处境绝望的人。 38、天助自助者,你要你就能。 39、我自信,故我成功;我行,我一定能行。 40、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 41、从现在开始,不要未语泪先流。 75、自己选择的路,跪着也要走完。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、N2 1、结构: VB法处理:不定性sp杂化,直线性,1个σ键,2个π键。 MO法处理:键级为3 N≡ N 所以 N2是已知最稳定的双原子分子。 2、性质 特殊的稳定性,但可发生以下反应 N2 + Li →Li3N (常温) N2 + Ca → Ca3N2 (加热) 3、制备 (1)NaNO2(饱和)+NH4Cl(饱和)→N2↑+NaCl+H2O (2) (NH4)2Cr2O7 →N2 ↑ + Cr2O3 + H2O (3) NH3 + CuO →N2 ↑ +Cu + H2O
N呈最低氧化数-3(还原反应) N连接有3个H(取代反应)
(1)加合反应 如:NH3 + H2O ==NH3.H2O ==NH4+ + OH加H+生成铵盐; 加OH- 释放NH3 :实验室制NH3、鉴定
NH4+盐
Ag+ + 2NH3 ─→[Ag(NH3)2]+
Cu2+ + 4NH3 ─→[Cu(NH3)4]2+
四、铵盐 固体铵盐的热分解规律(产物因酸根性质不同而异): 1、非氧化性酸的铵盐 a. 挥发性酸的铵盐 :NH3↑ + 酸↑(NH4Cl) b. 非挥发性酸的铵盐 :NH3↑+ 酸((NH4)3PO4) 2、 氧化性酸的铵盐:N2或氮的氧化物(不放NH3↑) 分析:因NH3具有还原性, 可认为分解过程中放出的NH3 和氧化性酸又进一步发生氧化还原反应 ①.NH4NO2→N2↑+ 2H2O (可用于实验室制N2) ②.NH4NO3 →N2O↑+ 2H2O → N2↑+ O2↑制炸药 ③.(NH4)2Cr2O7 → N2↑+Cr2O3+4H2O (反应中产生气体和绿色的Cr2O3,犹如火山爆发)
HNO3氧化性比浓HNO3强。
王水:浓硝酸与浓盐酸的混合液(体积比为1:3)可
溶解不能与硝酸作用的金属,如: Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O 3Pt+4HNO3+18HCl= H2[PtCl6]+4 NO↑+8H2O 金和铂能溶于王水,主要是由于王水中不仅含有HNO3、 Cl2、NOCl等强氧化剂: HNO3+3HCl=NOCl+Cl2↑+2H2O
HNO2 蓝色
N2O3 + H2O
NO↑+ NO2↑+ H2O 红棕色
此反应可用于NO2-的鉴定; (NO2- + H+ HNO2, HNO2不稳定, 产生特有的现象)。 将NO+NO2溶解在冰水中生成蓝色的 HNO2。 (3)既有氧化性又有还原性 2NO2- + 2I- + 4H+ → 2NO + I2 + 2H2O(用于定量测定NO2-含量) NO3- + I- 不反应 NO2- + Fe2+ + 2H+ ─→ NO + Fe3+ + H2O 5NO2- + 2MnO4- + 6H+ ─→ 5NO3- + 2Mn2+ + 3H2O
八、硝酸及其盐 1、HNO3 制备:工业:氨氧化法 实验室:NaNO3 + H2SO4(浓) →NaHSO4 + HNO3 性质: ①纯HNO3为无色液体,具有挥发性,强酸性 ②受热或光照分解:4HNO3 4NO2↑+ O2↑+ 2H2O (NO2又可溶于HNO中 ,使之呈黄─→棕色) ③强氧化性: a. 非金属 + HNO3 → 非金属含氧酸 + NO↑(Cl2、O2除外) 如:3C + 4HNO3 ─→ 3CO2↑+ 4NO↑+ 2H2O 3P + 5HNO3 + 2H2O ─→ 3H3PO4 + 5NO↑ S + 2HNO3 ─→ H2SO4 + 2NO↑ 3I2 + 10HNO3 ─→ 6HIO3 + 10NO↑+ 2H2O
三、NH3 结构:不等性sp3杂化,三角锥形 1、制备 工业合成: N2 + 3H2 2NH3 实验室制备: 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑+ 2H2O 2、性质 无色: 刺激味气体, 液氨可做制冷剂、溶剂。 三类反应: 基于NH3分子中N上有孤对: Cu + 4HNO3(浓) ─→ Cu(NO3)2 + 2NO2↑+ 2H2O 3Cu + 8HNO3(稀) ─→ 3Cu(NO3)2 + 2NO↑+ 4H2O Zn + 4HNO3(浓) ─→ Zn(NO3)2 + 2NO2↑+ 2H2O 4Zn + 10HNO3(稀) ─→ 4Zn(NO3)2 + N2O↑+ 5H2O 4Zn + 10HNO3(极稀) ─→ 4Zn(NO3)2 + NH4NO3 +3H2O
轨道σ键的键角90°小了许多。 因此可知P-P键是受了
个N原子都是sp杂化的,在三个N原子间存在着离域的大π34 键。
碱性强弱顺序:NH3>H2NNH2>NH2OH 联氨、羟胺既可以作氧化剂,又可以作还原剂:
2NH2OH+2AgBr→2Ag↓+ N2↑(N2O)+2HBr+2H2O
N2H4+4CuO--→2Cu2O+N2↑+2H2O HN3在水溶液中是稳定的,在水中略有电离,它的酸性类似于 醋酸,是个弱酸。
•
NO2- + NH4+ →N2↑+ 2H2O
HNO3及NO3-的结构: 教材p667
①HNO3分子的结构 : sp2杂化 ②NO3-离子的结构: 氮原子用sp2杂化轨道与三个氧原子形成三个σ键,四 个原子处于同一个平面。此外,氮原子的另一个p轨道和 三个氧原子p轨道中的单电子形成一个垂直于sp2平面的四 平面型结构,氮原子
同时还有高浓度的氯离子,它与金属离子形成稳定的配离
子如[AuCl4]-或[PtCl6]-,从而降低了溶液中金属离子的浓
度,有利于反应向金属溶解的方向进行。
2、硝酸盐 性质: ①溶解性:大多数易溶。 ②固体盐热分解性: 常温下稳定;高温下分解, 分 解产物随金属离子不同而异, 三种情况(除NH4NO3 外), 如下: 金属活泼性 >Mg Mg-Cu 分解产物 金属亚硝酸盐+O2 金属氧化物+NO2+O2
七、亚硝酸及其盐 制备: Pb(粉) + KNO3 →KNO2 + PbO
性质: (1) HNO2是一元弱酸(比HAc略强) (2) HNO2很不稳定, 只能存在于冷稀溶液中, 浓缩或受热时分解
NO + NO2 + 2NaOH ─→2 NaNO2 + H2O NaNO2 + HCl ─→ HNO2 + NaCl (冷冻条件)
<Cu
金属单质+NO2+O2
• ③ 氧化性(酸化后)──NO3-的鉴定: 3Fe2+ + NO3- + 4H+ ─→ 3Fe3+ + NO + 2H2O NO + [Fe(H2O)6]2+─→[Fe(NO)(H2O)5]2+ + H2O (棕色) • (这两个反应用于鉴定NO3-)──棕色环实验 NO2-也可用此方法鉴定, 但区别在于鉴定NO3时酸化用浓H2SO4, 而鉴定NO2-时用HAc酸化即 可使溶液呈棕色。 可见, NO2-的存在会干扰NO3-的鉴定, 可利用 如下反应排除干扰:
【问题】联氨和羟胺作为还原剂的优点是什
么?
答案:生成N2离开反应体系,不会引入杂质。 N2H4(l)+O2(g)--→N2(g)+2H2O N2H4(l)+2H2O2(l)--→N2 (g)+4H2O(g)
六、氮的氧化物 N的氧化数可以从+1变到+5。 N2O 、NO 、N2O3 、NO2 、N2O4 、N2O5,以一氧化氮NO和二 氧化氮NO2较为重要 1、NO(无色气体) 制备:实验室制法:铜和稀硝酸反应 工业制法:氨的催化氧化 结构:奇电子化合物,顺磁性(参看教材P660) 1个σ键,1个π键,1个三电子 π键,键级:2.5 性质: ①中性氧化物,不与水、酸、碱反应 ②可以同金属离子形成配合物, 例如FeSO4溶液形成棕色可溶性的硫酸亚硝酰合铁(Ⅱ), 是检验硝酸根的“棕色环实验”显色的原因 : FeSO4+NO → [Fe(NO)]SO4 ③极易失去1个电子形成亚硝酰离子: NO+(与N2为等电子体)
与两个氧原子p轨道形成三个原子四个电子的Л 键Л 34。
原子六电子的离域Л 键Л 46。
在NO3-离子中,每个键角为120°,N-O键长为121pm
介于单键键长(143pm)和双键键长(119 pm)之间。
九、单质磷
主要有三种同素异形体:白磷(有叫黄磷)、红磷和黑磷。
白磷剧毒,误食0.1g就能致死,皮肤接触到单质磷 也会引起中毒!白磷不溶于水,易溶于CS2。 磷在低于673K的蒸汽中或在二硫化碳溶液中以四面 体状的P4分子存在。分子中P-P-P键角是60°,比纯p
第十四章 氮族元素
一、氮族元素概述
元素名称: 氮 磷 砷 锑 铋 元素符号: N P As Sb Bi 价层电子构型: ns2np3 主要氧化值 :-3 、0、+3、+5(N还有+1、+2、+4) 从N → Bi +3氧化态稳定性↑ +5 氧化态稳定性↓ ∵ 价层的ns2这一电子对稳定性↑这称为惰性电子对效 应 “惰性电子对效应”也存在于ⅢA 、ⅣA族元素中。
