物理化学相平衡完整ppt课件
物理化学(上)课件 05章 相平衡

• 这种情况下组分数可用以下关系确定:
组分数(C) = 物种数(S ) 独立化学平衡数 (R) 同一相中独立的浓度关系数(R) 注意: ① 这种物质之间的浓度关系的限制条件:只有在同一
相中方能应用,不同相中不存在此种限制条件。
• 例如:CaCO3 的分解体系,虽然有 nCaO = nCO2
但因 CaO (s) 和 CO2 (g) 不是同一相,所以不能作 为特殊的浓度制约关系。
② 需要指出的是,有时由于考虑问题的角度不同,体 系物种数 (S) 的确定可能不同,但组分数不会改变。
• 例如水溶液体系:
i)纯水液相体系:
若不考虑水的电离,组分数 C = 1,等于物种数 S。
• 若考虑电离:H2O H+ + OH • 则 S = 3 ,但有一化学平衡: R =1;
• 液相中浓度关系式
• 注意:体系中的物种数(S )和组分数(C )这两个概念 的区别:
• 体系中有几种物质,则物种数 S 就是多少;而组分
1)如果体系中各物种之间没有发生化学反应,一般说 来此时组分数等于物种数:C = S
• 例如:乙醇 溶于水,组分数
C= S =2 2)如果体系中各物质之间发生了化学反应,建立了化
相与相之间在指定条件下有明显的界面,在界面上宏观 性质的改变是飞跃式的。
§5.1 引 言
相平衡是热力学在化学领域中的重要应用之一 研究多相系统的平衡在化学、化工的科研和生产 中有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。 一、多相平衡:
1)液体的蒸发(液相和气相平衡) 2)固体的升华或熔化(固相与气相或液相平衡) 3)气体或固体在液体中的溶解度(气-液、固-液相平衡) 4)溶液的蒸气压(溶液各组分-气相组分平衡) 5)溶质在不同相之间的分布(溶质在两溶液相中的平衡)
物理化学 第六章 相 平 衡 课件

第六章相平衡§6-1 相律1.基本概念(1)相和相数相:系统中物理性质和化学性质完全相同的均匀部分称为相,系统中相数目为相数。
相数用“P”表示。
相的确定:气体:无论有多少种物质都为一相液体:根据相互的溶解性可为一相、二相、三相固体:由固体的种类及晶型决定(固熔体除外)(2)自由度和自由度数自由度:能够维系系统原有相数,而可以独立改变的变量叫自由度,这种变量的数目叫做自由度数,用“F”表示。
说明:a)在一定范围内,任意改变F不会使相数改变。
b)自由度数和系统内的物种数和相数有关。
2.相律物种数:系统中所含独立物质的数目,用“S”表示。
依据:自由度数=总变量数-非独立变量数=总变量数-方程式数相律表达式:F = C – P + 2式中C = S –R- R’称组分数R 独立反应的方程式数R’独立限制条件3.几点说明(1) 每一相中均含有S种物质的假设,不论是否符合实际,都不影响相律的形式。
(2) 相律中的2表示整体温度、压强都相同。
(3) F = C – P + 2是通常的形式。
(4) 凝聚相系统的相律是F = C – P + 1§6.2单组分系统相图相图:表示相平衡系统的组成与温度、压力之间的图形。
单组分系统一相:P=1 则F=1-1+2=2(T,P)双变量系统二相:P=2 则F=1-2+2=1(T或P)单变量系统三相:P=3 则F=1-3+2=0 无变量系统1.水的相平衡实验数据由数据可得:(1)水与水蒸气平衡,蒸气压随温度的升高而增大;(2)冰与水蒸气平衡,蒸气压随温度的升高而增大;(3)冰与水平衡,压力增大,冰的熔点降低;(4)在0.01℃和610Pa下,冰、水和水蒸气共存,三相平衡。
2. 水的相图单相区:液态水,水蒸气,冰双相线:OA —液固共存线,冰的熔点曲线OB —气固共存线,冰的饱和蒸气压曲线OC —气液共存线,水的饱和蒸气压曲线三相点:冰、水和水蒸气共存相图的说明(1) 冰在熔化过程中体积缩小,故水的相图中熔点曲线的斜率为负,但大多数物质熔点曲线的斜率为正。
物理化学第五章-相平衡PPT课件

第6页/共82页
5.2 相律
相律(phase rule)
F=C–P+2
相律是相平衡体系中揭示相数P ,独立组分数C和
自由度 F之间关系的规律,可用上式表示。式中2
通常指T,p两个变量。相律最早由Gibbs提出,所 以又称为Gibbs相律。如果除T,p外,还受其它力
场影响,则2改用n表示,即:
F=C–P+n
2021/7/14
第10页/共82页
水的相图
2021/7/14
第11页/共82页
水的相图
OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点T 647 K , p 2.2107 Pa ,这时气-液界面消失。高于临界温 度,不能用加压的方法使气体液化。
OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。
斜率为正。
OC线 dp H fus m
dT T V fus
fusH 0, fusV 0
斜率为负。
第20页/共82页
5.4 二组分理想液态混合物的气-液平衡相图
p-对x图于二和组分T体-x系图,C=2,F=4-P 。P至少为1,则 F
最多为3。这三个变量通常是T,p 和组成 x。所以要
表示二组分体系状态图,需用三个坐标的立体图表示。
在液相线和气相线之间的梭 形区内,是气-液两相平衡。
2021/7/14
第25页/共82页
T-x图
(2) T-x图 亦称为沸点-组成图。外压为大气压力,当溶
液的蒸气压等于外压时,溶液沸腾,这时的温度 称为沸点。某组成的蒸气压越高,其沸点越低, 反之亦然。
T-x图在讨论蒸馏时十分有用,因为蒸馏通常 在等压下进行。T-x图可以从实验数据直接绘制。 也可以从已知的p-x图求得。
物理化学化学平衡PPT课件
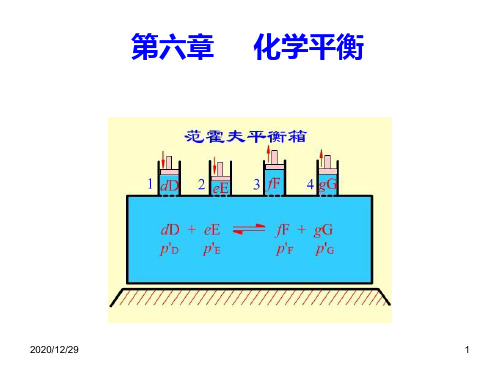
( pB B )equi.
( p ) B K p
( p ) B
Kp
p
B
B
B
B
B
K p
K
p
B PB
2020/12/29
当 B 0 时, K p 无单位。
Kp:与T有关 16
对于理想气体
K p
K
p
B PB
对于真实气体
K p K
K
f
B PB
ln
pB p
B
B
pB p
B
9
令 r Gm =
B
B
化学反应标准摩尔Gibbs 自由能
∴
r Gm = r Gm +
RT ln
B
pB p
B
令: Qp
B
pB p
B
压力商
rGm rGm RT ln Qp …理想气体反应的等温方程
2020/12/29
10
二、理想气体反应的标准平衡常数
B
对理想气体,pB cRT
B
Kc K p (RT ) B
5.液相反应用活度表示的平衡常数 Ka
Ka
(aB B )equi.
B
2020/12/29
19
总结 说明:
Kp
B
Kx ( p) B
K
n
p n总,equi.
B B
Kc
(RT
) B B
单位:
K p (: 压强)x
Kn (: mol)x Kc (: mol m3)x
了化学反应亲和势的概念。他定义化学亲和势A为:
def
G
A
( )T , p
物理化学课件6相平衡

*
基本要求:
三条两相平衡线 P=2,F=1,压力与温度只能改变一个,指定了压力,则温度由系统自定。
*
2. 水的相图
OC 是气-液两相平衡线,即水的蒸气压曲线。它不能任意延长,终止于临界点。临界点 ,这时气-液界面消失。高于临界温度,不能用加压的方法使气体液化。
OB 是气-固两相平衡线,即冰的升华曲线,理论上可延长至0 K附近。
l (水) A C e d c b a s(冰) O C ´ g (水蒸气) B
例3:在一个密闭抽空的容器中有过量的固体 NH4Cl,同时存在下列平衡:NH4Cl(s) = NH3(g) + HCl(g) 2HCl(g) = H2(g) + Cl2(g), 求:此系统的 S、R、R´ 、C、P、F ?
解:S = 3,R = 1,R´ = 0 (浓度限制条件 R’ 要求成比例的物质在同一相,此题中 CaO 与 CO2 为两相); C = S – R – R´ = 3 – 1 = 2,P = 3, F = C – P + 2 = 2 – 3 + 2 = 1
例2:一密闭抽空容器中有 CaCO3(s) 分解反应: CaCO3(s) = CaO(s) + CO2(g) 求:此系统 S、R、R´ 、C、F ?
0.103 0.165 0.260 0.414 0.610
193.5×103 156.0×103 110.4×103 59.8×103 0.610
*
2.水的相图
S(冰)
l (水)
T/℃
p/KPa
01
A
C
O
B
g (水蒸气)
*
水的相图是根据实验绘制的。图上有:
物理化学课件05章 相平衡

dG dGB dGB B dnB B dnB
因为 dnB dnB
dG B dnB B dnB (B B )dnB
平衡时 dG 0
B B
同理,可以推广到多相平衡系统
(4) 化学平衡条件
在达到化学平衡时,反应物的化学势等于生 成物的化学势,化学势的代数和可表示为
相图(phase diagram) 研究多相系统的状态如何随温度、压力和组成 等强度性质变化而变化,并用图形来表示,这种图 形称为相图。
§5.1 引 言
相律(phase rule)
研究多相平衡系统中,相数、独立组分数与描 述该平衡系统的变数之间的关系。它只能作定性的 描述,而不能给出具体的数目。
相(phase) 系统内部物理和化学性质完全均匀的部分称 为相。
f * C 1
若除温度、压力外,还要考虑其他因素(如磁 场、电场、重力场等)的影响,则相律可表示为
f C n
§5.4 单组分系统的相平衡
单组分系统的两相平衡——Clapeyron方程
外压与蒸气压的关系—— 不活泼气体对液体蒸气压的影响
水的相图 *硫的相图
超临界状态
在 界面上宏观性质的改变是飞跃式的。
§5.1 引 言
系统中相的总数称为相数,用 表示。
气体,不论有多少种气体混合,只有一个气相。
液体,按其互溶程度可以组成一相、两相或三 相共存。
固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
设 相膨胀了 dV 相收缩了 dV
当系统达平衡时 dA dA dA 0
dA p dV p dV 0
dV dV
p p
物理化学课件-相平衡

水的相图
E p B 冰 水
A C D T 气
水的相图
dp/dT=∆fusHm/∆fusVm ∆ ∆ E p
-20oC, 2.×108Pa × 临界点 374oC, × B 2.23×107Pa
冰
水
A C D T1 0.0098oC T 气
水的相图
AB 是气 液两相平衡线,即水的蒸气压曲线。它不能任意 是气-液两相平衡线 即水的蒸气压曲线。 液两相平衡线, 延长,终止于临界点 临界点p=2.2×107Pa,T=647K,这时 临界点。 延长,终止于临界点。临界点 × , , 液界面消失。 气-液界面消失。高于临界温度,不能用加压的方法使气体 液界面消失 高于临界温度, 液化。 液化。
f=K-Φ +2
相律是由吉布斯(Gibbs)1876年得到 1876年得到 相律是由吉布斯 1876 是自然界的普遍规律之一. 的,是自然界的普遍规律之一
相律推导
个组分, 个相.每个相中每种物质都存在 并没有化学反应. 每个相中每种物质都存在,并没有化学反应 设平衡系统中有K个组分 Φ 个相 每个相中每种物质都存在 并没有化学反应
µB(β) =µB θ(β)+ห้องสมุดไป่ตู้Tlna B(β) β β β
f=Φ(K-1)+2-K(Φ-1) 1 = KΦ-Φ+2-KΦ+K=K-Φ+2 Φ Φ
相律
如果指定了温度或压力: 如果指定了温度或压力 f*=K- Φ +1 1 f*称为条件自由度 如果考虑到 个因素的影响 则相 称为条件自由度,如果考虑到 个因素的影响,则相 如果考虑到n个因素的影响 律应写为: 律应写为 f*=K- Φ +n 在上述推导中假设每个组分在每个相中都有分配,如 在上述推导中假设每个组分在每个相中都有分配 如 中不含B 总变量中应减去一个变量,相 果某一相( 中不含 物质,总变量中应减去一个变量 果某一相 α)中不含B物质 总变量中应减去一个变量 相 应的化学势相等的等式中也减少一个,因此 因此,不影响相律的 应的化学势相等的等式中也减少一个 因此 不影响相律的 表达式. 表达式
物理化学 课件 第六章 相平衡

返回
自由度(degrees of freedom): 用字母 F 表示。 例: ① 一杯水和一桶水:
T, p, F =2,状态相同,不用确定系统的大小;
② H2O(l)-H2O(g)共存系统:
f=1, T,p中只有一个独立变量因 p=f(T) 。
③不饱和的NaCl(sln):T, p, c, F =3 ④ NaCl(饱和): T, p, f=2(浓度确定c=f(T))
上一内容 下一内容 回主目录
返回
§6-3 单组分系统相平衡
对于单组分系统,C = 1 ,由相律:
F C P2 3 P
若为单相,则 F= 2 ,可有两个自由度,温度与压力可以 是两个独立变量,在一定范围内任意变化。在 p – T 图上可 用面表示这类系统。
若为两相,则F = 1 ,只有一个自由度,温度与压力中 只有一个是独立变量。
上一内容
0.126 0.191 0.287 0.422 0.610 2.338 7.376 101.325 1554.4 22066
回主目录
0.103 0.165 0.260 0.414 0.610
193.5×103 156.0×103 110.4×103 59.8×103 0.610
下一内容
例1:今有密闭抽空容器中有过量固体 NH4Cl,有下列分解 反应: NH4Cl(s) = NH3(g) + HCl(g), 求:此系统的 R、R´ 、C、P、F 各为多少? 解:R=1,R´ =1(因为从 NH4Cl 出发,处于同一相,两种产 物符合比例 1:1), C = S – R – R´ = 3 – 1 – 1 = 1,P = 2,
上一内容 下一内容 回主目录
物理化学教学课件第五章相平衡

第三节 二组分系统的气-液平衡相图
(三)二组分完全互溶双液系相图的应用—— 精馏亦称分馏,是将二组分系统中完全互溶的组分A和B进行分离的一种工 艺,在工业上的应用非常广泛。其基本原理如图5-9所示。
第三节 二组分系统的气-液平衡相图
二、二组分液态部分互溶系统气-液平衡相图
当两种液体的化学性质差别 较大时,其相互溶解的情况与系 统的温度、压力和组成密切相关 ,在一定的温度、压力和组成范 围内两种液体可以完全互溶,也 可以部分互溶或者完全不互溶。
第三节 二组分系统的气-液平衡相图
A和B的气相组成分别用yA和yB表示,则有yA+yB=1。由式(5-12)可得
第三节 二组分系统的气-液平衡相图
2.杠杆规则 对组B进行物料衡算,则有
式(5-17)、式(5-18)均称为杠杆规则关系式。利用杠杆规则的 杠杆规则不仅对气液相平衡适用,在其他系统中的任意两相共存 区都成立,如液-液、液-固、固-固的两相平衡。
第三节 二组分系统的气-液平衡相图
三、二组分液态完全不互溶的气-液平衡相图
若两种液体的化学性质差别 很大,彼此间相互溶解的程度非 常小时,可以近似认为两液体完 全不互溶,如水汞、水二硫化碳
组成相图如图5-15所示。图中T*A 、TB*分别表示两个纯液态组分水 、汞的沸点。
第四节 二组分系统的固-液平衡相图
第四节 二组分系统的固-液平衡相
2.
第四节 二组分系统的固-液平衡相
2.
二组分固态部分互溶系 统相图还有具有一转熔温度( 转变温度)这种类型,如CdHg、Pt-W、AgCl-LiCl 系统,这类系统相图如图525所示。此相图形状与气相 组成位于两液相组成同一侧 的部分互溶二组分混合物的 气–液平衡相图相似。
物理化学上课件:05 相平衡

2. 相图(phase diagram)
表达多相系统的状态如何随温度、压力、组成等 强度性质变化而变化,并用图形来表示这种状态的变 化,这类图形称为相图。
相图的形状取决于变量的数目
双变量系统 三变量系统
平面图 立体图
根据需要还有三角形相图和直角相图等。
相律
1 相数 P : 系统中不同相的数目称为相数 2 物种数 S :系统中所有能单独存在的化学物质数目 3 组分数 C :能够表示相平衡系统中各相组成所需要的
(1) 仅由 NH4Cl(s) 部分分解,建立如下反应平衡: NH4Cl (s) =NH3(g)+HCl(g)
解: (1) C = S - R - R´= 3 - 1 - 1=1
f =C-P +2= 1-2+2=1 (2) 由任意量的 NH4Cl (s) 、NH3(g)、HCl(g) 建立如下反应平衡
dp vap H vap H dT T (Vg Vl ) TV (g)
解 (1) 因 S=3 、R=0 、R'=0,所以C = S-(R+R') =3,
(2) 在给定条件下反应 N2(g)+3H2(g)==2NH3(g) 达到平衡。系统中 有几个独立的平衡化学反应式,就有几个物种数不独立,R 即为 几。S =3、R =1、R' =0, C = S- (R+R') = 2
2 (1) 仅由CaCO3(s)部分分解,建立如下反应平衡: CaCO3 (s) = CaO(s)+CO2(g)
(2) 由任意量的 CaCO3 (s) 、 CaO (s)、 CO2 (g)建立如下反应平衡: CaCO3 (s) = CaO(s)+CO2(g)
物理化学第六章相平衡7.ppt

对于无气相的凝聚态系统,故F= C-P+1。
当处于恒温恒压且不考虑其他因素时:F = C-P
★相律公式适用于所有相平衡系统,对非平衡系统不适用;
但根据它只能求得变量的数目,不能知道它们的性质
例 : 碳 酸 钠 与 水 可 组 成 下 列 三 种 水 合 盐 : Na2CO3·H2O , Na2CO3·7H2O,Na2CO3·10H2O。 (1)试说明在1atm下,与碳酸钠的水溶液和冰共存的含水盐最 多可以有几种? (2)试说明在30℃时可与水蒸气平衡共存的含水盐最多可以有 几种?
第六章 相平衡
计划学时:10学时
§6.1 相 律
• 1.1 基本概念
(1)相和相数
★相--系统中物理性质和化学性质完全相同的均匀部分 ★相数--平衡系统中含有相的种类的数目,用 P 表示 ★相数的确定方法
气体--均为一相 液体--视互溶情况 固体--一般相数等于物种数(固溶体除外) 例如:NaHCO3分解平衡
OB线?
点:三相点,P=3,F=0
to 0.01C, po 0.610kPa
(3)相图的应用
① 当T、p 一定时,确定系统
相态。
② 当T、p 改变时,描述系统
相态变化。
a b cd e
系统从a到e过程系统的相态 改变如下:
H2Os H2Os H2Ol H2Ol H2Ol H2Og H2Og
P = 3(S NaHCO3、 S Na2CO3、g)
(2)物种数与组分数
★物种数S --系统中含有化学物质种类的数目
例如: NaCl水溶液
S=2 (NaCl 、H2O) S=3 (Na+ 、Cl -、 H2O)
S=5 (Na+ 、Cl -、H + 、OH - 、 H2O)
物理化学完整ppt课件

数称为(独立)组分数。 S:物种数
CSRR'
R:独立的化学平衡数 R′独立限制条件数
说明:★独立限制条件数只有在同一相中才能起作用
CaCO3(s)=CaO(s)+CO2(g) R′= 0 ★独立的化学平衡数:指物质间构成的化学平衡是相互独立的
C+H2O=CO+H2 C+CO2=2CO CO+H2O=CO2+H2 R=2 S=5 C=5-2=3
(1)因外压增加,使凝固点下降 0.00748K (2)因水中溶有空气,使凝固点下降 0.00241K
可编辑课件
16
例:如图为CO2的相图,试问: (1)将CO2在25℃液化,最小需加多大压力? (2)打开CO2灭火机阀门时,为什么会出现少量白色固体(俗称于冰)?
解:(1)根据相图,当温度为25℃ 液一气平衡时,压力应为67大气压, 在25℃时最小需要67大气压才能使 CO2液化。
2、水的相图
可编辑课件
13
◎组分数
S:物种数
CSRR'
R:独立的化学平衡数 R′独立限制条件数
总结1
说明:★独立限制条件数只有在同一相中才能起作用 ★独立的化学平衡数:指物质间构成的化学平衡是相互独立的
◎相律
◎单组分系统相图 F=C-P十2=3-P
单组分系统最多三相共存 单组分系统是双变量系统
可编辑课件
可编辑课件
7
杠杆规则还可以表示为:
(1)
m() 1 wB() wB 1
m( )
wB wB ()
m() m() wB() wB wB wB()
m( )
wB wB ()
m() wB wB() m wB() wB()
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.1 引言
自由度(degrees of freedom) 确定平衡体系的状 态所必须的独立强度变量的数目称为自由度,用字 母 f 表示。这些强度变量通常是压力、温度和浓度 等。
水的相图
水的相图
(2)到达P点时,气相出现, 在气-液两相平衡时,f 1 。 压力与温度只有一个可变。
(3)继续降压,离开P点时, 最后液滴消失,成单一气相,
f 2 。 通常只考虑(2)的情况。
三相点与冰点的区别
三相点是物质自身的特性,不能加以改变, 如H2O的三相点 T 2 7 3 .1 6 K ,p 6 1 0 .6 2 P a . 冰点是在大气压力下,水、冰、气三相共存。当大 气压力为105 Pa 时,冰点温度为273.15K ,改变外压, 冰点也随之改变。
如果已指定某个强度变量,除该变量以外的其它强
度变量数称为条件自由度,用 f *表示。
例如:指定了压力,
f * f 1
指定了压力和温度, f ** f 2
5.2 多相体系平衡的一般条件
在一个封闭的多相体系中,相与相之间可以有热 的交换、功的传递和物质的交流。对具有F 个相体系 的热力学平衡,实际上包含了如下四个平衡条件: (1)热平衡条件:设体系有,, K ,F 个相,达到平衡 时,各相具有相同温度
O点 是三相点(triple point),气-液-固三相
共存,F 3, f 0。三
相点的温度和压力皆由 体系自定。
H2O的三相点温度为273.16 K,压力为610.62 Pa。
水的相图
两相平衡线上的相变过程 在两相平衡线上的任何
一点都可能有三种情况。如 OA线上的P点:
(1)处于f点的纯水,保持 温度不变,逐步减小压力, 在无限接近于P点之前,气 相尚未形成,体系自由度为2。 用升压或降温的办法保持液相 不变。
OA线
dlnp vapHm dT RT2
v H ap m 0 斜率为正。
OB线 dlnpfusHm
水的相图
水的相图是根据实验绘制的。图上有:
三个单相区 在气、液、固三个
单相区内,F 1, f 2,温度和
压力独立地有限度地变化不会引起 相的改变。
三条两相平衡线 F 2, f 1,压力与温度只能改变
一个,指定了压力,则温度由体系自定。
水的相图
水的相图
OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点 T 647K, p2.2107 Pa,这时气-液界面消失。高于临界温 度,不能用加压的方法使气体液化。
相图(phase diagram) 表达多相体系的状态如何 随温度、压力、组成等强度性质变化而变化的图形, 称为相图。
5.1 引言
相(phase) 体系内部物理和化学性质完全均匀 的部分称为相。相与相之间在指定条件下有明显 的界面,在界面上宏观性质的改变是飞跃式的。 体系中相的总数称为相数,用 表示。
OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。
OC 是液-固两相平衡线,当C点延长至压力大于 2108 Pa时,相图变得复杂,有不同结构的冰生成。
水的相图
OD 是AO的延长线,是过冷水和水蒸气的介稳平衡 线。因为在相同温度下,过冷水的蒸气压大于冰的蒸 气压,所以OD线在OB线之上。过冷水处于不稳定状 态,一旦有凝聚中心出现,就立即全部变成冰。
定义: CSRR'
在平衡体系所处的条件下,能够确保各相组成所 需的最少独立物种数称为独立组分数。它的数值等于 体系中所有物种数 S 减去体系中独立的化学平衡数R, 再减去各物种间的浓度限制条件R'。
5.3 相律
相律(phase rule)
fFC2
相律是相平衡体系中揭示相数 ,独立组分数C和
自由度 f 之间关系的规律,可用上式表示。式中2
三相点与冰点的区别
三相点与冰点的区别
冰点温度比三相点温度低 0.01 K 是由两种因素造成的:
(1)因外压增加,使凝固点下降 0.00748K;
(2)因水中溶有空气,使凝固点下降 0.00241K。
两相平衡线的斜率
三条两相平衡线的斜率均可由Clausius-Clapeyron 方程或Clapeyron方程求得。
第五章 相平衡
5.1 引言 5.2 多相体系平衡的一般条件 5.3 相律 5.4 单组分体系的相图 5.5 二组分体系的相图及其应用 5.6 三组分体系的相图及其应用 5.7 * 二级相变
5.1 引言
相平衡是热力学在化学领域中的重要应用之一。 研究多相体系的平衡在化学、化工的科研和生产中 有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。
在单相区,物系点与相点重合;在两相区中, 只有物系点,它对应的两个相的组成由对应的相点 表示。
5.4 单组分体系的相图
单组分体系的相数与自由度
C 1
f F 3
当 F 1
单相
f 2
F 2 两相平衡
f 1
双变量体系 单变量体系
F 3 三相共存
f 0 无变量体系
单组分体系的自由度最多为2,双变量体系 的相图可用平面图表示。
通常指T,p两个变量。相律最早由Gibbs提出,所以 又称为Gibbs相律。如果除T,p外,还受其它力场影
响,则2改用n表分体系的相图
相点 表示某个相状态(如相态、组成、温度 等)的点称为相点。
物系点 相图中表示体系总状态的点称为物系点。 在T-x图上,物系点可以沿着与温度坐标平行的垂线 上、下移动;在水盐体系图上,随着含水量的变化, 物系点可沿着与组成坐标平行的直线左右移动。
T T L T F
(2)压力平衡条件:达到平衡时各相的压力相等
ppLpF
5.2 多相体系平衡的一般条件
(3) 相平衡条件: 任一物质B在各相中的化学 势相等,相变达到平衡
BB LF B
(4) 化学平衡条件:化学变化达到平衡
BB 0
B
5.3 相律
独立组分数(number of independent component)
