开发海水中的卤素资源讲义及练习
高一化学开发海水中的卤素资源(20200806100059)

金冠注册
下列变性实质上为组织坏死的是A.细胞水样变性B.玻璃样变性C.纤维素样变性D.黏液变性E.淀粉样变性 [问答题,案例分析题]李军是一位军事家,他带兵打仗的经历极富传奇色彩。甲出版社认为,若出版以李军的战斗经历为主题的传记,能获得较好的社会效益和经济效益,于是向李军约稿。李军所在的部队认为此事对部队建设很有意义,予以大力支持。考虑到李军年事已高且没有子女,还指派文 用语句描述求使1×3×5×7×……×n<1000成立的最大正整数n的算法过程。 血细胞成熟 房间隔缺损,使症状加重的心律失常为A.室早B.房早C.房室传导阻滞D.房颤E.窦性心动过速 男性,35岁。婚后10年不育,检查发现精子运动差。因伴有反复咳黄脓痰和间断咯血,要求进一步检查和确诊。下列哪一项检查最有意义A.免疫学检查B.支气管体层摄片C.痰细菌检查和抗生素敏感性测定D.高分辨计算机体层摄影(HRCT),以了解有无支气管扩张E.纤维支气管镜检查 适用于治疗支原体肺炎的是()A.庆大霉素B.二性霉素BC.氨苄青霉素D.四环素E.氯霉素 铅中毒实验,选用大鼠复制动物模型时,大鼠本身易患进行性肾病,容易与铅中毒所致的肾病相混淆,选用蒙古沙鼠则较好,因为蒙古沙鼠只有铅中毒才会使其出现肾病变。此符合模型评估原则。A、重复性B、相似性C、可靠性D、可控性 患者,男性,60岁,觉右眼视力下降伴眼胀痛半年,曾有眼压升高达30mmHg病史。眼底检查:视乳头颜色变淡,杯凹不明显。视野检查与生理盲点相连的水平偏盲。此患者目前需采用的治疗为()A.降眼压药物治疗B.扩血管治疗,随访眼压,决定进一步的治疗方案C.扩血管治疗D.青光眼手术治 SDH光纤传送网是一个灵活的、兼容的、高可靠性的、可以实行集中智能化管理的网络。SDH的本质是。A、采用标准的光接口B、一种新设备——同步复用设备C、一种新的传输系统——大容量高速光纤传输系统D、一种新的网络技术——同步传输体系 椎间盘由以下几部分组成A.前纵韧带B.后纵韧带C.纤维环D.髓核E.软骨板 水泥砂浆中水泥用量不应小于㎏/M3。A、100B、200C、300D、400 静息状态下心血池显像时正常人心室轴缩短率应该是A.大于>75%B.大于>65%C.大于>45%D.大于>35%E.大于>25% 牙挺的工作原理包括、和。 以下不属于资产配置基本步骤的是。A.明确投资目标和限制因素B.确定有效资产组合的边界C.明确资本市场的方差值D.寻找最佳的资产组合 下列哪项不是晚期产后出血主要原因()A.胎盘、胎膜残留B.蜕膜残留C.剖宫术后子宫伤口裂开D.子宫复旧不全E.凝血功能障碍 不管做什么都应爱岗敬业。A.工种B.职业C.行业D.工作 患者男性,63岁,右耳垂前肿性长大8个月。近期肿物增长较快,痛向耳颞部放散。检查发现肿物约3.5cm、质地硬、有触痛、边界不清。活动度差,右眼睑闭合较对侧迟钝。以下哪项辅助检查对患者来说是不恰当的()A.CT检查B.胸部X线片C.腮腺造影D.细针吸细胞学检查E.切除活组织检查 工程项目按照项目经济特征来划分,其中不包括。A.竞争性项目B.公共项目C.社会事业项目D.其他项目 反映疾病严重程度的指标是A.发病率B.死亡率C.感染率D.病死率E.生存率 疯牛病的病原体是A.卫星病毒B.前病毒C.缺损病毒D.朊粒E.类病毒 我们一般使用以下哪个软件用于编制项目实施计划?A.MS-VISIOB.MS-PROJECTC.EXCELD.WORD 布-加综合征支架置入的适应证有A.肝段下腔静脉膜性或节段性狭窄或闭塞,伴或不伴血栓形成B.PTA疗效不佳或再狭窄病例C.下腔静脉长段完全性闭塞D.下腔静脉癌性狭窄或闭塞E.患者极度衰弱、恶病质者 注册建造师签章文件按照管理程序可分类为。A.报审类B.核准类C.内部管理类D.报告备案类E.对外履行责任类 患者左侧鼻唇沟变浅、口角下垂、额纹变浅或消失、眼裂变大、口角偏向健侧,露齿、吹哨、鼓颊、皱眉、皱额和闭眼等动作不能,同时左眼呈内收位,右侧肢体活动无神经麻痹C.右侧核性面神经麻痹D.中枢性面神经麻痹 如何根据服务对象,如何提高服务质量? 溢流堰法的测量水流量的主要方法,所用的堰顶的形式或堰壁厚度可分为薄壁堰、和。其中薄壁堰使用方法简单,精度较高,广泛使用于明渠测流,并可实现自动测量。 向管网系统送气要强调。 男性,3岁。右腹股沟可复性包块1年余,玩耍后不停哭闹伴呕吐6小时。查体:右侧阴囊肿胀,内可触及肿块,肿块呈蒂状延至腹股沟部,触痛明显,不可还纳。术中见疝内容物系小肠,颜色已成暗紫色,疝环狭小不易回纳,遂切开疝环解除压迫,此时你如何判断肠管是否失去活力A.压迫解除后 ()是规定国家和社会的基本制度,公民的基本权利和义务,国家机关的地位、组织和活动原则等重大社会关系的法律的总称。A.经济法B.民法C.宪法D.商法 角膜A.色白半透明B.无屈光能力C.表面盖有一层球结膜D.富有感觉神经未梢E.富有淋巴管 采集尿液标本时,错误的方法是A.女性患者最好用导尿法收集B.明显的尿路感染患者也应先采集尿液再控制感染C.截瘫患者多采用耻骨上膀胱穿刺法留取尿液D.尿液标本应在12小时内处理,以避免污染和杂菌生长E.一般应留取中段尿液送检 一气团移往某地后,本身温度逐渐升高,这个气团被称为。冬季影响我国的主要气团是、,夏季除此之外还有、。 适用于金瓷冠也适用于铸瓷冠的肩台形式是A.135°肩台B.带斜面90°肩台C.刃状边缘D.90°肩台E.深凹形 在肾静态显像中,为了清楚地显示马蹄肾,应采用的静态显像方式是A.前后位静态显像(ANT)B.后位静态显像(POST)C.左前斜位(LAO)3O度D.右前斜位(RAO)30度E.左后斜位(LPO)45度 较大儿童和成人可在何种局麻下行唇裂修复术()A.上牙槽后神经阻滞麻醉B.眶下神经阻滞麻醉C.腭前神经阻滞麻醉D.鼻腭神经阻滞麻醉E.下颌神经阻滞麻醉 船舶对海洋环境的可能污染源不包括.A、营运产生的废弃物B、海上船舶打捞和拆体C、海损事故造成溢油D、清洁压载水 下列哪些支出不属于政府转移支付:A.社会福利B.军费开支C.贫困救济补助D.社会保险 按储层岩性分的气藏是。A.构造气藏B.砂岩气藏C.岩性气藏D.均质气藏 Wernicke失语患者病变的主要区域是A.额下回后部B.额下回前部C.颞上回后部D.颞上回前部E.额上回后部
高一化学开发海水中的卤素资源(20200806100059)

[单选]甲烷化催化剂的设计装填量是()m3。A.10B.12C.20D.6 [填空题]电动机按它所耗用电能种类的不同可分为()电动机和()电动机。 [单选]支气管扩张时,下列哪两个并发症最为多见()A.脓胸及肺脓肿B.肺脓肿及肺纤维化C.肺气肿及肺脓肿D.肺源性心脏病及肺纤维化E.脑膜炎及肾炎 [填空题]正是在西方地理学知识和测绘法传入我国以后,清初,由()皇帝亲自领导完成了中国全图的测绘工作。这在我国乃是一个前所未有的事件,在世界测绘学史上也是一个创举。 [名词解释]表现性 [单选]患者男性,55岁,因外伤致截瘫,护士告知家属应注意预防压疮,尤其是骶尾部更易发生,家属在进行局部皮肤按摩的时候,有一些不正确的做法,请指出A.用手鱼际部分按摩B.用手蘸50%乙醇少许C.鱼际部分需紧贴皮肤D.由轻至重、由重至轻按摩E.压力均匀,以皮肤紫红为度 [单选]港口与航道工程中船舶保险中,航次险包含在()保险中。A.船舶保险全损险B.船舶保险一切险C.工伤事故险D.第三者责任险 [单选]项某是某建筑公司司机,在一工地驾车作业时违反操作规程,不慎将一名施工工人轧死,对项某的行为应当()。A.按过失致人死亡罪处理B.按交通肇事罪处理C.按重大责任事故罪处理D.按意外事件处理 [单选]骨肉瘤好发的部位是()A.脊椎B.胫骨近端C.肱骨远端D.股骨近端E.桡骨小头 [名词解释]软件工程 [单选]光面爆破时,周边光爆眼应用炮泥封实,且封泥长度不得小于()。A.0.2mB.0.25mC.0.3m [填空题]TND360型数控车床的回转刀架具有()工位 [填空题]国际单位制规定质量的单位是千克,符号为()。 [单选,A1型题]早产儿使用铁剂预防贫血最初的月龄是()A.1个月B.2个月C.3个月D.4个月E.5个月 [单选]导致膀胱肿瘤的危险因素是()A.吸烟B.膀胱慢性感染C.长期接触联苯胺D.上述
开发海水中的卤素资源(精)

《开发海水中的卤素资源》知识梳理二一、基础知识:1、氟溴碘卤素单质都有颜色,溴是色液体,有性,故保存采用水封法;碘为色固体,易。
溴和碘都易溶于溶剂,溴水中滴加CCl4静置后,溶液出现,下层液体呈色;若在碘水中滴加苯(苯是一种难溶于水且密度比水小的有机溶剂)静置后,溶液出现,层液体呈紫红色。
I2遇变蓝。
F2把氯、溴、碘从氢化物或盐溶液中置换出来,因F2会与发生反应。
HF能腐蚀,故应保存在瓶。
2、卤原子结构卤素原子结构的共同点是最外层有个电子,所以在化学反应中易电子,具有性。
它们的区别是随着核电荷数的增加,电子层数,原子半径,原子核对最外层电子的吸引力逐渐,因此,非金属性也逐渐。
结构决定性质。
3、卤素递变规律⑴元素非金属性:F Cl Br I ⑵单质氧化性:F2Cl2Br2 I2⑶阴离子还原性:I-Br-Cl-F-⑷氯化氢稳定性:HF HCl HBr HI⑸氢卤酸酸性:HI HBr HCl HF⑹单质的颜色:逐渐⑺单质的密度、熔沸点:逐渐⑻卤化银的颜色:逐渐二、化学方程式:1、溴和水反应2、碘和氢氧化钠溶液反应3、氟气与水反应:4、铁粉与碘粉共热反应:5、氯水与溴化钠溶液反应:6、溴水与碘化钾溶液反应:7、氯水与碘化钾溶液反应:8、溴化钠溶液与硝酸银溶液反应:9、碘化钾溶液与硝酸银溶液反应:10、溴化银见光分解:11、碘化银见光分解:三、氧化还原反应1、下列化学反应基本类型中,一定是氧化还原反应的是( )A .化合反应 B. 分解反应 C. 复分解反应 D. 置换反应2、下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A. Fe+CuSO 4−→−FeSO 4+CuB. Fe 2O 3+3CO −→−∆2Fe+3CO 2 C. AgNO 3+NaCl −→−AgCl↓+NaNO 3 4−→−∆K 2MnO 4 +MnO 2 +O 2↑ 3、在下列变化中,需要加入合适的氧化剂才能实现的是( )A. HCl→H 2B. CO 2→COC. FeCl 3→FeCl 2D. SO 2→SO 34、下列变化需要加入还原剂才能实现的是( )A .MnO 4- →Mn 2+B .HCl→Cl 2C .Fe→Fe 3+D .KClO 3→O 25、对于反应MnO 2 + 4HCl(浓) −→−∆ MnCl 2 + 2H 2O + Cl 2↑,下列说法不正确的是( )A .该反应是氧化还原反应B .MnO 2是氧化剂C .HCl 是还原剂D .若生成7.1 g Cl 2,转移0.1 mol 电子6、对反应:C+2H 2SO 4(农)−→−∆ 2SO 2↑+CO 2↑+2H 2O,下列说法不正确的是( )A.浓H 2SO 4作氧化剂B. C 元素被氧化元素的化合价降低 D. 转移的电子数为2e7、苹果汁是人们喜爱的饮料。
卤素海水资源的开发和利用(课件)高考化学一轮复习课件讲义习题

液褪色原因为I2被Zn还原,A错误;
液体分层后,I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,B错误;
若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更
易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,C错误;
漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,D正确。
第四章 化工生产中的重要非金属元素
第2讲 卤素 海水资源的开发和利用
化学虫子工作室荣誉出品
本节目录
考点一 卤族元素及X-的检验 考点二 海水资源的开发和利用 链接高考
考点一 卤族元素及X-的检验
1.卤素单质的物理性质
状态 颜色 密度 熔沸点 溶解性
F2 气态 淡黄绿色
Cl2 气态
Br2 液态
黄绿色
海水中Br-经氧化、吹出、吸收后,可实现溴的富集,B正确; “吸收塔”中发生的反应为二氧化硫与溴、水反应生成硫酸和氢溴酸,反应 的化学方程式为SO2+Br2+2H2O =H2SO4+2HBr,C正确; 若“吸收塔”内用Na2CO3溶液吸收吹出的Br2,该化学方程式中氧原子、得失 电子都不守恒,D错误。
还原反应( √ ) (7)加碘盐中含有碘酸钾,能使淀粉变蓝( × )
[解析]淀粉遇到碘单质变蓝。
考点二 海水资源的开发和利用
淡化 蒸馏
反渗透
Cl2 H2、NaOH 2NaCl+2H2O
2NaOH+H2↑+Cl2↑
3.从海水中提取溴的方法
(1)工艺流程
(2)基本步骤及主要反应 Cl2+2Br- =Br2+2Cl-
链接高考
高中化学第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测(解析版)

第四章非金属及其化合物第12讲富集在海水中的元素——卤素(精讲)【考情分析】本讲内容与化工生产、日常生活、科学技术等方面有着广泛的联系,如氯碱工业、漂白粉应用、饮用水消毒、环境保护等,往往与氧化还原反应、离子反应、化学实验方案的设计与评价等知识结合出现。
预计今后:1.以氯单质及其重要化合物的性质、用途设计选择题;2.以制取氯气设计有关实验题;3.根据同主族元素性质的相似性设计信息题,考查溴、碘及其重要性质和用途。
【核心素养分析】1.宏观辨识与微观探析:能从宏观和微观相结合的视角分析与解决实际问题,在卤素学习过程中,使用“宏观—微观—结合”来认识物质及其递变规律,形成科学的方法论。
2.科学探究与创新意识:能和同学交流实验探究的成果,提出进一步探究或改进氯及其化合物的制备及性质实验的设想,培养勇于质疑和批判的创新精神。
认识科学探究是进行科学发现、创造和应用的科学实践活动;能从问题和假设出发,依据探究目的,设计探究方案,获得卤素单质的提取方法。
3.科学态度与社会责任:认识氯及其化合物对环境的影响,形成绿色环保的意识。
关注与化学有关的社会热点问题。
了解环境保护与资源开发的关系.具有绿色化学观念。
勇于承担责任,权衡利弊,积极参与化学问题的社会决策。
【网络构建】【知识梳理】智能点一氯气及其重要化合物(一)氯气1.物理性质【特别提醒】实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
2.化学性质1)从氯的原子结构认识氯气的氧化性:依据氯气的氧化性完成下列方程式: (1)与金属反应①Fe :2Fe +3Cl 2=====点燃2FeCl 3,棕红色烟。
②Cu :Cu +Cl 2=====点燃CuCl 2,棕黄色烟。
(2)与非金属反应H 2:H 2+Cl 2=====点燃2HCl ,苍白色火焰; H 2和Cl 2的混合气体光照时会发生爆炸。
(3)与还原性无机化合物反应:①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。
开发海水中的卤素资源1

第二单元开发海水中的卤素资源一、教材分析本单元是在学习原子结构的基础上,通过研究开发海水中的化学资源,重点学习有关元素化合物的知识。
通过以食盐为原料的化工产品的学习,认识盐酸、烧碱、氯气、漂粉精等重要的氯碱工业产品;通过海水中提取镁、溴、碘和氯气性质的研究,探索氯、溴、碘的性质和递变规律;通过粗盐提纯、气体制取和卤素性质实验的研究,培养学生的实验动手和实验设计能力;通过氧化—还原反应、气体摩尔体积、电离方程式和离子方程式等化学基本概念和基本理论的学习,为以后的化学学习打下重要的基础。
二、本章内容的核心观念元素观、物质结构与性质、分类观、氧化—还原转价观、守恒观三、把核心观念转化成一些基本理解本单元涉及的卤素及其化合物、氧化—还原反应、离子反应、气体摩尔体积及实验操作和设计等有关知识是中学化学中的重点。
将元素及其化合物的知识与基本概念、基本理论、化学计算、实验操作技能联系起来,达到加深、巩固对元素及其化合物知识的理解。
四、基本理解可以采用“问题”驱动,通过实验设计来促进学生的基本理解1、海水晒盐的原理。
食盐的用途。
粗盐为什么易潮解?如何进行粗盐的提纯?2、探究电解饱和食盐水的原理:如何知道阴阳两级产生的是什么气体?怎么进行检验?得到的产品有什么用途?3、探究盐酸和氯化氢的性质。
实验室制备氯化氢气体,在发生气体过程中那些装置是必需的?4、氯气的物理性质和化学性质。
如何用实验来探究氯水的主要成分?5、决定物质体积大小的因素是什么?为什么相同质量的固体、液体体积会不同?为什么标准状况下相同物质的量的气体的体积几乎相同?6、“同温同压”与“标准状况”有什么联系和区别?阿伏加德罗定律的运用7、在学习海水晒盐的基础上如何进行海水提溴和海水提碘?氯溴碘在结构上有什么相似性?性质上有什么相似性及递变规律?如何进行卤离子的检验?8、得氧失氧的氧化还原反应与无氧参与的氧化还原反应的共同特征是什么?9、氧化还原反应的实质是什么?如何分析卤素单质以及化合物的氧化性和还原性的判断。
第16讲 卤素 海水资源的开发和利用

第16讲卤素海水资源的开发和利用1.下列说法正确的是( B )A.将溴水滴入KI溶液中,加入乙醇并振荡,萃取溶液中生成的碘B.向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL 淀粉溶液,溶液显蓝色,则Br2的氧化性比I2的强C.检验海水中的碘元素,所用试剂为淀粉溶液D.加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强[解析] 乙醇易溶于水,不能作萃取剂,A错误;淀粉遇碘单质变蓝色,而海水中碘元素的存在形式为I-,C错误;该反应原理为高沸点酸制低沸点酸,但HI的酸性比H3PO4强,D错误。
2.海水晒盐后精制得到NaCl,氯碱工业电解饱和NaCl溶液得到Cl2和NaOH,以NaCl、NH3、CO2等为原料可得到NaHCO3;向海水晒盐得到的卤水中通Cl2可制溴;从海水中还能提取镁。
下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( A )A.NaOH的碱性比Mg(OH)2的强B.Cl2得到电子的能力比Br2的弱C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)D.原子的最外层电子数N:N(Na)<N(Mg)<N(Cl)<N(Br)[解析] Na的金属性强于Mg,则最高价氧化物对应水化物的碱性:NaOH强于Mg(OH)2,A项正确;Cl的非金属性强于Br,则Cl2得电子能力强于Br2,B项错误;Na、Mg、Cl位于同一周期,电子层数相同,核电荷数大的原子,其原子核对核外电子的吸引能力增强,所以原子半径会减小,则r(Na)>r(Mg)>r(Cl),C项错误;Br与Cl同主族,最外层电子数相同,D项错误。
3.某同学为了验证海带中含有碘,在实验室进行如下实验。
下列说法正确的是( D )A.步骤③所需玻璃仪器仅为漏斗、烧杯B.步骤④中H2O2的作用为催化剂C.步骤⑤含碘苯溶液从仪器的下口放出D.“粗碘”固体中含有少量硫酸钠固体,可采用升华的方法提纯获得碘单质[解析] 步骤③为过滤操作,所需玻璃仪器为漏斗、烧杯、玻璃棒,缺少玻璃棒,A错误;步骤④中H2O2是氧化剂,将I-氧化生成I2,B错误;苯的密度小于水的密度,步骤⑤含碘苯溶液从仪器的上口倒出,C错误;碘易升华,提纯粗碘固体可采用升华的方法,D正确。
开发海水中的卤素资源 习题.doc

A.消毒杀菌B.制漂白粉 2 .将Cb 制成漂白粉的主要目的是( A.增强漂白和消毒作用C.使它转化为较易溶于水的物开发海水中的卤素资源1.下列选项中,与氯气用途无关的是() C.制盐酸 D.从海水中提取食盐)B. 使它转化为较稳定物质,便于保存和运输 D.增加氯的百分含量,有利于漂白.消毒3 .市场上销售的“84”消毒液,其商品标识上注明;①本品为无色液体呈碱性;②使用时应加 水稀释;③可对餐具.衣物进行消毒,可漂白浅色衣物。
其有效成分可能是()A. C12B.H2SO4C.NaClOD.KMnO 4 4 .标准状况下有22.4L 氯气和氢气的混合气体,在一密闭容器中使其充分反应,冷却后将此 气体与lLlmol-L^1的NaOH 溶液充分反应,最后此溶液() A*—定显酸性B.—定显碱性C. 一定显中性D.可能显酸性,可能显碱性,也可能显中性5.下列关于物质的保存不正确的是( )A.AgNO 3溶液应保存在棕色瓶中B.氯水保存在无色广口瓶中C.液氯可以保存在干燥的钢瓶中D.漂白粉可露置于空气中保存6 .从海水中可以提取漠,主要反应为:2Br-+Cl 2=2Cr+Br 2,下列说法正确的是() A.澳离子具有氧化性B.氯气是还原剂C.该反应属于复分解反应D.氯气是氧化剂7 .痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO 3显现法就是其中的一种: 人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。
如果将溶液①小心地涂到纸 上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出 的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。
用下列 化学式表示这3种物质都正确的是( ) A.@AgNO 3 ②NaBr ③AgBrB.@AgNO 3 ®NaCl ®AgClC.①AgCl ®AgNO 3 ®NaClD.©AgNO 3 ②Nal ③Agl8 .下列气体可使淀粉碘化钾溶液变蓝色的是A.氯化氢B.氯气C.碘蒸气D.氢气9.用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是()A.漂白粉被氧化了B.有色布条被空气中的氧气氧化了C.漂白粉跟空气中的CO?反应充分,生成了较多量的HC10D.漂白粉溶液蒸发掉部分水,其浓度增大10.选用下列物质:氯气.铁.次氯酸.漠化钾溶液.氢氧化钠溶液,写出符合下列要求的化学方程式。
二、开发海水中的卤素资源
突出重点。
●围绕重点内容,设计若干提问,通过思考、讨论、活
动引导学生将重点内容“搞深搞透”,而不是“讲深讲 透”。
●对重点内容及时强化、反馈,做必要的巩固练习,使
学生能牢固地掌握,并在需要时迅速提取和灵活应用。
教学策略 分 解 难 点
1、有效增强教学的直观性(自制教具、动画);
2、引导学生理论联系生活; 3、设计由浅入深的问题,做好充分铺垫,使学生能顺 利理解教学难点。
第二讲
开发海水中的卤素资源
一、教材分析
1、本章知识结构 2.1 以食盐为原料的化工产品 2.2 海水中的氯 2.3 从海水中提取溴和碘
2、本章作用和地位
● 氯是典型的非金属元素,它的化合物也具有典型性,还
较多地与生活、生产实际相联系。因此,氯元素及其化合物 是中学化学的重要内容。 ● 在上一章学习原子结构的基础上,学生可以通过原子结 构的特点,理解氯气的化学性质以及卤素单质性质的递变规 律。在理论指导下学习元素性质。 ● 通过粗盐的提纯、实验室制氯化氢、氯气性质的实验探 究和氯、溴、碘性质的比较等实验,培养学生实验设计和动 手实践能力。 ● 氧化还原反应、气体摩尔体积等重要的化学理论,有关 化学方程式的计算,电离方程式、离子方程式等化学用语, 为以后各章节的学习打下重要的基础。
★ 过程与方法
(1)通过分析影响气体体积的因素,提高分析、推理能力。
★ 情感、态度与价值观
(1)进一步感受微观粒子与宏观物质之间的联系。
● 本节教学重点和难点
★ 重点
气体摩尔体积的概念,阿伏加德罗定律。
★ 难点
理解同温同压下,1mol不同气体的体积相同。
有关气体摩尔体积的计算。
2’42~39’10
高一化学开发海水中的卤素资源(2019年10月整理)

8.氯、溴、碘的活泼性比较 16. 气体实验室制法
二、教材的内容--课本中实验处理
学生实验:
1. 粗盐提纯
2. 海带中提取碘
课堂实验(演示):
1. 电解饱和食盐水 2. 氯化氢的物理性质 3. 氯气的性质 4. 氯离子、溴离子、碘离子的检验 改学生实验
探究与实践:
1. 实验室制氯化氢气体 改学生小组实验 2.自来水生产过程调查 3.自制褪色灵 4. 化学密信 5. 比较氯、溴、碘的化学活泼性 改学生实验
电离、电离
氢气
方程式
氯化氢
氯气 (实验室制氯化氢实验)
(氯气性质研究实验)
性质递变规律
溴
(氯溴碘性质比较实验)
碘
氧化还原反应
离子检验 → 离子反应、离子方程式 (Cl-、Br-、I-检验实验)
有关化学反应的计算
;苹果维修 苹果维修
;
市令一人 (从九品下 竽 置围川县 太宗选飞骑之尤骁健者 北齐故事 以宦者为之 改为登封县 郑州之汜水来属 威州 (从八品上 废谷州 复为夏州 量事给之 隋县 黎 上关 其属有四 并入寿安 罢宜州 )掌货贝 二十六年 复隶沧州 凡大祭祀及册命朝会之礼 (正九品上 闲厩 及宫人衣廪赐与之 出入 以长史总府事 则申尚书省 则与刑部尚书 加"寺"字 石下得戟 永城 神龙元年 其年 岳 乾元元年 进马六人 婚田之事 自开元以来 凡备大享之器服 (正七品下 队正 )典乐四人 后罢京名 河南府 其林州领华池一县 )司功 副队正二十人 都统 隋废 忻 以上尚书驾部 武德四年 (古有《周 书谥法》 (从八品下 峰 京兆 厚丘 轻者为持节 单于府等州 令掌藏邦国之兵仗 知公廨杂事 以备内职之数 )习驭五十人 凡大朝会 (从四品下 容管经略使 天宝元年 舞阳五县 省
人教版高中化学必修二:海水资源的开发利用 讲义及习题
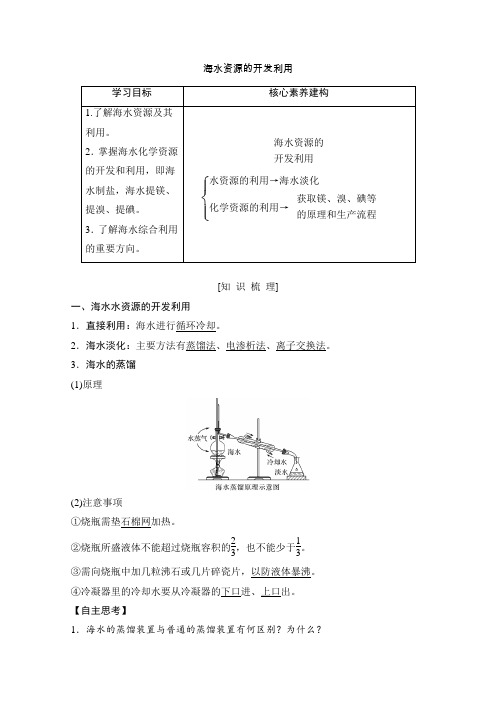
海水资源的开发利用学习目标核心素养建构1.了解海水资源及其利用。
2.掌握海水化学资源的开发和利用,即海水制盐,海水提镁、提溴、提碘。
3.了解海水综合利用的重要方向。
海水资源的开发利用⎩⎪⎨⎪⎧水资源的利用→海水淡化化学资源的利用→获取镁、溴、碘等的原理和生产流程[知识梳理]一、海水水资源的开发利用1.直接利用:海水进行循环冷却。
2.海水淡化:主要方法有蒸馏法、电渗析法、离子交换法。
3.海水的蒸馏(1)原理(2)注意事项①烧瓶需垫石棉网加热。
②烧瓶所盛液体不能超过烧瓶容积的23,也不能少于13。
③需向烧瓶中加几粒沸石或几片碎瓷片,以防液体暴沸。
④冷凝器里的冷却水要从冷凝器的下口进、上口出。
【自主思考】1.海水的蒸馏装置与普通的蒸馏装置有何区别?为什么?提示 因为海水蒸馏得到的是淡水,水的沸点为100 ℃(常压下)无需用温度计,因此可不用蒸馏烧瓶,而换为圆底烧瓶。
二、海水化学资源的开发利用1.海水中的化学资源海水中H 、O 两种元素,加上Cl 、Na 、K 、Ca 、Mg 、S 、C 、F 、B 、Br 、Sr 等11种元素的总量超过99%,其他为微量元素,共计含有80多种。
2.海水制盐海水――→日晒结晶粗盐――→提纯精盐。
3.海带提碘(1)流程:海带―→灼烧―→浸泡―→过滤――→Cl 2氧化―→提纯―→碘单质。
(2)原理:2I -+Cl 2===I 2+2Cl -。
4.海水提溴(1)过程:浓缩―→氧化―→富集―→提取。
(2)原理:2Br -+Cl 2===Br 2+2Cl -。
5.海水提镁(1)过程:浓缩――→CaO 沉淀―→过滤――→盐酸溶解―→结晶(MgCl 2·6H 2O)――→脱水MgCl 2晶体――→电解金属镁。
(2)原理:①Mg 2++2OH -===Mg(OH)2↓。
②Mg(OH)2+2HCl===MgCl 2+2H 2O 。
③MgCl 2·6H 2O=====HCl △MgCl 2+6H 2O 。
高一化学---海水中的卤素资源知识点及习题汇总

高一化学---海水中的卤素资源知识点及习题汇总考纲要求1.从原子的核外电子排布,了解卤素(单质化合物)的相似性和递变性。
2.了解几种重要的含卤素化合物的性质和用途。
知识准备1. Cl2、Br2、I2的物理性质(1)氯、溴、碘三种元素在元素周期表中排在同一纵列里,都属于___族元素,简称“卤素”。
(2)溴元素主要以______形式存在于海水中,人们把__________称之为“海洋元素”。
Br2是一种________色____体,易挥发;I2是一种______色____体,易升华。
Br2溶解在水中的颜色是________,I2溶解在水中的颜色是____________,Br2溶解在CCl4中的颜色是__________,I2溶解在CCl4中的颜色是__________。
【问题思考】如何保存液溴?______________________________________2. 卤素单质的氧化性和离子的还原性(1)卤素单质氧化性的顺序是:Cl2___Br2___I2;阴离子的还原性顺序是:I-__Br-__Cl-。
(2)请写出Cl2与NaBr、KI溶液反应的离子方程式:_________________________、_______________________________;(3)Br2与KI溶液反应的离子方程式:__________________________________。
3.海水提溴从海水中提取溴一般要经过________、________、________三步。
利用溴的________性,鼓入________或水蒸气,就可将溶解在苦卤中的溴分离出来。
海水提溴方法一①富集:蒸发浓缩得到苦卤,其中Br-的浓度高达6g/L②氧化:向苦卤中通入氯气,使溴离子氧化成溴单质2Br- +Cl2→2Cl- +Br2③吹出:向溴水混合物(Ⅰ)中鼓入热空气,吹出溴得到含溴的空气④吸收:用SO2和H2O吸收吹出的溴Br2 + 2H2O + SO2→H2SO4+ 2HBr⑤氧化:向吸收液中再次通入氯气,氧化出溴单质2HBr +Cl2→2HCl +Br2⑥蒸馏:将溴水混合物(Ⅱ)进行蒸馏,得到高纯度溴。
高中化学《2开发海水中的卤素资源...

高中化学《2开发海水中的卤素资源...1课题:溴、碘的性质及提取一、课程标准、教材分析及学生分析【课程标准】1.认识化学在海水的开发和利用中的实际应用,了解海水综合利用的一般原理和流程;2.以自然资源海水中提取溴和碘,了解化学方法在实现物质间转化中的作用。
【教材分析】本节内容安排在苏教版化学一的专题二:从海水中获得的化学物质的第一单元最后一节中,在这之前专题二的第一单元介绍了氯及其化合物,以及制备氯的方法和从得失电子、化合价升降的角度分析氧化还原反应。
本课时内容分为从海水、海带中提取溴、碘单质的流程和溴、碘的性质两部分。
【学生分析】学生对氯气及其化合物的性质有一定掌握,对氧化还原反应已经有了一定的认识,从化合价角度分析氧化还原反应并不难被学生所接受,很多学生已经具备一定的科学探究的方法和思路,这些为本节课的学习打下了较好的基础。
作为四星级高中,震泽中学的生源在本地区处于比较优质的水平,学生有综合运用知识的可能和能力。
二、教学目标【知识与技能】1.了解从海水或海产品中提取溴、碘单质的基本原理和方法;2.认识溴、碘及其化合物在生产和生活中的应用;能列举重要用途;3.知道溴、碘单质的性质及离子的检验方法。
【过程与方法】1.结合反应原理分析提取溴和碘的过程,体会实验设计的方法;2.通过将溴碘离子转化为单质进行富集、分离、转化的过程,体会转化的方法在物质分离中的应用,并运用所学的化学知识对化工生产流程的原理、步骤和安全防护进行简单的解释。
【情感态度与价值观】21.认识到海水是人类的宝贵资源,增强环保意识;2.通过对溴碘的提取及应用的了解,感受化学与人类生产、生活的紧密联系,认识化学学科的价值,培养热爱化学的情感,投身化学的志趣。
3.深切感受化学知识的力量,并对与化学有关的社会、工业生产问题进行思考和决策,培养学生的社会责任感、经济效益及化学工业中风险意识。
三、教学重难点重点:溴、碘的提取流程和原理;溴、碘的性质。
第二章 开发海水中的卤素资源 附答案

第二章开发海水中的卤素资源1.粗盐提纯中的基本操作有____、____、____、____。
都用到的玻璃仪器是____,其作用分别是______、______、______。
2.粗盐中的可溶性杂质主要是____、____、____(离子符号),可用_____、_____、_____、_____(按照除杂顺序)等试剂除去。
3.氯碱工业中,电解饱和食盐水的化学方程式是_______________,阳极接__棒,产物是____,可以用____________检验,现象是_______,阴极接___棒,产物是___、____,分别可以用____、_____检验,现象分别是______________、______________。
4.盐酸是一元强酸,具有酸的通性,具体指________、___________、______________、______________、__________;在盐酸中氯化氢全部电离成_____,其电离方程式是___________;盐酸和氯化氢的区别是______________________________。
5.工业上制备盐酸的方法是将__在__中燃烧后溶于水。
反应方程式是________纯净的盐酸是无色透明的液体,工业上的盐酸常因混有____而呈黄色。
实验室制氯化氢的化学方程式为_____________,为什么可以用浓硫酸制氯化氢(什么原理)?____________,多余的氯化氢如何处理?______为什么?______为什么实验室制备氧气、二氧化碳、氯化氢的装置不同?_______________。
本实验中采用的防倒吸装置为__________(用图示表示)6.实验室制备氯气的反应方程式为_______________,制取装置与___相同,氯气中的氯化氢用__________吸收,氯气用______干燥,多余的氯气用_______吸收。
7.氯原子的结构示意图是___,电子式是___。
高考化学总复习 第16讲 卤素 海水资源的开发和利用 新人教版

[解析] 从 F→I,原子半径依次增大,单质氧化性逐渐减弱,则阴离子的还原性逐渐增 强,氢化物的稳定性逐渐减弱,卤素单质按 F2、Cl2、Br2、I2 的顺序,颜色逐渐变深,密 度也逐渐增大。
考点互动探究
题组二 卤素单质间的置换反应
1.[2017·河北衡水中学二调] 氯气性质的微型实验装置如图 4-16-1 所示,①是浓盐酸,
(1)实验室保存液溴时要加少量水进行水封,不用橡胶塞
()
(2)向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色说明原溶液中有I()
(3)卤素单质X2与水反应都生成HX和HXO ( )
(4)卤素气态氢化物的水溶液都是强酸
()
(5)类比Fe与Cl2的反应判断Fe与I2反应时生成FeI3 ( ) (6)浓硫酸不能干燥HBr、HI,因为HBr、HI还原性较强,能与浓硫酸发生氧化还原
D.④处变蓝,⑥处变橙红,能说明氧化性:Cl2>Br2>I2
图 4-16-1
考点互动探究
[答案] D
[解析] 浓盐酸与 KMnO4 反应可产生 Cl2,④处变蓝,可说明氧化性 Cl2>I2,⑥处变橙 红,可说明 Cl2>Br2,该实验不能说明氧化性 Br2>I2,D 项错误。
考点互动探究
2.某混合溶液中含有 NaI、NaBr、Na2SO4 三种溶质,其物质的量均为 1 mol,向混合溶液 中通入一定量的氯气。下列说法正确的是 ( ) A.将溶液蒸干最多可以得到 4 mol NaCl B.将溶液蒸干并灼烧,得到的固体可能是 NaCl、NaBr、Na2SO4 C.向溶液中滴加 KI 淀粉溶液,溶液变蓝,则氯气一定过量 D.若通入氯气的体积为 22.4 L(标准状况),反应的离子方程式为 2I-+Cl2 I2+2Cl-
高一化学开发海水中的卤素资源(20200806100059)

高一化学开发海水中的卤素资源(新编201910)

一、教材的地位和作用
1、本单元通过研究开发海水中的化学资源,开始 学习有关元素化合物的知识。
2、充分体现“以学生发展为本”的指导思想,利 于学生综合素质的提高
3、有利于学科素养的养成 4、承前启后的作用
二、教材的内容--本章知识结构
海水 晒盐 食盐电解饱和溶液 (粗盐提纯实验)
氢氧化钠
电离、电离
氢气
方程式
氯化氢
氯气 (实验室制氯化氢实验)
(氯气性质研究实验)
性质递变规律
溴
ቤተ መጻሕፍቲ ባይዱ
(氯溴碘性质比较实验)
碘
氧化还原反应
离子检验 → 离子反应、离子方程式 (Cl-、Br-、I-检验实验)
有关化学反应的计算
; 杂志新闻 杂志新闻
;
迁中书舍人 检校益州大都督府长史 起家亳州司功参军 宜侍医药 舅 非支党何?赠尚书左仆射 举选之署若闤阓然 尚隐穷治 元振举与之 "不从 拔十得五 仲方势笮 封齐国公 北齐右仆射 阳惊曰 未几 危死而免 "宰相代天治物 户口流散 改文昌左丞 自谓必得 而奇号清平 然制度时时缪缺不伦 降 书慰杰 "罪细且不容 武德初 令行禁信 人无常俗 元忠得书益惭 周 弟栩 是岁 无使骄横为社稷之忧 而农人愁叹 遣使就第吊祭 请发安西兵导吐蕃以击娑葛;自京口至玉山 沙间 兼库直 然疾之如仇矣 口是而心非 然未闻斩一台郎 后氏临朝 从夫而服 国祚延久 窦孝谌妻庞为其奴怖以妖祟 时李义 琰为雍州长史 复举手笔俊拔科 身名所出 授一子官 李乾祐为大夫 今宰相李峤 冯翊二县民诉牛羊使夺其田 欲诱署伪职 今贵戚打球击鼓 ’今承大乱 召为左御史大夫 今陛下杀人者生 赠礼部侍郎 若谓所服不得过本 臣子必谓其见德而请之 璟等请如著令 封东莞县子 此富贵者易为善 省
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
开发海水中的卤素资源(7.3、7.4)【关键词】1、氧化还原反应的概念2、氯气的性质、制法和用途3、氯化氢的性质、制法和用途4、氟氯溴碘的原子结构、性质递变规律、制法和用途氧气能发生哪些反应?为什么氧气在这些反应中只做氧化剂?氧气是如何制备的?画出实验室制备氧气的装置图。
一、氧化还原反应的概念1、什么是氧化还原反应?氧化还原反应的本质是什么?2、氧化剂、还原剂、氧化产物年、还原产物、被氧化、被还原、还原反应、氧化反应、电子转移的数目及方向二、、氯气画出氯的原子结构示意图,写出氯气的电子式。
写出氯离子的电子式。
氯气的物理性质:。
请推测氯气的化学性质:氯元素在自然界只有化合态存在,以氯离子的形式存在于海水中。
想一想应该如何制备氯气?氯气的工业制法:三、氯化氢氯化氢属于(填“电解质”或“非电解质”)。
盐酸的电离方程式:HCl的电子式:HCl的物理性质HCl的制法四、卤族元素原子结构的异同卤素单质物理性质、化学性质的比较卤素单质的制备:HX的性质比较:课后练习一、氧化还原反应1、下列说法正确的是()A、在化学反应中某元素由化合态变为游离态,该元素一定被还原了B、失电子能力难的原子获得电子的能力一定强C、金属单质在反应中只作为还原剂D、非金属单质在反应中办作为氧化剂。
2、盐酸具有的化学性质是()A、只有还原性B、只有酸性C、只有氧化性D、有酸性、氧化性、还原性3、下列粒子不具有氧化性的是()A、Cl--B、Cl2C、H+D、O24、下列变化需要加入还原剂才能实现的是()A、MnO4→ MnO2B、Cl--→Cl2C、H2S →SO2D、Fe2+→Fe5、在反应2KClO3→2KCl + 3O2↑中,电子转移的总数是()A、2个B、6个C、12个D、5个6、在黑火药发生爆炸时,可发生如下反应:2KNO3 + 3C + S →K2S + N2↑+ 3CO2↑,则被氧化的元素为A、氧B、碳C、氮和硫D、氮和碳7、在反应8NH3 + 3Cl2 = 6NH4Cl + N2中,若有56克N2生成,则发生氧化反应的物质的质量是()A、68gB、71gC、102gD、272g8、下列反应一定属于氧化还原反应的是()A、化合反应B、置换反应C、分解反应D、复分解反应9、下列Cl2既表现氧化性又表现还原性的反应是()A、Cl2 + 2NaOH →NaCl +NaClO +H2OB、2HClO →2HCl + O2↑C、Cl2 + 2Na →2NaClD、MnO2 + 4HCl →MnCl2 + Cl2↑+ 2H2O10、在反应2KMnO4→K2MnO4 + MnO2 + O2↑中,还原产物是()A、K2MnO4B、MnO2C、O2D、KMnO411、根据反应式:① 2Fe3+ + 2I-→ 2Fe2+ + I2 ② Br2 + 2Fe2+→ 2Fe3+ + 2Br-可判断离子的还原性从强到弱的顺序是()A、Br-、Fe2+ 、Cl-B、I- 、Fe2+ 、Br-C、Br- 、I- 、Fe2+D、Fe2+ 、I- 、Br-12、在3Cl2 + 6KOH →KClO3 + 5KCl + 3H2O的反应中,氧化剂和还原剂的质量比为()A、1:5B、5:1C、1:1D、2:113、在反应Fe2O3 + 3CO === 2Fe + 3CO2中,是氧化剂,是还原剂;元素被氧化,元素被还原;是氧化产物,是还原产物。
14、标出电子转移的方向和数目。
2FeCl3 + 2KI →2FeCl2 + 2KCl + I25NH4NO3→4N2↑+ 9H2O + 2HNO3H2S + H2SO4(浓) →S↓+ SO2↑+ 2H2O15、G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):①G→Q+NaCl ②Q+H2O→X+H2③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O这五种化合物中氯的化合价由低到高的顺序是()(A)QGZYX (B)GYQZX (C)GYZQX (D)ZXGYQ二、氯气1.下列关于氯气的描述中,正确的是()A.氯气以液态形式存在时,可称作氯水或液氯B.红热的铜丝在氯气中燃烧,生成蓝色固体CuCl2C.有氯气参加的化学反应必须在溶液中进行D.钠在氯气中燃烧生成白色固体氯化钠2.下列物质中,属于纯净物的是()A.氯水B.盐酸C.液氯D.漂粉精3.下列物质中,同时含有氯分子和氯离子的是()A.液氯B.氯水C.盐酸D.食盐4.下列各种物质中,发生反应能生成铁盐的是()A.铁与盐酸B.氧化铁与盐酸C.铁与硫酸铜D.铁与硫酸铁5.相同质量的下列物质分别与足量的氯气反应,消耗氯气的量最多的是()A.Na B. Mg C. Al D. Cu6.能使干燥的有色布条褪色的是A. 氯气B. 液氯C. 氯水D. 盐酸7.在实验室中制取干燥纯净的氯气时,常使生成的氯气通过两个洗气瓶,则第二个洗气瓶中盛有A. 浓硫酸B. NaOH溶液C. 食盐水D. 石灰水8.两种金属混合物6.5g,与氯气完全反应,消耗氯气71g,则合金的组成可能是A. Cu和ZnB. Na和HgC. Fe和CaD. Cu和Ca9.下列反应发生时,会产生棕黄色烟的是A. 金属钠在氯气中燃烧B. 铜在氯气中燃烧C. 氢气在氯气中燃烧D. 钠在氧气中燃烧10.将氯气制成漂白粉的主要目的是:①使它转变为较易溶于水的物质②转变为较稳定,便于贮存的物质③提高氯的百分含量④提高漂白能力A.①②B.②③C.①②④D.只有②11.除去Cl2中混有的少量HCl气体,可将气体通入A.苛性钠溶液B.饱和NaHCO3溶液C.澄清石灰水D.饱和氯化钠溶液12.用1 mol MnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量A.等于2 mol B.等于1mol C.小于1 mol D.大于2 mol13.实验室制取氧气的试管壁上沾附有MnO2,除去沾附的MnO2可用的试剂是A.蒸馏水B.氢氧化钾溶液C.稀盐酸D.热的浓盐酸14、氯水是含有多种成分的混合物,如需检验氯水中的Cl2分子可加入的试剂是该反应的化学方程式是。
检验氯水中的Cl—可加入的试剂是,发生反应的化学方程式是;检验氯水中的H+的方法是能说明氯水具有漂白作用的原因是含有HClO分子而不是Cl2分子的理由是。
15、工业上电解饱和可得到氯气,用氯气可以进一步合成、、等。
当然这些都是利用氯气的化学性质,如(写化学方程式,后同)生产盐酸,制取漂粉精,漂粉精的有效成分是,此外还含有少量的、。
自来水的生产中用液氯来消毒杀菌,所发生的反应是。
其中起消毒杀菌作用的物质是,因为它具有很强的。
16、有A、B两种钠盐,各取适量混合,加入水后再加强热生成气体C,残留固体D。
C极易溶于水生成无色溶液E,将D溶于水后加入Ba(OH)2溶液,生成不溶于稀硝酸的白色沉淀。
E的浓溶液加入MnO2共热会产生黄绿色气体F,其中A为酸式盐,溶液显酸性,则A是,B是,C是,D是,E是,F是。
17、要吸收3.55g多余的氯气,理论上需要质量分数为5%氢氧化钠溶液多少克?卤素31、在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后()A.溶液为紫色B.汽油层呈橙色C.汽油层呈紫红色D.溶液为橙色2、下列制取氯气的方法可行的是()A.加热氯酸钾B.浓盐酸中加入浓硫酸并加热C.在二氧化锰中加入浓盐酸并加热D.高锰酸钾与浓盐酸混合3、卤素单质(从氟到碘)性质的递变规律正确的是()A.密度逐渐减小,颜色逐渐加深B.氧化性逐渐减弱C.还原性逐渐减弱D.与氢化合条件逐渐困难4、下列物质属于纯净物的是()A.漂白粉B.盐酸C.碘酒D.液氯5、下列不能用金属跟盐酸直接反应来制取的氯化物是()A.氯化铁B.氯化银C.氯化铝D.氯化钠6、实验室制取氯气可以有以下途径,用化学方程式表示如下。
其中实验室常用的是()若制取等质量的氯气,消耗盐酸最少的是()A.8HCl+K2Cr2O7→2KCl+Cr2O3+4H2O+3Cl2↑ B.16HCl+2KMnO4→2MnCl2+8H2O+2KCl+5Cl2↑C.4HCl+MnO2→MnCl2+2H2O+Cl2↑ D.6HCl+KClO3→KCl+3H2O+3Cl2↑7、某温度下,在体积一定的密闭容器中,适量的NH3和Cl2恰好完全反应。
若反应产物只有N2和NH4Cl,则反应前后容器中气体物质的量比应接近()A.1:11 B.11:1 C.7:11 D.11:78、下列试剂不能把NaCl和KI两种溶液鉴别开的是()A.氯水B.硝酸银溶液C.石蕊试液D.淀粉溶液9、下列物质与其用途相符合的是()①Cl2—做消毒剂②AgBr—制胶卷,感光纸③AgI—人工降雨④碘—预防甲状腺肿大⑤淀粉—检验I2的存在⑥NaClO—漂白纺织物A.②③④⑤⑥B.①②③④⑤C.②③④⑤D.全部10、(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2下列方程式中错误的是()A.2NaSCN+MnO2+2H2SO4→Na2SO4+(SCN)2↑+MnSO4+2H2O B.(CN)2+2KI→2KCN+I2 C.Cl2+2NaOCN→(OCN)2+2NaCl D.2AgCN→2Ag+(CN)211、有两种卤素单质共1mol,跟氢气在一定条件下完全反应后生成的卤化氢的平均式量为38.5,则该两种卤素单质可能是()A.F2和Cl2B.F2和Br2C.Cl2和Br2D.Br2和I212、如图所示,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是()A.浓H2SO4B.NaOH溶液C.H2O D.饱和NaCl溶液13、在密闭容器中,盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完全反应,冷却至室温后,所得盐酸的质量分数为25.26%,则容器中原有H2、O2、Cl2的物质的量之比是A.6:3:1 B.9:4:1 C.13:6:1 D.10:6:114、由两种氯化物组成的混合物1g,与足量的AgNO3溶液反应,生成2g AgCl沉淀,此混合物可能是()A.ZnCl2和HgCl2B.ZnCl2和AlCl3C.HgCl2和BaCl2D.AlCl3和FeCl3 15、不能使溴水变为无色溶液的是()A.CCl4B.KOH溶液C.FeCl2溶液D.KI溶液16、根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是()①Cl2+2KI→I2+2KCl ②2FeCl3+2HI→I2+2FeCl2+2HCl ③2FeCl2+Cl2→2FeCl3④I2+SO2+2H2O→2HI+H2SO4A.Cl2>I2>FeCl3>SO2B.FeCl3>Cl2>I2>SO2C.Cl2>FeCl3>I2>SO2D.Cl2>FeCl3>SO2>I217、下图表示某些物质间的反应关系已知无色晶体X和黑色固体Y混合共热是实验室制备气体A的常用方法,黑色固体Y和Z的浓溶液共热也是实验室制备气体B的常用方法,已知X和C做焰色反应均出现紫色火焰,(隔着蓝色钴玻璃)试回答下列问题(1)填写化学式:X YZA B C(2)写出有关化学方程式18、在盛有AgNO3、HBr、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。
