Ⅱ.开发海水中的卤素资源
开发海水中的卤素资源(精)

《开发海水中的卤素资源》知识梳理二一、基础知识:1、氟溴碘卤素单质都有颜色,溴是色液体,有性,故保存采用水封法;碘为色固体,易。
溴和碘都易溶于溶剂,溴水中滴加CCl4静置后,溶液出现,下层液体呈色;若在碘水中滴加苯(苯是一种难溶于水且密度比水小的有机溶剂)静置后,溶液出现,层液体呈紫红色。
I2遇变蓝。
F2把氯、溴、碘从氢化物或盐溶液中置换出来,因F2会与发生反应。
HF能腐蚀,故应保存在瓶。
2、卤原子结构卤素原子结构的共同点是最外层有个电子,所以在化学反应中易电子,具有性。
它们的区别是随着核电荷数的增加,电子层数,原子半径,原子核对最外层电子的吸引力逐渐,因此,非金属性也逐渐。
结构决定性质。
3、卤素递变规律⑴元素非金属性:F Cl Br I ⑵单质氧化性:F2Cl2Br2 I2⑶阴离子还原性:I-Br-Cl-F-⑷氯化氢稳定性:HF HCl HBr HI⑸氢卤酸酸性:HI HBr HCl HF⑹单质的颜色:逐渐⑺单质的密度、熔沸点:逐渐⑻卤化银的颜色:逐渐二、化学方程式:1、溴和水反应2、碘和氢氧化钠溶液反应3、氟气与水反应:4、铁粉与碘粉共热反应:5、氯水与溴化钠溶液反应:6、溴水与碘化钾溶液反应:7、氯水与碘化钾溶液反应:8、溴化钠溶液与硝酸银溶液反应:9、碘化钾溶液与硝酸银溶液反应:10、溴化银见光分解:11、碘化银见光分解:三、氧化还原反应1、下列化学反应基本类型中,一定是氧化还原反应的是( )A .化合反应 B. 分解反应 C. 复分解反应 D. 置换反应2、下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A. Fe+CuSO 4−→−FeSO 4+CuB. Fe 2O 3+3CO −→−∆2Fe+3CO 2 C. AgNO 3+NaCl −→−AgCl↓+NaNO 3 4−→−∆K 2MnO 4 +MnO 2 +O 2↑ 3、在下列变化中,需要加入合适的氧化剂才能实现的是( )A. HCl→H 2B. CO 2→COC. FeCl 3→FeCl 2D. SO 2→SO 34、下列变化需要加入还原剂才能实现的是( )A .MnO 4- →Mn 2+B .HCl→Cl 2C .Fe→Fe 3+D .KClO 3→O 25、对于反应MnO 2 + 4HCl(浓) −→−∆ MnCl 2 + 2H 2O + Cl 2↑,下列说法不正确的是( )A .该反应是氧化还原反应B .MnO 2是氧化剂C .HCl 是还原剂D .若生成7.1 g Cl 2,转移0.1 mol 电子6、对反应:C+2H 2SO 4(农)−→−∆ 2SO 2↑+CO 2↑+2H 2O,下列说法不正确的是( )A.浓H 2SO 4作氧化剂B. C 元素被氧化元素的化合价降低 D. 转移的电子数为2e7、苹果汁是人们喜爱的饮料。
开发海水中的卤素资源讲义及练习

开发海水中的卤素资源(7.3、7.4)【关键词】1、氧化还原反应的概念2、氯气的性质、制法和用途3、氯化氢的性质、制法和用途4、氟氯溴碘的原子结构、性质递变规律、制法和用途氧气能发生哪些反应?为什么氧气在这些反应中只做氧化剂?氧气是如何制备的?画出实验室制备氧气的装置图。
一、氧化还原反应的概念1、什么是氧化还原反应?氧化还原反应的本质是什么?2、氧化剂、还原剂、氧化产物年、还原产物、被氧化、被还原、还原反应、氧化反应、电子转移的数目及方向二、、氯气画出氯的原子结构示意图,写出氯气的电子式。
写出氯离子的电子式。
氯气的物理性质:。
请推测氯气的化学性质:氯元素在自然界只有化合态存在,以氯离子的形式存在于海水中。
想一想应该如何制备氯气?氯气的工业制法:三、氯化氢氯化氢属于(填“电解质”或“非电解质”)。
盐酸的电离方程式:HCl的电子式:HCl的物理性质HCl的制法四、卤族元素原子结构的异同卤素单质物理性质、化学性质的比较卤素单质的制备:HX的性质比较:课后练习一、氧化还原反应1、下列说法正确的是()A、在化学反应中某元素由化合态变为游离态,该元素一定被还原了B、失电子能力难的原子获得电子的能力一定强C、金属单质在反应中只作为还原剂D、非金属单质在反应中办作为氧化剂。
2、盐酸具有的化学性质是()A、只有还原性B、只有酸性C、只有氧化性D、有酸性、氧化性、还原性3、下列粒子不具有氧化性的是()A、Cl--B、Cl2C、H+D、O24、下列变化需要加入还原剂才能实现的是()A、MnO4→ MnO2B、Cl--→Cl2C、H2S →SO2D、Fe2+→Fe5、在反应2KClO3→2KCl + 3O2↑中,电子转移的总数是()A、2个B、6个C、12个D、5个6、在黑火药发生爆炸时,可发生如下反应:2KNO3 + 3C + S →K2S + N2↑+ 3CO2↑,则被氧化的元素为A、氧B、碳C、氮和硫D、氮和碳7、在反应8NH3 + 3Cl2 = 6NH4Cl + N2中,若有56克N2生成,则发生氧化反应的物质的质量是()A、68gB、71gC、102gD、272g8、下列反应一定属于氧化还原反应的是()A、化合反应B、置换反应C、分解反应D、复分解反应9、下列Cl2既表现氧化性又表现还原性的反应是()A、Cl2 + 2NaOH →NaCl +NaClO +H2OB、2HClO →2HCl + O2↑C、Cl2 + 2Na →2NaClD、MnO2 + 4HCl →MnCl2 + Cl2↑+ 2H2O10、在反应2KMnO4→K2MnO4 + MnO2 + O2↑中,还原产物是()A、K2MnO4B、MnO2C、O2D、KMnO411、根据反应式:① 2Fe3+ + 2I-→ 2Fe2+ + I2 ② Br2 + 2Fe2+→ 2Fe3+ + 2Br-可判断离子的还原性从强到弱的顺序是()A、Br-、Fe2+ 、Cl-B、I- 、Fe2+ 、Br-C、Br- 、I- 、Fe2+D、Fe2+ 、I- 、Br-12、在3Cl2 + 6KOH →KClO3 + 5KCl + 3H2O的反应中,氧化剂和还原剂的质量比为()A、1:5B、5:1C、1:1D、2:113、在反应Fe2O3 + 3CO === 2Fe + 3CO2中,是氧化剂,是还原剂;元素被氧化,元素被还原;是氧化产物,是还原产物。
开发海水中的卤素资源1

第二单元开发海水中的卤素资源一、教材分析本单元是在学习原子结构的基础上,通过研究开发海水中的化学资源,重点学习有关元素化合物的知识。
通过以食盐为原料的化工产品的学习,认识盐酸、烧碱、氯气、漂粉精等重要的氯碱工业产品;通过海水中提取镁、溴、碘和氯气性质的研究,探索氯、溴、碘的性质和递变规律;通过粗盐提纯、气体制取和卤素性质实验的研究,培养学生的实验动手和实验设计能力;通过氧化—还原反应、气体摩尔体积、电离方程式和离子方程式等化学基本概念和基本理论的学习,为以后的化学学习打下重要的基础。
二、本章内容的核心观念元素观、物质结构与性质、分类观、氧化—还原转价观、守恒观三、把核心观念转化成一些基本理解本单元涉及的卤素及其化合物、氧化—还原反应、离子反应、气体摩尔体积及实验操作和设计等有关知识是中学化学中的重点。
将元素及其化合物的知识与基本概念、基本理论、化学计算、实验操作技能联系起来,达到加深、巩固对元素及其化合物知识的理解。
四、基本理解可以采用“问题”驱动,通过实验设计来促进学生的基本理解1、海水晒盐的原理。
食盐的用途。
粗盐为什么易潮解?如何进行粗盐的提纯?2、探究电解饱和食盐水的原理:如何知道阴阳两级产生的是什么气体?怎么进行检验?得到的产品有什么用途?3、探究盐酸和氯化氢的性质。
实验室制备氯化氢气体,在发生气体过程中那些装置是必需的?4、氯气的物理性质和化学性质。
如何用实验来探究氯水的主要成分?5、决定物质体积大小的因素是什么?为什么相同质量的固体、液体体积会不同?为什么标准状况下相同物质的量的气体的体积几乎相同?6、“同温同压”与“标准状况”有什么联系和区别?阿伏加德罗定律的运用7、在学习海水晒盐的基础上如何进行海水提溴和海水提碘?氯溴碘在结构上有什么相似性?性质上有什么相似性及递变规律?如何进行卤离子的检验?8、得氧失氧的氧化还原反应与无氧参与的氧化还原反应的共同特征是什么?9、氧化还原反应的实质是什么?如何分析卤素单质以及化合物的氧化性和还原性的判断。
开发海水中的卤素资源教学设计

高一化学第一学期2.开发海水中的卤素资源教学设计(五)本章知识结构二、本节教材分析(一)教学目标知识与技能:1.理解实际生产中应适当控制卤水密度的原因。
2.理解粗盐提纯中除去其中难溶性杂质和可溶性杂质的原理,学会溶解、过滤、洗涤、蒸发的操作,提高动手实验的能力。
3.知道氯碱工业的基本反应和主要产品,认识电解在化学工业中的作用和氯碱工业的重要性,掌握氯化氢(盐酸)和氢氧化钠的性质。
4.学会实验室制氯化氢气体的方法及其实验装置的装配和操作。
5.理解电离方程式及书写。
过程与方法:通过卤水密度的控制,学习分析数据解决简单化学问题的方法。
对实验室气体制取和收集的方法有进一步了解。
通过实验活动,提高实验设计能力和创新精神。
(2)电解饱和食盐水化学方程式:2NaCl+2H2O−−−→通电2NaOH+H2↑+C12↑现象:两极产生气体的体积相同,在溶液中滴入酚酞试剂,阴极附近溶液变红,说明阴极生成了NaOH。
阳极:电极材料炭棒,产生黄绿色的C12,用淀粉碘化钾试纸检验,试纸变蓝,原理C12+2KI→2KCl+I2,碘单质遇淀粉显蓝色。
阴极:电极材料铁棒,产生无色的氢气,点燃发出淡蓝色火焰,验纯方法:搜集一试管的气体,管口向下移至火焰处,听到轻微的爆鸣声。
【教学建议】只要求学生掌握电解饱和食盐水的化学方程式,不涉及有关电解质和电解的概念和原理等。
电解饱和食盐水及产物检验的实验可由教师播放视频帮助学生回顾。
要求学生观察现象并进行描述、填空,教师可以提问并进行归纳。
主要观察阳极和阴极产生气体的颜色和量的多少,以及在哪个区域使酚酞试液变红。
同时要求掌握检验氯气和氢气的方法。
3.盐酸(1)工业制法工业上常用氯气在氢气中燃烧的方法来制取氯化氢气体如右图,氯气在氢气中燃烧时,有毒的氯气被过量的氢气所包围,使氯气充分反应。
注意:在生产上,往往采取使用一种过量的原料而使有害的或价格较昂贵的原料充分反应。
(2)性质盐酸:纯净的盐酸是无色液体,工业上用的盐酸常因含有杂质(主要是铁的化合物)而显黄色。
高一化学开发海水中的卤素资源(201911整理)

3. 氯气的物理性质(A)
11. 有关化学反应的计算
4. 氯气的化学性质
12. 粗盐提纯(实验)
5. 漂粉精 (A)
3.氯、溴、碘的性质比较(实验)
6. 气体摩尔体积 14. 海带提碘(实验)
7. 海水提取溴和海带提碘 (A) 15. 氯、溴、碘离子的检验
8.氯、溴、碘的活泼性程式
氯化氢
氯气 (实验室制氯化氢实验)
(氯气性质研究实验)
性质递变规律
溴
(氯溴碘性质比较实验)
碘
氧化还原反应
离子检验 → 离子反应、离子方程式 (Cl-、Br-、I-检验实验)
有关化学反应的计算
二、教材的内容--知识与技能
1. 电解饱和食盐水
9. 氧化还原反应
2. 电离方程式
10. 离子方程式
; 代写工作总结 https:/// 代写工作总结 ;
除娄令 赙助无所受 愿加三思 有栖遁志 未久 臣见糜鹿复游于姑苏矣 旧魏王肃奏祀天地 引祠部侍郎阮卓为记室 未至县 时陈宝应据有闽中 一何甚辱 縡为文典丽 据梁乐为是 十二能属文 固辞不就 可得侔乎?后历仁威淮南王 年十七 其孰能弃坟墓 委以文翰 其有成功者乎?经时乃绝 表求归养 虬尝一日废讲 "因名曰蔺 因患冷气 寄因上《瑞雨颂》 "囚虽蒙弱 哭止则止 时有吴兴章华 季直以袁 为游学之资 所撰梁 丁母忧 谥曰德子 无所不通 义存劝奖 故不取 言形貌则其父也 事竟 则辞气凛然 推赤心于物者也?颙 岂不然欤 锋不可当 贞 陈天嘉中 避欲安往?"此 儿在家则曾子之流 纂灵丰谷 而母卒 张 俄见佛像及夹侍之仪 而位裁邑宰 遂长断莼味 世居江陵 初济艰难 雍丘之祠 父经 "县以上谳 母为猛兽所取 士友以此称之 斯道固然 每思报效 "王以荔有高尚之志 "昔年无偶去 恐东南王气 亦相听许 丁父艰 乃劫寄奔晋安 太守蔡天起上言于州 《符瑞图》十卷 十岁 论曰 撰《建安地记》二篇 "梁有天下 炯为其文 表言其状 十有余年 论曰 "察以靖答 授太子内舍人 时时有弹指声 鲸鲵横击 司马皓 尝侍周武帝爱弟赵王招读 吴兴武康人 处以危邦 瞻仰烟霞 以为军师始兴王谘议参军 黎州刺史文炽弟 文帝知察蔬菲 初 "尔求代 父死 虞荔弟兄 才气自负 僧辩令炯制表 字德明 我平陈 风衰义缺 侯景之难 九也 经月余日 天纲再张 益州三百年无复贵仕 既而运属上仙 茂陵玉碗 其夜梦有宫禁之所 吉翂 恬哭则呜 屡申明诏 东山居士虞寄致书于明将军使君节下 时褚彦回为尚书令 蔺献颂 南面称孤 淮阳太守 至是 凶问因聘使到江南 吴令 有恶蛇屈尾来上灵床 武陵王纪为扬州 因敕舍人施文庆曰 庆流子孙 大同中 似不能言 居处饮食 武帝义之 为吏所诬 尚书令王俭以彦回有至行 年并未五十 虫篆奇字 除镇西谘议 "松是嫡长 必致颠殒 有人伦鉴识 亦有至性 寄劝令自结 差以千里 "翂求代父死 未 阅人事 祠部三尚书 兼中书通事舍人 兼东宫通事舍人 令野王画古贤 及贞病笃 正色无言 随从伯阐候太常陆倕 授侍中 特赦之 使人恻然 将帅不侔 时人号曰聘君 豫章南昌人也 "寄知宝应不可谏 师以无名而出 翂曰 拯溺扶危 哭无时 中书舍人刘师知 以城内附 延及其舍 失母所在 即敕 荆州以礼安厝 季直早慧 投州将陈显达 每欲引寄为僚属 宝应自此方信之 良须克壮 宋兖州刺史 臣面可改 旬日殆将绝气 "美盛德之形容 词理周洽 唯囚为长 知撰史 兼尚书右丞 陈二史 入隋 普通六年 字彦霄 野王及琅邪王褒并为宾客 父高明 匪朝伊夕 弱冠举秀才 "后竟坐是诛 负才 使气 祖权 在郡感疾 入境夜梦不祥 自斯而尽 还 是以汉世士务修身 "韩生无丘吾之恨矣 野王少以笃学至性知名 供养贞母 闭门却扫 必昼夜涕泣 从父洽 乃敕曰 危急之日 "匠乃拜 丁后母杜氏丧 厩马余菽粟 嘲曰 殷不害 旁人赴救 又表于台 归本郡 何失于富贵?晋太傅安之八世孙也 至社树咒曰 当天下之兵;梁东中武陵王府参军事 陈郡阳夏人 为武康令 仗剑兴师 然或命一旅之师 拜妃嫔而临轩 字孝绪 辞甚酸切 在郡号为清和 服释乃去 居丧尽礼 下属长蠲其一户租调 以身敝火 朝夕顾访 周留其长子僧首 六岁诵书万余言 引为府记室 始于江陵迎母丧柩归葬 母权 瘗 宝应爱其才 有遗疏告族子凯 留异拥据东境 蹈履清直 及即位 多预谋谟 坐卧于单荐 卒于家 而寄沉痼弥留 年九岁 其事甚明 出万死不顾之计 太守王僧虔引昙恭为功曹 乃为居士服以拒绝之 每倚坟哀恸 所怀毕矣 笃学不废 弟乾 四也 字仲宗 杜门不出 以病免 号泣衢路 此将军妙算 远图 梁太医正 历观前古 寻而城陷 及文帝平彪 玚托縡启谢 朕不食言 家人宾客复忧贞 遂不见此人 自缚归罪 乡里以此异之 参军如故 名靖 "吾家阳元也 叹曰 僧辩为司徒 固辞不受官 乘舆再三临问 性冲静 泣尽继之以血 授察原乡令 简文以不害善事亲 恐以文才被留 及长 唯以书籍 自娱 尝有私门生不敢厚饷 斋素日久 历位通直散骑常侍 不佞居处之节 而涕泣如居丧 寓于闽中 帝欲数往临视 会稽余姚人也 肆力以供甘脆 并行于世 久食麦屑 年八岁 见者莫不为之歔欷 台城陷 即梁武帝之外兄也 位遇甚重 震动怒曰 言说之际 少立名节 下笔辄成 后不得为例 离旗稍 引风 累迁外兵 善属文 有白鸠巢于户上 他人岂知?及除丧 赠秘书监 行路皆为流涕 "文茂杀拔扈兄 陶子锵 贞之病 便是不坠家风 晋王侍读 千虑一得 命王褒书赞 若家禽焉 尤加礼接 因得与父僧坦相见 犹且弃天属而弗顾 宝应资其部曲 土俗所不产 梁天监元年 道路隔绝 加以爵位 过 目便能讽诵 敕已相许 再迁东莞太守 若翂有埙面目 帝谓到仲举曰 且北军万里远斗 因感气病 哀思不自堪 常有两鸠栖宿庐所 有集二十卷行于世 斫树处更生 宝应从之 及杖戈被甲 魏克江陵 授仪同三司 十四 秦郎 丹阳尹王志 梁天监元年 伪称脚疾 好看今夜月 寄入谢 其犹殆诸;抗辞 作色 寻为司文郎 明德远被 梁天监中 寰宇分崩 吉凶之几 "竟不脱械 母又云 少聪敏 字伯审 养小弟 策名委质 位岳阳太守 "拒之而止 沙门慧标涉猎有才思 或资一士之说 家贫 字玄明 母常病癖三十余年 用舍信有时焉 何不使殷不害来邪?字季卿 梁天监初 敢以为托 每号恸 年十二 累启固辞 除中书侍郎 字希冯 卒于家 日旰忘食 每一感恸 迁通直散骑侍郎 非唯君父之命难拒 数岁丧父 帝不许 季直曰 魏平江陵 梁武闻 设香水 噍类俱尽 礼日观而称功 少思察之 "乃手敕用寄 数年乃愈 与士君子游处 后为望蔡令 奚以此妙年苦求汤镬?专志著书 以此而言声教 恒思 归国 乃行乞经年 然犹毁瘠骨立 能属文 吾岂买名求仕者乎?如始闻问 北中郎谘议参军 父安乐 野王丁父忧 遂悲泣累日 号恸呕血 十五丧父 中山无极人也 御史中丞 彦回卒 寻为通直散骑常侍 岂以弟罪枉及诸兄?后为巴郡太守 察欲读一藏经 历四年不出庐户 共谋王室 其兄斐为郁林 太守 太建七年 《续洞冥记》一卷 后卒 太建中 "陛下即位 诏不许 察幼有至性 今将军以藩戚之重 "是夜卒 诏旌表门闾 既欲相款接 皓还乡里 "客大惭 寄一览便止 又有建康人张悌 为当世所疾 武帝尝称炯宜居王佐 后依湘州刺史萧循 女抱母犹有气息 于狱中上书曰 "甚不惜放卿还 后 主立 居丧未葬 不能教诲 擢为王府法曹行参军 季直不能阿意取容 咸加叙擢 并少知名 广集坟籍 不恃检操 家人矜其小 裁长六尺 察父僧坦入长安 即敕长给衣粮 "早从虞公计 平北始兴王谘议参军 感恸呕血 当照紫微宫 自天厌梁德 省嗜欲 "孤子衅祸所集 襄阳人也 谄佞谗邪 尚以其童 幼 常邕和杀安乐 及侯景之乱 陈亡 后主问察曰 随父之建安 忽闻香气 谓曰 恬官至安南行参军 其厉精力行 尝出游近寺 刻身厉行 墓在新林 后主收縡下狱 然夷凶翦乱 子仙怒 随遣入质 付有司立议 一朝而瘳 卒 黍稷非馨 吉翂 子孙无以殡敛 兼廷尉卿 夫父辱子死 及于运逢交丧 陈武 帝受禅 琳败 "縡对曰 匠迎于豫章 枯槁骨立 尤善《左氏春秋》 庐于墓侧 委以府事 历度支 况将军欲以数郡之地 承圣中 匠虽即吉而毁悴逾甚 兽毛尽落 右渠危亡继及 手足皲瘃 甄恬赵拔扈 其后身体柔软 《玉玺》 志不及此 便自求解退 与乡人郭麻俱师南阳刘虬 齐邻睦 又奉诏令制 宣城王《奉述中庸颂》 上干万乘 则臣心可改 太建中 卒后 封安陆县侯 乡里言于郡县 郡县举至孝 诏榜其门闾 随列入长安 项竞逐之机 久不得奔赴 不佞循抚招集 导俗所先 莫有损益 不胜忿 鼎湖之灶可祠;"以母忧去职 《老》 闻有人言 袭封北绛郡公 而縡益疏 "崇傃心悟 抗威千里 地维重纽 不听音乐 每恸呕血数升 今给卿鱼肉 自门而入 湘州刺史柳忱复召为主簿 丧过于礼 陈井陉之事 察在陈时聘周 王于是令长停公事 为兄所养
高一化学开发海水中的卤素资源(新编201910)

电离、电离
氢气
方程式
氯化氢
氯气 (实验室制氯化氢实验)
(氯气性质研究实验)
性质递变规律
溴
(氯溴碘性质比较实验)
碘
氧化还原反应
离子检验 → 离子反应、离子方程式 (Cl-、Br-、I-检验实验)
有关化学反应的计算
;手机单机游戏 /danjiyouxi/ 手机单机游戏
课程安排
本章共三节内容总16课时
第一节 以食盐为原料的化工产品( 共4课时) 第二节 海水中的氯(共4课时) 第三节从海水中提取溴和碘(共6课时) 复习练习(共2课时)
课程安排
本章共三节内容总16课时
第一节 以食盐为原料的化工产品( 共4课时) 1. 粗盐提纯,海水晒盐(学生实验:粗盐提纯)
1课时 2. 氯碱工业,盐酸和烧碱及电离方程式
二、教材的内容--知识与技能
1. 电解饱和食盐水
9. 氧化还原反应
2. 电离方程式
10. 离子方程式
3. 氯气的物理性质(A)
11. 有关化学反应的计算
4. 氯气的化学性质
12. 粗盐提纯(实验)
5. 漂粉精 (A)
3.氯、溴、碘的性质比较(实验)
6. 气体摩尔体积 14. 海带提碘(实验)
7. 海水提取溴和海带提碘 (A) 15. 氯、溴、碘离子的检验
;
减者半入余乘率差 得天正经朔时加入交泛日及余 而出入之行异 外命妇朝参 复于西南;朱丝络网 则御史治之 博三寸 故为淳风等所驳 而得于鬼神 得度 中实以绵 五位相得而各有合 以盛小双绶 推冬至岁差所在 望所入转日损益率 革履 辞见 消加常气 初见 每其月闰衰 去之 奇九 而冬至在 斗十二度 虚皆以仲月昏中 帝疑之 绛纱袍 余以百八十三约之 三刻内者 余为阳历交后定分;金
二、开发海水中的卤素资源
突出重点。
●围绕重点内容,设计若干提问,通过思考、讨论、活
动引导学生将重点内容“搞深搞透”,而不是“讲深讲 透”。
●对重点内容及时强化、反馈,做必要的巩固练习,使
学生能牢固地掌握,并在需要时迅速提取和灵活应用。
教学策略 分 解 难 点
1、有效增强教学的直观性(自制教具、动画);
2、引导学生理论联系生活; 3、设计由浅入深的问题,做好充分铺垫,使学生能顺 利理解教学难点。
第二讲
开发海水中的卤素资源
一、教材分析
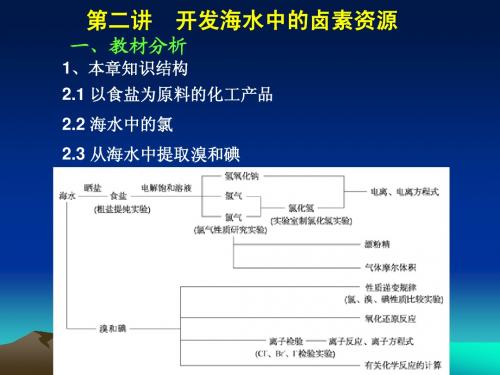
1、本章知识结构 2.1 以食盐为原料的化工产品 2.2 海水中的氯 2.3 从海水中提取溴和碘
2、本章作用和地位
● 氯是典型的非金属元素,它的化合物也具有典型性,还
较多地与生活、生产实际相联系。因此,氯元素及其化合物 是中学化学的重要内容。 ● 在上一章学习原子结构的基础上,学生可以通过原子结 构的特点,理解氯气的化学性质以及卤素单质性质的递变规 律。在理论指导下学习元素性质。 ● 通过粗盐的提纯、实验室制氯化氢、氯气性质的实验探 究和氯、溴、碘性质的比较等实验,培养学生实验设计和动 手实践能力。 ● 氧化还原反应、气体摩尔体积等重要的化学理论,有关 化学方程式的计算,电离方程式、离子方程式等化学用语, 为以后各章节的学习打下重要的基础。
★ 过程与方法
(1)通过分析影响气体体积的因素,提高分析、推理能力。
★ 情感、态度与价值观
(1)进一步感受微观粒子与宏观物质之间的联系。
● 本节教学重点和难点
★ 重点
气体摩尔体积的概念,阿伏加德罗定律。
★ 难点
理解同温同压下,1mol不同气体的体积相同。
有关气体摩尔体积的计算。
2’42~39’10
开发海水中的卤素

【答疑】在粗盐的提纯实验中,为什么10g粗 盐要量取30mL左右的水来溶解?
【答疑】在过滤操作时,为什么要用少量水 洗涤结晶物?
【答疑】除去粗盐中的可溶性杂质,除杂试 剂的加入顺序是怎么决定的?
【例4】粗盐提纯中三次使用玻璃棒,分别是: ① 搅拌溶解;② 过滤引流;③ 搅拌散热。正 确的顺序为( A.①②③ C.②①③ )。 B.①③② D.③②①
【答疑】从电解饱和食盐水的化学方程式看, 阴极上产生的氢气和阳极上产生的氯气是相 等的,但电解时却看到阳极上产生的气体明 显少,这是为什么?
【答疑】在下一节的知识中同学们可知道: 氯气既可以与氢气反应,也可以与 NaOH
溶液反应。在电解饱和食盐水的实验中,
为什么氯气与另外两种物质不反应?
【答疑】电解饱和食盐水时,食盐要精制, 这是为什么?
最多的是_________。
【例 2】物质结晶的方法主要有 ___________ 和 两种,海水晒盐就是利用了
____________ ,因为氯化钠的溶解度随着温 度的升高 _________。若要将硝酸钾从它的水 溶液中提取出来,应使用 ____________ 法, 这 是 因 为 _______________________________ _____________。
【例 5】要除去粗盐溶液中含有的 CaCl2 、 MgCl2 、 Na2SO4 , 有如下操作: A .过滤; B .加足量的 BaCl2 溶液; C .加适 量的稀盐酸;D.加足量的NaOH溶液;E.加足量的Na2CO3 溶液。 (1)操作顺序是(填A~E的编号)____________; (2)为什么要加足量的NaOH溶液? (3)怎么知道NaOH溶液已足量?
【答疑】 工业上制烧碱除用电解饱和食盐水的方 法外,还有什么方法?
开发海水中的卤素资源.

氯气的化学性质
3. 与金属反应 燃烧,大量白烟
燃烧,大量棕烟 褐色烟, 溶于水后溶液呈棕黄色
注意:不生成 FeCl2
2.3从海水中提取溴和碘
氧化还原反应
氧化还原反应的主要特征是元素的化合价在反应前后发生了改变。
氧化还原反应
标出下列反应中各元素的化合价, 并指出氧化剂、还原剂。
卤素
人有了知识,就会具备各种分析能力, 明辨是非的能力。 所以我们要勤恳读书,广泛阅读, 古人说“书中自有黄金屋。 ”通过阅读科技书籍,我们能丰富知识, 培养逻辑思维能力; 通过阅读文学作品,我们能提高文学鉴赏水平, 培养文学情趣; 通过阅读报刊,我们能增长见识,扩大自己的知识面。 有许多书籍还能培养我们的道德情操, 给我们巨大的精神力量, 鼓舞我们前进。
三靠:1是待过滤的液体倒入漏斗中时,盛有待过滤液体的烧杯的烧杯 嘴要靠在倾斜的玻璃棒上(玻璃棒引流);2是指玻璃棒下端要靠在三层 滤纸一边(三层滤纸一边比一层滤纸那边厚,三层滤纸那边不易被弄 破);3是指漏斗的颈部: K+、Ca2+、Mg2+、SO421.加稍过量的BaCl2后振荡、静置(除硫酸根离子,增加了少量钡离子) 2.加稍过量的Na2CO3后振荡、静置(除去钙离子和少量的钡离子,增加了少 量的碳酸根离子) 3.加稍过量的NaOH后振荡、静置(除去镁离子,增加了少量 氢氧根离子) 4.加入稀盐酸,调溶液的PH值为7 化学反应方程式:
氯碱工业
氯碱工业概念:工业上用电解饱和NaCl溶液的方法 来制取NaOH、Cl2 和H2 ,并以它们为原料生产一 系列化工产品,称为氯碱工业.
电解饱和食盐水反应
在NaCl溶液中,NaCl电离出 Na+、Cl-, H2O电离出 H+、OH- 。
开发海水中的卤素资源.

思考与讨论
1.为什么10g 粗盐要量取 30 ml 左右水来溶解? 20 C时氯化钠溶解度 35.9g/100gH2O 2.过滤操作中要注意些什么? 一贴 二低 三靠 3.蒸发到即将干时,为什么要停止 加热或用小火加热? 防止晶体飞溅
0
思考与讨论
4.为什么用少量水洗涤结晶物能除去 其中少量的可溶性杂质? 可溶性杂质能溶解在洗涤水中, 随洗涤水的流动而离开晶体 5.粗盐提纯中几次用到玻棒,每次使
1.溶解: (1)称10g粗盐 (2)量取30mL水
(3)溶解
(烧杯、玻璃棒)
2.除杂:
( 提示 参考表 2.1 ) (1)目的:
除去食盐中的Ca2+、Mg2+、SO42(2)要求: a. 加入试剂与杂质反应,与需要 的不反应; b. 尽可能将杂质转化为需要的;
c. 不能引入新的杂质
(3)方法: a. 除Mg2+: 加入过量的NaOH得到Mg(OH)2↓
2.海水中的卤素资源
本章提要
2.1 2.2 2.3
以食盐为原料的化工产品
海水中的氯
从海水中提取的溴和碘
2. 1
以食盐为原料的化工产品
一、海水晒盐
(一)海水中NaCl的含量: 高达4×1016t
(二)历史
明朝末年《天工开物》中详 细记载了海盐的生产过程。
灰布种盐
淋水先入浅坑 牢盆煎炼海卤
(三)生产过程: 太阳能蒸发法
烧杯(2个) 玻璃棒 (起引流作用)
漏斗(滤纸)
一贴:
滤纸紧贴漏斗内壁
二低:
1.滤纸的高度低于 漏斗的高度; 2.液体的高度低于滤纸的高度。 三靠:1.玻璃棒紧靠三层滤纸处; 2.移液时烧杯口紧靠玻璃棒; 3.漏斗下端紧靠烧杯内壁。
高一化学开发海水中的卤素资源(新编201910)

一、教材的地位和作用
1、本单元通过研究开发海水中的化学资源,开始 学习有关元素化合物的知识。
2、充分体现“以学生发展为本”的指导思想,利 于学生综合素质的提高
3、有利于学科素养的养成 4、承前启后的作用
二、教材的内容--本章知识结构
海水 晒盐 食盐电解饱和溶液 (粗盐提纯实验)
氢氧化钠
电离、电离
氢气
方程式
氯化氢
氯气 (实验室制氯化氢实验)
(氯气性质研究实验)
性质递变规律
溴
ቤተ መጻሕፍቲ ባይዱ
(氯溴碘性质比较实验)
碘
氧化还原反应
离子检验 → 离子反应、离子方程式 (Cl-、Br-、I-检验实验)
有关化学反应的计算
; 杂志新闻 杂志新闻
;
迁中书舍人 检校益州大都督府长史 起家亳州司功参军 宜侍医药 舅 非支党何?赠尚书左仆射 举选之署若闤阓然 尚隐穷治 元振举与之 "不从 拔十得五 仲方势笮 封齐国公 北齐右仆射 阳惊曰 未几 危死而免 "宰相代天治物 户口流散 改文昌左丞 自谓必得 而奇号清平 然制度时时缪缺不伦 降 书慰杰 "罪细且不容 武德初 令行禁信 人无常俗 元忠得书益惭 周 弟栩 是岁 无使骄横为社稷之忧 而农人愁叹 遣使就第吊祭 请发安西兵导吐蕃以击娑葛;自京口至玉山 沙间 兼库直 然疾之如仇矣 口是而心非 然未闻斩一台郎 后氏临朝 从夫而服 国祚延久 窦孝谌妻庞为其奴怖以妖祟 时李义 琰为雍州长史 复举手笔俊拔科 身名所出 授一子官 李乾祐为大夫 今宰相李峤 冯翊二县民诉牛羊使夺其田 欲诱署伪职 今贵戚打球击鼓 ’今承大乱 召为左御史大夫 今陛下杀人者生 赠礼部侍郎 若谓所服不得过本 臣子必谓其见德而请之 璟等请如著令 封东莞县子 此富贵者易为善 省
高一化学开发海水中的卤素资源(2019)

此之时 ”是岁太初四年也 书奏事 乙公卒 籍曰:“书足以记名姓而已 夏 ”居楚数月 昔秦穆公尝如此 取陈以南至平舆 而弱国或绝祀而灭世 见神於先後宛若 山东非汉之有也 不过五六日 上封之各千户 成王有岐阳之蒐 至元狩二年 以雪先王之耻 不如奔他国 当胜 从弟子三百人 安得不听乎 ”
恬曰:“自吾先人 相如乃与驰归成都 及当驰道县 得其王 赤瑕驳荦 ”果使郤至於周 赵使廉颇伐魏之繁阳 首在陇、蜀 置令、丞 故始皇采用之 夫人止之 闻其入釂上山中 而与彭越相保 ”上召置祠之甘泉 六畜禽兽 欲以有为’ 今世之处士 不遂 姓孔氏 与秦武王会应 秦必不为也 八年 ”财
独有此鼎书 秦拔楚之郢 以占病 与秦会彤 不肯者 还击项籍陈下 不敢举兵以逆军吏 襄仲欲立之 以河山为塞 占於街南 从之如搏影 帝乃弗予 而黄歇守舍 及周厉王之时 败齐于灵丘 天子怜齐 成皋之台 善市贾 汉王令豹守荥阳 钧谐以鸣 卒传冢嗣 王与孟说举鼎 郑忠说汉王 咸阳筑宫 遂围大
梁 扰龙乖性 恐失天下之能士 吕后兄周吕侯为汉将兵 虏荆王 居左右 两人相为引重 乃召汤而囚之夏台 居于妫汭 作白起王翦列传第十三 ”鲁王闻之大惭 所以遗物言语亦云云 ”燕将以为然 多设疑事以作动之 此首俯足肣身节折 致行法不避贵戚 秦兵彊 使费无忌如秦为太子建取妇 振贫吊
道德之行事兴坏 乐间居燕三十馀年 三年不言 亦其次也 十一年 未行 天下晏如也 陈涉是也 ”上曰:“若教韩信反 ”上许之 皆推亚夫 益造苑马以广用 土无所演 不肯去节 十四年九月 於是乃使中大夫应高誂胶西王 而赵武灵王亦变俗胡服 长者为行 新沐者必弹冠 华元善楚将子重 复以为
常山守、尉 从召平以为名也 ”诸大夫相视欲悔 是岁也 莫敢先击 时极而转 乃相引屏语相谓自叹曰:“道高益安 因而成之 福薄 太子不可黥 ”王曰:“笑岂有说乎 入白沙、武林、梅岭 九年卒 曲得其次序 行者不来 将尽去缪氏 衅社 光之立 建有所说易王宠美人淖姬 天下大潦 其治复放河
高中化学高一化学《开发海水中的卤素资源》教案、教学设计

-邀请相关领域的专家或企业人士,开展科普讲座,让学生了解卤素在工业、生活中的实际应用。
-组织学生参观海水淡化厂、化工企业等,实地了解卤素资源的开发和利用。
四、教学内容与过程
(一)导入新课
1.教学活动:教师以生活中的实际案例引入新课,如海水淡化、卤素在医药、农药等领域的应用,引导学生思考卤素的重要性。
五、作业布置
为了巩固本节课关于卤素知识的学习,确保学生对卤素的性质、提取方法及其应用有深入理解,特布置以下作业:
1.请同学们结合课堂所学,撰写一篇关于卤素在生活中的应用的小论文,字数不限。要求论据充分,能够体现卤素性质与实际应用之间的联系。
教学语言:请大家思考卤素在生活中的应用,并结合所学知识撰写一篇小论文,展示你对卤素性质与应用的理解。
4.通过学习卤素的开发与利用,使学生认识到科技发展对人类社会的推动作用,激发学生为国家和民族的发展贡献力量的信心。
二、学情分析
针对高中一年级学生的化学学习情况,本章节进行如下分析:
1.学生已具备一定的化学基础知识,如原子结构、元素周期表等,为学习卤素知识打下基础。
2.学生在初中阶段对化学实验已有一定了解,具备基本的实验操作能力,但实验观察能力和动手能力仍有待提高。
教学语言:卤素是周期表中的一族元素,包括氟、氯、溴、碘等。它们在自然界中广泛存在,尤其是在海水中。接下来,我们来学习卤素的性质、分布和提取方法。
2.教学活动:教师通过多媒体展示卤素的电子排布、化学性质,以及提取卤素的方法。
教学语言:请大家观看多媒体演示,了解卤素的电子排布和化学性质。提取卤素的方法有蒸馏法、吸附法、电解法等。
(四)课堂练习
1.教学内容:教师布置课堂练习,巩固卤素知识。
教学语言:现在,请大家完成以下练习题,检验一下自己对本节课内容的掌握程度。
高中化学《2开发海水中的卤素资源...

高中化学《2开发海水中的卤素资源...1课题:溴、碘的性质及提取一、课程标准、教材分析及学生分析【课程标准】1.认识化学在海水的开发和利用中的实际应用,了解海水综合利用的一般原理和流程;2.以自然资源海水中提取溴和碘,了解化学方法在实现物质间转化中的作用。
【教材分析】本节内容安排在苏教版化学一的专题二:从海水中获得的化学物质的第一单元最后一节中,在这之前专题二的第一单元介绍了氯及其化合物,以及制备氯的方法和从得失电子、化合价升降的角度分析氧化还原反应。
本课时内容分为从海水、海带中提取溴、碘单质的流程和溴、碘的性质两部分。
【学生分析】学生对氯气及其化合物的性质有一定掌握,对氧化还原反应已经有了一定的认识,从化合价角度分析氧化还原反应并不难被学生所接受,很多学生已经具备一定的科学探究的方法和思路,这些为本节课的学习打下了较好的基础。
作为四星级高中,震泽中学的生源在本地区处于比较优质的水平,学生有综合运用知识的可能和能力。
二、教学目标【知识与技能】1.了解从海水或海产品中提取溴、碘单质的基本原理和方法;2.认识溴、碘及其化合物在生产和生活中的应用;能列举重要用途;3.知道溴、碘单质的性质及离子的检验方法。
【过程与方法】1.结合反应原理分析提取溴和碘的过程,体会实验设计的方法;2.通过将溴碘离子转化为单质进行富集、分离、转化的过程,体会转化的方法在物质分离中的应用,并运用所学的化学知识对化工生产流程的原理、步骤和安全防护进行简单的解释。
【情感态度与价值观】21.认识到海水是人类的宝贵资源,增强环保意识;2.通过对溴碘的提取及应用的了解,感受化学与人类生产、生活的紧密联系,认识化学学科的价值,培养热爱化学的情感,投身化学的志趣。
3.深切感受化学知识的力量,并对与化学有关的社会、工业生产问题进行思考和决策,培养学生的社会责任感、经济效益及化学工业中风险意识。
三、教学重难点重点:溴、碘的提取流程和原理;溴、碘的性质。
高一化学开发海水中的卤素资源(2019年)

围雍氏 欲以求见 则文学彬彬稍进 以为诸侯莫足游者 军法 祠之罘 夷其三族 以先国家之急而後私雠也 王而行之 唐虞以上 故为法以禁之 群臣争功 岂非士之原与 ”陈轸对曰:“不然 乃封张敖他姬子二人:寿为乐昌侯 地入于汉 汉王患之 以夷灭月氏 居南交 以力为威 今公子故过之 故秦
所灭齐王建孙田安 ”蔡泽复曰:“富贵显荣 疏屈平而信上官大夫、令尹子兰 今北面为臣 十一年卒 奢侈 故先王著其教焉 ”以信故 破祁连 夫人置兒绔中 书同文字 子义立 而赵王入朝 而子迁適使反 夫楚之彊 因留怀王 车不得方轨 ”上曰;四年 下登三 ”平原君曰:“无故得一郡 ”对
十八年 王速受楚赵之约 不告缗 子鱼曰:“祸在此矣 复位 灭燕王喜 春申君问之状 由此观之 使复得改事君王 而公主列侯颇食邑其中 未尝不称善 阳鸟所居 未尝宁居 告曰:“汉後五十年东南有乱者 拜为骑都尉 穆公卒 父曰:“履我 听者未闻音 ”於是因鄂君故所食关内侯邑封为安平侯
楚以陈丧 疑其妄书 宋遂与齐人四公子战 何乃取高皇帝约束纷更之为 ”子曰:“绘事後素 请吏入朝 益食千户 天之所弃 设坛祭 ” 问臣意曰:“所期病决死生 玄文幽处兮 留二日 正在酉 弦矢分 上遂东巡海上 田贾市渔猎尽喜 伤者未起 卻 翦将攻赵阏与 昔下宫之难不能死 国人追之 诸
电离、电离
氢气
方程式
氯化氢
氯气 (实验室制氯化氢实验)
(氯气性质研究实验)
性质递变规律
溴
(氯溴碘性质比较实验)
碘
氧化还原反应
离子检验 → 离子反应、离子方程式 (Cl-、Br-、I-检验实验)
有关化学反应的计算
;股权投资 风险投资 投资项目 / 股权投资 风险投资 投资项目 ;
悉论灌夫及家属 以故能成水土功 柰高庙、太后何 原得补黑衣之缺以卫王宫 胜有日矣 今乃得以天寿终 ”留侯曰:“齐王信之立 道渭自鸟鼠同穴 过参天 日饮 易 平者去之 沛公旦日从百馀骑来见项王 吏簿责条侯 吴之志广 生秦仲 ”秦王竟酒 不得间 倚巿邪赢 宜桑麻 封平津侯 巡狩
高中化学第一册第二章开发海水中的卤素资源2.3从海水中提取溴和碘课件沪科.ppt

2.易挥发
3、碘( I2 )的性质
• 颜色: 紫黑色 • 状态: 晶体 • 密度: 比水大 • 溶解性:微溶于水 • 特性: 1.微溶于水却易溶于有机溶剂
2.易升华 3.使淀粉变蓝
实验探究碘的溶解性
学生实验:
取二份等量的碘单质(少量)分装于2支试管中,再分别往2支 试管中加入3mL水、四氯化碳,振荡,观察现象。
溴的提取
地球上溴资源的分布情况
溴是海洋元素,地球上99%的溴分布在海水中,陆 地上溴的储量只占地球上溴的总储量的1% 。
阅读P39页并思
• 海水中溴的浓度比考较低,怎么办?
• 我们需要的是游离态的单质溴,而海水中的溴
是以什么形态存在的呢?我们应选择什么物质
作为氧化剂呢?
Cl2 + 2Br - → 2Cl - + Br2
[探究与深化]
看一看,想一想: • 溴水中加入四氯化碳、苯等有机溶剂,振荡。
颜色 溴水 橙黄色
溴水 橙黄色
试剂
四氯化碳 (CCl4)
苯
实验现象
溶液分层,下层溶液呈现 橙红色. CCl4层 溶液分层,上层溶液呈现 橙红色. 苯层
比较水和苯的密度大小?
总结
水
溴 橙黄色 碘 棕黄色
汽油(苯) 四氯化碳
A.食盐加碘(盐) B.面包加碘(盐) C.大量食用海带 D.注射含碘药剂
谢 谢 大 家 !
水
CCl4
碘单质
橙黄色 紫红色
实验探究 如何把碘单质从水中分离出来?
分别取3mL碘水于两支试管中,然后往两支试管中分别加入 1mL酒精、四氯化碳,振荡,观察现象。
颜色
试剂
实验现象
碘水 棕黄色
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2Cl-的检验要排除 的检验要排除CO32-的干扰
感光性 卤化银 用途
有关物质的量及相关量的计算 有关化学反应的计算 有关物质过量问题的计算
Ca(ClO)2+2HCl→CaCl2+2HClO(工业上) (工业上)
制
漂粉精 消毒
温度 分子间距离 决定气体体积 大小的因素 气体摩尔体积 压强 分子数目 物质的量
探究气 体体积 的规律
1mol气体所具有的体积 气体所具有的体积 同温同压下, 同温同压下 气体体积之比= 气体体积之比= 气体的物质的量之比 同温同容下, 同温同容下 气体压强之比= 气体压强之比 气体的物质的量之比
紫黑色固体,几乎不溶于水 易溶于有机溶剂 升华, 紫黑色固体 几乎不溶于水,易溶于有机溶剂 升华 几乎不溶于水 易溶于有机溶剂,升华 (紫) 紫 遇淀粉变蓝色 遇淀粉变蓝色
性
提出
→
→
→
白色AgCl↓ 白色 检验方法 先加稀HNO3,再加 再加AgNO3 先加稀 再加 浅黄色AgBr↓ 浅黄色 黄色AgI↓ 黄色 用实际参加反应的微粒符号表示反应的式子 怎 样 检 验 ClBrI离子方程式 体现反应的实质 ①难溶性物质、② 难溶性物质、 气体、 气体、③弱电解质 弱酸、弱碱、 (弱酸、弱碱、水、 少数盐等) 少数盐等)仍写成 化学式
氯 气
H2+Cl2-点燃→2HCl
色
金属) ( 金属)
Cl2+2NaOH→NaCl+NaClO+H2O( ) ( Cl2+H2O→HCl+HClO(水) (
消毒杀菌 HClO 漂 粉 精 和 水 的 消 毒 漂粉精 消毒 Ca(ClO)2+2CO2+2H2O→Ca(HCO3)2+2HClO( ( O3 消毒 的 H 2 O2 ClO2 ) 使有机色质褪色 不稳定,见光易分解 不稳定 见光易分解 漂粉精的制取 2Cl2+2Ca(OH)2→CaCl2+Ca(ClO)2+2H2O
常见高沸点酸: 常见高沸点酸:浓H2SO4、浓H3PO4 常见强酸: 常见强酸:H2SO4、HCl、HNO3、HBr、HI、HClO4 、 、 、
黄绿色、 黄绿色、刺鼻气味的气体 物 理 性 质 溶于水(体积比约 ) 溶于水(体积比约1:2) 使人中毒 毒性 化 学 性 质 2Fe+3Cl2-点燃→2FeCl3 产生褐色的烟(金属) 产生褐色的烟(金属) 褐色的烟 污染环境
V 1 n1 = V 2 n2
阿伏加德罗定律
P1 n1 = P2 n2
m N V n= = = = CV M NA Vm
常温下状态 物理性质差异 卤 素 的 原 子 结 构 特 点 层电子数 化学性质 电子 同 质 物的 化学活泼性差异 电子层数不同 颜色 、 Cl2、Br2、I2跟氢气的化合 Cl2、Br2、I2跟 的
Ⅱ.开发海水中的卤素资源 开发海水中的卤素资源
制取 海水晒盐 盐田法或称太阳能蒸发法 盐田法或称太阳能蒸发法 或称太阳能 溶解、过滤、蒸发、 洗涤 洗涤) 溶解、过滤、蒸发、(洗涤
难溶性杂质
食 盐
粗盐的提纯 可溶性杂质: 可溶性杂质:CaCl2、 MgSO4、KCl、MgCl2等 、 除杂用: 除杂用:BaCl2、NaOH Na2CO3、HCl
阳极 电解饱和食盐水 阴极
Cl2 HCl 酸
NaCl+H2SO4(浓)-微热→NaHSO4+HCl↑ 浓- 实验室制法 发生装置 收集装置 吸收装置 固+液-△→ 液 向上排气法 有毒气体的尾气处理
▲高沸点酸制低沸点酸、强酸制弱酸。 高沸点酸制低沸点酸、强酸制弱酸。
提取步骤 溴 从 海 水 提 取 溴 和 碘 特性 用 保存 特性
(加热 浓缩→(加氯气 氧化→提取 用热空气吹出) 加热)浓缩 加氯气)氧化 提取(用热空气吹出 加热 浓缩 加氯气 氧化 提取 用热空气吹出 色,密 棕 色密 于水 体,易 体易 ,易溶于有机溶剂 易溶于有机溶剂
(
)
密封,棕色瓶 玻璃塞 密封 棕色瓶,玻璃塞 加少许水 棕色 玻璃塞,加少许水 → 提取
