氢氧化铝沉淀图像讲解
初中化学所有沉淀图片(附酸碱盐溶解性表)

初中化学所有沉淀图片(附酸碱盐溶解性表)
在初三化学(人教版)附录1:部分酸、碱和盐的溶解性表(室温)中,“不”代表这种物质不溶于水,“微”表示这种物质微溶于水。
我们在写方程式时,要注意标注沉淀符号“↓”。
今天,老师总结了表中所有沉淀(固态g)的颜色。
都是实物照片。
非常直观,方便同学们理解记忆。
酸碱盐溶解性表
以下是沉淀(固态)图片:
氢氧化钙 Ca(OH)2
氢氧化镁 Mg(OH)2
氢氧化铝 Al(OH)3
氢氧化锰本物质有两种:Mn(OH)2和Mn(OH)3
氢氧化锰本物质有两种:Mn(OH)2和Mn(OH)3
Mn(OH)2:白色到浅桃红色结晶。
在空气中极易与氧气反应,生成棕色的偏氢氧化锰沉淀。
方程式为:2Mn(OH)2+O2=2MnO(OH)2。
所以纯白色的氢氧化锰不多见,一般为带有棕色的晶体。
Mn(OH)3 :白色沉淀,常温下为固体。
氢氧化锌 Zn(OH)2
氢氧化亚铁 Fe(OH)₂
氢氧化铁 Fe(OH)3
氯化银 AgCl
硫酸钡 BaSO4
硫酸银 Ag2SO4
硫酸钙 CaSO4.2H2O
碳酸钡 BaCO3
碳酸钙 CaCO₃
碳酸镁 MgCO3
碳酸锰 MnCO3
碳酸锌 ZnCO3
碳酸亚铁 FeCO3
碳酸银 Ag₂CO₃
如果觉得有用的话,就分享并收藏吧!。
重难点十 有关氢氧化铝沉淀的图像分析及有关计算

重难点十 有关Al(OH)3沉淀的图像分析及有关计算【要点解读】x =n(OH -)/n(Al 3+)①当0<x <3时,随着x 淀的量逐渐增多 ②当x =3时,沉淀的量最多③当3<x≤4时,随着x =n(H +)/n(AlO 2-)①当0<x <1时,随着淀的量逐渐增多②当x =1时,沉淀的量最多2、滴加过程中铝元素存在形式的分析(1)向1 L 1 mol·L -1的AlCl 3溶液中滴加NaOH 溶液:(2)向1 L 1 mol·L -1的NaAlO 2溶液中滴加稀盐酸:【重难点指数】★★★【重难点考向一】体现A l (O H )3两性的图像分析【例1】向用HCl 酸化过的AlCl 3溶液中逐滴滴入NaOH 溶液,图中能正确表示这个反应的是( )【重难点考向二】有关氢氧化铝沉淀溶解图像的计算【例2】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL的溶液含NaOH 1mol/L,然后滴加1mol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )A.原合金质量为0.92gB.图中V2的值为60C.图中m的值为1.56D.产生氢气的体积为896mL(标准状况下)【趁热打铁】1.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )2.将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )A.镁和铝的总质量为9 gB.最初20 mL NaOH溶液用于中和过量的硫酸C.硫酸的物质的量浓度为2.5 mol•L-1D.生成的氢气在标准状况下的体积为11.2 L3.某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少.实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系.下列说法错误的是( )A.该未知溶液中至少含有3种阳离子B.滴加的NaOH溶液的物质的量浓度为5mol•L-1C.若另一种离子为二价阳离子,则a=10D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6g4.如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )A.往Ca(OH)2和KOH的混合溶液中通入CO2B.往AlCl3和NH4Cl的混合溶液中加NaOH溶液C.往Al2(SO4)3和(NH4)2SO4的混合溶液中加Ba(OH)2溶液D.往NH4Al(SO4)2溶液中加入NaOH溶液5.将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示;(1)当沉淀达到最大值时,Al(OH)3的质量;(2)原合金中Mg的质量;(3)盐酸的物质的量浓度。
“铝三角”的图像分析及计算

“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像A→B:Al3++3OH-===Al(OH)↓A→B:Al3++4OH-===AlO-+2H OA→B:AlO-+H++H O===Al(OH)↓A→B:4H++AlO-===Al3++2H O32Al3++3NH·H O===Al(OH)↓+3NH+4、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像O→A:H++OH-===H O(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量O →A:H++OH-===H O(2)把2O →A:2KAl(SO)+3Ba(OH)===2Al(OH)↓+3BaSO↓+K SO类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.①线表示Al(OH)3的物质的量的变化D.①线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1①3 B.2①3 C.6①1 D.3①13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
氢氧化铝沉淀图像分析

0
1
2
3
4
5
滴加NaAlO 的体积(V) 滴加NaAlO2的体积(V)
有关图象
AlO2- +CO2 + 2H2O = Al(OH)3 + HCO32AlO2- +CO2 + 3H2O = 2Al(OH)3 + CO32n[Al(OH)3](mol)
向NaAlO2溶液溶 液中通入CO 液中通入CO2气体
4Al(OH)3↓
AlO2-
结论: AlO2-存在碱溶液中,Al3+存在酸溶液中。 存在碱溶液中, 存在酸溶液中。
为什么Al(OH) 会具有两性—既与酸反应, 为什么Al(OH)3会具有两性—既与酸反应, 又与强碱反应? 又与强碱反应?
H++AlO2-+H2O
酸式电离
Al(OH)3
Al3++3OH碱式电离
2、氢氧化铝 、
1)制法: 常用铝盐+氨水 )制法: 常用铝盐+
Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3•H2O=Al(OH)3↓+3NH4+ 2)性质 ) 是一种白色胶状物, (1)Al(OH)3是一种白色胶状物,几乎不 ) 溶水,能凝聚水中的悬浮物. 吸附色素, 溶水,能凝聚水中的悬浮物 吸附色素,可 净化水。 净化水。 制备Al(OH)3时为什么不用 时为什么不用NaOH等强 制备 等强 碱溶液,而用氨水? 碱溶液,而用氨水?
现象:开始无沉淀, 现象:开始无沉淀,过一会儿产生白色沉淀且不溶解
科学探究3: 科学探究 :向NaAlO2溶液里滴加盐酸至过量
高中化学-图像
(7)将CO2通入偏铝酸盐溶液中 原理:CO2(少量)+2AlO2- + 3H2O = 2Al(OH)3 ↓+CO32CO2(过量)+AlO2- + 2H2O = Al(OH)3 ↓+HCO3现象:产生白色沉淀,沉淀不溶解。 图象: 沉淀
n(CO2)
Al(OH)3 + NaOH = NaAlO2 + 2H2O 现象:先有白色沉淀,后沉淀溶解 图象: 沉淀
1 2 3 4 n(NaOH)
(2)将AlCl3溶液滴入NaOH溶液中加至过量 原理:AlCl3 + 4NaOH == NaAlO2+3NaCl +2H2O 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl 现象:先无现象,后白色产生沉淀 图象: 沉淀
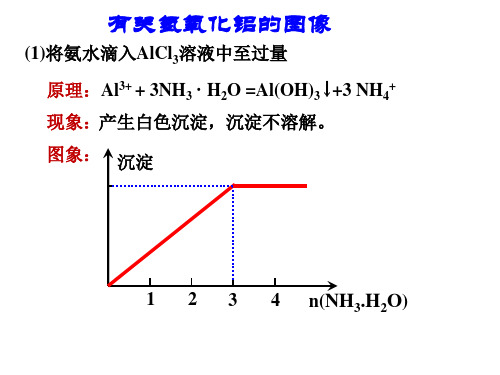
有关氢氧化铝的图像
(1)将氨水滴入AlCl3溶液中至过量 原理:Al3+ + 3NH3 ·H2O =Al(OH)3 ↓+3 NH4+ 现象:产生白色沉淀,沉淀不溶解。 图象: 沉淀
1 2 3 4 n(NH3.H2O)
(2)将NaOH溶液滴入AlCl3溶液中加至过量 原理:AlCl3 + 3NaOH = Al(OH)3↓+3NaCl
1 2 3 4 n(AlCl3)
(3)将HCl溶液滴入到NaAlO2溶液中至过量 原理:H+ +AlO2- + H2O = Al(OH)3 ↓ Al(OH)3 +3H+ = Al3+ + 3H2O 现象:先有白色沉淀,后沉淀溶解 图象: 沉淀
1 2 3 4 n(HCl)
氢氧化铝沉淀图像分析

为什么不用水, 而用NaOH溶液?
残渣
滤液
通CO2 过滤
Al 电解
滤液
Al(OH)3 灼 烧 Al2O3
第14页,共29页。
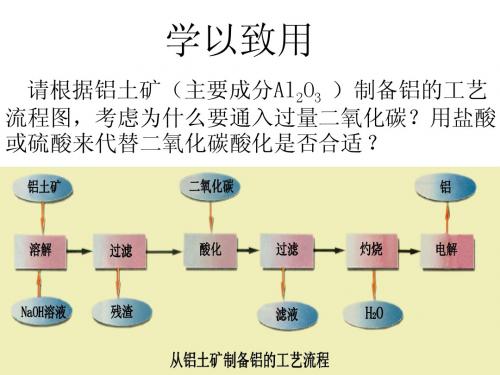
工业冶炼铝的流程图
铝 NaOH溶液 土 矿 过滤
(主要成分为Al2O3 )
残渣
滤液
通CO2 过滤
Al 电解
滤液
Al(OH)3 灼 烧 Al2O3
第15页,共29页。
因为氢氧化铝可溶解在氢氧化钠溶液中:
当氢氧化钠不足时,铝离子沉淀不完全, Al3++3OH-=Al(OH)3↓; 当氢氧化钠过量时,Al(OH)3+OH-=AlO2-+2H2O,铝离子会 转化为AlO2-。
第4页,共29页。
科学探究1:向AlCl3溶液里滴加NaOH溶液至过量
现象:先产生白色沉淀,然后沉淀逐渐溶解。
第7页,共29页。
为什么Al(OH)3会具有两性—既与酸反应,又 与强碱反应?
H++AlO2-+H2O
Al(OH)3
Al3++3OH-
酸式电离
碱式电离
第8页,共29页。
(3)不稳定性 2Al(OH)3==∆Al2O3+3H2O
在金属活动顺序表中,只有K、Ca、Na 的氢氧化物可溶于水(其对应的氧化物可与 水化合),热稳定性好;其它金属的氢氧化 物均难溶于水(其对应的氧化物不能与水化 合) ,且受热易分解生成金属氧化物和水。
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3 ——两性
第3页,共29页。
思考与交流1:某胃病患者胃酸过多,如果你是医生, 你用什么药物治疗胃酸过多?
8-2图像分析
向氢氧化钠溶液中逐滴加入氯化铝溶液直至过量
Al3+ + 4OH- → AlO2- + 2 H2O Al3++3AlO2—+6H2O →4Al(OH)3 ↓
练习: 练习:画出下列情况的图像
(纵坐标均为氢氧化铝沉淀的量,横坐标为加入试剂的量) 纵坐标均为氢氧化铝沉淀的量,横坐标为加入试剂的量)
•在氯化铝溶液中逐滴加入氨水直至过量 在氯化铝溶液中逐滴加入氨水直至过量 Al3++3NH3 · H2O →3NH4++Al(OH)3↓
练习3、若AlCl3溶液中除混有MgCl2和盐酸外,还混 有NH4Cl,向此溶液中逐滴滴加NaOH溶液直至过量, 发生的反应又有何不同,图象又有什么样的变化?
现象:开始无沉淀,之后产生沉 淀,沉淀量保持不变,沉淀部分 溶解
H+ + OH-→ H2O Mg2+ + 2OH-→ Mg (OH)2↓ Al3+ + 3OH-→ Al(OH)3↓ NH4+ + OH-→NH3·H2O Al(OH)3+ OH-→ AlO2-+2H2O
学以致用
请根据铝土矿(主要成分Al2O3 )制备铝的工艺 流程图,考虑为什么要通入过量二氧化碳?用盐酸 或硫酸来代替二氧化碳酸化是否合适 ?
有关氢氧化铝沉淀的图像
(纵坐标均为氢氧化铝沉淀的量,横坐标为加入试剂的量) 纵坐标均为Biblioteka 氧化铝沉淀的量,横坐标为加入试剂的量)
向氯化铝 氯化铝溶液中逐滴加入氢氧化钠 氢氧化钠溶液直至过量 氯化铝 氢氧化钠 过量 (1)Al3++3OH- →Al(OH)3↓ (2)Al(OH)3 + OH- → AlO2- + 2H2O 总:Al3+ + 4OH- → AlO2- + 2 H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
先产生白色沉淀后又消失
[Al(OH)4]-+H+===Al(OH)3↓+H2O Al(OH)3+3H+===Al3++3H2O
无明显现象→产生白色沉淀
[Al(OH)4]-+4H+===Al3++4H2O Al3++3[Al(OH)4]-===4Al(OH)3↓
[Al(OH)4]-+CO2===Al(OH)3↓+HCO3- 生成白色沉淀
重要提示 (1)NaOH溶液和AlCl3溶液滴加顺序不同,则现象不 同,可以用互滴的方法鉴别这两种溶液,同理,稀盐 酸和Na[Al(OH)4]溶液也可这样鉴别。
(2)向铝盐中滴强碱溶液,若已知生成的Al(OH)3沉淀 的量,只要沉淀量不为最大值和零,消耗OH-的量有 两种可能。
①若OH-不足 ②若OH-足量,消耗OH-共有两步 将Al3+全部转化为Al(OH)3沉淀:
B
AlCl3是 0.01 mol,
MgCl2是0.01 mol。
(2)C点所加的盐酸的体 积是 130 ml。
A 0.58
O 10.0
30.0
C V[HCl(aq)]/ml
试一试,你一定行!
1、 要使AlCl3中的Al3+完全转化成Al(OH)3沉淀,选用
的最佳试剂为:
A. NaOH溶液
B. 稀盐酸
有关AI(OH)3生成与溶解的图像分析
Al3++3OH-===Al(OH)3↓ Al(OH)3+OH-===[Al(OH)4]- 先产生沉淀后消失
先无明显现象后生成白色沉淀
Al3++4OH-==[Al(OH4)]- Al3++3[Al(OH)4]-===4Al(OH)3↓
Байду номын сангаас
生成白色沉淀 Al3++3NH3·H2O===Al(OH)3↓+3NH4+
C. 氨水
D. AgNO3溶液
2、既能与NaOH溶液反应,又能与盐酸反应的
物质是: ( )
A、Al(OH)3
B 、NaHCO3溶液
C 、NaCl溶液
D、AlCl3溶液
• (考查单质铝的性质)将等物质的量的 镁和铝相混合,平均分成4份,分别加到足 量的下列溶液中,充分反应后,放出氢气最 多的是( A )
逐滴加入NaOH溶液至过量 逐滴加入NaOH溶液至过量
字母代号
向20 mL物质的量浓度为0.5 mol·L-1的AlCl3溶液 中滴加2 mol·L-1 NaOH溶液时,得到的Al(OH)3沉 淀质量与所滴加NaOH溶液体积(mL)的关系如图所 示,
将一定质量的镁、铝合金投入100 mL一定物质的量浓 度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol·L-1的NaOH溶液至过量,生成沉淀的质量与加入 的NaOH溶液体积的关系如图所示,求:
6.向 Mg2+与 Al3+的酸性溶液中逐滴加入 强碱溶液
(1)现象:无明显现象―→出现沉淀―→渐 多―→最多―→减少―→不变
(2)反应 O―→A:H++OH-===H2O A―→B:Al3++3OH-===Al(OH)3↓ Mg2++2OH-===Mg(OH)2↓ B―→C:Al(OH)3+OH-===AlO- 2 +2H2O
Al3+~3OH-~Al(OH)3(最大值), 再反应掉部分Al(OH)3:
Al(OH)3(反应)~OH-~[Al(OH)4]-。
课堂练习2
向30 mL 某浓度的AlCl3溶液中逐渐加入浓度 为4 mol/L的NaOH溶液,产生沉淀与加入NaOH 溶液体积的关系如图所示。若产生0.78g白色沉 淀,则加入的溶液的体积可能为( ) BD
A. 3mL B. 7.5mL C. 15mL D. 27.5mL
n沉淀
0.03mol
0.01mol
0
7.5
27.530 VNaOH
溶液 ①饱和石灰水 ②AlCl3溶液 ③MgCl2、AICI3混合溶液 ④AlCl3溶液 ⑤含少量HCI的AICI3溶液
加入的物质 通入过量CO2 通入过量NH3
逐滴加入NaOH溶液
(3)图象
思维拓展
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于 足量水后,产生0.58g白色沉淀,再向所得悬浊液中 逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与 生成沉淀的关系如下图所示。试回答:
(1)混合物中各物质的物
质的量:
m(沉淀)/g
NaOH是 0.065 mol,
(1)盐酸的物质的量浓度(假设反应后溶液体积 不变)。 1.4 mol/L
(2)合金中镁和铝的质量。 Mg:3.6g
m(沉淀)/g
Al:2.7g
100 700 800
V[NaOH(aq)]/mL
类型 5.明矾溶液中逐滴加入 Ba(OH)2 溶液至过量
(1)现象:先有白色沉淀生成,然后部分沉淀溶解。 (2)有关反应:
考查金属铝与酸、碱反应的相关计算
1.铝与酸或碱溶液反应生成H2的量的关系
2Al~2OH-~3H2↑
(2Al~6H+~3H2↑)
2.几种反应情况的分析
(1)等量Al分别与足量酸(H+)和碱(OH-)溶液反应,
生成H2的物质的量之比为1∶1,耗H+和OH-物质的 量之比为3∶1。
(2)足量Al分别与物质的量相等的H+和OH-溶液反
应,生成H2的物质的量之比为1∶3。
必(定3)若是产:生H2的物质的量之比为13nnOHH(H(H2)2)11 , 则
与酸反应时,Al过量、H+不足;
与碱反应时,Al不足、OH-过量。
课堂练习3
将某质量的镁铝合金溶解在500mL盐酸中,向反 应后的溶液中逐滴加入1mol/LNaOH溶液,产生 沉淀质量与碱溶液体积的关系如图所示。求:
+
4
、Mg2+、Al3+的混合溶液
中逐滴加入NaOH,先与H+反应,再与Mg2+、Al3+生成
沉淀,再与NH+ 4 反应,最后再溶解Al(OH)3沉淀。
1 课堂练例习4 某无色溶液中,已知含有 H+、Mg2+、Al3+
等阳离子,逐滴加入 NaOH(溶液),则消耗 NaOH(溶 液)体积(x 轴)和生成沉淀量(y 轴)之间的函数关系,可 用下图表示,则下列图中正确的是( )
O―→A: 2KAl(SO4)2+ 3Ba(OH)2===2Al(OH)3↓ + 3BaSO4↓+K2SO4
A―→B : 2Al(OH)3 + K2SO4 + Ba(OH)2===BaSO4↓ +2KAlO2+4H2O
(3)图象
[特别提醒] 当溶液中有多种离子时要考虑离子之间的
反应顺序,如向含有H+、NH
