植物体内可溶性糖和可溶性蛋白含量的测定
苹果、梨以及香蕉中所含可溶性糖和蛋白质的比较测定和探讨

苹果、梨以及香蕉中所含可溶性糖和蛋白质的比较测定和探讨姓名:赵云霞同组者:辛芝红指导教师:郝雪峰(太原师范学院生物系112班学号2011131229)摘要本文用考马斯亮蓝法、蒽酮法分别对苹果、梨和香蕉提取液中蛋白质含量、可溶性糖含量进了测定。
结果表明:等质量的香蕉、苹果、梨中,香蕉含糖量最高,苹果次之、梨最低;香蕉含蛋白质量最高、其次为梨、苹果最少。
Abstract this paper by Coomassie brilliant blue,anthrone colorimetry respectively on apple, pear and bananaextracts.Protein content, soluble sugar content in the determination of. The results show that: the quality of banana,apple, pear, banana and sugar content of apples, pears was the second highest, lowest; Banana containing proteinIs the highest, followed by the least, apple pear 关键词苹果、梨、香蕉、可溶性蛋白质、可溶性糖Key words apple, pear, banana, soluble protein, soluble sugar 引言苹果和梨、香蕉是我们生活中最常见也是最多糖是单糖缩合的多聚物。
水果多糖作为天然植物多糖中的一类,虽然早就引起了人们的注意,但早期的研究主要是为了搞清其作为结构物质在水果质构方面的作用及在水果贮藏与加工过程中的变化与控制,以改善和保持水果及其加工制品的感官品质。
近年来随着天然活性多糖研究的深入,对水果多糖的研究重点也逐步转向了以开发利用为目的的水果多糖的提取分离、结构、化学和生物活性及应用研究,已有人对苹果果肉中多糖蛋白质进行过测定(刘杰超,焦中高2009),但还没有人对三叶草体内多糖做过相关的研究,也未对其叶和茎中所含多糖进行过对比。
植物组织中可溶性糖含量的测定

植物组织中可溶性糖含量的测定碳素营养中,作为营养物质主要是指可溶性糖和淀粉。
它们在营养中的作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为 NH 3 的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。
由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。
Ⅰ蒽酮法测定可溶性糖一、原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。
在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值。
但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差。
此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。
糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为 620 nm ,故在此波长下进行比色。
二、实验材料、试剂与仪器设备(一)实验材料任何植物鲜样或干样。
(二)试剂1. 80 %乙醇。
2. 葡萄糖标准溶液( 100 μg/mL ):准确称取 100 mg 分析纯无水葡萄糖,溶于蒸馏水并定容至 100 mL ,使用时再稀释 10 倍( 100 μg/mL )。
植物生理学中各项生理指标的测定方法

植物生理学中各项生理指标的测定方法一.实验内容实验1MDA(丙二醛)含量测定所需试剂:10%三氯乙酸(TCA)(纯)0.25%硫代巴妥酸(纯)实验2:可溶性蛋白含量测定所需试剂:考马斯亮蓝G-25095%乙醇85%磷酸实验3:SOD(超氧化物歧化酶)酶活性测定所需试剂:dl-甲硫氨酸(Met)NBTEDTA-Na2核黄素实验4:CAT(过氧化氢酶)活性(过氧化氢酶)测定所需试剂:PBS(PH=7.0)30%H2O2实验五:Ap某(抗坏血酸过氧化物酶)活性(即ASA—POD活性)测定所需试剂:ASA(分子量167.12)(乙=胺四乙酸=钠)EDTA—Na2PBS(pH7.0)30%H2O实验6:ASA(维生素C)含量测定偏磷酸95%乙醇磷酸4%2,2-二联吡啶FeCl3(或FeCl3·6H2O)实验7:GSH(谷胱甘肽,媚力肽GSHGSH是由谷氨酸、半胱氨酸和甘氨酸结合而成的三肽化合物)含量测定所需试剂:NaH2PO4·2H2ODTNB(二硫代硝基苯甲酸)PBS(PH6.8)实验8:脯氨酸测定所需试剂:磺基水杨酸甲苯茚三酮冰乙酸85%磷酸试验9:叶绿素含量测定。
80%丙酮试验9:GR活性测定试验10:过氧化氢含量测定。
三氯乙酸试验11:超氧阴离子含量测定二.酶液和母液提取1.酶液提取所需试剂:50mmol/L磷酸缓冲液(PH=7.8)(内含1%(m/v)聚乙烯吡哆烷酮PVP),0.1mmol/LEDTANa2或EDTA),也可为(内含2%(m/v)PVP),0.2mmol/LEDTANa2或EDTA)(先配制后用缓冲液定容)2.ASA.GSH母液提取所需试剂:5%偏磷酸1.抗氧化酶酶液提取(SOD.POD.CAT):1g(根据样品的量,少的可以适当减少)叶片加入预冷5ml.50mmol/L 磷酸缓冲液(PH=7.8)↓4℃冷冻15000g离心20分钟↓上清液即为酶液(5℃下保存一两天内备用,中短期用-20℃保存)2.ASA.GSH母液提取:0.1g叶片加入3ml预冷5%偏磷酸溶液↓4℃冷冻14000g离心10分钟↓上清液即为母液(5℃下保存备用)(偏磷酸可显著沉淀蛋白质和保护ASA)酶液提取所需试剂:PVP(聚乙烯吡哆烷酮):1%(1g溶于100ml水),1000ml需称取10g,此处用PBSEDTA-Na2:0.1mmol/L(37.2mgEDTA-Na2溶于1000ml蒸馏水),此处用PBSPBS(缓冲液)配制方法:①Na2HPO4·12H2O②NaH2PO4·2H2O取①71.64g,蒸馏水定容至1L,取②31.21g定容至1L,放置4℃冰箱备用PH=7.8取①91.5ml+②8.5ml=100ml(浓度0.2mol/L)需要0.05mol/L→将上述溶液烯释至400ml(0.2mol/L某0.1=0.05mol/L某V)母液提取所需试剂:5%偏磷酸:称5g纯偏磷酸,定容至100ml蒸馏水(需加热溶解,温度在50-60℃)偏磷酸有剧毒(偏磷酸难溶解,先得用研钵提前研碎,后用磁力搅拌器溶解一到两天后再定容)(现所用为38%HPO3,所以需称65.7895g,定容至500ml)三.实验步骤实验1:MDA含量测定1.1所需试剂:10%三氯乙酸(TCA)(纯)称10g定容至100ml0.25%硫代巴妥酸(纯)称0.25g用10%TCA定容至100ml(配制时,可一次完成,先配TCA,不要定容,再加入硫代巴比妥酸,然后定容,若难溶解,可以在磁力搅拌器上微热)1.2步骤:取0.3g叶片,加4ml磷酸缓冲液研磨,加入4ml0.25%的硫代巴比妥酸(溶于10%的三氯乙酸)溶液↓摇匀95℃加热15分钟↓快速冷却3000g离心15分钟↓取上清测定OD532,OD600,OD450值↓按公式求MDA浓度=6.45某(OD532-OD600)-0.56OD450(μmol/L)可溶性糖浓度=11.71某OD450(mmol/L)-3最后计算MDA含量(μmol/gFW)=[4某(MDA浓度某)某10/0.1]-3同时,可测得可溶性糖含量(mmol/gFW)=4某(可溶性糖浓度χ)某10/0.1(用多波长测定,在测定之前一定要矫正基线,公式中的参数可以直接在分光光度计上输入)注意:以0.25%的硫代巴妥酸溶液作空白调零MDA含量测定的改进1.可以用做酶活性时提取的酶液来直接测定MDA含量,用量可以定为1.0、1.5或2.0(较好)ml。
设计性实验报告植物可溶性蛋白质和糖含量的测定

设计性实验报告题目植物可溶性蛋白质和糖含量的测定课程名称:基础生物化学实验实验学期:2011至2012学年第一学期植物组织中可溶性蛋白质和糖含量的测定摘要本文以生菜、苹果为材料,采用考马斯亮蓝法(蛋白质)、蒽酮法(糖)、分光光度计法进行了可溶性糖和可溶性蛋白含量的测定。
结果表明:生菜的蛋白质含量为5.88(mg/g),糖含量为0.0739g/100g;苹果中蛋白质含量为0.2926(mg/g),糖含量为0.2126g/100g。
即说明:生菜中蛋白质含量高于苹果,但苹果中的糖含量更高。
关键词可溶性蛋白、可溶性糖,考马斯亮蓝G-250染色法,蒽酮法,含量测定1、材料与方法1.1 蛋白质含量测定标准蛋白质溶液、考马斯亮蓝试剂、生菜、苹果分光光度计、离心机、研钵、烧杯、电子秤、移液管、试管等1.2 糖含量测定200ug/ml标准葡萄糖、蒽酮试剂、浓硫酸、生菜、苹果试管、水浴锅、分光光度计、研钵、电子秤、移液管、量筒、试管架2、实验步骤蛋白质含量的测定(考马斯亮蓝G-250染色法)2.1标准曲线的绘制取六只试管,按下表加入试剂,摇匀,向个管加入5ml考马斯亮蓝试剂,摇匀,并放置5min左右,以0号试管为空白对照,在595nm下比色测定吸光度。
以蛋白质含量为横坐标,以吸光度为纵坐标绘制标准曲线。
2.2样品测定2.2.1样品提取分别秤取生菜、苹果鲜样 0.25~0.5g,用5ml蒸馏水或缓冲液研磨成匀浆后,3000r/min离心10min,上清液备用。
2.2.2 吸取样品提取液1.0ml(蛋白质含量适当稀释),放入试管中,加入5ml考马斯亮蓝试剂,摇匀,放置2min后在595nm下比色,测定吸光度,并通过标准曲线查得蛋白质含量。
糖含量测定2.3.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡萄糖含量为横坐标,光密度值为纵坐标,作出标准曲线。
设计性实验报告植物可溶性蛋白质和糖含量的测定

设计性实验报告题目植物可溶性蛋白质和糖含量的测定课程名称:基础生物化学实验实验学期:2011至2012学年第一学期植物组织中可溶性蛋白质和糖含量的测定摘要本文以生菜、苹果为材料,采用考马斯亮蓝法(蛋白质)、蒽酮法(糖)、分光光度计法进行了可溶性糖和可溶性蛋白含量的测定。
结果表明:生菜的蛋白质含量为5.88(mg/g),糖含量为0.0739g/100g;苹果中蛋白质含量为0.2926(mg/g),糖含量为0.2126g/100g。
即说明:生菜中蛋白质含量高于苹果,但苹果中的糖含量更高。
关键词可溶性蛋白、可溶性糖,考马斯亮蓝G-250染色法,蒽酮法,含量测定1、材料与方法1.1 蛋白质含量测定标准蛋白质溶液、考马斯亮蓝试剂、生菜、苹果分光光度计、离心机、研钵、烧杯、电子秤、移液管、试管等1.2 糖含量测定200ug/ml标准葡萄糖、蒽酮试剂、浓硫酸、生菜、苹果试管、水浴锅、分光光度计、研钵、电子秤、移液管、量筒、试管架2、实验步骤蛋白质含量的测定(考马斯亮蓝G-250染色法)2.1标准曲线的绘制取六只试管,按下表加入试剂,摇匀,向个管加入5ml考马斯亮蓝试剂,摇匀,并放置5min左右,以0号试管为空白对照,在595nm下比色测定吸光度。
以蛋白质含量为横坐标,以吸光度为纵坐标绘制标准曲线。
蛋白质含0 20 40 60 80 100量(ug)2.2样品测定2.2.1样品提取分别秤取生菜、苹果鲜样 0.25~0.5g,用5ml蒸馏水或缓冲液研磨成匀浆后,3000r/min离心10min,上清液备用。
2.2.2 吸取样品提取液1.0ml(蛋白质含量适当稀释),放入试管中,加入5ml考马斯亮蓝试剂,摇匀,放置2min后在595nm下比色,测定吸光度,并通过标准曲线查得蛋白质含量。
糖含量测定2.3.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡萄糖含量为横坐标,光密度值为纵坐标,作出标准曲线。
实验植物组织中可溶性糖含量的测定

实验方案一、实验目的通过实验,掌握测定萝卜品质的方法(一)萝卜外部形态的测定1、实验材料取鲜样3个∕小区直尺、蒸馏水、笔、记录本、吸水纸2、实验方法.用自来水将各组萝卜洗净后,再用蒸馏水洗涤,擦干表面水分.每个小区取3个重复,用电子天平称量每株的鲜重,用直尺测量植株的茎长、茎粗、叶长,取平均值作为指标值实验(二) 植物体内可溶性糖含量的测定(蒽酮法)一、实验目的了解蒽酮法测定可溶性糖含量的原理;掌握分光光度计的使用二、实验原理糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。
不同载培条件,不同成熟度都可以影响水果、蔬菜中糖类的含量。
因此对水果、蔬菜中可溶性糖的测定,可以了解和鉴定水果、蔬菜品质的高低。
蒽酮比色定糖法是一个快速而方便的定糖方法,在强酸性条件下,蒽酮可以与游离的或多糖中存在的己糖、戊糖及己糖醛酸(还原性和非还原性)作用生成蓝绿色的糖醛衍生物,其颜色的深浅与糖的含量在一定范围内成正比。
蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。
当存在含有较多色氨酸的蛋白质时,反应不稳定,呈现红色。
上述特定的糖类物质,反应较稳定。
该法特点:灵敏度高,测定量少,快速方便。
三、材料、仪器及试剂1.材料:植物种子、白菜叶、柑桔2.仪器:分光光度计;恒温水箱; 20ml具塞刻度试管(3支)漏斗;100ml容量瓶;刻度试管;试管架;剪刀;研钵3.试剂(1)200μg/ml标准葡萄糖:AR级葡萄糖100mg,蒸馏水溶解,定容至500ml。
(2)蒽酮试剂:1g蒽酮,用乙酸乙酯溶解,定容至50ml,棕色瓶避光处贮藏;(3)浓硫酸四、实验方法1.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡2.称取1克白菜叶,剪碎,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20ml刻度试管中,用10ml蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。
植物生理学中各项生理指标的测定方法

一.实验内容实验1 MDA(丙二醛)含量测定所需试剂:10%三氯乙酸(TCA)(纯) 0.25%硫代巴妥酸 (纯)实验2:可溶性蛋白含量测定所需试剂:考马斯亮蓝G-250 95%乙醇 85%磷酸实验3:SOD(超氧化物歧化酶)酶活性测定所需试剂:dl-甲硫氨酸(Met) NBT EDTA-Na2 核黄素实验4:CAT(过氧化氢酶)活性(过氧化氢酶)测定所需试剂:PBS(PH=7.0) 30% H2O2实验五:Apx(抗坏血酸过氧化物酶)活性(即ASA—POD活性)测定所需试剂:ASA(分子量167.12) (乙=胺四乙酸=钠)EDTA—Na2 PBS (pH7.0) 30%H2O实验6: ASA(维生素C)含量测定偏磷酸 95%乙醇磷酸 4% 2,2-二联吡啶 FeCl3(或FeCl3·6H2O)实验7:GSH(谷胱甘肽, 媚力肽GSH GSH是由谷氨酸、半胱氨酸和甘氨酸结合而成的三肽化合物)含量测定所需试剂:NaH2PO4·2H2O DTNB(二硫代硝基苯甲酸) PBS (PH6.8)实验8:脯氨酸测定所需试剂:磺基水杨酸甲苯茚三酮冰乙酸 85%磷酸试验9:叶绿素含量测定。
80%丙酮试验9:GR活性测定试验10:过氧化氢含量测定。
三氯乙酸试验11:超氧阴离子含量测定二.酶液和母液提取1. 酶液提取所需试剂:50mmol/L磷酸缓冲液(PH=7.8)(内含1% (m/v) 聚乙烯吡哆烷酮PVP),0.1mmol/L EDTANa2或EDTA),也可为(内含2% (m/v)PVP),0.2mmol/L EDTA Na2或EDTA)(先配制后用缓冲液定容)2. ASA . GSH母液提取所需试剂:5%偏磷酸1.抗氧化酶酶液提取(SOD.POD.CAT):1g(根据样品的量,少的可以适当减少)叶片加入预冷5ml. 50mmol/L磷酸缓冲液(PH=7.8)↓4℃冷冻15000g离心20分钟↓上清液即为酶液(5℃下保存一两天内备用,中短期用-20℃保存)2.ASA . GSH母液提取:0.1g叶片加入3ml预冷5%偏磷酸溶液↓4℃冷冻14000g离心10分钟↓上清液即为母液(5℃下保存备用)(偏磷酸可显著沉淀蛋白质和保护ASA)酶液提取所需试剂:PVP(聚乙烯吡哆烷酮):1%(1g溶于100ml水),1000ml需称取10g,此处用PBSEDTA-Na 2 : 0.1mmol/L (37.2mg EDTA-Na2溶于1000ml蒸馏水),此处用PBSPBS(缓冲液)配制方法:① Na2HPO4·12H2O ② NaH2PO4·2H2O取① 71.64g,蒸馏水定容至1L,取② 31.21g定容至1L,放置4℃冰箱备用PH=7.8 取① 91.5ml+② 8.5ml=100ml (浓度0.2mol/L)需要0.05mol/L→将上述溶液烯释至400ml (0.2mol/L*0.1=0.05mol/L*V)母液提取所需试剂:5%偏磷酸:称5g纯偏磷酸,定容至100 ml蒸馏水(需加热溶解,温度在50-60℃)偏磷酸有剧毒(偏磷酸难溶解,先得用研钵提前研碎,后用磁力搅拌器溶解一到两天后再定容)(现所用为38%HPO3,所以需称65.7895g,定容至500ml)三.实验步骤实验1:MDA含量测定1.1所需试剂:10%三氯乙酸(TCA)(纯)称10g定容至100ml0.25%硫代巴妥酸 (纯) 称0.25g用10%TCA定容至100ml(配制时,可一次完成,先配TCA,不要定容,再加入硫代巴比妥酸,然后定容,若难溶解,可以在磁力搅拌器上微热)1.2步骤:取0.3g叶片,加4ml磷酸缓冲液研磨,加入 4ml 0.25%的硫代巴比妥酸(溶于10%的三氯乙酸)溶液↓摇匀95℃加热15分钟↓快速冷却3000g离心15分钟↓取上清测定 OD532,OD600,OD450值↓按公式求 MDA浓度=6.45×(OD532-OD600)-0.56OD450 (μmol/L)可溶性糖浓度=11.71×OD450 (mmol/L)最后计算 MDA含量(μmol/g FW)= [4×(MDA浓度x)×10-3/0.1]同时,可测得可溶性糖含量(m mol/g FW)= 4×(可溶性糖浓度χ)×10-3/0.1(用多波长测定,在测定之前一定要矫正基线,公式中的参数可以直接在分光光度计上输入)注意:以0.25%的硫代巴妥酸溶液作空白调零MDA含量测定的改进1.可以用做酶活性时提取的酶液来直接测定MDA含量,用量可以定为1.0、1.5或2.0(较好)ml。
可溶性糖、淀粉、蛋白质

植物组织中可溶性糖、淀粉、氨基酸及蛋白质的系列测定一、目的从一份植物样品中系统分离和测定可溶性糖、淀粉、氨基酸及蛋白质等多种成分,不仅对研究植物体内碳、氮代谢,了解植物的生长发育状况有重要意义,亦可以作为鉴定其品质的重要指标,而且也有助于训练基本操作技能。
二、原理(一)分离提取原理在80~85%的乙醇中,植物组织中的还原糖、蔗糖以及游离氨基酸和叶绿素等溶解,而淀粉及蛋白质沉淀,再用9.2mol/L高氯酸溶解淀粉(蛋白质沉淀),最后用0.1mol/L氢氧化钠溶解蛋白质,然后选用适当的方法测定各个提取液中相应物质的含量。
(二)测定原理1.蒽酮比色法——可溶性糖含量测定碳水化合物及其衍生物经浓硫酸处理,生成糠醛,再与蒽酮脱水缩合而生成蓝绿色化合物,在一定范围内其颜色深浅与碳水化合物含量成线性关系。
蒽酮反应的颜色深浅,随温度条件和加热时间而变化,葡萄糖显色高峰在100℃时,加热10min后出现,而核糖在相同温度下,加热3min后出现。
此法灵敏度高,糖含量达30μg即可测定。
2.茚三酮比色法——氨基酸含量测定氨基酸的游离氨基与水合茚三酮作用后,产生二酮茚胺的取代盐等蓝紫色化合物,在570nm下有最大光吸收。
在一定范围内,其颜色深浅与氨基酸的含量呈正比。
3.考马斯亮蓝G-250结合法——蛋白质含量测定考马斯亮蓝在游离状态时呈红色,当与蛋白质结合后变为蓝色,后者最大光吸收在595nm,在一定范围内(0~1000μg/mL),其颜色深浅与蛋白质的含量呈正比。
此法快速灵敏,反应在2min内即达到平衡,室温1h内颜色稳定,而且干扰物也少。
三、实验用品(一)实验材料:植物样品。
(二)器皿:1.25mL刻度试管×8,15mL试管×20;2.10mL离心管×2;3.容量瓶:50mL×1,25mL×1;4.移液管:5mL×2;2mL×4,1mL×2,0.1mL×2;5.恒温水浴锅;6.离心机;7.电子天平;8.分光光度计。
植物含量测定实验报告

一、实验目的1. 掌握植物全氮、全磷、全钾含量的测定方法。
2. 了解植物叶绿素含量的测定原理和方法。
3. 掌握植物可溶性蛋白质和糖含量的测定方法。
二、实验原理1. 植物全氮、全磷、全钾含量的测定:采用H2SO4-H2O2消煮法,将植物样品消煮后,分别测定氮、磷、钾含量。
2. 植物叶绿素含量的测定:根据朗伯-比尔定律,利用分光光度计测定叶绿素在特定波长下的吸光度,从而计算叶绿素含量。
3. 植物可溶性蛋白质和糖含量的测定:采用考马斯亮蓝法和蒽酮法分别测定植物组织中可溶性蛋白质和糖含量。
三、实验材料与试剂1. 植物材料:生菜、苹果等。
2. 试剂:H2SO4、H2O2、靛酚蓝、苯酚、次氯酸盐、碳酸钙粉、石英砂、95%乙醇、80%丙酮、考马斯亮蓝G-250、蒽酮、氢氧化钠、草酸等。
3. 仪器:分光光度计、电子天平、研钵、试管、小漏斗、滤纸、吸水纸、移液管、量筒、剪刀等。
四、实验步骤1. 植物全氮、全磷、全钾含量的测定(1)将植物样品烘干、磨碎,过筛。
(2)准确称取0.2g样品,置于消煮管中。
(3)加入10mL浓H2SO4,小火加热消煮至样品完全消解。
(4)加入5mL H2O2,继续加热消煮至溶液澄清。
(5)冷却后,用蒸馏水定容至50mL。
(6)采用靛酚蓝比色法测定氮含量。
(7)采用钼锑抗比色法测定磷含量。
(8)采用火焰光度法测定钾含量。
2. 植物叶绿素含量的测定(1)准确称取0.1g新鲜植物叶片,加入少量石英砂和碳酸钙粉,用95%乙醇提取。
(2)过滤,收集滤液。
(3)在分光光度计下,分别测定叶绿素在波长652nm、663nm、645nm处的吸光度。
(4)根据吸光度计算叶绿素含量。
3. 植物可溶性蛋白质和糖含量的测定(1)采用考马斯亮蓝G-250法测定可溶性蛋白质含量。
(2)采用蒽酮法测定可溶性糖含量。
五、实验结果与分析1. 植物全氮、全磷、全钾含量根据实验结果,生菜全氮含量为2.5%,全磷含量为0.5%,全钾含量为1.5%;苹果全氮含量为1.2%,全磷含量为0.3%,全钾含量为0.8%。
植物组织中可溶性糖、淀粉、氨基酸及蛋白质的系列测定

实验四植物组织中可溶性糖、淀粉、氨基酸及蛋白质的系列测定一、目的从一份植物样品中系统分离和测定可溶性糖、淀粉、氨基酸及蛋白质等多种成分,不仅对研究植物体内碳、氮代谢,了解植物的生长发育状况有重要意义,亦可以作为鉴定其品质的重要指标,而且也有助于训练基本操作技能。
二、原理(一)分离提取原理在80-85%的乙醇中,植物组织中的还原糖、蔗糖以及游离氨基酸和叶绿素等溶解,而淀粉及蛋白质沉淀,再用9.2 mol/L高氯酸溶解淀粉(蛋白质沉淀),最后用0.1 mol/L氢氧化钠溶解蛋白质,然后选用适当的方法测定各个提取液中相应物质的含量。
(二)测定原理1.蒽酮比色法——可溶性糖含量测定碳水化合物及其衍生物经浓硫酸处理,生成糠醛,再与蒽酮脱水缩合而生成蓝绿色化合物,在一定范围内其颜色深浅与碳水化合物含量成线性关系。
蒽酮反应的颜色深浅,随温度条件和加热时间而变化,葡萄糖显色高峰在100℃时,加热10 min后出现,而核糖在相同温度下,加热3 min后出现。
此法灵敏度高,糖含量达30 μg即可测定。
2.茚三酮比色法——氨基酸含量测定氨基酸的游离氨基与水合茚三酮作用后,产生二酮茚胺的取代盐等蓝紫色化合物,在570 nm下有最大光吸收。
在一定范围内,其颜色深浅与氨基酸的含量呈正比。
3.考马斯亮蓝G-250结合法——蛋白质含量测定考马斯亮蓝在游离状态时呈红色,当与蛋白质结合后变为蓝色,后者最大光吸收在595 nm,在一定范围内(0-1000 μg /mL),其颜色深浅与蛋白质的含量呈正比。
此法快速灵敏,反应在2 min内即达到平衡,室温1h内颜色稳定,而且干扰物也少。
三、实验用品(一)实验材料:植物样品。
(二)器皿:1. 25 mL刻度试管⨯8 ,15 mL试管⨯20;2. 10 mL离心管⨯2;3. 容量瓶:50 mL⨯1 ,25 mL⨯1;4. 移液管:5 mL⨯2,2 mL⨯4,1 mL⨯2,0.1 mL⨯2;5. 恒温水浴锅;6. 离心机;7. 电子天平;8. 分光光度计。
植物可溶性糖含量检测

计算:
设V为植物样品稀释后的体积 C为提取液的含糖量 W为植物样重 可溶性糖%=CV/W×10
刻度试管
实验仪器 : 分光光度计
糖在硫酸作用下生成糠醛,糠醛再与蒽酮作用生成绿色络合物,颜色的深浅与糖含量有关,在650nm波长下OD值与糖含量成正比,由 于蒽酮试剂与糖反应的呈色强度随时间变化,故必须在反应后立即在同一时间内比色。
1 定量实验,且涉及标准曲线绘制,分光光度计的使用,因此溶液配制、材料选取等方面必须精确、仔细一减少误差。
实验步骤 恒温水浴锅
可溶性糖%=CV/W×10 恒温水浴锅
=0.
3 绘制标准曲线:取标准糖溶液将其稀释成一系列0、20、40、60、80毫克每摩尔的不同浓度的溶液,按上述方法分别测其OD值,然
后绘制标准曲线。
时冷却后逐滴加入饱和中性醋酸铅,以 2 显色及比色:吸取上述糖提取液1ml,加入5ml蒽酮试剂混合,沸水浴煮10min,取出冷却,在625nm处测OD值,从标准曲线上取得
提取液中糖的含量。
实验仪器 : 恒温水浴锅 刻度试管
分光光度除计 去蛋白质,直至加液时不再出现白色
X=196 刻度试管
沉淀为止,然后将此混合液连同残渣一
漏斗 C为提取液的含糖量
并倒入100ml容量瓶中,充分振荡定容,
=0.
过滤,于事先放有少量草酸钠粉末的三 X=196
2 实验组、对照组步骤应相同,使结论准确。
角瓶中,所得的透明液体即为可溶性糖 糖在硫酸作用下生成糠醛,糠醛再与蒽酮作用生成绿色络合物,颜色的深浅与糖含量有关,在650nm波长下OD值与糖含量成正比,由
实验七植物组织中可溶性蛋白质

实验七植物组织中可溶性蛋白质、可溶性糖含量的测定I、植物组织中可溶性蛋白质的测定一、原理由于蛋白质中存在着含有共轭双键的酪氨酸和色氨酸,因此蛋白质具有吸收紫外光的性质,最大吸收峰在280nm 波长处。
在此波长范围内,蛋白质溶液的光密度OD280nm 与其浓度呈正比关系,可作定量测定。
二、材料、仪器设备及试剂(一)材料植物叶片(二)仪器设备紫外分光光度计、分析天平、离心机、恒温水浴锅、研钵、移液管等(三)试剂 0.1 mol/L pH7.0 磷酸液三、实验步骤1.样品中蛋白质的提取称取植物叶片0.5~1.0 g放入研钵中,加入2mL 0.1 mol/L的磷酸缓冲液,研磨成匀浆,转移至15mL 离心管中,再用6mL磷酸缓冲液分次洗涤研钵,洗涤液收集于同一离心管中,在室温(20~25℃)下放置05~1.0h,以充分提取,然后在4000 r/min离心10 min,将上清液转入25 mL容量瓶中,并以磷酸缓冲液定容至刻度,即得待测样品提取液。
2.样品中蛋白质含量的测定取适量稀释后的蛋白质提取液,在紫外分光光度计上,分别于280 nm和260 nm波长条件下(以磷酸缓冲液为空白对照),测定提取液的吸收值,代入公式即可计算出样品中蛋白质的含量。
四、结果计算样品中蛋白质的浓度(mg/mL)=(1.45A280—0.74A260)×稀释倍数式中: 1.45 和 0.74 ——校正值。
A 280 ——蛋白质溶液在 280 nm 处的吸光度。
A 260 ——蛋白质溶液在 260 nm 处的吸光度Ⅱ、植物组织中可溶性糖的测定--蒽酮法一、原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。
植物组织中可溶性糖含量的测定

实验15 植物组织中可溶性糖含量的测定一、目的学会植物组织中可溶性糖含量的测定方法,了解不同的植物组织可溶性糖含量的高低。
二、材料用具及仪器药品1.材料:水果或蔬菜2.仪器用具:分光光度计、天平、恒温水浴锅、研钵、三角烧瓶、烧杯、容量瓶、试管、移液管、漏斗3.药品:乙醚、草酸钠、饱和醋酸铅标准葡萄糖母液:在电子天平上称取100mg分析纯无水葡萄糖,溶于蒸馏水中,定容至500ml,则得每ml 含糖量为200ug的标准溶液。
蒽酮试剂:称取1g蒽酮结晶粉末,溶解于1000ml稀硫酸溶液中即得。
[稀硫酸溶液由760ml浓硫酸(比重1.84)稀释成1000ml而成]三、原理植物在个体发育的各个时期代谢活动都发生相应的变化,碳水化合物的代谢也不例外,其含量也随之发生变化,本实验介绍的是蒽酮比色法,糖在硫酸存在下生成糠醛,糠醛再和蒽酮作用形成蓝绿色的缩合物,其颜色的深浅代表着糖含量的高低。
H2SO4糖糠醛脱水糠醛+蒽酮蓝绿色的缩合物四、方法步骤1.标准曲线的制作。
取标准糖溶液将其稀释成一系列不同浓度的溶液各10毫升,浓度分别为每毫升含糖0、25、50、75、100、120、150、200微克。
将试管编号,依次将每管中加入1毫升上述葡萄糖标准溶液及5毫升的蒽酮试剂,震荡使之完全混合,在沸水浴中煮沸10分钟,取出冷却,然后在分光光度计波长620纳米下比色,测定各溶液的光密度,以光密度为纵坐标,糖溶液浓度为横坐标,在坐标纸上绘出标准曲线。
2.测定样品的可溶性糖含量称取重量5g的新鲜植物叶子,于研钵中仔细研磨,研磨时加乙醚少许,直至为止,倒入烧杯中,用热水(70o C)洗涤研钵,洗涤液并入烧杯中,再加入蒸馏水约30~40ml。
将烧杯放在水浴锅上加热,保持温度70~80o C半小时,冷却后一滴一滴地加入饱和中性醋酸铅以除去混合液中的蛋白质,直至不再形成白色沉淀为止,然后将此混合物连同残渣一并洗水100ml容量瓶中,加水至刻度,充分摇荡,用漏斗过滤到三角烧瓶中,瓶中事先放有少量(约0.2——0.4g)的草酸钠粉末,以除去滤液中过量的醋酸铅,使生成草酸铅沉淀,再行过滤,所得透明滤液即为可溶性糖提取液。
植物体内可溶性糖和可溶性蛋白含量测定
植物体内可溶性糖和可溶性蛋白含量的测定摘要:目的通过标准曲线的绘制,测定白菜、芹菜、菠菜中可溶性蛋白和可溶性糖的含量,了解可溶性糖和可溶性蛋白的测定方法。
方法分别用蒽酮法和考马斯亮蓝染色法来测定植物体内可溶性糖和可溶性蛋白的含量。
结论关键词:白菜;芹菜;菠菜;可溶性蛋白含量;可溶性糖含量;蒽酮法;考马斯亮蓝染色法1 引言植物体内的可溶性糖和可溶性蛋白含量是重要的生理生化指标。
在作物的碳素营养中,作为营养物质主要是指可溶性糖和淀粉。
它们在营养中的作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为NH 3 的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。
由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。
可溶性蛋白是植物体内氮素存在的主要形式,其含量的多少与植物的代谢和衰老有密切的关系,同时它与植物体维持渗透压抗脱水也有很大关系。
白菜是十字花科芸薹属叶用蔬菜,味道鲜美可口,营养丰富,素有“菜中之王”的美称,为广大群众所喜爱。
芹菜属伞形科植物,富含蛋白质、碳水化合物、胡萝卜素、B族维生素、钙、磷、铁、钠等,同时,具有有平肝清热,祛风利湿,清肠利便、润肺止咳、降低血压、健脑镇静的功效。
菠菜藜科一年生草本植物,菠菜含有丰富的维他命A、维他命C及矿物质,它对各种贫血症和糖尿病、肺结核、高血压、风火赤眼等诸多疾病可起辅助治疗作用。
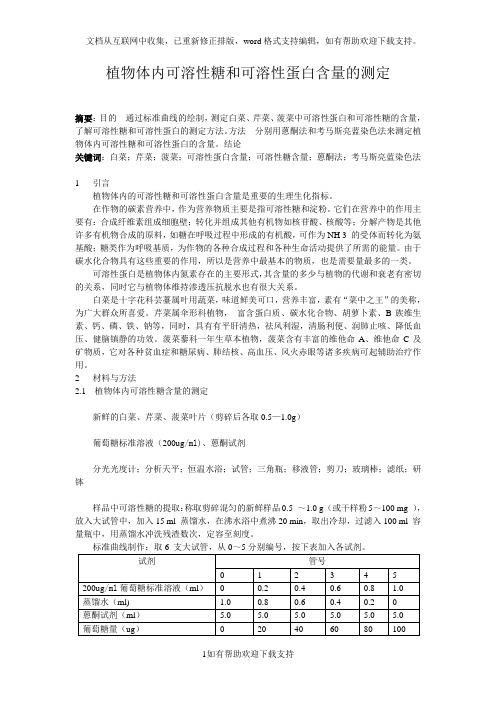
2 材料与方法2.1 植物体内可溶性糖含量的测定新鲜的白菜、芹菜、菠菜叶片(剪碎后各取0.5—1.0g)葡萄糖标准溶液(200ug/ml)、蒽酮试剂分光光度计;分析天平;恒温水浴;试管;三角瓶;移液管;剪刀;玻璃棒;滤纸;研钵样品中可溶性糖的提取:称取剪碎混匀的新鲜样品0.5 ~1.0 g (或干样粉5~100 mg ),放入大试管中,加入15 ml 蒸馏水,在沸水浴中煮沸20 min,取出冷却,过滤入100 ml 容量瓶中,用蒸馏水冲洗残渣数次,定容至刻度。
实验七 植物组织中可溶性蛋白质

实验七植物组织中可溶性蛋白质、可溶性糖含量的测定I、植物组织中可溶性蛋白质的测定一、原理由于蛋白质中存在着含有共轭双键的酪氨酸和色氨酸,因此蛋白质具有吸收紫外光的性质,最大吸收峰在280nm 波长处。
在此波长范围内,蛋白质溶液的光密度OD280nm 与其浓度呈正比关系,可作定量测定。
二、材料、仪器设备及试剂(一)材料植物叶片(二)仪器设备紫外分光光度计、分析天平、离心机、恒温水浴锅、研钵、移液管等(三)试剂0.1 mol/L pH7.0 磷酸液三、实验步骤1.样品中蛋白质的提取称取植物叶片0.5~1.0 g放入研钵中,加入2mL 0.1 mol/L的磷酸缓冲液,研磨成匀浆,转移至15mL 离心管中,再用6mL磷酸缓冲液分次洗涤研钵,洗涤液收集于同一离心管中,在室温(20~25℃)下放置05~1.0h,以充分提取,然后在4000 r/min离心10 min,将上清液转入25 mL容量瓶中,并以磷酸缓冲液定容至刻度,即得待测样品提取液。
2.样品中蛋白质含量的测定取适量稀释后的蛋白质提取液,在紫外分光光度计上,分别于280 nm和260 nm波长条件下(以磷酸缓冲液为空白对照),测定提取液的吸收值,代入公式即可计算出样品中蛋白质的含量。
四、结果计算样品中蛋白质的浓度(mg/mL)=(1.45A280—0.74A260)×稀释倍数式中:1.45 和0.74 ——校正值。
A 280 ——蛋白质溶液在280 nm 处的吸光度。
A 260 ——蛋白质溶液在260 nm 处的吸光度Ⅱ、植物组织中可溶性糖的测定--蒽酮法一、原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。
植物组织中可溶性糖含量的测定
植物组织中可溶性糖含量的测定XXX,YYY,ZZZ(版权所有,仅限个人)一.实验目的1、学习植物组织中可溶性糖的测定方法。
2、了解可溶性糖在植物物质代谢中的作用。
二、实验原理:(一)提取:利用可溶性糖溶于水的特性,将植物磨碎,用热水将组织中的可溶性糖提取出来,用铅离子沉淀提取液中的蛋白质,用草酸钠除去多余的铅离子,过滤后即可获得植物的可溶性糖提取液。
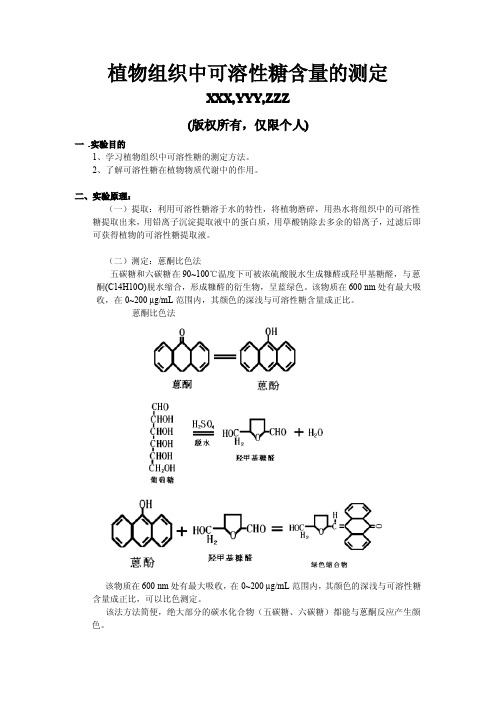
(二)测定:蒽酮比色法五碳糖和六碳糖在90~100℃温度下可被浓硫酸脱水生成糠醛或羟甲基糖醛,与蒽酮(C14H10O)脱水缩合,形成糠醛的衍生物,呈蓝绿色。
该物质在600nm处有最大吸收,在0~200µg/mL范围内,其颜色的深浅与可溶性糖含量成正比。
蒽酮比色法该物质在600nm处有最大吸收,在0~200µg/mL范围内,其颜色的深浅与可溶性糖含量成正比,可以比色测定。
该法方法简便,绝大部分的碳水化合物(五碳糖、六碳糖)都能与蒽酮反应产生颜色。
三、实验材料:大白菜Brassica campestris ssp.pekinensis四.实验步骤:1.标准曲线的绘制配制浓度分别为0,50,100,150,200µg/ml的糖标准溶液各10ml。
显色:取糖标准液lml于一干洁的试管中,加蒽酮试剂5ml混合,于沸水浴中煮沸10分钟。
比色:测定A600nm的吸光度值。
浓度:ug/mL050100150200吸光度:a00.1950.3550.5150.689绘制标准曲线:.可溶性糖的提取:称取0.250g待测植物叶片,放入研钵中,加少许乙醚研磨成均浆,用70℃的热水洗涤研钵,植物材料和洗涤后的溶液全量转移到100ml烧杯中,使总体积在30~ 40ml,将烧杯放在水浴锅中70~80℃半小时,冷却后滴加饱和中性醋酸铅以除去溶液中的蛋白质,连同残渣一起全量转移到100ml容量瓶中,定容,充分摇匀,用干燥漏斗过滤于一干燥的三角瓶中,瓶中事先放入少量(约0.2-0.4g)的草酸钠粉末,除去滤液中过量的铅,使生成草酸铅沉淀再行过滤,所得透明滤液即为可溶性糖提取液。
实验8植物组织中可溶性糖含量测定(蒽酮比色法)

实验方案一、实验目的通过实验,掌握测定萝卜品质的方法(一)萝卜外部形态的测定1、实验材料取鲜样3个∕小区直尺、蒸馏水、笔、记录本、吸水纸2、实验方法.用自来水将各组萝卜洗净后,再用蒸馏水洗涤,擦干表面水分.每个小区取3个重复,用电子天平称量每株的鲜重,用直尺测量植株的茎长、茎粗、叶长,取平均值作为指标值实验(二) 植物体内可溶性糖含量的测定(蒽酮法)一、实验目的了解蒽酮法测定可溶性糖含量的原理;掌握分光光度计的使用二、实验原理糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。
不同载培条件,不同成熟度都可以影响水果、蔬菜中糖类的含量。
因此对水果、蔬菜中可溶性糖的测定,可以了解和鉴定水果、蔬菜品质的高低。
蒽酮比色定糖法是一个快速而方便的定糖方法,在强酸性条件下,蒽酮可以与游离的或多糖中存在的己糖、戊糖及己糖醛酸(还原性和非还原性)作用生成蓝绿色的糖醛衍生物,其颜色的深浅与糖的含量在一定范围内成正比。
蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。
当存在含有较多色氨酸的蛋白质时,反应不稳定,呈现红色。
上述特定的糖类物质,反应较稳定。
该法特点:灵敏度高,测定量少,快速方便。
三、材料、仪器及试剂1.材料:植物种子、白菜叶、柑桔2.仪器:分光光度计;恒温水箱; 20ml具塞刻度试管(3支)漏斗;100ml容量瓶;刻度试管;试管架;剪刀;研钵3.试剂(1)200μg/ml标准葡萄糖:AR级葡萄糖100mg,蒸馏水溶解,定容至500ml。
(2)蒽酮试剂:1g蒽酮,用乙酸乙酯溶解,定容至50ml,棕色瓶避光处贮藏;(3)浓硫酸四、实验方法1.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡2.称取1克白菜叶,剪碎,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20ml刻度试管中,用10ml蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。
各生理指标测定方法要点

各生理指标的测定方法一、脯氨酸含量的测定1.茚三酮法1.1原理在正常环境条件下,植物体内游离脯氨酸含量较低,但在逆境(干旱、低温、高温、盐渍等)及植物衰老时,植物体内游离脯氨酸含量可增加10-100倍,并且游离脯氨酸积累量与逆境程度、植物的抗逆性有关。
用磺基水杨酸提取植物样品时,脯氨酸游离于磺基水杨酸的溶液中,然后用酸性茚三酮加热处理后,溶液即成红色,再用甲苯处理,则色素全部转移至甲苯中,色素的深浅即表示脯氨酸含量的高低。
在520nm波长下比色,从标准曲线上查出(或用回归方程计算)脯氨酸的含量。
1.2步骤试剂:(1)25%茚三酮:茚三酮------------0.625g冰乙酸------------15ml6mol/L磷酸--------10ml70°C水浴助溶;(2)6mol/L磷酸:85%磷酸稀释至原体积的2.3倍;(3)3%磺基水杨酸:磺基水杨酸------3g加蒸馏水至------100ml实验步骤:(1)称取0.1g样品放入研钵,加5ml 3%磺基水杨酸研磨成匀浆,100°C沸水浴15min;(2)冰上冷却,4000rpm离心10min;(3)提取液2ml+冰醋酸2ml+25%茚三酮2ml混合均匀,100°C沸水浴30min,冰上冷却;(4)加4ml甲苯混合均匀,震荡30s,静置30min;(5)以甲苯为空白对照,再520nm下测定吸光值。
1.3计算方法脯氨酸含量(μg/gFW)= X * 提取液总量(ml)/样品鲜重(g)*测定时提取液用量(ml)*10^6公式中:X-----从标准曲线中查得的脯氨酸含量(μg)提取液总量---------------------------5ml测定时提取液用量---------------------2ml问题及质疑:1.酸性体系下,脯氨酸与茚三酮加热反应后的最终产物为红色,再实验过程中,仅有少数时候能发现红色产物。
植物组织中可溶性糖含量测定

实验报告课程:植物生理学实验题目:植物组织中可溶性糖含量的测定一.【实验原理】植物的代谢活动随着植物的发育过程而不断发生着变化,碳水化合物的代谢也不例外,其含量也随之发生变化,在种子萌发过程中,在光合作用受到影响时和受到外界环境的胁迫等情况下植物可溶性糖含量都会发生变化。
了解植物可溶性糖含量的变化,在生理上与实践上都有重要意义。
蒽酮比色法是常用的测定可溶性五碳糖和六碳糖的方法,糖在硫酸的作用下脱水生成糠醛,糠醛再与蒽酮作用形成一种绿色的络合物,在一定的浓度范围内颜色的深浅与糖含量成正比,可以用比色法测定。
该法简便,但没有专一性,绝大部分的碳水化合物都能与蒽酮反应产生颜色。
二.【实验步骤】1、标准曲线的绘制2、可溶性糖的提取3、提取液的显色及比色三.【实验结果】实验中测得的数据如下所示:若以1号管调零,处理后数据如下:作出标准曲线如下:将y=0.261,0.269,0.247分别代入上述函数公式,得到:x=45.000,46.379,42.586;即三样品溶液中糖浓度分别为:45.000μg/mL,46.379μg/mL,42.586μg/mL。
样品中可溶性糖含量(m g·g-1)= A × c/(W × 103)式中,A——植物样品稀释后的体积(mL);C——提取液的含糖量(μg/mL);W——植物组织鲜重(g)。
四.【讨论】1、误差分析实验中的误差来源主要有:(1)植物材料称取的误差;(2)植物样品在转移过程中的损失;(3)最后过滤得到的提取液中尚有未除尽的醋酸铅;(4)移液管未润洗等等。
2、注意事项(1)样品提取液的显色应与标准曲线的绘制同步;(2)比色时以蒸馏水调零;(3)醋酸铅一定要除尽;(4)在样品转移过程中,尽量减少材料的损失;(5)进行第二次过滤时要更换滤纸,并将漏斗洗净。
3、植物组织中糖的测定方法还有很多种,举例说明它们的原理和优缺点。
(1)苯酚-硫酸法原理:糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10~100mg范围内其颜色深浅与糖的含量成正比,且在485nm 波长下有最大吸收峰,故可用比色法在此波长下测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物体内可溶性糖和可溶性蛋白含量的测定
摘要:目的通过标准曲线的绘制,测定白菜、芹菜、菠菜中可溶性蛋白和可溶性糖的含量,了解可溶性糖和可溶性蛋白的测定方法。
方法分别用蒽酮法和考马斯亮蓝染色法来测定植物体内可溶性糖和可溶性蛋白的含量。
结论
关键词:白菜;芹菜;菠菜;可溶性蛋白含量;可溶性糖含量;蒽酮法;考马斯亮蓝染色法
1 引言
植物体内的可溶性糖和可溶性蛋白含量是重要的生理生化指标。
在作物的碳素营养中,作为营养物质主要是指可溶性糖和淀粉。
它们在营养中的作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为NH 3 的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。
由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。
可溶性蛋白是植物体内氮素存在的主要形式,其含量的多少与植物的代谢和衰老有密切的关系,同时它与植物体维持渗透压抗脱水也有很大关系。
白菜是十字花科芸薹属叶用蔬菜,味道鲜美可口,营养丰富,素有“菜中之王”的美称,为广大群众所喜爱。
芹菜属伞形科植物,富含蛋白质、碳水化合物、胡萝卜素、B族维生素、钙、磷、铁、钠等,同时,具有有平肝清热,祛风利湿,清肠利便、润肺止咳、降低血压、健脑镇静的功效。
菠菜藜科一年生草本植物,菠菜含有丰富的维他命A、维他命C及矿物质,它对各种贫血症和糖尿病、肺结核、高血压、风火赤眼等诸多疾病可起辅助治疗作用。
2 材料与方法
2.1 植物体内可溶性糖含量的测定
2.1.1材料
新鲜的白菜、芹菜、菠菜叶片(剪碎后各取0.5—1.0g)
2.1.2试剂
葡萄糖标准溶液(200ug/ml)、蒽酮试剂
2.1.3仪器设备
分光光度计;分析天平;恒温水浴;试管;三角瓶;移液管;剪刀;玻璃棒;滤纸;研钵
2.1.4测定方法
样品中可溶性糖的提取:称取剪碎混匀的新鲜样品0.5 ~1.0 g (或干样粉5~100 mg ),放入大试管中,加入15 ml 蒸馏水,在沸水浴中煮沸20 min,取出冷却,过滤入100 ml 容量瓶中,用蒸馏水冲洗残渣数次,定容至刻度。
将各管快速摇动混匀后,在沸水浴中煮10 min,取出冷却,在620nm波长制标准曲线。
样品测定:取待测样品提取液1.0ml加蒽酮试剂5ml ,同以上操作显色测定光密度。
重复3次。
结果计算:
可溶性糖含量(%)=从标准曲线查得糖的量(μg)×提取液体积(ml)×稀释倍数/【测定用样品液的体积(ml)×样品重量(g)×106】×100
2.2 植物体内可溶性蛋白含量的测定
2.2.1材料
新鲜的白菜、芹菜、菠菜叶片(剪碎后各取0.5—1.0g)
2.2.2试剂
标准蛋白质溶液:用牛血清白蛋白配成含蛋白质100μg/的标准蛋白溶液;
90%乙醇;85%磷酸(W/V);考马斯亮蓝G-250溶液
2.2.3仪器设备
分光光度计;量筒;研钵;烧杯;量瓶;移液管;具塞刻度试管;分析天平;恒温水浴;
2.2.4测定方法
0~100μg/ml标准曲线的制作:取六支试管,分别按下表数据配制0~100μg/ml血清白蛋白液1ml。
准确吸取所配各管溶液0.1ml,分别放入10ml具塞试管中,加入5ml考马斯
样品提取液中蛋白质浓度的测定:吸取样品提取液1.0ml,放入具塞试管中(每个样品设置两个重复),加入5Ml考马斯亮蓝G-250溶液,充分混合,放置2min后在595nm下比色,记录吸光值,并通过标准曲线查得蛋白质含量。
结果计算:样品蛋白质含量(mg/g鲜重)=(C*V/a)/W
式中C-查标准曲线所得每管蛋白质含量(mg);
V-提取液总体积(ml);
a-测定所取提取液体积(ml);
W-取样量(g)。
3 结果分析
3.1 植物体内可溶性糖含量的测定
3.1.1可溶性糖标准曲线
3.1.2芹菜、白菜、菠菜中可溶性糖的吸光值
吸光值样品名称
芹菜白菜菠菜A1 0.358 0.347 0.333
A2 0.361 0.352 0.327
A3 0.367 0.351 0.327
平均值0.362 0.350 0.329
对照标准曲线,可以得出:在1g蔬菜样品中移取的1ml样品溶液中,芹菜样品溶液含糖量为80.930μg;白菜样品溶液的含糖量为78.139μg;菠菜样品溶液的含糖量为73.256μg。
3.1.3可溶性糖含量计算
样品含糖量=样品含量(ug)*稀释倍数*100/{样品重(g)*106}g/100g鲜重
样品质量/g 吸光值查表所得含
糖量/μg 稀释倍数可溶性糖含量
/μg
芹菜 1.00 0.362 80.830 100 0.8083 白菜 1.00 0.350 78.139 100 0.7813 菠菜 1.00 0.329 73.256 100 0.7325 由表可知:芹菜中可溶性糖含量最高,白菜中含量居中,菠菜中可溶性糖含量最低。
3.2 植物体内可溶性蛋白含量测定
3.2.1 可溶性蛋白标准曲线
表1 各试管中标准蛋白质的吸光值
管号0 1 2 3 4 5
蛋白质含量
(ug)
0 20 40 60 80 100
吸光度0 0.286 0.578 0.852 0.921 1.250
吸光值 样品名称 芹菜 白菜 菠菜 A1 0.095 0.122 0.085 A2 0.102 0.125 0.081 A3 0.097 0.128 0.080 平均值
0.098
0.125
0.082
照标准曲线,可以得出:在1g 蔬菜样品中移取的1ml 样品溶液中,芹菜样品溶液含蛋白量为4.619μg ;白菜样品溶液的含蛋白量为6.761μg ;菠菜样品溶液的含蛋白量为3.349μg 。
3.2.3可溶性蛋白计算
C ——查标准曲线值, ug V T ——提取液总体积, ml Vs ——测样时加样量,ml 样品 蛋白质含量C(ug) 提取液总体积
V T (ml ) 测样时加样量
Vs (ml ) 样品鲜重 W F (g ) 样品中蛋白质含量(mg/g ) 芹菜 4.619 5.0 1.0 1.0 0.023 白菜 6.761 5.0 1.0 1.0 0.034 菠菜
3.349
50.
1.0
1.0
0.016
由表可知:白菜中可溶性糖含量最高,芹菜中含量居中,菠菜中可溶性糖含量最低。
4 讨论
通过实验对芹菜、白菜和菠菜体内的可溶性糖和可溶性蛋白的含量进行了测定,了解植物体内可溶性糖和可溶性蛋白的含量有利于我们更清楚地了解各种植物,同时通过实验也让我们更加清楚地了解了植物体内可溶性糖和可溶性蛋白在植物生长中的作用。
可溶性糖是植物植物生长发育和基因表达的重要调节因子,它不仅是能量来源和结构
)
/ ( 1000 * * * g mg W V V
C F
S T
样品中蛋白质含量
物质,而且在信号传导中具有类似激素的初级信使作用。
它的主要作用有以下几点:参与植物体内渗透压调节,在干旱环境中植物为了减缓由胁迫造成的生理代谢不平衡,细胞大量积累一些小分子有机化合物,可溶性糖就是这些小分子有机化合物之一,它通过渗透调节来降低水势,维持较高渗透压,保证细胞的正常生理功能;糖类能够以类似植物激素的方式作为一种信号分子存在,在植物的生长、发育、成熟核素哀牢等许多过程中发挥调控作用在种子萌发和种苗发育早期糖类可以调控植物的花转变,并且对植物花转变的调控具有多重效应,糖信号还可以调控叶片的衰老等;糖与植物氮调节之间存在代谢关系,而且不同的糖信号和氮信号转导途径可以在不同水平上相互响应等
植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,可溶性蛋白质含量是一个重要的生理生化指标,测其含量是了解植物体总代谢的一个重要指标;在研究每一种酶的作用时,常以比活(酶活力单位/mg蛋白)表示酶活力大小及酶制剂纯度,这就需要测定蛋白质含量。
因此,测定植物体内可溶性蛋白质是研究酶活的一个重要项目。
参考文献
[1] 基础生物化学实验(第二版)北京高等教育出版社
[2] 何照范.张迪青保健食品化学及其检测技术 1998
[3] 刘魁英食品研究与数据分析 1998
[4] 李娟.耀庭.曾伟.罗璇.廖长春应用考马斯亮蓝法测定总蛋白含量2000年第13卷第2期
[5] 文赤夫.董爱文.李国章.雷姝.雷勇蒽酮比色法测定紫花地丁中总糖及还原糖含量 [期刊论
文] -现代食品科技2005(3)
[6] 赵江涛.李晓峰.李航.徐睿忞可溶性糖早高等植物带些调节中的生理作用2006
学生设计性实验论文
题目:植物体内可溶性糖和可溶性蛋白含量
的测定
姓名魏会会学号2012132119
专业生物技术班级123班
相关实验课程名称基础生物化学实验
指导老师单树花
实验学期2013~2014学年第二学期。
