滴定液标定记录
用于乙二醇法的滴定度的标定记录表

在化学实验中,乙二醇法是一种常用的滴定方法,用于测定液体中乙二醇的浓度。
而在进行乙二醇法滴定实验时,标定记录表则是非常重要的一部分,它记录了实验中各项数据和结果,对于实验的准确性和可重复性起着至关重要的作用。
下面,我将以此为主题,按照深度和广度的要求,撰写一篇有价值的文章,以便能更全面、深入地理解乙二醇法滴定度的标定记录表。
一、标定记录表的作用和重要性1.1 标定记录表的定义在乙二醇法滴定实验中,标定记录表记录了滴定时实验者所使用的试剂、实验条件、滴定过程中所消耗的物质量和滴定结果等详细信息。
它是实验数据的集中和整理,能够清晰、准确地反映出滴定实验的全过程和结果。
1.2 标定记录表的作用标定记录表不仅是对实验数据和结果的记录,更重要的是能够为实验的准确性和结果的可靠性提供有力的支持。
通过对标定记录表的详细记录和分析,可以发现实验中的误操作或误差,从而进行数据校正和结果修正,保证实验结果的准确和可靠。
1.3 标定记录表的重要性标定记录表的准确性和完整性对于实验结果的可信度和科学价值具有决定性的作用。
它是实验结果的可追溯性和可重复性的重要保障,也是科学研究的基础和前提。
二、标定记录表的内容和要求2.1 实验条件和环境记录在标定记录表中,应该详细记录实验进行时的环境温度、湿度和气压等实验条件,以及实验者的尊称、日期、实验设备和试剂信息等。
2.2 试剂使用和消耗记录标定记录表中应当清楚地记录所使用的试剂种类、规格和质量,以及试剂的消耗量和余量等信息,做到消耗量的准确记录和试剂的合理使用。
2.3 滴定过程和结果记录在滴定过程中,应当详细记录每次加入滴定试剂的体积和滴定终点的观察结果,以及最终的滴定结果和计算出的乙二醇浓度值等数据,确保实验结果的准确性和可信度。
2.4 对误差和校正的记录在标定记录表中,还应当对实验中可能出现的误差和校正措施进行详细的记录,如实验中的系统误差、仪器误差和人为误差等,以及实验中采取的修正和校正措施,确保实验结果的可靠性和科学性。
0.1M盐酸滴定液标定记录

0.1M盐酸滴定液标定记录
标定: 270~300℃干燥至恒重的称量瓶与无水碳酸钠重:
g/ g;
精密称取: ⑴⑵⑶
-) -) -)
加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色转变为暗紫色。
每1ml的盐酸滴定液(0.1mol/L)相当于5.30mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
消耗盐酸滴定液(0.1mol/L)的毫升数:
⑴ml; ⑵ml; ⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。
标定结果。
标定人:。
滴定液配制与标定记录(全新经典模版)

第一次称量
第二次称量
Hale Waihona Puke 结论备注规定:连续两次干燥后称重的差异在0.3mg以下
5.标定方法
第 1 页
6标定记录
6.1 标定记录(相对平均偏差≤0.1%;)
基准物质量(g)
VNaOH(ml)
计算公式
结果(mol/l)
相对平均偏差
6.2 复标记录
基准物质量(g)
VNaOH(ml)
计算公式
结果(mol/l)
相对平均偏差
6.3 相对误差计算标定平均值与复标平均值相对偏差(应为≤0.1%):
7.最终结果
结论
该滴定液溶液的浓度为,F值为
标定人: 复标人:
滴定液配制与标定记录(一)
环境条件:温度:℃ 相对湿度:% 记录编号:NSJC/JL-JS-011
溶液名称
配制数量
配制日期
标定日期
复标日期
有效期
配制依据
1.仪器信息:
仪器名称
型号
厂家
仪器编号
2.滴定管信息:
编号
校准值
校准日期
3.试剂信息:
试剂名称
规格
批号
厂家
4. 基准物质恒重记录:
恒重温度
恒重起止时间
乙二胺四醋酸二钠滴定液 (0.05mol/L)配制、标定及复标记录

滴定液配制、标定及复标记录R-QC-907-00滴定液名称:乙二胺四醋酸二钠滴定液(0.05mol/L)浓度校正因子F:配制日期:年月日有效期:基准试剂名称:氧化锌含量:生产厂家:批号:指示剂名称:铬黑T指示剂配制方法:取乙二胺四醋酸二钠19g,加水适量使溶解成1000ml,摇匀。
标定:取于约800℃干燥至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定结果用空白试验校正,每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg 的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度。
即得。
贮藏:置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
配制人:配制量:ml 计算公式:069.4)(m21⨯-=VVF式中:m为基准氧化锌的称取量(mg);V1为滴定中本滴定液的用量(ml);V2为空白试验中本滴定液的用量(ml);4.069为与每1ml的乙二胺四醋酸二钠滴定液(0.05mol/L)相当以毫克表示的氧化锌的质量。
上式中如将F改以浓度C (mol/L)计,则式中的“4.069”应该为“81.38”。
标定方法依据:《中国兽药典》2010年版一部附录滴定液标定记录基准试剂恒重温度: ℃恒重时间: h 室温: ℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:4.068 mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=滴定液复标记录基准试剂恒重温度:℃恒重时间:h 室温:℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:4.068mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=两人相对偏差:D= 两人平均值:C= mol/L浓度校正因子F=标定人:复核人:标定日期:年月日复标人:复核人:复标日期:年月日。
高锰酸钾滴定液的标定

教案课题:高锰酸钾滴定液的标定教学目标:1、学会高锰酸钾滴定液的标定方法;2、学会滴定过程中实验条件的控制方法和选用适当的方法加快反应速度;3、通过讲授、演示等手段培养学生科学、严谨的学习态度;4、通过学生动手提升学生独立思考、解决问题的能力;5、通过分组实验,培养学生团队协作能力;6、通过知识拓展培养学生的环保意识。
教学重点:1、高锰酸钾与还原性物质反应的实验条件控制2、滴定分析实验技能的培养教学难点:滴定管、移液管的正确操作及滴定终点的确定教学方法与手段:通过不同实验条件下的不同实验现象的对照,采用学生动手与示范实验相结合的方法,使学生增强感性认识,掌握高锰酸钾滴定的实验条件,并自行设计实验方案,完成整个标定过程。
教学实验设备:酸式滴定管、锥形瓶、25ml移液管、电炉授课人:上海市环境学校蒋克勤授课班级:0511班授课时间:2008年5月28日下午第5、6节教学过程:[复习]上一节课我们学习了氧化还原滴定法的特点及分类,下面提几个问题,请同学回答。
1、氧化还原滴定法必须符合哪些条件?答:反应能够进行完全;反应必需按一定的化学计量关系进行;反应速度要快,不能有副反应发生;反应必须有适当的方法确定化学计量点2、如何加快化学反应的速度?答:增加反应物浓度和提高酸度;升高溶液温度;加催化剂3、常用的氧化还原滴定法有哪几种?答:高锰酸钾法、碘量法、亚硝酸钠法等。
[导入新课]:今天我们来学习其中的高锰酸钾法。
高锰酸钾法是氧化还原滴定中非常重要的一种滴定分析方法,可以用来测定氧化性或还原性物质的含量,在水质监测的指标中高锰酸盐指数就是利用高锰酸钾法的基本原理进行测定的,高锰酸盐指数是水质监测中的一个重要指标,可以反映水体受有机物污染的程度。
接下来我们学习如何进行高锰酸钾滴定液的标定。
[新授内容]高锰酸钾滴定液的标定一、高锰酸钾法基本原理高锰酸钾法是在强酸性溶液中以高锰酸钾为滴定液直接或间接的测定还原或氧化性物质含量的滴定方法。
高锰酸钾滴定液标定

⑴ml;⑵ml;⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。标定结果。
标定人:
高锰酸钾滴定液标定
名 称
高锰酸钾滴定液
配制浓度
0.02mol/L
标定温度
℃
标定浓度
mol/L
相对湿度
%
配 制 日期
年 月 日
依 据
《中国药典》2000年版二部
标定:105℃干燥至恒重的称量瓶与基准草酸钠重: g/ g;
精密称取:⑴⑵⑶
-)-)-)
加新沸过的冷水25ml与硫酸10ml,搅拌使溶解,自滴定管中迅速加入本液约25ml,待退色后,加热至65℃,继续滴定至溶液显微红色并保持30秒钟不退;当滴定终了时,溶液温度应不低于55℃,每1ml的高锰酸钾滴定液(0.02mol/L)相当于6.70mg的草酸钠。
标准滴定溶液标定原始记录表
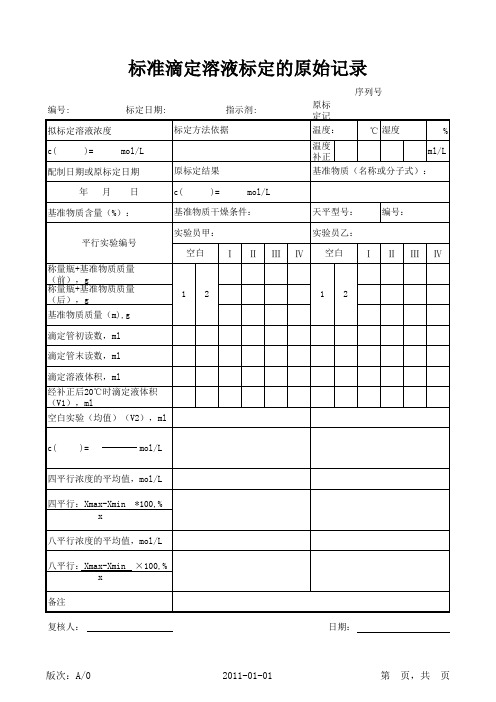
四平行浓度的平均值,mol/L 四平行:Xmax-Xmin x *100,%
八平行浓度的平均值,mol/L 八平行:Xmax-Xmin x 备注 复核人: 日期: ×100,%
版次:A/0
2011-01-01
第
页,共
页
版次:A/0
2011-01-01
第
页,共
页
版次:A/0
2011-01-01原始记录
序列号 编号: 拟标定溶液浓度 c( )= mol/L 原标定结果 c( )= mol/L 天平型号: 实验员乙: Ⅰ Ⅱ Ⅲ Ⅳ 空白 Ⅰ Ⅱ Ⅲ Ⅳ 编号: 标定日期: 指示剂: 标定方法依据 原标定记录编号: 温度: 温度补正值: ℃ 湿度 % ml/L
配制日期或原标定日期 年 月 日
页
版次:A/0
2011-01-01
第
页,共
页
基准物质(名称或分子式):
基准物质含量(%): 平行实验编号
基准物质干燥条件: 实验员甲: 空白
称量瓶+基准物质质量(前),g 称量瓶+基准物质质量(后),g 1 基准物质质量(m),g 滴定管初读数,ml 滴定管末读数,ml 滴定溶液体积,ml 经补正后20℃时滴定液体积 (V1),ml 空白实验(均值)(V2),ml c( )= mol/L 2 1 2
硝酸银滴定液配制、标定记录

第二次称量
称量瓶
g
g
称量瓶+样
g
g
用减重法分取四分:ag;bg;cg;dg.各加水ml使溶解,再加糊精溶液(1→50)ml,碳酸钙g与荧光黄指示液滴,用本液滴定至浑浊液由色变为色。消耗本液体积分别为aml;bml;cml;dml.〔每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg的氯化钠〕
Ca=---------------------------------------=mol/L
Cb=---------------------------------------=mol/L
Cc=---------------------------------------=mol/L
Cd=---------------------------------------=mol/L
=---------------------------------------=mol/L
相对平均偏差(%)=-------------------------------×100%= %
F=-----------=
相对偏差%
标定浓度
配制人:
标定人:
复核人:
标准液(滴定液)配制、标定记录
配液名称
硝酸银滴定液
浓度
mol/L
配制日期
年月日
标定日期
年月日
配制总量
ml
使用截止日期
年月日
所用试剂
碳酸钙、荧光黄指示液等
基准试剂
基准氯化钠
【配制】称取硝酸银g,置烧杯中,加水适量使溶解,移至1ห้องสมุดไป่ตู้00ml容量瓶中,加水至刻度,摇匀,即得。
硫酸亚铁铵滴定液标定记录单

名称
硫酸亚铁铵滴定液
配制浓度
0.1mol/L
标定温度
℃
标定浓度
mol/L
相对湿度
%
配制量
ml
配制日期
年月日标定人标定来自期年月日依据《中国药典》2010年版二部
标定:
精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。根据硫酸铈滴定液(0.01mol/L)的消耗量,算出本液的浓度。即得。
消耗硫酸铈滴定液(0.1mol/l)的毫升数:
⑴ml;⑵ml;⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。标定结果。
标定人:
48滴定液配制、标定记录
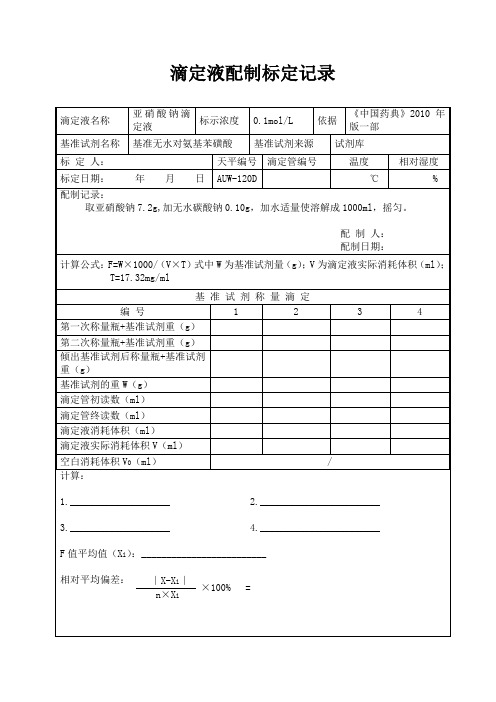
滴定液名称亚硝酸钠滴定液标示浓度0.1mol/L 依据《中国药典》2010年版一部基准试剂名称基准无水对氨基苯磺酸基准试剂来源试剂库标定人:天平编号滴定管编号温度相对湿度标定日期:年月日AUW-120D ℃%配制记录:取亚硝酸钠7.2g,加无水碳酸钠0.10g,加水适量使溶解成1000ml,摇匀。
配制人:配制日期:计算公式:F=W×1000/(V×T)式中W为基准试剂量(g);V为滴定液实际消耗体积(ml); T=17.32mg/ml基准试剂称量滴定编号 1 2 3 4第一次称量瓶+基准试剂重(g)第二次称量瓶+基准试剂重(g)倾出基准试剂后称量瓶+基准试剂重(g)基准试剂的重W(g)滴定管初读数(ml)滴定管终读数(ml)滴定液消耗体积(ml)滴定液实际消耗体积V(ml)空白消耗体积V0(ml)/计算:1.____________________2.________________________3.____________________4.________________________F值平均值(X i):_________________________∣X-X i∣×100% =n×X i相对平均偏差:滴定液名称高氯酸滴定液标示浓度 0.1mol/L 依据《中国兽药典》2010年版一部基准试剂名称基准邻苯二甲酸氢钾基准试剂来源试剂库标定人:天平编号滴定管编号温度相对湿度标定日期:年月日AUW-120D ℃%配制记录:取无水冰醋酸(按含水量计算,每1g水加醋酐5.22ml)750ml,加入高氯酸(70%~72%)8.5ml,在室温下缓缓滴加醋酐23ml,边加边摇,加完后再振摇均匀,放冷,加无水冰醋酸适量使成1000ml,摇匀,放置24小时。
配制人:配制日期:计算公式:F=W×1000/(V×T)式中W为基准试剂量(g);V为滴定液实际消耗体积(ml); T=20.42mg/ml基准试剂称量滴定编号 1 2 3 4第一次称量瓶+基准试剂重(g)第二次称量瓶+基准试剂重(g)倾出基准试剂后称量瓶+基准试剂重(g)基准试剂的重W(g)滴定管初读数(ml)滴定管终读数(ml)滴定液消耗体积(ml)滴定液实际消耗体积V(ml)空白消耗体积V0(ml)计算:1.____________________2.________________________3.____________________4.________________________F值平均值(X i):_________________________∣X-X i∣×100% =n×X i相对平均偏差:滴定液名称碘滴定液标示浓度 0.05mol/L 依据《中国兽药典》2010年版一部基准试剂名称基准试剂来源标定人:天平编号滴定管编号温度相对湿度标定日期:年月日AUW-120D ℃% 配制记录:配制人:配制日期:计算公式:基准试剂称量滴定编号 1 2 3 4基准试剂取样量V2(ml)滴定管初读数(ml)滴定管终读数(ml)滴定液消耗体积(ml)滴定液实际消耗体积V(ml)空白消耗体积V0(ml)/计算:1.____________________2.________________________3.____________________4.________________________F值平均值(X i):_________________________∣X-X i∣×100% =n×X i相对平均偏差:滴定液名称高锰酸钾滴定液标示浓度 0.02mol/L 依据《中国兽药典》2010年版一部基准试剂名称基准草酸钠基准试剂来源试剂库标定人:天平编号滴定管编号温度相对湿度标定日期:年月日AUW-120D ℃%配制记录:取高锰酸钾3.2g,加水1000ml,煮沸15分钟,密塞,静置2日以上,用垂熔玻璃漏斗滤过。
盐酸滴定液(0.1mol/L)配制及标定记录
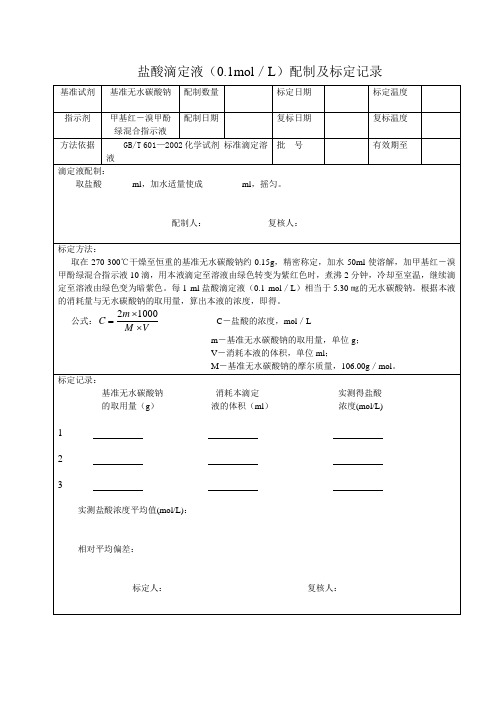
基准试剂
基准无水碳酸钠
配制数量
标定日期
标定温度
指示剂
甲基红-溴甲酚绿混合指示液
配制日期
复标日期
复标温度
方法依据
GB/T 601—2002化学试剂 标准滴定溶液
批号
有效期至
滴定液配匀。
配制人:复核人:
标定方法:
取在270-300℃干燥至恒重的基准无水碳酸钠约0.15g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。每1ml盐酸滴定液(0.1mol/L)相当于5.30㎎的无水碳酸钠。根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
相对平均偏差:_____________________________________
标定人:复核人:
复标记录:
基准无水碳酸钠消耗本滴定实测得盐酸
的取用量(g)液的体积(ml)浓度(mol/L)
1
2
3
实测盐酸浓度平均值(mol/L):________________
相对平均偏差:________________________________
公式: C-盐酸的浓度,mol/L
m-基准无水碳酸钠的取用量,单位g;
V-消耗本液的体积,单位ml;
M-基准无水碳酸钠的摩尔质量,106.00g/mol。
标定记录:
基准无水碳酸钠消耗本滴定实测得盐酸
的取用量(g)液的体积(ml)浓度(mol/L)
1
2
3
实测盐酸浓度平均值(mol/L):_________________
标准溶液配制与标定记录

实验员甲 平行试验编号 1 称量瓶+基准物质质量(前),g 称量瓶+准物质质量(后),g 基准物质质量,m /g 滴定管初度数,mL 滴定管终度数,mL 消耗滴定溶液体积,mL 温度(20℃)校正后滴定液体积, V /mL 空白试验消耗滴定液体积,V 0 /mL 基准物质的摩尔质量,M /(g/mol) 标准溶液浓度,C /(mol/L) 2 3 4 1 2
标准溶液配制与标定记录
编号:
标准溶液名称 配置日期 试剂名称 试剂质量
第 页溶剂名称
共 页配置体积
标定 拟标定溶液浓度或原标 定溶液浓度 基准物质名称 基准物质干燥条件 主要仪器 规格型号 标定日期或 原标定日期 基准物质纯 度 环境条件 精度 标定依据 指示剂 温度: ℃, 湿度: %RH
仪器编号
实验员乙 3 4
C
m 1000 (V V0 )M
四平行浓度的平均值,mol/L 四平行=
X max X min 100 X X max X min 100 X
,%
八平行浓度的平均值,mol/L 八平行= ,%
标准溶液浓度,C /(mol/L) 备注:四平行测定结果极差的相对值不得大于0.15%;八平行测定结果极差的相对值不得大于0.18% 校核: 年 月 日 复核: 标定:
0.5M盐酸滴定液标定
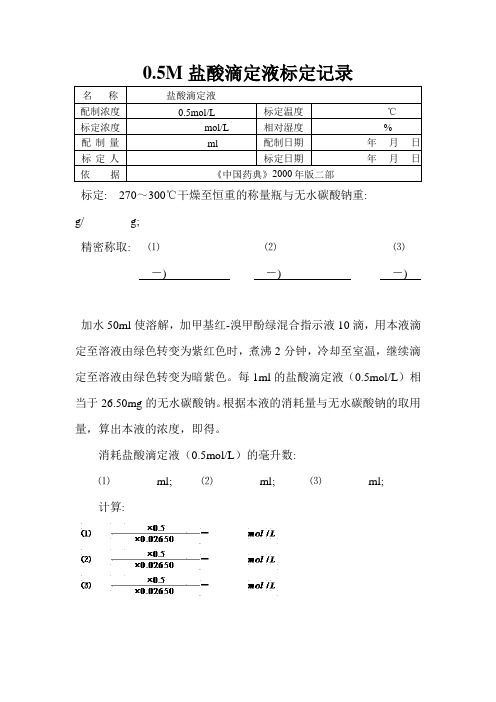
0.5M盐酸滴定液标定记录
标定: 270~300℃干燥至恒重的称量瓶与无水碳酸钠重:
g/ g;
精密称取: ⑴⑵⑶
-) -) -)
加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色转变为暗紫色。
每1ml的盐酸滴定液(0.5mol/L)相当于26.50mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
消耗盐酸滴定液(0.5mol/L)的毫升数:
⑴ml; ⑵ml; ⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。
标定结果。
标定人:。
硫酸滴定液标定记录
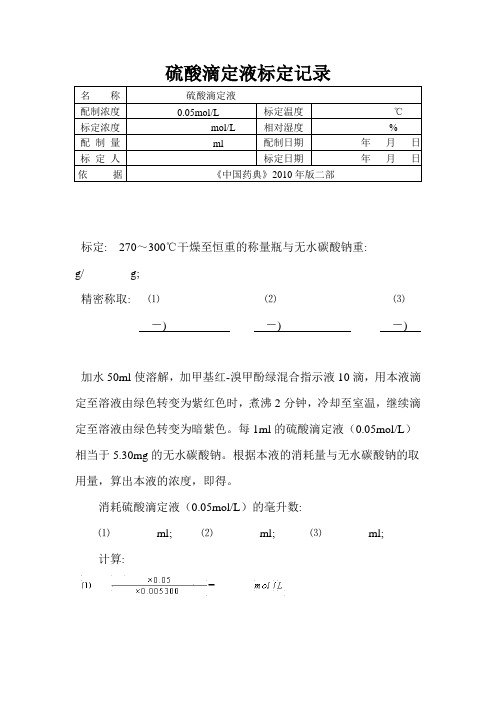
硫酸滴定液标定记录
标定: 270~300℃干燥至恒重的称量瓶与无水碳酸钠重:
g/ g;
精密称取: ⑴⑵⑶
-) -) -)
加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色转变为暗紫色。
每1ml的硫酸滴定液(0.05mol/L)相当于5.30mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
消耗硫酸滴定液(0.05mol/L)的毫升数:
⑴ml; ⑵ml; ⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。
标定结果。
标定人:。
标准溶液配制及标定记录

溶液名称
溶液编号
配制浓度
环境条件
配制日期
有效期至
所使用上级标准物质或溶液
标物名称
标物编号
编号/批号
浓度/纯度
有效期至
备注
所使用主要标准仪器或设备
仪器名称
型号/规格
出厂编号
生产厂家
计量有效期
备注
配制过程:
配制人员
复核人员
复核日期
标准溶液标定记录
待标溶液名称
待标溶液编号
名义浓度
所使用基准物质
标物名称
标物编号
编号/批号
浓度/纯度
有效期至
备注
CS=
所使用主要标准仪器或设备
仪器名称
型号/规格
出厂编号
生产厂家
计量有效期
备注
标定过程
标定人员
标定人员A
标定人员B:
标定次数
A1
A2
A3
A4
B1
B2
B3
B4
空白体积V0/ml
起始读数V1/ml
终点读数V2/ml
取待标溶液
体积V/ml
待标溶液
浓度C/(mol/L)
单人四平行结果
相对极差
八平行结果
相对极差
标定浓度
mol/L
备注:单人四平行结果相对极差应≤0.15%;
八平行结果相对极差应≤0.18%;
标定过程中待标溶液及标准滴定液温度应控制在20℃,否则体积应进行补正。
标定人员A签名及日期
标定人员B签名及日期
滴定液配制及标化记录

相对偏差3=——————————— = %
相对偏差4=——————————— = %
∑∣xi–x∣/n
相对平均偏差:= ———————————×100%
x
=—————————————————×100% = %
数
据
处
理
标准滴定液平均浓度:
CEDTA= ——————————————————————
标
定
记
录
标
化
记
录
-
方法依据:□GB/T 601□HG/T 2928□其他:
天平编号:滴定管编号:
次数
项目
1
2
3
4ቤተ መጻሕፍቲ ባይዱ
基准物质称量(g)
第一次称量
第二次称量
基准物重(m)
滴定液体积(ml)
滴定体积
滴定管校正
温度校正
空白消耗体积
实际滴定体积(V)
标定浓度计算
标定浓度计算
= mol/L
= mol/L
= mol/L
标定浓度计算
标定浓度计算
M
CEDTA=———————————————
0.08138×V
C1=
= mol/L
C2=
= mol/L
C3=
C4=
= mol/L
=mol/L
标定平均浓度:C复平均= —————————————=mol/L
标定结果相对偏差
X-X
相对偏差= ————————×100%
X
相对偏差1=——————————— = %
∑∣xi–x∣/n
相对平均偏差:= ———————————×100%
氢氧化钠标准滴定液的标定

氢氧化钠标准滴定液的标定
考核时间:70分钟
称取于105℃-110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,3.6±0.10g ,加80ml 无二氧化碳的水溶解,加两滴酚酞指示液(10g/L ),用配好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30秒。
同时做空白。
计算: C (NaOH )=M
V V 100021⨯-⨯)(m
式中:
m -邻苯二甲酸氢钾质量,单位为克(g )。
V 1-氢氧化钠溶液的体积的数量,单位是毫升(mL )。
V 2-空白试验氢氧化钠溶液的体积的数值,单位是毫升(mL )。
M -邻苯二甲酸氢钾的摩尔重量的数值,单位为克每摩尔(g/mol )[M (KHC 8H 4O 4)=204.22]。
取五次平行测定结果。
标准溶液浓度标定原始记录
实验用品
评分标准
评委签字:分析者:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
=
=
3
3
RSD%=
︳F4- F复均︳+ ︳F5- F复均︳+ ︳F6- F复均︳
×100%
3×F复均
RSD%=
×100%=%0.1%
3
误差限度:
RSD%=
︳F均- F复均︳
×100%
F均+F复均
RSD%=
×100%=%0.1%
结果计算:
F=
F均+F复均
=
=
2
2
复标人:
结论:本标准溶液浓度为
滴定液配制及标化记录
R–AⅡ02003–01
滴定液名称
盐酸(0.02mol/L)
配制数量
1000ml
基准试剂名称
基准无水碳酸钠
配制日期
年 月 日
指示剂名称
甲基红-溴甲酚绿
使用期限
三个月
标化温度
标化日期
年 月 日
复标温度
复标日期
年 月 日
配制方法:
取盐酸ml(1.8ml)加水适量使成1000ml。
配制人:
V1=ml V2=ml V3=ml
V控1=mlV空2=mlV空3=ml
计算:
F=
W基×1000
V×1.06
F1=
W基1×1000
=
×1000
=
V1×1.06
×1.06
F2=
W基2×1000
=
×1000
=
V2×1.06
×1.06
F3=
W基3×1000
=
×1000
=
V3×1.06
×1.06
相对偏差:
F均=
标定记录:
取在270~300℃干燥至恒重的基准无水碳酸钠约0.03g,精密称定,置锥形瓶中,
第一次干燥至恒重的称量瓶和基准试剂重:W1=g
第二次干燥至恒重的称量瓶和基准试剂重:W2=g
两次干燥至恒重的差:W1- W2=g-g =g0.3mg
W基1=W2- W3=g-g =g
W基2=W3- W4=g-g =g
F1+F2+F3
=
=
3
3
RSD%=
︳F1- F均︳+ ︳F2- F均︳+ ︳F3- F均︳
×100%
3×F均
RSD%=
×100%=%0.1%
3×
标化人:
复标记录:
取在270~300℃干燥至恒重的基准无水碳酸钠约0.15g,精密称定,置锥形瓶中,
W基4=W5- W6=g-g =g
W基5=W6- W7=g-g =g
V4=ml V5=ml V6=ml
V空4=mlV空5=mlV空6=ml
计算:
F=
W基×1000
V×5.30
F4=
W基4×1000
=
×1000
=
V4×5.30
×5.30
F5=W基5×Biblioteka 000=×1000
=
V5×5.30
×5.30
F3=
W基6×1000
=
×1000
=
V6×5.30
×5.30
相对偏差:
F复均=
W基3=W4- W5=g-g =g
注 :W3:为第一次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W4:为第二次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W5:为第三次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸两分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。每1ml盐酸滴定液(0.1mol/L)相当于1.06mg的无水碳酸钠。根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
W基6=W7- W8=g-g =g
注:W5:为第三次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W6:为第四次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W7:为第五次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
W8:为第六次称取干燥至恒重的基准试剂后的称量瓶和基准试剂重
加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸两分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。每1ml盐酸滴定液(0.5mol/L)相当于5.30mg的无水碳酸钠。根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
