基团贡献方法
基团贡献方法UNIFAC估算局部组成模型NRTLWILSONUNIQUAC的二元参数
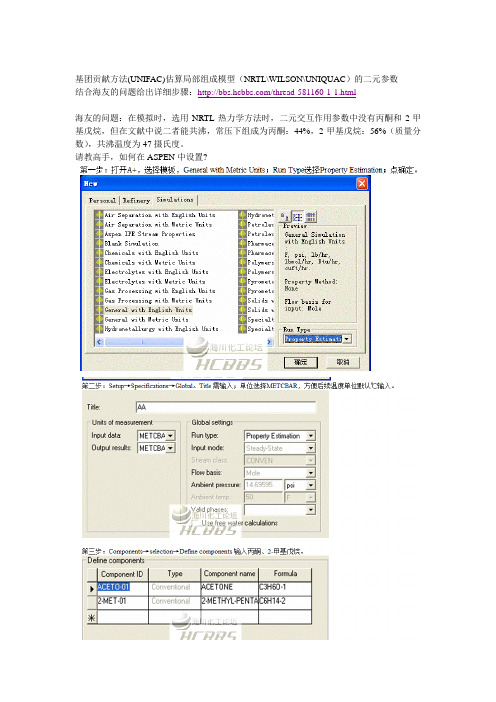
基团贡献方法(UNIFAC)估算局部组成模型(NRTL\WILSON\UNIQUAC)的二元参数结合海友的问题给出详细步骤:/thread-581160-1-1.html海友的问题:在模拟时,选用NRTL热力学方法时,二元交互作用参数中没有丙酮和2-甲基戊烷,但在文献中说二者能共沸,常压下组成为丙酮:44%,2-甲基戊烷:56%(质量分数),共沸温度为47摄氏度。
请教高手,如何在ASPEN中设置?问题:1. 在第五步中的Method为什么选Unif-DMD,而没有选其他的方法,比如UNIF-LBY、UNIF-R4等,这些方法有什么本质上的区别吗UNIFAC-DMD,LBY等没有本质区别,只是修正模型不同而已。
你找我发的那个A+10说明书看下,有详细介绍是什么修正。
2. 如果我不想使用Aspen自带的unifac基团交互参数,而是用自己的unifac基团交互参数(基团参数rq仍旧采用软件自带的),来进行楼主帖子中这样的估算,如何操作?另外,除了上面的问题外,还有一问,那就是如果我自己定义了Aspen中没有的新基团(有时候想把一个物质自己来进行拆分),而且通过别的途径得到了新基团的基团参数RQ以及所需要的相关基团交互参数,那么在这种情况下,在Aspen中怎么样来定义新基团,然后进行楼主帖子中的估算操作呢?还请楼主解答。
今天研究了一下,你的这两个问题应该都可以解决:1、当你选择UNIFAC方法的时候,A+默认使用数据库中参数,但也可以修改。
你只需要在parameters→unifac group binary→GMUFB-1中输入参数即可。
但这前提是你在components中有定义unifac groups,否则gmufb-1是灰色。
2、a+ components的UNIFAC group支持定义新的基团。
号码可以自己定义。
关键是你能定义官能团(方法有很多,bondi、unifac等等),这一步在分子结构中实现,并可以求的q、r的值。
计算环烷烃沸点的新方法——基团键贡献法

计算环烷烃沸点的新方法——基团键贡献法2∞2第22卷第3期.194~199有机化学Chine~Joamalof(…0…v0l22.2∞2I3.J94~199研究简报?计算环烷烃沸点的新方法——基团键贡献法王克强,王捷冯瑞英(.洛阳师范学院化学系洛阳471022)(许昌职业技术学院许昌461000)洛阳市第一高级中学洛阳471002)摘要根据分子中基团的特性和连接性.发展了一种直接根据分子结构信息计算环烷烃沸点的新方法基团键贡献法,该方法既考虑分子中基团的特性,又考虑基团之问的连接性(化学键),具有基团贡献法和化学键贡献法的特点对256种环烷烃沸点的计算结果表明,计算值与宴验值的一致性令人满意,平均误差071啦.关键词结构性能关系,基团键,基团键贡献法,沸点,烷烃GroupBondContribution'__.?.___-——ANewMethodforCalculating BomngPointsofCycloalkanesW ANG,Ke-QiangwA№,Jie.FENG,Rui—Yiag(mofChoTaist~,Normalc.,h~/ang471022)(~XuchangI.'ocatiormlTerhnical0f,461000)('.增sHigh&hodNoJ,4~002) AbslractOilcharacteristicsandconnectivi~,ofthegroupsinmolecules.groupbondscanbea ppliedtocharacterizemolecularstructure.Groupbondscontaininformationofgrouppropertyandco nnectivityinmoleculcs.Groupbonds,obtaineddirectlyfr(1堋molecularstructure,COIlbeusedtocNcuhWthepropertiesofmolecules.Anewmethod,thegroupbondcontributionmeth~,WItSdevelopedtocalculatetb eboilingpoints0fcycloalkmmsfrommolecularstructurelrhecalculatndresultsshowedthatthecaleutatedb oilingpointsof cycloalkaneswereingoodagreementwiththeexperimentaldata,withilloanrelativedeviatio nbeing0.71%for256cyeloalkanes(includingmonoeycloalkanesandpolyeycloalkmaes)egroupbondcontri butionmethodhasadvantagesoverthegroupcontributionmethodKeywordsatrueture-prepet~-relationship,groupbond,groupbendcontributhmmethod.bo ilingpoints,CVC】0日Ikane有机化台物结构性能定量关系的研究,是化学中'个十分活跃的研究领域.多年来,国内外许多研究者作了大量研究的工作,发展了许多根据分子结构预测化合物性能的方法.在有机化台物性能的预测方法中,应用较广的是基团贡献法和化学键贡献法,由于这些方法对同分异构体的区分能力相对较差,预测精度不够理想,作者之?4—6根据分子结构的特点,将基团贡献法和化学键贡献法结合在一起,发展了一种预测化合物性能的新方法一基团键贡献法,该方法具有基团贡献法和化学键贡献法的特点.可有效地预测化合物的性能.在有机化合物结构性能研究中,环状化台物的研究相对较为E-nHn:~'3558101@sdauO00t.~3558IOI@37InelRemlwdApril28,2001;re~sedSeptetnber17,2001;~ptedOctober22.ⅫNo3王克强等:计算:烷烃沸点的新方法摹囝键贡献法困难,无论是基团贡献法.还是化学键贡献法,都需要刘同的环进行修正,拓扑方法也需要对环状化台物分别处理.例如在环烷烃的研究中,拓扑方法对链烷烃和环烷烃的研究是分成陌类进行的,Estrade【提出计算环烷烃拓扑指数的方法.Schultz对单环烷烃的沸点与分子结构之间的关系作了研究,取得了较好的结果.本文用基团键贡献法发展一种计算环皖烃沸点的方法.对环烷烃沸点的计算结果表明.计算值与实验值的一致性令人满意1基本原理和方法结构决定性能是化学中的一条基本规律.化合物的性能不仅与分子中原子的种类和数El有关,而日更与原子的连接性有关根据前文的研究结果町知,分子结构可用基团键进行表征.显然,分子中基团的种类不同,基团键就不同;分子中基团的连接性不同,基团键也不同为简化起见,我们暂不考虑分子中环的大小,将环烷烃分子中的基团分为烷烃基团和环烷烃基团两大类,据此确定分子中基团键的数日对于烷烃,分子中有4种基团:分子中存在着1O种基团键.对于环烷烃,分子中有7种基团c其中包括烷烃分子的3种基团).其中三种新的基团为:为简化起,我们将环烷烃基团与烷烃基团之问形成的基团键作为烷烃基团键处理,仅考虑环烷烃基团之间形成的新基团键.同时根据环的大小进行适,的修正.环烷烃分子中有3种新基团,根据排列组台原理可以确定环烷烃分子中存在着C{+C;=6种新的基团键.表1列出了烷烃和环烷烃分子中存在的16种基团键,其中前l0种(C~C139)为烷烃基团键,后6种(GB『1_~GB』)为环烷烃基团键.分子中基团键的种类和数日可以直接根据分子结构确定,也可以根据分子结构的邻接矩阵和染色矩阵计算得到,具体计算方法见前文6.环烷烃与烷烃的主要差别在于前者分子中存在着环状结构,我们分两步计算环烷烃的沸点.第一步暂不考虑环烷烃与烷烃的差别,将环烷烃摹团烷烃基团处理,计算得到环烷烃沸点的近似值rlI(烷烃);第二步考虑环烷烃与烷烃的差别,计算环烷烃基团和环对沸点的影响,计算沸点的修JE量△r¨1这样即可计算得到环烷烃的沸点:(环烷烃)=Tb(烷烃J+AT1.(1)因此,只要根据分子结构计算,(烷烃)和△,即可得到环烷烃的沸点r(环烷烃).自先.我们探讨烷烃沸点T(烷烃)的计算.沸点是与分子结构密切相关的物理量,分了结构不同,沸点就不同既然分子结构可用基团键表征,那么,沸电必然为基团键的函数,因此.,(烷烃)满足:rlIc烷烃)=fl(GB)].显然,从理论上确定这函数是相当困难的,我们用数学方法进行近似处理我们发现,烷烃的沸点r(烷烃)随着分子巾碳原子数(碳原子数"与基团键之间存在着定量关系[TJ)的增加而增大,烷烃同分异构体之问的沸差异可用基团键定量描述,即碳原子数反映烷烃沸点的体变化趋势,基团键则从细节上反映r分子结构差异对沸点的影响.对烷烃沸点的拟台结果表明,沸点随着分子中碳原子的增加而增大,随着基团键的变化而改变,且烷烃的沸点1(烷烃)/n与基团键数n(GB)的线性函数和n(GB)/n显着相关,因此.我们选择的函数为b(烷烃)/=144.723+∑(+/)n(GB)…(2)式中为分子中的碳原子数,12.(GB,)为基团键GB. 的数目,日和C是与基团键特性有关的常数(基团键参数).表l列出了本文用753种烷烃沸点数据J 拟合得到基团键参数.其次,我们探讨环对沸点的影响.环烷烃中环对沸点的影响△r与环的大小及环上取代基的位置有关,前者对沸点的影响可根据环的人小进j修正, 后者对沸点的影响可根据环烷烃的基团键修正我们发现,环对△.的影响不仪与环的大小和数日有关,而且与分子中的碳原子数有关,在环的数目和大小一定的条件下,环的影响随着碳原子数的增加而增大;环烷烃基团键对沸点的影响同样与基团键的数目和分子中的碳原于数有关,且基团键的影响随着分子中碳原子数的增加而减小因此,我们选择的△函数为:l96有机化学V ol22.2002Bj)e-O.frS~c/n+哺㈥Tal~~靴2ParametersB.雌ofth团e式中(GBj)为环烷烃基团键GBj的数目,日是与基团键特性有关的常数(基团键参数),为环的数目.A为环的修正量.表2列出了本文用256种环烷烃沸点数据[拟合得到基团键参数和环修正量.表3列出了确定基团键参数所用的基团键数目. 表1计算Tb(烷烃)的基团键参数日和l'al~e1ParametemBi,Cofthegroupbondsforcalculating (alkane)2计算结果及讨论应用表2提供的基团键参数日,,c和环修正量△,可直接根据分子结构计算环烷烃的沸点.值得指出的是,在确定分子中环的大小和数目时,应注意各环应尽可能独立,不能存在环包含环的情况,即以取小环为主,所取的大环不能包含小环.例如,四环[2, 2,I,02一,os,]庚烷(图1)分子中的环为:1个四元环,2个三元环,1个五元环;三环r5,2,1,o2]癸烷分子中有3个五元环计算沸点的基本方法是:第一ringsforcalculatingATb下标C表示环烷烃基团之间形成的基团键表3确定基团键参数所用基团键的数目NTalde3Numberofthegroupbondstrsedincorre]atingthe paratt~etem丑andC代码Ⅳ代码Ⅳ代码Ⅳ代码N代码GB112492187G355GB】0737GB"9lGB2l5l91337G252GBl_494GB】d14G璐l015G57027GB】246GB】51由于G玮仅存在于乙烷中.其基团键的数目为H川H2圈1P耳环[2,2.1,o2~,os:庚烷和--~[5.2.1,0=]癸烷Figure1Quadrlcyclo[2.2,1.~,.]heptmr~andlricyclo[52,1.02,]deeane步暂不考虑环烷烃与烷烃的差别,将环烷烃基团作为烷烃基团处理,根据分子结构确定分子中基团键的种类,数目,代人式(2)计算(烷烃);第二步考虑环烷烃与烷烃的差别,根据分子中环烷烃基团之03王克强等:计算环烷烃沸点的新方法一基团键贡献法197 间形成的基团键及环的大小和数曰,代人式(3)计算△Th,将计算得到的I(烷烃)和△I代人式(1)即呵计算得到环烷烃的沸点.例如四环一2,2,l,.",03']庚烷,"=7,第一步,将环烷烃基团作为烷烃基团处理,分子中有2种基团键:n(G)=2,n(GB7)=8,代人式(2)得到Th(烷烃)=3O4.24K;第2步,考虑环烷烃基团的与烷烃基团的差别.环烷烃基团之间形成2种基团键:n(GB】1):2,n(GB】3)=8,分子中有1个四元环,2个三元环和1个五元环,代人式(3)可得△=82.5lK,代人式(1)得(环烷烃)=(烷烃)+△】,=386.75K;对于三环[5,2,1,02,]癸烷,,fr=10,第一步,将环烷烃基团作为烷烃基团处理,分子中有3种基团键:n(G)=3,(G)=6,n(GB7)=3,代人式(2)得到Th(烷烃)=339,05K;第2步.考虑环烷烃基团的与烷烃基团的羞别,环烷烃基团之间形成3种基团键:n(GB)=3,n(GB】1)=6,n(GBl)=3,分子中有3个五元环,代人式(3)可得△Tb=120.41K,代人式(1)得I(环烷烃)=(烷烃)+△TI=45946K.为确定本文方法的可靠程度和适用范围,我们对环烷烃(包括环丙烷到环二十烷)进行计算,并与实验值I进行比较.限于篇幅,表4列出了部分环烷烃沸点的计算结果,全体256种环烷烃的计算结果绘于图2.表4部分环烷烃沸点it-算值(ca1.)和实验值Tb(exl~)的比较Table4CⅥ)aI1s0nofthec~leulatedboilingpointTbmt}Iexperime.t.1dataofsoⅡcyclOalka~es环烷烃Tk,(exp)Th(ca1)E1%环烷烃(唧)Tb(eat)£/%甲基环丙烷27388271.88—0.73戊基环烷4768247587—0201一顺一2-二甲基环丙烷31018310.81020辛基环己烷5367553303—0.69异丙基环丙烷154340.57272十一烷基环己烷58635581.60—0.811一甲基一反2-£基环丙烷331.8133714161十四烷基环己烷6281562366—071 1顺一2一反一3三甲基环丙烷332.853H430.48十七烷基环己烷664.1566o58—054己基环丁烷34:375344.300.16=十烷基环己烷6951569332—0261一反一2-二甲基环丁烷33315337.30l24二十三烷基环己烷72215722.560.06秫-1'1AIA1nm+"1…AA…丙基环戊烷己基环戊烷壬基环戊烷十二烷基环戊烷五烷基环戊烷十八烷基环戊烷=十一烷基环1萱烷二四烷基环戊烷=十七烷基环戊烷三}烷基环戊烷三十三烷基环戊烷三十六烷基环戊烷己摹环戊烷】一反_2'二甲基环戊烷丙基环戊烷l一甲基一顺一2一乙基环戊烷】一甲基一反一3一乙基环戊烷1一』匝一2一顺一3一三甲基环戊烷l一顺一2顺一4-i甲基环戊烷丁基环戊烷特丁基戊烷1一甲基一反一2一丙基环戊烷41)4.1O476055351558435626.15662.1569'3157201574515767】57s7.15805.1537662 365024O4.10 401.20 39425 39615390.15 429754l800419.5241)447O.09 473】8—0.60 529.82一1.00 5_77.91—1.10 61952—106 65601—093 68834—069 717.】9—041 743.09—028 7054.5—009 787610068o6阻0.21 377.86033 37083】59 404.47009 39856—0.66 394.980l9 39150一l17 38793—0.57429.03—0.17422.5811O422.55072=十九烷基环己烷三十=烷基环己烷三十五烷基环己烷甲基环己烷1一顺一2一=甲基环己烷1一反一3-二甲基环己烷l雨基环己烷1甲基一顺2-乙基环己烷l一甲基一反一3一己基环己烷1,1,2一三甲基环己烷】一顺0丽一3一三甲基环已烷1一顺2一顺4三甲基环己烷l一反2一反4三甲基环己烷二环己甲烷1,】一二环己丁烷l_l一二环己庚烷1.1一二环己癸烷1.1一二环己十三烷】,】一二环己十六烷环千烷环十二烷环十五烷68.15788l5妍15374084O2939760 42987 42925424】5 418.35426l54211541437525.95 566.12605l564.O15 670.15 697.15 451555l2l5559】5772O58 794080758】3.640.8O 37806106 39953—084 39596—041 43】350.34 424.87一1.o2 421.63一O59 4】575—062 4l779一】96 414.55一1.57 414.5500452489一O205690305l608.9l0.62643.42O516736】()527002】04444896—0.57510.75—02755537一O68l98有机化学V o1.22,2g02续表环烷烃TbE/%环烷烃To7E/%(exp)(ca1)(exp.)(ca1)1一甲基一1一异而基环戊烷42l1542319048环十八烷5981560246()721一甲基一顺一3一异丙基环戊烷4151541717049联环庚烷56415565870311圳2一二己基环戊烷4267l42315~083环戊基环己烷4882548244—119I一反一3一二乙基环戊烷423154199l~0762,4,6-三甲基二环[3,1.1]庚烷4426543597—15】l一顺一2一二甲基一1一乙基环戊烷41715417740142一甲基二环[2,2.2]辛烷43l15435541O21一顺一2一一甲基一反一3一乙基环戊烷418.15416.07~050二环[2.1.O]戊烷318.653155l一0981一顺一2一二甲基一顺4乙基环戊烷420.1541284~17,4环『1n]_丁辟1'11钔一n11一顺一3一_I甲基一反一2一乙基环戊烷410.15416.07I44四环[2,2.I,.03]庚烷381.15386.75I.471一顺一3一二甲基反4乙基环戊烷410.15412.84065顺一一环[3.3,0]辛烷410.15412300.521.1,2,2_四甲基环戊烷496.15405.27~0.22反.=环[3,3.O]辛烷405.15412301.76 1.1-顺一2_顺一4一四甲基环戊烷403.15403.720.142一甲基二环l2,2,2辛烷43115435541.o21,1一顺一3一顺一4一四甲基环戊烷496.154.9O.89~I.313二环4,2.0一辛烷4091540892-一0.嘶1,2,2-反一3一四甲基环虎烷4l1.15409.79~0.33二环4.1,0.庚烷3896538017—2.43I一顺一2一反一3一婀4四甲基环戊烷4O415408.991.20三环:5,2,l,02癸烷4661545946—1.44I一反2一反一3一顺4四甲基环戊烷4O4154O8991.20螺[2.2]戊烷3131530746一12己基环己烷4O493406.5904l顺一六氢茚44O1543886—0.29表中环烷烃是用计算机选取的,方法是:对256种环烷烃编号为No1~256,选取No. 2,N05.8,….约占总数的三分之一!II2环烷烃沸点计算值Tb(c)与实验值(.xp)的比较Figure2(_^】m90nofthecalctrlatedboihngI~intTh(ca1)htheexperimentaldatars(e~p)ofcycl0alkane对256环烷烃的计算结果表明,无论是对含有一个环的简单环烷烃,还是对含有多个环的复杂环烷烃,沸点的计算值与实验值".]的一致性令人满意,计算结果的平均绝对误差3.29K,平均相对误差0.71%在计算的256种环烷烃中,计算误差小于0.5%的106种,计算误差在0.5%~l0%之问的90种,计算误差1.0%一1.5%之间的38种,计算误差1.5%~2.0%之间的l2种,计算误差2.0%~2.5%之间的6种,计算误差2.5%~3.0%之间的2种.计算误差大于3.0%的2种,最大计算误差3.13%.显然,绝大多数化合物的计算误差在l0%以内.文献上应用较广的计算烷烃沸的方法是Jobaek方法",该方法对上述256种烷烃计算结果的平均绝对误差46.89K,平均相对误差7.1】%.显然,与Joback方法相比,基团键贡献法将计算精度提高了一个数量级.因此,基团键贡献法具有适用范围,..,计算结果可靠的特点.此外,基团键贡献法是根据分子中基团的特性和连接性发展的,易丁实现计算机程序化设计,我们开发了相应的计算机程序,只需输A少量分子结构参数即可计算得到沸点预测值3结论本文根据分子中基团的特性和连接性,发展了一种根据计算环烷烃沸点的新方法——基团键贡献法,该方法既考虑了分子中基团的特性,又考虑了基团的连接性,同时具有基团贡献法和化学键贡献法的特点,对环烷烃(包括单环和多环烷烃)的计算结果表明,沸点计算值与实验值的一致性令人满意.No3王克强等:计算环烷烃沸点的新方法一基团键贡献法l99 1Reid,R.C;Prausrdtz,J.M;Poling,BE.Properties‰andt/qt,i&,4thEd.,McGraw-HillBook Company.NewY0rk.1987.2Xu,ZH;Mao,Z.X.;Wang,LS;Pang,YLHandbo&Chemi*'alProperey"EstimationMeth,~,Huaxue Got~,gyeChiCle.Bing,I99l(inCtfine~)(许志宏.毛卓雄,王乐珊,鹿瑶琳译,亿学性质估算方法手册,化学工业出版社,北京,1991.)3Wang,K.Q;Hu.YChin,.忡Ctwm.1997,17,230(inChinese)(王克强.胡英,有机化学,1997.t7.230.)4Wang,KQJ~.jiHngHuax,w1996,13.182 (inChisese)(土克强.计算机与应用化学,1996,17,182.)5Gutman,I;Estrade,E.JChemComputSci1996.36.5416schuhz.HP:Schultz1993.33,2407Wang,K.Q.Ch/nJChit~se)PjCheml《0唧nOrgCtwm.1999,19,304(in(于克强,有机化学,1997,19,304)8:~ericanPetroleumhmfituteResearchProject44,Seleaed pⅡofl#opertyofH)~warbonsandRelatedCom~unds1lrmo[hIacResearchCenterdtheAmericanPetroleum hrstitute,Texas,1,Tablea9Weast,RCCRCHandbookChen~tO,andm.66thFA.CRCPress.h,e..Horida,l986,04210Dean,J.Ahinge'HandbookofChemic-.13thEd. McGraw-HillBookCompany,NewY ork.1赠5.PP.7~82. 】lMa,PS踊uHuagong肛^u卧咖S,%uce,Huaxue Gon~,eChubami~e,l~ijing,1993(inChinese).(马肺生,石油化工数据手册,化学工业出版社,北京, 1993,(Y0104281LI,L.T:F,YY)。
benson基团贡献法

Benson基团贡献法1. 简介Benson基团贡献法(Benson group contribution method)是一种用于估算有机化合物的热力学性质的方法。
这种方法通过对有机分子中各个功能基团的贡献进行加和,从而预测化合物的热力学性质,如熔点、沸点、溶解度等。
该方法在有机化学和药物设计领域得到了广泛应用。
2. 背景在有机化学中,了解分子的物理性质对于合成新化合物、优化反应条件以及预测其行为至关重要。
然而,实验测定每个新合成的化合物的性质是非常耗费时间和资源的。
因此,发展一种可靠且高效的方法来估算这些性质变得十分重要。
Benson基团贡献法通过将一个分子拆分成各个功能基团,并使用已知基团性质数据来估算整个分子的性质。
这种方法利用了基团之间相互作用的简单加和原理,可以快速预测目标分子的性质。
3. 基本原理Benson基团贡献法将每个功能基团视为一个相互独立的单位,具有特定的热力学性质。
每个基团都被赋予一个特定的基团参数(group contribution),该参数与该基团的性质相关联。
这些参数可以通过实验测定或从文献中获得。
对于一个给定的分子,其性质可以通过将各个功能基团的贡献加和得到。
例如,对于一个分子的熔点,可以使用以下公式进行估算:Tm = Σ(Tm_i * n_i)其中,Tm表示分子的熔点,Tm_i表示第i个功能基团的标准熔点,n_i表示第i 个功能基团在分子中出现的次数。
类似地,其他性质如沸点、溶解度等也可以使用类似的方法进行估算。
4. 应用领域Benson基团贡献法在有机化学和药物设计领域得到了广泛应用。
它可以用于以下方面:4.1. 合成规划在合成新化合物时,预测其物理性质对于确定最佳合成路径至关重要。
Benson基团贡献法可以帮助化学家在合成前预测目标分子的性质,并据此选择最合适的合成路线。
4.2. 药物设计药物的热力学性质对于其吸收、分布、代谢和排泄(ADME)过程至关重要。
北京化工大学高等化热大作业-基团贡献法

浅谈基团贡献法引言不久前,我前往导师XXX的办公室,与他沟通交流学业上的问题。
谈话间,王老师提及的一种建立自由基聚合反应过程机理模型的方法──链节分析法[1],引起了我极大的兴趣。
这一方法可以对复杂的聚合反应过程进行准确的动态模拟,解决了以往须同时求解无限多个微分方程才能模拟聚合过程的难题。
通过这篇文献[1]我得知,对于高分子聚合物体系的热力学性质的处理,一直是建立聚合反应机理模型的难题之一。
此法[1]不再把组成和链长不同的无穷多的聚合物大分子作为组分,而是将流程模拟系统的组分中出现的C、E、A·、R·等基本单元,参考其相应的单体物性,从而得到大分子聚合物的各种热力学性质。
高分子的绝大部分热力学性质如密度ρ、比热容C p、焓H、摩尔体积V b、各种临界参数都能利用Joback基团贡献法,由基本单元的物性计算得到。
联想到化热课堂上与基团贡献法有关的似乎只有UNIFAC模型,因此我想对物性估算法中的基团贡献法展开讨论,描述各种不同的方法并加以简单的评价。
这便是本题目的来源。
第1章临界参数估算方法不论是通过自己对化工热力学的学习,还是通过对文献的查阅,都不难得出这样的结论:对纯物质而言,临界参数是最重要的物性参数之一。
其实,在所有的PVT关系中,无论是对应状态法还是状态方程法都与临界数据有关。
对应状态法已成为应用热力学的最基本法则[2],借助于对应状态法,物质的几乎所有的热力学参数和大量的传递参数可被预测,而对应状态法的使用又强烈地依赖于临界数据。
此外,涉及到临界现象的高压操作,如超临界萃取和石油钻井[2],也与临界参数密切相关。
总而言之,临界数据是化工设计和计算中不可缺少的重要数据。
临界参数如此重要,前人自然少不了花费巨大精力对其进行收集、整理和评定,但据我了解,所收集的临界数据大多局限于稳定物质的临界数据。
虽然近几年对不稳定物质临界参数测定方法的研究在开展着,并且也测定了一些不稳定物质的临界参数,但大部分的不稳定物质仍由于测定难度大而缺乏实测的临界数据。
易燃液体闪点预测模型综述

易燃液体闪点预测模型综述景冬莲;俞英;商杰;黄海燕【摘要】闪点(FP)是易燃液体及其分类标准的重要划分依据,同时也是衡量可燃液体火灾危险性的重要参数.闪点的确定将影响危险化学品的分类、储存、运输、使用、防火及危险品公示等各方面.为弥补实验测定的不足,借助模型预测来计算闪点具有重要的理论意义和实用价值.本文综述了易燃液体闪点的估算方法,主要分为三类:经验关联计算,基团贡献法计算和基于分子结构的模型预测,并讨论了三类方法各自的优势和不足.经验关联计算形式上简单,并且易于从实验数据中构建,一般与沸点相关联,使用数学回归或人工神经网络(ANN)方法获得.基团贡献法(GCM)是假设分子的性质是构成分子的所有基团贡献的函数,通过分子官能团贡献对闪点建立线性或非线性模型.基于分子结构的定量结构-性质关系,(QSPR)模型的建立与精度关键在于分子描述符的计算与筛选、模型建立的不同方法.近年来,鉴于各模型的优势与不足,将QSPR与其他预测模型和先进技术结合起来研究闪点与分子结构的相关性,是闪点预测的研究方向和热点,也为易燃液体混合物闪点的预测模型打下基础.【期刊名称】《天然气化工》【年(卷),期】2019(044)002【总页数】7页(P128-134)【关键词】易燃液体;闪点;模型预测【作者】景冬莲;俞英;商杰;黄海燕【作者单位】中国石油大学(北京)理学院重质油加工国家重点实验室,北京 102249;中国石油大学(北京)理学院重质油加工国家重点实验室,北京 102249;广西出入境检验检疫局危险品检测技术中心,广西南宁 536008;中国石油大学(北京)理学院重质油加工国家重点实验室,北京 102249【正文语种】中文【中图分类】O64闪点是衡量可燃液体火灾危险性的重要参数,在石油化工领域,生产、使用和储存有机物的场所均涉及危险等级的划分,而危险等级的划分以及相应的处理措施都取决于液体的闪点。
闪点的实验测定方法有开口杯法和闭口杯法,是获得闪点数据的有效方法。
2 HLB值的计算

2 HLB值的计算(1)Griffin关系式测定HLB值的方法最早由Griffin提出,该法繁琐且耗时[3].后来Griffin提出用下列经验式计算某些非离子型表面活性剂的HLB值.质量百分数法(基团重量法)对于有聚氧乙烯基类和多元醇类的非离子型表面活性剂:HLB=20*MH/M.式中,MH为亲水基部分的分子量,M为总的分子量.皂化值法对于多数多元醇的脂肪酸酯类表面活性剂[3]:HLB=20(1-S/A).其中S代表表面活性剂(多元醇酯)的皂化值(又称皂化数),A代表成酯的脂肪酸的酸值.对于皂化值不易测定的多元醇乙氧基化合物:HLB=(E+P)/5.式中E为表面活性剂的亲水部分,即乙氧基(C2H4O)的质量分数,P为多元醇的质量分数.皂化值不清的脂肪酸酯如妥尔油!松香酸酯!蜂蜡酯及羊毛酯等的HLB值都可以由上式求算.对于只用乙氧基(C2H4O)为亲水部分的表面活性剂和脂肪醇与C2H4O的聚合体,上式简化为:HLB=E/5.混合表面活性剂的HLB值具有加和性.A,B两种表面活性剂混合之后的HLB值为:HLB=HLBA*A%+HLBB*B%.(2)J.T.Davies关系式基团数法:1957年Davies提出将表面活性剂分子分解为不同的基团,这些基团各自对HLB有一定的贡献:HLB=7+Σ(亲水基的基数)+Σ(亲油基的基数).该方法适用于计算阴离子型表面活性剂和非离子型表表面活性剂的HLB与其在油水两相中的平衡浓度有关[4]:HLB-7=0.36ln(cW/cO)式中cW为表面活性剂在水相中的平衡浓度,cO为表面活性剂在油相中的平衡浓度,cW/cO为表面活性剂在两相中的分配系数.(3)无机性基团贡献法:把表面活性剂划分为有机性基团(一般疏水)和无机性20,据此得到表面活性剂分子中各基团的无机性!有机性贡献值.HLB=(E无机性基团值/E有机性基团值)@10(4)估算法利用表面活性剂在水中的溶解情况可以估计该表面活性剂的HLB值范围(见表1).水溶液外观不分散不良分散搅拌后*状分散稳定*状分散半透明至透明透明液HLB值1~4 3~6 6~8 8~10 10~1313~20(5)HLB值的实验测定和计算①气相色谱法气相色谱固定液分离样品的能力取决于固定液与样品中各组分的极性.据此,用表面活性剂做固定液,选择其他流动相可测定HLB.Beche和Birkmeier,以乙醇和乙烷混合物为流动相,表面活性剂为固定相进行测定,结果表明,乙醇与乙烷的保留时间比与HLB成直线关系:HLB=8.55ρ-6.36.*化剂载体的极性定义是二组分的保留时间比ρ: ρ=REtOH/RHex.其中,REtOH为乙醇的保留时间,RHex为乙烷的保留时间.当*化剂含有较多的自由多元醇组分时直线关系须做校正.保留时间比值随温度而改变,一般采用折中温度80度,在此温度下,大部分非离子*化剂为液体.②水数法聚氧乙烯型非离子表面活性剂的HLB与水数有一定关系:HLB=algW+b式中,a,b 为常数,W为水数!单位为mL.所谓水数是指以体积比为96%和4%的二氧杂环乙烷和苯胺混合物溶解样品,然后用水滴定至混浊所用水的数量.③对数法*化剂的亲水亲油平衡值与其亲水!疏水基团的重量比的对数有关:HLB=7+11.7lgWL/WO.其中WL,WO分别为*化剂分子中亲水!疏水基团的重量.测定HLB值的方法还有很多,测定及计算时所用的实验方法和所依据的关系式均有一定的使用范围,如果不适当地套用某一方法,则有时误差很大.2*化剂的选择和混合*化剂配方现适用于选择*化剂的方法主要有两种:HLB法(亲水亲油平衡法)和PIT法(相转变温度法).前者适用于各种类型表面活性剂,后者是对前一方法的补充,只适用于非离子型表面活性剂.2.1 HLB值与*化剂筛选一个具体的油-水体系究竟选用哪种*化剂才可以得到性能最佳的*状液,这是制备*状液的关键.最可*的方法是通过实验筛选,HLB值有助于筛选工作.通过实验发现,作为O/W型(水包油型)*状液的*化剂其HLB值常在8~18之间;作为W/O型(油包水型)*状液的*化剂其HLB值常在3~6之间.在制备*状液时,除根据欲得*状液的类型选择*化剂外,所用油相性质不同对*化剂的HLB值也有不同要求,并且,*化剂的HLB值应与被*化的油相所需一致.[4]有一种简单的确定被*化油所需HLB值的方法:目测油滴在不同HLB值*化剂水溶液表面的铺展情况,当*化剂HLB值很大时油完全铺展,随着HLB值减小,铺展变得困难,直至在某一HLB值*化剂溶液上油刚好不展开时,此*化剂的HLB值近似为*化油所需的HLB值.这种方法虽然粗糙,但操作简便,所得结果有一定参考价值.2.2 HLB值与最佳*化剂的选择每种*化剂都有特定的HLB值,单一*化剂往往很难满足由多组分组成的体系的*化要求.通常将多种具有不同HLB值的*化剂混合使用,构成混合*化剂,既可以满足复杂体系的要求,又可以大大增进*化效果.欲*化某一油-水体系,可按如下步骤选择最佳*化剂.油-水体系最佳HLB值的确①定选定一对HLB值相差较大的*化剂,例如,Span-60(HLB=4.3)和Tween-80(HLB=15),按不同比例配制成一系列具有不同HLB值的混合*化剂,用此系列混合*化剂分别将指定的油水体系制成系列*状液,测定各个*状液的*化效率(可用*状液的稳定时间来代表,也可以用其他稳定性质来代表),与计算出的混合*化剂的HLB,作图,可得一钟形曲线,与该曲线最高峰相应的HLB值即为*化指定体系所需的HLB值.显然,利用混合*化剂可得到最适宜的HLB值,但此*化剂未必是效率最佳者.所谓*化剂的效率好是指稳定指定*状液所需*化剂的浓度最低!价格最便宜.价格贵但所需浓度低得多的*化剂也可能比价格便宜!浓度大的*化剂效率高.②*化剂的确定在维持所选定*化体系所需HLB值的前提下,多选几对*化剂混合,使各混合*化剂之HLB值皆为用上述方法确定之值.用这些*化剂*化指定体系,测其稳定性,比较其*化效率,直到找到效率最高的一对*化剂为止.值得注意的是,这里未提及*化剂的浓度,但这并不影响这种选配方法,因为制备一稳定*状液所要求的HLB值与*化剂浓度关系不大.在*状液不稳定区域内,当*化剂浓度很低或内相浓度过高时,才会对本方法有影响.[6]采用HLB方法选择*化剂时,不仅要考虑最佳HLB值,同时还应注意*化剂与分散相和分散介质的亲和性.一个理想的*化剂,不仅要与油相亲和力强,而且也要与水相有较强的亲和力.把HLB值小的*化剂与HLB值大的*化剂混合使用,形成的混合膜与油相和水相都有强的亲和力,可以同时兼顾这两方面的要求.所以,使用混合*化剂比使用单一*化剂效果更好.综上所述,决定指定体系*化所需*化剂配方的方法是:任意选择一对*化剂,在一定范围内改变其混合比例,求得效率最高之HLB值后,改变复配*化剂的种类和比例,但仍需保持此所需HLB 值,直至寻得效率最高的复配*化剂.HLB值与混合*化剂配比在复配*化剂时,采用多少量合适可通过各自的HLB值和指定体系所需的HLB值求得.例如,在进行醋酸乙烯酯的O/W型*液聚合时,*化剂用量为3%,采用SDS和Span-65为*化剂,已知SDS的HLB值为40,Span-65的HLB值为2.1,*液聚合时要求的HLB值平均为16.0.设Span-65在混合*化剂中的质量分数为w%,则40(1-w%)+2.1w%=16,解之得w%=63.3%,则SDS在混合*化剂中的质量分数为36.7%.由此可知,在醋酸乙烯酯的O/W型*液聚合体系中,Span-65的用量占3%*63.3%=1.9%;SDS的用量占3%*(1-63.3%)=1.1%.3结束语在制备稳定*状液时,选择最适合的*化剂以达到最佳*化效果是关键问题.对于*化剂的选择,目前尚没有完善的理论.表面活性剂的HLB值在选择*化剂和确定复合*化剂配比用量方面有很大使用价值,其优点主要体现在它的加和性上,可以简单地进行计算;其问题是没有考虑其他因素对HLB值的影响,尤其是温度的影响,这在近年来用量很大的非离子型*化剂上表现尤为突出.此外,HLB值只能大致预示形成*状液的类型,不能给出最佳*化效果时*化剂浓度,也不能预示所得*状液的稳定性.因此,应用HLB值选择*化剂是一个比较有效的方法,但也有一定的局限性,在实际应用中还需要结合其他方法参照进行.。
benson基团贡献法

benson基团贡献法Benson基团贡献法是一种在有机化学中常用的方法,用于描述和分析有机分子中的基团对分子性质和反应性的影响。
这个方法的基本理念是将有机分子看作是由不同的基团组成的,而这些基团可以通过它们的化学性质和反应性来预测整个分子的性质和反应性。
Benson基团贡献法建立了一个基团贡献表,其中列出了不同基团对不同性质的贡献值。
这些基团贡献值可以用来计算整个分子的性质,如热力学稳定性、酸碱性、电子亲和性等。
通过对每个基团对总贡献值的求和,可以得到整个分子的性质。
在使用Benson基团贡献法时,首先需要将要研究的分子分解为不同的基团,并检查基团贡献表以确定每个基团的贡献值。
然后,根据基团的数量和贡献值,可以计算整个分子的贡献值。
通过比较不同分子的贡献值,可以预测它们的性质和反应性的差异。
Benson基团贡献法的优点在于它提供了一种简化和定量化的方法来描述有机分子的性质。
它可以用来预测化学反应的速率、平衡常数和反应产物的选择性。
此外,Benson基团贡献法还可以用于设计新的化合物,通过选择特定的基团来调节分子的性质,从而满足特定的应用需求。
尽管Benson基团贡献法在许多情况下都是有效的,但它也有一些局限性。
首先,基团贡献表是通过实验数据和统计方法得出的,并不适用于所有的分子和反应。
其次,基团之间的相互作用和环境效应可能会对基团贡献值产生影响,这些因素在Benson基团贡献法中没有考虑。
因此,在使用Benson基团贡献法时需要谨慎,并结合其他实验和计算方法进行综合分析。
总之,Benson基团贡献法是一种有机化学中常用的方法,可以用于预测有机分子的性质和反应性。
它提供了一种定量化和简化的描述有机分子的方法,可以帮助化学家们设计和优化化合物,以满足特定的应用需求。
然而,使用Benson基团贡献法时需要注意其局限性,并结合其他方法进行综合分析。
表面活性剂HLB值计算方法

.2 HLB值的计算(1)Griffin关系式测定HLB值的方法最早由Griffin提出,该法繁琐且耗时[3].后来Griffin提出用下列经验式计算某些非离子型表面活性剂的HLB值.质量百分数法(基团重量法)对于有聚氧乙烯基类和多元醇类的非离子型表面活性剂:HLB=20*MH/M.式中,MH 为亲水基部分的分子量,M为总的分子量.皂化值法对于多数多元醇的脂肪酸酯类表面活性剂[3]:HLB=20(1-S/A).其中S代表表面活性剂(多元醇酯)的皂化值(又称皂化数),A代表成酯的脂肪酸的酸值.对于皂化值不易测定的多元醇乙氧基化合物:HLB=(E+P)/5.式中E为表面活性剂的亲水部分,即乙氧基(C2H4O)的质量分数,P为多元醇的质量分数.皂化值不清的脂肪酸酯如妥尔油!松香酸酯!蜂蜡酯及羊毛酯等的HLB值都可以由上式求算.对于只用乙氧基(C2H4O)为亲水部分的表面活性剂和脂肪醇与C2H4O的聚合体,上式简化为:HLB=E/5.混合表面活性剂的HLB值具有加和性.A,B两种表面活性剂混合之后的HLB值为:HLB=HLBA*A%+HLBB*B%.(2)J.T.Davies关系式基团数法:1957年Davies提出将表面活性剂分子分解为不同的基团,这些基团各自对HLB有一定的贡献:HLB=7+Σ(亲水基的基数)+Σ(亲油基的基数).该方法适用于计算阴离子型表面活性剂和非离子型表表面活性剂的HLB与其在油水两相中的平衡浓度有关[4]:HLB-7=0.36ln(cW/cO)式中cW为表面活性剂在水相中的平衡浓度,cO为表面活性剂在油相中的平衡浓度,cW/cO为表面活性剂在两相中的分配系数.(3)无机性基团贡献法:把表面活性剂划分为有机性基团(一般疏水)和无机性20,据此得到表面活性剂分子中各基团的无机性!有机性贡献值.HLB=(E无机性基团值/E有机性基团值)@10(4)估算法利用表面活性剂在水中的溶解情况可以估计该表面活性剂的HLB值范围(见表1).水溶液外观不分散不良分散搅拌后*状分散稳定*状分散半透明至透明透明液HLB值1~4 3~6 6~8 8~10 10~13 13~20(5)HLB值的实验测定和计算①气相色谱法气相色谱固定液分离样品的能力取决于固定液与样品中各组分的极性.据此,用表面活性剂做固定液,选择其他流动相可测定HLB.Beche和Birkmeier,以乙醇和乙烷混合物为流动相,表面活性剂为固定相进行测定,结果表明,乙醇与乙烷的保留时间比与HLB成直线关系:HLB=8.55ρ-6.36.*化剂载体的极性定义是二组分的保留时间比ρ: ρ=REtOH/RHex.其中,REtOH为乙醇的保留时间,RHex为乙烷的保留时间.当*化剂含有较多的自由多元醇组分时直线关系须做校正.保留时间比值随温度而改变,一般采用折中温度80度,在此温度下,大部分非离子*化剂为液体.②水数法聚氧乙烯型非离子表面活性剂的HLB与水数有一定关系:HLB=algW+b式中,a,b 为常数,W为水数!单位为mL.所谓水数是指以体积比为96%和4%的二氧杂环乙烷和苯胺混合物溶解样品,然后用水滴定至混浊所用水的数量.③对数法*化剂的亲水亲油平衡值与其亲水!疏水基团的重量比的对数有关:HLB=7+11.7lgWL/WO.其中WL,WO分别为*化剂分子中亲水!疏水基团的重量.测定HLB值的方法还有很多,测定及计算时所用的实验方法和所依据的关系式均有一定的使用范围,如果不适当地套用某一方法,则有时误差很大.2*化剂的选择和混合*化剂配方现适用于选择*化剂的方法主要有两种:HLB法(亲水亲油平衡法)和PIT法(相转变温度法).前者适用于各种类型表面活性剂,后者是对前一方法的补充,只适用于非离子型表面活性剂.2.1 HLB值与*化剂筛选一个具体的油-水体系究竟选用哪种*化剂才可以得到性能最佳的*状液,这是制备*状液的关键.最可*的方法是通过实验筛选,HLB值有助于筛选工作.通过实验发现,作为O/W型(水包油型)*状液的*化剂其HLB值常在8~18之间;作为W/O型(油包水型)*状液的*化剂其HLB值常在3~6之间.在制备*状液时,除根据欲得*状液的类型选择*化剂外,所用油相性质不同对*化剂的HLB值也有不同要求,并且,*化剂的HLB值应与被*化的油相所需一致.[4]有一种简单的确定被*化油所需HLB值的方法:目测油滴在不同HLB值*化剂水溶液表面的铺展情况,当*化剂HLB值很大时油完全铺展,随着HLB值减小,铺展变得困难,直至在某一HLB值*化剂溶液上油刚好不展开时,此*化剂的HLB值近似为*化油所需的HLB值.这种方法虽然粗糙,但操作简便,所得结果有一定参考价值.2.2 HLB值与最佳*化剂的选择每种*化剂都有特定的HLB值,单一*化剂往往很难满足由多组分组成的体系的*化要求.通常将多种具有不同HLB值的*化剂混合使用,构成混合*化剂,既可以满足复杂体系的要求,又可以大大增进*化效果.欲*化某一油-水体系,可按如下步骤选择最佳*化剂.油-水体系最佳HLB值的确①定选定一对HLB值相差较大的*化剂,例如,Span-60(HLB=4.3)和Tween-80(HLB=15),按不同比例配制成一系列具有不同HLB值的混合*化剂,用此系列混合*化剂分别将指定的油水体系制成系列*状液,测定各个*状液的*化效率(可用*状液的稳定时间来代表,也可以用其他稳定性质来代表),与计算出的混合*化剂的HLB,作图,可得一钟形曲线,与该曲线最高峰相应的HLB值即为*化指定体系所需的HLB值.显然,利用混合*化剂可得到最适宜的HLB值,但此*化剂未必是效率最佳者.所谓*化剂的效率好是指稳定指定*状液所需*化剂的浓度最低!价格最便宜.价格贵但所需浓度低得多的*化剂也可能比价格便宜!浓度大的*化剂效率高.②*化剂的确定在维持所选定*化体系所需HLB值的前提下,多选几对*化剂混合,使各混合*化剂之HLB值皆为用上述方法确定之值.用这些*化剂*化指定体系,测其稳定性,比较其*化效率,直到找到效率最高的一对*化剂为止.值得注意的是,这里未提及*化剂的浓度,但这并不影响这种选配方法,因为制备一稳定*状液所要求的HLB值与*化剂浓度关系不大.在*状液不稳定区域内,当*化剂浓度很低或内相浓度过高时,才会对本方法有影响.[6]采用HLB方法选择*化剂时,不仅要考虑最佳HLB值,同时还应注意*化剂与分散相和分散介质的亲和性.一个理想的*化剂,不仅要与油相亲和力强,而且也要与水相有较强的亲和力.把HLB值小的*化剂与HLB值大的*化剂混合使用,形成的混合膜与油相和水相都有强的亲和力,可以同时兼顾这两方面的要求.所以,使用混合*化剂比使用单一*化剂效果更好.综上所述,决定指定体系*化所需*化剂配方的方法是:任意选择一对*化剂,在一定范围内改变其混合比例,求得效率最高之HLB值后,改变复配*化剂的种类和比例,但仍需保持此所需HLB值,直至寻得效率最高的复配*化剂.2.3 HLB值与混合*化剂配比在复配*化剂时,采用多少量合适可通过各自的HLB值和指定体系所需的HLB值求得.例如,在进行醋酸乙烯酯的O/W型*液聚合时,*化剂用量为3%,采用SDS和Span-65为*化剂,已知SDS的HLB值为40,Span-65的HLB值为2.1,*液聚合时要求的HLB值平均为16.0.设Span-65在混合*化剂中的质量分数为w%,则40(1-w%)+2.1w%=16,解之得w%=63.3%,则SDS在混合*化剂中的质量分数为36.7%.由此可知,在醋酸乙烯酯的O/W型*液聚合体系中,Span-65的用量占3%*63.3%=1.9%;SDS的用量占3%*(1-63.3%)=1.1%.3结束语在制备稳定*状液时,选择最适合的*化剂以达到最佳*化效果是关键问题.对于*化剂的选择,目前尚没有完善的理论.表面活性剂的HLB值在选择*化剂和确定复合*化剂配比用量方面有很大使用价值,其优点主要体现在它的加和性上,可以简单地进行计算;其问题是没有考虑其他因素对HLB值的影响,尤其是温度的影响,这在近年来用量很大的非离子型*化剂上表现尤为突出.此外,HLB值只能大致预示形成*状液的类型,不能给出最佳*化效果时*化剂浓度,也不能预示所得*状液的稳定性.因此,应用HLB值选择*化剂是一个比较有效的方法,但也有一定的局限性,在实际应用中还需要结合其他方法参照进行.。
基团贡献法及其应用讲解

5.2.2 分子性质与基团元贡献值的关联
分子性质的值与基团元贡献值之间的关联有下列的一些形式:
(1)直接加和法 就是分子性质值直接由各基团的贡献值以及各
种修正项直接加和而得,即 A niai
i
式中A代表分子的某一性质;ni为i基团的数目;ai为i基团的元贡献或 某种修正项。
(2)函数式法 这种关联法将分子的性质A作为某些参数B,
参照基团所在分子的主体结构及其特点将同一基团再加细分 :如: OH基团,在醇与酚中表现出不一样的性质
按照分子的立体构型划定基团 :顺反结构基团
在划分基团时往往把有共轭效应的基团分开:如1,3丁二烯中的C-C键 比没有共轭分子中的C-C键要短一些
同系物的第一化合物常被当作一个基团单独列出:如甲酸与羧基相连 的是氢原子,而醋酸与羧基相连的是碳原子
5.2.3 基团贡献法中的修正项
分子内构型强烈的影响分子性质的值,而采用纯粹由基团 性质的元贡献值加和,往往不能充分反映分子构型的差异 对分子性质影响的大小。除按基团加和外,常常还要加上 一些修正项,这些修正项常见的有:
1)环式构型修正
如环丙烷、环丁烷、环戊烷、环己烷与环庚烷比较: n<6 的环烃每个-CH2-具有不同的燃烧热,n6以后的环烃每个CH2-具有正常和相同的燃烧热。因此估算环状结构的化合 物的性质时常有修正项,尤其是碳数少的环。
同一种键在各种化合物中不但基本保持一定长度,而且,在典型的
键中A-B的距离可以很准确的表示为A-A及B-B距离的算术平均值
(A和B均代表原子,d代表距离)
d AB
1 2
(d
A
A
dBB )
例如(硅晶体中),由此求得
dCC 1.54A,dSiSi 2.34A
用基团贡献法估算聚乙二醇单甲醚-聚乳酸两亲嵌段共聚物的HLB值

用基团贡献法估算聚乙二醇单甲醚-聚乳酸两亲嵌段共聚物的HLB值董亚娟;惠志倩;戎宗明【摘要】采用水数法测定了聚乙二醇单甲醚-聚乳酸两亲嵌段共聚物系列样品的HLB(Hydrophile-Lipophile Balance)值,其数值与分子中亲水基团的体积分数(仇()呈线性变化规律.以Γ-分布概率密度函数描述聚乳酸链中单个聚乳酸链节对HLB的贡献,则聚乳酸链的有效链长可由Γ-分布概率密度函数的积分求得,由此得到了用基团贡献法估算此类共聚物HLB的方法,HLB计算方法的平均绝对误差小于0.97,与其实验测定误差相当,比常用的Griffin方法更为准确.%HLB (Hydrophile-Lipophile Balance) values of methoxy poly (ethylene glycol)-poly (lactic acid) (mPEG-PLA) samples were measured by water number method.A linear relationship was showed between the HLB values and the volume fraction of mPEG (ψEO) in its molecule.The Gamma probability density function (PDF) was used to describe the contribution of single PLA group to HLB,and the effective chain length of PLA chain could be calculated by integrating Gamma PDF.Therefore,HLB of mPEG-PLA can be estimated by group contribution method,and the average absolute error is less than 0.97,which is better than the results calculated by Griffin's method.【期刊名称】《华东理工大学学报(自然科学版)》【年(卷),期】2017(043)005【总页数】7页(P640-646)【关键词】亲水-亲油平衡;基团贡献法;有效链长;聚乳酸;聚乙二醇单甲醚-聚乳酸【作者】董亚娟;惠志倩;戎宗明【作者单位】华东理工大学化学与分子工程学院,上海200237;通标标准技术服务(上海)有限公司,上海200233;华东理工大学化学与分子工程学院,上海200237【正文语种】中文【中图分类】O631自1949年Griffin[1-2]提出亲水-亲油平衡(Hydrophile-Lipophile Balance,HLB)概念以来,HLB值一直是表面活性剂的一个重要性质[3],其在乳液制备[4]、原油脱盐[5]、乳化燃油[6]和新材料研制[7]等诸多方面有着广泛的应用。
表面活性剂HLB值计算方法

.2 HLB值的计算(1)Griffin关系式测定HLB值的方法最早由Griffin提出,该法繁琐且耗时[3].后来Griffin提出用下列经验式计算某些非离子型表面活性剂的HLB值.质量百分数法(基团重量法)对于有聚氧乙烯基类和多元醇类的非离子型表面活性剂:HLB=20*MH/M.式中,MH 为亲水基部分的分子量,M为总的分子量.皂化值法对于多数多元醇的脂肪酸酯类表面活性剂[3]:HLB=20(1-S/A).其中S代表表面活性剂(多元醇酯)的皂化值(又称皂化数),A代表成酯的脂肪酸的酸值.对于皂化值不易测定的多元醇乙氧基化合物:HLB=(E+P)/5.式中E为表面活性剂的亲水部分,即乙氧基(C2H4O)的质量分数,P为多元醇的质量分数.皂化值不清的脂肪酸酯如妥尔油!松香酸酯!蜂蜡酯及羊毛酯等的HLB值都可以由上式求算.对于只用乙氧基(C2H4O)为亲水部分的表面活性剂和脂肪醇与C2H4O的聚合体,上式简化为:HLB=E/5.混合表面活性剂的HLB值具有加和性.A,B两种表面活性剂混合之后的HLB值为:HLB=HLBA*A%+HLBB*B%.(2)J.T.Davies关系式基团数法:1957年Davies提出将表面活性剂分子分解为不同的基团,这些基团各自对HLB有一定的贡献:HLB=7+Σ(亲水基的基数)+Σ(亲油基的基数).该方法适用于计算阴离子型表面活性剂和非离子型表表面活性剂的HLB与其在油水两相中的平衡浓度有关[4]:HLB-7=0.36ln(cW/cO)式中cW为表面活性剂在水相中的平衡浓度,cO为表面活性剂在油相中的平衡浓度,cW/cO为表面活性剂在两相中的分配系数.(3)无机性基团贡献法:把表面活性剂划分为有机性基团(一般疏水)和无机性20,据此得到表面活性剂分子中各基团的无机性!有机性贡献值.HLB=(E无机性基团值/E有机性基团值)@10(4)估算法利用表面活性剂在水中的溶解情况可以估计该表面活性剂的HLB值范围(见表1).水溶液外观不分散不良分散搅拌后*状分散稳定*状分散半透明至透明透明液HLB值1~4 3~6 6~8 8~10 10~13 13~20(5)HLB值的实验测定和计算①气相色谱法气相色谱固定液分离样品的能力取决于固定液与样品中各组分的极性.据此,用表面活性剂做固定液,选择其他流动相可测定HLB.Beche和Birkmeier,以乙醇和乙烷混合物为流动相,表面活性剂为固定相进行测定,结果表明,乙醇与乙烷的保留时间比与HLB成直线关系:HLB=8.55ρ-6.36.*化剂载体的极性定义是二组分的保留时间比ρ: ρ=REtOH/RHex.其中,REtOH为乙醇的保留时间,RHex为乙烷的保留时间.当*化剂含有较多的自由多元醇组分时直线关系须做校正.保留时间比值随温度而改变,一般采用折中温度80度,在此温度下,大部分非离子*化剂为液体.②水数法聚氧乙烯型非离子表面活性剂的HLB与水数有一定关系:HLB=algW+b式中,a,b 为常数,W为水数!单位为mL.所谓水数是指以体积比为96%和4%的二氧杂环乙烷和苯胺混合物溶解样品,然后用水滴定至混浊所用水的数量.③对数法*化剂的亲水亲油平衡值与其亲水!疏水基团的重量比的对数有关:HLB=7+11.7lgWL/WO.其中WL,WO分别为*化剂分子中亲水!疏水基团的重量.测定HLB值的方法还有很多,测定及计算时所用的实验方法和所依据的关系式均有一定的使用范围,如果不适当地套用某一方法,则有时误差很大.2*化剂的选择和混合*化剂配方现适用于选择*化剂的方法主要有两种:HLB法(亲水亲油平衡法)和PIT法(相转变温度法).前者适用于各种类型表面活性剂,后者是对前一方法的补充,只适用于非离子型表面活性剂.2.1 HLB值与*化剂筛选一个具体的油-水体系究竟选用哪种*化剂才可以得到性能最佳的*状液,这是制备*状液的关键.最可*的方法是通过实验筛选,HLB值有助于筛选工作.通过实验发现,作为O/W型(水包油型)*状液的*化剂其HLB值常在8~18之间;作为W/O型(油包水型)*状液的*化剂其HLB值常在3~6之间.在制备*状液时,除根据欲得*状液的类型选择*化剂外,所用油相性质不同对*化剂的HLB值也有不同要求,并且,*化剂的HLB值应与被*化的油相所需一致.[4]有一种简单的确定被*化油所需HLB值的方法:目测油滴在不同HLB值*化剂水溶液表面的铺展情况,当*化剂HLB值很大时油完全铺展,随着HLB值减小,铺展变得困难,直至在某一HLB值*化剂溶液上油刚好不展开时,此*化剂的HLB值近似为*化油所需的HLB值.这种方法虽然粗糙,但操作简便,所得结果有一定参考价值.2.2 HLB值与最佳*化剂的选择每种*化剂都有特定的HLB值,单一*化剂往往很难满足由多组分组成的体系的*化要求.通常将多种具有不同HLB值的*化剂混合使用,构成混合*化剂,既可以满足复杂体系的要求,又可以大大增进*化效果.欲*化某一油-水体系,可按如下步骤选择最佳*化剂.油-水体系最佳HLB值的确①定选定一对HLB值相差较大的*化剂,例如,Span-60(HLB=4.3)和Tween-80(HLB=15),按不同比例配制成一系列具有不同HLB值的混合*化剂,用此系列混合*化剂分别将指定的油水体系制成系列*状液,测定各个*状液的*化效率(可用*状液的稳定时间来代表,也可以用其他稳定性质来代表),与计算出的混合*化剂的HLB,作图,可得一钟形曲线,与该曲线最高峰相应的HLB值即为*化指定体系所需的HLB值.显然,利用混合*化剂可得到最适宜的HLB值,但此*化剂未必是效率最佳者.所谓*化剂的效率好是指稳定指定*状液所需*化剂的浓度最低!价格最便宜.价格贵但所需浓度低得多的*化剂也可能比价格便宜!浓度大的*化剂效率高.②*化剂的确定在维持所选定*化体系所需HLB值的前提下,多选几对*化剂混合,使各混合*化剂之HLB值皆为用上述方法确定之值.用这些*化剂*化指定体系,测其稳定性,比较其*化效率,直到找到效率最高的一对*化剂为止.值得注意的是,这里未提及*化剂的浓度,但这并不影响这种选配方法,因为制备一稳定*状液所要求的HLB值与*化剂浓度关系不大.在*状液不稳定区域内,当*化剂浓度很低或内相浓度过高时,才会对本方法有影响.[6]采用HLB方法选择*化剂时,不仅要考虑最佳HLB值,同时还应注意*化剂与分散相和分散介质的亲和性.一个理想的*化剂,不仅要与油相亲和力强,而且也要与水相有较强的亲和力.把HLB值小的*化剂与HLB值大的*化剂混合使用,形成的混合膜与油相和水相都有强的亲和力,可以同时兼顾这两方面的要求.所以,使用混合*化剂比使用单一*化剂效果更好.综上所述,决定指定体系*化所需*化剂配方的方法是:任意选择一对*化剂,在一定范围内改变其混合比例,求得效率最高之HLB值后,改变复配*化剂的种类和比例,但仍需保持此所需HLB值,直至寻得效率最高的复配*化剂.2.3 HLB值与混合*化剂配比在复配*化剂时,采用多少量合适可通过各自的HLB值和指定体系所需的HLB值求得.例如,在进行醋酸乙烯酯的O/W型*液聚合时,*化剂用量为3%,采用SDS和Span-65为*化剂,已知SDS的HLB值为40,Span-65的HLB值为2.1,*液聚合时要求的HLB值平均为16.0.设Span-65在混合*化剂中的质量分数为w%,则40(1-w%)+2.1w%=16,解之得w%=63.3%,则SDS在混合*化剂中的质量分数为36.7%.由此可知,在醋酸乙烯酯的O/W型*液聚合体系中,Span-65的用量占3%*63.3%=1.9%;SDS的用量占3%*(1-63.3%)=1.1%.3结束语在制备稳定*状液时,选择最适合的*化剂以达到最佳*化效果是关键问题.对于*化剂的选择,目前尚没有完善的理论.表面活性剂的HLB值在选择*化剂和确定复合*化剂配比用量方面有很大使用价值,其优点主要体现在它的加和性上,可以简单地进行计算;其问题是没有考虑其他因素对HLB值的影响,尤其是温度的影响,这在近年来用量很大的非离子型*化剂上表现尤为突出.此外,HLB值只能大致预示形成*状液的类型,不能给出最佳*化效果时*化剂浓度,也不能预示所得*状液的稳定性.因此,应用HLB值选择*化剂是一个比较有效的方法,但也有一定的局限性,在实际应用中还需要结合其他方法参照进行.。
UNIFAC基团贡献法预测混合制冷剂的气液相平衡

( 3) ( 4) ( 5)
s
式中
f si =Leabharlann p si( p - p si ) V i PO Y = ex p RT
式中
对纯液体 i , p i 是饱和蒸气压 ; f i 是饱和状
s
态下 的 逸 度 ; V i 是 液 体 的 体 积, 由 Yen and Wo ods 关联式 [ 5] 得到 , 以上均为在温度 T 下的值 . U NIF AC 基团贡献法活度因子的算法如下
( 1 上海冷气机厂 , 上海 200070 ;
2
上海理工大学热工程研究所 , 上海 200093)
摘要 : 将 U N IFA C 基团贡 献法成功地应用于 HF Cs 混合制冷剂的 气液相平衡热力学 性质的预测 . 根据资料 拟合 得到了 CH 2 、 CF2 、 F 三 个主基团的 相互作 用参 数 , 用拟合 的基 团相 互作 用参 数预 测了 新工 质对 R32/ R227ea、 R227ea/ R 134a 和 R152a/ R227ea 及三 元混合制冷剂 R32/ R125/ R134a 的气 液相平衡数据 , 并与实 验进行了对比 , 两者基本吻合 . 本工作为今后 H FCs 混合制冷剂替代和制 冷系统 研究提 供了极 有推广 价值的物 性计算 方法和 数 据 , 满足了新工质工程设计的要求 . 关键词 : U NI FA C; 基团贡献 法 ; 气液 相平衡 ; 混合制冷剂 ; 新工质 中图分类号 : T Q 015 文献标识码 : A 文 章编号 : 0438- 1157 ( 2005) 10- 1832- 05
E stimation of refrig erant mixture phase equilibrium w ith U N IFA C model
基团贡献方法

基团贡献方法(UNIFAC)估算局部组成模型(NRTL\WILSON\UNIQUAC)的二元参数结合海友的问题给出详细步骤:/thread-581160-1-1.html海友的问题:在模拟时,选用NRTL热力学方法时,二元交互作用参数中没有丙酮和2-甲基戊烷,但在文献中说二者能共沸,常压下组成为丙酮:44%,2-甲基戊烷:56%(质量分数),共沸温度为47摄氏度。
请教高手,如何在ASPEN中设置?第一步:打开A+,选择模板,General with Metric Units;Run Type选择Property Estimation;点确定。
第二步:Setup→Specifications→Global。
Title 需输入;单位选择METCBAR,方便后续温度单位默认℃输入。
第三步:Components→selection→Define components 输入丙酮、2-甲基戊烷。
第四步:Properties→Estimation→Input→Setup→Estimation options→Estimate only the selected parameters→只勾选Binary interaction parameters。
第五步:在Binary对话框中,点击New, Parameter选择NRTL, Method选择UNIF-DMD,Component i 选择丙酮,Component j 选择2-甲基戊烷。
在Temperature中输入多个温度点。
温度范围最好包括两物质的沸点,这点很重要,影响二元参数的准确度。
在这里输入25、30、35、40、45、50、55、60、65共9个温度点。
第六步:Run,查看Results。
运行后,NRTL参数自动保存在NRTL二元相互作用参数中。
第七步:利用该二元交互参数分析其共沸。
首先,将Run Type 改回Flowsheet模式第八步:Tools→Analysis→Properties→Binary,Analysis 选择Txy,Basis选择Mass fraction,点击Go。
基团贡献法估算氯代化合物正辛醇-水分配系数

基团贡献法估算氯代化合物正辛醇-水分配系数氯代化合物正辛醇-水分配系数是指沉淀物中氯代化合物在水和正辛醇组合物中的分配比率,这也是一种药物不同组分之间的质量比。
引入基团贡献法估算氯代化合物正辛醇-水分配系数的方法,主要基于传统热力学原理和理论,通过研究分子内部不同基团各自对分配系数的贡献程度,进而定量地评估比配系数。
一、氯代化合物正辛醇-水分配系数估算方法1、计算不同基团的活化能采用基团贡献法求解氯代化合物正辛醇-水分配系数,第一步是求解分子各基团的活化能。
通过对含有内部基团的不同分子的活化能的比较,得出分子各基团的活化能值。
2、计算基团贡献系数通过不同基团的活化能比较,可以得到各基团的贡献系数,即分子内部基团贡献系数。
根据所求所得基团贡献系数,则可以进行下一步估算正辛醇-水分配系数的计算工作。
3、求解氯代化合物正辛醇-水分配系数根据前一步的基团贡献系数,可以利用热力学原理来求解正辛醇-水分配系数。
利用热力学原理,当溶液系统处于热力平衡状态时,各物质之间的相对比例或比配系数和其内部能量、势能等有关,贡献系数值越大,内部能量、势能越高,比配系数越大。
因此,可以根据各基团贡献系数,利用相关热力学原理,求解氯代化合物正辛醇-水分配系数的值。
二、优缺点1、优点:(1) 基团贡献法估算氯代化合物正辛醇-水分配系数的方法,基于传统的热力学原理,将分子内部基团的活化能相关的贡献程度结合分配系数,进行定量的评估;(2)此估算方法简单易行,计算结果能够较准确地反映氯代化合物正辛醇-水分配系数;2、缺点:此法给出的氯代化合物正辛醇-水分配系数仅能反映水溶液系统处于热力平衡状态时的分配比,不能够反映真实溶液系统,其结果相对准确度降低。
表面活性剂HLB值计算方法

表面活性剂H L B值计算方法Document number:NOCG-YUNOO-BUYTT-UU986-1986UT.2HLB值的计算(1)Griffin关系式测定HLB值的方法最早由Griffin提出,该法繁琐且耗时[3].后来Griffin提出用下列经验式计算某些非离子型表面活性剂的HLB值.质量百分数法(基团重量法)对于有聚氧乙烯基类和多元醇类的非离子型表面活性剂:HLB=20*MH/M.式中,MH 为亲水基部分的分子量,M为总的分子量.皂化值法对于多数多元醇的脂肪酸酯类表面活性剂[3]:HLB=20(1-S/A).其中S代表表面活性剂(多元醇酯)的皂化值(又称皂化数),A代表成酯的脂肪酸的酸值.对于皂化值不易测定的多元醇乙氧基化合物:HLB=(E+P)/5.式中E为表面活性剂的亲水部分,即乙氧基(C2H4O)的质量分数,P为多元醇的质量分数.皂化值不清的脂肪酸酯如妥尔油!松香酸酯!蜂蜡酯及羊毛酯等的HLB值都可以由上式求算.对于只用乙氧基(C2H4O)为亲水部分的表面活性剂和脂肪醇与C2H4O的聚合体,上式简化为:HLB=E/5.混合表面活性剂的HLB值具有加和性.A,B两种表面活性剂混合之后的HLB值为:HLB=HLBA*A%+HLBB*B%.基团数法:1957年Davies提出将表面活性剂分子分解为不同的基团,这些基团各自对HLB有一定的贡献:H LB=7+Σ(亲水基的基数)+Σ(亲油基的基数).该方法适用于计算阴离子型表面活性剂和非离子型表表面活性剂的HLB与其在油水两相中的平衡浓度有关[4]:HLB-7=(cW/cO)式中cW为表面活性剂在水相中的平衡浓度,cO为表面活性剂在油相中的平衡浓度,cW/cO为表面活性剂在两相中的分配系数.(3)无机性基团贡献法:把表面活性剂划分为有机性基团(一般疏水)和无机性20,据此得到表面活性剂分子中各基团的无机性!有机性贡献值.HLB=(E无机性基团值/E有机性基团值)@10(4)估算法利用表面活性剂在水中的溶解情况可以估计该表面活性剂的HLB值范围(见表1).水溶液外观不分散不良分散搅拌后*状分散稳定*状分散半透明至透明透明液HLB值1~43~66~88~1010~1313~20(5)HLB值的实验测定和计算①气相色谱法气相色谱固定液分离样品的能力取决于固定液与样品中各组分的极性.据此,用表面活性剂做固定液,选择其他流动相可测定和Birkmeier,以乙醇和乙烷混合物为流动相,表面活性剂为固定相进行测定,结果表明,乙醇与乙烷的保留时间比与HLB成直线关系:HLB=ρ.*化剂载体的极性定义是二组分的保留时间比ρ:ρ=REtOH/RHex.其中,REtOH为乙醇的保留时间,RHex为乙烷的保留时间.当*化剂含有较多的自由多元醇组分时直线关系须做校正.保留时间比值随温度而改变,一般采用折中温度80度,在此温度下,大部分非离子*化剂为液体.②水数法聚氧乙烯型非离子表面活性剂的HLB与水数有一定关系:HLB=algW+b式中,a,b 为常数,W为水数!单位为mL.所谓水数是指以体积比为96%和4%的二氧杂环乙烷和苯胺混合物溶解样品,然后用水滴定至混浊所用水的数量.③对数法*化剂的亲水亲油平衡值与其亲水!疏水基团的重量比的对数有关:HLB=7+WO.其中WL,WO分别为*化剂分子中亲水!疏水基团的重量.测定HLB值的方法还有很多,测定及计算时所用的实验方法和所依据的关系式均有一定的使用范围,如果不适当地套用某一方法,则有时误差很大.?2*化剂的选择和混合*化剂配方现适用于选择*化剂的方法主要有两种:HLB法(亲水亲油平衡法)和PIT法(相转变温度法).前者适用于各种类型表面活性剂,后者是对前一方法的补充,只适用于非离子型表面活性剂.值与*化剂筛选一个具体的油-水体系究竟选用哪种*化剂才可以得到性能最佳的*状液,这是制备*状液的关键.最可*的方法是通过实验筛选,HLB值有助于筛选工作.通过实验发现,作为O/W型(水包油型)*状液的*化剂其HLB值常在8~18之间;作为W/O型(油包水型)*状液的*化剂其HLB值常在3~6之间.在制备*状液时,除根据欲得*状液的类型选择*化剂外,所用油相性质不同对*化剂的HLB值也有不同要求,并且,*化剂的HLB值应与被*化的油相所需一致.[4]有一种简单的确定被*化油所需HLB值的方法:目测油滴在不同HLB值*化剂水溶液表面的铺展情况,当*化剂HLB值很大时油完全铺展,随着HLB值减小,铺展变得困难,直至在某一HLB值*化剂溶液上油刚好不展开时,此*化剂的HLB值近似为*化油所需的HLB值.这种方法虽然粗糙,但操作简便,所得结果有一定参考价值.值与最佳*化剂的选择每种*化剂都有特定的HLB值,单一*化剂往往很难满足由多组分组成的体系的*化要求.通常将多种具有不同HLB值的*化剂混合使用,构成混合*化剂,既可以满足复杂体系的要求,又可以大大增进*化效果.欲*化某一油-水体系,可按如下步骤选择最佳*化剂.油-水体系最佳HLB值的确①定选定一对HLB值相差较大的*化剂,例如,Span-60(HLB=和Tween-80(HLB=15),按不同比例配制成一系列具有不同HLB值的混合*化剂,用此系列混合*化剂分别将指定的油水体系制成系列*状液,测定各个*状液的*化效率(可用*状液的稳定时间来代表,也可以用其他稳定性质来代表),与计算出的混合*化剂的HLB,作图,可得一钟形曲线,与该曲线最高峰相应的HLB值即为*化指定体系所需的HLB值.显然,利用混合*化剂可得到最适宜的HLB值,但此*化剂未必是效率最佳者.所谓*化剂的效率好是指稳定指定*状液所需*化剂的浓度最低!价格最便宜.价格贵但所需浓度低得多的*化剂也可能比价格便宜!浓度大的*化剂效率高.②*化剂的确定在维持所选定*化体系所需HLB值的前提下,多选几对*化剂混合,使各混合*化剂之HLB值皆为用上述方法确定之值.用这些*化剂*化指定体系,测其稳定性,比较其*化效率,直到找到效率最高的一对*化剂为止.值得注意的是,这里未提及*化剂的浓度,但这并不影响这种选配方法,因为制备一稳定*状液所要求的HLB值与*化剂浓度关系不大.在*状液不稳定区域内,当*化剂浓度很低或内相浓度过高时,才会对本方法有影响.[6]采用HLB方法选择*化剂时,不仅要考虑最佳HLB值,同时还应注意*化剂与分散相和分散介质的亲和性.一个理想的*化剂,不仅要与油相亲和力强,而且也要与水相有较强的亲和力.把HLB值小的*化剂与HLB值大的*化剂混合使用,形成的混合膜与油相和水相都有强的亲和力,可以同时兼顾这两方面的要求.所以,使用混合*化剂比使用单一*化剂效果更好.综上所述,决定指定体系*化所需*化剂配方的方法是:任意选择一对*化剂,在一定范围内改变其混合比例,求得效率最高之HLB值后,改变复配*化剂的种类和比例,但仍需保持此所需HLB值,直至寻得效率最高的复配*化剂.值与混合*化剂配比在复配*化剂时,采用多少量合适可通过各自的HLB值和指定体系所需的HLB 值求得.例如,在进行醋酸乙烯酯的O/W型*液聚合时,*化剂用量为3%,采用SDS 和Span-65为*化剂,已知SDS的HLB值为40,Span-65的HLB值为,*液聚合时要求的HLB值平均为.设Span-65在混合*化剂中的质量分数为w%,则40(1-w%)+%=16,解之得w%=%,则SDS在混合*化剂中的质量分数为%.由此可知,在醋酸乙烯酯的O/W型*液聚合体系中,Span-65的用量占3%*%=%;SDS的用量占3%*%)=%.3结束语在制备稳定*状液时,选择最适合的*化剂以达到最佳*化效果是关键问题.对于*化剂的选择,目前尚没有完善的理论.表面活性剂的HLB值在选择*化剂和确定复合*化剂配比用量方面有很大使用价值,其优点主要体现在它的加和性上,可以简单地进行计算;其问题是没有考虑其他因素对HLB值的影响,尤其是温度的影响,这在近年来用量很大的非离子型*化剂上表现尤为突出.此外,HLB值只能大致预示形成*状液的类型,不能给出最佳*化效果时*化剂浓度,也不能预示所得*状液的稳定性.因此,应用HLB值选择*化剂是一个比较有效的方法,但也有一定的局限性,在实际应用中还需要结合其他方法参照进行.。
《绿色化学》试卷及答案

《绿色化学》试卷及答案《绿色化学》试卷及答案2010-08-13 08:42一、简答(30)原子利用率和原子经济性,基团贡献法,亲电性物质,光化学污染的化学本质,实现化工过程强化的主要方法,可生物降解的化学结构,Ι相反应和Ⅱ相反应。
二、用实例说明什么是电子等排物,电子等排物在安全化学品设计和绿色化学过程设计中的意义。
(10)三、举例说明绿色化学的主要研究领域(18)四、工业上生产苯胺采用的苯为原料,即苯先硝化再还原得到苯胺。
1、写出该过程的化学计量关系式和反应条件。
2、计算该方法的原子利用率,用绿色化学观点分析该过程的不足。
3、设计一条新的更接近绿色化学目标的苯胺合成路线。
4、分析你设计的过程的热力学可行性及其绿色化学优点。
为了实现你设计的过程,应从哪几个方面考虑设计相应催化剂。
(本题共22)五、举例说明催化剂在化学反应中的作用及催化科学与技术对绿色化学发展的重要作用。
(15)六、我看绿色化学(写出自己的观点和评价,也可以写出对课程的建议)(5)参考答案一、简答1.原子利用率和原子经济性:原子利用率:即在化学反应中有多少反应物的原子转变到了目标产物中。
可以用下式定义:原子利用率=(目标产物的量/按化学计量式所得说有产物的量之和)*100%=(目标产物的量/各反应物的量之和)*100%3原子经济性:原子经济性(Atom Economny)是指反应物重的原子有多少进入了产物,一个理想的原子经济性的反应就是反应物中的所有原子都进入了目标产物的反应,也就是原子利用率为100%反应。
3 2.基团贡献法:基团贡献法(Grup Contribution Method)模型又称为碎片贡献法(Fragments Contribution Method)模型,是定量-活性关系中使用最广的方法之一,根据Langmur的独立作用原理建立起来的。
基本假定是:我们感兴趣的某一活性是组成分子的1个或n个碎片或二级结构的贡献或贡献之和,而同一碎片能作出的贡献在不同化合物中是相同的,与它所处的化合物无关。
环境热力学第7章基团贡献法.ppt

Tc Tb 0.584 0.965 niTci
ni Tci
2 1
2
pc 0.113 0.0032nA ni pi 0.1
Vc 40 niVci
方法缺点:未考虑邻近基团影响,特别是-F、-Cl基团简单加和。
Constantinous-Gani法(C-G法)估算Tb 和临界性质
基团法介绍
• 乙烷 CH3-CH3
基团 2个 CH3
• 丙烷 CH3-CH2-CH3
基团 CH2
基团 2个 CH3+1个CH2
• 异丙烷 CH3-CH-CH3 CH3
基团 2个CH3+1个CH
基团 CH
基团法特点
一些基团法不依赖于任何其他物性,但有的 基团法关系式中需要其他物性参数。 如:计算临界温度Tc时,需要引入沸点Tb值; 在估算相平衡时,要引入表面积参数和体积 参数等微观参数。
化工数据估算的要求
误差小,同时要注意不同物性项目对误差要求不同; 尽量少用其他物性参数 计算过程或估算方程不要太复杂 估算方法要尽可能具有通用性,特别是关注对极性
化合物使用的可能性。 具有理论基础的方法常常有更好的发展前景。
估算方法
每项物性有各自的多种估算方法; 同一类型的估算方法又用于不同的物性项; 目前,实用的估算方法主要是对应状态法和基团
Tb 204.359 ln niTbi njTbj
Tc 181.728 ln niTci njTcj 2
pc 0.13705 0.1 0.100220 nipci njpcj
Vc 4.350 ln niVci njVcj
40年代起,开始修正临近基团的影响。 基团法从估算固定温度点开始,经过发展,目前基团法已经
表面活性剂HLB值计算方法

.2 HLB值的计算(1)Griffin关系式测定HLB值的方法最早由Griffin提出,该法繁琐且耗时[3].后来Griffin提出用下列经验式计算某些非离子型表面活性剂的HLB值.质量百分数法(基团重量法)对于有聚氧乙烯基类和多元醇类的非离子型表面活性剂:HLB=20*MH/M.式中,MH 为亲水基部分的分子量,M为总的分子量.皂化值法对于多数多元醇的脂肪酸酯类表面活性剂[3]:HLB=20(1-S/A).其中S代表表面活性剂(多元醇酯)的皂化值(又称皂化数),A代表成酯的脂肪酸的酸值.对于皂化值不易测定的多元醇乙氧基化合物:HLB=(E+P)/5.式中E为表面活性剂的亲水部分,即乙氧基(C2H4O)的质量分数,P为多元醇的质量分数.皂化值不清的脂肪酸酯如妥尔油!松香酸酯!蜂蜡酯及羊毛酯等的HLB值都可以由上式求算.对于只用乙氧基(C2H4O)为亲水部分的表面活性剂和脂肪醇与C2H4O的聚合体,上式简化为:HLB=E/5.混合表面活性剂的HLB值具有加和性.A,B两种表面活性剂混合之后的HLB值为:HLB=HLBA*A%+HLBB*B%.(2)J.T.Davies关系式基团数法:1957年Davies提出将表面活性剂分子分解为不同的基团,这些基团各自对HLB有一定的贡献:HLB=7+Σ(亲水基的基数)+Σ(亲油基的基数).该方法适用于计算阴离子型表面活性剂和非离子型表表面活性剂的HLB与其在油水两相中的平衡浓度有关[4]:HLB-7=0.36ln(cW/cO)式中cW为表面活性剂在水相中的平衡浓度,cO为表面活性剂在油相中的平衡浓度,cW/cO为表面活性剂在两相中的分配系数.(3)无机性基团贡献法:把表面活性剂划分为有机性基团(一般疏水)和无机性20,据此得到表面活性剂分子中各基团的无机性!有机性贡献值.HLB=(E无机性基团值/E有机性基团值)@10(4)估算法利用表面活性剂在水中的溶解情况可以估计该表面活性剂的HLB值范围(见表1).水溶液外观不分散不良分散搅拌后*状分散稳定*状分散半透明至透明透明液HLB值1~4 3~6 6~8 8~10 10~13 13~20 (5)HLB值的实验测定和计算①气相色谱法气相色谱固定液分离样品的能力取决于固定液与样品中各组分的极性.据此,用表面活性剂做固定液,选择其他流动相可测定HLB.Beche和Birkmeier,以乙醇和乙烷混合物为流动相,表面活性剂为固定相进行测定,结果表明,乙醇与乙烷的保留时间比与HLB成直线关系:HLB=8.55ρ-6.36.*化剂载体的极性定义是二组分的保留时间比ρ: ρ=REtOH/RHex.其中,REtOH为乙醇的保留时间,RHex为乙烷的保留时间.当*化剂含有较多的自由多元醇组分时直线关系须做校正.保留时间比值随温度而改变,一般采用折中温度80度,在此温度下,大部分非离子*化剂为液体.②水数法聚氧乙烯型非离子表面活性剂的HLB与水数有一定关系:HLB=algW+b式中,a,b 为常数,W为水数!单位为mL.所谓水数是指以体积比为96%和4%的二氧杂环乙烷和苯胺混合物溶解样品,然后用水滴定至混浊所用水的数量.③对数法*化剂的亲水亲油平衡值与其亲水!疏水基团的重量比的对数有关:HLB=7+11.7lgWL/WO.其中WL,WO分别为*化剂分子中亲水!疏水基团的重量.测定HLB值的方法还有很多,测定及计算时所用的实验方法和所依据的关系式均有一定的使用范围,如果不适当地套用某一方法,则有时误差很大.2*化剂的选择和混合*化剂配方现适用于选择*化剂的方法主要有两种:HLB法(亲水亲油平衡法)和PIT法(相转变温度法).前者适用于各种类型表面活性剂,后者是对前一方法的补充,只适用于非离子型表面活性剂.2.1 HLB值与*化剂筛选一个具体的油-水体系究竟选用哪种*化剂才可以得到性能最佳的*状液,这是制备*状液的关键.最可*的方法是通过实验筛选,HLB值有助于筛选工作.通过实验发现,作为O/W型(水包油型)*状液的*化剂其HLB值常在8~18之间;作为W/O 型(油包水型)*状液的*化剂其HLB值常在3~6之间.在制备*状液时,除根据欲得*状液的类型选择*化剂外,所用油相性质不同对*化剂的HLB值也有不同要求,并且,*化剂的HLB值应与被*化的油相所需一致.[4]有一种简单的确定被*化油所需HLB值的方法:目测油滴在不同HLB值*化剂水溶液表面的铺展情况,当*化剂HLB值很大时油完全铺展,随着HLB值减小,铺展变得困难,直至在某一HLB值*化剂溶液上油刚好不展开时,此*化剂的HLB值近似为*化油所需的HLB值.这种方法虽然粗糙,但操作简便,所得结果有一定参考价值.2.2 HLB值与最佳*化剂的选择每种*化剂都有特定的HLB值,单一*化剂往往很难满足由多组分组成的体系的*化要求.通常将多种具有不同HLB值的*化剂混合使用,构成混合*化剂,既可以满足复杂体系的要求,又可以大大增进*化效果.欲*化某一油-水体系,可按如下步骤选择最佳*化剂.油-水体系最佳HLB值的确①定选定一对HLB值相差较大的*化剂,例如,Span-60(HLB=4.3)和Tween-80(HLB=15),按不同比例配制成一系列具有不同HLB值的混合*化剂,用此系列混合*化剂分别将指定的油水体系制成系列*状液,测定各个*状液的*化效率(可用*状液的稳定时间来代表,也可以用其他稳定性质来代表),与计算出的混合*化剂的HLB,作图,可得一钟形曲线,与该曲线最高峰相应的HLB值即为*化指定体系所需的HLB值.显然,利用混合*化剂可得到最适宜的HLB值,但此*化剂未必是效率最佳者.所谓*化剂的效率好是指稳定指定*状液所需*化剂的浓度最低!价格最便宜.价格贵但所需浓度低得多的*化剂也可能比价格便宜!浓度大的*化剂效率高.②*化剂的确定在维持所选定*化体系所需HLB值的前提下,多选几对*化剂混合,使各混合*化剂之HLB值皆为用上述方法确定之值.用这些*化剂*化指定体系,测其稳定性,比较其*化效率,直到找到效率最高的一对*化剂为止.值得注意的是,这里未提及*化剂的浓度,但这并不影响这种选配方法,因为制备一稳定*状液所要求的HLB值与*化剂浓度关系不大.在*状液不稳定区域内,当*化剂浓度很低或内相浓度过高时,才会对本方法有影响.[6]采用HLB方法选择*化剂时,不仅要考虑最佳HLB值,同时还应注意*化剂与分散相和分散介质的亲和性.一个理想的*化剂,不仅要与油相亲和力强,而且也要与水相有较强的亲和力.把HLB值小的*化剂与HLB值大的*化剂混合使用,形成的混合膜与油相和水相都有强的亲和力,可以同时兼顾这两方面的要求.所以,使用混合*化剂比使用单一*化剂效果更好.综上所述,决定指定体系*化所需*化剂配方的方法是:任意选择一对*化剂,在一定范围内改变其混合比例,求得效率最高之HLB值后,改变复配*化剂的种类和比例,但仍需保持此所需HLB值,直至寻得效率最高的复配*化剂.2.3 HLB值与混合*化剂配比在复配*化剂时,采用多少量合适可通过各自的HLB值和指定体系所需的HLB值求得.例如,在进行醋酸乙烯酯的O/W型*液聚合时,*化剂用量为3%,采用SDS和Span-65为*化剂,已知SDS的HLB值为40,Span-65的HLB值为2.1,*液聚合时要求的HLB值平均为16.0.设Span-65在混合*化剂中的质量分数为w%,则40(1-w%)+2.1w%=16,解之得w%=63.3%,则SDS在混合*化剂中的质量分数为36.7%.由此可知,在醋酸乙烯酯的O/W型*液聚合体系中,Span-65的用量占3%*63.3%=1.9%;SDS的用量占3%*(1-63.3%)=1.1%.3结束语在制备稳定*状液时,选择最适合的*化剂以达到最佳*化效果是关键问题.对于*化剂的选择,目前尚没有完善的理论.表面活性剂的HLB值在选择*化剂和确定复合*化剂配比用量方面有很大使用价值,其优点主要体现在它的加和性上,可以简单地进行计算;其问题是没有考虑其他因素对HLB值的影响,尤其是温度的影响,这在近年来用量很大的非离子型*化剂上表现尤为突出.此外,HLB值只能大致预示形成*状液的类型,不能给出最佳*化效果时*化剂浓度,也不能预示所得*状液的稳定性.因此,应用HLB值选择*化剂是一个比较有效的方法,但也有一定的局限性,在实际应用中还需要结合其他方法参照进行.友情提示:方案范本是经验性极强的领域,本范文无法思考和涵盖全面,供参考!最好找专业人士起草或审核后使用。
合成段能量衡算Microsoft Office Word 文档

能量衡算2000吨/年功能药物蔗渣木聚糖硫酸酯工厂设计桂林理工大学绿意飞翔参赛队第1章 各物质比热容的估算物质比热容的计算是能量衡算的基础,在能量衡算的过程中需要用到许多物质的比热容,以下是几种比热容计算方法的介绍。
1.1 柯柏(KOPP )法则对20℃或接近20℃的固体,其热容可用柯柏(KOPP )法则近似估算。
按照柯柏(KOPP )法则,化合物在20℃时的摩尔热容spm C 约等于组成该化合物各原子的原子摩尔热容()pm e C 的总和:()spm e pm e eC N C =∑式中e N 为化合物分子中e 元素原子的数目。
故固体化合物的比热容sp C 可按下式进行近似计算:()1sp e pm eerC N C M =∑式中:r M ------化合物的千摩尔质量,kg/kmol 。
()pm e C ------e 原子的摩尔热容,J/(mol·K)。
原子摩尔热容表注:表中其他指固体金属元素1.1.1 木聚糖(BX )摩尔热容计算BX 分子式为()584n C H O[5()8()4()](57.53689.630416.474)180.616180.616 1.377/(.)(51281416)s pm pm C pm H pm O s pms p rC C C C nnnC nC kJ kg k M n=++=⨯+⨯+⨯====⨯+⨯+⨯由此估算可知木聚糖(BX )的热容值为1.377kJ/(kg·K)1.1.2 木聚糖硫酸酯(Xyl-O-SO 3H )n 摩尔热容 木聚糖硫酸酯分子式为()5642n C H O R ,根据酸活化化条件下氯磺酸吡啶对木聚糖(BX)的取代度等于1.40,则2个取代基中-SO 3H 比例为1.40。
因此,可以计算木聚糖硫酸酯的摩尔热容:C s pm =[5(C pm )c +6(C pm )H +4(C pm )O +2(C pm )R ]n=[5×7.536+8×9.630+4×16.474+1.4×(23.027+3×7.536)]n=[37.68+77.04+65.896+63.889]n =244.505n所以木聚糖硫酸酯的热容为1.002kJ/(kg ·K )1.2 基团贡献法热容的估算从化学化工物性数据手册查的以下相关物质的热力学性质(见表2-3):表2-3由于相关的物质的热力数无法测量得到,因此提出利用液体Cp的基团贡献法来计算一些有机物的的热容。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基团贡献方法(UNIFAC)估算局部组成模型(NRTL\WILSON\UNIQUAC)的二元参数
结合海友的问题给出详细步骤:/thread-581160-1-1.html
海友的问题:在模拟时,选用NRTL热力学方法时,二元交互作用参数中没有丙酮和2-甲基戊烷,但在文献中说二者能共沸,常压下组成为丙酮:44%,2-甲基戊烷:56%(质量分数),共沸温度为47摄氏度。
请教高手,如何在ASPEN中设置?
第一步:打开A+,选择模板,General with Metric Units;Run Type选择Property Estimation;点确定。
第二步:Setup→Specifications→Global。
Title 需输入;单位选择METCBAR,方便后续温度单位默认℃输入。
第三步:Components→selection→Define components 输入丙酮、2-甲基戊烷。
第四步:Properties→Estimation→Input→Setup→Estimation options→Estimate only the selected parameters→只勾选Binary interaction parameters。
第五步:在Binary对话框中,点击New, Parameter选择NRTL, Method选择UNIF-DMD,
Component i 选择丙酮,Component j 选择2-甲基戊烷。
在Temperature中输入多个温度点。
温度范围最好包括两物质的沸点,这点很重要,影响二元参数的准确度。
在这里输入25、30、35、40、45、50、55、60、65共9个温度点。
第六步:Run,查看Results。
运行后,NRTL参数自动保存在NRTL二元相互作用参数中。
第七步:利用该二元交互参数分析其共沸。
首先,将Run Type 改回Flowsheet模式
第八步:Tools→Analysis→Properties→Binary,Analysis 选择Txy,Basis选择Mass fraction,点击Go。
第九步:查看Txy曲线,求得共沸点常压下组成为丙酮:44.4%,2-甲基戊烷:55.6%(质
量分数),共沸温度为46.5摄氏度。
小结:UNIF-DMD估算得到的二元参数对丙酮与2-甲基戊烷共沸求算与文献值较为吻合。
在估算当中,估算温度的输入较为关键,当输入温度仅有1个的时候,共沸求算有差异。
温度输入最好包括两者的沸点。
也就是NRTL参数的TLOWER和TUPPER。
