大学无机化学与分析化学实验-14 常见阳离子的分离与鉴定-第III组阳离子课件
试验二十四常见阳离子的分离与鉴定

实验二十四 常见阳离子的分离与鉴定(一)一、主要教学目标(一)巩固和进一步掌握一些金属元素及其化合物的性质(二)了解常见阳离子的分离和检出方法,以及巩固检出离子的操作 二、教学的方法及教学手段:讲解法,学生实验法,巡回指导法 三、教学重点:常见阳离子的分离和检出方法,以及巩固检出离子的操作 四、教学难点:常见阳离子的分离和检出方法,以及巩固检出离子的操作 五、实验设备:离心机 六、实验内容(一)碱金属,碱士金属离子的鉴定1、Na +的鉴定①用饱和六羟基锑(V )酸钾KSb(OH)6溶液↓=+66)()(OH NaSb OH KSb NaCl假若没有沉淀,可以摩擦试管内壁②用醋酸铀酰锌与Na+在醋酸缓冲溶液中生成淡黄色结晶状醋酸铀酰锋钠沉淀↓•••=++++-+++O H Ac UO Ac Zn NaAc O H Ac UOZnNa 222222229)(3)(9932、K +的鉴定:①用饱和洒石酸氢钠NaHC 4H 4O 6NaCl O H KHC O H NaHC KCl +↓+644644—3、Mg 2+的鉴定 用镁试剂:蓝色沉淀滴镁试剂加入白滴入1)()(22↓OH Mg NaOH MgCl Mg 2+与镁试剂工在碱性溶液中生成蓝色螯合物沉淀 4、Ca 2+的鉴定(用草酸铵)Cl NH O CaC O C NH CaCl 442422422)()(+↓=+白5、Ba 2+的鉴定:用K 2CrO 4溶液在HAc 和NaAc 缓冲液中+↓=+24422Ba BaCrO CrO K BaCl 示有(二)P 区和ds 区部分金属离子的鉴定 1、Al 3+的鉴定,用HAC 酸化的铝试剂红色絮状沉淀滴氨水再加水浴加热搅拌滴铝试剂→2~1,2%1.03AlCl2、Sn 2+的鉴定+↓22222)(nS Cl Hg HgCl SnCl 示有变黑变灰白透量的 3、Pb 2+的鉴定NaOHPbCrO CrOPbNaOH PbCrO CrO LK mol NO Pb 可溶于黄沉淀溶解溶液黄)()(/1)(424244223↓=+↓-+4、Sb 3+的鉴定++353,2,)(3Sb BSb SbCl 示有苯层显紫色滴罗丹罗明加加数滴苯并释放出气体变为数粒亚销酸钠滴浓盐酸溶液5、Bi 3+的鉴定 用硫脲鲜黄色配合物硫脲→+33)(NO Bi6、Cu 2+的鉴定沉淀])([])([62264CN Fe Cu CuCl CN Fe K =+7、Ag +的鉴定↓•↓AgCl HNO Cl NH Ag O H NH AgCl HCl AgNO 323233)()(白 8、Zn 2+的鉴定42444244)()(])([])([)(SO NH SCN Hg Zn SCN Hg NH ZnSO +↓→+白9、Cd 2+的鉴定:32232)()(NaNO CdS S Na NO Cd +↓=+黄 10、)(2:222示有灰色白的鉴定++Hg SnCl HgCl Hg (三)部分混合离子的分离和鉴定。
《无机化学实验》教学大纲(本科)

《无机化学实验》教学大纲(本科)一、课程目标无机化学实验是师范本科学院化学专业学生必修的基础课程。
通过教学,应使学生:1、熟悉无机化学实验的基本知识,掌握无机化学基本操作技能(见后);2、掌握常见元素的单质和化合物的性质、制备和分离提纯方法,学会某些常数的测定方法;3、培养学生正确观察、记录、分析总结、归纳实验现象,合理处理数据,绘制仪器装置图和撰写实验报告,查阅手册,设计和改进简单实验以及处理实验室一般事故等的能力。
4、培养学生辩证唯物主义世界观,实事求是的科学态度和严谨的作风,使学生的知识、能力、素质得到全面提高,为后续实验课程打好基础,为学生终身发展奠基。
二、教材、参考书教材:《无机化学实验》(第三版)北京师范大学化学系无机化学教研室编,高等教育出版社,1999年。
参考书:1、《化学实验规范》北京师范大学1985年。
2、《实验无机化学》王致勇,连祥珍编著,清华大学出版社,1987 年。
3、《实验无机化学》沈君朴主编,天津大学出版社,1992年。
4、《无机化学实验》(第二版),中山大学等校,高等教育出版社5、《重要无机化学反应》(第二版),陈寿椿,上海科技技术出版社,1982年。
三、教学时数及分配本课程共108学时,可如下分配综合设计实验8个24学时考试6学时其中:基本操作实验10个29.5 %基本理论方面实验8个23.5%无机制备及性质实验8个23.5%综合设计实验8个23.5%四、大纲内容实验一仪器的认领和洗涤、安全教育1、明确无机化学实验的目的和要求。
2、认领无机化学实验常用仪器,熟悉其名称、规格,了解使用注意事项。
3、练习常用仪器的洗涤和干燥方法。
4、了解实验室的规章制度、安全操作和常见事故的处理方法。
实验二灯的使用和玻璃管的简单加工1、了解酒精喷灯的构造和原理,掌握正确的使用方法,了解正常火焰各部分的温度。
2、初步练习玻璃管、棒的截、拉、弯曲、拉制、熔烧等操作。
实验三台秤和分析天平的使用1、了解台秤和分析天平的基本结构,学习正确的称量方法。
无机化学实验报告:常见阳离子的分离与鉴定
→HNO3酸化
2d 2mol·L-1HAc Zn2+ →(NH4)2[Hg (SCN) 4] 白↓
擦试管壁
在中性或微酸性条件下: Zn2++Hg (SCN) 42-=Zn[Hg (SCN) 4]↓ 相同条件下:Cu2+→黄绿色↓Co2+→蓝色↓
Cd2+ 2d 0.5mol·L-1 Na2S
Hg2+
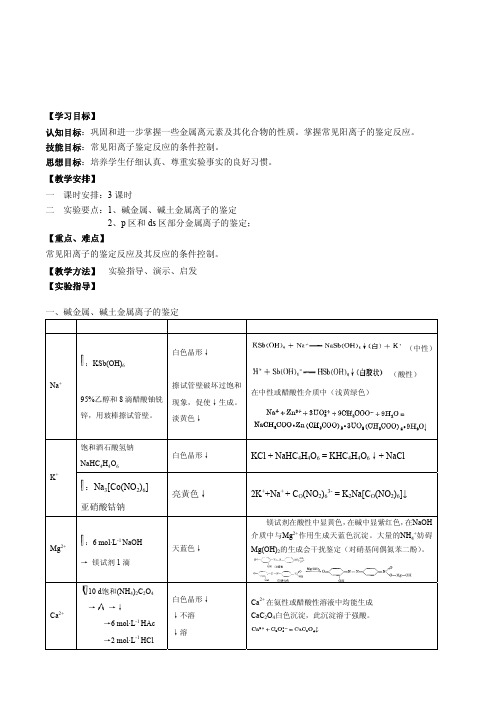
2、p 区和 ds 区部分金属离子的鉴定; 【重点、难点】 常见阳离子的鉴定反应及其反应的条件控制。 【教学方法】 实验指导、演示、启发 【实验指导】
一、碱金属、碱土金属离子的鉴定
离子 方法、试剂
现象
解释及方程式
白色晶形↓
(中性)
:KSb(OH)6
(酸性)
Na+
擦试管壁破坏过饱和
在中性或醋酸性介质中(浅黄绿色)
黄色↓
Pb2+
:2d 1mol·L-1K2CrO4
→
→ 2 mol·L-1
NaOH
溶于 NaOH (Pb2+的鉴定应在中性 或微酸性条件进行。)
Pb2+ + CrO42-=PbCrO4↓ (溶于HNO3、NaOH不溶醋酸) PbCrO4 +OH-→PbO22-
Bi2+ →1d 2.5%硫脲
黄色溶液
黄色络合物
己烯-1-羧酸三铵盐.它与 NH3H2O:降低酸度
铝 盐形成红色内络盐,加
入氨水则则形成红色沉
淀.
性状:棕黄色或棕红色粉
末。易溶于水,溶于乙醇。
逐滴 Sn2+
0.2 mol·L-1 HgCl2
白↓→灰→黑 除强还原剂,一般离 子不干扰。
(完整版)常见阳离子的分离及鉴定

2020/4/14
(8)Mn2+的鉴定 5BiO3- + 2Mn2+ + 14H+
═ 5Bi3+ + 2MnO4— (紫红色溶液)+7H2O
(9)Co2+的鉴定 Co2+ + 4SCN— = [Co(SCN)4]2—( 蓝色)
试 HCl)
(NH4)2S (NH3-NH4Cl)
(NH4)2CO3 (NH3-NH4Cl)
硫化物 难溶于水
分 组 依 据
两酸两碱系统分析法
分别检出NH4+、Na+、Fe3+、Fe2+
氯化物易溶于水
硫酸盐 难溶于水
硫酸盐易溶于水
氢氧化物难溶于水及 氨水
氨性条件下不生成沉淀
2020/4/14
(2)Pb2+的鉴定 Pb2+ + CrO42—→ PbCrO4↓(黄色沉淀) (3) Cu2+的鉴定 2Cu2++ [ Fe(CN)6]4- → Cu2Fe(CN)6↓ (红棕色)
2020/4/14
(4)Fe3+的鉴定 ①Fe3++ nSCN — == Fe(SCN)nn-3 (血红色溶液) ②K+ + Fe3++ [ Fe(CN)6]4- →[K Fe(CN)6 Fe] ↓
2020/4/14
硫化氢系统分析法
硫化物不溶于水
硫化物溶于水
在稀酸中生成硫化物沉淀
分
组
氯化物溶于热水
依 据
氯化物 不溶于 热水
常见阳离子的分离与鉴定.

6mol· L-1NO3 +
沉淀溶解
6mol· L-1NH4· H2O
☺ Zn2+的鉴定:
3滴0.2mol· L-1ZnSO4 + 2滴2mol· L-1HAc + 白色沉淀 3滴(NH4)2[(SCN)4]
11
☺ Hg2+的鉴定:
2滴0.2mol· L-1HgCl2 + 逐滴加0.5mol· L-1SnCl2 继续加
硫化氢法。 两酸两碱法是以最普通的酸 (盐酸、硫酸 ) 和碱 ( 氨水、 氢氧化钠 ) 作试剂,根据各离子氯化物、硫酸盐、氢氧化物 的溶解度不同进行分离鉴定; 硫化氢法依据各离子硫化物以及它们的氯化物、碳酸盐 和氢氧化物的溶解度不同进行分离鉴定。
3
【实验原理】
与HCl溶液反应:
Ag+、Hg22+、Pb2+等
Ag+ 、 Pb2+ 、 Cu2+ 、 Cd2+ 、 Bi3+ 、 Hg+ 、 Hg22+ 、 Sb3+、Sn2+等
5
【仪器与试剂】
仪器:
试管(10ml),离心管(10ml),离心机
试剂:
HCl、H2SO4、HNO3、HAc、NaOH、NH3· H2O、 MgCl2、CaCl2、BaCl2、AlCl3、PbNO3、SnCl2、 HgCl2、Bi(NO3)3、CuCl2、AgNO3、ZnSO4、镁试
与稀H2SO4溶液反应: Ba2+、Sr2+、Ca2+ 、Pb2+ 、Ag+ 等 与NaOH溶液反应: Al3+、Zn2+、Pb2+ 、Sb2+ 、Sn2+等 与NH3溶液反应: Ag+、 Cu2+、Cd2+ 、Zn2+等
无机化学常见阳离子分离与鉴定

离子鉴定方法备注Hg2+①Hg2+离子,可被铜置换,在铜表面析出金属汞的灰色斑点,示有Hg2+离子:Cu + Hg2+ → Cu2+ + Hg↓②在2滴试液中,加入过量SnCl2溶液,SnCl2与汞盐作用,首先生成白色Hg2Cl2沉淀,过量SnCl2将Hg2Cl2进一步还原成金属汞,沉淀逐渐变灰,说明Hg2+离子存在。
2HgCl2 + Sn2+ → Sn4+ + Hg2Cl2↓+ Cl–Sn2+ + Hg2Cl2→ 2Hg↓+ Sn4+ + 2Cl–Mg 2+取几滴试液,加入少量镁试剂(对硝基苯偶氮间苯二酚),再加入NaOH溶液使呈碱性,若有Mg 2+存在,产生蓝色沉淀。
Mg 2+离子量少时,溶液由红色变成蓝色。
加入镁试剂后,溶液显黄色,表示试剂酸性太强,应加入碱液。
Ni 2+、Co2+、Cd 2+的氢氧化物与镁试剂作用,干扰Mg 2+的鉴定。
Mn2+取1滴试液,加入数滴0.1mol·L-1HNO3溶液,再加入NaBiO3固体,若有Mn2+存在,溶液应为紫红色。
Na+取1滴试液,加入8滴乙酸铀酰锌试剂,用玻璃棒摩擦试管。
淡黄色结晶乙酸铀酰锌钠(NaCH3COO·Zn(CH3COO)2·UO2(CH3COO)2·H2O)沉淀出现,示有Na+离子存在。
①反应应在中性或乙酸酸性溶液中进行。
②大量K+离子存在干扰测定,为降低K+离子浓度,可将试液稀释2~3倍。
NH4+①在表面皿上,加入5滴6mol·L-1 NaOH,立即把一凹面贴有湿润红色石蕊试纸(或pH试纸)的表面皿盖上,然后放在水浴上加热,试纸呈碱性,示有NH4+离子存在。
②在点滴板上放1滴试液,加2滴奈斯勒试剂(K2[HgI4]与KOH的混合物),生成红棕色沉淀,示有NH4+离子存在。
NH4+离子含量少时,不生成红棕色沉淀而得到黄色溶液。
Ni2+取2滴试液,加入2滴二乙酰二肟(丁二肟)和1滴稀氨水,生成红色的沉淀,说明有Ni2+离子存在。
无机化学常见阳离子分离与鉴定

离子鉴定方法备注Hg2+①Hg2+离子,可被铜置换,在铜表面析出金属汞的灰色斑点,示有Hg2+离子:Cu + Hg2+ → Cu2+ + Hg↓②在2滴试液中,加入过量SnCl2溶液,SnCl2与汞盐作用,首先生成白色Hg2Cl2沉淀,过量SnCl2将Hg2Cl2进一步还原成金属汞,沉淀逐渐变灰,说明Hg2+离子存在。
2HgCl2 + Sn2+ → Sn4+ + Hg2Cl2↓+ Cl–Sn2+ + Hg2Cl2→ 2Hg↓+ Sn4+ + 2Cl–Mg 2+取几滴试液,加入少量镁试剂(对硝基苯偶氮间苯二酚),再加入NaOH溶液使呈碱性,若有Mg 2+存在,产生蓝色沉淀。
Mg 2+离子量少时,溶液由红色变成蓝色。
加入镁试剂后,溶液显黄色,表示试剂酸性太强,应加入碱液。
Ni 2+、Co2+、Cd 2+的氢氧化物与镁试剂作用,干扰Mg 2+的鉴定。
Mn2+取1滴试液,加入数滴0.1mol·L-1HNO3溶液,再加入NaBiO3固体,若有Mn2+存在,溶液应为紫红色。
Na+取1滴试液,加入8滴乙酸铀酰锌试剂,用玻璃棒摩擦试管。
淡黄色结晶乙酸铀酰锌钠(NaCH3COO·Zn(CH3COO)2·UO2(CH3COO)2·H2O)沉淀出现,示有Na+离子存在。
①反应应在中性或乙酸酸性溶液中进行。
②大量K+离子存在干扰测定,为降低K+离子浓度,可将试液稀释2~3倍。
NH4+①在表面皿上,加入5滴6mol·L-1 NaOH,立即把一凹面贴有湿润红色石蕊试纸(或pH试纸)的表面皿盖上,然后放在水浴上加热,试纸呈碱性,示有NH4+离子存在。
②在点滴板上放1滴试液,加2滴奈斯勒试剂(K2[HgI4]与KOH的混合物),生成红棕色沉淀,示有NH4+离子存在。
NH4+离子含量少时,不生成红棕色沉淀而得到黄色溶液。
Ni2+取2滴试液,加入2滴二乙酰二肟(丁二肟)和1滴稀氨水,生成红色的沉淀,说明有Ni2+离子存在。
常见阳离子的分离、鉴定

实验27 常见阳离子的分离、鉴定一、实验目的1.了解常见阳离子的基本性质和重要反应。
2.掌握常见阳离子的分离原理及鉴定方法。
3.进一步练习分离、鉴定的基本操作。
二、实验原理离子的分离和鉴定是以各离子对试剂的不同反应为依据的,这种反应常伴随有特殊的现象,如沉淀的生成或溶解,特殊颜色的出现,气体的产生等等。
各离子对试剂作用的相似性和差异性都是构成离子分离与检出方法的基础,也就是说,离子的基本性质是进行分离鉴定的基础。
因而要想掌握阳离子的分离鉴定的方法,就要熟悉阳离子的基本性质。
离子的分离和鉴定只有在一定条件下才能进行。
所谓一定的条件主要指溶液的酸度、反应物的浓度、反应温度、促进或妨碍此反应的物质是否存在等。
为使反应向期望的方向进行,就必须选择适当的反应条件。
因此,除了要熟悉离子的有关性质外,还要学会运用离子平衡(酸碱、沉淀、氧化还原、配位等平衡)的规律控制反应条件,这对于我们进一步掌握离子分离条件和鉴定方法的选择将有很大帮助。
对于常见阳离子分离的性质是指常见阳离子与常用试剂的反应及其差异,重点在于应用这些差异性将离子分开。
常见阳离子与常用试剂的反应:1. 与HCl 溶液反应AgCl ↓ 白色,溶于氨水Hg 2Cl 2↓ 白色,溶于浓HNO 3及H 2SO 4 PbCl 2 ↓ 白色,溶于热水,NH 4A c 、NaOH Ba SrCa Ca 2+浓度很大时,才析出沉淀 Pb NaOH 、NH 4Ac(饱和)、热HCl 溶液、浓H 2SO 4,不溶于稀H 2SO 4 Ag3. 与NaOH 反应Al 2-或[Al(OH)4]-Zn ZnO 22-或[Zn(OH)4]2-Pb PbO 22-或[Pb(OH)4]2-Sb SbO 2-Sn 22-或[Sn(OH)4]2-Cu 2+ Cu(OH)42-4. 与NH 3反应Ag + [Ag(NH 3)2]+Cu 2+ 3)4]2+ (深蓝) Cd 2+ 3)4]2+浓NaOH △Zn[Zn(NH 3)4]2+Ni 2+3)4]2+ (蓝紫色)Co[Co(NH 3)6]4+ (土黄色) [Co(NH 3)6]3+(棕红色)5. 与(NH 4)2CO 3反应Cu Cu 2(OH)2CO 3 ↓ 浅蓝3)4]2+ 深蓝 Ag Ag 2CO 3 (Ag 2O)↓白色3)2]+ 无色 ZnZn 2(OH)2CO 3↓ 白色3)4]2+ 无色Cd Cd 2(OH)2CO 3↓ 白色[Cd(NH 3)4]2+ 无色 Hg Hg 2(OH) 2CO 3↓ 白色Hg 2 Hg 2CO 3(白)↓ → HgO ↓(黄) + Hg ↓(黑) +CO 2 ↑ Mg Mg 2(OH)2CO 3 ↓ 白色 Pb 2+Pb 2(OH)2CO 3 ↓ 白色 Bi (BiO)2CO 3 ↓ 白色 Ca 3 ↓ 白色 Sr SrCO 3 ↓ 白色 Ba 3 ↓ 白色 Al 3 ↓ 白色 Sn Sn(OH)2 ↓ 白色 Sn Sn(OH)4 ↓ 白色 Sb Sb(OH)3 ↓ 白色 6. 与H 2S 或(NH 4)2S 反应应当掌握各种阳离子生成硫化物沉淀的条件及其硫化物溶解度的差别,并用于阳离子分离。
常见阳离子的分离与鉴定

四.定性分析实验记录及结论
认真观察实验现象, 认真观察实验现象,如实地做好记 录,注意实验现象与文献书本上所描述 的差异,综合各种因素考虑问题, 的差异,综合各种因素考虑问题,以期 得出正确的结论。 得出正确的结论。
记录 描述 报告 反应方程式
实验分三个单元
第Ⅰ组阳离子的分离和鉴定 Ag+、Hg22+、Pb2+ 第Ⅱ组阳离子的分离和鉴定 Cu2+、Bi3+、Cd2+、Hg2+、As(III,V)、Sb3+、Sn4+ 以及 组阳离子沉淀以后留在溶液中的Pb 第Ⅰ组阳离子沉淀以后留在溶液中的Pb2+ 其硫化物难溶于Na ,称为铜组( 其硫化物难溶于 2S,称为铜组(ⅡA组) 组 其硫化物能溶于Na ,称为锡组( 其硫化物能溶于 2S,称为锡组(ⅡB组) 组 第Ⅲ组阳离子的分离和鉴定 Fe3+、Fe2+、Co2+、Ni2+、Mn2+、Cr3+、Zn2+、Al3+ —— 在氨碱性溶液中沉淀完全 其中Cr 生成Cr(OH)3和Al(OH)3沉淀 其中 3+、Al3+ 生成
常见阳离子的分离与鉴定
一. 无机定性分析 ——
无机物的半微量定性分析
化学方法具有一定优越性: 化学方法具有一定优越性:
灵活性大,不需特殊仪器设备, 灵活性大,不需特殊仪器设备,尤其在某些不 便于使用仪器或条件有限的地方。 便于使用仪器或条件有限的地方。
定性分析的实验训练: 定性分析的实验训练:
可对化学元素按周期表排列的性质、 可对化学元素按周期表排列的性质、无机化合 离子)的性质增进了解, 物(离子)的性质增进了解,对已学过的普通化学 中许多基本原理基本知识有一个从理性认识到感性 认识的提高。 认识的提高。
【精品】无机化学常见阳离子分离与鉴定

【精品】无机化学常见阳离子分离与鉴定
无机化学中,阳离子分离与鉴定是非常重要的步骤, divide the steps into several parts on the basis of their functions,浏览以下:
- 预处理:预处理是分离各种有机和无机杂质和有效物质阳离子的第一步,可以使用加草酸、高氯酸、稀硫酸等剂量分离有机杂质和无机阳离子。
- 共析:用于分离有关的化合物的有机溶剂,在共析实验中,重要的是选择适当的溶剂,可以实现离子弱共析和离子强共析。
- 根据溶解度和萃取受体的选择:根据溶解度的不同,主要分为水溶和有机溶,而有机溶非水溶即萃取受体,常见萃取受体有醚、氯仿、氨和甲醇等。
- 重结晶和提取:溶剂提取技术非常重要,原料中的阳离子萃取到某种溶剂后,应收集溶解液,用新的溶剂萃取,以尽量的减少萃取回收的溶剂的数量。
- 结晶干燥:使用适当的溶剂对结晶结果进行结晶干燥。
在结晶过程中,有一些溶剂和添加剂被带出去,而结晶干燥可以有效地去除残留的溶剂。
- 多重梯度洗脱:多重梯度洗脱可以得到更纯的产品,常用的洗脱技术有多相洗脱、多极性洗脱、溶解度变洗脱、聚丙烯酰胺凝胶层析等。
- 鉴定技术:鉴定阳离子的技术常采用X波发射(EDX)、原子荧光光谱(AES)、原子质谱(MS)等技术,分析阳离子的精确性很重要,也可以利用热分析技术,如热重分析(TGA)、热分散光元仪(DSC)来确定其组成和特性。
以上是无机化学中阳离子分离与鉴定的步骤,然而,实际操作过程根据实际情况还可能需要中和、萃取、逆流色谱、粒子分离以及晶格弛豫技术等多项技术进行支持。
在操作分离与鉴定步骤时,需要掌握相关基础知识,并仔细审查操作过程,以确保工作效果。
常见阳离子的分离及鉴定

二、实验原理
• 用系统分析法分析阳离子时,要按照一定的顺序 加入若干种试剂,将离子按组逐一地沉淀出来。 这些分组用的试剂称为组试剂。
• 常见阳离子有23个元素共28个离子,鉴定反应的 相互干扰较大,常采用系统分析法。
2019/10/25
硫化氢系统分析法
硫化物不溶于水
硫化物溶于水
COONH4 OH
→ HO
C
O Al/3
CO
O
(7)Cr3+的鉴定 Cr3+ + OH—→ Cr(OH)3(灰绿色沉淀) Cr(OH)3 + OH-(过量)→ [Cr(OH)4]- (亮绿色溶液) 2Cr(OH)4- + 3H2O2 + 2OH- → 8H2O + 2CrO42- (黄色溶液)
Pb2+ + CrO42— → PbCrO4↓(黄色沉淀)
在稀酸中生成硫化物沉淀
分
组
氯化物溶于热水
依 据
氯化物 不溶于 热水
硫化物不溶 于硫化钠
硫化物溶 于硫化钠
在稀酸中不生成 硫化物沉淀
碳酸盐不溶于水 碳酸盐溶于水
相 Ag+
应 离
Hg22+
子 Pb2+
组 第一组 名 银组
称 盐酸组
Pb2+ Bi3+ Cu2+ Cd2+
二A组
Hg2+ As(Ⅲ,Ⅴ) Sb(Ⅲ,Ⅴ Sn2+ 、
红色沉淀,表示有Al3+存在。
Al/3
Al3+ +
O OH
C
OH
——
C
SO3Na
阳离子的分离与鉴定

阳离子的分离与鉴定阳离子的分离与鉴定一. 实验目的1. 掌握用两酸三碱系统分析法对常见阳离子进行分组分离的原理和方法。
2. 掌握分离、鉴定的基本操作与实验技能。
二. 实验原理阳离子的种类较多,常见的有二十多种,个别检出时,容易发生相互干扰,所以一般阳离子分析都是利用阳离子某些共同特性,先分成几组,然后再根据阳离子的个别特性加以检出。
凡能使一组阳离子在适当的反应条件下生成沉淀而与其它组阳离子分离的试剂称为组试剂,利用不同的组试剂把阳离子逐组分离再进行检出的方法叫做阳离子的系统分析。
在阳离子系统分离中利用不同的组试剂,有很多不同的分组方案。
如硫化氢分组法,两酸、两碱系统分组法。
下面介绍一种以氢氧化物酸碱性与形成配合物性质不同为基础,以HCl、H2SO4、NH3 H2O、NaOH、(NH4)2S为组试剂的两酸三碱分组方法。
本方法将常见的二十多种阳离子分为六组。
第一组:盐酸组Ag+,Hg22+,Pb2+第二组:硫酸组Ba2+,Ca2+,Pb2+第三组:氨合物组Cu2+,Cd2+,Zn2+,Co2+,Ni2+第四组:易溶组Na+,NH4+,Mg2+,K+第五组:两性组Al3+,Cr3+,Sb III、V,Sn II、IV第六组:氢氧化物组Fe2+,Fe3+, Bi3+,Mn2+,Hg2+用系统分析法分析阳离子时,要按照一定的顺序加入组试剂,将离子一组一组沉淀下来,具体分离方法如下表。
表阳离子分组步骤试液(用个别检出法鉴定NH4+、Fe2+、Fe3+)(Hg)(两性组) (氢氧化物组) (第三组硫化物) (第四组易溶组)AlO2?、Cr O42?Fe(OH)3、K+、Na+、Mg2+、NH4+SbO43?、SnO32?MnO(OH)2、NaBiO3、HgNH2Cl每组分出后,继续再进行组内分离,直至鉴定时相互不发生干扰为止。
在实际分析中,如发现某组离子整组不存在(无沉淀产生)、这组离子的分析就可省去。
从而大大简化了分析的手续。
无机化学常见阳离子分离与鉴定

无机化学常见阳离子分离与鉴定.doc一、分离1、氢氧根离子(OH^-)氢氧根离子与金属离子形成的沉淀可以通过NaOH沉淀法分离出来。
在水溶液中,氢氧根离子与金属离子结合形成相应的金属氢氧化物,这些氢氧化物可以形成沉淀,实现分离。
一些阳离子的氢氧化物沉淀的颜色也是它们鉴定的基础之一。
2、氟化物(F^-)氟化物结合度和其他类似的离子相比较小,因此可以和其他阴离子分离。
使用鸟巢法可以分离出氟化物,该方法使用的络合剂是季铵盐鸟巢环(NH4)3 [FeF6]。
3、碳酸盐(CO32-)在水中,CO32-可以形成与Ca2+、Ba2+、Pb2+、Ag+等阳离子结合的沉淀。
因此,通过观察生成的沉淀的颜色可以确定阳离子的存在。
氰化物形成的配合物稳定性很高,一些盐可以沉淀分离氰化物。
通过加入相应的酸可以分解盐的氰化物,若遇到硝酸银时,则可以生成白色的沉淀。
硫酸盐与Barium离子结合可以形成硫酸钡的沉淀。
可以用BaCl2试剂发生反应,观察生成的白色沉淀可以确认硫酸盐的存在。
氯化物可以通过加入AgNO3实现分离,生成白色的AgCl沉淀。
AgCl颜色淡黄色并且易溶于NH3溶液中。
二、鉴定1、铁离子(Fe3+)Fe3+可以通过与硝酸铵一起存在,在加热时生成棕黄色的Fe(OH)3沉淀。
此外,还可以借助Ti(III)还原Fe3+为Fe2+,并使用Fenton试剂检测Fe2+的产生。
2、铜离子(Cu2+)Cu2+可以通过和N,N-二乙基-1,6-二亚胺染料组成的溶液反应而呈现出深蓝色,且颜色随着浓度的增加而增加。
Zn2+可以通过向含有鞣酸的溶液中加入氢氧化钠而产生白色沉淀进行鉴定。
Mn2+可以通过加入氢氧化钠和汞齐试剂而鉴定。
试剂与汞齐反应,生成黑色沉淀,同时文中的Mn(OH)2也被沉淀。
Mg2+可以通过向可溶性的Phenolphthalein-indicator(溶于环己酮)溶液中添加MgCl2所生成的红色沉淀进行鉴定。
Al3+可通过加入含有增效剂的Eriochrome Black T试剂检测出来,试剂经络合反应后转变为紫红色,而Al3+呈现出浅紫色。
无机化学实验报告

实验名称:常见阳离子的分离与鉴定实验日期:2023年2月24日实验地点:化学实验室一、实验目的1. 巩固和进一步掌握一些金属离子及其化合物的性质。
2. 掌握常见阳离子的鉴定反应。
3. 培养学生仔细认真、尊重实验事实的良好习惯。
二、实验原理在无机化学中,金属离子具有不同的性质,通过实验可以观察到它们在不同条件下的反应现象。
本实验通过一系列的化学反应,对常见阳离子进行分离与鉴定。
三、实验器材与试剂1. 器材:试管、烧杯、玻璃棒、滴管、酒精灯、酒精、蒸馏水、盐酸、硫酸、氢氧化钠、氢氧化铵、氨水、硫化氢、氯化钡、氯化银、硝酸银、氯化铁、氯化铜、氯化锌、氯化铝、氯化钴、氯化镍等。
2. 试剂:硫酸铜、氯化钠、氯化钾、氯化铁、氯化钴、氯化镍、硫酸锌、硫酸铝、硫酸钴、硫酸镍、硫酸钠、硫酸钾、硝酸银、硫化氢、氨水、氢氧化钠、氢氧化铵、氯化钡、氯化银、硝酸铁、氯化铁、氯化铜、氯化锌、氯化铝、氯化钴、氯化镍等。
四、实验步骤1. 碱金属、碱土金属离子的鉴定(1)Na+的鉴定:将待测溶液加入少量稀盐酸,再加入少量硝酸银溶液,若产生白色沉淀,则证明含有Na+。
(2)K+的鉴定:将待测溶液加入少量稀盐酸,再加入少量硝酸银溶液,若产生白色沉淀,则证明含有K+。
(3)Ca2+的鉴定:将待测溶液加入少量稀盐酸,再加入少量碳酸钠溶液,若产生白色沉淀,则证明含有Ca2+。
2. p区和ds区部分金属离子的鉴定(1)Fe2+的鉴定:将待测溶液加入少量稀盐酸,再加入少量硝酸铁溶液,若产生红褐色沉淀,则证明含有Fe2+。
(2)Cu2+的鉴定:将待测溶液加入少量稀盐酸,再加入少量硫化氢溶液,若产生黑色沉淀,则证明含有Cu2+。
(3)Zn2+的鉴定:将待测溶液加入少量稀盐酸,再加入少量氯化锌溶液,若产生白色沉淀,则证明含有Zn2+。
(4)Al3+的鉴定:将待测溶液加入少量稀盐酸,再加入少量氢氧化钠溶液,若产生白色沉淀,则证明含有Al3+。
(5)Co2+的鉴定:将待测溶液加入少量稀盐酸,再加入少量氯化钴溶液,若产生蓝色沉淀,则证明含有Co2+。
常见阳离子的分离与鉴定(一)

物,碳酸盐溶解性的不同,以HCl,H2S,
(NH4)2S和(NH4)2CO3为组试剂将常见的阳
离子分成五个分析组。
硫化氢系统分组步骤示意图
ⅠV组试液
HCl,Δ
AgCl Hg2Cl2
I组 盐酸组
Ⅱ V组
H2O2,0.3mol/L HCl,NH4I及H2S
IIIV组
PbS HgS Bi2S3 As2S3 CuS Sb2S3 CdS SnS2 II组
Ag+,Cd2+,Al3+,Ba2+,Na+ HCl AgCl↓ NH3∙H2O Cd2+,Al3+,Ba2+,Na+ NH3∙H2O Cd(NH3)42+, Ba2+,Na+ H2SO4 Cd2+, Na+ Na2S CdS↓ 亮黄 示有Cd2+ KSb(OH)6 白色↓
Ag(NH3)2+
HNO3 铝试剂 AgCl↓ 白色 红色↓
浓NaOH 空气中O2
少量生成FeO2-
Fe
(二)生成氢氧化物、氧化物或碱式盐沉淀 Mn2+ Mn(OH)2 NaOH ,不溶于过量 NaOH 的有: Cd2+ Cd(OH) 2 白
Ag+ Hg2+ Hg22+ Co2+ Ni2+
Ag2O 褐 HgO 黄 Hg2O 黑
Fe(OH)2 浅绿
Fe(OH)3 红棕 空气中O2 浅粉红色 MnO(OH)2 棕褐
碱式盐 蓝 碱式盐 浅绿
浓NaOH
Co(OH)2 粉红 Ni(OH)2 绿
与NH3反应
Ag+ Cu2+ Ag2O 褐 Ag(NH3)2+ 无色
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4) Fe3+离子的鉴定反应 a.以K4[Fe(CN)6] 试剂鉴定Fe3+ 离子 在点滴板上滴加三价铁盐溶液及K4[Fe(CN)6] 试剂各1滴→立即生成
蓝色沉淀。 b.以KSCN试剂鉴定Fe3+ 离子 在点滴板上加三价铁盐溶液及KSCN试剂各1滴→立即呈深红色。
溶液:CrO42-、AlO2- 和ZnO22沉淀: Fe(OH)3、MnO(OH)2、Ni(OH)2和Co(OH)3
(2) CrO42-、AlO2- 和ZnO22- 的鉴定 a.CrO42- 离子的鉴定 溶液呈黄色则表明有CrO42-存在。取1份溶液按Cr3+ 鉴定方法检验。 b. Al3+、Zn2+ 离子的鉴定 另取2份溶液,分别鉴定Al3+及Zn2+离子。
(3) Mn2+ 的分离与鉴定 将 (1) 所得沉淀热水洗涤3次(充分搅拌)→离心分离→沉淀上加
2mol/L H2SO4溶液6~8滴溶解Fe3+、Ni2+、Co2+ →离心分离→MnO(OH)2 沉淀+3%H2O23滴、2mol/L H2SO4溶液2滴→加热→沉淀溶解并除H2O2 , 按Mn2+ 离子鉴定方法检验。
a.Cr3+ 离子氧化成为铬酸盐 小试管中加入三价铬盐溶液2滴,滴加2mol/L NaOH溶液至生成
沉淀又溶解→滴加3% H2O23滴→水浴加热→溶液渐黄即生成铬酸盐。 b.以Pb(NO3)2试剂鉴定铬酸盐 铬酸盐溶液1滴→滴加Pb(NO3)2试剂1滴,即得黄色PbCrO4沉淀。 c.过铬酸法鉴定铬酸及重铬酸盐 试管中滴加乙醚、1mol/L H2SO4溶液及3% H2O2溶液各7滴→混匀
5.第Ⅲ组阳离子的分离与鉴定
(4) Fe3+ 和Ni2+、Co2+ 离子的分离及Ni2+、Co2+离子的鉴定
取步骤 (4) 所得含Fe3+、Ni2+、Co2+ 离子溶液+2mol/LNH4Cl溶液5 滴→逐滴+浓氨水至呈碱性后再+浓氨水4滴→离心分离
沉淀:Fe(OH)3 溶液:[Ni(NH3)6]2+ 和 [Co(NH3)6]2+
(5) Fe2+ 离子的鉴定反应 在点滴板上加二价铁盐溶液及K3[Fe(CN)6] 试剂各1滴→立即生成蓝
色沉淀。
(6) Ni2+ 离子的鉴定反应 在点滴板上加镍盐溶液及2mol/L 氨水各1滴→加丁二酮肟试剂1滴
→生成鲜红色沉淀。
4.第Ⅲ组阳离子的鉴定反应
(7) Zn2+离子的鉴定反应 在点滴板上加0.02% CoCl2 溶液及 (NH4)2[Hg(SCN)4] 试剂各1滴→搅
→滴加K2CrO4 或K2Cr2O7溶液1滴→振摇试管则上层乙醚生成特征蓝 色。
CrO42- + 2 H2O2 + 2 H+ == H2CrO6 + 2 H2O Cr2O72- + 4 H2O2 + 2 H+ == 2 H2CrO6 + 3 H2O
4.第Ⅲ组阳离子的鉴定反应
(3) Mn2+离子的鉴定反应 在小试管中加入少许NaBiO3粉末→滴加 6mol/L HNO3溶液10滴及
Fe3+离子。
思考题
1.将第III组阳离子沉淀为硫化物或氢氧化物时的反应条件是什么? 组试剂是什么?
2.在弱酸性的水溶液中,第III组阳离子各具什么颜色?能否根据试 液的颜色来初步判断有哪些离子可能存在?
3.洗涤第I、II、III组阳离子化合物沉淀时,有时可用水,有时要用 稀酸,有时又要用NH4Cl或NH4NO3稀溶液,为什么?
高等教育大学教学课件 《无机化学与分析化学实验》
常见阳离子的分离与鉴定
第Ⅲ组阳离子的分离和鉴定
第Ⅲ组阳离子的分离和鉴定
第Ⅲ组阳离子包括Fe3+、Fe2+、Co2+、Ni2+、 Mn2+、Cr3+、Zn2+、Al3+ 离子
—— 在氨碱性溶液中生成硫化物沉淀完全 Cr3+、Al3+ 生成Cr(OH)3和Al(OH)3沉淀
拌混匀,不生成沉淀→加锌盐溶液1滴→立即析出蓝色沉淀。
(8) Co2+离子的鉴定反应 a.以NH4SCN试剂鉴定Co2+ 离子 在点滴板上加钴盐溶液及NH4SCN试剂各1滴→加丙酮2滴,溶液即
呈现天蓝色。
b.以KNO2试剂鉴定Co2+ 离子 在小试管中滴加钴盐溶液2滴→6mol/L HAc溶液酸化→加6mol/L
谢谢欣赏!
4.从一含第III组阳离子的未知液中,分取2份试液,一份加入过量 的NaOH仍有沉淀存在;另一份在NH4Cl存在下加入氨水后则无沉 淀生成。问:在此未知液中可能存在哪些离子?
5.若不采用硫化氢或硫化铵试剂,能否将下列两组中的各个离子分 离?试写出分离步骤。
(1) Al3+、Zn2+、Fe3+、Co2+ (2) Mn2+、Ni2+、Al3+
纸上点滴反应:茜素试剂及铝盐溶液各1滴→两斑点相交→在氨 水瓶口熏1~2min →茜素斑点呈紫色,铝盐溶液浸润的斑点无色,两 斑点相交处则为红色→将滤纸烘干 使氨挥发,则紫色变淡而红色不褪。
4.第Ⅲ组阳离子的鉴定反应
(2) Cr3+离子的鉴定反应
定性分析中一般是将三价铬氧化成铬酸盐,再进行鉴定铬酸盐。
定方法检验。
注意:
1. Cr3+、Al3+、Zn2+ 离子与Fe3+、Mn2+、Ni2+、Co2+ 离子 分离时,必须有足够的碱性和足量的H2O2,并注意充 分搅拌,以得到氧化生成CrO42- 的效果。
2. 鉴定Zn2+ 离子时,应注意调节合适的酸度。 3. 进行 Ni2+ 、Co2+ 离子鉴定时,必须注意到掩蔽共存的
1. Fe3+、Ni2+、Mn2+、Zn2+、Co2+ 在氨性溶液中与硫代乙酰胺的作用
取 Fe3+、Ni2+、Mn2+、Zn2+、Co2+试液各 2 滴,
分别 +浓氨水至碱性 → + 5%硫代乙酰胺溶液
2 滴 → 沸水浴加热,观察生成沉淀的颜色。
2.第Ⅲ组阳离子与氨水的反应
取 Fe3+、Ni2+、 Cr3+、Zn2+、Co2+ 、Al3+液各 4 滴 分别 + 2mol/L氨水1滴,观察生成沉淀的颜色。 再滴加6mol/L氨水, 观察沉淀的溶解情况 。
取溶液分别进行Ni2+、Co2+ 离子的鉴定。 Ni2+ 离子——鉴定需先加入NaF。 Co2+ 离子——鉴定需经6mol/L HAc酸化再+6mol/L KNO2 试剂,水 浴加热;或在NaF存在下,用NH4SCN和丙酮试剂鉴定。
(5) Fe3+离子的鉴定 将步骤 (5) 所得沉淀用2mol/L HCl 溶液溶解,然后按Fe3+ 离子的鉴
观察有何变化。
4.第Ⅲ组阳离子的鉴定反应
(1) Al3+离子的鉴定反应
a.以铝试剂鉴定Al3+ 离子
铝盐溶液2滴及2mol/L HAc溶液4滴→+铝试剂4滴→沸水浴加热→ 滴加2mol/L氨水至碱性(石蕊试纸)→滴加2mol/L (NH4)2CO3溶液3 滴→生成鲜红色沉淀。
b.以茜素试剂鉴定Al3+ 离子
KNO2试剂2滴→水浴加热→立即析出黄色的K3[Co(NO2)6]沉淀。
5.第Ⅲ组阳离子的分离与鉴定
(1) Cr3+、Al3+、Zn2+ 离子与Fe3+、Mn2+、Ni2+、Co2+ 离子的分离 取第III组阳离子试液于25ml烧杯,加浓盐酸5滴→煮沸除H2S,蒸发
浓缩至1ml左右→6mol/L NaOH调节pH9 →+3%H2O25滴→ +40% NaOH 溶液5滴→充分搅拌→煮沸除过量H2O2 →转移至离心试管,离心分离
3.第Ⅲ组阳离子与NaOH和H2O2的反应
取 Fe3+、Ni2+、 Mn2+、 Cr3+、Zn2+、Co2+ 、Al3+ 溶液各 4 滴
分别 + 2 mol/L NaOH 溶液 1 滴, 观察情况 。 再加入3% H2O2 溶液 2 滴,水浴中加热,
