无菌、微生物检查法方法学验证实例
无菌检查微生物限度检查方法学验证实例

供试液制备:取样品10瓶分别加0.1%蛋
白胨溶液30 ml溶解后,过滤。
7.活菌计数
活菌计数结果见表1。
10-4稀释
10-5稀释
10-7稀释
试验次数
1
2
1
21Βιβλιοθήκη 2金黄色葡萄球菌56
60
枯草芽孢杆菌
77
79
白色念珠菌
86
70
黑曲霉菌
80
76
铜绿假单胞菌
47
50
方法验证
直接接种法:取样品12支,分别接种8支硫乙醇酸盐和4支霉菌液体培养基2ml/支后,再按要求加入相应的阳性菌液(30-100个/ml),置规定温度培养3-5天,逐日观察结果。
仪器和滤器:HTY-2000A集菌仪,全封闭无菌试验过滤培养器(批号20050105)北京牛牛基因有限公司。
01
方法:中国药典2005年版无菌检查的验证实验
02
操作方法 菌液制备: 取金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、铜绿假单胞菌的新鲜培养物少许接种至营养肉汤培养基中, 生孢梭菌的新鲜培养物少许接种至硫乙醇酸盐流体培养基中, 32.5±2.5℃培养18~24小时;
培养:硫乙醇酸盐流体培养基桶30-35℃培养;真菌培养基桶23-28℃培养。观察结果。
结果 细菌和真菌数计数结果分别见表1和表2。
表1 细菌数计数 表2 真菌数计数结果
*
菌 种
大肠埃希菌
金黄色葡萄球菌
枯草芽孢杆菌
铜绿假单胞菌
生孢梭菌
计数(CFU)
22
26
36
39
62
66
58
54
45、 23
128、108
无菌检验方法学验证方案

无菌检验 方法学验证方案辽宁爱母医疗科技有限公司 辽宁爱母医疗科技有限公司 2010 年 9 月1文件名称无菌检验方法学验证方案总页数文件编号起草部门起草人起草日期备注审核部门审核人审核意见审核日期生产技术部主管起草部门主管审批部门审批人审批意见审批日期总工办负责人质量部主管2目录 1、验证对象、范围及时间 2、目的 3、实施验证的人员分工及职责 4、可接受标准 5、验证操作方法 6、验证结论 7、结果分析与评价 8、漏项与偏差表 9、再验证周期 10、最终批准 11、附录31、验证对象及范围 本实验是关于产品无菌检查试验的验证。
参照《中国药典2005年版》二 部附录无菌检查方法进行试验。
结果采用直接接种法对人工污染的六种菌株 进行试验,产品对枯草芽孢杆菌、生孢梭菌有不同程度的抑菌作用。
采用薄 膜过滤法用0.9%氯化钠100mL进行样品稀释,然后用500mL的pH7.0氯化钠缓冲 液分几次冲洗,可消除其抑菌成分。
验证结果应显示对产品无菌试验方法。
2、目的 本方案的目的在于为分析评价无菌检验方法,以确认采用适宜的检验 方法。
3、实施验证的人员分工及职责表 1 无菌检验方法学验证小组职责分工验证职责 起草验证方案 起草验证报告 无菌检验方法学验证实施 检 验负责部门负责人审核验证方案和验证报告 批准验证方案和验证报告 4、接受标准 已对生化检验人员进行专业培训。
5、验证操作方法 5、1 概述 本产品为三类医疗器械无菌产品。
无菌检查法是对该产品质量控制的重要 检查项目,《2005年版药典》要求建立产品的无菌检查法时要进行方法学的 验证,来确认所采用的方法适用。
按照《中国药典2005年版》要求,以金葡4球菌,铜绿假单胞菌,枯草芽孢杆菌、生孢梭菌、白色念珠菌,黑曲霉菌作 为实验菌种,对甲磺酸罗哌卡因注射液无菌检查方法进行了验证实验。
5、2 验证主要文件 文件名称 《无菌工作服管理规程》 《初始污染菌检验》 编号AM·SMP·De23-05-I实际情况5、3 无菌服洗衣消毒灭菌程序 适量 纯化水浸泡2 分钟加洗涤剂15 分钟 洗涤脱水0.1 新洁尔灭浸泡 15 分钟纯化水漂洗5 分钟 3 分钟消毒纯化水漂洗脱水121℃,30min晾干放入无菌袋灭菌放入传递窗 5、4 取样缓冲区指定地点将浸有灭菌生理盐水的棉拭子在无菌服的门衣襟、袖上来回涂抹 10 次 (往返为一次)采样面积为 5cm×5cm,将棉拭子放入 10ml 灭菌生理盐水的试 管中。
美罗培南无菌检查的方法学验证

美罗培南化学名称为: ( 4 R, 5 S , 6 S ) 一 3 - [ [ ( 3 S , 5 S ) 一 5 一 ( 二 = : 甲基氨 甲酰基) 一 3 一 吡咯烷】 硫】 - 6 一 【 ( 1 R ) 一 1 - 羟 乙基卜4 一 甲基一 7 一 氧一 1 一 氮双环【 3 . 2 . O ] 庚一 2 一 烯一 2 一 羧酸三水合物。美罗培南为人工合成 的广谱碳青霉烯类抗生素 , 容易穿透 大 多数革兰 阳性和阴性细 菌的细胞壁 ,而达到其作用靶点青霉素结合蛋 白 美罗培南与氨基糖苷类抗生素合用可产生协同作用l 1 。 美罗培南适用于成人 和儿童由单一或多种对美罗培南敏感 的细菌引起的肺炎、 子宫 内膜炎、 皮肤 软组织感染、 败血症等。无菌检查法系用于检查药 典要求无菌 的药 品、 医疗 器具、 原料、 辅料及其他 品种是否无菌的一种方法[ 6 - 1 3 ] 。本实验对美 罗培南无 菌检硷方法进行验证。 1 试 验环 境 与 材料 1 . 1试验环境: 在环境洁净度为 B + A的无菌室中进行 。 l _ 2仪器: N K F 3 3 0一次性全封 闭集菌培养器 ( 温州图旺生物技 术设备有 限公司) 、 HT Y一 6 0 1智能集菌仪 ( 温州 图旺生物技术设备有限公司) 、 H Y 一 2 ( A ) 调速 多用 振 荡 器 ( 东莞 康 润 仪器 设 备 有 限 公司 ) 、 S P X 一 2 5 0智 能 生化 培 养 箱( 北京北瑞达医药科技有限公司) 、 MJ X一 1 5 0 B智能霉菌培养箱 ( 北京北瑞 达 医 药 科技 有 限 公 司) 、 Y X Q - L S 一 3 0 S I I 高 压 灭 菌锅 ( 西 安 常仪 仪 器 设 备 有 限
I 3试验用菌株 : 生孢梭 菌[ C MC C( B ) 6 4 9 4 1 1 ( 第 4代 ( 上海北诺生物科 技有限公司) 、 白色念珠菌l C MC C( B ) 9 8 0 0 1 】 ( 第 4代) ( 上海北诺生物科技有 限公司) 、 金黄色葡萄球菌[ C MC C ( B ) 2 6 0 0 3 1 ( 第 4代) ( 上海北诺生物科技有 限公司) 、 枯草芽孢杆菌[ C MC C( B ) 6 3 5 0 1 1 ( 第 4代) ( 上海北诺生物科技有限 公司) 、 大肠埃希菌 E C MC C( B ) 4 4 1 0 2 3 ( 第 3代) ( 七 海 北诺生物科技有限公 司) 、 黑 曲霉[ C MC C( B ) 9 8 O O 3 ] ( 第 3代) ( 上海北诺生物科技有限公 司) 。 l - 4培 养基 、 稀释 液 及缓 冲 液 1 . 4 . 1干粉培养基: 硫 乙醇酸盐培养基 ( 』 东环凯微生物科技有 限公司) 、
无菌检查方法验证
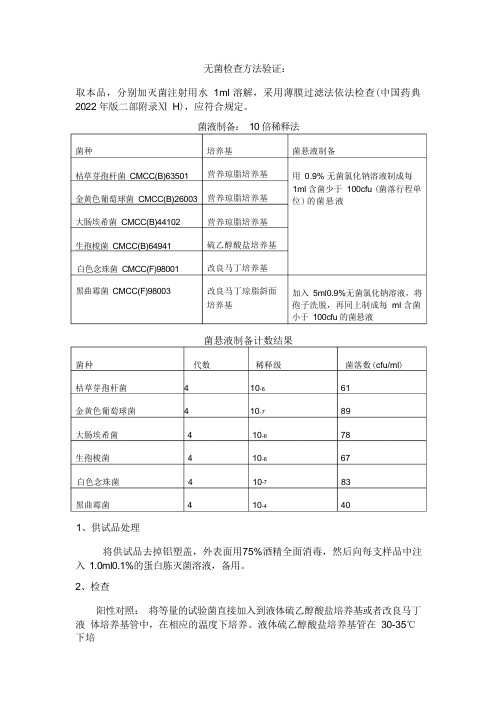
无菌检查方法验证:取本品,分别加灭菌注射用水 1ml 溶解,采用薄膜过滤法依法检查(中国药典 2022 年版二部附录Ⅺ H ),应符合规定。
菌液制备: 10 倍稀释法培养基 营养琼脂培养基营养琼脂培养基营养琼脂培养基硫乙醇酸盐培养基改良马丁培养基改良马丁琼脂斜面 培养基菌悬液制备计数结果菌种 代数 稀释级 菌落数(cfu/ml )枯草芽孢杆菌 4 10-6 61金黄色葡萄球菌 4 10-7 89大肠埃希菌 4 10-6 78生孢梭菌 4 10-6 67白色念珠菌 4 10-7 83黑曲霉菌 4 10-4 401、供试品处理将供试品去掉铝塑盖,外表面用75%酒精全面消毒,然后向每支样品中注 入 1.0ml0.1%的蛋白胨灭菌溶液,备用。
2、检查阳性对照: 将等量的试验菌直接加入到液体硫乙醇酸盐培养基或者改良马丁液 体培养基管中,在相应的温度下培养。
液体硫乙醇酸盐培养基管在 30-35℃下培菌种枯草芽孢杆菌 CMCC(B)63501 金黄色葡萄球菌 CMCC(B)26003 大肠埃希菌 CMCC(B)44102生孢梭菌 CMCC(B)64941白色念珠菌 CMCC(F)98001黑曲霉菌 CMCC(F)98003菌悬液制备用 0.9% 无菌氯化钠溶液制成每 1ml 含菌少于 100cfu (菌落行程单 位)的菌悬液加入 5ml0.9%无菌氯化钠溶液,将 孢子洗脱,再同上制成每 ml 含菌 小于 100cfu 的菌悬液养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
阴性对照:将灭菌的液体硫乙醇酸盐培养基或者改良马丁液体培养基管直接放在相应的温度下培养。
液体硫乙醇酸盐培养基管在30-35℃下培养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
样品 (薄膜过滤法):每种实验菌取10 支处理好的供试品溶液,将溶液合并后加入制备好的菌悬液1ml,用0.1%的蛋白胨灭菌溶液稀释至100ml,按薄膜过滤法过滤,取出滤膜,将其分为3 等份,分别置于含硫乙醇酸盐流体培养基及改良马丁培养基的容器中,其中一份作为阳性对照用。
银杏叶口服液微生物限度检查试验及方法学验证资料

银杏叶口服液微生物限度检查试验及方法学验证资料作者:朱晓燕来源:《中国新技术新产品》2011年第07期摘要:对银杏叶口服液进行微生物限度检查试验及其方法学验证,确认采用的方法适合于该药品的微生物限度检查。
关键词:银杏叶口服液;微生物限度检查法;方法学验证。
中图分类号:F763 文献标识码:A微生物限度检查法取银杏叶口服液3支(规格:10ml),共取10ml供试品,至90mlPH7.0氯化钠-蛋白胨缓冲液中,混匀,制成1:10、1:100、1:1000供试液备用。
细菌数取1:10供试液50ml用薄膜过滤法过滤。
用PH7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,每次冲洗100ml,共冲洗三次.冲洗后取出滤膜,菌面朝上贴于营养琼脂培养基平板上培养.若滤膜上无菌落生长,以霉菌数取各稀释级供试液1ml,采用平皿法,依法《中国药典》2005年版一部附录检查,应符合规定。
控制菌取1:10供试液10ml(相当于供试品1ml)接种至100 ml相应培养基中,培养18-24小时。
依《中国药典》2005年版一部附录检验,结果应符合规定。
微生物限度检查方法学验证依据《中国药典》2005年版,对银杏叶口服液的微生物限度检查法进行了方法学验证,验证结果如下:1样品:银杏叶口服液批号:10042114、10042124、10042134生产单位:哈药集团三精制药股份有限公司2 验证用菌种:金黄色葡萄球菌(Staphylococcus aureus) [CMCC(B)26003]大肠埃希菌(Escherichia coli)[CMCC(B)44102]枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]白色念珠菌(Candida albicans) [CMCC(F)98001]黑曲霉(Aspergillus niger) [CMCC(F)98003]3 验证用培养基:营养琼脂培养基批号:090225玫瑰红钠琼脂培养基批号:080905胆盐乳糖培养基批号:090104营养肉汤培养基批号:090121改良马丁培养基批号:090220曙红亚甲蓝培养基批号:090322以上培养基均由中检所提供。
无菌检查方法验证报告

无菌检查方法验证报告目录1. 目的 (3)2. 适用范围 (3)3. 接受标准 (3)4. 抽样计划 (3)5. 设备、试剂和菌种信息 (3)6. 试验步骤 (4)7. 供试品检查 (6)8. 结论 (6)9. 再验证周期 (6)10. 附件清单 (6)1.目的支据中国药典2020版无菌检查法的要求,对产品的无菌检查法进行验证,以确定一种无菌检查的方法能有效的消除该产品对微生物的抑制作用,从而证实该方法的有效性和实用性。
2.适用范围适用于本司产品的无菌检查。
3.接受标准与阳性对照比较,含供试液各容器中的试验菌(金黄色葡萄球菌、大肠埃希菌、生孢梭菌、白色念珠菌、枯草芽孢杆菌和黑曲霉)均生长良好,则可照此检查方法和检查条件进行供试品的无菌检查。
如含供试品的任一容器内的试验菌生长微弱、缓慢或不生长,则说明供试品的该检验量在该检验条件下有抑菌作用,需进一步改进检验条件再进行方法验证试验。
4.抽样计划随机抽取灭菌后的样品24份。
具体信息见表一:表一样品信息确认人/日期:复核人/日期:5.设备、试剂和菌种信息5.1设备信息详见表二表二设备信息确认人/日期:复核人/日期:5.2试剂信息详见表三:表三试剂信息确认人/日期:复核人/日期:5.3菌种信息详见表四:表四菌种信息确认人/日期:复核人/日期:5.3.1菌液的制备用接种环取金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的第三代培养物用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的菌悬液;用接种环取生孢梭菌的第三代培养物用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的菌悬液;用接种环取白色念珠菌的第四代培养物用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的菌悬液;用接种环取黑曲霉的第三代培养物,向培养物中加入10mL0.9%无菌氯化钠溶液,将孢子洗脱,转移孢子悬液至无菌试管内,用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的孢子悬液。
以上操作均在微生物检验室阳性菌室的生物安全柜中进行。
无菌、微生物限度检查及方法验证

01
02
03
直接接种法
将样品接种在培养基上, 观察是否有微生物生长。
薄膜过滤法
将样品通过薄膜过滤,收 集滤膜上的微生物,再进 行培养。
离心沉淀法
将样品离心,收集沉淀物 中的微生物,再进行培养 。
无菌检查的注意事项
确保环境洁净
无菌检查需要在洁净的环境中进行,以避免 外界微生物的污染。
避免样品中防腐剂的影响
方法验证
方法验证的定义与目的
定义
方法验证是对检测方法的可靠性、准确性和可重复性的评估过程,以确保该方 法能够满足预期的检测要求。
目的
方法验证的目的是确保所采用的无菌、微生物限度检查方法具有足够的灵敏度 、特异性、重现性和可操作性,以保证检测结果的准确性和可靠性。
方法验证的流程
准备验证计划
制定详细的验证计划,包括验 证实验的设计、实验步骤、数 据收集和分析等内容。
进出口检验
进出口药品需要进行严格的微生物限度检查,以确保药品符合进口 国或地区的质量标准,保障公众健康。
方法验证在药品质量控制中的应用
验证无菌、微生物限度检查方法的可靠性
通过方法验证可以确保无菌、微生物限度检查方法的准确性和可靠性,提高药品质量控制 水平。
评估检测方法的性能指标
方法验证过程中需要对检测方法的性能指标进行评估,如灵敏度、特异性、重现性等,以 确保检测结果的准确性和可靠性。
如果样品中含有防腐剂,可能会抑制微生物 的生长,因此需要进行相应的处理。
正确选择培养基
根据待测样品的特性,选择适合的培养基, 以确保微生物能够正常生长。
定期进行方法验证
无菌检查方法需要定期进行验证,以确保其 可靠性。
0义与目的
无菌、微生物限度、细菌内毒素方法学验证

无菌检查验证用菌株:
金黄色葡萄萄球菌 (Staphylococcus aureus) [CMCC(B) 26 003] 铜绿假单胞菌 (Pseudomonas aeruginosa) [CMCC(B) 10 104] **拟修订为大肠埃希菌 枯草芽孢杆菌 (Bacillus subtilis) [CMCC(B) 63 501] 生孢梭菌 (Clostridium sporogenes) [CMCC(B) 64 941] 白色念珠菌 (Candida albicans) [CMCC(F) 98 001] 黑曲霉 (Asperglllus niger) [CMCC(F) 98 003]
直接接种法
取符合直接接种法培养基用量要求的硫 乙醇酸盐流体培养基8管,分别接入小于 100cfu的金黄色葡萄球菌、铜绿假单胞 菌、枯草芽孢杆菌、生孢梭菌各2管;取 符合直接接种法培养基用量要求的改良 马丁培养基4管,分别接入小于100cfu的 白色念珠茵、黑曲霉各2管。其中1管接 人规定量的供试品,另1管作为对照,按 规定的温度培养3~5天。
验证的目的是为了确认试验中供试品应 选择药典中所收载的何种供试液制备方 法、何种测定方法及确定的检测系统是 否适用于该供试品的检验,即只有通过 方法验证,才能确定供试品的检验条件 和方法,保证“微生物限度检查”或 “无菌检查”方法的科学性和检验结果 的准确性。
2.不同企业生产的相同品种,特别是中
问题:方法选择错误
薄膜过滤法和直接接种法 如:一般供试品(无特殊说明)采用直接接种法 某厂家胸腺五肽注射液为普通注射剂,完全可以 采用薄膜过滤法,生产单位进行的无菌检查验证 法为直接接种法。 也有的厂家把两种方法的验证都写上,结论中也 没有说明采用那种方法。 CP2005:无菌检查法包括薄膜过滤法和直接接种 法,只要供试品性状允许,应采用薄膜过滤法。 修订:改为薄膜过滤法重新进行验证。
盐酸左氧氟沙星氯化钠注射液无菌检查方法学验证

盐酸左氧氟沙星氯化钠注射液无菌检查方法学验证作者:吴羽岚嵇海澄来源:《中国医药科学》2013年第13期[摘要] 目的对盐酸左氧氟沙星氯化钠注射液的无菌检查方法进行探讨,建立其无菌检查方法。
方法按《中国药典》(2010年版)附录ⅪH无菌检查方法进行。
结果在验证条件下,该方法能消除对微生物生长的抑制作用。
结论可以采用此法对本品的无菌进行检查。
[关键词] 盐酸左氧氟沙星氯化钠注射液;无菌检查方法;薄膜过滤法[中图分类号] R-331 [文献标识码] B [文章编号] 2095-0616(2013)13-95-02Study of sterile examination method of levofloxacin hydrochloride and sodium chloride injection WU Yulan JI HaichengJiangsu Hansoh Pharmaceutical Co.Ltd.,Lianyungang 222000,China[Abstract] Objective To discuss and establish the sterile examination method of levofloxacin hydrochloride and sodium chloride injection. Methods The test were done according to appendix XIH-sterile examination method in"Chinese Pharmacopeia"(2010 edition). Results The method could eliminate the inhibition of microbe growth under the validation condition. Conclusion This method can be used for the sterile examination of levofloxacin hydrochloride and sodium chloride injection.[Key words] Levofloxacin hydrochloride and sodium chloride injection;Sterile examination method;Membrane-filter procedure盐酸左氧氟沙星(Levofloxacin Hydrochloride)化学名称:(S)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧代-7H-吡啶并[1,2,3-de]-[1,4]苯并嗪-6-羧酸盐酸盐的水合物,属第三代喹诺酮类抗菌药。
无菌、微生物限度检查及方法验证

此法为实验室工作用菌种的最常用的保藏方法,仅能用于工作用菌种的短期保藏。
8
琼脂斜面低温保藏法保藏法(厂家常用)
保藏芽胞液对
产芽胞的微生物宜制成芽胞菌悬液后再保藏, 无菌操作,取1ml孢子液接入茄形瓶或培养皿内,轻轻转动使菌液均匀分布于培养基表面。 将培养皿在适当的温度下培养。一般需要7天或更长时间 在层流台下,取3~5ml氯化钠磷酸盐缓冲液(pH7.0)加入培养皿内 用无菌玻璃L棒轻轻刮下菌苔,注意不要划破培养基。 用无菌注射器或无菌吸管吸取菌悬液,收集于试管中。 将收集的芽胞液放在80~90℃水浴中加热15分钟,冷却。 做好标记,放至2~8℃冰箱中保藏。原始芽胞液可保存1年。 每次使用前用平皿法重新标定其浓度。
微生物实验室的质量管理
设施—洁净室、净化工作台、生物安全柜。 设备—高压蒸汽灭菌器、电热恒温干烤箱、培养箱、冰箱。 实验仪器—全封闭薄膜过滤装置、电动匀浆仪、电热恒温水浴箱、离心机、显微镜,及刻度吸管、试管、三角烧瓶、培养皿等。 建立主要设施、设备、仪器的明细记录,内容包括名称、型号、生产厂家、购买日期。 质量保证档案:购买发票、安装验收或开箱验收记录、调试记录、计量检定或运行校验合格证、指定专人负责、制订标准操作规程(SOP)、建立使用登记册,维修、保养记录、改造或更新记录、直至报废记录。
记录温湿度是否在规定的范围内,每次实验时,对操作室和层流台做微生物沉降菌落计数并记录;如发现问题应找原因,及时报修和报告并将报修原因和结果记录归档。如遇停电,应立即停止实验,重新进入无菌室前,至少开启机房运转1小时以上。
实验室使用管理
微生物实验室的质量管理
平时实验室内应尽可能减少人员的走动或活动,通向洁净室的门要关闭或安装自动闭门器使其保持关闭状态。
枯草芽孢杆菌 [CMCC(B)63501] 金黄色葡萄球菌 [CMCC(B)26003] 生孢梭菌 [CMCC(B)64941] 铜绿假单胞菌 [CMCC(B)10104] 大肠埃希菌 [CMCC(B)44102] 乙型副伤寒沙门菌 [CMCC(B)50094] 白色念珠菌 [CMCC(B)98001] 黑曲霉 [CMCC(B)9 003]
蛇胆川贝液微生物限度检查试验及方法学验证资料

计数 方 法验 证 结 果
表 1 批 号 :6 2 1 4 0 12 1
2 样品 : 胆J贝液 1 蛇 I I
批 号 :6 2 14 0 12 1 00 0 1 7 15 4
生产单位: 哈药集团三 精制药股份有限公司 6 A稀 释剂 对 照组 : . 1 用 2 验证用菌种 2 相 应 稀 释剂 代替 供 试 品 , 按 金 黄 色 葡 萄球 菌 [a hl ocs ar  ̄ S py ccu ue t o u [MC (2 0 3 C CB 60 ] ) 6 . 2霉菌及酵母菌计数 大 肠 埃 希 菌 ( s e ci cl f C 回 方法验 证 E c r h o) M C h i a iC
-
10 9 -
市I 与 路I 政I I 桥
何 友 生
科 信 技
— —
黑 龙 江— —
息
高速公路计重收费系统施工探讨
( 中铁 四局 集团电气化工程有限公 司, 安徽 蚌埠 2 34 ) 3 0 0
摘 要: 近年来 , 国家经济快速发展 , 高速公路 建设 如火如茶, 车里程 日新月异 , 通 计重收 费系统在 高速公路 中的应用越 来越广泛。 因此, 根据 高 速公路现场施工的一些经验, 以山东德商高速公路 菏曹段 计重收费 系统为例 , 对动态称重 系统施工进行探讨。 关键词 : 计重收 费系统 ; 施工;g t 讨
下:
9mP 7 0 lH . 0氯化 钠 一蛋 白胨 缓 冲液中 , 合均匀 , 昆 制成 1 : l 供试液备用。 0 6 方法学验 证试验 61 细菌计数方法验证 61 试验组 : 11 .1 . 取 :0供 试液 ll m 加入 相应 阳性试 验 菌菌悬液 ld立即倾注一定 , r r 量 营养 琼脂 培养基 , 置 3~5 0 3 ℃培养, 每株试验菌平 行制 备二 个平行 样 ,测 定其 菌数 。 6 :菌液组:取制备好 .2 1 的 试 验 菌 悬 液 l l 平 皿 m至 中,倾往一定量琼脂培养基, 至相应的温度培养。测定所 加的试验菌数。 . 3供 6 . 试 品对 照 组 : 1 取 规定量供试液 ,按菌落计数 方法测定供试品本底菌数。
微生物限度方法学验证完整版

微生物限度方法学验证 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】微生物限度检查方法学验证一、检验方法依据微生物计数法(中国药典2015年版四部1105);控制菌检查法(中国药典2015年版四部1106);非无菌药品微生物限度标准(中国药典2015年版四部1107);抑菌效力检查法(中国药典2015年版四部1121)检查。
二、菌种、培养基及稀释液表2培养基表3对照用培养基表4试剂稀释液:(1)缓冲液取L磷酸二氢钾溶液250ml,加L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,既得。
(2)%无菌氯化钠溶液取氯化钠,加水溶解使成1000ml,过滤,分装、灭菌。
(3)%(ml/ml)聚山梨酯80的%无菌氯化钠溶液取聚山梨酯80 ,用%无菌氯化钠溶液溶解并稀释至1000ml,滤过,分装,灭菌,备用。
(4)靛基质试液取对二甲氨基苯甲醛,加入95%乙醇95ml,充分振摇,使完全溶解后,取盐酸20ml徐徐滴入。
三、菌液的制备1细菌、霉菌、酵母菌接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中,培养24小时;接种白色念珠菌的新鲜培养物至改良马丁培养基上,培养48小时。
上述培养物用%无菌氯化钠溶液制成每1ml含菌数为50~100cfu的菌悬液备用。
接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基上,培养7天,加入5ml含%(ml/ml)聚山梨酯80的%无菌氯化钠溶液,将孢子洗脱,然后吸出孢子悬液(用带有无菌棉花的能过滤菌丝的无菌毛细吸管)用%无菌氯化钠溶液制成每1ml 含孢子数50~100cfu的孢子悬液。
菌液制备后若在室温下放置,应在2小时内使用,若保存在2~8℃可在24小时内使用。
2控制菌接种大肠埃希菌、乙型副伤寒沙门菌、金黄色葡萄球菌的新鲜培养物至营养肉汤培养基中,培养24小时。
用%无菌氯化钠溶液制成每1ml含菌数为10~100cfu 的菌悬液。
熊胆粉微生物限度检查方法学验证

熊胆粉微生物限度检查方法学验证目的建立熊胆粉微生物限度检查方法,并对方法进行验证。
方法采用《中国药典》2010年版一部附录ⅩⅢC微生物限度检查法对熊胆粉进行微生物限度检查。
结果用pH 7.0的无菌氯化钠蛋白胨缓冲液制备样品,可采用培养基稀释法(1∶20供试液,0.1 mL/皿)进行细菌计数;采用培养基稀释法(400 mL 营养肉汤)进行沙门菌检查;采用1∶10供试液的常规法进行霉菌及酵母菌计数和控制菌检查。
结论该方法消除了样品的抑菌性,可用于该品种的微生物限度检查。
[Abstract] Objective To set up the microbial limit test ways for bear gall powder and verification of the method. Methods A microbial limits method of Chinese Pharmacopeia (2010 edition) part one appendix ⅩⅢC was used to detected the microbial limit test method of bear gall powder. Results Sodium chloride-peptone aseptic buffer solution (pH=7.0) was used to prepare the test sample. Culture media dilution (1∶20 sample solution, 0.1 mL/dish) was used to count the bear gall powder bacteria. Salmonella test method for culture media dilution method (400 mL NB) was used. 1∶10 selected liquid was adopted to do the mildew and yeast count and control bacteria inspection by the conventional method. Conclusion This method can eliminate the antimicrobial properties and it can be used for the microbial limit test for bear gall powder.[Key words] Bear gall powder; Microbial limit test; Validation熊胆粉为熊科动物黑熊Selenaretos thibetanus Cuvier经胆囊手术引流胆汁而得的干燥品,收载于国家药品标准《新药转正标准》第11册[1],本品有一定的抑菌作用[2],但其微生物限度檢查一直采用常规方法检验,根据《中国药典》2010年版的要求,对原用的常规方法进行验证[3]。
2022版药典微生物限度微生物无菌方法学验证流程

2022版药典微生物限度微生物无菌方法学验证流程1.:提交单位购买申请菌种的购买:需要1.5个月单位介绍信证明工作用途等文件,并向中检院网站提交申请,接到申请后一个月后中检院会把有的菌种邮寄到使用单位,中检院菌种经常缺货并不是很齐全,不能一次买齐所需要的8种菌一次性买齐,2.每种从菌复活、分离、纯化复壮:共需要30天药典规定进行药品检验所需8种标准阳性菌,购买中检院冻干菌粉后进行复活与保藏1大肠埃希菌2金黄色葡萄球菌3枯草芽孢杆菌4生孢梭菌5铜绿假单胞菌6沙门菌(细菌每种冻干菌粉复活到分离纯化保藏各需要3-4天时间)7白色念珠菌8黑曲霉菌(霉菌酵母菌冻干菌粉从复活到分离纯化制备孢子菌悬液需要至少7天时间)3.培养基适用性/灵敏度验证:需要60-80天实验中使用的培养基需要进行与中检院提供的标准培养基进行培养基适用性验证每种培养基不同批号之间也需要进行验证之后方可以进行微生物检验用药检室现有培养基种类20余种,每种培养基验证需要3-4天,完成所有培养基适用性验证需要60-80天。
恩替卡韦分散片微生物限度方法学适用性验证:1.回收率验证:回收率验证实验共需要26天(若回收率达不到药典规定需要重新选用另一种方法进行验证)五种实验菌分别验证1金黄色葡萄球菌2铜绿假单胞菌3枯草芽孢杆菌4白色念珠菌5黑曲霉菌五种阳性菌的回收率验证需使标准阳性菌回收率在阳性对照组计数达到50%-200%之间假设验证一次成功3种细菌回收率各需要4天时间,2霉菌酵母菌各需要7天时间2.控制菌适用性验证:共需要20天大肠埃希菌控制菌方法:需要5天时间其他制剂含药材原粉的中药制剂需要检查沙门菌、耐胆盐革兰式阴性菌各需要7天时间共1周实验室消毒实验用具灭菌,实验细菌培养物灭活处理,实验用具洗涮等方法学验证一次顺利完成共需要46天,验证方法过程需要重复一遍作为方法学适用性确认复方茵陈注射液无菌方法学适用性验证:1.方法适用性验证:验证实验共需要30天(若回收率失败或达不到药典规定回收率需要重新选用方法进行验证)五种实验菌分别验证1金黄色葡萄球菌2大肠埃希菌菌3枯草芽孢杆菌4生孢梭菌5白色念珠菌6黑曲霉菌6种实验组阳性菌需与对照管组进行对照,含供试品的实验菌均生长良好则说明方法可行假设验证一次成功每种菌分别按规定温度培养,培养时间不得超过5天实验室消毒实验用具灭菌,实验细菌培养物灭活处理,实验用具洗涮等,方法学验证一次顺利完成共需要30余天,验证方法过程需要重复一遍作为方法学适用性确认。
微生物限度检查方法学验证实验

生物安全柜(Biological safety cabinets, BSCs)是为操作原代培养物、菌毒株以及诊 断性标本等具有感染性的实验材料时,用来 保护操作者本人、实验室环境以及实验材料, 使其避免暴露于上述操作过程中可能产生的 感染性气溶胶和溅出物而设计的。
生物安全柜正广泛用于微生物和生物工程及 其他对操作环境有苛刻要求的场所,目前正 在为医疗卫生、制药、科学研究领域提供无 菌、无尘的可移动的工作环境。
用于微生物限度验证的菌种
菌株选择的原则:代表性,普遍性,低或非致病性,标准 菌株(或该药品中常见的污染菌)
菌种的要求:不得超过5代,采用适宜的方法保存。
CMCC (China Medical Culture Collection Center) 中国医学微生物菌种保藏管理中心 B- Bacteria(细菌) F-Fungi(真菌)
(1) 不确定性:药品受外来微生物的污染,这种 污染是可有可无;在有中又可多可少;其种类可 以多样.污染的情况依生产,设备,原材料,管理, 剂型等等条件而定,非药品本身所固有.所以微 生物限度检验的对象是不确定的.药品所规定 的项目,除无菌检查,热原具有上述性质,其他 项均无此特征.这一点往往被忽视.污染对药品 而言是一个意外事件.污染批号中的不合格品 是一个随机变量.
结果时 。 定期的验证。
同一产品不同批次、不同企业生产的同一产品。
当建立药品的微生物限度检查方法时,应进 行细菌、霉菌及酵母菌计数的方法学验证, 以确认所采用的方法适合于该药品的细菌、 霉菌及酵母菌数的测定。
验证时,按供试液的制备和细菌、霉菌及酵 母菌计数所规定的方法及下列要求进行,对 各试验菌的回收率逐一进行验证。
产单位全面质量管理水平与提高药品质量的 重要措施.
2008 无菌_微生物限度及细菌内毒素检查方法学验证中常见问题及分析_国明

中国药品标准 2008年第 9卷第 1 Nhomakorabea 47以减少膜的吸附, 对于抑菌性较强的注射用无菌粉 末或固体原料, 一定要充分溶解、混合均匀。 114 加菌时机不一致
验证试验主要考虑滤器中残留抗菌物质对阳性 菌生长的影响, 应与对照滤器比较而作出判断, 所以 验证试验中加菌时机要与对照一致 [ 2] 。
115 薄膜过滤法滤膜材质选择不正确, 直接影 响试验结果
20 05年 版药 典执 行以 来药 品 生 产企 业 、科 研 单 位等 在药品质量标准建立及检验工作中困难和问题较多 的项目。我们在药品注册品种的审核检验中, 发现 有的申报单位对方法学验证的意义理解不够, 验证 试验的科学性、完整性及可操作性均存在着很多问 题。为尽快提高方法学验证水平, 更好地保证用药 的安全性, 现将方法学验证工作中常遇到的问题进 行分析、讨论。 1 无菌检查方法学验证问题及分析 111 验证菌株选择不正确 11111 敏感菌株与阳性对照菌不一致, 降低了阳性 对照菌的意义。有些药品选择了敏感菌株进行方法 学验证试验, 但是无菌检查时阳性对照菌不是验证 试验选定的敏感菌株。实际工作中抑制枯草芽孢杆 菌的样品很多, 可用此作为敏感菌株, 但药典规定无 菌检查时以金黄色葡萄球菌作为阳性对照菌, 使金 黄色葡萄球菌失去了阳性对照菌的意义。应在此类 无菌检查时也增加敏感菌株作为阳性对照菌。 11112 2005年版药典无菌检查中规定 / 抗革兰阴 性菌为主的供 试品以大肠埃希菌为对照菌 0, 但方 法学验证规定用菌株没有大肠埃希菌, 缺少了验证 此类药物抗菌作用的代表菌株。建议对抗菌作用中 明确具有抗革兰阴性菌的药品进行无菌检查方法学 验证时, 应增加大肠埃希菌作为验证菌株。 112 验证时取样量不符合要求 11211 无菌检验量与验证试验的取样量不同, 与中 国药典 2005年版方法学验证要求不符。进行供试 品检查时, 所采用的检验方法和检验条件应与验证 的方法相同, 应按照规定的检验数量和检验量取样。 11212 有的生产单位无菌检查方法学验证仅按抽 验产品检验数量进行验证, 药典规定应按照批出厂 产品最少检验数量进行试验 [ 1] 。 113 方法选择错误或不恰当, 不符合 2005 年版中 国药典要求 11311 有的申报单位无菌检查时无论什么药品都 用直接接种法。 2005年版中国药典规定, 只要供试 品性状允许, 应采用薄膜过滤法 [ 1] 。 11312 有些申报单位对非抑菌性供试品也用大量 的冲洗液冲洗, 如每次 100 mL, 10次 /膜, 既增加了 对膜的损伤和对微生物生物特性的破坏机会, 也增 加了检验繁琐性和检验人员的工作量。所以薄膜过 滤时尽 可能 减少 冲 洗量, 冲 洗 不一 定 为每 次 100 mL, 可少量多次, 并注意充分振摇。对于抑菌性较 强的供试品, 可以先用适宜的稀释液稀释后再过滤,
盐酸左氧氟沙星氯化钠注射液无菌方法学确认

盐酸左氧氟沙星氯化钠注射液无菌方法学确认摘要:目的:建立盐酸左氧氟沙星氯化钠注射液实验室转移的无菌方法学确认。
方法:采用《中国药典》2020年版四部无菌检查法-薄膜过滤法。
结果:按该方法进行试验,样品的检验量在该检验条件下无抑菌作用。
结论:盐酸左氧氟沙星氯化钠注射液在实验室转移后,按此方法进行无菌检查是可行的。
关键词:盐酸左氧氟沙星氯化钠注射液;无菌检查法;薄膜过滤法一、目的根据《盐酸左氧氟沙星氯化钠注射液》质量标准【无菌】检查项下规定,进行实验室转移的无菌方法学确认,经确认的方法进行试验,确定样品的检验量在该检验条件下无抑菌作用,建立其无菌检查方法。
二、实验仪器与样品1、仪器和试药:立式压力蒸汽灭菌器、ZW集菌仪、三联集菌培养器、接种棒、试管、培养皿、生化培养箱、无菌生理盐水、硫乙醇酸盐流体培养基(北京三药科技开发公司)、胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖琼脂培养基、沙氏葡萄糖液体培养基(均广东环凯微生物科技有限公司)、3批样品(规格:250ml:左氧氟沙星0.5g与氯化钠2.25g)。
2、试验用菌种:均由中国食品药品研究院提供金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(B)44102]、枯草芽孢杆菌[CMCC(B)63501]、生孢梭菌[CMCC(B)64941]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]。
三、实验操作及结果1、菌液的制备:1.1分别取金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的新鲜培养物少许接种至胰酪大豆胨液体培养基中,生孢梭菌的新鲜培养物少许接种至硫乙醇酸盐流体培养基中,30~35C°培养18~24h。
取经培养24h的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的胰酪大豆胨液体培养物1ml,0.9%无菌氯化钠溶液10倍量逐级稀释至含菌数小于100cfu的菌悬液。
取经培养24h的生孢梭菌的硫乙醇酸盐流体培养物1ml,0.9%无菌氯化钠溶液10倍量逐级稀释至含菌数小于100cfu的菌悬液。
微生物方法学验证范本

编码:VP-C01-MM-01 XXXX软膏微生物限度检查方法学验证方案起草人:年月日审核人:年月日年月日年月日批准人:年月日目录1.验证立项表2.验证内容2.1验证目的2.2验证范围2.3验证要求2.4验证方法2.4.1.试验原料、稀释剂和标准微生物2.4.2细菌、霉菌及酵母菌验证内容2.4.3金黄色葡萄球菌验证内容2.4.4铜绿假单胞菌验证内容3.验证报告验证立项表(REC)XXXX软膏微生物限度检查方法学验证方案1.验证目的XXXX软膏配方中含水杨酸、硼酸,该两种物质具有一定的抑菌性。
根据《中国药典》(2005年版)微生物限度检查标准规定,对XXXX软膏进行细菌、霉菌及酵母菌、铜绿假单胞菌、金黄色葡萄球菌检查方法的验证试验,以确认供试品的抑菌活性及测定方法的可靠性。
2.验证范围本公司XXXX软膏的微生物限度检测。
3.判定标准3.1验证小组成员3.2细菌、霉菌及酵母菌在3次平行试验中,稀释剂对照组的菌回收率(稀释剂对照组的平均菌落数占菌液组的平均菌落数的百分率)应均不低于70%,试验组的菌回收率(试验组的平均菌落数减去供试品对照组的平均菌落数的值占菌液组的平均菌落数的百分率)均不低于70%;产品的试验组与阳性菌组的菌落数差异不超过30%,假定产品试验组的平均值与阳性菌组的平均值之比为Q,则0.7W Q W1.3。
3.3金黄色葡萄球菌在3次平行试验中,供试品组:结果应为阴性,未检出金黄色葡萄球菌;试验组:结果应为阳性,检出金黄色葡萄球菌;阴性对照组:结果应为阴性,未检出阴性对照菌;阳性对照组:结果应为阳性,检出金黄色葡萄球菌。
3.4铜绿假单胞菌在3次平行试验中,供试品组:结果应为阴性,未检出铜绿假单胞菌;试验组:结果应为阳性,检出铜绿假单胞菌;阴性对照组:结果应为阴性,未检出阴性对照菌;阳性对照组:结果应为阳性,检出铜绿假单胞菌。
4.验证方法4.1试验原料、稀释剂和标准微生物4.1.1试验样品:XXXX软膏三批,批号为、、。
无菌检查的方法学验证

无菌检查方法(中国药典2010版)验证方案验证方案编号:起草单位(Composed by):质检部(QC Department)起草人(Composer):日期(Date):审核人(Reviewed by QC):日期(Date):审核人(Reviewed by QA):日期(Date):批准人(Approved by):日期(Date):目录1. 验证目的2. 验证人员3. 验证依据及参考文件4. 仪器与设备5. 验证过程5.1 培养基及稀释液5.2 菌液的培养与制备5.3 方法验证试验6. 验证总结1. 验证目的:本试验是注射液的抑细菌、抑真菌活性及所用的无菌检查方法的可靠性进行验证,以确认该产品在该检验量、该检验条件下无抑菌活性或其抑菌活性已被充分消除至可以忽略。
即:保证所用的无菌检验方法能对该产品进行准确、可靠的检验。
2. 验证人员:验证小组组长:验证小组副组长:验证小组成员:3. 验证依据及参考文件:验证依据:中华人民共和国药典2010版二部参考文件:2010年版中国药典无菌检查方法、验证操作学习班讲稿汇编(中国药品检验所)4. 仪器与设备XG1.DM-0.36B型机动门脉冲真空灭菌器细菌培养箱霉菌培养箱净化工作台5. 验证过程:5.1 培养基及稀释液5.1.1 培养基及稀释液的配制按“中国药典2010版二部附录Ⅺ H无菌检查法”中,有关规定配制本验证所需培养基:5.1.2培养基的适用性检验5.1.2.1 培养基无菌性检查从以上培养基及稀释液中,每批随机取5支(瓶),培养14天,应无菌生长。
结果记录:结论:5.1.2.2 培养基灵敏度检查取每管装量为12ml的硫乙醇酸盐流体培养基9支,分别接种小于100cfu的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌各2支,另1支不接种作为空白对照,培养3天,逐日观察结果。
取每支装量为9ml的改良马丁培养基5支,分别接种小于100cfu的白色念珠菌、黑曲霉各2支,另1支不接种作为空白对照,培养5天,逐日观察结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021/3/12
无菌、微生物检查法方法学验证实
2
例
• 方法:中国药典2005版无菌检查中薄膜 过滤法方法验证
• 验证试验用菌种:验证试验用菌种包括 金黄色葡萄球菌(26003)、铜绿假单胞 菌(10104)、枯草芽孢杆菌(63501)、 生孢梭菌(64941)、白色念珠菌 (98001)、黑曲霉菌(98003),来自
2021/3/12
无菌、微生物检查法方法学验证实
5
例
供试液制备:取样品10瓶分别加0.1%蛋 白胨溶液30 ml溶解后,过滤。
7. 活菌计数 活菌计数结果见表1。
2021/3/12
无菌、微生物检查法方法学验证实
6
例
10-4稀释 10-5稀释 10-7稀释
试验次数
1 2 1212
金黄色葡萄球菌
56 60
2021/3/12
无菌、微生物检查法方法学验证实
8
例
薄膜过滤法:
取样品11支,将样品过滤于封闭式滤器(3 联筒/套),用0.1%蛋白胨氯化钠溶液冲洗 500ml后,再分别人工污染金黄色葡萄球菌、 枯草杆菌50~100个/筒即可,同时平行做稀释 剂的对照组。将稀释剂对照滤筒和污染阳性 菌的验证滤筒置37℃培养3~5d,逐日观察, 结果见表2、3、4。
(3) 大肠埃希菌(Escherichia coli) [CMCC(B) 44102];
(4) 铜绿假单胞菌(Pseudomonas aeruginosa) [CMCC(B) 10104];
(5) 生孢梭菌(Clostridium sporogenes)[CMCC(B) 64941];
(6) 白色念珠菌(Candida albicans)[CMCC(F) 98001];
无菌检查、微生物 限度检查 方法学
验证实例
2021/3/12
无菌、微生物检查法方法学验证实
1
例
虎杖苷注射液无菌检查的方法验证
• 样品:虎杖苷注射液由深圳海王药业有限公司 提供,批号。
• 培养基:无菌检查用硫乙醇酸盐液体培养基,
批号040203;霉菌液体培养基,批号 040302; 营养肉汤培养基,批号 ;营养琼脂培养基, 批号 040513;0.1%蛋白胨溶液,批号050217; 虎红钠琼脂培养基,批号040202;由中检所所 培养基室提供。
17
例
取 经 32.5±2.5℃ 培 养 19~21h 小 时 的 大 肠 埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、 铜绿假单孢菌肉汤培养物1ml,加9ml生理盐 水,10倍稀释至约10-5~10-8之间。
取经36℃培养18~22h的生孢梭菌硫乙醇 酸盐流体培养基培养物1ml,加9ml生理盐水 ,10倍稀释至10-6,混匀备用。
中国医学细菌保藏中心。
2021/3/12
无菌、微生物检查法方法学验证实
3
例
菌液制备:
取经34℃培养18~24小时的金黄色葡萄 球菌、绿脓假单胞菌与枯草芽孢杆菌肉汤液 体培养物1ml加入9ml 0.9%氯化钠溶液中, 10倍稀释至10-5~10-7约为50~100cfu/ml 备用。
取经24℃培养18~24小时的白色念珠菌
液体培养物1ml,加入9ml 0.9%氯化钠溶液
中,10倍稀释至10-5约为50~100cfu/ml备
用。
2021/3/12
无菌、微生物检查法方法学验证实
4
例
取经34℃培养18~24小时的生孢梭菌硫乙 醇酸盐液体培养物1ml ,加入9ml 0.9%氯化 钠溶液中,10倍稀释至10-7备用。
取经培养一周的黑曲霉斜面培养物,加 0.9%氯化钠溶液3ml,洗下孢子,转移至另 一空管,标准比浊管比浊后,取1ml加入9ml 0.9%氯化钠溶液中10倍稀释至10-4约为50~ 100cfu/ml备用。
无菌、微生物检查法方法学验证实
16
例
操作方法
菌液制备:
取金黄色葡萄球菌、枯草芽孢杆菌、大 肠埃希菌、铜绿假单胞菌的新鲜培养物少许 接种至营养肉汤培养基中, 生孢梭菌的新鲜 培养物少许接种至硫乙醇酸盐流体培养基中, 32.5±2.5℃培养18~24小时;
2021/3/12
无菌、微生物检查法方法学验证实
(7) 黑曲霉(Aspergillus niger) [CMCC(F)98003]。
2021/3/12
无菌、微生物检查法方法学验证实
15
例
仪器和滤器:HTY-2000A集菌仪,全封闭无 菌试验过滤培养器(批号)北京牛牛基因有 限公司。
方法:中国药典2005年版无菌检查的验证实 验
2021/3/12
2021/3/12
无菌、微生物检查法方法学验证实
13
例
头孢噻肟钠无菌原料的无菌实验方法验证
• 样品:头孢噻肟钠无菌原料,规格:0.5g/瓶; 批号:;生产单位:Aventis Pharma Deutschland GmbH
• 培养基:硫乙醇酸盐流体培养基、真菌培养基、 营养肉汤、普通斜面、真菌斜面、营养琼脂、 虎红琼脂(均由中国药品生物制品检定所培养基 室提供)
2021/3/12
无菌、微生物检查法方法学验证实
9
例
2021/3/12
无菌、微生物检查法方法学验证实
10
例
2021/3/12
无菌、微生物检查法方法学验证实
11
例
2021/3/12
无菌、微生物检查法方法学验证实
12
例
结论:
根据上述结果,由于采用直接接种 法进行虎杖苷注射液的无菌检查,存在 对金黄色葡萄球菌和枯草杆菌生长的抑 制作用。因此,虎杖苷注射液的无菌检 查应依据中国药典无菌检查方法中的薄 膜过滤法进行,冲洗量规定为500ml。
枯草芽孢杆菌
77 79
白色念珠菌
86 70
黑曲霉菌
80 76
铜绿假单胞菌
47 50
2021/3/12
无菌、微生物检查法方法学验证实
7
例
方法验证
直接接种法:取样品12支,分别接种8 支硫乙醇酸盐和4支霉菌液体培养基 2ml/支后,再按要求加入相应的阳性菌 液(30-100个/ml),置规定温度培养 3-5天,逐日观察结果。
• β-内酰胺酶:2ml大于300单位/毫升(批号:)
2021/3/12
无菌、微生物检查法方法学验证实
14
例
验证试验用菌种:
(1)金黄色葡萄球菌(Staphylococcus aureus) [CMCC(B) 26003];
(2) 枯草芽孢杆菌(Bacillus subtilis)[CMCC(B) 63501];
2021/3/12
