富马酸替诺福韦酯杂质结构方式,杂质标准品
富马酸替诺福韦二吡呋酯中6种有关物质高效液相色谱测定方法改进

富马酸替诺福韦二吡呋酯中6种有关物质高效液相色谱测定方法改进程诚;杨智慧【摘要】目的建立测定富马酸替诺福韦二吡呋酯中6种有关物质的高效液相色谱法.方法色谱柱采用Waters Symmetry C18柱(250 mm×4.6 mm,5μm),以甲醇-0.01 mol/L磷酸氢二钠溶液(用磷酸调节pH至5.0)-叔丁醇(15:22:3)为流动相A,以甲醇-0.01 mol/L磷酸氢二钠溶液(用磷酸调节pH值至5.0)-叔丁醇(30:7:3)为流动相B进行梯度洗脱,流速为1.0 mL/min,检测波长为260 nm,柱温为30℃.结果该制剂中杂质C、杂质D、杂质E、杂质F、杂质G、富马酸质量浓度的线性范围为0.375~20.000 mg/mL;信噪比(S/N)≥3时,富马酸、杂质D、杂质E、杂质F 的检出限为7.5 ng/mL,杂质C和杂质G的检出限为0.15μg/mL;S/N≥10时,富马酸、杂质D、杂质E、杂质F的定量限为15 ng/mL,杂质C和杂质G的定量限为0.375μg/mL.富马酸、杂质C、杂质D、杂质E、杂质F和杂质G的回收率分别为98.70%,99.13%,98.90%,99.51%,99.10%,98.59%,RSD分别为1.28%,1.04%,1.03%,0.97%,1.25%,0.94%(n=9).结论该方法重复性好,专属性强,可更有效地控制富马酸替诺福韦二吡呋酯的质量.【期刊名称】《中国药业》【年(卷),期】2018(027)024【总页数】4页(P31-34)【关键词】富马酸替诺福韦二吡呋酯;有关物质;高效液相色谱法;质量控制【作者】程诚;杨智慧【作者单位】江苏省连云港市食品药品检验检测中心,江苏连云港 222000;江苏省连云港市食品药品检验检测中心,江苏连云港 222000【正文语种】中文【中图分类】R927.2;R917;R979.5富马酸替诺福韦二吡呋酯是美国Gilead Sciences公司研制的新型核苷酸逆转录酶抑制剂,临床主要用于治疗人类免疫缺陷病毒(HIV)感染[1-4];同时可通过干扰乙型病毒型肝炎(简称乙肝)病毒DNA聚合酶的功能而抑制乙肝病毒的复制[5],降低血清及肝组织内的病毒载量。
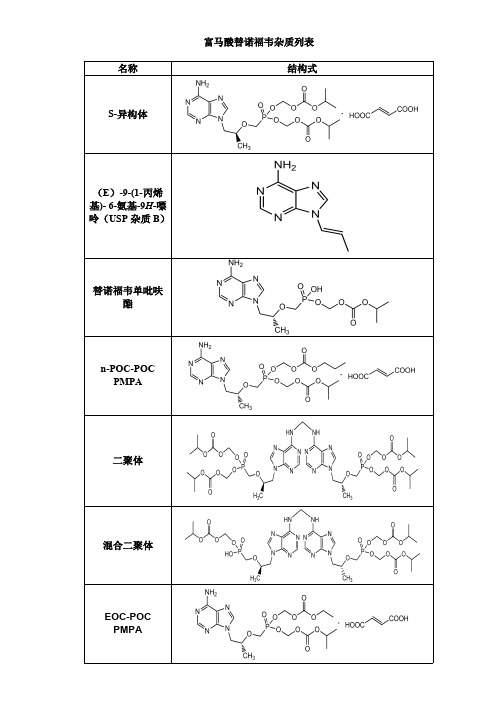
富马酸替诺福韦杂质列表
深圳菲斯是专业进口标准品代理商,主要品牌有 TRC、TLC、Molcan、EP、BP、 USP、Sinco 等品牌标准品。 1.替卡格雷杂质 2.利伐沙班杂质 3.阿考替胺杂质 4.普拉克索杂质 5.阿哌沙班杂 质 6.氨氯地平杂质 7.硼替佐米杂质 8.比索洛尔杂质 9.阿比特龙杂质 10.非布司 他杂质 11.安立生坦杂质 12.依折麦布杂质 13.厄洛替尼杂质 14.索拉非尼杂质 15. 维格列汀杂质 16.阿伐那非杂质 17.托法替尼杂质 18.米格列奈杂质 19.沃替西汀 杂质 20 尼贝地平杂质 21.艾帕列净杂质 22.阿普斯特杂质 23.门冬氨酸缩合物 24. 依托考昔杂质 25.达格列净杂质 26.尼达尼布杂质 27.托匹司他杂质 28.坎格列净 杂质 29.帕泊昔利布杂质 30.依鲁替尼杂质 31.盐酸氨溴索杂质 32.达比加群酯杂 质等库存 库存新产品,当天发货!
富马酸替诺福韦杂质列表 名称 结构式
S-异构体
(E)-9-(1-丙烯 基)- 6-氨基-9H-嘌 呤(USP 杂质 B)
替诺福韦单吡呋 酯
n-POC-POC PMPA
二聚体
混合二聚体
EOC-POC PMPA
DEC-POC PMPA
Des-Methyl TDF (去甲基替诺福 韦二吡呋酯)
MOC-POC PMPA
富马酸丙酚替诺福韦 结构式

富马酸丙酚替诺福韦结构式富马酸丙酚替诺福韦的结构式如下:富马酸丙酚替诺福韦是一种抗病毒药物,其化学名称为(S)-2-((S)-2-{[(S)-1-((2-氨基-9H-嘧啶-6-基)甲基)-2-恶唑基](甲基)氨基}-3-羟基丙酸(2R,3S)-2-乙酯。
这种药物主要用于治疗乙型肝炎病毒感染。
富马酸丙酚替诺福韦的结构式中展示了药物分子的结构组成和空间排列。
富马酸丙酚替诺福韦由多个功能基团组成,包括嘧啶环、恶唑环、甲基氨基和羟基丙酸基团。
这些功能基团在药物分子中有着特定的位置和排列,与药物的抗病毒活性密切相关。
富马酸丙酚替诺福韦的嘧啶环是药物分子的核心结构,具有抗病毒活性的关键作用。
嘧啶环上的氨基和甲基氨基团通过形成氢键与病毒RNA的碱基配对结合,从而抑制病毒复制。
恶唑环则通过与病毒酶结合抑制其活性,进一步阻断病毒复制过程。
富马酸丙酚替诺福韦的羟基丙酸基团也具有重要的作用。
羟基丙酸基团通过与病毒RNA或酶结合,调节药物与病毒之间的相互作用,增强抗病毒效果。
富马酸丙酚替诺福韦的结构式不仅展示了药物分子的结构组成,还提供了药物分子空间结构的信息。
药物分子的空间结构对于其与病毒靶点的相互作用至关重要。
药物的空间结构决定了其在生物体内的吸收、分布、代谢和排泄等性质,进而影响其药效和安全性。
富马酸丙酚替诺福韦的结构式为研究人员提供了一个重要的参考,可以通过对其结构的分析和优化,设计出更具高效和安全性的抗病毒药物。
同时,富马酸丙酚替诺福韦的结构式也为医生和药师提供了理解和解释药物作用机制的基础,从而更好地指导药物的临床应用。
富马酸丙酚替诺福韦的结构式是理解和研究该药物的重要工具。
通过分析结构式,我们可以了解药物分子的结构组成和空间排列,进而理解其与病毒靶点之间的相互作用,为药物的研发和临床应用提供科学依据。
富马酸替诺福韦二吡呋酯杂质的合成

富马酸替诺福韦二吡呋酯杂质的合成黄小光;朱少璇;陈金瑞【摘要】为控制富马酸替诺福韦二吡呋酯的产品质量,以腺嘌呤为起始物料,合成了5种杂质:(R)-1-(6-氨基-9H-嘌呤-9-基)丙基-2-醇,(R)-[{[1-(6-氨基-9H-嘌呤-9-基)丙基-2-基]氧基}甲基]磷酸,[[{[(R)-1-(6-氨基-9H-嘌呤-9-基)丙基-2-基]氧}甲基](羟基)磷酸]氧]甲基异丙基碳酸酯,[[[{[(R)-1-(6-氨基-9H-嘌呤-9-基)丙基-2-基]氧}甲基](异并氧基)磷]氧]甲基异并氧基碳酸酯和(R)-异丙基[9-[2-[[双{[(异丙氧羰基)氧]甲氧}磷]甲氧基]丙]-9H-嘌呤-6-基]氨基碳酸酯,其结构经UV-Vis,1H NMR,13C NMR,MS(ESI)和元素分析确证.【期刊名称】《合成化学》【年(卷),期】2018(026)012【总页数】5页(P934-938)【关键词】富马酸替诺福韦二吡呋酯;腺嘌呤;杂质;合成;质量控制【作者】黄小光;朱少璇;陈金瑞【作者单位】广州白云山医药集团股份有限公司白云山制药总厂,广东广州510515;广州白云山医药集团股份有限公司白云山制药总厂,广东广州 510515;广州白云山医药集团股份有限公司白云山制药总厂,广东广州 510515【正文语种】中文【中图分类】R914.5;O626富马酸替诺福韦二吡呋酯(Chart 1)为Gilead Sciences公司研制的核苷酸逆转录酶抑制剂(NtRTIs) ,于2001年经美国FDA批准上市,主要用于治疗艾滋病(HIV 感染)。
2008年,FDA批准其用于慢性乙型肝炎(HBV感染)。
富马酸替诺福韦二吡呋酯具有耐受性好、耐药率低、停药反弹率低、肾毒性小等优点,尤其对HIV合并HBV感染患者具有较好的临床应用前景[1-4]。
替诺福韦很难被胃肠道吸收,需经酯化和成盐反应形成水溶性的富马酸替诺福韦二吡呋酯,才能发挥抗病毒作用[5-7]。
富马酸替诺福韦酯杂质

富马酸替诺福韦酯杂质富马酸替诺福韦酯(Tenofovir disoproxil fumarate,CAS:202138-50-9)中文名:富马酸替诺福韦酯杂质A英文名:Tenofovir disoproxil fumarate impurity A规格:10mg-100mg纯度:>95%用途:实验室分析及新药研究中文名:富马酸替诺福韦酯杂质B英文名:Tenofovir disoproxil fumarate impurity B规格:10mg-100mg纯度:>95%用途:实验室分析及新药研究中文名:富马酸替诺福韦酯杂质C英文名:Tenofovir disoproxil fumarate impurity C规格:10mg-100mg纯度:>95%用途:实验室分析及新药研究中文名:富马酸替诺福韦酯杂质D英文名:Tenofovir disoproxil fumarate impurity D规格:10mg-100mg纯度:>95%用途:实验室分析及新药研究中文名称:富马酸替诺福韦酯中文别名:(R)-9-(2-磷酸甲氧基丙基)腺嘌呤二(异丙氧羰基氧甲基)酯富马酸盐;富马酸泰诺福韦酯;富马酸替诺福韦二吡呋酯英文名称:Tenofovir disoproxil fumarate英文别名:9-((R)-2-((Bis(((isopropoxycarbonyl)oxy)methoxy)phosphinyl)methoxy)propyl)adenine fumarate; bis({[(1-methylethoxy)carbonyl]oxy}methyl){[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}phosphonate(2E)-but-2-enedioate CAS号:202138-50-9该产品信息由广州优瓦仪器有限公司整理上传,相关杂质还有新利司他杂质、沃替西汀杂质、巴多昔芬杂质、醋酸巴多昔芬杂质、非马沙坦杂质、芬戈莫德杂质、枸橼酸托法替尼杂质、瑞替加滨杂质等,品牌有CATO、USP、Reagecon、EP、BP、TRC、TLC020-********。
抗HIV感染药富马酸替诺富韦酯中两个杂质的合成

作者: 梁朝阳[1];刁伟[1];曹孝文[2]
作者机构: [1]常州制药厂 江苏 常州 213018;[2]常州出入境检验检疫局 江苏 常州 213022出版物刊名: 化工管理
页码: 68-68页
年卷期: 2013年 第14期
主题词: 富马酸替诺富韦酯;合成;杂质;结构鉴定
摘要:目的本文章报道了合成抗HIV感染药富马酸替诺富韦酯中的杂质T-D和T-M以加强该药的质量控制。
方法通过富马酸替诺福韦酯合成过程中的中间体T3合成得到T3-单异丙酯;再由T3-单异丙酯合成T-D。
杂质T-M主要是通过富马酸替诺福韦酯合成过程中的中间体T4合成得到T4-单酯;再由T4-单酯合成T-M。
结果我们对所合成的杂质结构进行了鉴定。
结论该合成方法反应条件温和、原料易得、操作简单。
替诺福韦杂质种类整理列表

、马来酸氯苯那敏杂质、瑞格列奈杂质等;并提供COA、NMR、HPLC、MS等图谱。
专LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌
中文名称 替诺福韦
替诺福韦杂质种类整理列表
英文名称
CAS
规格
用途
Tenofovir
147127-20-6 10mg-25mg-50mg-100mg
项目报批 纯度高于99.89%
结构式
替诺福韦单磷酸盐
Tenofovir monophosphate
206646-04-0 10mg-25mg-50mg-100mg
项目报批 纯度高于99.89%
替诺福韦酯相关化 合物 E
Tenofovir Disoproxil Related Compound E
211364-69-1 10mg-25mg-50mg-100mg
项目报批 纯度高于99.89%
武汉斯坦德供应各种杂质对照品:泊沙康唑杂质、替卡格雷杂质、索拉非尼杂质、索拉菲尼相关杂质、去氧肾上腺素杂质、维生素BI杂质
项目报批 纯度高于99.89%
替诺福韦磷酸氢盐
Tenofovir Diphosphate 166403-66-3 10mg-25mg-50mg-100mg
项目报批 纯度高于99.89%
富马酸替诺福韦二 吡呋酯二聚体
Tenofovir Disoproxil Dimer
1093279-76-510mg-25mg-50mg-100mg
富马酸替诺福韦酯翻译

主题物质【中文名称】富马酸替诺福韦酯【分子式】C19H30N5O10P.C4H4O4【相对分子量】635.5【化学名称】(R)-[[2-(6-氨基-9H-嘌呤-9-基)- 1-甲基乙氧基]甲基]膦酸二异丙氧羰氧基甲酯富马酸盐【CAS号】202138-50-9【理化性质】本品为白色或类白色结晶性粉末。
【溶解度】在水中微溶,在甲醇中溶解,在二氯甲烷中不溶。
【类别】核苷酸逆转录酶抑制剂。
【贮藏】富马酸替诺福韦酯必须存储在密闭容器中,避光,存储温度为2-8度。
【其他信息】富马酸替诺福韦酯可能呈多态性。
【要求】【定义】富马酸替诺福韦酯的含量范围在98.5%-101.0%,测定时应先干燥到无水。
【产物】生产方法验证了这种物质的存在,如果被检测到,将遵守一个极限不超过5ppm的杂质K,它可能是一种合成的相关物质,用合适的方法,得到一个不超过1.0%的杂质G。
【薄层检验】测试方法A,B,C,D可能会被用到。
A.用方法A.1,如果不能被紫外检测到,换用方法A.2A.1在1.14.1薄层色谱法下进行这项试验,用硅胶R-16板,用含67%体积的二氯甲烷,20%体积的乙腈,10%体积的甲醇和3%的氨水作为流动相。
取10mg/ml的测试物质A和10mg/ml的富马酸替诺福韦酯B各5微升。
把薄层板从色谱室中拿出来后,让它在空气中彻底干燥。
在紫外线为254nm下检查色谱。
从溶液A对应的位置看到清晰的点,对应溶液B中的外光和强度。
A.2在1.14.1薄层色谱法下进行这项检查,在测试方法A.1下描述现象。
但要用硅胶R5作为涂料物质。
用碘试液在薄层板上染色并在日光下检验色谱。
从溶液A对应的位置看到清晰的点,对应溶液B中的外光和强度。
B.用方法B.1进行检测,如果用紫外得不到,改用方法B.2。
B.1在1.14.1薄层色谱法下进行检测,用硅胶R6作为涂料物质,并且以50%体积的庚烷,30%体积的冰醋酸和20%体积的二氯甲烷混合体作为流动准备好之后,保持溶液在大约6度,或用注射剂加冷却剂保持在6度。
富马酸替诺福韦二吡呋酯波谱数据与结构确证

富马酸替诺福韦二吡呋酯波谱数据与结构确证宋爱华;张延峰;沙沂;高源;李宁;马跃平【摘要】对富马酸替诺福韦二吡呋酯的紫外吸收光谱(UV)、红外吸收光谱(IR)、质谱(ESIMS和HRMS)、核磁共振谱(1H NMR,13C NMR,31P NMR,DEPT-135,COSY,HSQC和HMBC)、差热分析(DSC)和热重分析(TGA)报道并进行解析,对其所有的NMR谱信号进行归属,同时讨论质谱的主要碎片离子的可能的裂解方式和红外特征吸收峰所对应的官能团的振动形式,通过多种谱学技术确证富马酸替诺福韦二吡呋酯的结构。
%Ultraviolet spectrum, infrared spectrum, mass spectra and nuclear magnetic resonance spectra (i.e.,1H NMR,13C NMR,31P NMR, DEPT-135, COSY, HSQC and HMBC) of tenofovir disoproxil fumarate were collected and interpreted. All NMR signals were assigned. Based on the mass spectral data, the possible fragmentation pathways were discussed. The infrared spectrum was used to analyze the types of vibration of the functional groups in the compound. The structure of the compound was determined.【期刊名称】《波谱学杂志》【年(卷),期】2015(000)003【总页数】9页(P542-550)【关键词】核磁共振(NMR);归属;化学位移;富马酸替诺福韦二吡呋酯;结构确证【作者】宋爱华;张延峰;沙沂;高源;李宁;马跃平【作者单位】沈阳药科大学药学院,辽宁沈阳 110016;石药集团中诺药业石家庄有限公司,河北石家庄 050000;沈阳药科大学药学院,辽宁沈阳 110016;沈阳药科大学中药学院,辽宁沈阳 110016;沈阳药科大学中药学院,辽宁沈阳 110016;沈阳药科大学中药学院,辽宁沈阳 110016【正文语种】中文【中图分类】O482.53富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate),化学名为9-[(R)-2-[[双[[(异丙氧基羰基)氧基]甲氧基]氧膦基]甲氧基]-丙基]腺嘌呤富马酸盐(1∶1),其结构式见图1,是美国Gilead公司开发的一种新型核苷酸类逆转录酶抑制剂,于2002年在欧盟上市,用于治疗HIV-1感染和慢性乙型肝炎[1],具有耐受性好、耐药率低、停药反弹率低、肾毒性小等特点.目前有关于富马酸替诺福韦二吡呋酯的合成[2]、药代动力学[3,4]、质谱分析及1H NMR数据归属[5]等方面的文献报道,而尚未见富马酸替诺福韦二吡呋酯较为完整的UV、IR和13C NMR数据解析归属等相关文献报道.本文结合文献[6–8]方法,对富马酸替诺福韦二吡呋酯进行了较全面的波谱表征,测定了富马酸替诺福韦二吡呋酯的紫外吸收光谱(UV)、红外吸收光谱(IR)、核磁共振谱(1H NMR,13C NMR,31P NMR,DEPT-135,1H-1H COSY,HSQC和HMBC)、质谱(ESIMS和HRMS),对其所有的1H和13C NMR信号进行了归属,讨论了红外特征吸收峰所对应的官能团的振动形式以及质谱的主要碎片离子的可能的裂解方式,同时也进行了差热分析(DSC)和热重分析(TGA),从而提供了较完备的富马酸替诺福韦二吡呋酯的结构和光谱、波谱信息,为其质量研究提供参考依据.1.1 仪器及试剂1.1.1 仪器紫外光谱用岛津2201紫外可见分光光度计(日本岛津)测定;红外光谱用Bruker IFS55付立叶变换红外分光光度计测定,KBr压片;1H NMR,13C NMR,31P NMR,DEPT-135,COSY,HSQC和HMBC均用Bruker Avance-600型核磁共振谱仪测定,样品溶于D2O,以TMS为内标,1H NMR谱的实验工作频率为600.13 MHz,13C NMR谱的实验工作频率为150.92 MHz,1H NMR谱的谱宽6 009.6 Hz,13C NMR谱的谱宽45 454.5 Hz.二维谱包括2D梯度场1H-1H COSY,HSQC,HMBC均采用瑞士Brucker公司标准脉冲序列.1H-1H COSY的F1维的谱宽为6 009.6 Hz,F2维的谱宽为6 009.6 Hz,F1域零填充至1 024进行FT变换,F1,F2域均采用Qsine bell窗函数处理谱图,采样数矩阵为1 024×512.HSQC的F1(13C)和F2(1H)维的谱宽分别为45 454.5 Hz和6 009.6 Hz,F1域零填充至1 024进行FT变换,F1,F2域均采用Qsine bell窗函数处理谱图,采样数矩阵为1 024×384.HMBC的F1(13C)和F2(1H)维的谱宽分别为45 454.5 Hz和6 009.6 Hz,F1域零填充至1 024进行FT变换,F1,F2域均采用Sine bell窗函数处理谱图,采样数矩阵为2 048×162.脉冲间隔为2 s,1JCH= 140 Hz.HMBC实验选取nJCH= 5.0 Hz;ESIMS用Agilent 1100 系列SL离子阱质谱仪测定;HRMS用Bruker micrOTOF质谱仪测定,ESI源;热差分析用日本岛津DSC-60型差示扫描量热仪测定,参数设置:起始温度:35 ℃;升温速率:5 /min℃ ;终止温度:150 ℃;氛围:氮气30 mL/min.仪器校正标准物质:磺胺二甲嘧啶(中国食品药品检定研究院),熔点200 ℃,实测200.47℃;热重分析用日本岛津TGA-50型热重分析仪测定,参数设置:升温速率:10/min℃ ;终止温度:150 ℃;氛围:氮气.1.1.2 试剂氘代试剂D2O (Cambridge Isotope Laboratories, Inc);其他试剂均为分析纯.1.2 化合物制备1.2.1 替诺福韦二吡呋酯制备反应方程式1.2.2 富马酸替诺福韦二吡呋酯制备反应方程式2.1 UV在样品的中性溶液(134.7 μg/mL MeOH溶液)紫外光谱中λmax260 nm,吸收强度(摩尔吸收系数ε)为2×103,是结构中腺嘌呤的K带吸收.λmax207 nm,吸收强度(摩尔吸收系数ε)为2×103,是结构中嘧啶的E2带吸收,其酸性(0.1 mol/L HCl/MeOH溶液)和碱性溶液(0.1 mol/L NaOH/MeOH溶液)的紫外光谱与中性溶液紫外光谱基本一致.2.2 IR富马酸替诺福韦二吡呋酯的IR吸收光谱中,1 626 cm–1,1 579 cm–1,1 506 cm–1(νC=CνC=N),3 108 cm–1,3 051 cm–1(ν=CHArH),1 185 cm–1,1 159 cm–1(δ=CHArH面内),890 cm–1(δ=CHArH面外)表明有一个孤立的五取代芳杂环,说明邻三取代嘧啶基团的存在.1 268 cm–1(νP=OP(OR)2),984 cm–1(νP-O-CP(OR)2)为膦酸酯的高度特征峰.富马酸替诺福韦二吡呋酯的红外吸收光谱数据及归属见表1.2.3 MS因富马酸替诺福韦酯为有机盐,所以采用ESI质谱仪,测得正离子扫描的准分子离子 m/z 520 [M-116+H]+,其精确分子量为 520.182 7,推算出去碱基部分分子式为C19H31N5O10P,碱基部分的分子式为C19H30N5O10P.按正离子方式检测的一级全扫描质谱中可看到替诺福韦二吡呋酯的准分子离子峰m/z 520和m/z 542 [M-116+Na]+.在该供试品按正离子方式检测的二级全扫描质谱中,可以看到4个主要碎片离子峰,其主要碎片的可能裂解途径见图2.2.4 NMR2.4.1 1H NMR和1H-1H COSY1H NMR谱中给出13组质子信号,结合1H-1H COSY,HSQC,HMBC谱综合分析和文献[5]比对,可知高场区δ 1.28 (3H, d, J = 6.0 Hz, H-14)、1.29 (6H, d, J = 6.0 Hz, H-21, 22)、1.30 (6H, d, J = 6.0 Hz, H-29, 30)为与次甲基相连的5个甲基质子信号.δ 3.98 (1H, m, H-11)、4.89 (1H, m, H-20)、4.92 (1H, m, H-28)为3个次甲基质子信号.δ 4.27 (1H, dd, J = 14.4, 8.4 Hz, H-10a)和4.46(1H, dd, J = 14.4, 3.0 Hz, H-10b)为1组亚甲基质子信号.δ 3.86 (1H,dd,J = 14.4,JPH= 9.0 Hz)、4.12 (1H,dd,J = 14.4,JPH= 6.6 Hz)为与P原子相连的亚甲基质子信号.δ 6.70(2H,s)为烯氢质子的信号.δ 8.27(1H, s) 和8.38(1H, s)为五取代芳杂环上两个质子信号.综上所述,结合1H-1H COSY谱提供的信息,我们对化合物的1H NMR数据进行了归属,并与文献进行了对比,见表2.2.4.2 13C NMR,DEPT,HSQC和HMBC测试样品的13C NMR谱中出现17组碳信号,分别对应结构中的23个碳原子,依据氢谱解析结果和 HSQC、HMBC谱中的相关信号可对结构中所有碳信号进行归属,其13C NMR,DEPT,HSQC和HMBC数据见表3.HMBC谱中,可见δH8.27(H-8)、8.38(H-2)与δC151.9 (C-4)相关,另有δH8.27(H-8)与δC120.9 (C-5)、δH8.38(H-2)与δC154.5 (C-6)分别相关,结合IR可推断该化合物结构中存在多取代嘌呤结构片段A.在1H-1H COSY中,质子δH3.98 (H-11)分别与δH4.27、4.46 (H-10)和1.28 (H-14)相关,HSQC谱中上述质子分别与碳信号δC80.1 (C-11)、51.5(C-10)、18.5 (C-14)相关,可知存在结构片段B.HMBC谱中片段B中的质子δH4.27、4.46 (H-10)与片段A的碳信号δC151.9 (C-4)、147.7 (C-8)有远程相关,(见图3),可确定A、B片段连接方式.在31P NMR谱中的信号δ 23.4可证明该化合物结构中存在磷酸酯结构片段.从连氧叔碳信号δC80.1(JPC= 10.9 Hz) (C-11)的磷碳偶合常数值判断,该碳与磷原子隔三键相连.HSQC谱中亚甲基质子δH3.86,4.12 (H-13)与连氧碳信号δC64.8 (JPC= 165.1 Hz)相关,从该亚甲基的磷氢、磷碳偶合常数判断,其与磷酸酯结构片段的磷原子直接相连.HSQC谱中,质子δH5.44,5.48~5.51和5.55 (H-16、H-24)与碳信号δ 87.8 (C-16、C-24)相关,从碳、氢化学位移值及磷氢偶合常数判断,两仲碳均与磷酸酯结构片段的氧原子相连,存在结构片段C.HSQC谱中 4个甲基信号δH1.29 (H-21、22),1.30 (H-29、30)与δC23.7(C-21, 22、C-29, 30)直接相关,δH4.89 (H-20),4.92 (H-28)与叔碳信号δC78.0 (C-20),78.7 (C-28)直接相关,结合碳氢数据可推断结构中存在两个化学环境相近的异丙基,HMBC谱中质子δH4.89 (H-20),4.92 (H-28)分别与两个羧酸酯基碳信号δC156.3 (C-18),156.4 (C-26)有远程相关,构成两个化学环境相同的结构片段D.而片段C中质子δH5.44 (H-16a)、5.48~5.51(H-16b或H-24a)、5.55(H-24b)和4.88(H-20)与片段D中季碳信号δC156.3 (C-18),156.4 (C-26)有远程相关,从而构成了替诺福韦二吡呋酯的结构.在 HMBC谱中δC174.0 (C-1', 4')与烯氢质子δH6.70(H-2', 3')有远程相关,可推断富马酸结构的存在.综上可确定测试样品结构为富马酸替诺福韦二吡呋酯.此外,C-16,C-24及其所连支链的结构相同,化学环境相似,两支链对应位置的1H和13C数据归属可以互换.2.4.3 31P NMR谱在富马酸替诺福韦二吡呋酯供试品的31P NMR谱中,δ 23.35按磷化学位移规律,应归属为该化合物结构中唯一的一个磷原子.2.5 热分析差热分析(DSC)测试结果:114.61 ℃、117.64 ℃有吸热峰;热重分析(TGA)测试结果:150 ℃内无失重.本文通过UV,IR,MS,1H NMR,13C NMR,31P NMR,DEPT,COSY,HSQC和HMBC谱的测定和解析,对富马酸替诺福韦二吡呋酯的结构进行了全面分析与验证,通过ESIMS、HRMS确定了富马酸替诺福韦二吡呋酯的分子式,结合红外光谱给出各基团的特征吸收,1H NMR,13C NMR,31P NMR,DEPT,COSY,HSQC和HMBC谱的测定和解析确证了化合物的氢信号归属,同时对碳信号进行了全归属,补充了相关数据,并根据以上综合确证了富马酸替诺福韦二吡呋酯的化学结构.同时对该化合物进行了热分析,为化合物提供更完备的信息.【相关文献】[1] Michailidis E, Kirby Ka, Hachiya A, et al. Antiviral therapies: focus on hepatitis Breverse transcriptase[J]. Int J Biochem Cell B, 2012, 44(7): 1 060-1 071.[2] Yan Nan (严楠), Lin Chun-hua(林春花), Liao Wei-lin(廖维林), et al. Synthesis of tenofovir disoproxil fumarate(富马酸替诺福韦二吡呋酯的合成)[J]. Fine Chemicals(精细化工), 2014,31(8): 983-987.[3] Gong Xu(宫旭), Imene Adouani, Hang Tai-jun(杭太俊), et al. Pharmacokinetics and bioequivalence of tenofovir disoproxil fumarate tablets in healthy Chinese volunteers(富马酸替诺福韦二吡呋酯片在健康国热体内的药动学及生物等效性研究)[J]. Chinese Journal of New Drugs(中国新药杂志), 2013, 22(6): 686-690.[4] Jiang Li-yuan(姜莉苑), Ding Li(丁黎), Zhong Shui-sheng(钟水生), et al. Pharmacokinetics of tenofovir disoproxil fumarate capsule in Chinese volunteers (富马酸替诺福韦二吡呋酯胶囊在中国人体内的药代动力学)[J]. Journal ofChina Pharmaceutical University(中国药科大学学报), 2013, 44(4): 348-351.[5] Zhou Hai-yun(周海云), Chen Xiao-hong(陈晓红), Li Wei(李玮), et al. Mass analysis of tenofovir disoproxil fumarate and determination of fumarate combination ratio byNMR(富马酸替诺福韦二吡呋酯的质谱分析及NMR测定富马酸相对含量)[J]. Chinese Journal Pharmaceutical Analysis(药物分析杂志), 2012, 32(12): 2 180-2 183.[6] Wu Chun-li(吴春丽), Li Jie-ming(李杰明), Wei Hui-jie(魏会杰), et al. Spectral analysis and structural elucidation of atorvastatin lactone(阿托伐他汀内酯的波谱学数据与结构确证)[J]. Chinese J Magn Reson(波谱学杂志), 2014, 31(2): 268-277.[7] Yuan Yun-fei(袁云飞), Hong Hai(洪海), Yang Xiao-yun(杨晓云), et al. Spectroscopic data of fluacrypyrim and interpretations(嘧螨酯波谱学数据全归属)[J]. Chinese J Magn Reson(波谱学杂志), 2013, 30(4): 567-575.[8] Song Ai-hua(宋爱华), Sha Yi(沙沂), Xu Xiao-xue(徐晓雪), et al. Differentiating Bupleurumbicaule from Bupleurum chinense using1H NMR spectroscopy(基于1H NMR技术的锥叶柴胡与北柴胡鉴别研究)[J]. Chinese J Magn Reson(波谱学杂志), 2014, 31(2): 214-221.。
WHO-富马酸替诺福韦Tenofovir disoproxil fumarate质量标准

Monographs: Pharmaceutical substances: Tenofoviri disoproxili fumaras - Tenofovir disoproxil fumarateC19H30N5O10P,C4H4O4Relative molecular mass. 635.5Chemical name. 1,1'-bis(1-methylethyl)1,1'-[({[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}phosphonoyldioxy)dimet hyl] dicarbonate (ester) hydrogen (2E)-but-2-enedioate (salt); CAS Reg.No. 202138-50-9.Description. White to almost-white, crystalline powder.Solubility. Slightly soluble in water, soluble in methanol, very slightly soluble in dichloromethane.Category. Antiretroviral (Nucleotide Reverse Transcriptase Inhibitor).Storage. Tenofovir disoproxil fumarate should be kept in a tightly closed container, protected from light, and stored at a temperature between 2 and 8°C.Additional information. Tenofovir disoproxil fumarate may exhibit polymorphism.RequirementsDefinition. Tenofovir disoproxil fumarate contains not less than 98.5 percent and not more than 101.0 percent of tenofovir disoproxil fumarate (C19H30N5O10P,C4H4O4), calculated with reference to the anhydrous substance.Manufacture. The production method is validated to ensure that the substance, if tested, would comply with:- a limit of not more than 5 ppm for the mutagenic impurity9-(prop-1-enyl)-9H-purin-6-amine (impurity K), which may be a synthesis related substance, using a suitable method, and- a limit of not more than 1.0% for the tenofovir disoproxil (S)-enantiomer (impurity G), using a suitable chiral chromatographic method.Identity tests• Either tests A, B and C or test D may be applied.A. Carry out test A.1 or, where UV detection is not available, test A.2.A.1 Carry out the test as described under 1.14.1 Thin-layer chromatography, using silica gel R6 as the coating substance and a mixture of 67 volumes of dichloromethane R, 20 volumes of acetonitrile R, 10 volumes of methanol R and 3 volumes of ammonia (~260 g/l) TS as the mobile phase. Apply separately to the plate 5 μl of each of 2 solutions in methanol containing (A) 10 mg of the test substance per ml and (B) 10 mg of tenofovir disoproxil fumarate RS per ml. After removing the plate from the chromatographic chamber, allow it to dry exhaustively in air or in a current of air. Examine the chromatogram in ultraviolet light (254 nm).The principal spot obtained with solution A corresponds in position, appearance, and intensity with that obtained with solution B.A.2 Carry out the test as described under 1.14.1 Thin-layer chromatography, using the conditions described above under test A.1 but using silica gel R5 as the coating substance. Stain the plate with iodine vapour and examine the chromatogram in daylight.The principal spot obtained with solution A corresponds in position, appearance, and intensity with that obtained with solution B.B. Carry out test B.1 or, where UV detection is not available, test B.2.B.1 Carry out the test as described under 1.14.1 Thin-layer chromatography, using silica gel R6 as the coating substance and a mixture of 50 volumes of heptane R, 30 volumes of glacial acetic acid R and 20 volumes of dichloromethane R as the mobile phase. Apply separately to the plate 5 μl of each of the following 2 solutions in ethanol R. For solution (A) use 10 mg of the test substance per ml and for solution (B) use 2 mg of fumaric acid R per ml. Develop the plate in an unsaturated tank over a path of 10 cm. After removing the plate from the chromatographic chamber, allow it to dry exhaustively in air or in a current of air. Examine the chromatogram in ultraviolet light (254 nm).One of the principal spots obtained with solution A corresponds in position, appearance, and intensity with that obtained with solution B.B.2 Carry out the test as described under 1.14.1 Thin-layer chromatography, using the conditions described above under test B.1 but using silica gel R5 as the coating substance. Spray lightly with a 16 g/l solution of potassium permanganate R and examine the chromatogram in daylight.The principal spot obtained with solution A corresponds in position, appearance, and intensity with that obtained with solution B.C. The absorption spectrum (1.6) of a 25 µg/ml solution, when observed between 220 nmand 320 nm, exhibits a maximum at about 261 nm; the specific absorbance () is 230 to 250.D. Carry out the examination as described under 1.7 Spectrophotometry in the infrared region. The infrared absorption spectrum is concordant with the spectrum obtained from tenofovir disoproxil fumarate RS or with the reference spectrum of tenofovir disoproxil fumarate. If the spectra thus obtained are not concordant, repeat the test using the residues obtained by separately dissolving the test substance and tenofovir disoproxil fumarate RS in a small amount of methanol R and evaporating to dryness. The infrared absorption spectrum is concordant with the spectrum obtained from tenofovir disoproxil fumarate RS.Specific optical rotation (1.4). Use a 10.0 mg/ml solution in hydrochloric acid (0.1 mol/l)VSand calculate with reference to the anhydrous substance; = -20° to -26°.Water. Determine as described under 2.8 Determination of water by the Karl Fischer method, Method A. Use about 1.0 g of the substance; the water content is not more than 10 mg/g.Heavy metals. Use 1.0 g in 30 ml of methanol R for the preparation of the test solution as described under 2.2.3 Limit test for heavy metals, Procedure 2; determine the heavy metals content accordi ng to Method A; not more than 20 μg/g.Sulfated ash (2.3). Not more than 1.0 mg/g.Related substances. Carry out the test as described under 1.14.4 High-performance liquid chromatography, using a stainless steel column (25 cm x 4.6 mm) packed withbase-deactivated particles of silica gel the surface of which has been modified with chemically bonded oct adecylsilyl groups (5 μm).The mobile phases for the gradient elution consist of a mixture of Mobile phase A and Mobile phase B, using the following conditions:Mobile phase A: 2 volumes of acetonitrile R, 20 volumes of phosphate buffer pH 6.0 and 78 volumes of water R.Mobile phase B: 65 volumes of acetonitrile R, 20 volumes of phosphate buffer pH 6.0 and 15 volumes of water R.Prepare the phosphate buffer pH 6.0 by dissolving 3.50 g of potassium dihydrogen phosphate R and 1.70 g of tetrabutyl ammonium hydrogen sulfate R in 800 ml of water R, adjust the pH to 6.0 by adding sodium hydroxide (1 mol/l) VS and dilute to 1000 ml with water R.After preparation, keep the solutions at about 6°C, or use an injector with cooling.Prepare the following solutions using water R as diluent. For solution (1) use 1.0 mg of the test substance per ml. For solution (2) dilute a suitable volume of solution (1) to obtain a concentration of 5 µg of tenofovir disoproxil fumarate per ml. For solution (3) use 0.2 mg of fumaric acid R per ml.For the system suitability test: prepare solution (4) by heating solution (1) carefully in a boiling water-bath for 20 minutes.Operate with a flow rate of 1.0 ml per minute. As a detector use an ultraviolet spectrophotometer set at a wavelength of 260 nm.Maintain the column temperature at 30 °C.Inject 20 μl of solution (4). The test is not valid unless the resolution between the principal peak (retention time about 40 minutes) and the peak due to the tenofovir monoester (with a relative retention of about 0.5) is not less than 25.Inject alternat ively 20 μl each of solutions (1) and (2) and (3). In the chromatogram obtained with solution (1), the following peak is eluted at the following relative retention, with reference to tenofovir (retention time about 40 minutes): fumarate about 0.15.In the chromatogram obtained with solution (1), the area of any peak due to the tenofovir monosoproxil (impurity A) is not greater than twice the area of the principal peak obtained with solution (2) (1.0%); the area of any other impurity peak is not greater than the area of the principal peak obtained with solution (2) (0.5%) and the areas of not more than two such peaks are greater than 0.4 times the area of the principal peak obtained with solution (2) (0.2%). The sum of the areas of all peaks, other than the principal peak, is not greater than 5 times the area of the principal peak obtained with solution (2) (2.5%). Disregard any peak corresponding to the peak obtained in the chromatogram with solution (3) and any peak with an area less than 0.1 times the area of the principal peak in the chromatogram obtained with solution (2) (0.05%).AssayDissolve 0.40 g, accurately weighed, in 30 ml of glacial acetic acid R1 and titrate with perchloric acid (0.1 mol/l) VS, determine the end point potentiometrically as described under 2.6 Non-aqueous titration Method A. Each ml of perchloric acid (0.1 mol/l) VS is equivalent to 63.55 mg of tenofovir disoproxil fumarate (C19H30N5O10P,C4H4O4).ImpuritiesA. (1-methylethyl)(8R)-9-(6-amino-9H-purin-9-yl)-5-hydroxy-8-methyl-5-oxo-2,4,7-trioxa-5-λ5-phosphanon anoate (tenofovir monosoproxil),B. (1-methylethyl)(5RS,8R)-9-(6-amino-9H-purin-9-yl)-5-methoxy-8-methyl-5-oxo-2,4,7-trioxa-5-λ5-phosph anonanoate,B. methyl (1-methylethyl)(5RS)-5-{[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}-5-oxo-2,4,6,8-tetrao xa-5-λ5-phosphanonanedioate,D. (1-methylethyl)(5RS,8R)-9-(6-amino-9H-purin-9-yl)-8-methyl-5-(1-methylethoxy)-5-oxo-2,4,7-trioxa-5-λ5-phosphanonanoate,E. (1-methylethyl)(8R)-5-hydroxy-8-methyl-9-(6-{[(1-methylethoxy)carbonyl]amino}-9H-purin-9-yl)-5-oxo-2,4,7-trioxa-5-λ5-phosphanonanoate,F. bis(1-methylethyl)9,9'-[methylenebis(imino-9H-purine-6,9-diyl)]bis[(8R)-5-hydroxy-8-methyl-5-oxo-2,4,7-tri oxa-5-λ5-phosphanonanoate] (tenofovir monosoproxil dimer),G. bis(1-methylethyl)5-{[(1S)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}-5-oxo-2,4,6,8-tetraoxa-5-λ5 -phosphanonanedioate (tenofovir disoproxil (S)-enantiomer) [see under Manufacture],H. 1-methylethyl propyl(5RS)-5-{[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}-5-oxo-2,4,6,8-tetrao xa-5-λ5-phosphanonanedioate,I. bis(1-methylethyl)5-{[(1R)-2-(6-{[({9-[(2R)-5-hydroxy-2,11-dimethyl-5,9-dioxo-3,6,8,10-tetraoxa-5-λ5-pho sphadodecyl]-9H-purin-6-yl}amino)methyl]amino}-9H-purin-9-yl)-1-methylethoxy]methyl }-5-oxo-2,4,6,8-tetraoxa-5-λ5-phosphanonanedioate (tenofovir di- and monosoproxil heterodimer),J. tetrakis(1-methylethyl)5,5'-(methylenebis{imino-9H-purine-6,9-diyl[(2R)-propane-1,2-diyl]oxymethylene})bis[5-oxo-2,4,6,8-tetraoxa-5-λ5-phosphanonanedioate] (tenofovir disoproxil dimer),K. 9-(prop-1-enyl)-9H-purin-6-amine, [see under Manufacture],L. (1-methylethyl)(5RS)-5-{[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}-10-methyl-5,9-dioxo-2,4,6,8-tetraoxa-10-aza-5-λ5-phosphaundecanoate,M. ethyl 1-methylethyl(5RS)-5-{[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}-5-oxo-2,4,6,8-tetrao xa-5-λ5-phosphanonanedioate.。
一种富马酸替诺福韦酯中杂质9

专利名称:一种富马酸替诺福韦酯中杂质9‑丙烯基腺嘌呤的测定方法
专利类型:发明专利
发明人:张贵民,商庆节,王现珍
申请号:CN201610511267.6
申请日:20160630
公开号:CN107561204A
公开日:
20180109
专利内容由知识产权出版社提供
摘要:本发明涉及一种富马酸替诺福韦酯中杂质9‑丙烯基腺嘌呤的测定方法,属于医药技术领域。
该方法采用内标法,利用超高效液相色谱法‑电喷雾离子化串联质谱法来检测富马酸替诺福韦酯样品中9‑丙烯基腺嘌呤的浓度,液相条件中流动相由甲醇水组成,梯度洗脱;盐酸左西替利嗪作为9‑丙烯基腺嘌呤测定的内标。
本发明所建立的富马酸替诺福韦酯中杂质9‑丙烯基腺嘌呤的UPLC‑MS/MS 测定法在专属性、精密度、线性、稳定性等方面均达到了中国药典2015年版的分析要求。
申请人:山东新时代药业有限公司
地址:273400 山东省临沂市费县北外环路1号
国籍:CN
更多信息请下载全文后查看。
LC-HRMS

[基金项目]广东省广州市知识产权工作专项资金(ZL201710649577.9)。
▲通讯作者LC-HRMS/MS研究富马酸替诺福韦二吡呋酯片中聚合物肖 颖1 王健松1▲ 袁 晓2 林顺权2 叶心睿31.广州白云山医药集团股份有限公司白云山制药总厂,广东广州 510515;2.广州牌牌生物科技有限公司,广东广州 510530;3.广州白云山明兴制药有限公司,广东广州 510250[摘要] 目的 研究富马酸替诺福韦二吡呋酯片中潜在的聚合物杂质。
方法 采用液质联用方法,选用大气压化学离子化源(APCI 离子源)和电喷雾离子化源(ESI 离子源)对富含杂质的样品(包括破坏实验后的样品)进行聚合物研究,发现其潜在的聚合物并推测其结构。
结果 富马酸替诺福韦二吡呋酯片破坏样品中检出二聚体、三聚体杂质。
结论 富马酸替诺福韦二吡呋酯片中存在潜在可检出的聚合物杂质:二聚体和三聚体杂质,其中二聚体的三个杂质为已知杂质,分别为杂质H、W、S。
[关键词] 富马酸替诺福韦二吡呋酯;二聚体;三聚体;液质联用[中图分类号] R969 [文献标识码] A [文章编号] 2095-0616(2024)07-0068-05DOI:10.20116/j.issn2095-0616.2024.07.16LC-HRMS/MS study on polymers in tenofovir disoproxil fumarate tabletsXIAO Ying 1 WANG Jiansong 1 YUAN Xiao 2 LIN Shunquan 2 YE Xinrui31. Guangzhou Baiyunshan Pharmaceutical Holdings Co., Ltd. Baiyunshan Pharmaceutical General Factory, Guangdong, Guangzhou 510515, China;2. Guangzhou PI PI Biotech Inc., Guangdong, Guangzhou 510530, China; 3 Guangzhou Baiyunshan Mingxing Pharmaceutical Co., Ltd., Guangdong, Guangzhou 510250, China[Abstract] Objective To study the potential polymer impurities in tenofovir disoproxil fumarate tablets. Methods The samples rich in impurities (including the samples after the destructive experiment) were studied by liquid chromatography-mass spectrometry (LC-MS) with atmospheric pressure chemical ionization source (APCI ion source) and electrospray ionization source (ESI ion source), with their potential polymers found and their structures speculated. Results Dimer and trimer impurities were detected in the sample after the destructive experiment of tenofovir disoproxil fumarate tablets. Conclusion There are potential detectable polymer impurities in tenofovir disoproxil fumarate tablets: dimer and trimer impurities, among which the three impurities in the dimer are known impurities, namely H, W, and S.[Key words] Tenofovir disoproxil fumarate; Dimer; Trimer; Liquid chromatography-mass spectrometry富马酸替诺福韦二吡呋酯为美国Gilead Sciences Inc.公司1988年开发,2001年在美国首次上市,适应证为艾滋病病毒(human immunodificiency virus,HIV)感染,2008年增加乙型肝炎病毒(hepatitis B virus,HBV)感染适应证。
富马酸丙酚替诺福韦片中有关物质测定及杂质鉴定

富马酸丙酚替诺福韦片中有关物质测定及杂质鉴定章海云;金秉德;王玲兰;宿亮;徐彬滨;朱跃芳【期刊名称】《中国药业》【年(卷),期】2024(33)7【摘要】目的建立检测富马酸丙酚替诺福韦片中有关物质含量的高效液相色谱法,以及鉴定制剂中未知湿热降解杂质化学结构的二维液相色谱-三重四极杆串联质谱法。
方法有关物质测定中,色谱柱为Waters XTerra MS C_(18)柱(250 mm×4.6 mm,5μm),流动相为0.02 mol/L磷酸盐(1 mol/L氢氧化钾溶液调pH至6.0)-甲醇(95∶5,V/V)-甲醇(梯度洗脱),流速为1.0 mL/min,检测波长为260 nm,柱温为35℃,进样量为20μL。
化学结构鉴定中,色谱柱为Agilent Zorbax Eclipse Plus C_(18)柱(50 mm×3.0 mm,1.8μm),流动相为0.1%甲酸水溶液-甲醇(55∶45,V/V),流速为0.4 mL/min,柱温为35℃,采用电喷雾离子源(ESI),正离子模式,质荷比(m/z)扫描范围为100~1000,雾化气体(氮气,N_(2))压力为45 psi,干燥气(N2)流速为6 L/min,温度为350℃,碎裂电压为150 V,二级质谱碰撞裂解能量为30 eV。
根据保留时间、分子量及二级碎片识别湿热降解杂质。
结果丙酚替诺福韦与5个降解杂质A-E的定量限分别为0.4,0.4,2.0,2.0,0.8,0.8 ng。
5个降解杂质A-E的杂质校正因子分别为0.61,0.70,3.16,0.75,0.85;平均加样回收率分别为100.20%,95.23%,102.36%,94.48%,97.26%,RSD分别为0.50%,0.23%,0.89%,1.02%,1.67%(n=9)。
未知湿热降解杂质分别为杂质D乳糖加合物及丙酚替诺福韦乳糖加合物。
结论该方法专属性强、灵敏度好、准确度高,可用于富马酸丙酚替诺福韦片中有关物质的含量测定,通过特征碎片离子可快速识别丙酚替诺福韦乳糖加合物类杂质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
29
Tenofovir Related Compound 5
1234081-04-9
30
Tenofovir Related Compound 6
383365-04-6
31
Tenofovir Related Compound 7
79487-89-1
32
Tenofovir monophosphate
21
Diisopropyl Tenofovir Fumarate
160616-04-6 (free base)
22
(S)-Tenofovir
147127-19-3
23
6N-Bromomethyl Tenofovir Disoproxil
24
Tenofovir Disoproxil Fumarate Impurity
7
替诺福韦酯杂质F
TenofovirImpurityF
8
(S)-替诺福韦二异丙氧碳酸甲基酯
9
替诺福韦异丙氧碳酸甲基丙基碳酸甲基酯
ቤተ መጻሕፍቲ ባይዱCAS:1217542-13-6
10
替诺福韦二聚物单酯
CAS:1093279-77-6
11
替诺福韦二聚物
Tenofovir Disoproxil Dimer
CAS:1093279-76-5
206646-04-0
33
Tenofovir Diphosphate
166403-66-3
34
Tenofovir Trimer Impurity 1
35
Tenofovir Trimer Impurity 2
如需咨询,欢迎联系广州尤瓦化工产品:4000-868-328
富马酸替诺福韦酯分子结构式
序号
名称
结构
1
替诺福韦单异丙氧碳酸甲基酯
Tenofovir Disoproxil Related Compound E
CAS:211364-69-1
2
替诺福韦酯异丙氧碳酸甲基甲基酯
CAS:1246812-16-7
3
替诺福韦异丙氧碳酸甲基甲氧碳酸甲基酯
Mono-POC MethylTenofovir
CAS:1246812-43-0
4
Tenofovir ImpurityQ
5
替诺福韦异丙氧碳酸甲基异丙基酯
Tenofovir Disoproxil Related Compound G
CAS:1422284-15-8
6
替诺福韦-N-异丙氧羰基异丙氧碳酸甲基酯
Tenofovir Impurity E
CAS:1244022-56-7
Tenofovir Disoproxil Carbamate
18
Diethylaminocarboxymethyl POC Tenofovir Fumarate
19
6N-Hydroxymethyl Tenofovir Disoproxil
1244022-53-4
20
Isopropyl Tenofovir
(N6-CH2OH-POC PMPA)
25
Tenofovir Related Compound 1
342631-41-8
26
Tenofovir Related Compound 2
379270-35-6
27
Tenofovir Related Compound 3
52364-31-5
28
Tenofovir Related Compound 4
12
9-丙烯腺嘌呤
Tenofovir Disoproxil Related Compound B
CAS:4121-40-8
13
替诺福韦酯杂质R
Tenofovir ImpurityR
14
替诺福韦异丙氧碳酸甲基乙基碳酸甲基酯
15
替诺福韦二乙酯
Tenofovir impurity V
16
替诺福韦单乙酯
17
