第四课 讲解-配位化合物命名20160929
《配位化合物》课件

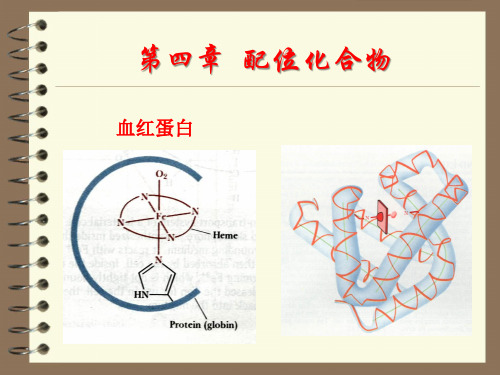
负离子
非金属元素形成的阴离子在配合物中带有负 电荷。
稀土金属配离子
稀土金属作为特殊的金属离子在配合物中具 有重要的应用价值。
配合物的合成方法
直接溶液法
通过将金属离子和配体直接 溶解在溶剂中形成配位化合 物。
配体置换法
通过将原有配体置换为新的 配体来合成具有不同结构和 性质的配位化合物。
3 重要性
配位化合物广泛应用于医药、化妆品、催化剂等众多领域。
配位基概述
配体定义
配体是指能够通过一个或多 个配位键与金属离子结合的 化学物质。
配位键
配位键是指配体与金属离子 之间共享的电子对。
配位数
配位数指配位中心金属离子 周围配位体的个数。
金属配离子概述
正离子
金属离子在配合物中带有正电荷。
零价配离子
气相法
通过在气相中使金属原子与 配体反应生成配位化合物。
配合物的分类
1 单核配合物
配位中心金属离子与多 个配体结合形成。
3 簇合物
多个金属离子通过配位 键相互连接形成。
配位数与配位几何
1
配位几何
2
配位几何是指配合物中配体排列的空
间结构。
3
六配体
4
六配体通常呈现八面体或六面体配位 几何。
《配位化合物》PPT课件
本课件旨在介绍配位化合物的基本概念和性质,以及其在不同领域的应用。 通过清晰的内容和生动的图像,希望您能对配位化合物有一个全面而深入的 了解。
初识配位化合物
1 定义
配位化合物是指通过配位键将中心金属离子与一个或多个配体结合形成的化合物。
2 历史
配位化合物的研究始于18世纪,为现代配位化学的奠基。
配位化合物

1-2、配位化合物的组成 、 配合物组成示意图
1、中心离子(或原子) 、中心离子(或原子) ①过渡金属元素: 过渡金属元素: 阳离子: 阳离子:如Ag+ Cu2+ Fe3+等 中性原子:Fe(CO)5 Ni(CO)4等 中性原子: 阴离子(极少数):如 阴离子(极少数):如HCo(CO)4等 ): ②少数高氧化态的非金属元素: 少数高氧化态的非金属元素: 如 SiF62-等
第十九章
主要内容
配位化合物
1、配位化合物的基本概念 、 2、配位化合物的化学键理论 、 3、配位化合物的稳定性 、
本章要求: 本章要求: 1.掌握有关配位化合物组成、命名等基本概 .掌握有关配位化合物组成、 念。 2.掌握配位化合物价键理论的主要论点,并 .掌握配位化合物价键理论的主要论点, 能用此解释一些实例。 能用此解释一些实例。 3.掌握配位化合物稳定常数的意义、 3.掌握配位化合物稳定常数的意义、应用及 有关计算。 有关计算。 4.了解螯合物的特性和应用。 .了解螯合物的特性和应用。 5.了解物质形成配位化合物前后的性质变化。 .了解物质形成配位化合物前后的性质变化。
第一节 配位化合物的基本概念 1-1 配位化合物的定义
[实验 往两个反应杯中各注入少量 实验] 往两个反应杯中各注入少量0.5mol/LCuSO4 实验 / 溶液,然后往其中一个反应杯中滴加BaCl2溶液,就有白 溶液,然后往其中一个反应杯中滴加 溶液, 色沉淀生成,再往另一反应杯中滴加NaOH溶液,有浅蓝 溶液, 色沉淀生成,再往另一反应杯中滴加 溶液 色沉淀生成。这个实验说明在CuSO4溶液中确实存在着 色沉淀生成。这个实验说明在 SO42-离子和 2+离子。 离子和Cu 离子。 再另取少量CuSO4溶液,加入过量的氨水,溶液变为 溶液,加入过量的氨水, 再另取少量 深蓝色,同样将此溶液分为两份,一份中滴加BaCl2溶液, 溶液, 深蓝色,同样将此溶液分为两份,一份中滴加 有白色沉淀生成说明此溶液中仍有SO 离子; 有白色沉淀生成说明此溶液中仍有 42-离子;往另一份 中滴加NaOH溶液,就无浅蓝色沉淀生成,说明此溶液中 溶液, 中滴加 溶液 就无浅蓝色沉淀生成, 几乎检查不出Cu 离子的存在。 几乎检查不出 2+离子的存在。
配位化合物命名

汇报人:
CONTENTS
PRT ONE
PRT TWO
中心原子:配位化合物的核心通常 为金属离子
配位数:中心原子与配体结合的数 目
添加标题
添加标题
添加标题
添加标题
配体:与中心原子结合的化学物质 可以是有机物、无机物或离子
配位化合物的命名:根据中心原子、 配体和配位数进行命名
单核配位 化合物: 只有一个 中心原子 的配位化 合物
配位基团:表示配位体的连接基团如NH3为NH2基团CO为CO基团 NO为NO基团等
配位数:表示配位化合物中配位原子的数目通常用罗马数字表示 配位比:表示配位化合物中配位原子与中心原子的比例通常用分数表示 配位数和配位比的表示方法:例如[Co(NH3)6]Cl3的配位数为6配位比为6:1 配位数和配位比的表示方法:例如[Fe(CN)6]4-的配位数为6配位比为6:4
多核配位 化合物: 有多个中 心原子的 配位化合 物
内配位化合 物:中心原 子与配体之 间通过共价 键结合的配 位化合物
外配位化合 物:中心原 子与配体之 间通过离子 键结合的配 位化合物
单齿配位 化合物: 每个配体 只含有一 个配位原 子的配位 化合物
多齿配位 化合物: 每个配体 含有多个 配位原子 的配位化 合物
药物开发:配位化合物在药物 设计中的应用
生物成像:配位化合物在生物 成像中的应用
基因编辑:配位化合物在基因 编辑中的应用
生物传感器:配位化合物在生 物传感器中的应用
生物医学领域: 用于药物设计和 合成
材料科学领域: 用于制备新型功 能材料
环境科学领域: 用于废水处理和 污染物去除
化学分析领域: 用于分析样品和 检测化学物质
大学无机化学课件配位化合物

Mn+ + ne ≒ M
Mn Ln e M nL
MnL /M
Mn/M
配位的
型
精品课件
(4) 用磁矩判断
n(n2),n为中心离子的未成 子对 数
外轨型配合物:未成对电子数多,µ 较大,
一般为高 自旋配合物
内轨型配合物:未成对电子数减少, µ 较小,
一般为低自旋
配合物
精品课件
Co(NH3)63+,Co3+: 3d6
3d
调整
3d d2sp3杂化
4d 4p 4s
4d 4p 4s
Cu + NH3 = Cu(NH3) 2+
K稳 1
Cu(NH3) 2+ + NH3 = Cu(NH3)22+ K稳
2
KKCCKK不稳稳uu稳((=NN4 =HH33))K23K稳22不++ 1稳×++1×KNN稳HH33K2不==精×稳品CC课uu2件K((×稳NNHH333K))×不3422稳++
[Zn(NH3)4]SO4 [Ag(NH3)2](OH)
三氯化五氨 . 水合钴(III) 硫酸四氨合锌(II) 氢氧化二氨合银(I)
精品课件
§9.2 配合物的化学键理 论
9.2.1 价键理论 9.2.2 晶体场理论(自学)
精品课件
9.2.1 价键理论
解决的问题:⑴ 配合物的配位数
⑵几
何构型
一、基本要矩点及反应活性
精品课件
(2)配体(配位体):含有孤对电子
① 无机配体:H2O、NH3、CO、CN-、X—等。 有机配体 。
② 配位原子:直接与中心原子以配位键相连的原子。
配位化合物

[Cu(NH3)4] SO4 硫酸四氨合铜(Ⅱ)
若外界为氢离子,则在配阴离子之后缀以“酸”字,即称为 “某酸”。例如: K2[PtCl6] 六氯合铂(Ⅳ)酸钾
第四章 配位化合物
二、配合物的命名
课堂互动
请你用系统命名法命名下列配合物: (1)H4[Fe(CN)6] (2)[Ag(NH3)2]+ (3)[Zn(NH3)4] 2+ (4)[NiCl(Py)(NH3)2]Cl
第四章 配位化合物
重点小结
1.配合物由内界和外界组成,内界是配合物的特征部分,是由中 心金属离子(或原子)和配位体通过配位键结合而成的配阳离子 或配阴离子;配位体有单齿配位体和多齿配位体。 2.配合物的命名遵循一般无机化合物 “阴离子在前,阳离子在后 ”的命名原则。内界为配阳离子称为“某化某”,例如, [Co(NH3)2(H2O)3Cl]Cl2命名为二氯化一氯二氨·三水合钴(Ⅲ)]或“某 酸某”,例如,[Zn(NH3)4]SO4命名为硫酸四氨合锌(Ⅱ);内界为配 阴离子称为“某酸”,例如,H2[PtCl6]命名为六氯合铂(Ⅳ)酸。
类别 配位酸 配位碱 配位盐
中性分子
化学式 H3[PtCl6] [Ag(NH3)2]OH [Zn(NH3)4]SO4 [Co(NH3)5(H2O)]Cl3 K4[Fe(CN)6] [Fe(CO)5]
系统命名 六氯合铂(Ⅲ)酸 氢氧化二氨合银(Ⅰ) 硫酸四氨合锌(Ⅱ) 三氯化五氨·一水合钴(Ⅲ) 六氰合铁(Ⅱ)酸钾 五羰基合铁
第四章 配位化合物
第四章 配位化合物
一、配位化合物的概念 二、配位化合物的组成 三、配位化合物的命名
药学基础知识配位化合物

药学基础知识配位化合物一、配位化合物的定义往CuSO4的稀溶液滴加6mol/L的氨水不断振摇,开始时有天蓝色Cu(OH)2沉淀,继续再加氨水时,沉淀消失。
在溶液中检查不到Cu2+却只能检测到SO42-,推测生成了一种新物质,用酒精沉淀,再经结构分析:该物质为[Cu(NH3)4]SO4·H2O。
物质[Ag(NH2)]NO3,K2[HgI4]……,在水溶液中形成离子[Cu(NH3)4]2+,[Ag(NH2)]+,[HgI4]2-。
金属离子(或原子)与一定数目的中性分子或负离子结合成不易离解的复杂离子称为配离子。
含有配离子及配位分子的化合物统称为配合物。
配合物与复盐如明矾[KAl(SO4)2]12H2O不一样,不能相混。
二、配合物的组成以[Cu(NH3)4] SO4为例其组成可表示配位离子1.中心原子:一般为金属阳离子(原子),特别是过渡金属离子,Fe、Co、Ni、Cu、Ag、Au等。
2.配体:中心原子周围的分子或离子(可以是阴离子,也可以是中性分子)。
3.配位原子:配体中能向中心原子提供孤对电子的原子如NH3中的N原子,H2O中的O原子,CN-中的C 原子,以N、P、O、S、C等原子居多。
配体又分:4.配位数:直接与中心原子相结合的配位原子总数。
以2、4、6较为多见。
在[Pt(en)2]Cl其配位数为4。
5.配离子电荷:中心原子和配位体电荷的代数和。
如[Cu(NH3)4]2+、[Fe(CN)6]4-。
三、配位化合物的类型1.简单配位化合物单齿配位体与单个中心离子(或原子)所形成的配合物K2[PtCl6][Fe(H2O)6]Cl5[Cr(H2O)6]Cl3Na[AlF6]2.螯合物由中心离子和多齿配体结合而成的环状配合物。
思考题:在制剂中作为金属离子络合剂使用的是A.NaHCO3B.NaClC.焦亚硫酸钠D.NaOHE.依地酸二钠【正确答案】E四、配位平衡Ks(K稳)称为配离子的稳定常数,Ks越大,说明生成配离子的倾向越大,配合物越稳定。
高中化学配位化合物命名规则解析与应用

高中化学配位化合物命名规则解析与应用化学是一门普遍存在于我们日常生活中的学科,而化学配位化合物则是其中的重要一环。
在学习化学的过程中,我们经常会遇到需要命名配位化合物的题目,理解并掌握其命名规则是解题的关键。
本文将对高中化学配位化合物命名规则进行解析,并通过具体的例子和分析来说明这些规则的应用。
一、正离子的命名正离子的命名通常是根据其元素名称来进行的。
例如,对于铁离子Fe2+,我们可以直接称之为“铁离子”。
但是对于存在多个氧化态的金属离子,我们需要通过罗马数字来表示其氧化态。
例如,Fe3+可以称为“三价铁离子”。
二、阴离子的命名阴离子的命名通常是根据其元素名称的后缀来进行的。
例如,氧化物离子O2-可以称为“氧化物”,氯离子Cl-可以称为“氯离子”。
另外,一些常见的阴离子也有特定的名称,比如OH-可以称为“氢氧根离子”,CO32-可以称为“碳酸根离子”。
三、配位体的命名配位体是指与金属离子形成配位键的原子或分子。
在命名配位体时,我们需要根据其化学式或名称来进行。
例如,H2O可以称为“水”,NH3可以称为“氨”,Cl-可以称为“氯化物”。
四、配位化合物的命名在命名配位化合物时,首先需要写出金属离子的名称,然后根据配位体的名称和数量来进行命名。
配位体的名称通常以其化学式的前缀来表示其数量,如mono-表示一个,di-表示两个,tri-表示三个,tetra-表示四个。
例如,对于配位体Cl-,我们可以称之为“氯化物”,如果有两个Cl-配位体,则可以称之为“二氯化物”。
在实际应用中,我们还需要注意一些特殊情况。
例如,当配位体的名称以元素名称结尾时,需要将其名称改为以“-o”结尾。
例如,CN-可以称为“氰根离子”,但在配位化合物中,我们需要将其称为“氰化物”。
另外,一些常见的配位体也有特定的名称,如H2O可以称为“水合物”,NH3可以称为“胺”。
通过以上的解析,我们可以看出,命名配位化合物的关键是理解金属离子、阴离子和配位体的命名规则,并合理运用这些规则进行组合。
配合物的中文命名法

普鲁士蓝的来历:
18世纪有一个名叫狄斯巴赫的德国人,他是制造和使用涂料的 工人,因此对各种有颜色的物质都感兴趣。总想用便宜的原料制造 出性能良好的涂料。有一天他制造出了一种蓝色的涂料。 狄斯巴赫的老板是个唯利是图的商人,他感到这是一个赚钱的 好机会,于是,他对这种涂料的生产方法严格保密,并为这种颜料 起了个令人捉摸不透的名称——普鲁士蓝,以便高价出售这种涂料。 德国的前身普鲁士军队的制服颜色就是使用该种颜色,以至1871年 德意志第二帝国成立后相当长一段时间仍然沿用普鲁士蓝军服,直 至第一次世界大战前夕方更换成土灰色。 直到20年以后,一些化学家才了解普鲁士蓝是什么物质,也掌 握了它的生产方法。原来,草木灰中含有碳酸钾,牛血中含有碳和 氮两种元素,这两种物质发生反应,便可得到亚铁氰化钾,它便是 狄斯巴赫得到的黄色晶体,由于它是从牛血中制得的,又是黄色晶 体,因此更多的人称它为黄血盐。它与三氯化铁反应后,得到六氰 合铁酸铁,也就是普鲁士蓝。
2.1 几何(立体)异构及几何异构体的命名
多种配体在中心原子(离子)周围所处的相对位 置不同而导致的异构现象称为配合物的几何异构。
2.1.1 顺-反异构
同种配体处于相邻位
置者称为顺式异构体,
同种配体处于对角位 置者称为反式异构体。 MA2B2类型的平面正 方型配合物具有顺反
异构体。如
[Pt(NH3)2Cl2]。
⑥当中心离子具有多种氧化态时,可在该原子后用 括号注明(常用罗马数字)
配体的次序
①无机配体在前,有机配体在后 [PtCl2(Ph3P)2] 二氯·二(三苯基磷)合铂(II)
•
②先阴离子配体,后阳离子配体,最后中性配体 K[PtCl3NH3] 三氯·氨合铂(II)酸钾 ③同类配体,按配位原子元素符号的英文字母顺序 [Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(III) ④若同类配体的配位原子相同,则含较少原子数的配体排 在前 [Pt(NO2)(NH3)(NH2OH)(Py)]Cl 氯化硝基·氨·羟氨·吡啶合铂(II)
大学基础化学配位化合物讲稿

第一节 配位化合物的基本概念
配合物的命名实例
[Co(NH3)5(H2O)]2(SO4)3 [Co(NH3)2(en)2]Cl3 硫酸五氨·水合钴(III) 氯化二氨·二(乙二胺)合钴(III)
NH4[Co(NO2)4(NH3)2]
[Ni(CO)4] NH4[Cr(NCS)4(NH3)2]
四硝基·二氨合钴(III)酸铵
第一节 配位化合物的基本概念
③ 静电作用: • 中心原子的电荷愈多,愈有利于形成配位数大 的配离子 [PtCl4]2-, [PtCl6]2• 配体所带的电荷愈多,配体间的斥力就愈大, 配位数相应变小 [Ni(NH3)6]2+, [Ni(CN)4]2-。
第一节 配位化合物的基本概念
一些金属离子的配位数
深蓝色
第一节 配位化合物的基本概念
• 1、配位单元:由金属离子(或原子)和一定数 目的中性分子或阴离子通过配位键所组成的单元 称为配位单元。 配位单元包括:配阳离子、配阴离子、中性的分 子。 2、配位化合物:含有配位单元的化合物。
• •
第一节 配位化合物的基本概念
带正电荷的配离子称为配阳离子 [Cu(NH3)4]2+、[Ag(NH3)2]+ 带负电荷的配离子称为配阴离子 [HgI4]2-、[Fe(NCS)4]含有配离子的化合物和配位分子统称为配合物。 配合物可以是 酸: H[Cu(CN)2] 碱: [Cu(NH3)4](OH)2 盐: [Cu(NH3)4]SO4 也可以是电中性的配位分子 [Ni(CO)4] 习惯上把配离子也称为配合物 [Cu(NH3)4]2+
大学化学基础:配位化合物
4d 4s 4p
结论: Cu(NH3)42+ 易被氧化成Cu(NH3)43+ ×错误结论
d sp 杂 化 3d
8 NH3 NH3 NH3 NH3 2
4d d sp2 杂 化 轨 道
(1) 可以解释[Co(CN)6]4- 易被氧化[Co(CN)6]3但无法解释[Cu(NH3)4]2+比[Cu(NH3)4]3+稳定的 事实 (2) 对配合物产生高低自旋的解释过于牵强. (3) 无法解释配离子的稳定性与中心离子电子构 型之间的关系 重要原因:未考虑配体对中心离子的影响
2 .价键理论的应用
1)内层和外层的d轨道均可参与杂化
•内轨型 •外轨型
中心离子杂化轨道的形成
1)(n-1)d nS nP型(内轨型)
例1、讨论Ni(CN)42 –构型
Ni(CN)42 –
Ni2+ (3d8): 3d
在CN-作用下,d电子重排
4s
4p
然后空d轨道进行杂化
•• ••
••
••
dsp2杂化
键的共价性较强,稳定性较好,在水溶液 中,一般较难离解为简单离子。
2)nS nP nd型(外轨型)
[FeF6]3–
[FeF6]3– sp3d2杂化, 八面体构型, 外轨型配合物
Co(NH3)62+: Co2+: 3d7
4d 4s 3d7
sp 3d 2杂化 3d
8 NH3 NH3 NH3 NH 3 NH3 NH3
亚硝酰铁氰化钠 Na2[Fe(CN)5NO]· 2H2O
氯化三(乙二胺)合铬(III)
例:命名下列配合物,指出它们的
配位体、配位原子及配位数 [Co(NH3)6]3+ 六氨合钴(Ⅲ)配离子 配体: NH3 ,配位原子: N
配位化合物课件

硫氰根 异硫氰根
C6H5 -
py ( en Ph3P )
苯基
吡啶 乙二胺 三苯基膦
NO CO H2O
亚硝酰 羰基 水
NH3
(O2)
氨
双氧
3. 配体的先后顺序 在配位单元中,可能涉及多种
配体,所以要明确规定命名时配体
的次序。 下述的每条规定均以其前一条 规定为基础。
(1) 先无机配体后有机配体。
配体前面用 二、三、四 · · ·
· ·表示该配体的个数。 ·
[ Co NH3)H2O ] Cl3 ( 5 三氯化五氨•水合钴(III)
Cu2 [ SiF6 ]
六氟合硅(IV)酸亚铜
几种不同的配体之间加 ‘ • ’
隔开。
[ Co NH3)H2O ] Cl3 ( 5 三氯化五氨•水合钴(III)
Cu2 [ SiF6 ]
2. 空间异构 空间异构又叫立体异构。 空间异构分为:
(1) 几何异构 (2) 旋光异构
空间异构特点是 配位单元的中心与配体之间键 联关系相同,但配体相互位置不同, 或配体在中心周围排列方式不同。
(1) 几何异构 几何异构又叫顺反异构,其特点是
配体相互位置不同。
例如配位数为 4 的平面正方形结构 的 [ PtCl(NH3)],有几何异构现象。 2 2
[ CrCl H2O) ] Cl2•H2O ( 5
(2) 配位异构 内界之间交换配体,得到的异构 体称为配位异构。 如 [ Co NH3) ] [ Cr CN )] 和 ( ( 6 6 [ Cr NH3)] [ Co CN )] ( ( 6 6 互为配位异构。
(3) 键合异构
组成和结构均相同但配位原子
(4) 配位原子相同,配体
熟悉配位化合物的命名规则

熟悉配位化合物的命名规则配位化合物是由一个或多个受体离子(通常为金属离子)和一个或多个配体离子(通常是化学中的非金属离子或配体分子)通过共价键或配位键形成的化合物。
它们广泛应用于各个领域,如医学、工业和环境科学等。
配位化合物的命名规则通常遵循一定的规范,以确保命名的一致性和易读性。
配位化合物的命名主要包括两个方面,一是金属离子的命名,二是配体离子或配体分子的命名。
下面将详细介绍这两个方面的命名规则。
一、金属离子的命名金属离子的命名主要遵循以下规则:1. 阳离子通常使用原子名称,并在名称后面加上离子电荷。
例如,Fe^3+是铁离子的氧化态为+3的形式。
2. 阴离子通常使用负离子的化学名称,并在名称后加上离子电荷。
例如,Fe^3+ 配合物中的氨配体是氨离子(NH3),可以用氮氢(III)来表示。
3. 如果阴离子具有多个可能的化学价态,可以使用罗马数字来表示其化学价态。
例如,Fe^3+ 和 Fe^2+ 可以分别称为铁(III)和铁(II)。
二、配体离子或配体分子的命名配体离子或配体分子的命名主要遵循以下规则:1. 以配体中的小离子(阴离子或阳离子)来命名。
例如,CN-为氰离子,同样的,OH-为羟基离子。
2. 如果配体是一个分子,可以用其常用名称或化学名称来命名。
例如,NH3为氨分子。
3. 如果配体是一个配体离子,例如H2O,它可以用其负离子的化学名称(氧化二氢)或常用名称(水)来命名。
4. 当配体是一个配体离子时,可以在其离子名称之前加上一定的前缀来表示其配位性。
例如,NO2- 是亚硝酸根离子,可以用亚硝合(III)来表示。
综上所述,配位化合物的命名规则非常重要,可以使人们准确地了解化合物的成分和结构,从而有效地进行科学研究和工程应用。
通过理解和熟悉这些命名规则,人们可以更加准确和便捷地进行化学实验和研究。
配位化合物的命名规则还在不断发展和完善中,随着科技的进步,会有越来越多的新命名规则被提出和应用。
1.3-配位化合物的命名

• ⑤若配位原子相同,配体中所含原子数目也相同, 则按在结构式中与配位原子相连的原子的元素符 号字母顺序排列 • [Pt (NH2)(NO2)(NH3)2] 胺基·硝基·二氨合铂(II)
• ⑥配体相同,配位原子不同,则按配位原子元素 符号的字母顺序排列 (- SCN, -NCS)或不同的名 称命名 • 例1:[Fe(CN)5(NO)]2• 五氰·亚硝酰合铁(II)离子
• K3〔Fe(CN)6〕(铁氰化钾) • 称赤血盐 。
• Fe4〔Fe(CN)6〕3 (亚铁氰化铁)称普 鲁士蓝。
完
• 阴、ቤተ መጻሕፍቲ ባይዱ离子都是配合物
• 先配阴离子,(酸)后配阳离子。 • [Cr(NH3)6][Co(CN)6] • 六氰合钴(III)酸六氨合铬(III) • [Pt(NH3)6][PtCl4] • 四氯合铂(II)酸六氨合铂(II)
• • • •
实际上,某些配合物还常用俗名, 如K4[Fe(CN)6] (亚铁氰化钾) 又称黄血盐 。
• 例2:[Ni(phen)2(H2O)2]2+
• 二水·二(1,10-菲罗啉)合镍(II)离子
含配阴离子的配合物
• 在配阴离子与外界阳离子之间用酸字相连 • 例:K2[Fe(CN)6] 六氰合铁(III)酸 钾 • 阴离子命名顺序:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• K2Ba[Fe(NO2)6] • Potassium barium hexanitritoferrate(II) • (NH4)2[Ni(SCN)4] • ammonium tetrathiocyanatonickelate(II) • Ni[Ce(NO3)6] nickel(II) hexanitratocerate(IV) • Ag[Sb(SO4)2] silver(I) disulfatoantimonate(III)
• Silver(I) disulfatostibate(III)
• Li[Ag(S2O3)] lithium thiosulfatoargentate(I)
• Rb2[Be(C2O4)2] rubidium dioxalatoberyllate
NH4[Mn(C3H2O4)2(OH2)2]
ammonium bismalonatodiaquamanganate(III)
• K2[CuCl4] potassium tetrachlorocuprate(II)
• K2[Pt(CNS)6] • potassium hexathiocyanoplatinate(IV)
• K3[Fe(CN)6] potassium hexacyanoferrate(III)
• Na[B(NO3)4] sodium tetranitratoborate(III) • Na3[Co(CO3)3] sodium tricarbonatocobaltate(III)
pentaamminehydroxidorhodium(III) nitrateБайду номын сангаас
• H2O => aqua • NH3 ammonia => ammine • CO carbonyl • NO nitrosyl O2 dioxygen N2 dinitrogen
• ethylenediamine (en) • pyridine (py) • 1,10-phenanthroline (phen) • 2,2'-bipyridine (bipy) • 4,4'-bipyridine • triphenylphosphine
•HSO3- => bisulfito •H- => hydro hydrido •C6H5- => phenyl (ph) •C5H5- => cyclopentadienyl •CO32- => carbonato
Multiplicity
monodentate •mono = 1 hepta=7 •di = 2 octa= 8 •tri = 3 nona= 9 •tetra = 4 deca =10 •penta = 5 undeca=11 •hexa = 6 dodeca=12
• [Cu(NH3)4]SO4
• tetraamminecopper(II) sulfate • [Cr(H2O)5Cl]SO4 pentaaquachlorochromium(III) sulfate • [Cr(H2O)4Cl2]Cl
tetraaquadichlorochromium(III) chloride
• [Cu(en)2]2+
• bis(ethylenediamine)copper(II) ion
•Anionic coordination sphere
• K3[Fe(CN)6] • potassium hexacyanoferrate(III) • K2[PtCl4] potassium tetrachloroplatinate(II)
• (NH4)2[Ni(C2O4)2(H2O)2] •ammonium diaquabis(oxalato)nickelate(II)
Cationic coordination sphere Anionic coordination sphere
[Ti(H2O)6][CoCl6] • hexaaquatitanium(III) hexachlorocobaltate(III) • [Cu(en)2][PtCl4] • bis(ethylenediamine)copper(II) tetrachloroplatinate(II)
• [Pt(NH3)5Cl]Br3 pentaamminechloroplatinum(IV) bromide
•[Pt(H2NCH2CH2NH2)2Cl2]Cl2 dichlorobis(ethylenediamine)platinum(IV) chloride
• [Co(H2NCH2CH2NH2)3]2(SO4)3 tris(ethylenediamine)cobalt(III) sulfate
第五课 Nomenclature of Coordination Coumpounds
配合物的形态
•[ ] •[ ]+L• M+[ ]•[ ]+[
]-
• neutral compound • ionic => cation before anion
Ligands
• Neutral Molecules
•Anionic coordination sphere
• -ate ending
Neutral molecule
• Fe(CO)5 pentacarbonyliron(0)
• [Ru(NH3)4(HSO3)2] • tetraamminebis(bisulfito) ruthenium(II) • [Cr(NH3)3Cl3]
• [Co(en)2Cl2]Cl
dichlorobis(ethylenediamine)cobalt(III) chloride
• [Cu(NH3)4]SO4
• tetraamminecopper(II) sulfate
• [Co(NH3)4(H2O)F]2+
tetraammineaquafluorocobalt(III) ion
Fe(CN)63- ferricyanide hexacyanoferrate(III) ion Fe(CN)64- ferrocyanide Fe(CO)5 is called iron carbonyl.
exercise
• [IrH3(PPh3)3] • [Co(NO2)(NH3)5]Cl2 • [Co(ONO)(NH3)5]Cl2
K[CrO3F]
potassium fluorotrioxochromate(VI)
K3[Ir(NO2)4Cl2]
potassium dichlorotetranitritoiridate(III)
Rb2[InCl5(OH2)]
rubidium aquapentachloroindate(III)
[Rh(OH)(NH3)5](NO3)2
bi- or tri- dentate •bis => 2 •tris => 3 •tetrakis => 4 •…… •dodecakis=12
Coordination Sphere Nomenclature
•Cationic coordination sphere
• Generally -ium ending • or name of center element
• triamminetrichlorochromium(III)
cationic coordination sphere
• [Cr(NH3)3(H2O)3]Cl3 • triamminetriaquachromium(III) chloride Solution: • ·The complex ion is found inside the parentheses. In this case, the complex ion is a cation. • ·The ammine ligands are named first because alphabetically(按字母顺序地), "ammine" comes before "aqua."
• [Cr(H2O)2BrClFI]• diaquabromochlorofluoroiodochromate(III) ion • [Pt(NH3)Cl3]amminetrichloroplatinate(II) ion
• Na2[NiCl4] •sodium tetrachloronickelate(II) •[Pt(NH3)2Cl4 ] •diamminetetrachloroplatinum(IV)
•Anions
•F- => fluoro fluorido •Cl- => chloro chlorido •Br- => bromo bromido •I- => iodo iodido •O2- => oxo oxido •OH- => hydroxo hydroxido •CN- => cyano cyanido
&
• [Cr(NH3)6][IrCl6] • hexaamminechromium(III) hexachloroiridate(III)
•[Ag(NH3)2][Ag(CN)2] •diamminesilver(I) dicyanoargentate(I) •diamminesilver(I) dicyanidoargentate(I)
Trihydridotris(triphenylphosphine)iridium(III) Pentaamminenitrocobalt(II) chloride
Pentaamminenitritocobalt(III) chloride
• 1. [CoBr(NH3)5]SO4 • 2. [Fe(NH3)6][Cr(CN)6] • 3. [Co(SO4)(NH3)5]+ • 4. [Fe(OH)(H2O)5]2+ • 1. pentaamminebromocobalt(III) sulfate • 2. hexaammineiron(III) hexacyanochromate (III)
