器械临床试验受试者筛选入选表
受试者筛选入选表

受试者筛选入选表
研究题目:
研究中心编号及名称:
●每个签署知情同意书的患者都需要登记;
●受试者编号为中心号2位+筛选顺序号3位,根据患者签署知情同意书的先后顺序,顺序号依次从小到大;
如01中心,受试者编号为01001 、01002、01003,依次往下;
●患者姓名缩写与CRF填写要求一致;四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;
四字姓名填写每一个字首字母;
举例:张红
李淑明
欧阳小惠
●;
●结束日期是指患者结束试验的日期。
若患者筛选失败,则结束日期为确定筛选失败的日期,并应在“筛选失败的原因”栏予以记录;
若患者完成整个试验,则结束日期为该患者完成试验的日期;若患者提前中止研究(无论是因为失访、不可耐受的不良事件、疗效不佳等任何原因),结束日期应为该患者中止研究的日期,并应在“脱落原因”栏予以记录
受试者筛选入选表
注:受试者编号格式:中心号(2位)+筛选顺序号(3位),例如:01001 ,入组日期请记录获取随机号日期。
306PLA JG R 001 02受试者入选筛选登记表

临床试验申请表306PLA-JG-T-001-01研究者履历表306PLA-JG-T-002-01项目名称: CFDA批件号:研究中心名称:研究中心代号:方案编号:参加负责项目分工:研究者声明临床试验协调会签到表306PLA-JG-T-003-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:临床试验协调会记录表306PLA-JG-T-004-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:日期:__________________ _ 主要研究者:临床试验提交伦理审议申请表306PLA-JG-T-005-01中国人民解放军第306医院国家药物临床试验机构管理文件临床试验启动会签到表306PLA-JG-T-006-01项目名称:方案编号:申办单位:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:中国人民解放军第306医院国家药物临床试验机构管理文件临床试验启动会记录表306PLA-JG-T-007-01项目名称:方案编号:申办单位:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:_________日期:主要研究者:_________ _中国人民解放军第306医院国家药物临床试验机构管理文件研究人员分工表306PLA-JG-T-008-01项目名称:方案编号:申办单位:专业科室:主要研究者:主要研究者签字:日期:中国人民解放军第306医院国家药物临床试验机构管理文件受试者筛选/入选表306PLA-JG-T-009-01页第页___共___中国人民解放军第306医院国家药物临床试验机构管理文件受试者签认代码表306PLA-JG-T-010-01 项目名称:方案编号:___第共页___页中国人民解放军第306医院国家药物临床试验机构管理文件严重不良事件报告表306PLA-JG-T-011-01项目名称:CFDA批件号:方案编号:中国人民解放军第306医院国家药物临床试验机构管理文件/ 报告者(研究医生)/报告日期:确认者(主要研究者/日期: /时间:/ / 发送者/日期者送是CFDA注册司否发伦理委员会申办至:□是□否□是□否□是□否中国人民解放军第306医院国家药物临床试验机构管理文件完成试验受试者编码目录306PLA-JG-T-012-01项目名称:方案编号:___第共页___页中国人民解放军第306医院国家药物临床试验机构管理文件临床试验总结会签到表306PLA-JG-T-013-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:中国人民解放军第306医院国家药物临床试验机构管理文件临床试验总结会记录表306PLA-JG-T-014-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:________日期:主要研究者:_________ _中国人民解放军第306医院国家药物临床试验机构管理文件临床试验用药物(物资)签收记录单306PLA-JG-T-015-01 项目名称: CFDA批件号:方案编号:研究中心名称:研究中心代号:发送单位名称:___第页___共页中国人民解放军第306医院国家药物临床试验机构管理文件试验用药物保存记录表306PLA-JG-T-016-01方案编号:项目名称:药物编号:药物名称:药物批号:药物规格:中国人民解放军第306医院国家药物临床试验机构管理文件试验用药物分发回收记录表306PLA-JG-T-017-01中国人民解放军第306医院国家药物临床试验机构管理文件临床试验剩余药物(物资)退回/销毁记录单306PLA-JG-T-018-01中国人民解放军第306医院国家药物临床试验机构管理文件文件接收、保管记录表306PLA-JG-T-019-01项目名称:方案编号:发送方:接收方:送交人:_________________ 日期:_________________注:本记录一式两份,本份由_____________(研究中心名称)保存。
医疗器械及体外诊断试剂临床试验基本文件目录

医疗器械/体外诊断试剂临床试验基本文件目录
为指导申办者和医疗器械临床试验机构开展医疗器械(含体外诊断试剂,下同)临床试验,特制定本文件目录供参考执行。
医疗器械临床试验开展顺序一般为:申办者完成临床前相关研究,选择已备案的医疗器械临床试验机构以及主要研究者,并组织临床试验方案等相关文件制定。
伦理委员会审查批准该临床试验,申办者与临床试验机构签订合同后进行医疗器械临床试验项目备案;其中,对人体具有较高风险的第三类医疗器械临床试验,还应当经国务院药品监督管理部门批准。
受试者签署知情同意书以及入组,研究者按照临床试验方案实施临床试验。
申办者在临床试验完成后向所在地省局报告。
一、临床试验准备阶段
—1 —
二、临床试验进行阶段
—2 —
三、临床试验完成或者终止后
—3 —。
试验受试者筛选入选表
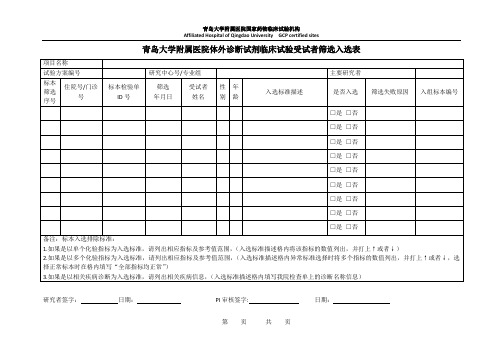
项目名称
试验方案编号
研究中心号/专业组
主要研究者
标本
筛选
序号
住院号/门诊号
标本检验单ID号
筛选
年月日
受试者
姓名
性别
年龄
入选标准描述
是否入选
筛选失败原因
入组标本编号
□是□否
□是□否
□是□否□是□否□是□否Fra bibliotek□是□否
□是□否
□是□否
□是□否
备注:标本入选排除标准:
1.如果是以单个化验指标为入选标准,请列出相应指标及参考值范围,(入选标准描述格内将该指标的数值列出,并打上↑或者↓)
2.如果是以多个化验指标为入选标准,请列出相应指标及参考值范围,(入选标准描述格内异常标准选择时将多个指标的数值列出,并打上↑或者↓,选择正常标本时在格内填写“全部指标均正常”)
3.如果是以相关疾病诊断为入选标准,请列出相关疾病信息,(入选标准描述格内填写我院检查单上的诊断名称信息)
研究者签字:日期:PI审核签字:日期:
受试者筛选、入选

受试者筛选、入选SOP
一、目的:建立受试者筛选、入选的操作规程,确保试验的顺利进行。
二、范围:适用于所有临床试验。
三、规程:
1.受试者是药物临床试验的客观对象,试验方案的设计应满足科学和伦理的要求,保护受试者权益。
2.根据药物临床试验方案的要求,从不同人群中(健康志愿者、门诊患者、住院患者等)招募受试者。
可以通过张贴招募广告、社区宣传、电视广播等方式招募受试者。
3.药物临床试验的研究人员在熟悉试验方案后,向受试者进行知情同意,待对方充分考虑、理解并充分咨询同意后,签署知情同意书。
知情同意的过程遵照受试者知情同意SOP。
4.受试者签署知情同意书后,按照各项药物临床试验的入组和排除标准对受试者进行筛选,并填写《受试者筛选与入选表》。
必须满足所有入选标准,并不能符合任一排除标准的受试者方可进入药物临床试验。
5.符合方案要求的受试者按照方案既定的标准随机分组,并进行相应的观察治疗。
青岛大学附属医院体外诊断试剂临床试验受试者筛选入选表
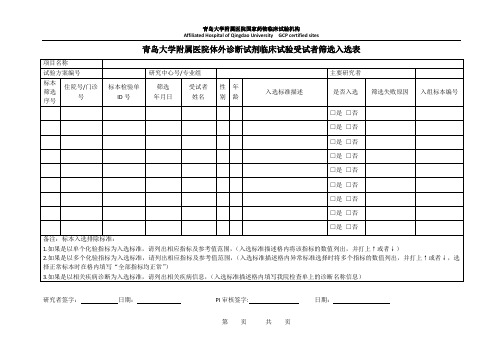
项目名称试验方案编号研究来自心号/专业组主要研究者
标本
筛选
序号
住院号/门诊号
标本检验单ID号
筛选
年月日
受试者
姓名
性别
年龄
入选标准描述
是否入选
筛选失败原因
入组标本编号
□是□否
□是□否
□是□否
□是□否
□是□否
□是□否
□是□否
□是□否
□是□否
备注:标本入选排除标准:
研究者签字:日期:PI审核签字:日期:
1.如果是以单个化验指标为入选标准,请列出相应指标及参考值范围,(入选标准描述格内将该指标的数值列出,并打上↑或者↓)
2.如果是以多个化验指标为入选标准,请列出相应指标及参考值范围,(入选标准描述格内异常标准选择时将多个指标的数值列出,并打上↑或者↓,选择正常标本时在格内填写“全部指标均正常”)
3.如果是以相关疾病诊断为入选标准,请列出相关疾病信息,(入选标准描述格内填写我院检查单上的诊断名称信息)
GCP档案室医疗器械临床试验归档登记表
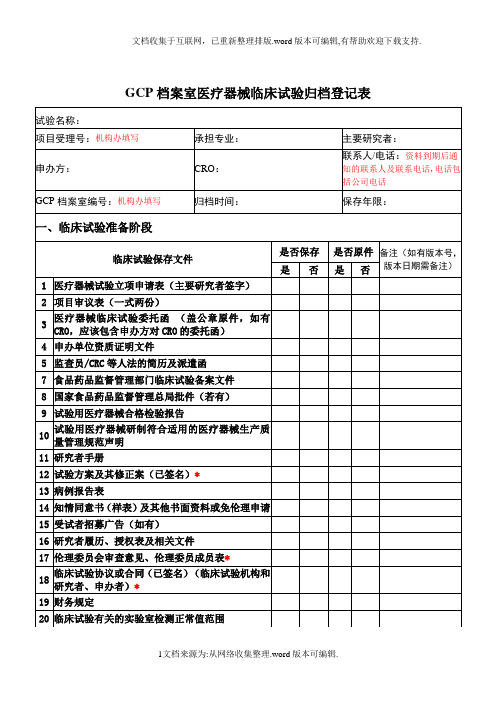
医学、实验室检查,操作的正常值范围更新(若有)
27
试验用医疗器械与试验相关物资的交接单
28
监查员访视报告
29
已签名的知情同意书*
30
原始医疗文件*
31
病例报告表(已填写,签名,注明日期)*
32
研究者对严重不良事件的报告(若有)*
33
申办者对严重不良事件和可能导致严重不良事件的器械缺陷的报告(若有)
19
财务规定
20
临床试验有关的实验室检测正常值范围
21
医学或实验室操作的质控证明(若有)*
22
试验用医疗器械与试验相关物资的交接单
23
临床试验启动会培训记录
二、临床试验进行阶段
临床试验保存文件
是否保存
是否原件
备注(如有版本号,版本日期需备注)
是
否
是
否
24
研究者手册更新件(若有)
25
其他文件(方案、病例报告表、知情同意书、书面情况通知)的更新(若有)
是
否
是
否
1
医疗器械试验立项申请表(主要研究者签字)
2
项目审议表(一式两份)
3
医疗器械临床试验委托函 (盖公章原件,如有CRO,应该包含申办方对CRO的委托函)
4
申办单位资质证明文件
5
监查员/CRC等人法的简历及派遣函
7
食品药品监督管理部门临床试验备案文件
8
国家食品药品监督管理总局批件(若有)
9
试验用医疗器械合格检验报告
34
受试者鉴认代码表*
35受Leabharlann 者筛选表与入选表36研究者签名样张及研究者授权表
