第十一章动力学(一)习题解答解析
11-化学动力学 习题

k2 k1
Ea 1 1 R T2 T1
再确定是一级反应,并利用半衰期和速率常数的关系
t1/ 2
ln 2 k
0.693 k
例: 某反应在15.05℃时的反应速率常数为34.40×103 dm3·mol1·s1,在40.13℃时的反应速率常数为189.9×103 dm3·mol1·s1。求反应的活化能,并计算25.00℃时的反应 速率常数。
分析:利用阿伦尼乌斯方程的定积分形式
ln
k2 k1
Ea 1 1 R T2 T1
解:lnkFra bibliotek k1Ea R
T1 T2 T1T2
即
ln
189.9 103 34.40 103
Ea 8.314JK1
mol1
(288.20 313.28)K 313.28K 288.20K
E a = 51.13 kJ·mol1
2. 某反应进行时,反应物浓度与时间成线性关系,则此反 应的半衰期与反应物初始浓度 a (a) 成正比 (b) 成反比 (c) 平方成反比 (d) 无关
3、若反应速率常数k的单位为浓度·时间-1,则该反应为: ( D )。 A、三级反应 B、二级反应 C、一级反应 D、零级反应
4、零级反应AB的半衰期t1/2与A的初浓度cA,0及速率常数k 的关系是:( C )。
ln
0.2303min 1 0.0128min 1
1 650K
=1.4337 ×10-3 K-1, T2 = 698 K
【11.47】
ln 2 54 min
0.0128 min 1
k
(T2
)
1 t
ln
cA,0 cA
1 ln 100 0.2303 min 1 10 min 10
(整理)第11章动力学练习题

第十一章动力学练习题一、是非题(对的画√错的画×)1、反应速率系数k A 与反应物A 的浓度有关。
( )2、反应级数不可能为负值。
( )3、一级反应肯定是单分子反应。
( )4、对二级反应来说,反应物转化为同一百分数时,若反应物的初始浓度越低,则所需时间越短。
( )5、对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈敏感。
( )6、阿累尼乌斯活化能的定义是dTkd RT Ea ln 2=。
( ) 7、对于元反应,反应速率系数部随温度的升高而增大。
( ) 8、若反应A →Y ,对A 为零级,则A 的半衰期 AA k C t 20,21=.。
( )9、设对行反应正方向是放热的,并假定正逆都是元反应,则升高温度更利于增大正反应的速率系数。
( )10、连串反应的速率由其中最慢的一步决定,因此速率控制步骤的级数就是总反应的级数。
( ) 11、鞍点是反应的最低能量途径上的最高点,但它不是势能面上的最高点,也不是势能面上的最低点。
( )12、过渡态理论中的活化络合物就是一般反应历程中的活化分子。
( ) 13、催化剂只能加快反应速率,而不有改变化学反应的标准平衡常数。
( )14、复杂反应是由若干个基元反应组成的,所以复杂反应的分子数是基元反应的分子数之和.。
( )15、质量作用定律只适用于元反应。
( )16、某反应,若其反应速率方程式为υA =κA B ,则当c B,0>>c A,0时,反应速率方程可约化为假二级反应。
( )17、若反应+Z 的速率方程为 υ= kc A c B , 则该反应是二级反应,且肯定是双分子反应。
( )18、对于反应 2NO + Cl 2 −→− 2NOCl ,只有其速率方程为:υ=k {c (NO)}2c (Cl 2),该反应才有可能为元反应。
其他的任何形式,都表明该反应不是元反应。
( )19、 知道了反应物和产物可写出化学反应方程式, 但不能由配平的化学反应式直接写出反应级数和反应分子数。
4第十一章化学动力学全解

物化第十一章化学动力学习题、名词解释1•反应机理 2.基元反应 3.反应级数4.反应分子数5.反应速率常数6.半衰期二、简答题1. 反应级数和反应分子数有何区别?2. 简述零级反应的主要特征有哪些?3. 简述一级反应的主要特征有哪些?4. 简述二级反应的主要特征有哪些?5. 已知气相反应2HI=H 2+I 2之正、逆反应都是二级反应:(1) 问正、逆反应速率常数 k 、k '与平衡常数K 的关系是什么? (2) 问正、逆反应的活化能与正反应恒容反应热的关系是什么? 6. 阈能的物理意义是什么?它与阿累尼乌斯经验活化能E a 在数值上的关系如何?三、判断题 1.某反应的速度常数 k=4.62 X 0-2分-1,又初始浓度为0.1mol.dm -3,该反应的半衰期为15分。
2. 单分子反应称为基元反应,双分子反应和三分子反应称为复合反应。
3. 简单反应都是简单级数反应;简单级数的反应不一定就是简单反应。
4. 双分子反应一定是二级反应5. 当温度一定时,化学反应的活化能越大其反应速率越大。
6. 在同一反应中各物质的变化速率相同。
7. 若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。
8. 单分子反应一定是基元反应。
9. 双分子反应一定是基元反应。
10. 零级反应的反应速率不随反应物浓度变化而变化。
11. 若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
12. 一个化学反应进行完全所需的时间是半衰期的 2倍。
13. —个化学反应的级数越大,其反应速率也越大。
14 .若反应A + B T + Z 的速率方程为:r=kC A C B ,则该反应是二级反应,且肯定是双分子反应。
15•对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生 成更多的产物。
16. 若反应(1)的活化能为E 1,反应(2)的活化能为E 2,且E 1 > E 2,则在同一温度下 k 1 一定小于k ?。
大学物理习题答案第十一章

[习题解答]11-7 在磁感应强度大小为B = 0.50 T 的匀强磁场中,有一长度为l = 1.5 m 的导体棒垂直于磁场方向放置,如图11-11所示。
如果让此导体棒以既垂直于自身的长度又垂直于磁场的速度v 向右运动,则在导体棒中将产生动生电动势。
若棒的运动速率v = 4.0 m ⋅s -1 ,试求:(1)导体棒内的非静电性电场K ;(2)导体棒内的静电场E ;(3)导体棒内的动生电动势ε的大小和方向;(4)导体棒两端的电势差。
解(1)根据动生电动势的表达式,由于()的方向沿棒向上,所以上式的积分可取沿棒向上的方向,也就是d l 的方向取沿棒向上的方向。
于是可得.另外,动生电动势可以用非静电性电场表示为.以上两式联立可解得导体棒内的非静电性电场,为,方向沿棒由下向上。
图11-11(2)在不形成电流的情况下,导体棒内的静电场与非静电性电场相平衡,即,所以,E 的方向沿棒由上向下,大小为.(3)上面已经得到,方向沿棒由下向上。
(4)上述导体棒就相当一个外电路不通的电源,所以导体棒两端的电势差就等于棒的动生电动势,即,棒的上端为正,下端为负。
11-8 如图11-12所表示,处于匀强磁场中的导体回路ABCD ,其边AB 可以滑动。
若磁感应强度的大小为B = 0.5 T ,电阻为R = 0.2 Ω,AB 边长为 l = 0.5 m ,AB 边向右平移的速率为v = 4 m ⋅s -1 ,求:(1)作用于AB 边上的外力;(2)外力所消耗的功率;(3)感应电流消耗在电阻R 上的功率。
解(1)当将AB 向右拉动时,AB 中会有电流通过,流向为从B 到A 。
AB 中一旦出现电流,就将受到安培力F 的作用,安培力的方向为由右向左。
所以,要使AB 向右移动,必须对AB施加由左向右图11-12的力的作用,这就是外力F外。
在被拉动时,AB中产生的动生电动势为,电流为.AB所受安培力的大小为,安培力的方向为由右向左。
外力的大小为,外力的方向为由左向右。
天津大学物理化学教研室《物理化学》(第6版)笔记和课后习题(含考研真题)详解-第十一章至第十二章【圣

1.转化速率
用单位时间内反应发生的进度来定义。对于非依时计量学反应,反应进度ξ定义为:dξ
▪
▪
≝ (1/vB)dnB,所以转化速率ξ为ξ≝ dξ/dt=(1/vB)(dnB/dt),转化速率的单位为 mol·s
-1。
注意:
▪
(1)反应的转化速率ξ是广度量,依赖于反应系统的大小;
(2)对于非依时计量反应,转化速率的数值与用来表示速率的物质 B 的选择无关;
(2)分级数与组分的计量系数无关;
(3)分级数一般为零、整数或半整数(正或负);
(4)对于速率方程不符合
v
kcAnA
cnB B
的反应,不能应用级数的概念。
在每个反应组分的分级数都是一级的二级反应中,若维持其中一组分的浓度远远大于另
一组分的浓度,反应过程中其浓度变化可以忽略不计,从而使此反应表现为一级反应,这种
(3)与化学计量式的写法有关,应用上述定义式时必须指明化学反应方程式。
2.反应速率
单位体积的转化速率,定义式为
def
vξ
V (
1
)( dnB )
νBV dt
1 / 134
圣才电子书 十万种考研考证电子书、题库视频学习平台
反应速率 v 为强度量,其单位为 mol·m-3·s-1,与用来表示速率的物质 B 的选择无关, 与化学计量式的写法有关。
2.半衰期法
ln t1
2
ln
2n1 1 (n 1)k
(1
n) ln cA,0
如上,反应的半衰期的对数和初始浓度成直线关系,直线的斜率为(1-n)。只要获得
两个不同浓度下对应的半衰期的数值,就可以求得反应的级数 n(运用此关系式时,n≠1)。
【精品】空气动力学111

第一章流体介质习题:1-1.气瓶容积为315.0m ,在K 303时,瓶中氧气的压强是26/105m N ⨯,求气瓶中氧气的重量。
解:由完全气体状态方程RT p ρ=……………………①和质量体积关系Vm=ρ……………………………② 得:N KK s m s m m m N RT pVg mg G 50.84303)/(053.287/8.915.0/105222326≈⨯⋅⨯⨯⨯=== 所以气瓶中氧气的重量为N 50.84。
1-2.两平行圆盘,直径都为D ,两者相距h ,下盘固定,上盘以匀角速度ω旋转。
盘间有一种粘性系数为μ的液体。
假设与直径D 相比两盘的距离h 为小量,两盘之间液体的速度分布呈线性关系。
试推导粘性系数μ与转矩T 及角速度ω之间的关系式。
解:如右图建立平面直角坐标系xy o -,上盘的轴向速度设为:()r n r ωυ=,,因为两盘之间液体速度呈线性分布,所以两盘之间液体的周向速度为:()r hy n r ωυ=,……………………………①摩擦应力为:dyd υμτ=………………………② 取上盘dr 微段圆环为研究对象,其转矩为:r ds dT ⋅⋅=τ……………………………③∵θrdrd ds =……………………………④∴①、②、④代入③得:θμωτdrd hr dr ds dT 3=⋅⋅=两边积分得:hD drd hr T D 3242023πμωθμωπ==⎰⎰,即为粘性系数μ与转矩T 及角速度ω之间的关系。
1-3.用容积为31000m 的金属罐作水压试验。
先在容器内注满一个大气压的水,然后加压注水,使容积内压强增加到25/107m N ⨯,问需再注入多少水?解:有水的体积弹性模数公式可知水压试验后容器内的液体密度增量为:ρρE =∆,则多注入水的体积为:3293225285.0/101.21000)/101325/107(m mN m m N m N E V p V E p VmV ≈⨯⨯-⨯=⋅∆=⋅⋅∆=⋅∆=∆=∆ρρρρρ。
第十一章化学动力学基础(一)练习题及答案

第十一章化学动力学基础(一)练习题一、选择题1. 某化学反应的方程式为2A →P,则在动力学研究表明该反应为:( )(A) 二级反应(B) 基元反应(C) 双分子反应(D) 以上都无法确定2. 对下面反应来说,当用-(d[N2]/dt)表示其反应速率时,与此速率相当的表示是:( )3H2(g)+ N2(g)= 2NH3(g)(A) 2(d[NH3]/dt)(B) 1/3(d[H2]/dt(C) -1/2(d[NH3]/dt)(D) 1/2(d[NH3]/dt)3. 某化学反应为2A + B →P,实验测定其速率常数为k = 0.25 (mol • dm-3)-1• s-1, 则该反应的级数为:( )(A) 零级反应(B) 一级反应(C) 二级反应(D) 三级反应4. 某一基元反应为mA →P,动力学方程为r = k[A]m,[A]的单位是mol • dm-3,时间的单位是s,则k的单位是:( )(A) mol(1 - m)• dm3(m - 1)• s-1(B) mol- m• dm3m• s-1(C) mol(m - 1)• dm3(1 - m)• s-1(D) mol m• dm-3m• s-15. 某气相反应在400 K时的k p = 10-3 kPa-1• s-1,若用k c表示应等于:( )(A) 3326 (mol • dm-3)-1• s-1(B) 3.326 (mol • dm-3)-1• s-1(C) 3.01 × 10-4(mol • dm-3)-1• s-1(D) 3.01 × 10-7(mol • dm-3)-1• s-16. 某反应,当反应物反应掉5/9所需时间是它反应掉1/3所需时间的2倍,则该反应时:( )(A) 3/2级反应(B) 二级反应(C) 一级反应(D) 零级反应7. 有两个都是一级反应的平行反应:下列说法错误的是:( ) (A) k总= k1 +k2(B) E总= E1 +E2(C) k1/k2 = [B]/[C] (D) t1/2 = ln2/(k1 + k2)8. 某一分解反应,当反应物浓度为0.2 mol•L-1,反应速率为0.3 mol•L-1•s-1。
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
电工学简明教程第二版习题答案(第十一章)
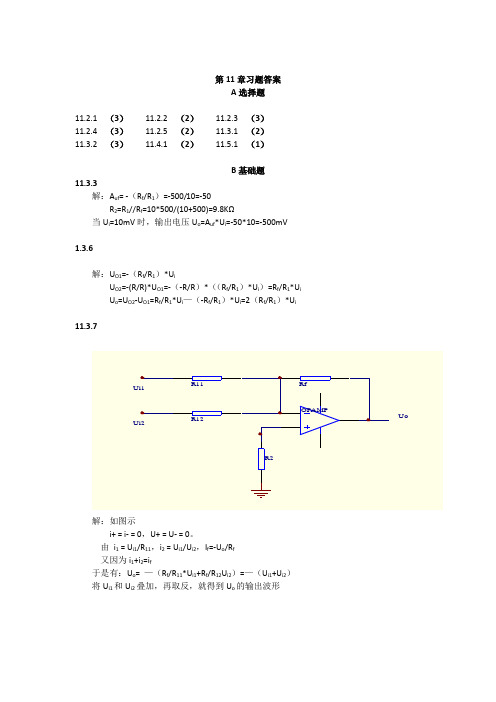
I1=5mA I2=0.5mA I3=0.1mA I4=50A I5=10A
于是Rf1=U0/-Ix
故RF1=5V/5mA=1k
RF2=5V/0.5mA-KF1=9k
RF4=5V/0.1mA-RF1-RF2=50k
RF3=5V/50*10-6mA-RF1-RF2-RF3=40k
RF5=5V/10*10-6mA-RF1-RF2-RF3-RF4=400K
Uox=-Rf/RixU; (x=1.2.3.4.5)
即:R1x=-Ui/UoxRf
每个量程上输入最大时,输出均为5V。
故R11=50/5*1M=10M
R12=10/5*1M=2M
R13=5/5*1M=1M
R14=1/5*1M=200K
R15=0.5/5*1M=100K
11.3.18
解:输出电压U=-i*RF
即有
R1=100k,Cf=1uF或者R1=10k,Cf=10uF
11.3.13
解:由“虚断”可知
U-=U+=R3/(R2+R3)Ui2
由“虚短”可知
(Ui1—U-)/R1=(U—Uo1)/Rf
所以Байду номын сангаас
Uo1=-Rf/R1*Ui1+R3/(R2+R3)*(1+Rf/R1)Ui2
=-20/10x1.1+20/(10+20)x(1+20/10)x1
R2=R1//Rf=10*500/(10+500)=9.8KΩ
当Ui=10mV时,输出电压Uo=Auf*Ui=-50*10=-500mV
1.3.6
解:UO1=-(Rf/R1)*Ui
UO2=-(R/R)*UO1=-(-R/R)*((Rf/R1)*Ui)=Rf/R1*Ui
《物理化学(第五版)》第十一章复习题答案
复习题11
对于复杂反应,如果有一步放出很多热, 大于决速步的活化能,或激发态分子发生 反应,生成处于基态的生成物,表观上活 化能是负值,所以有负温度系数效应,反 应温度升高,速率反而下降。这种反应不 多,一般与NO氧化反应有关。
复习题12
12.某温度时,有一气相一级反应 A(g)→2B(g)+C(g),在恒温、恒容条件下进 行。设反应开始时,各物质的浓度分别为 a,b,c,气体总压力为p0,经t时间及当A完全 分解时的总压力分别为pt和p∞,试推证该分 解反应的速率常数为
t3 4
a
3 4
a
1 2
a12
k 2 1
3 ka
复习题5
t1 2
a
1 2
a
13
a13
k 3 1
3 2ka 2
t3 4
a
3 4
a
13
a13
k 3 1
15 2ka 2
所以,对a=b的二级反应,t3/4 =3 t1/2。同 理,对a=b=c的三级反应t3/4 =5t1/2。
复习题6
零级反应不可能是基元反应,因为没有零分 子反应。一般是由于总反应机理中的决速步 与反应物的浓度无关,所以对反应物呈现零 级反应的特点。零级反应一般出现在表面催 化反应中,决速步是被吸附分子在表面上发 生反应,与反应物的浓度无关,反应物通常 总是过量的。
复习题2
基元反应一定具有简单反应级数,但具有 简单级数的反应不一定是基元反应,如 H复2杂(g)反+I应2(g。)=2HI(g)是二级反应,但是一个
1 2
d
P
dt
k2
A
B
2
r2
1 2
d A
第十一章 动力学(一)习题解答

第十一章 习题解答1、298K 时N 2O 5(g)分解反应其半衰期21t为5.7h ,此值与N 2O 5的起始浓度无关,试求:(1)该反应的速率常数。
(2)作用完成90%时所需时间。
解 半衰期与起始浓度无关的反应为一级反应,代入一级反应公式即可求(1)1211216.07.52ln 2ln -===h ht k (2) h hy k t 94.189.011ln 1216.0111ln 11=-=-=-例、某气相反应的速率表示式分别用浓度和压力表示时为:r c =k c [A]n 和r p =k p p A n ,试求k c 与k p 之间的关系,设气体为理想气体。
解 因设气体为理想气体。
所以 p A V=n A RT , p A =c A RT=[A]RT 设气相反应为 aA(g)→P(g) 则nA p A p p k dtdp a r =-=1 将上面结果代入n p p RT A k dtRT A d a r )]([)]([1=-=化简c n c n n p r A k A RT k dtA d a ===--][][)(}[11 k c 与k p 之间的关系为 1)(-=n pc RT k k 3、对于1/2级反应k R P −−→试证明:(1)112201[][]2R R kt -=; (2)证 (1)21][][R k dtR d r =-=,⎰⎰=-tRR kdt R R d 021][][积分kt R R =-)][]([22121, 所以 kt R R 21][][21210=- (2)当21t t =时,0][21][R R =,代入(1)式 21021021021021])[12(2])[211(2)][21(][2R R R R kt -=-=⎪⎭⎫ ⎝⎛-=所以21021])[12(2R kt -=例、某人工放射性元素放出α粒子,半衰期为15min ,试问该试样有80%分解,需时若干? 解 放射性元素分解为一级反应,121min 0462.0min 152ln 2ln -===t kmin 8.3480.011ln min 0462.0111ln 11=-=-=-y k t例、把一定量的PH 3(g)迅速引入温度为950K 的已抽空的容器中,待反应物达到该温度时开始计时(此时已有部分已知反应 4PH 3(g)−→−kP 4(g)+6H 2(g) 为一级反应,求该反应的速率常数k 值(设在t=∞时反应基本完成)。
《理论力学》第10-11章习题参考解答

1 2
(1 3
G1 g
r 2 ) 2
(G1
G2 )
r 2
求得:
3g(G1 G2 ) r(G1 3G2 )
,
vB
r
3(G1 G2 )gr (G1 3G2 )
②分析AB杆各点的加速度,由基点法得:
aB
aA
aAn
aB A
将矢量方程在铅垂方向投影得:
0
a
n A
aBA
所以:
AB
aBA L
aAn L
《理论力学》第10章习题参考解答
FD
解:已知:
T 10(s), n 2 4 (rad / s) 60
①分析OA的受力,有:
F 3.5 FD 1.5
FD
7 3
F
②取轮子为研究对象,动力学方程为:
(1 2
mr2 )
Fs r
FS
FD f
7Ff 3
求得: 14Ff 3mr
因为角加速度为常数,所以轮子作匀减速运动,则有:
G2 g
aC
FB
L 2
FAy
L 2
(1 12
G2 g
L2 ) AB
解方程得:
FB
G2 (G1 2G2 ) G1 3G2
vB
AB aC
aB
aB A
aCn aB A
C
FB
G2
vA aA aAn FAy FAx
r 2 L
3g(G1 G2 ) (G1 3G2 )L
③分析AB杆各点的加速度,由基点法得: aC aCn aA aAn aCA
将矢量方程在铅垂方向投影得:
aC
a
n A
aC A
物理化学第十一章 化学动力学基础练习题

第十一章化学动力学(1)练习题一、填空题1、某反应物得转化率分别达到50%,75%,87、5% 所需时间分别为t1/2,2t1/2,3t1/2,则反应对此物质得级数为。
2、某二级反应,反应消耗1/3需时间10min,若再消耗1/3还需时间为分钟。
3、两个活化能不相同得反应,如果E1<E2,且都在相同得升温区内升温,则(填“>”或“<”或“=”)4、只有一种反应物得二级反应得半衰期与反应得初始浓度得关系为。
5、(浙江大学考研试题)反应A→Y+Z中,反应物A得初始浓度为1mol·dm-3,初始速率为0、01 mol·dm-3·s1,假定该反应为二级反应,则其速率系数k A为,半衰期为。
6、(西北工业大学考研试题)反应2A→3B,则之间得关系就是。
7、(西北工业大学考研试题)一级反应以对时间作图为一直线,速率系数等于直线得。
8、(浙江大学考研试题)丁二烯得液相聚合反应,实验已确定对丁二烯为一级,并测得在323K时得速率系数为3、3×102min1,当丁二烯得转化率为80%时,反应时间为。
9.某反应A+B Y+Z,加催化剂后正反应速率系数与不加催化剂时正反应速率系数比值,则逆反应速率系数比值____。
10、某复杂反应得表观速率常数与各基元反应速率常数之间得关系为,则表观活化能与各基元反应活化能之间得关系为____。
二、单选题:1.反应3O22O3,其速率方程d[O2]/d t = k[O3]2[O2] 或d[O3]/d t = k'[O3]2[O2],那么k 与k'得关系就是:(A) 2k = 3k' ; (B) k = k' ;(C) 3k = 2k' ; (D) ½k= ⅓k' 。
2.有如下简单反应a A + b B dD,已知a <b < d,则速率常数k A、k B、k D得关系为:(A) ;(B) k A < k B < k D ;(C) k A > k B > k D ;(D) 。
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
第十一章化学动力学基础1练习题

第十一章化学动力学基础1练习题第十一章化学动力学基础(1)练习题一、判断题:1.在同一反应中各物质的变化速率相同。
2.若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。
3.单分子反应一定是基元反应。
4.双分子反应一定是基元反应。
5.零级反应的反应速率不随反应物浓度变化而变化。
6.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
7.一个化学反应进行完全所需的时间是半衰期的2倍。
8.一个化学反应的级数越大,其反应速率也越大。
9.若反应A + B Y + Z的速率方程为:r=kc A c B,则该反应是二级反应,且肯定不是双分子反应。
10. 下列说法是否正确:(1) H2+I2=2HI 是2 分子反应;(2) 单分子反应都是一级反应,双分子反应都是二级反应。
;(3) 反应级数是整数的为简单反应(4) 反应级数是分数的为复杂反应。
11.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
12.若反应(1)的活化能为E 1,反应(2)的活化能为E 2,且E 1 > E 2,则在同一温度下k 1一 定小于k 2。
13.若某化学反应的Δr U m < 0,则该化学反应的活化能小于零。
14.对平衡反应A Y ,在一定温度下反应达平衡时,正逆反应速率常数相等。
15.平行反应C B A 21−→−−→−kk ┤,k 1/k 2的比值不随温度的变化而变化。
16.复杂反应的速率取决于其中最慢的一步。
17.反应物分子的能量高于产物分子的能量,则此反应就不需要活化能。
18.温度升高。
正、逆反应速度都会增大,因此平衡常数也不随温度而改变。
二、单选题:1.反应3O 2 2O 3,其速率方程 -d[O 2]/d t = k [O 3]2[O 2] 或 d[O 3]/d t = k '[O 3]2[O 2],那 么k 与k '的关系是:(A) 2k = 3k ' ; (B) k = k ' ; (C) 3k = 2k ' ; (D) ½k = ⅓k ' 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十一章 习题解答1、298K 时N 2O 5(g)分解反应其半衰期21t为5.7h ,此值与N 2O 5的起始浓度无关,试求:(1)该反应的速率常数。
(2)作用完成90%时所需时间。
解 半衰期与起始浓度无关的反应为一级反应,代入一级反应公式即可求(1)1211216.07.52ln 2ln -===h ht k (2) h hy k t 94.189.011ln 1216.0111ln 11=-=-=-例、某气相反应的速率表示式分别用浓度和压力表示时为:r c =k c [A]n 和r p =k p p A n ,试求k c 与k p 之间的关系,设气体为理想气体。
解 因设气体为理想气体。
所以 p A V=n A RT , p A =c A RT=[A]RT 设气相反应为 aA(g)→P(g)则nA p A p p k dtdp a r =-=1 将上面结果代入n p p RT A k dtRT A d a r )]([)]([1=-=化简c n c n n p r A k A RT k dtA d a ===--][][)(}[11k c 与k p 之间的关系为 1)(-=n p c RT k k 3、对于1/2级反应k R P −−→试证明: (1)112201[][]2R R kt -=; (2)证 (1)21][][R k dtR d r =-=,⎰⎰=-tRR kdt R R d 0210][][积分kt R R =-)][]([22121, 所以 kt R R 21][][21210=- (2)当21t t =时,0][21][R R =,代入(1)式21021021021021])[12(2])[211(2)][21(][2R R R R kt -=-=⎪⎭⎫ ⎝⎛-=所以 21021])[12(2R kt -=例、某人工放射性元素放出α粒子,半衰期为15min ,试问该试样有80%分解,需时若干? 解 放射性元素分解为一级反应,121min 0462.0min152ln 2ln -===t kmin 8.3480.011ln min 0462.0111ln 11=-=-=-y k t例、把一定量的PH 3(g)迅速引入温度为950K 的已抽空的容器中,待反应物达到该温度时开始计时(此时已有部分分解),测的实验数据如下:已知反应 4PH 3(g)−→−kP 4(g)+6H 2(g) 为一级反应,求该反应的速率常数k 值(设在t=∞时反应基本完成)。
解 对一级反应,其积分式为kt c c AA =0,ln,下面找出总压p 与反应物浓度c A 间的关系,设c A =Mp+N ,(1)当t=0时,c A = c A,0,p=p 0,c A,0=M p 0+N (2) 当t=∞时,c A =0,p= p ∞,0= M p ∞+N (3) (2)-(3)式,得c A,0=M (p 0-p ∞) (4) (1)-(3)式,得c A =M (p -p ∞) (5)(4)、(5)式代入一级反应积分式得kt p p p p =--∞∞0ln ,所以 当t=58s 时,100222.034.3685.3600.3585.36ln 581ln 1-∞∞=--=--=s s p p p p t k 当t=108s 时,100221.068.3685.3600.3585.36ln 1081ln 1-∞∞=--=--=s s p p p p t k10222.0-=sk4、在298K 时,用旋光仪测定蔗糖在酸溶液中水解的转化速率,在不同时间所测得的旋光度(t α)如下试求该反应的速率常数k 值。
解 蔗糖在酸溶液中水解可按准一级反应处理,且蔗糖浓度与旋光度之间亦存在线性关系,即c A =Mt α+N ,与上题道理相同可得∞∞--=ααααt A A c c 00,,代入一级反应积分方程得kt t =--∞∞αααα0ln,然后以)ln(∞-ααt 对t作图,得一直线,斜率为-k ,求得13min 102.5--⨯=k 。
或将各组数据代入kt t =--∞∞αααα0ln,求出k 值,然后取平均值,结果与作图求取一致。
6、含有相同物质的量的A 、B 溶液,等体积相混合,发生反应A+B →C ,在反应经过了1小时后,发现A 已消耗了75%,当反应时间为2小时后,在下列情况下,A 还剩余多少没有反应?(1) 当该反应对A 为一级,对B 为零级; (2) 当该反应对A ,B 均为一级; (3)当该反应对A ,B 均为零级。
解 (1) 一级反应时114ln 75.011ln 1111ln 1-=-=-=h h y t k当t=2h 时yh h -=-11ln214ln 1, 1-y=6.25%(2) 二级反应时,运用a=b 的二级反应公式12375.0175.01111-=-⨯⨯=-⨯=h aa h y y ta k 当t=2h 时yy a h h a -⨯⨯=-12131, 1-y=14.3% (3)零级反应时1075.075.0111-=⨯==ah a hay t k当t=2h 时ay hah 2175.01=-, y=1.5>1,说明A 早已作用完毕。
当y=1时A 刚好作用完,所需时间为h a ahay k t 333.1175.01110=⨯⨯==-。
7、在298K 时,NaOH 与CH 3COOCH 3皂化作用的速率常数k 2与NaOH 和CH 3COOC 2H 5皂化作用的速率常数'2k 的关系为k 2=2.8'2k 。
试问在相同的实验条件下,当有90%的CH 3COOCH 3被分解时,CH 3COOC 2H 5的分解百分数为若干?(设碱与酯的浓度均相等) 解 碱与酯的皂化作用是典型的二级反应,所以yy ta k -=112,'''211y y ta k -=8.211'''22=--=y yyy k k , 解得'y =0.76或'y =76%。
9、对反应2NO(g)+2H 2(g)→N 2(g)+H 2O(l)进行了研究,起始时NO 与H 2的物质的量相等。
采用不同的起始压力相应的有不同的半衰期,实验数据为求该反应级数为若干?解 已知n 级反应半衰期的表示式为nn n Ap n k p t ---=--=101121)1(12取对数 021ln )1(ln ln p n A t -+=以21ln t ~0ln p 作图,得一直线,斜率为1-n ,求得n ≈3。
或用下述公式)/ln()/ln(10'0'2121p p t t n +=代入各组数据,求出n 值,然后取平均值得3=n 。
10、已知某反应的速率方程可表示为[][][]r k A B C αβγ=,请根据下列实验数据,分别确定该反应对各反应物的级数α、β和γ的值并计算速率系数k 。
解 根据反应的速率方程,将四组实验数据代入得55.0100.0100.0050.010k αβγ-⨯=⨯⨯⨯ (1) 55.0100.0100.0050.015k αβγ-⨯=⨯⨯⨯ (2)52.5100.0100.0100.010k αβγ-⨯=⨯⨯⨯ (3) 514.1100.0200.0050.010k αβγ-⨯=⨯⨯⨯ (4)(1)/(2)得1(0.01/0.015)γ=,解得0γ=(1)/(3)得2(0.005/0.010)(1/2)ββ==,解得1β=-(4)/(1)得14.1/5(0.020/0.010)2αα==,ln(14.1/5)ln 2 1.5α==(3)式取对数5ln(2.510)ln 1.5ln0.010ln0.010k -⨯=+-5ln ln(2.510) 1.5ln0.010ln0.0108.294k -=⨯-+=-解得k=2.5×10-4(mol·dm -3)1/2·s -112、某抗菌素在人体血液中呈现简单级数的反应,如果给病人在上午8点注射一针抗菌素,然后在不同时刻t 测定抗菌素在血液中的浓度c(以mg/100cm 3表示),得到如下数据:(1)确定反应级数;(2) 求反应的速率常数k 和半衰期21t ;(3)若抗菌素在血液中的浓度不低于0.37 mg/100cm 3才为有效,问约何时该注射第二针?解 (1) 以lnc 对t 作图,得一直线,说明该反应是一级反应。
数据见下表:h h c 409629.048.0ln 10⨯=-c 0=0.705 mg/100cm 3h hc c k t 7.637.0705.0ln 09629.01ln 110===-。
6.7hr应在6.7hr 后注射第二针。
13、在抽空的刚性容器中,引入一定量纯A 气体(压力为p 0)发生如下反应:A(g)→B(g)+2C(g),设反应能进行完全,经恒温到323K 时开始计时,测定总压随时间的变化关系如下:求该反应的级数及速率常数。
解 此题的关键是找出反应物A 的分压随时间的变化规律。
题中给出的是总压,因此要通过反应方程式找出A 的分压与总压间的定量关系。
设开始计时时A 的分压为p 0,B 的分压为p ’,计时后某时刻A 的分压为p ,A(g) → B(g) + 2C(g)t=0 p 0 p ’ 2p ’ p 总(0) t=t p (p 0 – p)+ p ’ 2(p 0 – p)+2p ’ p 总(t) t=∞ 0 p 0+p ’ 2(p 0 + p ’) p 总(∞) p 总(0)= p 0 +3p ’=53.33kPa (1) p 总(t)=3(p 0 + p ’)-2p (2) p 总(∞)= 3(p 0+ p ’)=106.66kPa (3) 由方程(1)、(3),解得p ’=8.893kPa ; p 0 =26.66kPa由方程(2), 当p 总(t)=73.33 kPa 时, p =16.67 kPa 当p 总(t)=80.00 kPa 时, p =13.33 kPa由尝试法求反应级数,将两组数据代入二级反应的速率方程t k p p p =-011min 3066.26167.161⨯=-p k kPakPa , k p =7.5×10-4(kPa)-1·min -1min 5066.26133.131⨯=-p k kPakPa , k p =7.5×10-4(kPa)-1·min -1k p 值为一常数,说明该反应为二级反应,k p 值为7.5×10-4(kPa)-1·min -1。
15、当有碘存在作为催化剂时,氯苯(C 6H 5Cl)与氯在CS 2溶液中有如下的平行反应(均为二级反应): C 6H 5Cl+Cl 2−→−1k HCl+邻-C 6H 4Cl 2 C 6H 5Cl+Cl 2−→−2k HCl+对-C 6H 4Cl 2设在温度和碘的浓度一定时,C 6H 5Cl 和Cl 2在CS 2溶液中的起始浓度均为0.5mol ·dm -3, 30min 后有15%的C 6H 5Cl 转化为邻-C 6H 4Cl 2,有25%的C 6H 5Cl 转化为对-C 6H 4Cl 2,试计算k 1和k 2。
