第六章 氧化反应 63
第六章氧化反应

第六章氧化反应从广义上来讲,凡是有机物分子中碳原子失去电子,碳原子总的氧化态增高的反应均称为氧化反应;从狭义上讲,凡使反应物分子中的氧原子数增加,氢原子数减少的反应称为氧化反应。
利用氧化反应除了可以得到各类有机化合物如醇、醛、酮、酸、酯、环氧化物和过氧化物等,还可以制备有机腈和二烯烃等。
有机物的氧化反应都是强放热反应,因此,氧化反应中及时移除反应热是一个很关键的问题。
烃类和其它有机物的氧化反应几乎都是不可逆反应,反应都能进行到底。
有机合成中氧化方法主要有三种,即催化氧化和催化脱氢、化学氧化、电解氧化。
此外,生物氧化在有机合成中的应用也日益受到人们的重视。
生物氧化是一种较缓和的氧化过程。
人类在很早以前就利用微生物进行氧化反应来进行酿酒、制醋。
生物氧化具有高度的选择性,收率高,反应条件温和,三废少等特点。
因此,生物氧化是一种很有发展前景的氧化合成方法。
第一节催化氧化和催化脱氢一、催化氧化在没有催化剂的情况下,有机物在室温下与空气接触,就能发生缓慢的氧化反应,这种现象称为自动氧化。
在实际生产中常常需要使用催化剂,以提高反应的速度和选择性。
在催化剂存在下进行的氧化反就应称为催化氧化。
催化氧化法生产能力大,对环境污染小,且作为氧化剂的空气和氧来源广泛,无腐蚀性。
因此,工业上大吨位产品多采用空气催化氧化法。
氧化反应根据反应温度和反应物聚集状态不同,又可分为液相催化氧化和气相催化氧化反应。
液相催化氧化多在100︒C左右进行反应;气相催化氧化则常在200~400︒C下进行反应。
(一)液相空气氧化液相空气氧化是液态有机物在催化剂存在下,通入空气进行的催化氧化反应。
液相空气氧化反应的实质是在气液两相间进行的,大多采用鼓泡型反应器。
1.反应历程液相空气氧化属于自由基反应历程,其反应历程包括链的引发,链的传递和链的终止三个步骤,其中决定性步骤是链的引发。
下面以烃的氧化为例:(1)链引发 烃类R-H 在光照、热及可变价金属盐或自由基引发剂的作用下发生C-H 键的均裂而生成自由基R ⋅。
第六章 氧化反应new

Chapter 6 Oxidation Reaction
概述
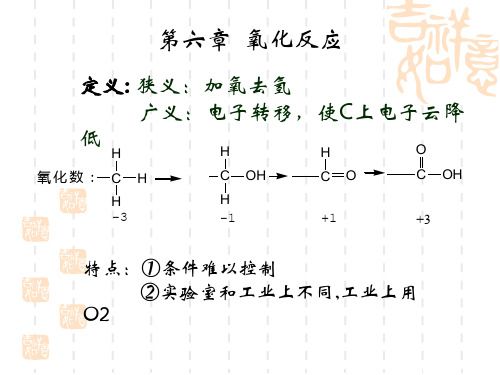
定义:狭义:加氧去氢。
在无机化学中凡是失电子或氧化数增 加的反应为氧化反应。
广义:电子转移,使C上电子云降低。
应用:将烯烃、醇、醛、酮、活性亚甲基化合物 、芳烃等氧化成相应的醇、环氧化物、醛、酮、 酸等化合物。 K2Cr2O7 , H2SO4 O2N CH3 O2N COOH oC , 30min 140
OH CH2CH3 SeO2 HOAc CH2CH3
例如:
第一节 烃类的氧化 三 烯丙位的氧化反应
2 酪酐—吡啶 (Collins试剂)
2 铬酐—吡啶(分子内盐) (Collins试剂(CrO3.2Py CH2Cl2)
CrO3 Py
CH3 CH3
O
CrO3-Py/CH2Cl2
(氧化的同时发生烯丙双键移位)
H
Pb(OAc)4 O R
Pb(OAc)3 H C C R -OAc
R
O
H R
O
H C OAc R
R
C
H2O
R
C
H C OH
R
第一节 烃类的氧化二 羰基α -位氧化
1 形成α-位羟基酮
H2C
COOEt Pb(OAc)4 COOEt
AcOHC
COOEt 水解 COOEt
HOHC
COOEt COOEt
O
The chromium(V1) oxide should be added to dry pyridine at such a rate that the temperature does not exceed 20°C and in such a way that the oxide mixes rapidly with pyridine.
第六章 氧化反应

饱和脂肪烃的氧化反应仅对那些具有叔C-H键的饱和烃才有 合成价值。铬酸或高锰酸盐常常可将叔C-H键选择性氧化成叔醇, 若为手性叔碳的C-H键,氧化时可保持构型。
n-Bu CH 3 Et
CH 3
PhCH 2NEt3MnO 4 3℃ , 数天
H
Na 2 Cr2 O 7 HClO 4 / HOAc / H 2 O
CH 3 CH 3 CH 3
n-BuONO / CH 3ONa (91%)
CH 3 NOH O
CH 2O/ HCl / HOAc (~100%)
CH 3
CH 3 O O
O
6.1.4 烯丙位烃基的氧化
烯丙位的甲基、亚甲基或次甲基在一些氧化剂作用下可被氧化成相应的醇 (酯)、醛或酮,而双键不被氧化或破坏,但可能发生双键的迁移。 铬酐-吡啶配合物和二氯甲烷组成的溶液称为Collins试剂,它和PCC[铬酐吡啶配合物的盐酸盐]在室温下可使醇迅速氧化成相应的羰基化合物,而对醇 中的双键、苄位亚甲基和硫醚不起作用。若使用过量的Collins试剂(室温) 或PCC(在二氯甲烷或苯中回流),可将烯丙位碳氢键氧化成羰基。
n-Bu CH 3 Et
CH 3 OH
(72%)
OH
桥环化合物的桥头C-H键一般为叔C-H,张力较大的桥头碳 氢键因离子和自由基均难形成,不易发生氧化反应,但一些环 系较大的桥环化合物的氧化反应也可选择性地发生在桥头碳原 子上。例如:
(40%~50% )
HO
CrO3 / Ac2O / AcOH 35 C , 1h , r.t. , 6h(71%)
OH
CrO 3 / H 2SO 4 / 丙酮 (75%)
O
Jones 氧化
OLeabharlann OHH(73%)
第六章 氧化反应

(2) 空气氧化
Br O2 / Co(OAc)2 / HBr / HAc 2h CH3 COOH Br (91%)
(3) 用硝酸铈铵作氧化剂,苄位 用硝酸铈铵作氧化剂, 亚甲基氧化成酮
ArCH2CH3 CAN / HNO3 900C, 70min O Ar C CH3 (77%)
O CAN / HNO3 300C, 90min (76%)
CH3 CH3 CH2 C CH CH3 SeO2 CH3 CH3 CH C OH CH CH3 CH2 OH CH3 CH2 C CH CH3
34
:
1
(3)当上述两规则有矛盾时, (3)当上述两规则有矛盾时,一般遵 当上述两规则有矛盾时 循(1)
CH3 H3C C CH CH2CH3 SeO2 H 3C CH2OH C CH CH2CH3
二
羰基 α 位活性烃基的氧化
1 形成 α -羟酮
O C O Pb(OAc)4 / BF3 O(C2H5)2 / C6H6 250C AcO AcO CH3 O O C CH2OAc
(86%)
加BF3有利于羰基的甲基乙酰化
RN O2 / tBuOH / tBuOK / P(OC2H5)3 H COCH3 CONH2 -200C HO COCH3 CONH2 RN
机理: 机理:
Ce4+ ArCH3 +
ArCH2 + Ce4+ + H2O
+ Ce3+ + H+ ArCH2
3+ ArCH2OH + Ce + H+
ArCH3OH + 2Ce
4+
+ 2Ce3+ + 2H+ ArCHO
第六章 氧化反应

OH
H2CrO4
O
Jones氧化法(CrO3-H2SO4-丙酮)
OH CrO3/H2SO4/CH3COCH3 O
(75%)
§2 Jones氧化法
O CrO3/H2SO4/CH3COCH3 O HO O O (73%) O
§2 PCC
Cl N H
/ CrO 3
= PCC
§2 PDC
2
N H
2
Cr2O7
PhCOOOH O + (94:6) O
§4 .1.5 有机过氧酸为环氧化剂
OH PhCOOOH O OH
§4 .1.5 有机过氧酸为环氧化剂
OOCCH 3 PhCOOOH
OOCCH 3 O
§4. 2 .1 顺式羟基化
• 常用试剂是高锰酸钾 • 四氧化锇 • 碘-湿乙酸银。
§4. 2.1 顺式羟基化
TPAP(Pr4NRuO4)
• 直接将RuCl4· nH2O加到过量的溴酸钠(NaBrO3)的l mol/L 浓度的碳酸钠水溶液中,氧化成[RuO4]-,接 着加入(Pr4N)OH,即产生深绿色的TPAP晶体, 过滤后干燥备用。TPAP用量(摩尔分数)为5%(相 对于被氧化的醇),常用的共氧化剂为双氧水和N甲基吗啉氧化物(NMO),由于TPAP是在非水介质 中氧化醇,故共氧化剂用后者。常用的溶剂是 CH2Cl2 或CH3CN,在用CH2Cl2 作溶剂时加10% 的CH3CN ,可提高催化剂的利用率。
= PDC
§2 醇氧化成酮
PhCH(OH)Ph
PCC
PhCOPh
(100%)
§2 醇氧化成醛
HO DMAP/HCl/CrO3 HO HO CHO
§2 醇氧化成酮:用锰化合物氧化
第六章 氧化反应

O2N
HO H N H O
O2N Al[OCH(CH3)2]3, HOCH(CH3)2
HO H N H O
O p-Nitro- -acetamido--hydroxyphenylpropanone
H OH (± )-thero-1-p-nitrophenyl-2acetamidopropane-1,3-diol
加氧或脱氢 的反应 称为氧化
Oxidation State(氧化态)
氧化与药物代谢
药物生物合成
第一节 烃类的氧化反应
一、 烷烃的氧化
Oxidation of alkanes and alkyl groups
Barton reaction
二、 苄位烃基的氧化
1. 氧化生成醇、酮、羧酸
2)Jones reagent (选择性氧化方法): —— CrO3-diluted H2SO4-acetone
Jones reagent HO O
—— Unsaturated secondary alcohols can be oxidized to ketones while carbon-carbon double bonds remain unchanged.
O CCH3 RC O3H
methyl
O COCH3 ? + O OCCH3
√
?
三、 –羟酮的氧化反应
第四节 含烯键化合物的氧化
一. 烯键环氧化
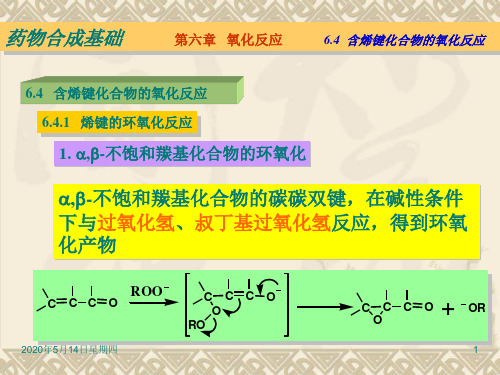
1. ,–不饱和羰基化合物的环氧化
,–不饱和羰基化合物中,碳碳双键与羰基共轭,一 般在碱性条件下用过氧化氢或叔丁基过氧化氢使 之环氧化.
机理
O2N
Br2, C6H5Cl O
第六章氧化反应

× R
R'
C
酮
O
[O]
O [O]
O
R CH
R COH
38
1、用铬化合物氧化
铬化合物
CH OH
CO
39
R
O
O
快
CH OH +
Cr
R'
HO
OH
R
O
CH O Cr O
R'
HO
O
R
慢
C O Cr O
R'
H
OH
H2O
O
O
RC R'
O + H3O+ +
Cr OH
O
HO
Cr OH
40
甾体环上位阻大的OH反而易被氧化, 因为脱氢是控制反应速率的步骤:
O R C CH2 CH2R
R OH C
CH RH2C
O
Se RO
O
C
CH RH2C
OH Se
O
[2,3-δ迁移]
RO
C
OH
CH
Se
RHC
O
H
RO
C
+ SeO + H2O
CH
RHC
14
2. 亲核反应 (1)亲核消除 二甲基亚砜氧化醇生成醛或酮的反应属亲核消除反应机理。
NC N
H H3C S CH3
(二)三氧化铬-吡啶配合物(科林斯试剂)
将三氧化铬加到过量的吡啶(质量比为三氧化铬 :吡啶=1:10) 中即生成三氧化铬-吡啶配合物吡啶溶液,它可以氧化伯、仲醇为 醛、酮,效果很好,对酸敏感的官能团不受影响。
也可将三氧化铬吡啶配合物从吡啶中分离出来,干燥后再溶于二 氯甲烷中使用,这样组成的溶液称为科林斯试剂。它是使伯、仲醇 氧化成醛、酮最普通的方法。
第六章 氧化反应

• 环氧化反应中取代基较多的双键比取代基少 的更易反应。富电子的双键比缺电子的双键 易反应。
O t-BuOOH, PhH Mo(CO)6, reflux
CHO
t-BuOOH Ti(Ⅳ), SiO2 O
CHO
• 对于含烯丙醇结构的烯烃,在金属催化剂 存在下,叔丁基过氧化氢可区域选择性或 立体选择性的环氧化反应。
• α,β-不饱和腈在过氧化氢碱性介质中,首先在氰 基上加成,随之在双键上的环氧化反应得到环氧 酰胺,叔丁基过氧化氢碱性条件环氧化α,β-不饱 和腈可以得到环氧腈
NH C N H2O2, NaOH OOH O O NH2
Ph C N Ph t-BuOOH NaOH Ph Ph O C N
• 过氧羧酸是最常用的环氧化试剂。是用相应 的羧酸与过氧化氢反应制取。过氧羧酸大多 不稳定,现用现配。 • 过氧羧酸与烯烃反应是合成环氧化物最简便 的方法。尤其对孤立双键、单独用过氧化氢 或过氧醇(不存在金属催化剂)不易被环氧 化,而用过氧羧酸很容易反应,其环氧化烯 烃的反应机理是过氧羧酸对碳-碳双键的氢 电性进攻
• 6-3-4 高碘酸 • 高碘酸或高碘酸盐水溶液是1,2-二醇氧化裂解 试剂。溶剂为甲醇、乙醇、乙酸、二氧六环等。 能定量的反应,根据高碘酸的消耗,推知多元 醇中相邻羟基的数目,根据产物推知原化合物 的结构。
H H R C C CH2CH2 COOH OHOH KIO4/H2SO4 EtOH/H2O RCHO + CHO-CH2CH2COOH
O
Ph (1) O3 (2) Zn, AcOH
O
Ph CHO
O
(1) O3, Et2O, 0 de AcO H (2) LiAlH4, 0 de OAc
颜范勇-第六章氧化反应

HC CH CH2 R O
HC CH CH R OH
HC CH C O
R
43
1、用二氧化硒氧化
• SeO2是常用的烯丙基氧化剂,可将烯丙位 的烃基氧化成相应的醇,最初的氧化产物 易被SeO2进一步氧化成羰基化合物,通常 氧化产物是醛或酮。如要得到醇,氧化反 应可在乙酸中进行,生成乙酸酯,抑制进 一步氧化,再水解成所需要的醇。
第六章 氧化反应
Chapter 6 Oxidation Reaction
1
概述
概述
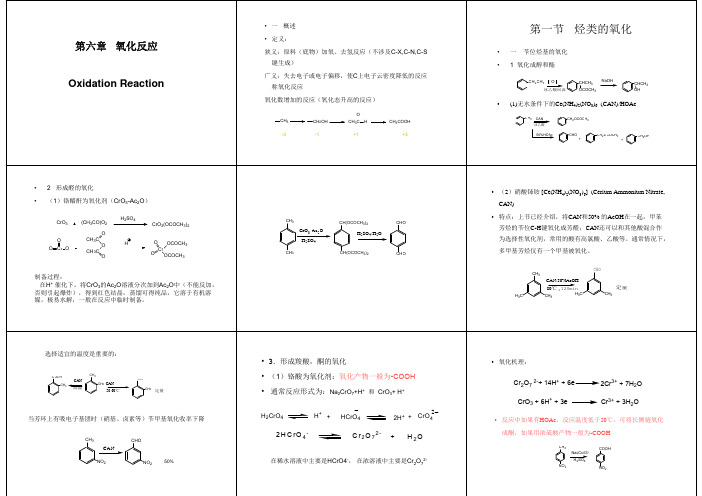
• 定义: • a)广义:失去电子或电子偏移,使C上电子 云密度降低的反应称氧化反应 • b)狭义:原料(底物)加氧、去氢反应(不 涉及C-X,C-N,C-S键生成)
• c)氧化数增加的反应(氧化态升高的反应)
2
• 氧化反应特点: • a)反应较为激烈,伴有大量副反应发生 • b)同一结构可用多种氧化剂,同一氧化 剂可氧化多种底物 • c)一般有机物分子中,电荷密度大的部 位易氧化
O
O
30%H2O2/10%NaOH 热EtOH中,3min
CH3
(67%)
H3C
(1)
OH
12
• 2. 苄位氧化成醛 • (1) 铬酐-醋酐(CrO3-Ac2O)氧化苄位甲基形成醛 基 • 铬醋酐制备:
O
O O Cr O+ CH3 C CH3 C
O
O
OCCH3 Cr OCCH3 O
O O
O
• 过程:将CrO3的AcOH溶液分次加到Ac2O中,得 到红色结晶,蒸馏可得纯品,它溶于有机溶剂, 13 极易水解,一般在反应中临时制备。
第六氧化反应
Jones试剂
CH3
H3C
CC
CH3
O O(不氧化苄甲基)
3.铬酐—吡啶络合物
适合于所有对酸敏感的官能团的醇类氧化,烯丙位、 苄位-OH(不改变双键位置)
O
O Cr O +HCl
O
O Cr OH
N
Cl
O O Cr OH
N
Cl
C H
C CH2OH H
CrO3/Py
C C CHO HH
HO
CH2OH
HO
CH3 CH3
O C
O C
O
O
O
OCCH3
Cr
O
OCCH3
O
CH3
O
O
OCCH3
+
Cr
O
OCCH3
O
H2O
CHO
OCOCH3
CH
+
OCOCH3
O OH
Gr OH
O
② 二氯铬酰(Etard埃塔试剂)
制备:HCl、H2SO4滴加到CrO3中,蒸馏除水
CrO3+HCl
H2SO4 <10℃
O
Cl
O Gr Cl
CHO
CrO3/Py
4.锰化合物的氧化
①KMnO4
H+ × 强
OH中
√
MnO4-+2H2O+3e
MnO2+4OH
H
C
N
OH
α-位无H
R
H2 OHH2 CCC
R' OH
H
α-位有H
C
N
O
R
C
OHH2 CC
R'
第六章 氧化反应
RCHO + Ag2O
RCOOH + Ag
2Ag + CuO
Ag2O + Cu2O
Cu2O + O2
CuO
机理:
RCO R1
R2COOOH
OH
a
R1COOR
R C R1
a
b
O OCOR2
b RCOOR1
基团迁移顺序: 叔烷基,环己基,仲烷基,苄基,苯基,伯烷基,甲基
H3CO
COCH3 CH3COOOH
机理:
RNCN
R N C HN R
R + H+ RN
R N C HN R C HN R
O H3C S CH3
O
S H3C
CH3
H+ R N C HN R
O
OH-
+
H
(RNH)2C
R2 CH O H
R1
O+
O
H3C
S
CH3
+C H3C
CH3
O
S H3C
C R1 R2
CH3
常用的酸有: H3PO4, CF3CO2H, HOAc
O O
OH OH
DMSO/Ac2O
O
R.T
H N C Ar
O
OH
O
O
O N C Ar
(59%)
CH3
OH CH3 OH
DMSO/Ac2O R.T
CH3
CH3 O
O (47%)
• 机理:
R1 CH OH + Al(O-i-Pr)3 R2
H3C C O H3C
i-OPr + Al I-OPr
第6章 氧化反应

常用的氧化剂是过氧酸(如过氧苯甲酸及其氯代物)或叔丁基过氧化氢 (需金属催化剂)。产物仍保持烯烃的立体化学结构:
其反应机理为:
6.4烯烃的氧化
过氧酸的氧化能力与对应酸的强度成正比,其氧化能力顺序为:
烯烃的环氧化常受空间阻碍的影响,在阻碍较小的一侧形成环氧化合物; 若有羟基的存在,由于其感应作用,则形成与羟基在同侧的环氧化物。
6.4.3烯烃类化合物的氧化切断
烯烃类化合物的氧化切断:进行此种类反应常用高锰酸钾-高碘酸钠的混 合氧化剂,或使用臭氧。 1)使用KMnO4-NaIO4混合氧化剂 利用KMnO4将烯烃类转变成二醇类,再用NaIO4将醇类氧化切断,并进一步氧 化成为羧酸。由于KMnO4作用后产生的MnO2可以被NaIO4氧化回到KMnO4, 故只需使用催化剂量的KMnO4 :
6.4.2烯烃的二羟基化反应
1)以高锰酸钾为氧化剂时,条件控制十分重要,否则形成的二醇类会进一
步氧化裂解:
CH2=CHCH(OCH3)2+KMnO4
H2O,5℃ 67%
CH2CHCH(OCH3)2
OH OH
若有机化合物不溶于水时,常加入相转移催化剂,如季铵盐等,使反应 在有机溶剂中进行,但反应的酸碱度也会影响产物。
OsO4,t-BuOH-THF-H2O,25℃,4h
反应都是遵循空间效应,从阻碍小的一侧作用。又因为OsO4是亲电子性, 所以反应不在氢较少的富电子双键发生。
6.4.2烯烃的二羟基化反应
3)以碘及湿的醋酸银为氧化剂,用这种方法可以获得空间位阻较大一侧的 顺式-邻二醇:
邻二醇化合物以高碘酸HIO4处理,得到两个羰基化合物:
O RCH2CH2CR
O
O
第六章 氧化反应 6.3
O
H2O2/NaOH pH 8.5-9.0
O COOC2H5
82%
COOC2H5
3
2019年1月18日星期五
O R1 R2
2
LiOH/手性季铵盐(5mol%) 30%H2O2/(3eq.)n-Bu2O R1
O R2
Br
HO N I
R Ph Ph 3-MePh
1
R 4-MePh Ph Ph
产率(%) 95 97 100
OH
RuO4/NaIO4
COOH
RuO4/NaIO4
COOH
RuO4/NaIO4
COOH
HOOC
COOH
O
O
RuO4/NaIO4
HO 2019 年1月18日星期五
HOOC HOOC
18
稠芳环的臭氧化开环是合成芳香醛衍生物的有效方法
CHO HCOOH or NaOH COOH CHO Me2S or Ph3P CHO
ROOH/V(cat.)
Collins 试剂
O
MnO2 KMnO4
SeO2
CAN
K2CrO4
2019年1月18日星期五
其它见书p322
8
③腈存在下的双键环氧化
机理见p323
O O O
O
H2O2/C6H5CN KHCO3/MeOH
O
CH3COOOH
注意羰基的插入反应和烯键环氧化的反应条件
CHO COOH
19
3) NaOH/EtOH, reflux 15 min
6.5.2 芳烃氧化成醌
1. 铬酸为氧化剂
苯或烃基苯很难氧化成醌,萘与蒽、菲则易于氧化
CrO3/HOAc/H2O
第6章_氧化反应

5-甲基吡嗪-2-羧酸
格列吡嗪等的中间体
5-甲基-2-羟甲基吡嗪与水成悬液, 20℃滴 加5%的高锰酸钾溶液(1:1.2), 反应2h. 滴加饱和亚硫酸氢钠至高锰酸钾颜色消失. 抽滤, 滤液用盐酸调pH为2, 过滤得固体.
38
第二节 醇类的氧化
三. 二元醇的氧化
1. 1,2-二醇的氧化 四乙酸铅氧化
CH3 (NH4)2Ce(NO3)6 / 100%AcOH Reflux CH3 CH3 CH3 CH3
7
CHO
CH3
80℃, 120min CH3 CH3
CH2OCOCH3
第一节 烃类的氧化
一. 苄位烃基的氧化
2. 氧化生成醛 在温和的条件下, 氧化剂 (硝酸铈铵、三氧化 铬-乙酐等) 可以将苄位烃基氧化成醛. 反应条件提高, 可以将苄位烃基氧化成酸.
C6H5CH3 (NH4)2Ce(NO3)6 / 100%AcOH Reflux C6H5CH2OCOCH3 90%
H2O, NaOH
C6H5CH2OH
C6H5CH3
(NH4)2Ce(NO3)6 / 50%AcOH 100℃
C6H5CHO + C6H5CH2OH + C6H5CH2OCOCH3 36% 7% 7%
一. 伯、仲醇氧化成醛、酮
2. 用锰的化合物氧化 活性二氧化锰可以由硫酸锰和高锰酸钾反应 得到, 具有大的表面积和低的含水量, 可以选择 性氧化α,β不饱和醇得到醛或酮.
OH HO MnO2 / CH2Cl2 r.t. HO O HO OH
35
第二节 醇类的氧化
二. (伯)醇被氧化成羧酸
铬酸、高锰酸钾、硝酸、氧气(过渡金属 氧化物作催化剂)等可以氧化伯醇为羧酸.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
2018年10月12日星期五
1
/2 O2
PdCl2/CuCl2
O
15
其它例子见Page 330
6.5 芳烃的氧化反应
6.5.1 芳烃的氧化开环
当芳环上有给电子基时,如氨基、羟基等,芳环易开环, 但产物复杂,合成意义不大
OH
2018年10月12日星期五
8
(2) 有机过氧酸作氧化剂
与碱性的过氧化氢不同,有机过氧酸氧化烯键有高度的 立体选择性,原烯烃的构型不变(即顺式加成),烯烃的 Z、E型被有机过氧酸氧化后分别得到不同的产物
有机过氧酸常有酸酐与过氧化氢制备:如
(CF3CO)2O
H3C(H2C)7 H
+ H2O2
(CH2)7COOH H
R1 H R2 H
OsO4 Py
R1 R2 H H O O Py Os Py O O
H2O
R1 H
R2 H
HO OH
+
HO Os O
OH O
(3). 碘-湿醋酸银为氧化剂
Pré vost 试剂
O O I Me
Woodward法
O Me O I
+ AgI
HO O OH O
I
I
Ag
O O O
Me CH3 OH
OH
RuO4/NaIO4
COOH
RuO4/NaIO4
COOH
RuO4/NaIO4
COOH
HOOC
COOH
O
O
RuO4/NaIO4
HO 2018 年10月12日星期五
HOOC HOOC
17
稠芳环的臭氧化开环是合成芳香醛衍生物的有效方法
CHO HCOOH or NaOH COOH CHO Me2S or Ph3P CHO
手性季铵盐
N N
Fe
N
H N
Mn
H N O Cl
O H2O2 H N
Mn
H N O Cl
N
O
O
P450活性中心
(R,R)-salen-Mn(III)配合物
氧合-salen配合物
Ph
COOEt
Ph
COOEt O
(R,R)-salen-Mn(III)配合物
2018年10月12日星期五
(56%) 95-97%ee
O
H2O2/NaOH/MeOH
O O
O
Z和E型得到的E构型的产物
O
O
O
H2O2/NaOH -15 -0
2018年10月12日星期五
o
o
92%
1
H2O2/NaOH/MeCOMe
O OH O O
O
pH 10.5 t-BuOOH/NaOH/MeCOMe
COOC2H5 COOC2H5
O
H2O2/NaOH pH 8.5-9.0
O Cl Cl Cl Cl O CN CN
氯醌
DDQ
25
OH
DDQ/C6H6
O
OH
6h
O
3. 有机硒为脱氢剂
O
1. LDA/THF/-78 o 2.C6H5SeBr
O
O
1. LDA/THF/-78 2.C6H5SeCl 3. H 2O2
o
O
2018年10月12日星期五
其它例子见书p33826
6.6.2 脱氢芳构化
O COOC2H5
82%
COOC2H5
2
2018年10月12日星期五
O R1 R2
2
LiOH/手性季铵盐(5mol%) 30%H2O2/(3eq.)n-Bu2O R1
O R2
Br
HO N I
R Ph Ph 3-MePh
1
R 4-MePh Ph Ph
产率(%) 95 97 100
仿生催化剂
%ee 89 84 92
13
6.4.3 烯键的断裂氧化
1. 用高锰酸钾氧化
烯键断裂成碳基化合物或酸
KMnO 4/冠醚/Ph-H 25o
CH 2
COOH
97%
O
KMnO 4/NaIO 4/Me 2CO/H2O 5-25
o
100%
其它例子见书p329 2. 臭氧分解 烯键断裂成碳基化合物或酸
o
O3/MeCOOH/四氰乙烯 -70
KMnO 4 HO
HO
COOH COOH
N N COOH COOH
若为稠环化合物,苯环常开环
NO2
KMnO4
NO2 COOH COOH
N N
KMnO4/H2O
NO2 HO Cl Cl
KMnO4
Cl
COOH COOH
16
2018年10月12日星期五
用催化量的四氧化钌和过碘酸钠混合试剂可激烈进 攻苯环,而不影响侧链烷基
2018年10月12日星期五 4
①烯烃的环氧化
最有效的催化剂是Mo(CO)6, 常用过氧化氢烷(ROOH)作氧化剂
过氧化氢烷的结构影响反应速度,烷基上存在吸电子基可增 大反应速度:
Me O O H C Me Me
>
O O H C Me Me
O
>
+
O
O O H Me C Me Me
O
t-BuOOH/Mo(CO)6
COOH H2O2/HCOOH or H2O2/NaOH
2) KI/NaI/AcOH, r.t 0.5~1 h CHO CHO 1) O3/MeOH, -30o
73-88%
O3/MeOH
H
OH O O
53-68%
-50o
H
OMe
86-88%
COOH
2) HCl, r.t. 1 h
2018年10月12日星期五
2 RC CH
2018年10月12日星期五
+
1
/2 O2
RC C
C CR
其它例子见p340
28
6.7 胺的氧化反应 6.7.1 伯胺的氧化
NH2 NHOH N O NO2
N OH
N O NH 2
MeCOOOH 过量 冷 MeCOOOH
N O N
2018年10月12日星期五
29
NH 2
NO 2
MeCOOOH MeCOOH
OH
RHC N-R O
例子见p342-343
2018年10月12日星期五
31
6.7.3 叔胺的氧化
氧化剂不同,叔胺的产物不同,活性二氧化锰 有三种常见氧化方式:
1). 2). 3).
10
H OH OH (CH2)7COOH H3C(H2C)7 H OH
pH = 9 2018 年10月12 日星期五 KMnO 4/H 2O/H2SO4
?
H OH O
KMnO4/t-BuOH/H2O/NaOH 0 KMnO4/H2O KMnO4/H
R1 H R2 H
o
OH OH CHO CHO
R1 R2 H H HO O Mn O O OH R2 H OH
21
2018年10月12日星期五
6.5.3 芳环的酚羟基化
Elbs氧化法引入酚羟基:即过二硫酸钾在冷碱溶液中将
酚羟基氧化,在原有酚羟基的邻对位引入酚羟基
OH
K2S2O8/NaOH
OH
OH
H3O
OSO 3K OH
其它例子见书P335
2018年10月12日星期五 22
6.5.4 稠芳环与氧Diels-Alder反应
O
O
SeO2/H2O
O
O
O
2018年10月12日星期五
24
RH 2C R'
H OH
+
RHC R'
SeO2
RH 2C R'
H O O Se OH
H RHC R'
O Se O OH
+
O
H2O
+
SeO
2. 醌类为脱氢剂
常用的四氯苯醌、2,3-二氯-5,6-二氰苯醌
O Cl Cl O
2018年10月12日星期五
OH OH
2018年10月12日星期五
Ag 2O
O O
20
OH
O
Ag 2O
OH
O
3. Fré my盐为氧化剂
OH
+
SO3K O N SO3K
O
+
O O
亚硝基二磺酸钾盐
SO3K HO N SO3K
Fremy
O KO3S N H KO3S
+
O KO3S N O KO3S H H
+
SO3K O N SO3K
OCH3 OCH3
ArNH 2 RCH 2NH2
MnO 2 过量 MnO 2
ArN
NAr
RCHO
N C
30
NH2 CH2
2018年10月12日星期五
Ag2O/H2O 25~70oC
6.7.2 仲胺的氧化
氧化剂常为过氧化氢、过氧酸等,产物为烃基羟胺,硝酮
NH NOH N O
RCH 2NHR
RCH 2NR
Ag H2O
O Me O
12
HO
OH
H2O
O
2018年10月12日星期五
2. 反式羟基化
(1). 有机过氧酸为氧化剂
R1 R R2 R3
