高分子化学 第二章
高分子化学-第二章 缩聚和逐步聚合
N0
N0
反应程度与转化率的区别
转化率:参加反应的单体量占起始单体量的分数,是指已 经参加反应的单体的数目
反应程度:则是指已经反应的官能团的数目
例如: 一种缩聚反应,单体间双双反应很快全部变成二聚体,就 单体转化率而言,转化率达100%;而官能团的反应程度 仅50%
反应程度与平均聚合度的关系
聚合度是指高分子中含有的结构单元的数目
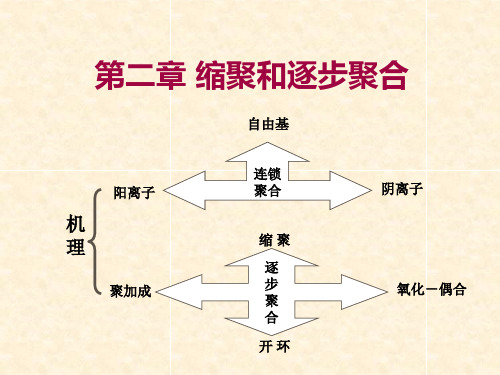
聚加成:形式上是加成反应,但反应机理是逐步反应。 如聚氨酯的合成(p17)。
开环反应:部分开环反应为逐步反应,如水、酸引发的己内 酰胺的开环反应。
氧化-偶合:单体与氧气的缩合反应, 如 2,6-二甲基苯酚和氧 气形成聚苯撑氧,也称聚苯醚。
2 逐步聚合反应的特点
官能团间的反应,无特定的活性中心;无所谓的引发、 增长、终止等基元反应;反应逐步进行,每一步的反 应速率和活化能大致相同;
[ H + ][ A- ] KHA =
[ HA ]
[ HA ] [ H + ] [ A- ] = KHA
代入式
-d [ COOH ] = k1k3[ COOH ][OH ][ H+]
dt
k 2KHA
催化用酸HA:可以是二元酸本身,但反应较慢,也可以是 外加酸,如H2SO4,大大加速
自催化缩聚反应
无外加酸,二元酸单体催化剂,[HA] = [COOH]
Flory对此进行了解释:
官能团等活性理论是近似的,不是绝对的,这一理论大大简化了研 究处理,可用同一平衡常数表示,整个缩聚过程可以用两种官 能团之间的反应来表征
COOH + HO
k1
OCO
k1
2. 线型缩聚动力学
不可逆条件下的缩聚动力学
高分子化学第二章-缩聚及逐步聚合

l 按反应热力学的特征分类 平衡缩聚反应 指平衡常数小于 103 的缩聚反应 不平衡缩聚反应 平衡常数大于 103
l按生成聚合物的结构分类 线型缩聚 体型缩聚
2.2.3 特点
缩聚反应是缩合聚合反应的简称,是缩合反应多 次重复结果形成缩聚物的过程。 1、典型缩合反应——形成低分子化合物
3 、反应程度与数均聚合度的关系
数均聚合度是指高分子中含有的结构单元的数目。
Xn
起始单体数目
=
达到平衡时同系物数目(大分子数)
N0 N
代入反应程度关系式
P = N0-N = 1- N
N0
N0
P = 1- 1 Xn
1 Xn = 1-P
一般 Xn 100~200 P提高到
0.99~0.995
300 250 200
a. 密闭体系中,nw=P
Xn
1 P
K=
1 nw
K
当M n 104 , P 1, X n
K nw
平衡缩聚中数均聚合度与平衡常数
及小分子副产物浓度三者关系
Xn只与温度有关,与其他无关。(因为nw平衡时为定值)
b. 敞开体系,水排出,则 nw为体系中剩余的。
说明:X
的影响因素
n
密闭体系,只与T有关 敞开体系,与排出的水有关
3、缩聚中的副反应 副反应
消去反应 化学降解 链交换反应
消去反应
HOOC(CH2)nCOOH
HOOC(CH2)nH + CO2
二元酸脱羧温度(℃)
己二酸 300~320 庚二酸 290~310 辛二酸 340~360 壬二酸 320~340 癸二酸 350~370
高分子化学第二章逐步聚合反应

2.1 缩合反应与缩聚反应
O
酯 化
CH3C_ OH + H_OCH2CH3
反
O
应
CH3C_OCH2CH3 + H2O
酰 胺 化
O CH3C_OH + H_NHCH2CH3
反
O
应
CH3C_NHCH2CH3 + H2O
双官能团单体的多步缩合反应:
H O O C(CH 2)4CO_O H+H _N H (CH 2)6N H 2
3、单体通式 a–R–c
H2N(CH2) 5OH 仅参加前面二类型的均缩聚或混缩聚反应而不能单独进行 聚合,这叫共缩聚反应,产物叫做共缩聚物。
合成一种线型缩聚物一般可有多种聚合反应路线和相应的 单体,但是按照这些单体的合成难易、聚合反应的难易以 及聚合物相对分子质量的高低,通常只有一两种单体是最 符合条件的。
2 与官能团所处的空间环境有关 对苯二胺 + 对Biblioteka 二甲酰氯 反应活性较低H2N_
_NH 2+CO l C _ _COl C 全芳聚酰胺
间苯二胺 + 间苯二甲酰氯 反应活性较高
H2N_ _NH 2+CO l C _ _COl C 全 芳 聚 酰 胺
3 环化反应倾向大小 羟基酸的聚合-环化反应倾向与碳原子数
由带两个或两个以上官能团的单体之间连续、重复进行的缩 合反应称为缩合聚合反应,简称缩聚反应。
2.2 逐步聚合反应单体
2.2.1 线型缩聚反应单体的类型
1、单体通式 a–R–b
HO(CH2)5COOH
H2N(CH2) 5COOH
属于均缩聚反应,得到均缩聚物。
第二章 高分子化学2

4.影响阴离子型聚合反应的因素
1.溶剂:对链增长活性中心离子对解离 状态有影响。 2.温度:机理比较复杂,影响比较大, 一般来说,升高温度聚合速率下降。
逐步反应
它反映大分子形成过程中的逐步性。反应初期 单体很快消失,形成二聚体、三聚体、四聚体 等低聚物,然后这些低聚物之间进行反应,分 子量随反应时间逐步增加。绝大多数缩聚反应 属于逐步反应。
第一节 聚合反应
一、自由基聚合反应
本反应突出特点是反应开始时必须首先 产生自由基活性中心。
(一)自由基的产生与活性
聚合反应:由低分子单体合成高分子化合物的化 学反应。 加聚反应:聚乙烯、聚氯乙烯 聚合反应: 缩聚反应:酚醛树脂
第二章 高分子化学
链锁聚合 聚合反应: 逐步聚合 (聚合机理的不同)
链锁聚合
链锁聚合:由链引发,链增长,链终止等反应组 成,其特征是瞬间形成高分子聚合物,分子量随 反应时间的变化不大,反应需要活性中心。 链锁聚合根据反应中心的不同分为:自由基聚合, 阳离子聚合和阴离子聚合,它们的反应活性中心 分别为自由基、阳离子和阴离子。一些烯类单体 的加聚反应大多数属于链锁聚合反应。
(1)链引发反应
A、碱金属引发反应: 金属钠引发苯乙烯。
+ + +
2Na +2CH2=CH 2NaCH CH2 NaCHCH2 CH2CHNa C6H5 C6H5 C6H5 C6H5 B、金属烷基化合物引发反应:丁基锂引发苯乙烯。 H C4H9Li + CH2=CH C4H9CH2 C Li C6H5 C6H5
高分子化学02自由基聚合

自由基聚合是最重要的高分子合成反应之一
4
2.2 连锁聚合的单体
连锁聚合的单体包括单烯类、共轭二烯类、炔类、羰基 和环状化合物。 不同单体对聚合机理的选择性受共价键断裂后的电子结 构控制。 醛、酮中羰基双键上C和O的电负性差别较大,断裂后具 有离子的特性,因此只能由阴离子或阳离子引发聚合,不能 进行自由基聚合。环状单体一般也按阴离子或阳离子机理进 行聚合。
21
(2)以头—尾方式结合时,空间位阻要比头—头方式结合 时的小,故有利于头尾结合。 虽然电子效应和空间位阻效应都有利于生成头尾结构聚 合物,但还不能做到序列结构上的绝对规整。从立体结构来 看,自由基聚合物分子链上取代基在空间的排布是无规的, 因此聚合物往往是无定型的。
22
3)链终止反应 链自由基失去活性形成稳定聚合物的反应。可以 分为偶合终止和歧化终止。 偶合终止:两个链自由基头部的独电子相互结合 成共价键,生成饱和高分子的反应。生成的高分 子两端都有引发剂碎片,聚合度为链自由基重复 单元数的两倍。
δ
CH2
CH
Y
例如丙烯腈中的腈基能使负电荷在碳—氮两个原 子上离域共振而稳定。
H CH2 C C N CH2 H C C N
9
卤素原子既有诱导效应(吸电子),又有共轭效应(推 电子),但两者均较弱,因此既不能进行阴离子聚合,也不 能进行阳离子聚合,只能进行自由基聚合。如氯乙烯、氟乙 烯、四氟乙烯均只能按自由基聚合机理进行。 除了少数含有很强吸电子基团的单体(如偏二腈乙烯、 硝基乙烯)只能进行阴离子聚合外,大部分含吸电子基团的 单体均可进行自由基聚合。 含有共轭双键的烯类单体,如苯乙烯、α-苯乙烯、丁二 烯、异戊二烯等,因电子云流动性大,容易诱导极化,因此 既可进行自由基聚合,也可进行阴、阳离子聚合。
高分子化学第二章 缩聚和逐步聚合

O=
C
H2C─C O H2C─CH2
H2C O
H2C CH2 CH2
20
• HO–(CH2)n–COOH缩聚
n=1,2HOCH2COOH HOCH2COOCH2COOH O=C-CH2O-C=O + H2O OCH2
21
• n=2
HO(CH2)2COOH
CH2=CH-COOH+H2O
• n=3 HO(CH2)3COOH
CH2-C=O CH2-CH2-O + H2O
22
• n=4 HO(CH2)4COOH
CH2-CH2-C=O CH2-CH2-O + H2O
• n>=5,成链,形成线形聚合物。
23
• 成环倾向大小,主要取决于单体的结构, 受反应条件的影响较小。
• 环上取代基或环上元素改变时,环的稳定 性也相应变化。
• 在工业上:锦纶大量用来制造轮胎帘子 布、工业用布、缆绳、传送带、帐篷、 鱼网等,还可用作降落伞。
64
• 还可用于制造轴承、齿轮、滚子、 滑轮、辊轴、风扇叶片、涡轮、垫 片等。
65
全芳聚酰胺
• 是20世纪60年代由美国的杜邦公司首先开 发成功的。
13
自由基聚合
线型缩聚
③只有链增长才使聚 ③任何物种间都能反应, 合度增加,从一聚体 使分子量逐步增加。反应 增长到高聚物,时间 可以停留在中等聚合度阶 极短,中途不能暂停。段,只在聚合后期,才能 聚合一开始,就有高 获得高分子量产物。 聚物存在。
④在聚合过程中,单 ④聚合初期,单体几乎全
体逐渐减少,转化率 部缩聚成低聚物,以后再
(2—23式)
• 水部分排出时:
-dC/d t =k1 [ (1-P)2-P•nW/ K]
高分子化学第二章

3.3
聚合度与平衡常数的关系
O
COOH
+
HO
C
O
+ H2O
设t=0时 平衡时
N。 N
N。 N
0 (N。—N)
0 Nw
N —— 平衡时未反应的羧基或羟基数 N0–N —— 也是已反应的羟基或羧基的mol数即是平 衡时生成的酯基数; Nw —— 体系中H2O的mol数
K=
_ _ [ OCO ][H2O] _ _ [ COOH][ OH]
_ _ H [ORCO]n OH
该反应事实上包括 n-1 个反应,当然就存在 n-1个平 衡常数。
aRb+aRb aRRb+ab aRRb+ aRb aRRRa+ab aRRRb+ aRb bRRRRb+ab 单体+单体 单体+二聚体 单体+三聚体 二聚体+三聚体 反应速率R1 R2 R3 R4 Rn-1 平衡常数K1 K2 K3 K4 Kn-1
第二章
逐步聚合反应
(stepwise polymerization)
第一节
引言
逐步聚合: 是具有两个或两个以上官能团的低分之化合物 相互反应而逐步生成高分子化合物的反应。
研究意义:
1、大多数杂链聚合物都是靠这类聚合合成的。 如:聚碳酸酯 (聚2,2双[4,4′羟基苯基] 丙烷碳酸酯):
_ n HO CH3 _C _ CH3 O _ _ _ n Cl C Cl OH +
_
_
-H2O
+己二酸
HO [OC(CH2)4CONH(CH2)6NH] H
_
_
_ _ -H2O HO [OC(CH2)4CONH(CH2)6NH] OC(CH2)4COOH
高分子化学第二章自由基聚合

按反应机理 连锁聚合 自由基聚合 阳离子聚合 阴离子聚合
聚合反应
逐步聚合
自由基聚合的产物占聚合物总产量60%以上
自由基聚合的理论研究比较成熟完善
根据活性中心不同,连锁聚合反应又分为:
自由基聚合:活性中心为自由基 阳离子聚合:活性中心为阳离子 阴离子聚合:活性中心为阴离子 配位离子聚合:活性中心为配位离子
C=O C O
• 碳碳双键: 既可均裂也可异裂,可以进行自由基聚合或离子 聚合(ionic polymerization)
C
C
C= C
C
C
1. 电子效应(electron effect)
可分为诱导效应(induction effect)和共轭效应 共轭效应是指两个以上双键(或三键)以单 (resonance effect) 1)诱导效应—取代基的推、吸电子性 a
• 若基团的吸电子倾向过强,如硝基乙烯
(nitroethylene)等,只能阴离子聚合而难
以进行自由基聚合。
不少单体既能阴离子聚合,又能自由基聚合,但如果 取代基吸电性太强,δ+ 过大,则只能阴离子聚合
CN
e.g:
CH2 C
CH2 CH NO2
CN ,
只能阴离子聚合
卤原子,它的诱导效应是吸电
子,但P — π 共轭效应却有供 电性,但两者均较弱,所以 VC(vinyl chloride)只能自由 基聚合。 总之:当诱导效应与共轭效应共存时, 且作用方向相反时,往往是共轭效应起 主导作用,决定单体的聚合方式。
从诱导效应: 烷氧基具有吸电子性,但氧上未共用电子对能和 双键形成 P-π共轭,却使双键电子云密度增加。
共轭效应占主导地位,所以可以进行阳离子聚合。
高分子化学第二章答案完整版

第二章缩聚和逐步聚合思考题2.1简述逐步聚合和缩聚、缩合和缩聚、线形缩聚和体形缩聚、自缩聚和共缩聚的关系和区别。
解(1)逐步聚合和缩聚逐步聚合反应中无活性中心,通过单体中不同官能团之间相互反应而逐步增长,每步反应的速率和活化能大致相同。
缩聚是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,缩聚物为主产物,同时还有低分子副产物产生,缩聚物和单体的元素组成并不相同。
逐步聚合和缩聚归属于不同的分类。
按单体—聚合物组成结构变化来看,聚合反应可以分为缩聚、加聚和开环三大类。
按聚合机理,聚合反应可以分成逐步聚合和连锁聚合两类。
大部分缩聚属于逐步聚合机理,但两者不是同义词。
(2)缩合和缩聚缩合反应是指两个或两个以上有机分子相互作用后以共价键结合成一个分子,并常伴有失去小分子(如水、氯化氢、醇等)的反应。
缩聚反应是缩合聚合的简称,是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,主产物为大分子,同时还有低分子副产物产生。
l-1、1-2、1-3等体系都有一种原料是单官能度,只能进行缩合反应,不能进行缩聚反应,缩合的结果,只能形成低分子化合物。
醋酸与乙醇的酯化是典型的缩合反应,2-2、2-3等体系能进行缩聚反应,生成高分子。
(3)线形缩聚和体形缩聚根据生成的聚合物的结构进行分类,可以将缩聚反应分为线形缩聚和体形缩聚。
线形缩聚是指参加反应的单体含有两个官能团,形成的大分子向两个方向增长,得到线形缩聚物的反应,如涤纶聚酯、尼龙等。
线形缩聚的首要条件是需要2-2或2官能度体系作原料。
体形缩聚是指参加反应的单体至少有一种含两个以上官能团,并且体系的平均官能度大于2,在一定条件下能够生成三维交联结构聚合物的缩聚反应。
如采用2-3官能度体系(邻苯二甲酸酐和甘油)或2-4官能度体系(邻苯二甲酸酐和季戊四醇)聚合,除了按线形方向缩聚外,侧基也能缩聚,先形成支链,进一步形成体形结构。
(4)自缩聚和共缩聚根据参加反应的单体种类进行分类,可以将缩聚反应分为自缩聚、混缩聚和共缩聚。
高分子化学-2-缩聚及其他逐步聚合反应

数均分子量、重均分子量的计算公式为:
M0 Mn 1 P0
聚合度分散系数
M 0 (1 P) Mn 1 P
Xw Mw d 1 p Mn Xn
(b) (a)
线形高分子
无规支化 高分子
(c)
梳形 高分子
(d)
星形 高分子
交联高分子 (f) (体型高分子)
请问:什么样的单体 能合成体型聚合物?
缩聚反应的类型不同,可逆程度也不同。可逆
程度可由平衡常数来衡量。需注意的是,平衡常数
较小时,低分子副产物的存在对分子量的提高影响 很大。
2.3 线形缩聚反应动力学
为什么要研究聚合反应动力学?
1. 合成高分子需要聚合反应动力学方面的知识 2. 逐步聚合与连锁聚合反应的动力学特征具 有显著的区别
逐步聚合是从单体开始,通过官能团间的反应,实 现分子量一步步增大,从而生成大分子量聚合物的过程。
2.2.2 线形缩聚反应的单体
用于合成线形缩聚物的单体必须带有两个官能团, 根据它们之间互相作用的情况,可分为以下几类:
官能团类型单一,且可互相反应,如HO-R-OH 官能团类型单一,不可互相反应,如 带不同类型的官能团,且内部可反应,如HO-R-COOH 带不同类型的官能团,且内部不可反应,如H2N-R-OH
根据等活性理论,聚酯化的速率可用羧酸的消
失速率来表示,即:
RP = -d[COOH]/dt = k[COOH][OH][H+]
k为反应速率常数
H+可来自于羧酸本身,进行自催化;也可外加无 机酸催化,从而形成两种不同的动力学体系。
自催化聚合反应
没有外加强酸时,二元酸单体自身充当催化剂
因此,当二元酸和二元醇的浓度相等时,
高分子化学第02章 缩合和逐步聚合反应

2020/2/2
16
3). 反应程度
在缩聚反应中,常用反应程度来描述反应的深度。
反应程度:是参加反应的官能团数占起始官能团数的分 数,用P表示。 反应程度可以对任何一种参加反应的官能团而言,以等 物质量的二元酸和二元醇的缩聚反应为例:
2020/2/2
17
假定:
体系中起始二元酸和二元醇的分子总数为N0 t 时的聚酯分子数为N
反应程度和平衡常数对缩聚物聚合度有影响,但通常不 利用它们调控聚合度。
2020/2/2
47
例:对苯二甲酸(NAmol)和乙二醇(NBmol)反应得到聚酯,试求: (1)NA=NB=1mol,数均聚合度为100时的反应程度p (2)当平衡常数K=4时,要求生成的数均聚合度为100,体系中的水量(mol)
即对于聚酯合成,若反应体系封闭,因K≈4,则
在密闭 体系
聚酯化反应,K = 4, p = 0.67,X n 只能达到 3 聚酰胺反应,K = 400, p = 0.95,X n 只能达到21 不可逆反应 K = 104, p = 0.99,X n 只能达到101
2020/2/2
43
非密闭体系 在实际操作中,要采取措施排出小分子
解:(1)当NA=NB=1mol时,
n
1 1-p
100, p
0.99
(2)当平衡常数K=4,X n 100 ,体系中生成的水nw为:
X n K 100 pnw
nw K 2 4 104 mol Xn
2020/2/2
48
2.5.3 基团数比对聚合度的影响
HOCH2
CH2OH C CH2OH CH2OH
季戊四醇
高分子化学自由基聚合

重要的速率方程
• ln [M]0 /[M] =kp (fkd/kt)1/2[I]1/2 t
• 适用于稳态条件下 • [M]0为开始加入的浓度;[M] 为 t 时刻的浓度;[I]:
为引发剂浓度,常作常数处理; [M]0 /[M] :转化 率。
关于聚合度
• 歧化终止:Xn=v • 偶合终止: Xn=2v • 以上两种方式终止时:
Xn C D 2
分子量和链转移反应
引入链转移常数:链转移速率常数 与链 增长速率常数之比, C = ktr/kp。
1
[I]
[S] 1
= CM + CI + CS +
Xn0
[M] [M] Xn
链转移常数:链转移速率常数与链 增长速率常数之 比, C = ktr/kp。它表明链转移反应发生的难易,C 越大,链转移反应越易发生,该化合物的链转移能 力越大。
链引发:引发速率最小(慢引发) 链增长:强放热,活化能低,增长速率极
高(快增长) 链终止:自由基失去活性中心(速终止) 链转移:生成新的自由基(易转移)
基元反应速率方程
链引发:
Ri = 2fkd[I]
链增长(相当于整个反应的总速率):
Rp = -d[M]/dt =kp[M][M•]
链终止:
Rt = 2kt[M•]2
高分子化学 第二章 自由基聚合
自由基反应存在的三种 物质
• 引发剂:具有活性中心 • 单体
• 聚合物:其大小与活性中 心的寿命有关
几种基本的聚合反应
• 自由基聚合:大多数带吸电子基的烯 类单体
• 阳离子聚合:带给电子集团的烯类单 体
• 阴离子聚合:带吸电子集团的烯类单 体
高分子化学-2

特点: 自由基数目未减少,但损失了一个引发剂分子; 聚合物分子量降低,引发剂效率下降。 (3)向溶剂或链转移剂转移
H CH2 CH + S Y X CH2 C S + Y X
高分子化学
南京航空航天大学材料科学与技术学院
21
第二章 自由基聚合
n CH
O
CH O
O
+ n CH2
CH
O
CH O
CH
O
CH2
CH
n
高分子化学
南京航空航天大学材料科学与技术学院
13
第二章 自由基聚合
3)三取代和四取代乙烯:
由于位阻效应,一般不能聚合。 特例:氟代乙烯,不论氟代的位置和数量,均能 聚合。原因是F的原子半径较小,且电负性最强。
二、羰基化合物
由于极性较强,一般不能进行自由基聚合,只能进行 离子型聚合。 例如:甲醛,既可以进行阴离子聚合,也可进行阳离子 聚合。
18
高分子化学
第二章 自由基聚合
特征: 大分子聚合度与链自由基单元数相同; 大分子一端为引发剂残基,另一端为饱和或不饱和。 可以采用带标记原子的引发剂结合分子量的测定,计算出偶合与 歧化终止的比例。 链终止反应特征: 活化能低, 8-21kJ/mol。 Kt 约106-108 l/mol-s,速率非常快。 链终止方式与温度、压力、气氛有关。 例如:MMA,60℃以上,歧化终止为主;60 ℃以下,两种均有。
1)无取代基:
CH 2 CH 2
结构对称,偶极矩为零,难诱导聚合,须在高温高 压或特殊的引发剂如TiCl4-三乙基铝等络合体系中才能 进行自由基聚合或配位聚合。
高分子化学课件;第二章自由基聚合

• 无链转移时,ν= Rp/ Ri 因为稳态时Rt =Ri
n 得到 = kp[Байду номын сангаас]/2(fktkd[I])1/2
对比
• 速率方程 R p = kp[M] (fkd/kt)1/2[I]1/2 • 动力学链长 n = kp[M]/2(fktkd[I])1/2
CM CI CS分别表示向单体,向引发剂,向溶剂的链转移常数。
其中,转化率= [M]0 /[M]
PS:凝胶效应的动力学解释
• 自动加速作用:随着反应进行,kt下降明显; Kp不变,Kd不变,因此(kp/kt1/2)显著增大, 聚合反应速率不降反升。
• 影响:1.使聚合反应速率显著上升外 2.聚合产物分子量显著增加
• 减缓自动加速作用:提高温度,使用良溶剂
动力学链长(ν)和聚合度
速率方程
根据假设 3、稳态,有Ri = Rt 代入链增长速率方程得
Rp = kp[M] (fkd/kt)1/2[I]1/2
“平方根定则”:聚合反应速率与引发剂浓 度[I]的平方根成正比,与单体浓度[M]一次 方成正比,可作为自由基聚合的判据。
聚合总速率
上式积分得: ln [M]0 /[M] =kp (fkd/kt)1/2[I]1/2 t
• 无链转移反应时, ν=平均每条增长链所含 的单体单元数
• 当发生歧化终止时, Xn = n • 当发生偶合终止时, Xn = 2n
•
兼有两种方式终止时,
n
Xn C D
2
链转移反应对聚合度的影响
得到:
1
[I]
[S]
= CM + CI + CS +
高分子化学导论第2章线性缩聚和逐步聚合

2.7 体形缩聚和凝胶化作用
一. 体形缩聚 1. 定义
在缩聚反应中,参加反应的单体只要有一种单体具有 两个以上官能团( f >2),缩聚反应将向三个方向发展, 生成支化或交联结构的体形大分子,称为体形缩聚。 体形缩聚的最终产物称为体形缩聚物。
r
=
Na
Na+2Nc
2表示1个分子Cb中的1个基 团b相当于一个过量的bBb 分子双官能团的作用
q=
Nc Na
=
2Nc Na
2
推导过程同上
r
=
1
q+1
1+r
q+2
Xn = 1+r-2rP = q+2( 1-P )
和前一种情况相同,只是 r 和 q 表达式不同
3)aRb 加少量单官能团物质Cb(分子数为Nc) 基团数比和分子过量分率如下:
Polymer Chemistry
高分子化学
缩聚和逐步聚合
2.1 发展历史
按聚合机理或动力学分类:
• 逐步聚合(stepwise polymerization) 无活性中心,单体官能团间相互反应而逐步增长
• 连锁聚合(chain polymerization) 活性中心(active center)引发单体,迅速连锁增长
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
若q很小
高分子化学第二章

2.4.2.2 平衡缩聚动力学
聚酯化反应是平衡常数较小的可逆反应。 如果小分子副产物不能及时排除,则逆 反应不能忽视。
如羧基和羟基等当量,令其起始浓度c0=1, 时间t时的浓度为c,则酯的浓度为1—c。在 水未排出的情况丁,水的浓度也为1—c。 如果有一部份水排出,则令其残留浓度nW
2.5 影响线型缩聚物聚合度的因 素和控制方法
一分子中能参加反应的官能团数称为官能 度。
1-1官能度体系
例:醋酸与乙醇反应体系,它们均为单官能团物质。
1-2官能度体系
例:辛醇与邻苯二甲酸酐(官能度为2)反应的体系。
(苯酚)
缩聚反应
2-2或2官能度体系的单体进 行缩聚,形成线型聚合物的 缩聚反应称做线型缩聚。
2-2官能度体系
如二元酸和二元醇,生成线形缩聚物。通式如下:
两单体非等基团数:用过量摩尔分率q和基团数比r 表示。工业上常用q,而理论分析时用r。
Na、Nb:体系中官能团a、b的起始基团数
• aAa单体为基准,bBb微定量,设基团a的反应程度为p,
a、b 的反应数均为Nap 基团a 的残留数为Na-Nap,b的残留数为Nb-Nap (a+b)的残留总数(即大分子链的端基数): Na+Nb-2Nap 大分子总数(端基数的一半): (Na+Nb-2Nap)/2 • 结构单元数为(Na+Nb)/2
逐步特性是所有缩聚反应所共有的,可逆平衡 的程度则各类缩聚反应有明显的差别。
自由基聚合与线形缩聚特征的比较
2.3.4 缩聚过程中的副反应
缩聚反应通常须在较高温度和较长时间下才能完 成,往往伴有一些副反应。 (1)官能团的消去 如合成聚酯时,二元羧酸在高温下脱羧反应。 合成聚酰胺时,二元胺发生分子内(间)的 脱氨反应。
《高分子化学》第2章 逐步聚合反应

1 概述
1. 1 逐步聚合的基本概念
逐步聚合是高分子合成最基本的类型之一。逐步聚合
的基本特征是官能团之间的反应。聚合度随时间逐步增 长,而转化率在聚合初期即可达到很高。
缩聚反应是最常见的逐步聚合反应。聚酰胺、聚
酯、聚碳酸酯、酚醛树脂、脲醛树脂、醇酸树脂等均为重 要的缩聚产物。
许多特殊结构的聚合物也都是通过缩聚反应制得的。 缩聚反应的基本特征是平衡和反应中脱出小分子。
26
第二章 逐步聚合反应
27
第二章 逐步聚合反应
2)聚合反应的可逆平衡 缩聚一般为可逆平衡反应,与低分子的缩合反应相似。
由于体系中所有的活性官能团具有同样的活性,因此可用 一个平衡常数来表示。
OH + COOH
OCO + H2O
K k1 [OCO ][H 2O] k 1 [OH][ COOH]
子降解,单体分子与聚合物分子之间存在可逆平衡的逐步 聚合反应。
如聚酯化反应:
n HOOC R COOH + n HO R' OH
聚合 水解
HO ( OC-R-CO O-R'-O )nH + (2n-1) H2O
9
第二章 逐步聚合反应
(ii)不平衡线形逐步聚合反应 聚合反应过程中生成的聚合物分子之间不会发生交换
18
第二章 逐步聚合反应
缩聚反应的单体转化率、产物聚合度与反应时间关系 示意图:
单 体 转 化 率
产 物 聚 合 度
反应时间
19
第二章 逐步聚合反应
3 线形缩聚反应机理
3.1 线形缩聚与成环反应
缩聚反应过程中常常存在两种环化反应:分子内环化与 单体单元内环化。 3.1.1 分子内环化
《高分子化学》第二章知识点

第二章缩聚及其他逐步聚合反应缩聚反应1、按聚合机理或动力学分类:*连锁聚合(Chain polymerization)*逐步聚合(Stepwise polymerization)大部分缩聚属于逐步机理,大多数烯类加聚属于连锁机理2、逐步聚合的种类:*缩聚:官能团间的缩合聚合反应,同时有小分子产生。
*聚加成:形式上是加成,机理是逐步的。
*开环反应:部分为逐步反应,如水、酸引发己内酰胺的开环生成尼龙-6*氧化偶合:单体与氧气的缩合反应,如2,6-二甲基苯酚和氧气形成聚苯撑氧,也称聚苯醚(PPO)。
*Diels-Alder反应:共轭双烯烃与另一烯类发生1,4 加成,制得梯形聚合物.即多烯烃的环化聚合。
(附1)重要的逐步聚合物3、绝大多数天然高分子都是缩聚物。
4、线性缩聚反应单体需要满足的条件:2-2官能度体系、反应单体不易成环、较少副反应。
线形缩聚反应的机理特征①逐步特性:官能团之间逐步反应n-聚体+m-聚体=(n+m)-聚体+水高分子链向两个方向增长,分子链逐步增长②可逆平衡:缩聚产物被反应中伴生的小分子降解,单体分子与聚合物分子之间)aABb +ab存在可逆平衡的反应。
aAa + bBb=( k₁/k-1平衡常数:K=k₁/k-1可逆程度,可根据平衡常数K衡量。
线形缩聚大致分三类:K较小:反应可逆。
如聚酯化反应(K=4),低分子副产物的存在对分子量影响较大,需高温减压脱除;K中等:如聚酰胺反应K=300-400),低分子副产物对分子量有所影响,一定程度减压脱除;K很大:可看作不可逆反应。
如聚砜、聚碳酸酯等反应K>1000。
单体的转化率:参加反应的单体量占总单体量的百分比7、缩聚:官能团间的缩合聚合反应,同时有小分子产生。
8、缩聚反应的特点:单体具有官能团:OH,NH₂, COOH, COOR, COCI等;产生小分子副产物;缩聚物和单体分子量不成整数倍;缩聚物有特征官结构能团。
9、官能度体系:(缩聚批注中也有提及)官能度:分子中能参与反应的官能团数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章参考答案
3. 己二酸与下列化合物反应,那些能形成聚合物?
解:己二酸为2官能度单体,f =2。
a. 乙醇:2-1体系不能形成聚合物,生成己二酸二乙酯。
b. 乙二醇:2-2体系形成线形聚合物,即聚己二酸乙二醇酯。
c. 甘油:2-3体系形成体型聚合物。
d. 苯胺:2-1体系不能形成聚合物,生成己二酰二苯胺。
e. 己二胺:2-2体系形成线形聚合物,即己二酰二胺或称尼龙-66。
5. 下列多对单体进行线形缩聚:己二酸和己二醇。
己二酸和己二胺,
己二醇和对苯二甲酸,己二胺和对苯二甲酸。
简明给出并比较缩聚物的性能特征。
⑴. 己二酸和己二醇:形成线形聚酯。
分子中无氢键,且分子柔软,所
以,聚合物的熔点低,强度小,且不耐溶剂,易水解,不能用作结构材料。
但可作为聚氨酯的预聚物、药物载体、可降解的缝合线等。
⑵. 己二酸和己二胺:形成线形聚酰胺,即尼龙-66。
其有较高的结晶
度、熔点和强度,可以用作高强度的合成纤维和工程塑料。
⑶. 己二醇和对苯二甲酸:形成线形芳香聚酯,即涤纶聚酯,苯环的存
在,提高了聚酯的刚性、强度和熔点,亚乙基赋予聚酯的柔性,使
涤纶聚酯成为合成纤维的第一大品种。
⑷. 己二胺和对苯二甲酸:形成半芳胺,即尼龙-6T,其热稳定性好,
熔点高。
6. 简述线形缩聚中的成链和成环倾向。
选定下列单体中的m值,判
断其成环倾向。
在线形缩聚时,单体及中间产物有成环倾向,一般,五、六元环的结构比较稳定,易成环;另外单体浓度对成环倾向也有影响,因成环是单分子反应,缩聚是双分子反应,因此,低浓度有利于成环,高浓度有利于线形缩聚而成链。
⑴. 氨基酸:当1
m时,经双分子缩合后,易形成六元环。
甘氨酸形成
=
甘氨酸酐。
当2
m时,经消去反应,可能形成丙烯酸。
=
当4
3or
m=时,分子内形成酰胺后,易形成五、六元环。
当5
m时,主要形成线形聚合物。
≥
⑵. 乙二醇与二元酸:不易成环,主要形成线形聚合物。
7. 简述线形缩聚的逐步机理,以及转化率与反应程度的关系。
线形缩聚的逐步机理——逐步和平衡。
⑴. 线型缩聚反应的逐步性
缩聚反应形成聚合物是官能团之间相互反应的结果。
缩聚早期,单体很快消失,转变成二聚体、三聚体、四聚体等低聚物,转化率很高,但反应程度不高,以后的缩聚反应则在低聚物之间进行。
聚合度随反应时间而增加。
延长聚合时间的主要目的主要是提高反应程度和分子量,而不在于提高转化率。
缩聚早期,单体的转化率就很高,而分子量和反应程度却很低。
⑵. 线型缩聚反应的平衡性
许多缩聚反应是可逆的,其可逆的程度可由平衡常数来衡量。
根据其大小,可将线型缩聚大致分成三类:①平衡常数小,如聚酯化反应,K≈4,低分子副产物水的存在对聚合物相对分子质量影响很大,应除去。
②平衡常数中等,如聚酰胺化反应,K≈300~500,水对聚合物相对分子质量有所影响。
③平衡常数很大或看作不可逆,如聚碳
酸酯和聚砜一类的缩聚,平衡常数总在几千以上。
不同的缩聚反应,其可逆平衡程度有明显的差别。
转化率与反应程度的关系:
转化率为参加反应变成聚合物的单体占起始单体量的百分数。
反应程度为参加反应的官能团数占起始官能团数的分率。
缩聚反应的本质是官能团之间的反应,只有官能团之间充分反应才能生成大分子,故,用反应程度才能描述反应进行的深度或相对分子量的大小。
计算题
8. 等摩尔的二元醇和对苯二甲酸在280℃下封管内进行缩聚,平衡
常数4=K ,求最终n X 。
另在排除副产物水的条件下缩聚,欲得100=n X ,问体系中残留水分有多少?
()3
141101422=+=+=∴+==-K X K K
P K P P K n -平衡时,
,=封闭体系, ()()0004.01000041101422===∴==-==-n w w
w n w X K n n K Pn K P X K
Pn P K -平衡时,,=部分排除水分,
9. 等摩尔二元醇和二元酸缩聚,另加醋酸1.5%,求999.0 995
.0或=p 时聚酯的聚合度是多少?
80995.0985.02985.01985.01211985.0015
.02222 995.0 %5.1 '=⨯⨯-++=-++==⨯=+==rP r r X N N N r P n b b a +时:
,当醋酸过量
117999
.0985.02985.01985.01211985.0015.022
22 999.0 %5.1 '=⨯⨯-++=-++==⨯=+==rP r r X N N N r P n b b a +时:,
当醋酸过量 ()()015.0122
=-++=q p q q X n 其它求聚合度的方法: ⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛⇒=++⨯=-=分子总数倍非过量基团数的2985.1015.01122 22f f P X n
10. 尼龙1010是根据1010盐中过量的癸二酸来控制分子量,如果要
求分子量为20000,问1010盐的酸值应该是多少?(以g KOH mg 计)
374101033810100盐的分子量为=重复单元的分子量尼龙M -
3.11822.590====n X M M n n n 重复单元数
因为酸过量,所以假设癸二胺的反应程度 1=P
由聚合度可以求出单体的基团数比r 。
983.03.11811211==-+=-++=r r r rp r r X n 解出:
如果癸二胺的基团数为1=a N ,则癸二酸0173.1983.01==b N ()()()盐=
酸值盐101018.537425610173.121010g mgKOH M M N N KOH a b =⨯⨯-⨯-=。
