高考化学复习四大平衡常数的综合应用PPT
高中化学第8章 第54讲 水溶液中四大平衡常数的综合应用---2023年高考化学一轮复习(新高考)

第54讲水溶液中四大平衡常数的综合应用复习目标 1.掌握四大平衡常数[K a(K b)、K h、K w、K sp]的简单计算。
2.利用题目信息或图像,结合离子平衡,解决实际问题。
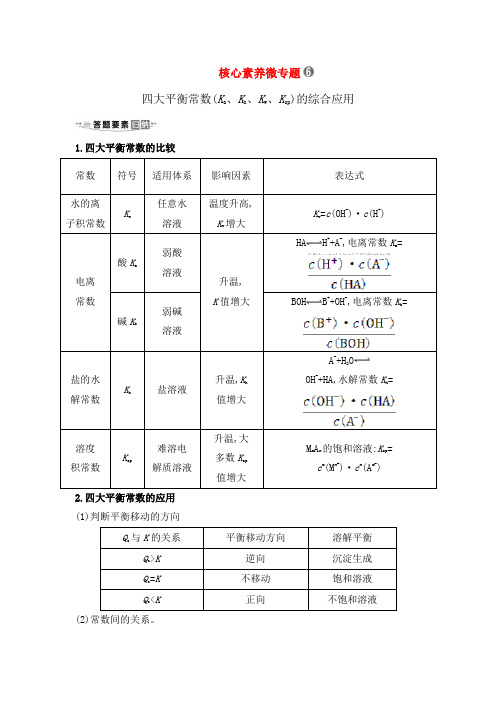
1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w 任意水溶液温度升高,K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)注意(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a(或K b)、K h均变大。
2.四大平衡常数的应用(1)判断平衡移动的方向Q与K sp的关系平衡移动方向结论Q>K sp逆向溶液过饱和,有沉淀析出Q=K sp不移动溶液饱和,处于平衡状态Q<K sp正向溶液未饱和,无沉淀析出(2)常数间的关系 ①强碱弱酸盐:K h =K w K a ;②强酸弱碱盐:K h =K wK b。
(3)判断离子浓度比值的大小变化。
如将NH 3·H 2O 溶液加水稀释,c (OH -)减小,由于电离平衡常数为c (NH +4)·c (OH -)c (NH 3·H 2O ),此值不变,故c (NH +4)c (NH 3·H 2O )的值增大。
广东省惠东县高考化学一轮复习 第八章 水溶液中的离子平衡“四大平衡”课件.pptx

可逆的
研究
溶液中的 包括强碱弱酸盐、溶液中的难溶
化学反
对象
弱电解质 强酸弱碱盐及弱 电解质
应
酸弱碱盐
溶液中的氯化
工业合 醋酸溶液、碳酸钠、氯化铁、
举例
银、硫酸钡、
成氨 氨水等 醋酸铵等
氢氧化铁等
3
2.产生原因及影响因素不同 中学化学中的四种平衡产生的原因不同,影响它们的 因素也不完全相同.
(1)化学平衡 可逆反应中,正反应和逆反应同时进行,只是在达到 平衡前,正反应速率大于逆反应速率,当这个可逆反 应进行到正反应速率与逆反应速率相等时,反应物与 生成物浓度不再改变,达到表面上静止的一种“平衡 状态”,这就是化学反应所能达到的限度(同条件下, 反应物的转化率最大).影响这种平衡的因素有温度、 压强、反应物及生成物的浓度等.
16
2.元素(原子团)守恒
电解质溶液中的某些元素或原子团存在“守恒关系”,
如NH4Cl溶液中存在氮元素守恒:c(NH3·H2O)+c(NH
+
4
)
=c(Cl-).这种守恒思想的合理利用往往可以使解题化难
为易.
17
3.质子守恒 电解质溶液中,由于电离、水解等过程的发生,往往存 在质子(H+)的转移,但转移过程中质子数量保持不变, 称为质子守恒.如在NaHS溶液中,存在NaHS的电离 和水解及H2O的电离,其质子转移情况可作如下分析:
在一温度下达到平衡时,K=ccmpCA··ccqnDB.
(2)平衡转化率
对于一般的化学反应:aA+b
cC+dD,达到平衡时
反应物A的转化率为:α(A)=
A的初始浓度-A的平衡浓度 A的初始浓度
×100%=c0Ac0-AcA×100%.
高考化学复习:水溶液中四大平衡常数的综合应用

二、利用电离常数判断化学反应进行的方向 2.部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25 ℃) Ka=1.77×10-4 Ka=4.9×10-10 Ka1=4.3×10-7Ka2=5.6×10-11
下列选项错误的是_______a_d______(填字母)。 a.2CN-+H2O+CO2===2HCN+CO2-3 b.2HCOOH+CO23-===2HCOO-+H2O+CO2↑ c.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
√D.XZ线上任意点均有pH=7
返回
解析:任何水溶液中都有Kw=c(H+)·c(OH-),因此两条曲线间任一点均 有此关系,A项正确;XZ线上任意点溶液呈中性,M区域在XZ上方均有c(H +)<c(OH-),B项正确;T1时Kw小于T2时Kw,则T1<T2,C项正确;XZ线上任 意点溶液呈中性,但只有当c(H+)=10-7 mol·L-1时pH=7,D项错误。
_6_.0_×_1_0_-__3mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7 mol·L-1 时,溶液中的 c(SO23- )/c(HSO- 3 )= __0_._6_2___。 (2)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离的平衡
常数值为_8_.7_×__1_0_-_7(已知:N2H4+H+
√B.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
C.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
D.
用石
灰水处理含有Mg2+
和HCO
- 3
的硬水,发生反应的离子方程式为
2020高考化学冲刺核心素养专题 四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用含解析
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数Kw任意水溶液温度升高,Kw增大Kw=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a= 碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数Kh盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数Ksp难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Qc与K的关系平衡移动方向溶解平衡Qc>K逆向沉淀生成Qc=K不移动饱和溶液Qc<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以。
四大平衡常数之间的联系及其应用

2.下表是 25 ℃时某些弱酸的电离常数。
化学式 CH3COOH HClO
H2CO3
H2C2O4
Ka
Ka=1.8× Ka=3.0 Ka1=4.1×10-7 Ka1=5.9×10-2
10-5
×10-8 Ka2=5.6×10-11 Ka2=6.4×10-5
(1)H2C2O4 与含等物质的量的 KOH 的溶液反应后所得溶液呈酸性,
四大平衡常数之间的联系 及其应用
电解质溶液中的电离常数、水的离子积常数、水解常数 及溶度积常数是在化学平衡常数基础上的延深和拓展,它是 定量研究平衡移动的重要手段。各平衡常数的应用和计算是 高考的热点和难点。要想掌握此点,在复习时就要以化学平 衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列 原理和相关守恒定律为计算依据,以各平衡常数之间的联系 为突破口,联系元素及化合物知识,串点成线,结线成网, 形成完整的认识结构体系,就能势如破竹,水到渠成。
4.水的电离平衡曲线如右图所示。
(1)若以 A 点表示 25 ℃时水在电离平衡时的离子
浓度,当温度升到 100 ℃时,水的电离平衡状态 到 B 点,则此时水的离子积从1_0_-_1_4增加到_1_0_-_1_2 。
(2)25 ℃时,在等体积的①pH=0 的 H2SO4 溶液, ②0.05 mol·L-1 的 Ba(OH)2 溶液,③pH=10 的 Na2S 溶液, ④pH=5 的 NH4NO3 溶液中,发生电离的水的物质的量之比是 _1_∶__1_0_∶__1_0_10_∶__1_0_9____。
子方程式为 2CO32-+Cl2+H2O===Cl-+ClO-+2HCO3-。
考法 二 水的离子积常数的应 用与计算
3.右图表示水中 c(H+)和 c(OH-)的关系,
2023届高三化学二轮复习 四大滴定及其应用 课件

①滴定终点现象的描述:当加入最后1滴××溶液(标准溶液)时,溶液由× 色变为×色,且半分钟内色不改变。
②指示剂的选择
对于反应前后有明显颜色变化的反应(如酸性KMnO4溶液与H2C2O4溶液的 反应)不需要使用指示剂,对于反应前后颜色变化不明显(如碘水与Na2S2O3
溶液的反应)或无颜色变化(酸碱中和)的反应则需要使用指示剂。
常见误差分析:
以标准酸溶液滴定未知浓度的碱(酚酞做指示剂)为例
6.“滴定”曲线类图象探究 (1)图示强酸与强碱滴定过程中pH曲线 ( 以 0 . 1 0 0 0 m o l ·L -1 N a O H 溶 液 滴 定 2 0 . 0 0 m L 0 . 1 0 0 0 m o l ·L -1盐
化学计算
方程式的正确书写 计算模型的确定 误差分析
教学策略
1.立足基础:酸碱中和滴定 氧化还原反应; 2.促进知识迁移;
3.重视学生计算能力的培养。
酸为例)
(2)强酸(碱)滴定弱碱(酸)pH曲线比较
例:室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列B说法正确的是 ( )
A.Ⅱ表示的是滴定醋酸的曲线 B.pH=7时,滴定醋酸消耗的V(NaOH)
小于20.00 mL C.V(NaOH)=20.00 mL时,
过量KI溶液及一定量的稀H2SO4,充分反应。用标准Na2S2O3溶液滴定 (滴定Ⅰ);溶液再以酚酞为指示剂,用标准液NaOH溶液滴定(滴定Ⅱ)。
已知产生I2的反应(不考虑Cl2与水反应):
实验数据如下:
加入量n(H2SO4)/mol 2.505×10-3 滴定Ⅰ测出量n(I2)/mol 2.005×10-3 滴定Ⅱ测出量n(H2SO4) 1.505×10-3
高考化学复习四大平衡常数的综合应用

SO23-+H2O HSO- 3 +OH-
Kh=c(HScO(- 3 )SO·c23-()OH-)=KKaw2=6.01×0-1104 -8
所以cc((HSSOO32--3))=
10-5 10-14
=60。
6.0×10-8
(3)①Kh(CN-)=1.61×10-5,由此可求出 Ka(HCN)=6.2×10-10, 故 CN-的水解能力强于 HCN 的电离能力,由于盐与酸的总浓度 相等,故 CN-水解产生的 c(OH-)大于 HCN 电离生成的 c(H+), 混合溶液显碱性,c(CN-)<c(HCN)。②当溶液显中性时,由电荷 守恒得 c(K+)=c(CN-)+c(Cl-),由物料守恒得 c(HCN)=c(K+)- c(CN-)=c(Cl-)=0.5c mol·L-1,由 CN-+H2O HCN+OH-得 Kh=c(OHc(-)C·Nc(-)HCN)=1.00×.3110--70×.50c.5c=1.61×10-5,解得 c=0.616 2。 答案:(1)2.36×10-5 (2)向右 60
四大平衡常数之间的关系(实例) 已知:H2S 的电离常数为 Ka1、Ka2;CdS 的溶度积常数为 Ksp。 ①常温下,Na2S 溶液中,S2-的水解常数为 Kh1,HS-的水解常 数为 Kh2,则 Kh1=Kw/Ka2,Kh2=Kw/Ka1; ②反应 CdS(s)+2H+(aq) Cd2+(ad)+H2S(aq)的平衡常数为 K,则 K=Ksp/(Ka1·Ka2)。
平衡关系式(实例) 及平衡常数表 符号 适用体系
达式
CH3COO-+H2O
盐的水解 平衡常数
Kh
弱离子的 盐溶液
CH3COOH+OH- Kh=c(CHc3(COCOHH3C)O·Oc(-)OH-)
一轮加强:四大平衡常数(Ka、Kh、Kw、Ksp)综合应用

MmAn 的饱和溶液的 Ksp=cm(Mn+)·cn(Am-) 以 NH+ 4 +H2O NH3·H2O+H+为例 Kh=cH+c·cNNHH+43·H2O
3
4
2.“四大常数”之间的四种换算关系
(1)Ka(或 Kb)与 Kw、Kh 的关系
①一元弱酸或弱碱的 Ka 或 Kb 与弱酸根或弱碱离子的 Kh 关系 Ka=KKwh或 Kb=KKwh。 ②二元弱酸的 Ka1、Ka2 与相应酸根的水解常数 Kh1、Kh2 的关系 Ka1=KKhw2,Ka2=KKhw1。
Ksp=c(Mn+)·cn(OH-)=cOnH-·cn(OH-)=cn+1nOH-=1n10K-wpHn+1。
(4)沉淀转化常数 K 与 Ksp 的关系,如
3Mg(OH)2(s)+2Fe3+(aq) 2Fe(OH)3(s)+3Mg2+的 K=KK32s[p[MFegOOHH32]]。
5
63.四大平衡常数的应用
(2)25 ℃时,H2SO3 HSO- 3 +H+的电离常数 Ka=1×10-2,则该温度下 NaHSO3 水解 反应的平衡常数 Kh=________,若向 NaHSO3 溶液中加入少量的 I2,则溶液中ccHH2SSOO- 33将 ________(填“增大”“减小”或“不变”)。
7
8
【解析】 (1)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离
(2)已知
25
℃时,H2B 的 Ka1=m,Ka2=n,则 cHCO-3 ·cOH-
pH=5
的
NaHB
溶液中ccHB22B-=________。
解析 (1)Kh=
cCO23-
=5×10-5,又 c(HCO-3 )∶c(CO23-)=1∶2,
2025年高考化学一轮复习课件大单元四第十一章第47讲化学平衡常数的综合计算

提升 关键能力
3.[2019·全国卷Ⅱ,27(2)节选]某温度下,等物质的量的碘和环戊烯( )在刚性容器
内发生反应: (g)+I2(g)
(g)+2HI(g) ΔH>0,起始总压为105 Pa,平衡时
总压增加了20%,环戊烯的转化率为__4_0_%___,该反应的平衡常数Kp=_3_._5_6_×_1_0_4_Pa。
第47讲
化学平衡常数的综合计算
复 习
1.了解压强平衡常数的含义,了解平衡常数与速率常数的关系。
目 标
2.掌握平衡常数和平衡转化率计算的一般方法。
考点一 压强平衡常数及相关计算
内
容
索
考点二 化学平衡常数与速率常数的关系
引
练真题 明考向
< 考点一 >
压强平衡常数及相关计算
整合 必备知识
1.气体的分压p(B) 相同温度下,当某组分气体B单独存在且具有与混合气体总体积相同的体积时,该气 体B所具有的压强,称为气体B的分压强,简称气体B的分压,符号为p(B),单位为Pa 或kPa或MPa。 气体B的分压p(B)=气体总压p×B的体积分数=气体总压p×B的物质的量分数。
研究表明正反应速率 v 正=k 正·c(Mb)·p(O2),逆反应速率 v 逆=k 逆·c(MbO2)(其中 k 正 和 k 逆分别表示正反应和逆反应的速率常数)。 (1)平衡常数K与速率常数k正、k逆之间的关系
k正 式为K=__k_逆__(用含有k正、k逆的式子表示)。
整合 必备知识
可逆反应达到平衡状态时,v 正=v 逆,所
整合 必备知识
4.列三段式法计算压强平衡常数
例 一定温度和催化剂条件下,将1 mol N2和3 mol H2充入压强为p0的恒压容器中, 测得平衡时N2的转化率为50%,计算该温度下的压强平衡常数(Kp)。
第47讲 化学平衡常数的计算2024年高考化学大一轮复习课件

衡浓度是多少?平衡常数K是多少? 三段式法——“起、转、平、列方程”
1.8 mol/L
(2)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol/L,c(N)=a mol/L; 达到平衡后,c(P)=2 mol/L,则M的转化率为_5_0_%_,N的起始浓度为6__m_o_l·L-1
转化 平衡
P平衡
p kPa
=
1.45 1.0
P平衡 =p kPa
KP=
p(S)×p(CO2) p(SO2)
=
(0.45p)2 0.55p
平衡时 p(SO2)=01..5455p kPa =81p/220 kPa p(S)= p(CO2)=p kPa
=p kPa
(变式训练)
1. 850oC,向某刚性容器加入1.0 mol SO2和足量碳粉, 发生反应C(s)+SO2(g) S(g)+CO2(g),反应经过11分钟达到平衡,平衡压强 为p kPa 平衡时硫蒸气的体积分数为1/3, 0~11 min内,平均反应速率
C(s)+CO2(g) ⇌2CO(g)
KP
=
(96%p)2 4%p
=
23.04p
MPa
02 恒温恒容体系,计算Kp 注意:非恒压体系可能要计算平衡时的总压强
例. 850oC,向某刚性容器加入1.0 mol SO2和足量碳粉,起始压强为p kPa , 发生反应C(s)+SO2(g) S(g)+CO2(g),反应经过11分钟达到平衡,平衡时 硫蒸气的物质的量为, 0~11 min内,平均反应速率
01 恒温恒压体系,计算Kp
2023届高三化学高考备考一轮复习+化学平衡常数+速率常数和平衡常数的关系+课件

在25 ℃时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下
表,下列说法错误的是( C)
物质 起始浓度/(mol·L-1) 平衡浓度/(mol·L-1)
X
YZ
0.1 0.2 0
0.05 0.05 0.1
A.反应达到平衡时,X 的转化率为 50%
B.反应可表示为 X+3Y
2Z,平衡常数为 1 600
①v正=k正·ca(A)·cb(B)、v逆=k逆·cc(C)·cd(D)
②v正=k正·pa(A)·pb(B)、v逆=k逆·pc(C)·pd(D) ③v正=k正·xa(A)·xb(B)、v逆=k逆·xc(C)·xd(D)
(2)具体化速率方程:以具体物质表示的正逆反应速率
①vA正=k正·ca(A)·cb(B)、vC逆=k逆·cc(C)·cd(D) ②vA正=k正·pa(A)·pb(B)、vC逆=k逆·pc(C)·pd(D) ③vA正=k正·xa(A)·xb(B)、vC逆=k逆·xc(C)·xd(D)
4.计算某刻
(1)抽象化:
v正 v逆
=
k正 k逆
y(a A) y(c C)
yy((db DB))=K·
y(a A) y(b B) y(c C) y(d D)
(2)具体化:
vA正 vC逆
= k正 y(a A) y(b B)= a
k逆 y(c C)Байду номын сангаасy(d D) c
×K×
y(a A) y(b B) y(c C) y(d D)
(5)Cl2+H2O
HCl+HClO 的平衡常数表达式
(1)× (2)× (3)× (4)× (5)×
()
(6)某一化学反应的平衡常数与反应的温度有关,还与反应本身有关( )(7) 与某一化学反应的平衡常数化学反应本身和温度有关,并且会受到起始浓度 的影响( )(8)两种物质反应,不管怎样书写化学方程式,平衡常数不变( )(9)温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数( )(10)当生成物浓度幂之积与反应物浓度幂之积比值小于K时,v正<v逆( )(11)只改变一个影响因素,平衡常数KK值变化,平衡一定移动( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SO23-+H2O HSO- 3 +OH-
Kh=c(HScO(- 3 )SO·c23-()OH-)=KKaw2=6.01×0-1104 -8
所以cc((HSSOO32--3))=
10-5 10-14
=60。
6.0×10-8
(3)①Kh(CN-)=1.61×10-5,由此可求出 Ka(HCN)=6.2×10-10, 故 CN-的水解能力强于 HCN 的电离能力,由于盐与酸的总浓度 相等,故 CN-水解产生的 c(OH-)大于 HCN 电离生成的 c(H+), 混合溶液显碱性,c(CN-)<c(HCN)。②当溶液显中性时,由电荷 守恒得 c(K+)=c(CN-)+c(Cl-),由物料守恒得 c(HCN)=c(K+)- c(CN-)=c(Cl-)=0.5c mol·L-1,由 CN-+H2O HCN+OH-得 Kh=c(OHc(-)C·Nc(-)HCN)=1.00×.3110--70×.50c.5c=1.61×10-5,解得 c=0.616 2。 答案:(1)2.36×10-5 (2)向右 60
•
6.铜山湖远离城市,所以,能够本分 地、无 欲无求 地、自 然而然 地进行 着四季 轮回、 昼夜更 替,春 绿夏艳 秋静冬 安,白 天张扬 着活力 ,夜晚 安守着 宁静。 她,不 近人亦 不远人 ,不为 秋愁亦 不为春 喜,只 顺其自 然地存 在着, 任人亲 疏。
•
7.记得《易.系辞上》说过这样的话 :圣人 与天地 相似, 所以不 违背自 然规律 ;知道 周围万 物而以 其道成 就天下 ,所以 不会有 过失; 乐天知 命,没 有忧愁 ;安于 所居之 地,敦 厚而施 行仁德 ,所以 能爱。
(4)已知某温度下 CaC2O4 的 Ksp 为 2.5×10-9。将 0.02 mol·L-1 澄清石灰水和 0.01 mol·L-1 H2C2O4 溶液等体积混合,所得溶液 中 C2O24-的物质的量浓度为____________________。
解析:(1)由题给表格可知,H2C2O4、HC2O- 4 、NH3·H2O 的电 离常数相对大小为 Ka(H2C2O4)>Ka(HC2O- 4 )>Kb(NH3·H2O), 故草酸铵溶液显酸性。(2)阴极得电子发生还原反应:2H++ HOOC—COOH + 2e - ===HOOC — CHO + H2O 。 (3)① 加 入 75%酒精是为了降低草酸钠的溶解度,便于晶体析出。②二者 反应后溶质为草酸氢钠,因为溶液显酸性,所以 HC2O-4 的电离 程 度 大 于 其 水 解 程 度 , 则 离 子 浓 度 大 小 顺 序 为 c(Na + ) > c(HC2O- 4 )>c(H+)>c(C2O24-)>c(OH-)。(4)混合后所得溶液中
Ka1=5.4×10-2 Ka2=5.4×10-5 Kb=1.8×10-5
(1)(NH4)2C2O4 溶 液 的 pH________7( 填 “ > ”“ < ” 或 “=”)。 (2) 用 惰 性 电 极 电 解 饱 和 草 酸 溶 液 可 制 得 乙 醛 酸 (OHC—COOH)。阴极的电极反应式为____________________ _____________________________________________。 (3)草酸钠是一种重要的还原剂。合成草酸钠的操作如下:
1.(1)已知 25 ℃时,NH3·H2O 的电离平衡常数 Kb=1.8× 10 - 5 , 该 温 度 下 1 mol·L - 1 的 NH4Cl 溶 液 中 c(H + ) = ________mol·L-1。(已知 5.56≈2.36) (2)常温下,用 NaOH 溶液吸收 SO2 得到 pH=9 的 Na2SO3 溶液, 吸收过程中水的电离平衡 ________(填“向左”“向右”或 “不”)移动。试计算所得溶液中cc((HSOSO23-3-))=________。(常 温下 H2SO3 的电离平衡常数 Ka1=1.0×10-2,Ka2=6.0×10-8) (3)已知常温下 CN-的水解常数 Kh=1.61×10-5。
(3)①碱 < c(Na+)>c(CN-)>c(OH-)>c(H+) ②0.616 2
2.(2019·青岛高三模拟)草酸即乙二酸,是一种有机二元酸,
在工业上有重要的作用。草酸在 100 ℃开始升华,157 ℃时大
量升华,并开始分解。
电离方程式
电离常数
H2C2O4 HC2O- 4 NH3·H2O
H++HC2O- 4 H++C2O24- NH+ 4 +OH-
平衡关系式(实例) 及平衡常数表 符号 适用体系
达式
CH3COO-+H2O
盐的水解 平衡常数
Kh
弱离子的 盐溶液
CH3COOH+OH- Kh=c(CHc3(COCOHH3C)O·Oc(-)OH-)
溶度积常
数
Ksp
难溶电 解质
Mg(OH)2(s) Mg2+(aq)+2OH- (aq) Ksp[Mg(OH)2]= c(Mg2+)·c2(OH-)
草酸―N―加a―2C热―O3→
75%酒精 ――→
过滤 ――→
草酸钠晶体
①75%酒精的作用是________________________________。
②当草酸与碳酸钠的物质的量按 2∶1 充分混合后,溶液中 pH
<7。请将该溶液中离子浓度按由大到小的顺序排列:________
___________________________________________。
(3)①降低草酸钠的溶解度,便于晶体析出
②c(Na+)>c(HC2O- 4 )>c(H+)>c(C2O24-)>c(OH-)
(ห้องสมุดไป่ตู้)5×10-7 mol·L-1
•
1.一方面,城市是可爱的。它创造了 现代文 明,并 耀武扬 威地显 摆着现 代文明 的物质 成果, 引诱着 人们集 聚其中 。
•
2.在这里,不仅有四通八达的交通网 络、美 轮美奂 的摩天 大楼、 令人咋 舌的财 富神话 、繁忙 紧张的 生活节 奏、层 出不穷 的竞争 机会、 丰富多 彩的文 娱生活 ,而且 生活于 其中的 人们能 够分享 财富的 盛宴、 发展的 成果, 能够编 织梦想 、追求 理想, 能够开 阔眼界 、增长 见识, 能够施 展才华 、实现 自我。
•
3.另一方面,城市是可怜的。它远离 了自然 ,侵害 了人心 ,异化 了人性 。我们 的不少 城市, 不仅没 能把物 质成果 转化成 让人们 快乐、 幸福的 动力, 反而把 人们变 成了追 逐名利 的工具 。至少 目前, 在很多 城市里 ,绿色 消失了 ,纯净 的水源 消失了 ,清新 的空气 消失了 ,安全 的食品 消失了 ,人与 自然的 和谐共 处成了 遥远的 神话, 人与人 的
①含等物质的量浓度 HCN、NaCN 的混合溶液显___________ (填“酸”“碱”或“中”)性,c(CN-)________c(HCN)。溶液 中各离子浓度由大到小的顺序为___________________。 ②若将 c mol·L-1 的盐酸与 0.62 mol·L-1 的 KCN 等体积混合后 恰好得到中性溶液,则 c=________。
专题9 水溶液中的离子反应与平衡
突破 17 四大平衡 常数的综合应用
1.四大平衡常数
符号
水的离子
积常数
Kw
弱电解质电 离平衡常数
Ka 或 Kb
平衡关系式(实例) 及 适用体系
平衡常数表达式
任意水 溶液
弱酸或弱 碱溶液
H2O H++OH- Kw=c(H+)·c(OH-)
HF H++F- Ka=c(Hc+()H·cF()F-)
解析:(1)Kh=c(H+)c(·cN(HN4+H)3·H2O)=KKwb,
c(H+)≈c(NH3·H2O),而 c(NH+ 4 )≈1 mol·L-1。
所以 c(H+)= Kh=
10-14 1.8×10-5
mol·L-1≈2.36×10-5 mol·L-1。
(2)NaOH 电离出的 OH-抑制水的电离平衡,Na2SO3 电离出的 SO23-水解促进水的电离平衡。
四大平衡常数之间的关系(实例) 已知:H2S 的电离常数为 Ka1、Ka2;CdS 的溶度积常数为 Ksp。 ①常温下,Na2S 溶液中,S2-的水解常数为 Kh1,HS-的水解常 数为 Kh2,则 Kh1=Kw/Ka2,Kh2=Kw/Ka1; ②反应 CdS(s)+2H+(aq) Cd2+(ad)+H2S(aq)的平衡常数为 K,则 K=Ksp/(Ka1·Ka2)。
c(Ca2+)=0.005
m
o
l
·L
-
1
,
K
s
p
(
C
a
C
2
O
4
)
=
c
(
C
a
2
+
)
·c
(
C
2
O
2- 4
)
=
2.5×10-9,则 c(C2O24-)=2.50×.00150-9 mol·L-1=5×10-7 mol·L-1。 答案:(1)<
(2)2H++HOOC—COOH+2e-===HOOC—CHO+H2O
2. 相关规律 (1)Qc 与 K 的关系:二者表达式相同,若 Qc<K,平衡正向移动; 若 Qc=K,平衡不移动;若 Qc>K,平衡逆向移动。 (2)平衡常数都只与温度有关,温度不变,平衡常数不变。升高 温度,Ka(或 Kb)、Kw、Kh 均增大,而 Ksp 一般会增大。 (3)Ka(或 Kb)、Kh、Kw 三者的关系式为 Kh=KKwa(或 Kh=KKwb)。
信任成了黄牙小儿的天真妄想。
•
4.浊雾笼罩下的财富不夜城,不仅侵 蚀了星 星的亮 光,而 且泯灭 了心灵 的光芒 ,使我 们的眼 睛近视 、散光 且老花 ,失去 了辨别 真伪、 美丑、 善恶的 天然能 力,使 我们的 心迷茫 且苦闷 。生活 在城市 ,我们 几乎忘 了:夜 ,本该 是黑的 ,本该 是有星 星的, 本该是 安静的 ,本该 带着人 们心安 理得地 歇息的 。
