彗星实验
彗星实验步骤范文

彗星实验步骤范文彗星是一种天体现象,指的是在太阳系内绕太阳运行的一类小天体。
彗星的核心主要由冰和岩石组成,当与太阳接近时,晶体冰会热化并以气体形态释放出来,形成彗尾。
彗星实验可以帮助我们更好地理解彗星的形成和性质。
以下是彗星实验的步骤:材料:-一块冰块-一盆水-一小束干冰-一台射灯或强力手电筒-一个黑暗的室内或夜晚的户外空间步骤1:准备冰块和水在一盆水中放入一块冰块,确保冰块完全浸泡在水中。
这样可以模拟太阳系中的彗核。
步骤2:制作彗尾将一小束干冰放在碗中或任何合适的容器中。
干冰是固态二氧化碳,具有非常低的温度,当它接触到周围的空气时,会迅速蒸发并形成气体。
这模拟了彗星接近太阳时晶体冰的热化过程。
确保干冰不会直接接触到水。
步骤3:创建黑暗环境将彗星模型置于黑暗的室内或夜晚的户外空间中。
这样可以让彗尾更加清晰可见。
步骤4:使用射灯或手电筒将射灯或强力手电筒对准盆中的冰块,并打开它。
这样可以模拟太阳的辐射对彗核的加热作用。
步骤5:观察彗尾的形成当射灯或手电筒照射到冰块上时,干冰会迅速蒸发,并产生一道透明或白色的气体云。
这个气体云模拟了彗尾的形成,它会围绕彗核散开。
步骤6:测量和记录使用测量工具可以测量彗核的直径,以及彗尾的长度和宽度。
同时,记录彗尾的颜色和形态。
步骤7:改变实验条件尝试改变冰块的形状、大小和温度等条件,观察和记录彗尾的变化。
这有助于了解不同条件对彗尾的影响。
步骤8:分析和总结根据观察和记录的数据,分析彗尾的形成和特征。
比较不同实验条件下彗尾的差异,并总结出彗尾的性质和形成机制。
总结:通过这个实验,我们可以更好地理解彗星的形成和性质。
彗尾的形成是由彗核受到太阳辐射的加热而导致晶体冰热化释放出来的气体所形成的。
实验中可以通过改变不同的条件,观察和比较彗尾的差异,更深入地了解彗尾的形成机制。
此外,实验还可以帮助我们理解彗星的形态特征,如彗核的大小、彗尾的长度和宽度等。
在实验的基础上,我们可以进行更深入的研究,以便更好地了解和探索太阳系中的彗星现象。
单细胞凝胶电泳试剂盒(彗星实验)说明书

单细胞凝胶电泳试剂盒(彗星实验)使用说明书一 单细胞凝胶电泳实验介绍单细胞凝胶电泳( Single Cell Gel Electrophoresis, SCGE) 又名彗星试验(comet assay), 1984 年起用于检测的真核细胞的DNA 断裂和修复,具有方法灵敏、快速优点,同时既可以定性又可以定量,目前DNA 损伤检测的其他方法(Giemsa 染色法,TUNUL 法、DNA 电泳梯度法、流式细胞检测法)是无法比拟的。
彗星实验是检测DNA 微损伤和修复的新方法,得到国际遗传毒性检测程序工作会议认可。
彗星实验是简单、快捷检测DNA 微损伤的方法,被广泛应用于遗传毒理、放射生物学、生物监测、癌症化疗和细胞凋亡、衰老等领域。
是一个十分成熟的技术,逐渐成为快速检测DNA损伤的一种方法,尤其应用于新药开发、保健品开发、化妆品开发、环境监测和毒理学研究等领域。
彗星实验具有以下优点:1 适用范围广,不仅适用于静止状态的细胞,且对T 和B 淋巴细胞敏感;2 所需实验器材较少,一台荧光显微镜和一套电泳装置即可完成彗星实验;3 实验流程短,一天可完成一个实验流程,且图像获取和数据分析可隔日完成;4 安全性好,避免了同位素的使用;5 在单细胞水平上对DNA 损伤进行可视性检测;6 准确性好、灵敏度高;7 属于新技术,客观实际,国际遗传毒性学术委员会认可。
二、试剂盒组成(见试剂盒内)三、试剂使用说明(见试剂盒内)四、操作步骤1.各种细胞用冰冷的PBS 洗一次,离心收集,用PBS 重悬,密度为1×104-5个/ml。
2.铺胶:下述各浓度琼脂糖凝胶均用PBS 配制。
3.第1 层凝胶的制备:将加热熔解的正常熔点琼脂糖(NMA),冷至45-60℃,取适量铺于载玻片CometSlide上,再置4℃下10min 使NMA 凝固。
也可以先铺胶,晾干后无尘存放,1周内使用(据经验,此法较优)。
4.第2 层凝胶的制备:低熔点琼脂糖LMA在60-70℃水浴加热至少20min 使之完全溶化,冷至37℃(可以放置于细胞培养箱中或水浴箱冷却至37℃,低熔点琼脂糖LMA在37℃可维持3小时)。
彗星实验要点

1、凋亡细胞的观察:看过国外此法作出的凋亡细胞彗星图像,很漂亮,用CASP软件分析后,其曲线呈典型的双峰,而正常细胞为单峰.我的一些教训:观察凋亡细胞最好把电压、电流、和电泳时间均调低,否则,凋亡细胞中的DNA片断跑的太块,荧光下根本看不到凋亡细胞的尾巴.注:我用的是中性条件,20V,200mA,20min, 凋亡细胞观察宜选用10V,100mA,10min.朋友们如果有异议,请不吝赐教,也对我有所帮助。
2、解旋20分钟应该没问题,但是我认为您的电泳时间过长,当然我不知道您的电泳条件(电压、电流、),我认为20分钟足够了,时间长了一是浪费时间,二是彗星图像不好,不利于分析.您的裂解时间有点短了,文献报道,最好不要少于1.5小时3、一般100ul0.5%低熔点胶中含400个细胞就足够了4、本版【图片仓库】子版有我做的彗星图像,感兴趣可以看看http://www。
dxy。
cn/bbs/post/view?bid=66&id=2729243&sty=1&tpg=1&age=05、注意,CASP只读.tif扩展名的图像,如果你的相机拍摄的图像可以有.tif 格式,就更好了,如果是。
jpg格式,那还要在计算机中转换一下,不过很简单6、首先,荧光染色的东西最好马上看,否则影响结果。
其次,您的染色液量我觉得多了点,我用2ug/ml,1ml注射器1滴就可以。
第三,要忠于实验结果,图象内容不能更改,可以用ACDSEE或PHOTOSHOP 转换图象格式或大小,所以,作出来的实验图象质量要好7、。
背景的选择问题,如果图片质量好的话,背景大小不同,对结果影响不是很大,如果图片背景乱七八糟,那背景框的选择肯定对结果产生很大影响。
我的建议:背景框不要太大,参考我贴的那个图。
注意,背景框可以在细胞的上面或下面,如果背景框在上面时,分析后的图像(分析后出现一个头、尾分明的图像,是基本重合在细胞上的)质量很差,很不规则,那再把背景框调到下面试试,如果还是不好,那只能说你的结果质量不好了.背景框的选择关键在于分析同一批细胞,背景框要相同,才能保持资料的可比性。
彗星实验

彗星实验(Comet assay),又称单细胞凝胶电泳(Single cell gel electrophoresis,SCGE),各种理化因子作用细胞后引起的DNA链的断裂可用该方法检测[1~3],并在统计学基础上对损伤程度做出评估[4]。
本实验对Singh 等[5]建立的碱性彗星实验的一些步骤作了改良。
用超净工作台上的紫外消毒灯[可发射波长为254 nm的紫外线(Ultraviolet,UV),属于UVC波段范围]作为DNA损伤的诱导因子[7~9],诱导K562细胞DNA损伤,用改良彗星实验检测损伤程度,验证改良的实验系统是否可靠,同时筛选并评价DNA损伤的分析指标。
1 材料与方法1.1 细胞K562细胞,来源于第四军医大学免疫学教研室,37 ℃、5% CO2培养箱中培养,取对数期细胞进行实验。
1.2 紫外线照射装置紫外消毒灯(ZSZ-20型,20 W,天津市紫晶特种光源有限公司)。
1.3 主要试剂和仪器培养基:10%新生牛血清(杭州四季青公司),90%RPMI-1640培养液(Hyclone公司);双抗(青、链霉素,100 UI/ml);TritonX-100(Genview分装);二甲基亚砜、肌苷酸钠(Sigma分装);低熔点琼脂糖(FMC 分装);常熔点琼脂糖(Spanish分装)。
其余生化试剂均为分析纯。
电泳仪:由西北大学物理系提供;电泳槽:DYC33A型(北京市六一仪器厂);显微镜:Leica DM LB 2 (Leica 公司);彗星图象分析软件:CASP软件(casp-1.2.21.4 实验分组及UV处理收集对数生长的K562细胞,台盼蓝染色计数,细胞活力大于95%,用Hank's(pH7.4)调整细胞密度至1×105/ml,接种于塑料培养皿中(ф=35 mm,2 ml/plate),然后进行紫外线照射(0.3 mW/cm2)。
实验分为对照组和8个照射组,各照射组分别照射3、5、10、40,60、120、180、240 s,对照组不进行紫外线照射,之后进行彗星实验。
彗星实验

玻片、琼脂糖、细胞裂解液、碱性解链溶液(PH>13,200mM NaOH,1Mm EDTA)、电泳槽、超纯水、DAPI、PBS、荧光显微镜。
实验步骤:
1.制片:,用吸水纸将玻片滑面及四周吸干,自然晾干备用;
2.细胞处理:将细胞消化收集,离心后吸弃上清,用预冷的1*PBS清洗细胞一次,以1*10^5细胞/ml悬浮细胞;
彗星实验
彗星实验又称单细胞凝胶电泳实验。
实验原理:它能有效地检测并定量分析细胞中DNA单,双链缺口损伤的程度。当各种内源性和外源性DNA损伤因子诱发细胞DNA链断裂时,其超螺旋结构受到破坏,在细胞裂解液作用下,细胞膜、核膜等膜结构受到破坏,细胞内的蛋白质、RNA以及其他成分均扩散到电解液中,而核DNA由于分子量太大不能进入凝胶而留在原位。在中性条件下,DNA片段可进入凝胶发生迁移,而在碱性电解质的作用下,DNA发生解螺旋,损伤的DNA断链及片段被释放出来。由于这些DNA的分子量小且碱变性为单链,所以在电泳过程中带负电荷的DNA会离开核DNA 向正极迁移形成"彗星"状图像,而未受损伤的DNA部分保持球形。DNA受损越严重,产生的断链和断片越多,长度也越大,在相同的电泳条件下迁移的DNA量就愈多,迁移的距离就愈长。通过测定DNA迁移部分的光密度或迁移长度就可以测定单个细胞DNA损伤程度,从而确定受试物的作用剂量与DNA损伤效应的关系。该法检测低浓度遗传毒物具有高灵敏性,研究的细胞不需处于有丝分裂期。同时,这种技术只需要少量细胞。
3.铺胶:将细胞与凝胶以一定的比例(1:10)混匀后迅速滴于玻片上,在显微镜下观察细胞的数目(注意调整比例及铺板均匀),4℃黑暗环境中固化10min;
4.裂解:轻轻取出玻片,将玻片浸于预冷的细胞裂解液中,4℃避光裂解30-60min;
体内彗星试验

附件15体内彗星试验In Vivo Mammalian Alkaline Comet Assay1 范围本规范确定了体内彗星试验的基本原则、要求和方法。
本规范适用于化妆品原料的遗传毒性检测。
2 试验目的评价化妆品用原料的遗传毒性。
3 定义3.1 碱性单细胞凝胶电泳:在单个细胞或细胞核水平检测DNA损伤的一种敏感技术。
3.2 彗星:经过电泳后细胞核的形状,形似彗星。
细胞核部分形成彗星头部,在电场力的作用下脱离细胞核的DNA片断形成彗尾。
3.3 “刺猬状”细胞:显微图像下由小或模糊不清的头以及大的弥漫性尾组成的细胞。
3.4 尾部DNA含量:反应总强度(彗头与彗尾之和)中彗星的强度。
可反应DNA片断的数量,用百分比表示。
3.5 最大耐受剂量:试验期内引起动物产生轻微毒性效应的最高剂量,在这个剂量下,动物产生明显的临床体征,如异常行为或反应,轻微的体重下降或靶组织细胞毒性,但是并不会引起死亡或痛苦。
4 试验原理DNA双螺旋结构在强碱性溶液中(pH>13)会松弛,在电场力的作用下,正常的DNA 保留在原位不动,而单链或双链DNA断裂所形成的DNA片断在会向阳极移动,形成彗星状。
DNA片断所形成的彗星状拖尾的长度及强度可以反应DNA片断的大小和数量。
通过检测尾部DNA含量(%)等终点指标可以评价DNA损伤程度。
5 试验基本原则动物染毒一定时间后处死并解剖动物,获取靶器官,制备单细胞悬液。
单细胞悬液与琼脂糖混合后经过裂解过程去除细胞膜,并暴露于强碱性溶液(pH>13)中进行DNA解旋,经过电泳、固定、染色,在荧光显微镜下观察,通过分析软件对彗星状细胞进行分析,判定DNA损伤程度。
每个样品需分析足够数量的细胞进行最终结果评价。
6 溶液的配制(所有溶液均现用现配)6.1 0.5%(w/v) 低熔点凝胶低熔点胶以0.5%(w/v)的浓度溶于D-PBS(无Ca2+、Mg2+和酚红)溶液中,并利用微波炉加热。
彗星试验

单细胞凝胶电泳分析法单细胞凝胶电泳分析法(彗星分析法)治愈癌症是一个难题,长期以来科学家们一直在苦苦探索.我们目前知道,致癌的过程与许多因素有关,但如果我们能阻止其中的任何一个步骤,癌细胞便无法形成。
因此,探测致癌物质的技术与癌细胞的及时发现就显得尤其重要!然而截至目前为止,科学家们仍无法研究出一种简易基因测试法或综合的方法来检测出可能的致癌物。
因此,致癌物对DNA的作用仍是癌症研究的一个重要课题。
遗传毒物学为一专门研究化学及各类物质对人体遗传基因影响的科学。
人体每天暴露在大量的化学物质当中,为了诊测这些物质对人体DNA的影响,科学家们发明了多种测定方法,然而,多年来人们所使用的这些测试方法却不能准确与快速的辨识出会使人体致癌的物质。
为了解决这些问题,单细胞凝胶电泳法(Single Cell Gel Assay)应运而生,通常亦称之彗星分析法(Comet Assay)。
它之所以称为彗星分析法是因为被破坏的DNA形似彗星,此方法已被证实是最具敏感性又最具快速性的方法。
研究人员使用这种方法可在24小时内获得初步结果,在十天之内能得到结论性的证据。
此种测定方法速度远快于其它方法,不仅可以测出某种物质是否是致癌物,而且还可测出被破坏细胞的损害程度。
彗星分析法是用来判别某种物质是否是致癌物,并衡量其对人体DNA修补的影响程度,这一分析过程是将健康的人体白血球接触于被测试的物质后,然后再用彗星分析法来进行测试,如果被测试的物质是致癌物质,那么DNA将被破坏,而被损坏的DNA将开始游离细胞核,形成彗星形状。
DNA受到致癌物质的损坏愈大,DNA碎段就愈多,愈小的DNA碎段游离的速度就愈快,也游离愈远,因而形成了彗星的尾部,而较大的一些碎段位置则靠近细胞核,因而形成彗星的头部。
DNA碎段的游动的程度不同 使它呈现出彗星状,使研究人员能很容易看清细胞的损害程,彗星的长度与DNA的损害程度有关,此长度是指从细胞核到彗星尾端的距离,也就是说,彗星尾端愈长,细胞的损害程度愈大。
彗星实验

彗星实验收集目标细胞:处死小鼠后,迅速分离肝脏,选取最左叶肝脏,在4℃放置2h的PBS溶液中多次清洗,直至看不到血液。
将肝组织至于含有2 mL4℃PBS 溶液的小烧杯中,用小剪刀剪碎(2-3 mm)。
台盼蓝排斥法检测细胞活力,细胞存活率大于95%方可用于实验,调整细胞密度为5×105-106个/ml。
此步在暗室中进行。
制片:取100 μL置于45℃预热的0.75% NMA滴加于载玻片一侧,迅速盖上盖玻片(24 mm×50 mm),注意不要产生气泡,至4 ℃凝固约20分钟后轻轻移去盖玻片。
吸取10 μL待检测的细胞悬液与100 μL 37℃预热的0.75% LMA混匀,迅速将细胞混悬液滴加到第一层凝固的NMA上,再迅速盖上盖玻片使其均匀铺开,同样需避免起泡。
将玻片至4℃凝固约30 min,操作注意避光,每只动物制作三张平行片。
裂解:轻轻移去盖玻片,将载玻片水平轻缓浸入4℃预冷的裂解液(pH= 10),于4℃避光放置1 h。
解旋:轻轻拿出载玻片,浸入PBS缓冲液5 min,用滤纸吸去多余水分后放入电泳槽。
玻片并列放置,不留空隙。
将新鲜配置的冰冷电泳缓冲应用液轻轻倒入电泳槽,使液面完全覆盖载玻片,放置20 min解旋。
避光进行。
电泳:根据预实验,设置电泳仪25V、300 mA电泳20 min。
避光进行。
中和:切断电源,小心取出玻片,置染缸,中和缓冲液浸洗,3次×5 min/次。
脱水保存:从电泳仪中轻轻取出载玻片,浸入PBS缓冲液2次×5 min/次。
吸干周围水分后放入乙醇脱水,约1 h后取出自然晾干保存。
染色:在玻片上滴加EB染色液50 μL(5 μg/mL)染色,盖上新盖玻片。
用滤纸吸去多余染料,于2 h内使用荧光显微镜镜检。
镜检:EB染色后,未受损细胞在镜下表现为为圆形荧光核心,只有彗星头部,没有明显的尾。
受损细胞则有彗星尾伸向正极,形成一个亮的头部和尾部,形似彗星。
彗星实验

彗星实验(Comet assay),又称单细胞凝胶电泳(Single cell gel electrophoresis,SCGE),各种理化因子作用细胞后引起的DNA链的断裂可用该方法检测[1~3],并在统计学基础上对损伤程度做出评估[4]。
本实验对Singh 等[5]建立的碱性彗星实验的一些步骤作了改良。
用超净工作台上的紫外消毒灯[可发射波长为254 nm的紫外线(Ultraviolet,UV),属于UVC波段范围]作为DNA损伤的诱导因子[7~9],诱导K562细胞DNA损伤,用改良彗星实验检测损伤程度,验证改良的实验系统是否可靠,同时筛选并评价DNA损伤的分析指标。
1 材料与方法1.1 细胞K562细胞,来源于第四军医大学免疫学教研室,37 ℃、5% CO2培养箱中培养,取对数期细胞进行实验。
1.2 紫外线照射装置紫外消毒灯(ZSZ-20型,20 W,天津市紫晶特种光源有限公司)。
1.3 主要试剂和仪器培养基:10%新生牛血清(杭州四季青公司),90%RPMI-1640培养液(Hyclone公司);双抗(青、链霉素,100 UI/ml);TritonX-100(Genview分装);二甲基亚砜、肌苷酸钠(Sigma分装);低熔点琼脂糖(FMC 分装);常熔点琼脂糖(Spanish分装)。
其余生化试剂均为分析纯。
电泳仪:由西北大学物理系提供;电泳槽:DYC33A型(北京市六一仪器厂);显微镜:Leica DM LB 2 (Leica 公司);彗星图象分析软件:CASP软件(casp-1.2.2,/index.php下载);CO2培养箱:BB16HF型(上海力申科学仪器有限公司);环地牌紫外辐照计(北京师范大学光电仪器厂)。
1.4 实验分组及UV处理收集对数生长的K562细胞,台盼蓝染色计数,细胞活力大于95%,用Hank's(pH7.4)调整细胞密度至1×105/ml,接种于塑料培养皿中(ф=35 mm,2 ml/plate),然后进行紫外线照射(0.3 mW/cm2)。
彗星实验

Comet Assay 彗星分析系统软件功能:彗星试验-单细胞凝胶电泳Single cell gel electrophoresis是一种快捷、高灵敏度的检测DNA受损的方法.Comet Assay 专业彗星试验图像分析软件,提供专业快速的测量方法。
测量指标包括头半径,尾长度,积分光密度,头/尾DNA含量比例,尾矩,Olive 矩等多种参数。
具有自动或手动调节分割彗星头部和尾部功能同时提供对双染色系统的分析系统可广泛用于环境毒理学中对DNA具有损伤作用的分析:如紫外光、电离辐射、氧自由基等因素造成的DNA损伤。
以及细胞凋亡,抗癌药物的药物毒理学研究,遗传毒理研究和肿瘤治疗的跟踪监测等单细胞凝胶电泳(彗星试验):原理、应用和局限性彗星试验:原理、应用和局限性1. 前言过去十年中,彗星试验或单细胞凝胶电泳(SCGE)已成为一个评定DNA损伤的标准方法,广泛应用于遗传毒性试验、人类生物监测和分子流行病学、生态毒理学以及DNA损伤修复的基础研究,且因其简单、灵敏、多功能、快速、经济实用而赢得了广大科研工作者的青睐,和其有关的文献数目逐年上升。
在应用彗星试验时不会过多去考虑它如何运作和它提供何种信息,因为它在论证DNA损伤中的成功已足以证明它的价值。
这一点实在太可惜,因为它不仅能告诉我们细胞内存在的损伤的类型,而且能告诉我们损伤的程度。
尽管彗星试验是检测DN A断裂的基本方法,但由于对特异性核酸内切酶损伤的引入使其可以检测紫外线诱导的嘧啶二聚体,氧化碱基和烷基化损伤。
2.检测原理和检测指标2.1 背景二十世纪七十年代,Peter Cook和其同事们制定了一种用非离子去污剂使细胞溶解来研究核结构的方法。
这种处理除去胞膜、胞质和核质,并使核小体破裂(几乎所有的组蛋白均被浓盐提取),剩下的就是由核基质或RNA、蛋白质组成的支架以及DNA所构成的类核,其DNA的双螺旋以核小体的组蛋白为核心形成负超螺旋结构。
超螺旋的存在使DNA不能自由旋转,Cook 等提出一个模型,DNA间断的附加于基质,有效的形成一系列环状、而不是线性分子。
彗星实验_精品文档

彗星实验引言彗星一直以来都是天文学家们极感兴趣的研究对象。
这些神秘的天体经常在夜空中出现,但它们的起源和特性仍然是一个谜。
为了更好地理解彗星,科学家们进行了许多实验研究,探索彗星的成因、组成和行为。
本文将介绍一些与彗星相关的实验研究,以及这些实验对科学理解的贡献。
一、彗星的成因实验彗星的成因一直是科学家们关注的焦点。
根据现代天文学的认识,彗星由冰和尘埃组成的核心围绕太阳运行而形成,当彗星靠近太阳时,由于太阳的热量,核心表面的冰会汽化并形成彗尾。
为了验证这一理论,科学家进行了一系列实验。
实验1:模拟彗星核心科学家使用低温环境下的实验设备,模拟了彗星核心的条件。
他们将不同比例的冰和尘埃混合物注入真空箱中,然后通过控制温度和压力来模拟彗星附近的条件。
结果显示,当冰暴露在太阳热量下时,会出现蒸发现象,形成气体云团。
实验2:热解冰的实验为了更好地理解彗星冰的汽化过程,科学家进行了热解冰的实验。
他们使用激光或加热器对不同类型的冰进行加热,观察其汽化速率和生成的气体成分。
通过这些实验,科学家发现不同类型的冰具有不同的汽化温度和成分。
这些发现有助于推动彗星的起源研究。
二、彗星成分的研究实验除了了解彗星的成因外,科学家们还对彗星的成分进行了深入研究。
彗星的核心主要由冰、岩石和有机物质组成。
为了确定彗星的成分,科学家开展了一系列实验。
实验3:分析彗星样本在现实情况下,样本收集是非常困难的,因为彗星的远离地球。
然而,科学家有机会分析来自彗星的尘埃颗粒和气体,这些尘埃和气体是由彗星释放的。
通过采集和分析这些样本,科学家能够了解彗星中存在的化学物质和元素。
实验4:模拟彗星成分为了更好地理解彗星的成分,科学家基于已有的数据和实验结果,制作了模拟彗星成分的实验材料。
这些材料通常由冰、尘埃和有机物质组成,以模拟彗星核心的成分。
科学家通过研究和分析这些模拟物质,进一步了解彗星成分的可能性。
三、彗星行为的实验研究除了了解彗星的成因和成分外,科学家们还对彗星的行为进行了实验研究。
彗星实验量化步骤

彗星实验是一种用于测量DNA损伤的实验方法,其量化步骤如下:
1.细胞处理:将待测细胞进行处理,例如加入化学物质或辐射等,以诱导DNA损伤。
2.细胞裂解:将处理后的细胞进行裂解,使细胞内的DNA暴露出来。
3.电泳:将裂解后的细胞进行电泳分离,一般采用琼脂糖凝胶电泳,将DNA片段按大小分离。
4.染色:将电泳后的DNA染色,通常采用ethidium bromide或SYBR Green等染料,以便观察和记录DNA损伤情况。
5.成像:将染色后的凝胶置于紫外线下进行成像,以记录DNA损伤情况。
6.分析:使用专业软件对成像结果进行分析,计算DNA损伤程度的量化指标,例如尾部长度、尾部强度等。
7.统计分析:对实验数据进行统计学分析,例如t检验、方差分析等,以确定DNA 损伤是否具有显著差异。
彗星分析实验:单细胞凝胶电泳
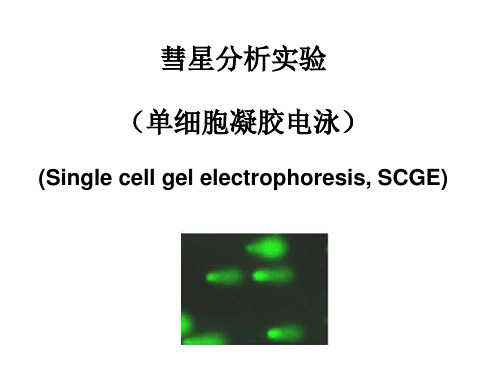
实验步骤
6. 中和、染色
– 将载玻片置于大平皿中,用中和液中和2~3次, 4℃,每次 15min
– 用滤纸将缓冲液吸干 – 每凝胶滴加100 μl AO, 染色20min (避光) ; – 将玻片在蒸馏水中漂洗(避光)。
实验步骤
7. 观察、拍照和分析:
– 置荧光显微镜下,拍照 – 用专用的软件进行分析。
彗星的测量
• 尾长,彗星头部中心到尾部最远端的距离。
– 尾长只在相对低的损伤水平增加,随后损伤剂 量增加时,尾部光密度增加,而尾长不变
彗星的测量
• 头尾光密度比,通常以尾部DNA量占全部 DNA量的百分比表示。
– 与损伤频率成线性关系,受阈值设定的影响较 小,并在最大范围内分辨损伤(理论上,尾部 DNA从0%-100%)
基本原理
• 若细胞受损,在碱性电泳液(pH>13)中, DNA双链解螺旋且碱变性为单链,单链断 裂的碎片分子量小可进入凝胶中,电泳时 断链或碎片离开核DNA向阳极迁移,形成 拖尾。
基本原理
• 细胞核DNA 受损伤越严重,产生的断链就越多, 片段也越小,电泳表现为尾长增加和尾部荧光 增强。
• 因此,通过测定DNA 迁移部分的光密度或迁移 长度就可定量测定单个细胞损伤的程度。
玻片上使胶均匀展开,室温固化10min
实验步骤
2. 制片:第2 层凝胶的制备 • 将细胞与0.7%LMA 混合均匀(体积比1/9) • 迅速将适量(100~200μl)含细胞的LMA
滴到第1 层琼脂糖上,室温固化10min
实验步骤
3. 细胞裂解: • 将玻片置于平皿中,轻轻加入预冷的新鲜
配置的细胞裂解液。4℃下避光裂解2-3h; • 取出载玻片用PBS漂洗2次(要求动作轻柔,
彗星实验要点

彗星实验要点彗星是太阳系中的天体,由冰和尘埃组成。
研究彗星有助于我们了解宇宙的起源和演化过程。
在进行彗星实验时,需要注意以下要点:一、实验目的:实验的目的是观察和研究彗星的结构、成分以及行为规律,为研究宇宙的起源和演化提供数据和依据。
二、实验材料:1. 彗星模型:用于模拟真实彗星的结构和成分。
可采用球形模型,表面覆盖冰块和尘埃颗粒。
2. 光源:提供照明,以便观察彗星的亮度和行为。
3. 显微镜:用于放大观察彗星的细节和变化。
4. 光谱仪:用于分析彗星发出的光谱,确定其成分。
三、实验步骤:1. 准备工作:清洁实验器材,确保实验环境无尘、没有杂质。
2. 彗星模型的制作:按照彗星的特征,制作一个模拟彗星的球形模型,并在表面覆盖一层冰块和尘埃颗粒。
3. 光源照明:将光源照射在彗星模型上,观察彗星的亮度变化。
4. 显微镜观察:使用显微镜放大观察彗星模型的细节,并记录下变化和特征。
5. 光谱分析:使用光谱仪对彗星发出的光谱进行分析,确定彗星的成分。
四、实验注意事项:1. 安全第一:在实验进行过程中,要遵循实验室安全规范,避免任何可能的危险。
2. 实验环境:保持实验环境的稳定和整洁,避免影响实验结果。
3. 观察细节:在观察彗星模型时,要仔细观察和记录下彗星的细节变化,包括亮度、颜色、飘尾等。
4. 精确测量:在进行光谱分析时,要确保测量的准确性和精度,注意仪器的校准。
5. 结果分析:基于实验所观察到的数据和现象,进行合理的分析和推理,得出结论。
五、实验结果与讨论:1. 根据光谱分析的结果,确定彗星中的成分,如水、氨、甲烷等。
2. 分析彗星模型的亮度变化和飘尾现象,研究彗星的活动规律和运动轨迹。
3. 结合已有的彗星观测数据和理论模型,对实验结果进行讨论和比较。
六、实验结论:实验结果表明,彗星是由冰和尘埃组成的天体,其活动和运动受到多种因素的影响。
彗星实验为研究宇宙的起源和演化提供了重要的数据和依据。
七、实验的意义与展望:通过彗星实验,我们可以更好地了解彗星的结构、成分和活动规律,进一步探索宇宙的奥秘。
彗星实验

彗星实验(Comet assay),又称单细胞凝胶电泳(Single cell gel electrophoresis,SCGE),各种理化因子作用细胞后引起的DNA链的断裂可用该方法检测[1~3],并在统计学基础上对损伤程度做出评估[4]。
本实验对Singh等[5]建立的碱性彗星实验的一些步骤作了改良。
用超净工作台上的紫外消毒灯[可发射波长为254 nm的紫外线(Ultraviolet,UV),属于UVC 波段范围]作为DNA损伤的诱导因子[7~9],诱导K562细胞DNA损伤,用改良彗星实验检测损伤程度,验证改良的实验系统是否可靠,同时筛选并评价D N A损伤的分析指标。
1 材料与方法1.1 细胞K562细胞,来源于第四军医大学免疫学教研室,37 ℃、5%CO2培养箱中培养,取对数期细胞进行实验。
1.2 紫外线照射装置紫外消毒灯(ZSZ-20型,20 W,天津市紫晶特种光源有限公司)。
1.3 主要试剂和仪器培养基:10%新生牛血清(杭州四季青公司),90% RPMI-1640培养液(Hyclone公司);双抗(青、链霉素,100 UI/ml);Triton X-100(Genview分装);二甲基亚砜、肌苷酸钠(Sigma分装);低熔点琼脂糖(FMC分装);常熔点琼脂糖(Spanish分装)。
其余生化试剂均为分析纯。
电泳仪:由西北大学物理系提供;电泳槽:DYC33A型(北京市六一仪器厂);显微镜:Leica DM LB 2 (Leica 公司);彗星图象分析软件:CASP 软件(casp-1.2.21.4 实验分组及UV处理收集对数生长的K562细胞,台盼蓝染色计数,细胞活力大于95%,用Hank's(pH7.4)调整细胞密度至1×105/ml,接种于塑料培养皿中(ф=35 mm,2 ml/plate),然后进行紫外线照射(0.3 mW/cm2)。
实验分为对照组和8个照射组,各照射组分别照射3、5、10、40,60、120、180、240 s,对照组不进行紫外线照射,之后进行彗星实验。
彗星实验原理和方法

彗星实验原理和方法彗星是太阳系中一种具有尾巴的天体,主要由冰和尘埃组成。
彗星实验是通过模拟彗星状况来研究其物理性质和行为的实验。
彗星实验的原理是利用实验室中的设备和材料模拟彗星的环境和特征,从而观察和测量彗星相关现象。
本文将介绍彗星实验的原理和方法。
彗星实验的原理基于以下几个重要因素:彗星的组成、彗星的运动、彗星的进化过程。
彗星主要由冰和尘埃组成,当彗星靠近太阳时,太阳的辐射会使冰融化并形成尾巴;彗星的运动受到引力的影响,会围绕太阳轨道运动;彗星是古老物质的遗迹,可以提供有关太阳系形成和演化的信息。
彗星实验可以采用不同的方法和设备进行,下面是一种常见的彗星实验方法。
材料准备:-细粒子状尘埃:可以使用石英粉末或其他微尘颗粒。
-液态冰:可以使用液态氮或液态二氧化碳,用于模拟彗星的冰质。
-模拟太阳光源:可以使用激光或强光作为太阳光源。
步骤:1.准备一个实验室内的真空室,可以模拟外太空的真空环境。
2.在真空室内,制备一块透明板,将细粒子状尘埃均匀地撒在板上,形成尘埃层。
3.涂抹一层透明粘合剂在尘埃层上,使其牢固粘在板上。
4.用液态冰均匀地喷洒在尘埃层上,形成冰层。
5.在一侧装置模拟太阳光源,将激光或强光聚焦在冰层上。
6.开启真空室,创建接近真空的环境,同时以控制速度旋转冰层。
7.开启模拟太阳光源,照射在旋转的冰层上。
8.观察实验现象并进行记录和测量。
主要关注冰的蒸发和尘埃的运动情况。
彗星实验的结果可以提供有关彗星物理性质和行为的信息。
例如,可以通过观察冰的蒸发和尘埃的运动模式来研究彗星尾巴的形成和演化过程;可以测量冰的蒸发速率和尘埃的扩散速度,从而了解彗星的物质损失和彗星尾巴的演化机制。
彗星实验的优点是可以在控制条件下进行观察和测量,可以重复实验以验证结果。
然而,由于彗星的复杂性和特殊性,彗星实验仍然有一定的限制和挑战,需要进一步的研究和改进。
总之,彗星实验通过模拟彗星环境和特征,可以研究彗星的物理性质和行为。
彗星实验

1.制片第一层胶: 将预热45℃的80ul, 0.6% 的正常熔点琼脂糖(NMA ) 滴在磨砂载玻片的磨砂面上, 迅速用一干净玻片边缘将胶铺平, 或加盖盖玻片压平胶面, 将玻片臵保湿盒内,4℃,10 min 使胶凝固。
第二层胶: 将10ul 待测细胞悬液盒75ul, 0.6% 的低熔点琼脂糖(LMA ) 在37℃混匀,滴在第一层胶板上(加盖玻片者需先轻轻揭去盖玻片) , 迅速加干净的盖玻片使胶铺平, 将玻片臵保湿盒内, 4℃,10 min使胶凝固。
第三层胶: 在凝固的LMA 层上滴加37℃,0.6%LMA,盖上盖玻片,使其凝固。
铺第一层胶的目的是使第二层胶平整、附着紧密, 铺第三层胶的目的是对第二层胶中的细胞起保护作用。
2.裂解移去盖玻片, 将载玻片水平浸入新配臵的预冷4℃裂解液( 2.5 mol/LNaCl, 100mmol/L Na2EDTA,10 mmol/L Tris, 1%肌氨酸钠, pH = 10, 用前加入1% 体积的Triton X2100, 10%二甲亚砜) 中至少1小时。
此步骤的目的是溶解细胞膜及核膜, 除去蛋白质、RNA 等, 仅存留核骨架。
3.解旋从裂解液中取出载玻片, 用蒸馏水浸泡或PBS 冲洗, 洗去胶表面的盐溶液然后将载玻片臵于水平电泳槽中, 倒入新配制的碱性电泳缓冲液(1 mmol/L Na2EDTA,300 mmol/L NaOH, pH = 13), 约没过胶面0.25cm 左右, 碱解旋20~40 min, 以便使DNA 在碱性条件下解旋成单链DNA,使DNA 断片在电泳场中易于迁移。
4.电泳电压25V,电流300mA,低温避光,电泳20~40min。
5.中和将载玻片取出,用0.4 mmol/L Tris 缓冲液(pH = 7.5) 中和2~3 次, 每次5~15 min, 以除去碱和去污剂,以免影响染色效果。
6.染色观察根据显微镜的滤镜种类选择染色剂。
常用吖啶橙(2mg/L)、溴化乙啶(20mg/L)、碘化丙啶(2.5~5.0 mg/L )、4,6-联脒-2-苯基吲哚(5 mg/L )或苯并嗯唑啉2-2喹啉等, 用量50~ 100ul, 滴臵胶板上, 盖上盖玻片, 24小时内检测, 时间过长将导致荧光减弱。
彗星实验原理

彗星实验原理一、引言彗星是天文学中的一种天体,由于其不规则的形状和长尾巴的特征,备受人们关注。
为了更好地研究彗星,科学家们开展了许多实验,其中最著名的就是彗星实验。
本文将详细介绍彗星实验的原理。
二、什么是彗星实验彗星实验是一种用于模拟彗星运动轨迹的实验。
科学家通过在实验室中制造类似于彗星运动轨迹的物理环境,来研究和探索这些天体。
三、原理1. 引力作用在太阳系中,每个天体都会受到其他天体的引力作用。
这种引力作用会影响它们的运动轨迹。
同样地,彗星也会受到太阳和其他行星的引力作用,并且其运动轨迹也会因此发生变化。
2. 离心力作用除了引力作用外,离心力也会影响彗星运动轨迹。
当一个物体在高速旋转时,它所受到的离心力就越大。
同样地,在太阳系中旋转速度快的行星和卫星所受到的离心力也会更大。
3. 摩擦力作用摩擦力是指当一个物体在介质中运动时,由于介质的阻力而产生的一种力。
对于彗星来说,其尾巴所处的空间中存在着一定的气体和尘埃,因此彗星在运动过程中也会受到摩擦力的作用。
4. 实验装置为了模拟彗星运动轨迹,科学家们通常使用一个旋转的圆盘来代表太阳,并在圆盘上放置一些小球来代表行星和卫星。
然后将一个小球(代表彗星)放置在圆盘上,并让它开始旋转。
通过改变圆盘的旋转速度、小球之间的距离以及小球之间的质量等因素,科学家们可以模拟出不同情况下彗星运动轨迹的变化。
四、应用通过彗星实验,科学家们可以更好地理解和研究太阳系中各个天体之间的相互作用关系,从而更好地预测和解释彗星运动轨迹上出现的各种现象。
此外,还可以借助实验结果来验证天文观测数据的准确性,并为未来的天体探测任务提供指导。
五、结论彗星实验是一种用于模拟彗星运动轨迹的实验,其原理主要包括引力作用、离心力作用和摩擦力作用等因素。
通过这种实验,科学家们可以更好地研究和解释彗星运动轨迹上出现的各种现象,并为未来的天体探测任务提供指导。
彗星实验原理

彗星实验原理引言:彗星是宇宙中一种常见的天体,它们由冰和尘埃组成,随着它们接近太阳,冰会融化并释放出尘埃和气体,形成美丽的尾巴。
彗星实验旨在模拟彗星的形成和演化过程,以深入研究它们的物理特性和化学成分。
本文将介绍彗星实验的原理和相关实验方法。
一、原理:彗星实验的基本原理是模拟宇宙中的低温和真空环境,使冰体受到太阳光辐射和其他外部因素的影响而产生物质的释放和形态变化。
主要包括以下几个方面:1.1 低温环境模拟在彗星实验中,科学家使用低温设备或液氮等冷却剂将实验室温度降低到接近宇宙中的低温环境,通常在几十到几百摄氏度以下。
这样可以使冰体保持固态,并模拟宇宙中的低温条件。
1.2 真空环境模拟为了模拟宇宙中的真空环境,彗星实验通常在高真空条件下进行。
科学家使用真空泵将实验室内的气体抽取,降低压强,使实验室内的气体浓度接近于零,以模拟真空环境。
1.3 光辐射模拟彗星实验中,科学家使用光源模拟太阳光辐射,照射到冰体上。
太阳光中的紫外线和其他辐射能够加热冰体并引起其物质的释放和变化。
二、实验方法:彗星实验的具体方法可以根据研究目的和实验条件的不同而有所差异。
下面介绍几种常见的实验方法。
2.1 冰体加热实验科学家将冰体放置在真空室内,并通过光源照射冰体,加热冰体表面。
随着冰体受热,冰体内的冰开始融化,并释放出尘埃和气体。
科学家可以通过观察和分析释放物质的特性来研究彗星的物理和化学性质。
2.2 冰体射流实验科学家将冰体装置在喷嘴中,并通过真空泵抽取气体,使喷嘴内部形成真空环境。
然后,科学家通过加热冰体,使冰体融化并形成射流。
通过观察射流的形态和特性,科学家可以了解冰体在真空环境下的行为和变化。
2.3 冰体基质实验科学家将冰体与其他物质(如尘埃、有机物等)混合,并模拟宇宙中的条件。
通过研究冰体与其他物质之间的相互作用,科学家可以推测彗星中的化学成分以及其形成和演化过程。
三、实验结果及意义:彗星实验的实验结果可以提供有关彗星物理特性和化学成分的重要信息,并对我们理解彗星的起源和演化提供帮助。
彗星实验

彗星实验————————————————————————————————作者: ————————————————————————————————日期:ﻩ彗星实验(Comet assay),又称单细胞凝胶电泳(Single cell gelelectrophoresis,SCGE),各种理化因子作用细胞后引起的DNA链的断裂可用该方法检测[1~3],并在统计学基础上对损伤程度做出评估[4]。
本实验对Singh等[5]建立的碱性彗星实验的一些步骤作了改良。
用超净工作台上的紫外消毒灯[可发射波长为254 nm的紫外线(Ultraviolet,UV),属于UVC波段范围]作为DNA损伤的诱导因子[7~9],诱导K562细胞DNA损伤,用改良彗星实验检测损伤程度,验证改良的实验系统是否可靠,同时筛选并评价DNA损伤的分析指标。
1材料与方法1.1 细胞K562细胞,来源于第四军医大学免疫学教研室,37 ℃、5% CO2培养箱中培养,取对数期细胞进行实验。
1.2 紫外线照射装置紫外消毒灯(ZSZ-20型,20 W,天津市紫晶特种光源有限公司)。
1.3主要试剂和仪器培养基:10%新生牛血清(杭州四季青公司),90% RPMI-1640培养液(Hyclone公司);双抗(青、链霉素,100 UI/ml);Trito nX-100(Genview分装);二甲基亚砜、肌苷酸钠(Sigma分装);低熔点琼脂糖(FMC分装);常熔点琼脂糖(Spanish分装)。
其余生化试剂均为分析纯。
电泳仪:由西北大学物理系提供;电泳槽:DYC33A型(北京市六一仪器厂);显微镜:Leica DM LB 2 (Leica公司);彗星图象分析软件:CASP软件(casp-1.2.2,下载);CO2培养箱:BB16HF型(上海力申科学仪器有限公司);环地牌紫外辐照计(北京师范大学光电仪器厂)。
1.4实验分组及UV处理收集对数生长的K562细胞,台盼蓝染色计数,细胞活力大于95%,用Han k's(pH7.4)调整细胞密度至1×105/ml,接种于塑料培养皿中(ф=35 mm,2 ml/plate),然后进行紫外线照射(0.3 mW/cm2)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
彗星实验(Comet assay),又称单细胞凝胶电泳(Single cell gel electrophoresis,SCGE),各种理化因子作用细胞后引起的DNA链的断裂可用该方法检测[1~3],并在统计学基础上对损伤程度做出评估[4]。
本实验对Singh 等[5]建立的碱性彗星实验的一些步骤作了改良。
用超净工作台上的紫外消毒灯[可发射波长为254 nm的紫外线(Ultraviolet,UV),属于UVC波段范围]作为DNA损伤的诱导因子[7~9],诱导K562细胞DNA损伤,用改良彗星实验检测损伤程度,验证改良的实验系统是否可靠,同时筛选并评价DNA损伤的分析指标。
1 材料与方法细胞K562细胞,来源于第四军医大学免疫学教研室,37 ℃、5% CO2培养箱中培养,取对数期细胞进行实验。
紫外线照射装置紫外消毒灯(ZSZ-20型,20 W,天津市紫晶特种光源有限公司)。
主要试剂和仪器培养基:10%新生牛血清(杭州四季青公司),90%RPMI-1640培养液(Hyclone公司);双抗(青、链霉素,100 UI/ml);TritonX-100(Genview分装);二甲基亚砜、肌苷酸钠(Sigma分装);低熔点琼脂糖(FMC 分装);常熔点琼脂糖(Spanish分装)。
其余生化试剂均为分析纯。
电泳仪:由西北大学物理系提供;电泳槽:DYC33A型(北京市六一仪器厂);显微镜:Leica DM LB 2 (Leica 公司);彗星图象分析软件:CASP软件(casp-1.2.2,下载);CO2培养箱:BB16HF型(上海力申科学仪器有限公司);环地牌紫外辐照计(北京师范大学光电仪器厂)。
实验分组及UV处理收集对数生长的K562细胞,台盼蓝染色计数,细胞活力大于95%,用Hank's 调整细胞密度至1×105/ml,接种于塑料培养皿中(ф=35 mm,2 ml/plate),然后进行紫外线照射 mW/cm2)。
实验分为对照组和8个照射组,各照射组分别照射3、5、10、40,60、120、180、240 s,对照组不进行紫外线照射,之后进行彗星实验。
细胞活性检测台盼蓝拒染法[10]即时检测经UV处理后K562细胞的活性。
彗星实验1988年Singh等[5]建立了碱性彗星实验,我们对该实验流程进行改良,首先改变了制胶方法,并在裂解后加入水洗的操作步骤,中和完成后再用梯度酒精脱水。
具体流程如下:①镀膜法制备底胶,将洁净的载玻片在%的常熔点琼脂糖中浸没1 min后,置37 ℃孵箱烘烤过夜;实验时将细胞悬液与低熔点琼脂糖(42 ℃)以1∶1的比例在离心管中混匀,立即灌胶(先用盖玻片在已包被的载片上搭一个22 mm×10 mm× mm的小槽再灌胶),4 ℃静置15 min后取下盖片,制得含细胞胶层。
②裂解,4 ℃,1 h。
③水洗,三蒸水4 ℃水洗3 次,5 min/次。
④解旋,4 ℃,20 min。
⑤电泳,4 ℃,20 min, V/cm。
⑥中和,3 次,每次5 min。
⑦梯度酒精脱水,(50%、70%、80%、90%、100%、100%,常温下各一次,每次5 min)。
⑧染色(EB,20 μg/ml,20 μl),之后镜检,每组随机取50 个细胞,用CASP分析软件进行分析[11~14]。
统计学方法实验数据进行t 检验。
2 结果改良实验方法的结果通过对制胶方法的改进,基本解决了实验中常见的脱胶现象。
同时经梯度酒精脱水后的彗星图象基本位于一个焦平面上(图1),采图更为方便、可靠。
台盼蓝染色结果显示紫外线照射没有产生致死性损伤。
彗星实验结果由表1可知,UV照射K562细胞从最短的照射时间(3 s, mJ/cm2)开始,实验组尾长、彗星长、尾矩、Olive尾矩均大于对照组,且差异具有统计学意义 (P<。
当UV照射时间延长到240 s时,各参数不再增加。
从3 s到180 s,这些检测参数均表现出时间依赖效应。
表2的数据显示,实验组彗星头部半径、头部的面积、头部的DNA含量、头部平均荧光强度、头部DNA百分比随照射时间的增加,表现出振荡模式。
表3的实验结果显示,UV处理后,实验组细胞核DNA尾部的面积、尾部DNA、尾部DNA百分比均大于对照组,t检验有统计学意义(P<,且随UV照射时间的延长,除尾部平均荧光强度外,其它各参数下实验组表现出增加的趋势,显示出时间依赖效应。
3 讨论DNA分子中的共轭键可吸收较短波长的紫外线,从而导致自身发生损伤[15]。
彗星实验可以检测DNA链断裂损伤。
我们采用改良的彗星实验进行检测,用尾长、彗星长、尾矩,Olive尾矩作为分析指标,结果显示,cm2 UV照射3 s即可造成细胞DNA损伤,且随UV照射时间的增加,DNA损伤也增加,表现出良好的时间效应关系,说明改良的彗星实验方法和上述四种分析指标比较可靠。
当照射时间增加到240 s时,各分析指标有下降的趋势,表明彗星实验有检测的阈值,当细胞损伤程度超过此值后,该方法就不能够进行准确的检测。
当以尾部的面积、尾部的DNA和尾部的DNA百分比作为分析指标时,结果表现出时间依赖性,提示可以将这些参数用作DNA损伤的分析指标。
Durand等[16]分析了彗星图象的几种指标(尾长,彗星尾部DNA百分比,彗星尾矩),发现尾矩这一指标具有分析范围广的特点。
我们的实验结果与他们的研究有较好的一致性。
由于尾矩、Olive尾矩等分析参数可以反映尾部的面积、尾部的DNA含量以及尾部的DNA百分比,因此选择尾长、彗星长、尾矩、Olive尾矩作为彗星实验的分析指标,均能较好反映细胞DNA的损伤程度。
而采用彗星头部半径、头部面积、头部DNA含量、头部DNA百分比和头、尾部的平均荧光强度作为分析指标时,损伤程度随UV光强的增加表现出振荡模式,提示这6种分析指标不适合用作彗星实验DNA损伤的评价指标。
综上,我们建立的改良彗星实验系统具有较好的可靠性,CASP分析软件可用于彗星实验的分析,彗星长、尾长、尾矩和Olive尾矩,均能较好地反映细胞DNA的损伤程度。
由Osting 和Johanson 于1984 年首先提出的微电泳技术,1988 年经Singn 等进一步完善为单细胞凝胶电泳( single cell gel elect rophoresis , SCGE) 。
SCGE 是一种在单细胞水平上检测DNA 链损伤的方法,其原理是:包埋在琼脂糖凝胶中的细胞在中性或碱性条件下经裂解与解旋后,带负电荷的DNA 游离断片,在电场作用下向阳极迁移。
在荧光显微下观察,受损DNA 形成的影像形似夜空中的彗星,故又称“彗星试验”(Comet Assay) 。
彗星试验检测单细胞水平DNA 损伤,无需放射性示踪,适用于各种有核细胞,样品用量少,试验周期短,故而灵敏、快速、简便(1 ,2) 。
目前国内外对彗星试验研究的热点主要集中在两个方面:彗星试验的应用与方法学研究。
1 彗星试验的应用111 检测化学物质引起的DNA 损伤目前,对化学物质的DNA 损伤作用检测依然是彗星试验的主要应用范围。
自彗星试验建立以来,已有多种物质的DNA 损伤作用经过检测,对金属化合物、氧化剂、烷化剂、交联剂的研究都有报道。
近年来的研究不仅仅局限在物质是否造成DNA 损伤,在损伤机制、损伤与修复问题上已有了新的探索。
等用彗星试验检测了五种氯化烷、烯类物质,结果证明:氯基数目的多少与双键是否存在使物质致DNA 损伤作用存在质和量的差别,含氯数目越多,DNA 损伤作用越强,带双键的烯类比无双键的烷类损伤作用强,说明物质的DNA 损伤作用与其结构密切相关(3) 。
Toshio Kasamatsu 将彗星试验改良,使细胞裂解后再染毒,并与传统彗星试验比较,结果发现:所检测的直接致突变物,在改良法和传统法中均得到阳性结果;需要经过代谢或膜作用才能对DNA 造成损伤的间接致突变物则只在传统法中得到阳性结果,在改良法中为阴性,这一研究成果对我们分析遗传毒物的化学与生物特性颇有参考价值(4) 。
112 化学物质的靶组织遗传毒性评价B. L. Pool2Zobel 等将从人体组织直肠获得的细胞克隆后,暴露于有致癌危险性的化学物中,观察形成直肠肿瘤的情况,该研究证明彗星试验能有效评估不同化学物质对靶组织的遗传毒性(5) 。
体外试验检测出的致突变物质,在机体内经代谢后,对整个机体的作用如何,对哪些组织具有遗传毒性,是否具有特异性靶组织,彗星试验体内试验研究将对其做出客观评价。
1. 3 辐射生物学研究过去的研究已证实彗星试验检测低剂量辐射引起的DNA 损伤快速、灵敏。
它可以监测接触放射线的人群DNA 损伤状况,监测肿瘤放疗前后DNA 损伤变化,总之,彗星试验已被广泛应用于辐射损伤的监测。
1996 年Takajj Ikushima 提出假说:辐射诱发DNA 损伤的有效修复机制的激发与放射适应性有关。
他们首先让细胞在37 ℃接受非损伤性低剂量辐射4h ,再以损伤剂量处理适应细胞和未适应细胞,发现适应细胞损伤修复率高。
这一发现使我们对辐射生物效应的研究打开了新思路(6) 。
1. 4 肿瘤细胞生物学研究1. 4. 1 凋亡与肿瘤:细胞凋亡与肿瘤的关系,是目前毒理学研究的一个崭新方向。
肿瘤的产生缘于机体内调节细胞增殖和死亡平衡的机制被破坏。
在肿瘤发生发展及灭亡过程中,细胞凋亡起着重要作用,对凋亡的进一步研究将对认识肿瘤的发生机制、预防及治疗肿瘤产生深远的影响(7) 。
凋亡发生时将产生180 —200bp 或其整数倍大小的DNA 片段,在彗星试验中呈现独特的小头大尾的形态学特征, (8) 因此,以DNA 损伤为检测终点的彗星试验可用于凋亡的检测。
1. 4. 2 肿瘤细胞药物抗性: Peggy Olive 等研究发现:肿瘤细胞亚群对DNA 损伤具有抗性(9) 。
由于彗星试验检测单细胞水平DNA 损伤,对细胞亚群的损—208 —伤情况,各细胞亚群对物质作用的反应是否均一都能得到明确的结果。
因此,彗星试验用于检测药物抗性细胞,能够为治疗方案的及时调整提供依据。
1. 5 生态毒理学1996 年G. Koppen 等首次将彗星试验应用于植物细胞- 蚕豆根尖细胞,他们将蚕豆根尖细胞以浸泡方式暴露在不同化合物的溶液中,观察DNA 损伤情况,发现甲磺酸甲酯、甲磺酸乙酯、丝裂霉素C、氯化镉、重铬酸钾、氯化铬都能诱导蚕豆根尖细胞DNA损伤。
彗星试验用于植物系DNA 损伤监测,对于环境质量的评估非常有意义(10) 。
1. 6 工业废水监测研究工业废水的遗传毒性最常用的方法是微生物测试系统(Ames 试验) 和植物测试系统(紫母草花粉母细胞和蚕豆根尖细胞微核试验) ,这些试验需对样品进行预处理,操作繁杂。
