高二化学平衡移动测试题
高二化学化学平衡状态判断、平衡移动综合练习题(附答案)

高二化学化学平衡状态判断、平衡移动综合练习题一、单选题1.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:()()()()2A g +B s C g +D g ,下列描述中不能表明该反应已达到平衡状态的是( ) A.混合气体的密度不变 B.单位时间内生成n mol D ,同时生成n mol C C.容器中的温度不再变化D.C(g)的物质的量浓度不变2.在一个不传热的固定容积的密闭容器中,发生可逆反应A(g)+B(C(g)D(g)g)m q n p +,当m 、n 、p 、q 为任意整数时,一定达到平衡的标志是( )①体系的温度不再改变 ②体系密度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率(A):(B):(C):(D)::: v v v v m p n q =⑥单位时间内mol m A 发生断键反应,同时mol p C 也发生断键反应 A.③④⑤⑥B.①③④⑥C.②③④⑥D.①③④⑤3.甲醇是一种可再生能源,具有广阔的开发和应用前景。
工业上一般采用如下反应合成甲醇:2232CO (g)3H (g)CH OH(g)H O(g)++。
能说明反应已达到化学平衡状态的是( )A.容器内2CO 、2H 、3CH OH 、2H O 的浓度之比为1:3:1:1B.生成1mol 2H O ,同时消耗3mol 2HC.体系中物质的总质量不变D.恒温恒容下,密闭容器中压强保持不变 4.可逆反应:222NO (g)2NO(g)O (g)+,在容积不变的密闭容器中进行,下列能说明该反应达到平衡状态的有( )①单位时间内生成2mol O n 的同时生成2mol NO n ②容器内总压强不再变化③2NO 、NO 、2O 的物质的量浓度之比为2:2:1 ④混合气体的密度不再改变 ⑤混合气体的颜色不再改变⑥混合气体的平均相对分子质量不再改变 A.2个B.3个C.4个D.5个5.在一个固定容积的密闭容器中,可逆反应:A(g)B(C(g)+D(g)g)m p q n +中,当m 、n 、p 、q 为任意正整数时,能说明该反应一定达到平衡状态的是( )A.气体分子的平均摩尔质量不再发生变化B.各组分的物质的量浓度不再改变C.A 与C 的质量分数相等D.反应速率A C B D ::::::v v v v m n p q = 6.氨基甲酸铵分解反应为2432NH COONH (s)2NH (g)CO (g)+,在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是( ) A.密闭容器中氨气的体积分数不变 B.241molNH COONH 分解同时有317gNH 消耗 C.密闭容器中混合气体的密度不变 D.混合气体的平均分子量不变7.恒容密闭容器中发生反应:222NO (g)2NO(g)+O (g)(2NO 红棕色气体,NO 无色气体),下列状态中不能表明该反应达到平衡状态的有( ) A. 混合气体的颜色不再改变的状态B. 单位时间内生成mol n 2O 的同时生成2mol n 2NOC. 混合气体的密度不再改变的状态D. 混合气体的平均相对分子质量不再改变 8.一定温度下,反应()()22N g 3H g +()32NH g 达到化学平衡状态的标志是( )A.223N H NH 、和的质量分数不再改变B.()()()223N H NH c c c ∶∶=1∶3∶2 C. 断裂1 mol N≡N 键的同时,形成6 mol N —H 键 D. N 2与H 2的物质的量之和是NH 3的物质的量的2倍9.在一定温度下的恒容密闭容器中发生反应:2SO 2(g)+O 2(g)⇌2SO 3(g),下列证据不能说明反应一定达到化学平衡状态的是( ) A .容器内的压强不再改变B .SO 2的转化率不再改变C .223SO : O : ()O ()()S c c c = 2 : 1 : 2D .SO 3的生成速率与SO 3的消耗速率相等10.在一定温度下,下列叙述不是可逆反应A(g)+3B(g)2C(g)达到平衡状态标志的是( )①C 生成的速率与C 分解的速率相等②单位时间内生成a mol A,同时生成3a mol B ③A、B 、C 的浓度不再变化 ④A、B 、C 的压强不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化⑦单位时间内消耗a mol A,同时生成3a mol B ⑧A、B 、C 的分子数之比为1︰3︰2A.②⑧B.①⑥C.②④D.③⑧ 11.能表示H 2(g)+ I 2(g) 2HI(g)已经达到平衡状态的标志是( )①()()()22H I HI c c c ==时 ②()()()22H :I :HI 1:1:2c c c =时③()()()22H I HI c c c 、、不再随时间而改变 ④单位时间内生成 mol n H 2的同时生成2mol n HI ⑤单位时间内生成 mol n H 2的同时生成 mol n I 2 ⑥反应速()()()22H I 1/2HI v v v == ⑦一个H-H 键断裂的同时有两个H-I 键断裂 ⑧温度和体积一定时,容器内压强不再变化 ⑨温度和体积一定时,混合气体的颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化 ⑪条件一定,混合气体的平均相对分子质量不再变化 A .③④⑦⑨⑩B .③④⑦⑨C .②③④⑦⑨D .②③④⑥⑦⑨12.一定温度下,可逆反应2NO 22NO+O 2在体积不变的密闭容器中反应,达到平衡状态的标志是( )①单位时间内生成 mol n O 2的同时生成2 mol n NO 2 ②单位时间内生成 mol n O 2的同时生成2 mol n NO ③混合气体的平均相对分子质量不再改变的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态⑥用22NO NO O 、、的物质的量浓度变化表示的反应速率的比为2:2:1的状态 A .① ③ ④B .① ④ ⑥C .② ③ ⑤D .① ② ③ ④ ⑤ ⑥13.一定温度下,恒容密闭容器中发生反应:()()()()A g B g C g D g m n p q ++,其中m n p q、、、为任意正整数。
高中化学平衡移动及影响因素练习题(附答案)
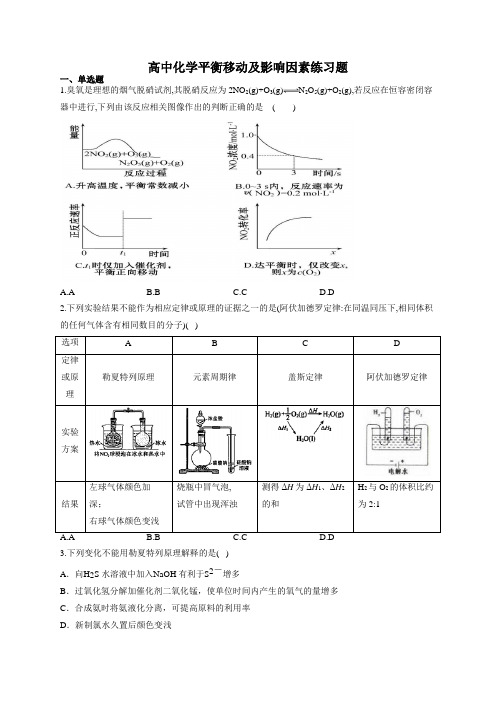
高中化学平衡移动及影响因素练习题一、单选题1.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()A.AB.BC.CD.D2.下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)( )左球气体颜色加烧瓶中冒气泡, 测得ΔH为ΔH、ΔH H与O的体积比约3.下列变化不能用勒夏特列原理解释的是( )A.向H2S 水溶液中加入N aOH 有利于S2-增多B.过氧化氢分解加催化剂二氧化锰,使单位时间内产生的氧气的量增多C.合成氨时将氨液化分离,可提高原料的利用率D.新制氯水久置后颜色变浅4.下列不能能用勒夏特烈原理解释的是( ) A .对2HI====H 2+I 2平衡体系增加压强使颜色变深B .在溴水中存在如下平衡:Br 2+H 2O===HBr+HBrO ,当加入NaOH 溶液后颜色变浅C .反应2NO+2CO===2CO 2+N 2正反应放热,升高温度使平衡向逆方向移动D .合成氨反应:N 2+3H 2===2NH 3正反应放热,为使氨的产率提高,理论上应采取低温高压的措施5.下列事实不能..用勒夏特列原理解释的是( ) A .光照新制的氯水时,溶液的pH 逐渐减小 B .高温,使2N 和2H 转化为更多的3NH (△H <0) C .可用浓氨水和氢氧化钠固体快速制取氨气 D .增大压强,有利于2SO 和2O 反应生成3SO6.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)2C(g)达到平衡时,各物质的物质的量之比为n (A):n (B):n (C)=2:2:1。
保持温度不变,以2:2:1的物质的量之比再充入A 、B 、C,则( ) A.平衡不移动B.再次达到平衡时,n (A):n (B):n (C)仍为2:2:1C.再次达到平衡时,C 的体积分数增大D.正反应速率增大,逆反应速率减小7.下列事实不能用勒夏特列原理解释的是( ) ①工业合成氨,反应条件选择高温②实验室可以用排饱和食盐水的方法收集氯气 ③使用催化剂可加快SO 2转化为SO 3的速率④硫酸工业中,增大O 2的浓度有利于提高SO 2的转化率 A.②③B.②④C.①③D.①④8.在某密闭容器中,反应a A(g)+b B(g)c C(g)+d D(g)达到平衡时,B 的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B 的浓度降为0.3mol/L 。
高二化学平衡移动图像问题专项训练题(附答案)

高二化学平衡移动图像问题专项训练题一、单选题1.在不同条件下进行化学反应2A(g) B(g) + D(g), B、 D起始浓度均为0,反应物A的浓度-1序号0 20 40 50①800 1.0 0.67 0.50 0.50②800 x 0.50 0.50 0.50③800 y 0.75 0.60 0.60④820 1.0 0.25 0.20 0.20下列说法不正确的是( )A.①中B在0~20min平均反应速率为8.25x10-3mo1·L-1min-1B.②中K=0.25,可能使用了催化剂C.③中Y=1.4mo1·L-1D.比较①、④可知,该反应为吸热反应2.烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1L)。
下列分析不正确的是( )A.乙烯气相直接水合反应的ΔH<0B.图中压强的大小关系为:p1>p2>p3C.图中a点对应的平衡常数K=5/16D.达到平衡状态a、b所需要的时间:a>b3.升高温度,下列各项的值可能减小的是( )A.化学反应速率vB.NaCl的溶解度SC.化学平衡常数KD.弱酸的电离平衡常数K a4.在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔΗ在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③ ),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )A.该反应的ΔΗ>0B.氢碳比:① <② <③C.其他条件不变的情况下,增大容器的体积可提高CO 2的转化率D.若起始时CO 2浓度为2mol·L -1,H 2浓度为4mol·L -1,在图中曲线③ 氢碳比条件下进行反应,则400K 时该反应的平衡常数数值约为1.75.在某容积一定的密闭容器中,有下列可逆反应:()()()A g +B g xC g H 僔未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数( )A. 34P >P ,y 轴表示C 的转化率B. 34P <P ,y 轴表示B 的体积分数C. 34P <P ,y 轴表示混合气体的密度D. 34P >P ,y 轴表示混合气体的平均摩尔质量6.在一恒温、恒容密闭容器中发生反应:()()()()50~804180~200Ni s +4CO g Ni CO g ,H<0垐垐垎V 噲垐垐℃℃利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是( ) A. 增加Ni 的量可提高CO 的转化率,Ni 的转化率降低℃ B. 缩小容器容积,平衡右移,H V 减小C. 反应达到平衡后,充入CO 再次达到平衡时,CO 的体积分数降低D. 当()()44v Ni CO =v CO ⎡⎤⎣⎦正正时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态7.以下自发反应可以用熵判据来解释的是( ) A. ()()()222N g +2O g ==2NO g H=+67.7kJ/mol VB. ()()()23CaO s +CO g ==CaCO s H=-175.5kJ/mol VC. ()()()()434332NH CO s ==NH HCO s +NH g H=+74.9kJ/mol VD. ()()()2222H g +O g ==2H O l H=-285.8kJ/mol V 8.工业上以CH 4为原料制备H 2的原理为CH 4(g)+H 2O(g)4CO(g)+3H 2(g) ΔΗ>0。
(完整版)高中化学平衡移动习题及答案

化学平衡移动一、选择题1.压强变化不会使下列化学反应的平衡发生移动的是()A.H2(g)+Br2(g)2HBr(g) B.N2(g)+3H2(g)2NH3(g)C.2SO2(g)+O2(g)2SO3(g) D.C(s)+CO2(g)2CO(g)【解析】对于气体体积不变的反应,改变压强时化学平衡不移动。
【答案】 A2.对于平衡CO2(g)CO2(aq)ΔH=-19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()A.升温增压B.降温减压C.升温减压D.降温增压【解析】正反应放热,要使平衡右移,应该降低温度;另外正反应为气体分子数减少的反应,所以为了增加CO2在水中的溶解度,应该增大压强,故选D。
【答案】 D3.在常温常压下,向5 mL 0.1 mol·L-1FeCl3溶液中滴加0.5 mL 0.01 mol·L-1的NH4SCN溶液,发生如下反应:FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl,所得溶液呈红色,改变下列条件,能使溶液颜色变浅的是()A.向溶液中加入少量的NH4Cl晶体B.向溶液中加入少量的水C.向溶液中加少量无水CuSO4,变蓝后立即取出D.向溶液中滴加2滴2 mol·L-1的FeCl3【解析】从反应实质看,溶液中存在的化学平衡是:Fe3++3SCN-Fe(SCN)3,Fe(SCN)3溶液显红色,加入NH4Cl晶体,因为在反应中NH4+、Cl-未参与上述平衡,故对此平衡无影响;加水稀释各微粒浓度都变小,且上述平衡逆向移动,颜色变浅;CuSO4粉末结合水,使各微粒浓度变大,颜色加深;加2滴2 mol·L-1FeCl3,增大c(Fe3+),平衡正向移动,颜色加深(注意,若加入FeCl3的浓度≤0.1 mol·L-1,则不是增加反应物浓度,相当于稀释)。
【答案】 B4.合成氨工业上采用了循环操作,主要原因是()A.加快反应速率B.提高NH3的平衡浓度C.降低NH3的沸点D.提高N2和H2的利用率【解析】合成氨工业上采用循环压缩操作,将N2、H2压缩到合成塔中循环利用于合成氨,提高了N2、H2的利用率。
高中化学平衡的移动 专项训练

化学平衡的移动(专题训练)1.某温度时,发生反应2HI(g)H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2 mol HI;②3 mol HI;③1 mol H2与1 mol I2,分别达到平衡时,以下关系正确的是()A.平衡时,各容器的压强:②=①=③B.平衡时,I2的浓度:②>①>③C.平衡时,I2的体积分数:②=①=③D.从反应开始到达平衡的时间:①>②=③2.CO2经催化加氢可合成乙烯:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)。
0.1 MPa 时,按n(CO2)∶n(H2)=1∶3投料,测得不同温度下平衡时体系中各物质浓度的关系如图,下列叙述不正确的是()A.该反应的ΔH<0B.曲线b代表H2O的浓度变化C.N点和M点所处的状态c(H2)不一样D.其他条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大3.已知反应:CO(g)+3H2(g)CH4(g)+H2O(g)。
起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲)。
下列有关说法正确的是()A.上述反应的ΔH<0B.N点时的反应速率一定比M点的快C.降低温度,H2的转化率可达到100%D.工业上用此法制取甲烷应采用更高的压强4.工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g)CO(g)+3H2(g)。
在一定条件下a、b两个恒温恒容的密闭容器中均通入1.1 mol CH4(g)和1.1 mol H2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。
已知容器a的体积为10 L,温度为T a,下列说法不正确的是()A.容器a中CH4从反应开始到恰好平衡时的平均反应速率为0.025 mol·L-1·min-1B.a、b两容器的温度可能相同C.在达到平衡前,容器a的压强逐渐增大D.该反应在T a温度下的平衡常数为275.不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。
化学平衡移动练习题(含答案)

第二章第三节化学平衡移动练习题(1)一、选择题1.对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是()A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动C.正、逆反应速率都减小,平衡向逆反应方向移动D.正、逆反应速率都增大,平衡向正反应方向移动2.在一定条件下,可逆反应:N 2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是()A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数3.下列说法正确的是() A.可逆反应的特征是正反应速率总是和逆反应速率相等B.其他条件不变时,使用催化剂只改变反应速率,而不能改变化学平衡状态C.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态4.对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是()A.加入一种反应物 B.对平衡体系加压C.升高温度 D.使用催化剂5.对平衡CO 2(g)CO2(aq) △H= -19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()A.升温增压B.降温减压 C.升温减压D.降温增压6.2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。
合成氨反应在铁催化剂表面进行时效率显着提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是()A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动B.将氨气从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动C.升高温度可加快反应速率,且有利于平衡向合成氨的方向移动D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动7.关于催化剂的叙述,正确的是()A.催化剂在化学反应前后性质不变B.催化剂在反应前后质量不变,故催化剂不参加化学反应C.使用催化剂可以改变反应达到平衡的时间D.催化剂可以提高反应物的转化率8.对于可逆反应2A2(g)+B22B(1)(正反应为放热反应)达到平衡,要使正、逆反应的速率都增大,而且平衡向右移动,可以采取的措施是()A.升高温度B.降低温度C.增大压强D.减小压强9.在一容积固定的密闭容器中,反应 2SO2(g)+O2(g) 2SO3(g)达平衡后,再通入18O2气体,重新达平衡。
(新)高中化学平衡移动习题及答案(供参考)

化学平衡移动一、选择题1.压强变化不会使下列化学反应的平衡发生移动的是()A.H2(g)+Br2(g)2HBr(g) B.N2(g)+3H2(g)2NH3(g)C.2SO2(g)+O2(g)2SO3(g) D.C(s)+CO2(g)2CO(g)【解析】对于气体体积不变的反应,改变压强时化学平衡不移动。
【答案】 A2.对于平衡CO2(g)CO2(aq)ΔH=-19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()A.升温增压B.降温减压C.升温减压D.降温增压【解析】正反应放热,要使平衡右移,应该降低温度;另外正反应为气体分子数减少的反应,所以为了增加CO2在水中的溶解度,应该增大压强,故选D。
【答案】 D3.在常温常压下,向5 mL 0.1 mol·L-1FeCl3溶液中滴加0.5 mL 0.01 mol·L-1的NH4SCN溶液,发生如下反应:FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl,所得溶液呈红色,改变下列条件,能使溶液颜色变浅的是()A.向溶液中加入少量的NH4Cl晶体B.向溶液中加入少量的水C.向溶液中加少量无水CuSO4,变蓝后立即取出D.向溶液中滴加2滴2 mol·L-1的FeCl3【解析】从反应实质看,溶液中存在的化学平衡是:Fe3++3SCN-Fe(SCN)3,Fe(SCN)3溶液显红色,加入NH4Cl晶体,因为在反应中NH4+、Cl-未参与上述平衡,故对此平衡无影响;加水稀释各微粒浓度都变小,且上述平衡逆向移动,颜色变浅;CuSO4粉末结合水,使各微粒浓度变大,颜色加深;加2滴2 mol·L-1FeCl3,增大c(Fe3+),平衡正向移动,颜色加深(注意,若加入FeCl3的浓度≤0.1 mol·L-1,则不是增加反应物浓度,相当于稀释)。
【答案】 B4.合成氨工业上采用了循环操作,主要原因是()A.加快反应速率B.提高NH3的平衡浓度C.降低NH3的沸点D.提高N2和H2的利用率【解析】合成氨工业上采用循环压缩操作,将N2、H2压缩到合成塔中循环利用于合成氨,提高了N2、H2的利用率。
高二化学化学平衡状态判断、平衡移动综合练习题(附答案)

高二化学化学平衡状态判断、平衡移动综合练习题一、单选题1.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:()()()()2A g +B s C g +D g ,下列描述中不能表明该反应已达到平衡状态的是( ) A.混合气体的密度不变 B.单位时间内生成n mol D ,同时生成n mol C C.容器中的温度不再变化D.C(g)的物质的量浓度不变2.在一个不传热的固定容积的密闭容器中,发生可逆反应A(g)+B(C(g)D(g)g)m q n p +,当m 、n 、p 、q 为任意整数时,一定达到平衡的标志是( )①体系的温度不再改变 ②体系密度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率(A):(B):(C):(D)::: v v v v m p n q =⑥单位时间内mol m A 发生断键反应,同时mol p C 也发生断键反应 A.③④⑤⑥B.①③④⑥C.②③④⑥D.①③④⑤3.甲醇是一种可再生能源,具有广阔的开发和应用前景。
工业上一般采用如下反应合成甲醇:2232CO (g)3H (g)CH OH(g)H O(g)++。
能说明反应已达到化学平衡状态的是( )A.容器内2CO 、2H 、3CH OH 、2H O 的浓度之比为1:3:1:1B.生成1mol 2H O ,同时消耗3mol 2HC.体系中物质的总质量不变D.恒温恒容下,密闭容器中压强保持不变 4.可逆反应:222NO (g)2NO(g)O (g)+,在容积不变的密闭容器中进行,下列能说明该反应达到平衡状态的有( )①单位时间内生成2mol O n 的同时生成2mol NO n ②容器内总压强不再变化③2NO 、NO 、2O 的物质的量浓度之比为2:2:1 ④混合气体的密度不再改变 ⑤混合气体的颜色不再改变⑥混合气体的平均相对分子质量不再改变 A.2个B.3个C.4个D.5个5.在一个固定容积的密闭容器中,可逆反应:A(g)B(C(g)+D(g)g)m p q n +中,当m 、n 、p 、q 为任意正整数时,能说明该反应一定达到平衡状态的是( )A.气体分子的平均摩尔质量不再发生变化B.各组分的物质的量浓度不再改变C.A 与C 的质量分数相等D.反应速率A C B D ::::::v v v v m n p q = 6.氨基甲酸铵分解反应为2432NH COONH (s)2NH (g)CO (g)+,在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是( ) A.密闭容器中氨气的体积分数不变 B.241molNH COONH 分解同时有317gNH 消耗 C.密闭容器中混合气体的密度不变 D.混合气体的平均分子量不变7.恒容密闭容器中发生反应:222NO (g)2NO(g)+O (g)(2NO 红棕色气体,NO 无色气体),下列状态中不能表明该反应达到平衡状态的有( ) A. 混合气体的颜色不再改变的状态B. 单位时间内生成mol n 2O 的同时生成2mol n 2NOC. 混合气体的密度不再改变的状态D. 混合气体的平均相对分子质量不再改变 8.一定温度下,反应()()22N g 3H g +()32NH g 达到化学平衡状态的标志是( )A.223N H NH 、和的质量分数不再改变B.()()()223N H NH c c c ∶∶=1∶3∶2 C. 断裂1 mol N≡N 键的同时,形成6 mol N —H 键 D. N 2与H 2的物质的量之和是NH 3的物质的量的2倍9.在一定温度下的恒容密闭容器中发生反应:2SO 2(g)+O 2(g)⇌2SO 3(g),下列证据不能说明反应一定达到化学平衡状态的是( ) A .容器内的压强不再改变B .SO 2的转化率不再改变C .223SO : O : ()O ()()S c c c = 2 : 1 : 2D .SO 3的生成速率与SO 3的消耗速率相等10.在一定温度下,下列叙述不是可逆反应A(g)+3B(g)2C(g)达到平衡状态标志的是( )①C 生成的速率与C 分解的速率相等②单位时间内生成a mol A,同时生成3a mol B ③A、B 、C 的浓度不再变化 ④A、B 、C 的压强不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化⑦单位时间内消耗a mol A,同时生成3a mol B ⑧A、B 、C 的分子数之比为1︰3︰2A.②⑧B.①⑥C.②④D.③⑧ 11.能表示H 2(g)+ I 2(g) 2HI(g)已经达到平衡状态的标志是( )①()()()22H I HI c c c ==时 ②()()()22H :I :HI 1:1:2c c c =时③()()()22H I HI c c c 、、不再随时间而改变 ④单位时间内生成 mol n H 2的同时生成2mol n HI ⑤单位时间内生成 mol n H 2的同时生成 mol n I 2 ⑥反应速()()()22H I 1/2HI v v v == ⑦一个H-H 键断裂的同时有两个H-I 键断裂 ⑧温度和体积一定时,容器内压强不再变化 ⑨温度和体积一定时,混合气体的颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化 ⑪条件一定,混合气体的平均相对分子质量不再变化 A .③④⑦⑨⑩B .③④⑦⑨C .②③④⑦⑨D .②③④⑥⑦⑨12.一定温度下,可逆反应2NO 22NO+O 2在体积不变的密闭容器中反应,达到平衡状态的标志是( )①单位时间内生成 mol n O 2的同时生成2 mol n NO 2 ②单位时间内生成 mol n O 2的同时生成2 mol n NO ③混合气体的平均相对分子质量不再改变的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态⑥用22NO NO O 、、的物质的量浓度变化表示的反应速率的比为2:2:1的状态 A .① ③ ④B .① ④ ⑥C .② ③ ⑤D .① ② ③ ④ ⑤ ⑥13.一定温度下,恒容密闭容器中发生反应:()()()()A g B g C g D g m n p q ++,其中m n p q、、、为任意正整数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 化学平衡移动 转化率班级: 组号: 姓名: 成绩: 一.选择题1.在密闭容器中发生如下反应:aX(气)+bY(气) cZ(气)+dW(气),反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W 的浓度为原平衡时的倍。
下列叙述中不正确的是( )A.平衡向逆反应方向移动 +b<C+d 的体积分数增加 的转化率下降 答案:C2.已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )①生成物的质量分数一定增加;②生成物产量一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用催化剂 A .①③ B .③⑤ C .②⑤ D .④⑥ 答案:C3.在5 L 的密闭容器中充入2 mol A 气体和1 mol B 气体,在一定条件下发生反应:2A g +B g 2C g ,达平衡时,在相同温度下测得容器内混合气体的压强是反应前的65,则A 的转化率为A67% B 50% C 25% D 5% 答案:B4.在一密闭溶器中,用等物质的量的A 和B 发生如下反应:A(g)+2B(g) 2C(g)反应达到平衡时,若混合气体中A 和B 的物质的量之和与C 的物质的量相等,则这时A 的转化率为 ( )A. 40%B. 50%C. 60%D. 70% 答案:A5.在恒压容器a 和恒容容器b 中,分别充入体积比为1∶3的N 2和H 2。
若开始时两容器的体积相等,且在相同的条件下达到平衡时,两容器的N 2的转化率应当是( ) A .a 中大 B .b 中大 C .a 、b 一样大 D .无法判断 答案:A6.在容积相同A 、B 两个密闭容器中,分别充入2molSO 2和1molO 2,使它们在相同的温度下发生反应:2SO 2+O 22SO 3,并达到平衡。
在反应过程中,若A 容器保持体积不变,B 容器保持压强不变,当A 中的SO 2的转化率为25%时,则B 容器中SO 2的转化率应是( ) A 、25% B 、>25% C 、<25% D 、% 答案:B7.一定条件下,将10mol H 2和1mol N 2充入一密闭容器中,发生反应:N 2(g)+3H 2(g)2NH 3(g),达到平衡时,H 2的转化率可能是( )A .25%B .30%C .35%D .75% 答案:A8.α1和α2分别为A 、B 在两个恒容容器中平衡体系A(g)2B(g)和2A(g)B(g)的转化率,在温度不变的情况下,均增加A 的物质的量,下列判断正确的是A .α1、α2均减小B .α1、α2均增大C .α1减小,α2增大D .α1增大,α2减小 【答案】A9.某体积可变的密闭容器,盛有适量的A 和B 的混合气体,在一定条件下发生反应:A +3B 2C 若维持温度和压强不变,当达到平衡时,容器的体积为V L ,其中C 气体的体积占有10%,下列推断正确的是 ( )① 原混合气体的体积为 L ② 原混合气体的体积为 L ③ 反应达平衡时气体A 消耗掉 L ④ 反应达平衡时气体B 消耗掉 L A. ②③ B. ②④ C. ①③ D. ①④ 答案:A10.X 、Y 、Z 为三种气体,把a mol X 与b mol Y 充入一密闭容器中,发生反应X +2Y2Z ,达到平衡时,若它们的物质的量满足:n (X)+n (Y)=n (Z),则Y 的转化率为( ) A. 5b a +×100% B. b b a 5)(2+×100% C. 5)(2b a +×100% D. aba 5+×100% 答案:B和x 2分别为两个恒容容器中平衡体系A(g)2B(g)和2A(g)B(g)的转化率,在温度不变的情况下,均增加A 的物质的量.下列判断正确的是 ( )A. x 1降低, x 2增大B. x 1, x 2均降低C. x 1增大, x 2降低D. x 1, x 2均增大答案:A12.将 mol SO 2和 mol O 2通入1.00 L 的密闭容器中,1500 K 时,反应达到平衡,测得SO 3的物质的量浓度为 mol·L -1,则平衡时SO 2的平衡转化率为( ) A .30% B .32% C .50% D .18% 答案:B 。
13.一定温度下,在一密闭容器中,充入一定量的H 2(g)和I 2(g)发生如下反应:H 2(g)+I 2(g) 2HI(g),并达到平衡状态,此时H 2的转化率x %,向平衡混合体系中充入一定量的I 2(g),重新达到平衡后H 2的转化率将( )A .增大B .减小C .不变D .无法确定 答案:A 。
14.在5 L 的密闭容器中充入2 mol A 气体和1 mol B 气体,在一定条件下发生反应:2A(g)+B(g) 2C(g),达到平衡时,在相同温度下测得容器内混合气体的压强是反应前的56,则A 的转化率为( )A .67%B .50%C .25%D .5% 答案:B 。
15.在恒压容器a 和恒容容器b 中,分别充入体积比为1∶3的N 2和H 2。
若开始时两容器的体积相等,且在相同的条件下达到平衡时,两容器的N 2的转化率应当是( ) A .a 中大 B .b 中大 C .a 、b 一样大 D .无法判断 答案:A16.在恒温、恒容的条件下,有反应2A(g)+2B(g) C(g)+3D(g),现从两条途径分别建立平衡。
途径Ⅰ:A 、B 的起始浓度均为2 mol/L ;途径Ⅱ:C 、D 的起始浓度分别为2 mol/L 和6 mol/L ,则以下叙述正确的是 ( ) A .两途径最终达到平衡时,体系内混合气的浓度相同 B .两途径最终达到平衡时,体系内混合气的百分组成不同 C .达平衡时,途径Ⅰ的反应速率v (A)等于途径Ⅱ的反应速率v (A) D .达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的1/2解析:分析反应特点,反应前后气体分子数不变,把途径Ⅱ中的C 、D 的浓度转化为A 、B 的浓度,都是4 mol/L 二者为等效平衡,混合气的百分组成相同,浓度不同A 项、B 项都不正确。
由于途径Ⅱ中A 的浓度大,故反应速率大,C 不正确,恒容条件下,途径Ⅱ的浓度为Ⅰ的2倍,故其密度也是Ⅰ的2倍,D 项正确。
答案:D17.T ℃时,将6 mol CO 2和8 mol H 2充入2 L 密闭容器中,发生反应CO 2(g)+3H 2(g) CH 3OH(g)+H 2O(g),容器中H 2的物质的量随时间的变化如图中实线所示。
图中虚线表示仅改变某一反应条件时,H 2的物质的量随时间的变化。
下列说法正确的是( )A .反应开始至a 点时v (H 2)=1 mol·L -1·min -1B .若曲线Ⅰ对应的条件改变是升温,则该反应ΔH >0C .曲线Ⅱ对应的条件改变是减小压强D .T ℃时,该反应的化学平衡常数为解析:本题主要考查反应速率、平衡移动、平衡常数的计算等知识点。
A 项,反应开始至a 点时v (H 2)=2 mol 2 L 1 min =1 mol·L -1·min -1,正确;B 项,曲线Ⅰ和实线对比,升温,平衡时H 2的物质的量变大,说明平衡逆向移动,该反应ΔH <0,错误;C 项,曲线Ⅱ和实线对比,平衡时H 2的物质的量变小,说明平衡正向移动,对应的条件改变是增大压强,错误;D 项,平衡时c (H 2)=1 mol·L -1,c (CO 2)=2 mol·L -1,c (CH 3OH)=c (H 2O)=1 mol·L -1,K =c (H 2O)·c (CH 3OH)c (CO 2)·c 3(H 2)=1×12×13=,错误。
答案:A18.在密闭容器中,对于可逆反应A(?)+3B(?) 2C(g) ΔH <0,平衡时C 的体积分数与温度和压强的关系如图所示,下列判断正确的是( )A .当n (A)∶n (B)∶n (c)=1∶3∶2时,反应达到平衡状态B .A 、B 聚集状态均无法确定C .压强增大时,混合气体的平均相对分子质量增大D .其他条件不变,升高温度,反应的平衡常数增大解析:由该条件不能确定是否达平衡,A 项错误;由图知加压C%增加,表明加压平衡向右移动,根据平衡移动原理知正向是气体体积缩小的方向,则B 一定是气体,A 不确定,此时混合气体的总质量增加或不变,总物质的量在减小,则混合气体的平均相对分子质量增大,B 项错误,C 项正确;其他条件不变,升高温度,平衡逆向移动,反应的平衡常数减小,D 项错误。
答案:C19.【武献敏】在一定条件下,N 2+3H 22NH 3达到平衡状态后,按如下操作,化学平衡不发生移动的是( )A .保持T 、V 不变,充入HClB .保持T 、V 不变,充入N 2C .保持T 、p 不变,充入HeD .保持T 、V 不变,充入He解析:保持T 、V 不变,充入HCl ,HCl 与NH 3反应生成NH 4Cl ,平衡向正反应方向移动,A 项错误;充入N 2,反应物浓度增大,平衡向正反应方向移动,B 项错误;保持T 、p 不变,充入He ,各物质的浓度减小,平衡向逆反应方向移动,C 项错误;充入He ,各物质的浓度不变,平衡不移动,D 项正确。
答案:D20.在恒容密闭容器中有可逆反应:nA(g) + mB(g) pC(g) m+n>p ,(正反应吸热) 处于平衡状态,对该平衡的下列说法正确的是( )A .升高温度,c(B)/c(C)的比值减小B .加入B ,A 和B 的转化率均增大C .充入C ,A 和B 的物质的量浓度增大,达到平衡时A 的质量百分含量增大D .降温时,混合气体的平均相对分子质量增大 答案:A21.在一定温度下,反应12H 2(g)+12X 2(g)HX(g)的平衡常数为10。
若将的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )A .5%B .33%C .25%D .17% 答案:D 22.为了探索外界条件对反应a X(g)+b Y(g)c Z(g)的影响,以X 和Y 物质的量比为a ∶b 开始反应,通过实验得到不同条件下达到平衡时Z 的物质的量分数,实验结果如上图所示。
以下判断正确的是( )A .ΔH >0,a +b >cB .ΔH >0,a +b <cC .ΔH <0,a +b >cD .ΔH <0,a +b <c解析:根据图像知,升高温度平衡时Z 的物质的量分数减小,说明正反应是一个放热反应,即ΔH <0;增大压强,平衡时Z 的物质的量分数增大,说明正反应是一个气体分子数减小的反应,即a +b >c ,C 项正确。
