第三章-化学动力学基础PPT课件
普通化学——化学动力学基础PPT课件

(产物取正,生成物取负)
显然,两种方法定义的数值不一样,它们之间的关系为: r ri 1 dci vi vi dt
式中,vi为反应系数,符号一律取正)
||
||
5
3.1.2 反应动力学方程
1 积分形式的动力学方程
描述反应体系中某组分浓度与时间的关系的函数称为积分形式的动 力学方程:
ci = g(t)
||
||
10
3.2 简单级数的反应的动力学方程
常见的简单级数的反应有零级反应、一级反应和二级反 应,三级反应的例子不多。 零级反应(准)——气、固相催化反应,酶催化反应 一级反应——同位素衰变反应,部分取代反应 二级反应——水解反应,部分取代反应
||
||
11
3.2.1 一级反应
一级反应:A → P dc kc dt
t
图3.2 一级反应
||
||
13
一级反应计算示例
例3.1 从考古发现的某古书卷中取出的小块纸片,测得 其中 14C/12C 的比值为现在活的植物体内 14C/12C 的比值 的0.795 倍。试估算该古书卷的年代。
解: 已知 1 4 7 1 4 7 - 0 1 e - , t 12 5730a
可用式(2.34)求得此一级反应速率常数k
第三章 化学动力学基础
第三章 化学动力学基础
化学热力学为我们提供了判断反应能否自发进行的依据。 但是一个热力学自发的反应不一定能够进行,例如:
H2(g)+O2(g) = H2O(g) 298.15K时标准摩尔反应吉布斯函数变为–457kJ·mol-1,但 在此温度下,不点燃或无撞击的情况下几天甚至几月都 观察不到水分子的产生。
2 微分形式的动力学方程
第三章化学动力学初步

限速步骤(定速步骤):在一连串的反应中,较慢的基元反应限 制 了整个反应的速率,这一步骤称为限速步骤。
4
3.2 反应速率理论简介 速率理论简介 论简
3.2.1有效碰撞理论
1.反应速率正比于反应物分子的碰撞次数υ∝Z0c(NO)c(O3) 2.反应物分子必须定向碰撞才可能发生反应 有效碰撞
无效碰撞
υ∝PZ0c(NO)c(O3)
10
3.4 反应速率与温度的关系
3.4.1 范特霍夫 范特霍夫(Van’t Hoff)近似规则 近似规则 近似
反应体系的温度每升高10 K,化学反应速率将增加到原来的 k T + n ⋅10 2~4倍。 k T + 10 =γn =γ
kT
kT
γ:温度系数;一般为2~4,k:各温度下的反应速率常数。
9
表3.2 cA和cB及反应速率v
∴根据实验结果可知:m = 2,n = 1 反应的速率方程为υ =kcA
2c D
反应的级数:m + n =
3
说明 (1)常见反应级数:零、一、二级反应,三级反应少见,三级以上 反应无。 (2)反应级数可为零、正整数、分数, 反应级数不同K的单位不同。 (3)复合反应可由限速步骤写出速率方程。
单位是J·mol-1 。
上式两边取自然对数,得:
Ea ln k = ln A − RT
Ea lg k = lg A − (3.6) 2.303RT
【例3-1】对下列反应C2H5Cl(g)→C2H4(g) + HCl(g),已知 A=1.6×1014,Ea=246.9 KJ·mol-1,求700 K时的速率常数。如果 反应温度升高到710 K时,计算速率常数,并与700 K时的速率常 数做比较。
化学反应动力学基础N

3.5910 4 3.6010
3.62 10 4 3.6110
4
3.61104 3.68104
N2O5的分解速率与N2O5浓度的比值是恒定的,
即反应速率 r 与 c(N2O5) 成正比。
即:
r kc( N2O5 )
对于一般的化学反应:
aA bB yY zZ
到达一定的温度,速率反而下降。如多相催化 反应和酶催化反应。 (4)速率在随温度升到某一高度时下降,再升高温 度,速率又迅速增加,可能发生了副反应。 (5)温度升高,速率反而下降。这种类型很少, 如一氧化氮氧化成二氧化氮。
T
T
T
T
T
一、 范特霍夫规则
1884年 Van' t Hoff 提出:
kT 10K 2~4 kT
c-t图
r-c图
40℃,CCl4中N2O5分解反应的r:c( N2O5 )
t /s
0 300 600 900 1200
r : c N 2 O5 / s1
t /s
1800 2400 3000 4200 5400
r : c N 2 O5 / s
1
3.6510
4
4
3.64104 3.6210 3.6910
2
1 k kA 0
仅适用于只有一种反应物的纯U-238就
有0.257mg的Pb-206。试计算此岩石的年
龄。已知U-238的半率期为4.5109年。
解:假设分析时U-238的量为1mg ,岩石中原来铀
的总量应为1mg加上衰变为Pb-206的量。
238 m(U 238 ) 1.000 mg 0.257 mg 1.297 mg 206
北理无机化学第3章-化学动力学基础

基元反应
§3.2 浓度对反应速率的影响
NO2(g)+CO(g) NO(g)+CO2(g)
v=kc(NO2)c(CO)
反应级数 n = 2
基元反应 2NO(g)+O2(g)2NO2(g)
v=kc(NO)2c(O2)
反应级数 n = 3
第三章 化学动力学基础
3.注意
§3.2 浓度对反应速率的影响
或
lg{k}
Ea 2.303RT
lg{k0}
k: 反应速率常数,由反应的性质和温度决定;
Ea:实验活化能,单位为kJ·mol-1,是表示反应特性 的常数;
k0:指数前因子,频率因子,对指定反应为一常数。
第三章 化学动力学基础
§3.3 温度对反应速率的影响
3.3.2 Arrhenius 方程式的应用
vB ΔcB Δt
vC
ΔcC
t
vD ΔcD Δt
浓度的单位:mol·L-1 时间的单位:s(h、min)
第三章 化学动力学基础
例:
起始浓度/(mol·L-1)
§3.1 反应速率的意义
N2 + 3H2 → 2NH3
13
0
2秒后浓度/(mol·L-1)
0.8 2.4 0.4
同一反应,可用不同物质的浓度的变化表示反应速率,其 值可能不同。
vN2
-
(0.8-1) 2
0.1mol
L-1
S-1
vH2
-
(2.4- 3) 2
0.3 mol
L-1
S-1
vNH3
(0.42
0)
0.2 mol
L-1
S-1
第三章 化学动力学基础
第三章 化学反应动力学的计算
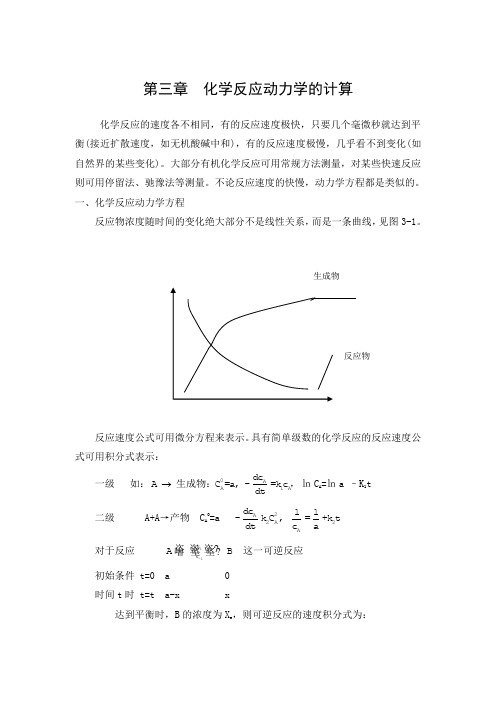
第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。
第三章 化学动力学基础

1 d pB υ ν B dt
(4)单位为mol· L-1· s-1
7
影响化学反应速率的内因是:反应物的本性。 影响化学反应速率的外因是:反应的各种条件, 主要包括反应物浓度、温度和催化剂
8
3.2浓度对反应速率的影响——速率方程式
3.2.1 化学反应速率方程 对于一般反应:aA+bByY+zZ 反应速率与反应物浓度间的定量关系为: =kc (A) c (B) 称为化学反应的速率定律或反应的速率方程式
1 k υ α β c Ac B
单位由反应级数而定: 零级反应k的单位为mol· L -1 · s-1, 一级反应k的单位为s-1, 二级反应k的单位为mol -1· L ·s-1 。 它是表征化学反应速率相对大小的物理量。大小 11 与浓度无关,但与温度有关。
2.反应级数 、——c (A)、 c(B)的指数,称为反应级数。 一般有, ≠a、 ≠b 如果=1,表示该反应对A物质为一级反应。 =2 表示该反应对B物质是二级反应。 +——反应总级数。 ★注意: 反应级数由实验确定。可以是零、正整数、分 数和负数。
35
活化络合物:指运动着的两种(或多种)反应物 分子逐渐接近并落入对方的影响范围之内而 形成的处于反应物与产物之间的一种结合状 态。例如下列反应中 NO+ O3─→O2+NO2 NO+ O3─→[O—NOO—O] ─→ O2+NO2 反应物转化为生成物的过程中,分子构型发生 连续变化,生成了活化络合物,它所处的状态 称为过渡状态。
15
3.2.3 确定化学反应速率方程的方法 ------初始速率法
其基本要点为: ①将反应物按不同的组成配制一系列混合物 ②先只改变一种反应物A的浓度,保持其它反 应物浓度不变 ③反应在某一温度下开始进行,记录一定时间间隔内 A的浓度变化,作出图cA-t,确定t=0时的瞬时速率。 若能得到至少两个不同cA条件下瞬时速率,就可确 定A的反应级数。 ④同样的方法,确定其它反应物的反应级数。 这种由反应物初始浓度的变化确定反应速率和 速率方程式的方法,称为初始速率法。
第三章酶酶活力化学动力学

A
B
常见的有消旋和变旋、醛酮异构、顺反异构和变位酶类。
合成酶,又称为连接酶,能够催化C-C、C-O、C-N 以及C-S 键的形成反响。这类反响必须与ATP分解反响相互偶联。 A + B + ATP + H2O ===AB + ADP +Pi 例如,丙酮酸羧化酶催化的反响: 丙酮酸 + CO2 + ATP + H2O 草酰乙酸+ ADP +Pi
20世纪80年代发现某些RNA有催化活性,还有一些抗体也有催化活性,甚至有些DNA也有催化活性,使酶是蛋白质的传统概念受到很大冲击。
·某些RNA有催化活性〔 ribozyme,核酶〕
1982年美国T. Cech等人发现四膜虫的rRNA前体能在完全没有蛋白质的情况下进行自我加工,发现RNA有催化活性 。
抗体:与抗原特异结合的免疫球蛋白。
抗体酶:指具有催化功能的抗体分子,在抗体分子的可变区 〔即肽链的N端〕是识别抗原的活性区域,这局部区 域被赋予了酶的属性。
1986年美国Schultz和Lerner两个实验室同时在Science上发表论文,报道他们成功地运用单克隆抗体技术制备了具有酶活性的抗体〔catalytic antibody〕。
1.高效性
E+S
P+ E
ES
能量水平
反应过程
G
E1
E2
转换数〔turnover number, TN or kcat〕:
每秒钟或每分钟,每个酶分子转换底物的分子数,或每秒钟或每分钟每摩尔酶转换底物的摩尔数。
即酶只能对特定的一种或一类底物起作用,这种 专一性是由酶蛋白的立体结构所决定的。可分为: 绝对专一性:有些酶只作用于一种底物,催化一个 反响, 而不作用于任何其它物质。 相对专一性:这类酶对结构相近的一类底物都有作 用。包括键专一性和基团专一性。 立体异构专一性:这类酶不能区分底物不同的立体异构 体,只对其中的某一种构型起作用,而 不催化其他异构体。包括光学专一性 和几何异构专一性。
化学反应动力学(全套课件582P)

或 r 1 d[Ri ]
i dt
对于气相反应,也可用压力表示反应速率:
rP
1 a
dPA dt
1 b
dPB dt
1 c
dPC dt
1 d
dPD dt
或:
rP
1
i
dPRi dt
对于理想气体: Pi ci RT
化学反应动力学
课程属性: 学科基础课 学时/学分:60/3
教 材:
《 Chemical Kinetics and Dynamics 》 J. I. Steinfeld, et al, 1999 ( Prentice Hall )
参考书 :
1《化学反应动力学原理》(上、下册) 赵学庄编 (高等教育出版社)
k = 2×104
k = 1×10-2
§1-2 反应速率的定义
( Definition of the Rate of a Chemical Reaction ) 若一个反应的化学计量式如下:
(1) a A + b B c C + d D 或写为: (2) 0 = iRi
式(2) 中,
Ri:反应物和产物。 i: 化学计量系数, 它对于反应物为负,
1 给定乙醛的初始浓度, 测定不同反应时间 的反应速率及乙醛浓度,从而确定反应的 反应级数。
则反应速率 与[CH3CHO]的平方成正比, 即称其时间级数为二级的。
2 以乙醛的不同初始浓度进行实验, 测 定不同初始浓度下的反应速率,从 而确定反应级数。
则反应速率与乙醛的初始浓度的一 次方成正比,即称其浓度级数为一 级的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.2.1 化学反应速率方程
3.2.2 由实验确定反应速率方程 的简单方法—初始速率法
3.2.3 浓度与时间的定量关系
13.02.2021
-
17
第三章 化学动力学基础
§3.2 浓度对反应速率的影响
3.2.1 化学反应速率方程
r kcA cB
上式称为化学反应的速率方程式,也称化 学反应的速率定律 。(挪威古德葆和魏格)
13.02.2021
-
18
第三章 化学动力学基础
§3.2 浓度对反应速率的影响
其中,cA,cB:反应物的浓度,单位:mol·L-1 k:速率常数(Rate Constant),不同反应有 不同的 k 值
α,β: 反应对A,B的级数
n = α+β:各反应物浓度的指数之和叫反应级数
通常,反应级数不等于化学反应方程式中该物质 的化学式的系数。
内求得的,叫平均速率,用 r 表示。
13.02.2021
-
6
第三章 化学动力学基础
(2) 表示式
§3.1 化学反应速率的概念
对化学反应:
0 νBB
r Δc(A)
B
Δc(B)
r
A
Δt
B
Δt
r Δc(C) C t
r Δc(D)
D
Δt
浓度的单位:mol·L-1
时间的单位:s(h、min)
13.02.2021
rH 2-(2 2 -3 .4 )0m .3L o -1s l-1
13.02.2021
rN3H (0 2 -0 .- 4 )0m .2L o -1s l-1
8
第三章 化学动力学基础
§3.1 化学反应速率的概念
(3) 注意
为使反应速率为正值,若以反应物表示
反应速率,则浓度变化率前要加负号 ;
2. 瞬时速率
13.02.2021
-
15
第三章 化学动力学基础
§3.1 化学反应速率的概念
对定容条件下的气相反应,反应速率 可以用反应系统中组分气体的分压对时间 的变化率来定义。则
r 1 dpB
B dt
13.02.2021
-
16
§3.2 浓度对反应速率的影响
——速率方程
(Effect of Concentration on Reaction Rate)
13.02.2021
-
4
§3.1 化学反应速率的概念
3.1.1 平均Βιβλιοθήκη 率和瞬时速率 3.1.2 定容反应速率
13.02.2021
-
5
第三章 化学动力学基础
§3.1 化学反应速率的概念
3.1.1 平均速率和瞬时速率 1. 平均速率
(1) 定义
单位时间内,某反应物或生成物浓度的 变化。
如果化学反应的速率是在一定时间间隔
13.02.2021
-
10
例:N2O5的分解反应: 2N2O5(g)→4NO2(g)+O2(g)
在340 K测得实验数据为
t /min
012345
c(N2O5)/(mol·L-1) 1.00 0.70 0.50 0.35 0.25 0.17 求反应在2分钟内的平均速率及1分钟时的瞬时速
率。
13.02.2021
定义:时间间隔Δt 趋于无限小时的平
均速率的极限值。
1c(B)
rlim rlim
Δt0
ν Δt0 B
t
13.02.2021
-
9
第三章 化学动力学基础
§3.1 化学反应速率的概念
对表示式
或
aA +bB → cC + dD
r 1 dcB νB dt
r 1d c A 1d c B1d c C1d c D ad t bd t cd t dd t
13.02.2021
-
14
第三章 化学动力学基础
3.1.2 定容反应速率
§3.1 化学反应速率的概念
化学反应在定容条件下进行时,温度不
变,系统的体积不随时间变化,物质B的物
质的量浓度cB,则定义:
rdefd 1 dcB Vdt B dt
ΔnB νB
r 被称为定容条件下的反应速率
r 1d c A 1d c B1d c C1d c D ad t bd t cd t dd t
-
11
第三章 化学动力学基础
§3.1 化学反应速率的概念
解: (1)求平均反应速率
2N2O5(g)→4NO2(g)+O2(g)
r 1Δc(N2O5) ν Δt
(0.51.0)00.1m 2 o L 1lm i1n 2(20)
13.02.2021
-
12
作图法求瞬时反应速率
浓度(N2O5)
0.92
0
13.02.2021
-
2
化学动力学(chemical kinetics)
1.化学动力学——研究化学反应的快慢(即速率)
和微观历程(或称机理)
2.
表观动力学:主要有反应级数、速率常数、活化能等
主要研 究领域
分子反应动力学:研究有关反应速率的理论
催化动力学:讨论催化剂和催化反应
宏观动力学:讨论除温度、浓度、催化剂以外的各
13.02.2021
时间t
4.2
N2O5分-解的c-t曲线 t /min
13
第三章 化学动力学基础
§3.1 化学反应速率的概念
(2)求1分钟时的瞬时反应速率
在c-t 线上任一点作切线,其斜率的负值 就是N2O5该时刻的瞬时速率
斜 率 0 .9 2 0 0 .2(m 2L o -1m l -1 )in 4 .2 0
13.02.2021
-
19
第三章 化学动力学基础
§3.2 浓度对反应速率的影响
-
7
第三章 化学动力学基础
§3.1 化学反应速率的概念
例:
N2 + 3H2 → 2NH3
起始浓度/(mol·L-1) 1
3
0
2秒后浓度/(mol·L-1)0.8 2.4 0.4
同一反应,可用不同物质的浓度的变
化表示反应速率,其值可能不同。
rN 2-(0 2-1 .8 )0m .1L o -1s l-1
第三章 化学动力学基础
§3.1 化学反应速率的意义
§3.2 浓度对反应速率的影响
§3.3 温度对反应速率的影响
§3.4 反应速率理论和反应机理简介
§3.5 催化剂与催化作用
13.02.2021
-
1
热力学: 过程的能量交换( ΔH ) 过程的方向( ΔG ) 过程的限度( K) ---可能性
动力学: 反应速率(快慢) 反应机理 (怎样进行)---现实性
种物理因素对工业生产过程中的反应的 影响,属于化学工艺学。
13.02.2021
-
3
热力学不涉入时间,当然不涉及反应速率,也 不涉及反应机理。
速率和机理是化学动力学研究的核心问题。 反应速率因不同的反应而异:
火药爆炸——瞬间 中和反应——几秒 高温固相合成无机材料、有机合成、高分子
合成——小时 橡胶老化——年 石油,煤的形成——几百万年
