羊水栓塞指南及最新进展
2024版羊水栓塞科普宣传课件pptx

03
羊水栓塞治疗与预防措施
治疗原则及方法
抗过敏
给予抗过敏药物,如肾上腺素、 地塞米松等,缓解过敏反应。
抗休克
补充血容量,应用升压药物, 纠正休克状态。
立即抢救
识别羊水栓塞症状,迅速启动 急救流程,确保母婴安全。
改善呼吸
保持呼吸道通畅,给予吸氧、 机械通气等支持治疗。
防治DIC
早期应用肝素等抗凝药物,预 防弥散性血管内凝血(DIC) 的发生。
04
并发症处理与康复指导
常见并发症及处理措施
呼吸衰竭
休克
保持呼吸道通畅,给予机械通气支持,监测 血气分析,及时调整呼吸机参数。
补充血容量,应用血管活性药物,纠正酸中 毒,维持血流动力学稳定。
弥散性血管内凝血(DIC)
多器官功能衰竭
早期识别并处理DIC,给予抗凝、补充凝血 因子等治疗。
针对受损器官进行支持治疗,如保护肝功能、 肾功能替代治疗等。
生风险。
患者教育与心理支持
知识普及
向患者及家属普及羊水栓塞相关 知识,提高其认知水平和自我防
范意识。
心理疏导
针对患者可能出现的焦虑、恐惧 等心理问题,给予心理疏导和支 持。
家属参与
鼓励家属积极参与患者的治疗和 护理过程,提供情感支持和家庭 关爱。
康复指导
对患者进行康复指导,帮助其尽 快恢复身体健康和心理健康。
题。
评估指标
02
包括生命体征、症状改善情况、生活质量等评估指标,全面评
估患者康复效果。
健康指导
03
提供健康教育和指导,帮助患者建立健康生活方式,预防疾病
复发。
05
羊水栓塞案例分析与经验教训
羊水栓塞抢救流程的最新指南

羊水栓塞抢救流程的最新指南羊水栓塞是一种罕见但极为严重的产科并发症,其发病迅速且死亡率高。
为了提高抢救成功率,本文将详细介绍羊水栓塞抢救流程的最新指南,包括早期识别、紧急处理、多学科协作等方面。
一、早期识别羊水栓塞的早期识别是抢救成功的关键。
以下为一些常见症状:1. 呼吸困难、咳嗽、气促、胸痛等呼吸系统症状。
2. 寒战、发热、皮肤潮红或发绀等过敏症状。
3. 血压下降、心率加快、尿量减少等循环系统症状。
4. 凝血功能障碍,如皮肤、粘膜出血点、瘀斑等。
一旦出现上述症状,应立即怀疑羊水栓塞,并启动抢救流程。
1. 增加氧合:保持气道通畅,尽早实施面罩吸氧、气管插管或人工辅助呼吸,维持氧供,以避免呼吸和心搏骤停。
2. 抗过敏:解除肺动脉高压,保证心排出量和血压稳定,避免过度输液。
常用药物有地塞米松、氢化可的松等。
3. 纠正凝血功能的障碍:包括积极处理产后出血,及时补充凝血因子,如输注大量的新鲜血液、血浆、冷沉淀、纤维蛋白原等。
4. 全面监测:包括血压、呼吸、心率、血氧饱和度、心电图、中心静脉压、心排出量和凝血功能等。
三、多学科协作羊水栓塞的抢救需要多学科密切协作,包括产科、麻醉科、重症医学科、血液科、儿科等。
各科室应相互配合,共同参与抢救工作。
1. 终止妊娠:如羊水栓塞发生于分娩前,应考虑立即终止妊娠。
2. 剖宫产:心脏骤停者应立即实施心肺复苏,复苏后仍无自主心跳可考虑紧急实施剖宫产。
3. 子宫切除术:一旦出现凝血功能障碍时,应果断快速的实施子宫切除术。
五、预防措施1. 提高产科医生对羊水栓塞的认识,加强培训和演练。
2. 加强产前检查,及时发现和处理高危因素。
3. 严格掌握剖宫产指征,降低剖宫产率。
4. 加强产后出血的预防和处理,及时发现和处理DIC。
总结羊水栓塞是一种罕见但极为严重的产科并发症,其抢救流程需要多学科密切协作,及时、准确地识别和处理。
通过加强培训、提高认识、严格掌握剖宫产指征等措施,可以降低羊水栓塞的发生率和死亡率。
羊水栓塞论文:羊水栓塞的诊治进展

羊水栓塞论文:羊水栓塞的诊治进展【摘要】羊水栓塞是严重的妊娠、分娩及产褥期并发症,起病急骤,来势凶险,死亡率高,是由羊水中的有形物质挤入母血循环引起。
宫缩过强是主要诱因,积极预防,早期诊断,合理使用肝素,及时终止妊娠和切除子宫,切断羊水物质来源是羊水栓塞抢救成功的关键。
【关键词】羊水栓塞;诱因;预防;治疗the progress in diagnosis and treatment of amminonic fluid embolirmhuang yanli【abstract】 amniotic fluid embolization is a serious complication during pregnancy, childbirth and puerperium, characterized by geting uprapidly , bringing dangerous, and the mortality rate is high.it caused by the visible material of amniotic fluid who pushed in the female blood circulation. contractions overpowered is the main inducement. aggressive prevention, early diagnosis, using the heparin reasonably , timely termination of pregnancy and hysterectomy, cutting the source ofamniotic fluid are all the keys to rescue successfully .【key words】amminonic fluid embolirminducement preventiontreatment羊水栓塞(amminonic fluid embolirmafe)是指分娩过程中羊水突然进入母体血循环引起急性肺栓塞、过敏性休克及弥散性血管内凝血(dineminated intravaicular coagulationdic)、肾衰竭或猝死的严重分娩并发症。
羊水栓塞的急救与处理PPT课件
.
3
二、纠正呼吸循环衰竭
1、解除肺动脉高压 为了减轻肺动脉栓塞,阻断栓塞后迷
走神经反射引起的肺血管及支气管痉挛,以缓解肺动脉高压及缺 氧,应立即应用解痉药,常用药物有如下几种。
(1)盐酸罂粟碱 首次用量30~90mg加入5%~10%GS250~500ml 中静滴。与阿托品同时应用,为解除肺动脉高压的首选药物。
.
2
一、紧急处理
立即给氧,改善肺泡毛细血管低氧,预防 肺水肿发生,减轻心脏负担。对羊水栓塞所致 的呼吸困难,用一般的鼻导管法给氧效果常不 满意,应用面罩加压给氧,流量5~10L/min。 病情严重时行气管插管以保证氧供给。保持血 氧饱和度在90%以上。尽快开放至少两条静脉 通道,便于用药及输液,同时抽取下腔静脉血 5ml用于诊断。心跳骤停者立即徒手心肺复苏。
(3)血管活性药物的应用 如果血容量基本补足,血压仍不上 升时可用血管活性药物。常用多巴胺20mg加入GS250ml中滴入。
3、防治心力衰竭 尽早进行心肌保护治疗,常用西地兰
0.2~0.4mg加入50%GS20ml静脉注射,还可用辅酶A、ATP和细胞 色素C等营养心肌药物。
.
5
三、抗过敏
羊水栓塞致肺循环病变的原因不完全是羊水中有形 成分引起的机械栓塞,羊水入血后引起一些血管活性 物质的释放才是重要因素。一旦疑诊羊水栓塞应立即 静脉推注地塞米松20mg,然后根据病情再继续滴注地 塞米松20mg。肾上腺皮质激素可解除痉挛,稳定溶酶 体,不仅可保护细胞而且还可抗过敏。
.
6
四、防治DIC
国内外一致主张尽快应用肝素,于症状发作后10min内应用 效果最好,症状典型可不等实验室结果。首次肝素用量为 25~50mg加入100ml生理盐水中60min内静脉滴入。试管法凝血时 间为20min左右,大于30min提示肝素过量,应及时停用肝素,小 于12min提示肝素剂量不足,可酌情增加肝素用量。对DIC患者早 期应用肝素,可防止新微血栓的形成。由于大量凝血因子及血小 板的消耗,再使用肝素治疗后,静脉输注新鲜全血、纤维蛋白原、 血小板悬液、洗涤红细胞和新鲜冰冻血浆,可用于治疗继发于 DIC的出血倾向。
2024版年度羊水栓塞最新PPT课件

保持呼吸道通畅 心脏骤停处理 抗过敏治疗
解除肺动脉高压
立即进行面罩给氧或气管插管, 必要时行机械通气。
给予大剂量糖皮质激素,如地塞 米松等。
2024/2/3
12
药物治疗选择及注意事项
药物选择
首选肾上腺素,可重复使用;其他药 物包括多巴胺、去甲肾上腺素等。
注意事项
5
临床表现与分型
2024/2/3
临床表现
羊水栓塞的典型临床表现包括骤然的血压下降、组织缺氧和消 耗性凝血病。患者可能出现呼吸急促、发绀、抽搐、昏迷等症 状。
分型
根据临床表现和严重程度,羊水栓塞可分为暴发型和缓慢型。 暴发型患者在短时间内出现严重的低血压、休克和急性呼吸衰 竭;缓慢型患者的症状则相对较轻,病程较长。
心电图
可出现右心负荷增加的表现,如 SⅠQⅢTⅢ征等。
尸检
肺小动脉和毛细血管内有羊水成 分。
2024/2/3
超声心动图
右心房、右心室扩大,肺动脉高 压。
胸部X线片
双肺弥散性点片状浸润影,沿肺 门周围分布,伴右心扩大。
10
03
治疗原则与方案
Chapter
2024/2/3
11
急救处理措施
立即进行心肺复苏,尽早实施电 除颤。
6
02
诊断与鉴别诊断
Chapter
2024/2/3
7
诊断标准及流程
急性低氧血症,表现为呼吸困难、紫绀或呼吸停 止
上述症状发生在分娩、剖宫产术、刮宫术或是产后短 时间内(多数发生在分娩后2小时内)
2024/2/3
急性低血压或心脏骤停 凝血功能障碍,表现为出血不止
8
足月妊娠分娩时羊水栓塞的护理措施及满意度分析

足月妊娠分娩时羊水栓塞的护理措施及满意度分析【摘要】目的:分析在足月妊娠分娩时发生羊水栓塞的护理措施及应用后产妇的满意度。
方法:于2019年8月-2020年8月,选择在我院足月分娩时发生羊水栓塞的产妇20例为研究对象,按照随机双盲法分为对照组10例,实施常规性护理方法,分为护理组10例,实施临床护理路径方法。
比较两组的抢救成功率、生活质量评分及满意度。
结果:护理组的抢救成功率高于对照组(P<0.05);护理组的生活质量评分高于对照组(P<0.05);护理组的满意度高于对照组(P <0.05)。
结论:对足月妊娠分娩时发生羊水栓塞产妇实施临床护理方法,可提升抢救成功率,改善生活质量并提升护理满意度。
【关键词】足月妊娠;羊水栓塞;护理;满意度前言孕妇在分娩过程中会因羊水入侵机体血液循系统引起产妇肺栓塞、休克、弥漫性血管内凝血及肾衰竭等病理改变,以上综合征称为是羊水栓塞[1]。
该症多发于分娩阶段,在分娩过程中因宫缩力过大和羊膜腔内压力增加等影响,导致羊水进入产妇的机体循环系统,进而诱发系列的并发症。
羊水中因有组织因子类似物,在进入血液系统后会启动外源性凝血系统,使得微血管发生大面积血栓,极易造成血小板的损害。
为此为预防和提高羊水栓塞的抢救成功率[2],本文主要就临床护理路径方法的应用展开分析,现总结为下。
1资料与方法1.1一般资料研究区间2019年8月-2020年8月,选取20例在我院分娩时发生羊水栓塞的产妇为研究对象,按照随机双盲法分为对照组(n=10)和护理组(n=10),对照组年龄为25-37岁,年龄均值为(31±2.5)岁,孕周为37-40周,均值为(38.5±2.4)周;护理组中年龄为26-38岁,年龄均值为(32±2.1)岁,孕周为37-41周,均值为(39±2.2)周,分析两组产妇一般资料,差异不具有统计学意义(P>0.05)。
纳入标准:符合临床关于羊水栓塞相关诊断标准;经医护人员告知产妇及家属对研究知情并签署知情同意书,排除标准:合并其他重大疾病产妇;治疗依从性较差产妇;神经功能不全产妇。
羊水栓塞2018指南

• 2.当其他原因不能解释的急性孕产妇心、肺功能衰竭伴以下1种或几种情况:低 血压、心律失常、呼吸短促、抽搐、急性胎儿窘迫、心脏骤停、凝血功能障碍、 孕产妇出血、前驱症状(乏力、麻木、烦躁、针刺感),可考虑为AFE。这不包 括产后出血但没有早期凝血功能障碍证据者,或其他原因的心肺功能衰竭者。
羊水栓塞2018
重症医学科
羊水栓塞:
• AFE的发病机制尚不明确。通常认为,当母胎屏障破坏时,羊水成分进入母体循环, 一方面引起机械性的阻塞,另一方面母体将对胎儿抗原和羊水成分发生免疫反应, 当胎儿的异体抗原激活母体的炎症介质时,发生炎症、免疫等“瀑布样”级联反应, 从而发生类似全身炎症反应综合征,引起肺动脉高压、肺水肿、严重低氧血症、呼 吸衰竭、循环衰竭、心脏骤停及孕产妇严重出血、DIC、多器官功能衰竭等一系列 表现;在这个过程中,补体系统的活化可能发挥着重要的作用。
• 3.凝血功能障碍:大部分AFE孕产妇存在DIC,发生率高达83%以上,且可为AFE的首发表 现。表现为胎儿娩出后无原因的、即刻大量产后出血,且为不凝血,以及全身皮肤黏膜 出血、血尿、消化道出血、手术切口及静脉穿刺点出血等DIC表现。
• 4.急性肾功能衰竭等多器官功能损害:AFE孕产妇的全身器官均可受损,除心、肺功能衰 竭及凝血功能障碍外,肾脏和中枢神经系统是最常受损的器官和系统,存活的AFE孕产妇 可出现肾功能衰竭和中枢神经系统功能受损等表现。
羊水栓塞:
• AFE的诊断强调为细致、全面的排他性诊断。排除导致心力衰竭、 呼吸衰竭、循环衰竭的疾病,包括肺栓塞、心肌梗死、心律失常、 围产期心肌病、主动脉夹层、脑血管意外、药物性过敏反应、输 血反应、麻醉并发症(全身麻醉或高位硬膜外阻滞)、子宫破裂、 胎盘早剥、子痫、脓毒血症等。
2024羊水栓塞产妇的抢救经过及反思

2024羊水栓塞产妇的抢救经过及反思近年,围生期产妇栓塞性疾病呈递增状态,其中,羊水栓塞危险性最大,对其防治措施尤为关键。
羊水栓塞发病急,病情凶险,多发生于分娩过程中,亦可发生于中期妊娠引产及钳刮术中。
发生在孕足月分娩者,死亡率高达70%〜80%,是孕产妇死亡的重要原因。
随着人们生活质量的提高,对护理质量的要求逐年提高,对产妇护理工作提出了更高的要求,近期,我们医院成功抢救一名羊水栓塞的孕产妇。
病例回顾患者:李某,女,29岁,2021-07-1912:19患者因宫口开大2cm于16:00送入产房,16:27患者突然出现抽搐、面色青紫,紧急联系手术室准备手术,行心电监护,心电监护示心率70次/分、血压及血氧饱和度未测出,未触及到颈动脉搏动,考虑心脏骤停,立即予心肺复苏,同时立即予气管插管、肾上腺素、阿托品等抢救药物治疗,考虑羊水栓塞,T16:43将患者紧急转入手术室继续抢救,16:45于手术室患者心跳恢复、瞳孔散大、昏迷状态,GCS评分3分,立即行剖宫产术,术后完善增强CT诊断为肺栓塞,转入ICU进一步治疗。
2021-07-1920:10气管插管呼吸机辅助呼吸心电监护示P113次/分,BP120∕63mmHg,血氧饱和度100%,麻醉未醒。
双侧瞳孔等大等圆,直径2.0mm,光反存在。
腹腔引流通畅,腹壁引流通畅,尿管通畅,尿色清。
腹部右侧一腹腔引流管、一腹壁引流管,腹部左侧一腹腔引流管,一前鞘下引流管,腹腔引流管接引流袋记量,腹壁、前鞘下引流管均接负压引流球记量,均引流出血性液体。
2021-07-19血红蛋白47g/L给予冷沉淀10u红细胞2u血浆400ml z血压低,给予肾上腺素升压,效果不佳,予垂体,间羟胺静脉泵入,血压维持在100∕60mmHg o2021-07-20患者持续气管插管接呼吸机辅助呼吸,持续去甲肾上腺素、垂体后叶素、间羟胺、右美托泵入。
双侧瞳孔等大等圆,直径为5.0mm,对光反射迟钝;给予床边B超,心脏彩超,床边胸片,血气分析示血红蛋白73g/L,给予冷沉淀15u,红细胞6u,血浆IoOOml静脉滴入后,急诊行经右侧股动脉行腹腔动脉造影+腰动脉栓塞术。
2024年最新羊水栓塞

最新羊水栓塞最新羊水栓塞研究进展及临床处理策略摘要:羊水栓塞是一种罕见但严重的孕产妇并发症,其特点是起病急骤,进展迅速,对母婴生命安全构成极大威胁。
本文旨在综述最新羊水栓塞的研究进展,包括病因学、病理生理学、临床表现、诊断方法及治疗策略,以期为临床医生提供参考。
关键词:羊水栓塞;研究进展;临床处理;孕产妇并发症一、引言羊水栓塞(AmnioticFluidEmbolism,AFE)是一种罕见但危及生命的孕产妇并发症,其特点是起病急骤,进展迅速,对母婴生命安全构成极大威胁。
尽管AFE的发病率较低,但死亡率较高,因此,对于AFE的研究和认识不断深入,旨在提高其早期诊断和有效治疗的能力。
二、病因学1.胎盘异常:胎盘早剥、胎盘植入等胎盘异常情况可能导致羊水栓塞的发生。
2.子宫收缩过度:子宫收缩过度可能导致羊膜破裂,使羊水进入母体循环系统。
3.胎儿毛发、角化物质等进入母体循环:羊水中含有胎儿毛发、角化物质等,这些物质可能通过破裂的羊膜进入母体循环系统,引起AFE。
三、病理生理学1.羊水进入母体循环:羊水中的胎儿毛发、角化物质等进入母体循环后,可能引起过敏反应、血栓形成等。
2.炎症反应:羊水栓塞时,羊水中的胎儿毛发、角化物质等可能激活母体免疫系统,引发炎症反应。
3.循环系统障碍:羊水栓塞可能导致母体循环系统的障碍,如肺动脉高压、心脏负荷加重等。
四、临床表现羊水栓塞的临床表现多种多样,常见症状包括呼吸困难、胸痛、心慌、咳嗽、发绀、意识丧失等。
AFE还可能导致胎儿宫内窘迫、胎儿死亡等严重后果。
五、诊断方法羊水栓塞的诊断主要依赖于临床表现和辅助检查。
常用的辅助检查方法包括:1.血常规:血常规检查可发现母体血液中存在胎儿毛发、角化物质等。
2.胸部X线检查:胸部X线检查可发现肺部浸润、肺动脉高压等表现。
3.心电图:心电图检查可发现心脏负荷加重、心律失常等表现。
4.超声心动图:超声心动图检查可发现心脏结构和功能异常。
六、治疗策略羊水栓塞的治疗策略主要包括支持治疗、抗过敏治疗、抗凝治疗、手术治疗等。
羊水栓塞dic阶段处理原则

羊水栓塞DIC阶段处理原则1.引言羊水栓塞是指胎儿或胎盘中的羊水进入母体循环系统,引起肺动脉高压和肺循环障碍,并导致母体循环衰竭的一种罕见但严重的并发症。
其病理生理机制复杂,临床表现多样,治疗困难重重。
羊水栓塞可引起DIC(弥漫性血管内凝血)的发生,而羊水栓塞DIC是其严重阶段之一。
本文将就羊水栓塞DIC阶段的处理原则进行探讨,并提供个人观点和理解。
2.羊水栓塞DIC的定义和特点羊水栓塞DIC是指羊水栓塞在发生后,由于病理生理机制的影响,导致机体发生弥漫性血管内凝血。
该病理过程中,血液中的凝血因子和纤溶酶系统失衡,引起血小板减少、纤维蛋白原降低和血管壁受损,最终导致凝血、溶解和纤维化的紊乱。
羊水栓塞DIC的特点是病情进展迅速,且具有很高的病死率。
3.羊水栓塞DIC阶段的处理原则3.1 尽早诊断和急救羊水栓塞DIC的处理需要紧急而迅速的响应。
首要任务是尽早诊断该病,并立即进行急救措施。
医疗人员应该对患者的病史、症状和实验室检查结果进行综合分析,以早期发现并诊断羊水栓塞DIC。
一旦确诊,急救措施包括维持患者呼吸和循环稳定,给予氧气和纠正酸中毒等。
3.2 控制DIC的进展DIC是羊水栓塞DIC的主要病理生理机制之一,在处理过程中,需要控制DIC的进展。
这可以通过供给足够的血小板和凝血因子来实现。
补充血小板和凝血因子的输注,可以帮助恢复凝血功能和控制DIC的发展。
抗凝和纤溶治疗也是控制DIC进展的重要手段,例如使用肝素和抗纤溶药物等。
3.3 病因治疗和分娩在治疗羊水栓塞DIC阶段时,应尽早寻找病因并进行针对性治疗。
病因可能包括胎盘早剥、子宫破裂等,需要及时处理这些原发病因,以减轻病情的进展。
在羊水栓塞DIC的处理中,分娩也是必要的步骤。
通过分娩,可以减轻胎儿对母亲的负担,降低母体的病死率。
4.个人观点和理解羊水栓塞DIC是一种危重病症,而其处理的关键在于尽早诊断和急救。
在处理过程中,控制DIC的进展、寻找和治疗病因以及进行分娩是不可或缺的步骤。
2024年羊水栓塞应急预案

羊水栓塞应急预案1.引言羊水栓塞是一种罕见但严重的孕产期并发症,通常发生在分娩过程中或分娩后立即。
它是指羊水中的胎儿细胞、毛发、羊水脂肪等物质进入孕妇的循环系统,引起过敏反应和凝血异常,导致呼吸困难、心脏骤停、休克等严重症状。
羊水栓塞的发病率和死亡率均较高,因此,制定羊水栓塞应急预案至关重要。
2.预警机制2.1孕妇风险评估医院应对所有孕妇进行羊水栓塞风险评估,包括高龄、多胎妊娠、过熟儿、胎儿生长受限、羊水过多、胎盘早剥、胎儿窘迫等高危因素。
对于具有高危因素的孕妇,应加强监测和评估,及时发现羊水栓塞的早期征兆。
2.2羊水栓塞早期征兆医护人员应熟练掌握羊水栓塞的早期征兆,包括孕妇出现呼吸困难、胸痛、心慌、气促、面色苍白、血压下降等症状。
一旦发现这些征兆,应立即启动应急预案。
3.应急处置流程3.1紧急救治孕妇出现羊水栓塞征兆时,医护人员应立即进行紧急救治,包括保持呼吸道通畅、给予高浓度氧疗、建立静脉通道、进行心肺复苏等。
同时,通知产科、麻醉科、重症医学科等相关科室进行会诊。
3.2药物治疗根据孕妇病情,给予抗过敏、抗休克、抗凝血、纤溶等药物治疗。
对于凝血功能异常的孕妇,应及时输注新鲜冰冻血浆、血小板等血制品。
3.3手术治疗如孕妇出现严重凝血功能障碍、胎儿窘迫等情况,应立即进行剖宫产手术。
术中注意控制出血,术后密切观察孕妇生命体征和出血情况。
3.4转诊对于基层医院无法处理的情况,应及时将孕妇转诊至具备救治条件的上级医院。
转诊过程中,保持与上级医院的沟通,提前告知孕妇病情和救治情况。
4.预防措施4.1健康宣教加强孕产妇羊水栓塞防治知识的宣传教育,提高孕产妇的自我防护意识。
孕妇应定期进行产前检查,及时发现并处理高危因素。
4.2产时监护产时密切监测孕妇生命体征,及时发现羊水栓塞的早期征兆。
对于具有高危因素的孕妇,应加强监护,必要时进行剖宫产。
4.3产后护理产后密切观察孕妇生命体征和出血情况,及时发现并处理产后并发症。
羊水栓塞最新共识

临床表现
AFE通常起病急骤。
通常在分娩过程中或产后立即发生,大多发生在胎 儿娩出前2 h 及胎盘娩出后30 min内。
有极少部分发生在中期妊娠引产、羊膜腔穿刺术中 和外伤时。
AFE的典型临床表现为产时、产后出现突发的低氧 血症、低血压和凝血功能障碍。
前临驱床症状表现
(30%~40%)
●憋气、呛咳、呼 吸急促、心慌、胸 痛、寒战、头晕、 恶心、呕吐、乏力、 麻木、针刺样感觉、 焦虑、烦躁、精神 状态改变和濒死感 [1-2] ●胎心监护:减速、 基线变异消失等。
诊断
急性孕产妇心、肺功能衰竭
低
心
呼
抽急
心
凝
孕
前
血
律
吸
搐性
脏
血
产
驱
压
失
短
胎
骤
功
妇
症
常
促
窘
停
能
出
状
障血
碍
伴有一种或几种情况,可考虑为AFE
鉴别诊断
AFE的诊断强调为细致、全面的排他性诊断。 AFE需特别注意与严重产后出血引起的凝血功能异常相鉴别。一 旦产后很快发生阴道流血且为不凝血,或大量阴道流血及与出血 量不符的血压下降或氧饱和度下降,应立即进行凝血功能的相关 检查,如出现急性凝血功能障碍,特别是有低纤维蛋白原血症时 [4,8],应高度怀疑AFE或者胎盘早剥。在分娩过程中或产后出现 心肺、凝血功能异常等表现时,在保证基本的呼吸循环支持治疗 的同时,充分结合病史、发病特征及凝血功能等辅助检查结果, 多数情况下做出正确的鉴别诊断并不困难,重要的是能考虑到 AFE的诊断。
谢谢您的聆听
(四)产科处理 若AFE发生在胎儿娩出前,抢救孕妇的同时应及时终止妊娠,行阴
羊水栓塞ppt课件ppt(共24张PPT)

手术时机
手术方式
根据患者具体情况选择合适的手术方 式,如剖宫产术、子宫切除术等。在 手术过程中应注意止血、输血、预防 感染等措施的应用。
尽早手术干预,以减轻组织缺氧和器 官功能损害。
04
并发症预防与处理策略
常见并发症类型
1 2
产后出血 由于羊水栓塞导致凝血功能障碍,可能引发产后 出血。
立即给予氧气吸入,必 要时行气管插管或气管 切开,确保呼吸道通畅。
抗过敏
迅速给予大剂量糖皮质 激素,如地塞米松等, 以抗过敏、抗炎、抗休
克治疗。
纠正缺氧
抗休克
给予高流量吸氧,提高 血氧饱和度,改善组织
缺氧状态。
补充血容量,应用升压 药物及多巴胺等血管活 性药物,维持血压稳定。
药物治疗选择及原则
首选肾上腺素
THANKS
感谢观看
补充血容量,应用升压药物和 多巴胺等血管活性药物维持血 压稳定。
立即抢救
一旦怀疑孕妇发生羊水栓塞, 应立即组织多学科协作抢救团 队,进行紧急救治。
抗过敏治疗
给予大剂量糖皮质激素抗过敏 治疗,同时应用抗组胺药物和 钙剂等药物辅助治疗。
纠正凝血功能障碍
早期应用肝素等抗凝药物,补 充凝血因子和血小板等血液制 品,纠正凝血功能障碍。
为家属提供必要的培训和教育, 帮助他们更好地理解和支持患者
的康复过程。
06
总结回顾与展望未来进 展方向
本次课程重点内容回顾
01
02
03
04
羊水栓塞的定义、病因 和病理生理机制
羊水栓塞的临床表现、 诊断和鉴别诊断
羊水栓塞的治疗和预防 措施
羊水栓塞的并发症和预 后
羊水栓塞ppt课件

制定和完善羊水栓塞的诊疗规 范,指导临床实践。
加强多学科协作
建立多学科协作机制,提高羊 水栓塞的综合诊治能力。
加强患者教育和宣传
提高患者对羊水栓塞的认识和 自我保健能力。
THANKS FOR WATCHING
感谢您的观看
多器官功能衰竭预防与处理
01
合理用药,避免药物对器官的损害。
02
处理措施
一旦发生多器官功能衰竭,立即进行器官功能支持治疗。
03
多器官功能衰竭预防与处理
根据病情选择合适的支持治疗 措施,如机械通气、血液透析 等。
加强营养支持和免疫治疗,提 高患者抵抗力。
积极处理原发病和并发症,促 进器官功能恢复。
抗休克
补充血容量,应用升压药物和血管活 性药物,如多巴胺、间羟胺等,维持 血压稳定。
防治DIC和肾衰竭
防治DIC
早期应用肝素抗凝治疗,补充凝血因子,如新鲜冰冻血浆、冷沉淀等。
防治肾衰竭
监测尿量,及时应用利尿剂,如呋塞米等,保护肾功能。必要时行连续性肾脏替代治疗(CRRT)。
产科处理
终止妊娠
对于胎儿已成熟或病情严重者,应及时终止妊娠。根据产妇和胎儿情况选择合适的分娩方式,如剖宫产或阴道分 娩。
减轻焦虑和恐惧
羊水栓塞是一种紧急情况 ,患者容易产生焦虑和恐 惧情绪,心理支持有助于 减轻这些负面情绪。
增强信心
通过心理支持,患者可以 更好地了解疾病和治疗方 案,从而增强对治疗的信 心。
方法
采用认知行为疗法、放松 训练、家庭支持等方法进 行心理支持。
家属沟通技巧及培训
沟通技巧
指导家属如何与患者进行有效沟 通,如倾听、表达关心和支持等
05 患者教育与心理支持
羊水栓塞

羊水栓塞
病理生理
传统的观点(机械性梗阻学说):AFE的发生主要是羊 水及其中的有形物质如胎儿鳞状上皮细胞、胎粪、胎 脂、毳毛等进入母体循环引起肺血管的物理性的阻塞 和痉挛所致 有研究不支持上述观点 1. 动物实验不能验证 2. 发现死于其他疾病的部分孕产妇循环血中也找到了 胎儿细胞 3. 影像学检查结果并不支持有形成分阻塞肺血管
羊水栓塞
美国母胎医学会指南要点
分娩前AFE发生心跳骤停时,建议孕龄23周以上者立即分娩
AFE 治疗时适当的给氧和通气非常关键,当血流动力学发生改变时
血管活性药物以及心脏正性肌力药物的使用 推荐早期评估凝血功能,早期积极处理产后出血
羊水栓塞
小结
罕见、难以预测、突发、凶险的分娩期并发症
别诊断中考虑到 AFE 可能
不推荐任何特异性的实验室诊断用于确诊或排除AFE,AFE目前仍然 是一项临床诊断
AFE 患者发生心跳骤停,必须就地展开高质量心肺复苏,包括标准
的基础心脏生命支持(BCLS)和高级心脏生命支持(ACLS) 推荐包括麻醉、呼吸、重症医学母胎医学等专家在内的多学科会诊, 共同处理
羊水栓塞
羊水栓塞-发病率
发病率:
不同报道为2.0:100,000 - 7.7:100,000 不等 我国:6.7~20.7/10万
(余艳红,第三届国产医学新进展高峰论坛论文汇编)
羊水栓塞
羊水栓塞-死亡率
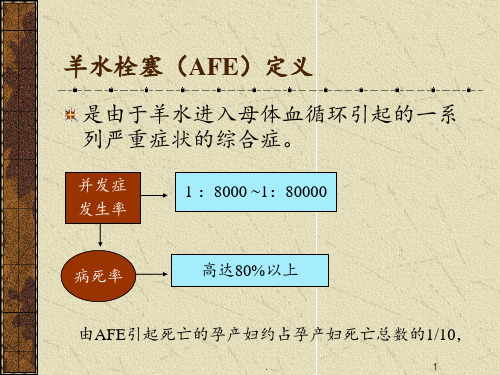
死亡率: 早年可达61-ຫໍສະໝຸດ 6%近年来下降至13-26%
发达国家 近10年中所有孕产妇死亡中AFE所致占5%~15% 我国 1996年全国孕产妇死亡中AFE所致占20.7%
20
羊水栓塞
美国羊水栓塞诊断标准
羊水栓塞诊治指南

羊水栓塞的诊治指南羊水栓塞的诊断救治剖宫产最严重的并发症就是羊水栓塞,其发生率虽然不高,但一旦发生,死亡率极高。
掌握羊水栓塞的急救确实是麻醉医生必备的基本功。
表现为突然出现的呼吸困难、紫甘,迅速进入昏迷,休克、DIC【病因学】羊水中的有形物质进入母体血循环而引起一系列病理生理变化。
羊水中的有形物质包括:扁平上皮、毳毛、胎脂、胎粪、粘蛋白等。
其诱因如下:经产妇居多;多有胎膜早破或人工破膜史;常见于宫缩过强或缩宫素(催产素)应用不当;胎盘早期剥离、前置胎盘、子宫破裂或手术产易发生羊水栓塞;死胎不下可增加羊水栓塞的发病率。
羊水进入母体循环的条件是胎膜已破;有较强的子宫收缩;血管开放。
进入的途径为子宫颈内膜静脉及子宫下段静脉;胎盘边缘静脉窦;损伤的子宫血窦,如子宫破裂、子宫颈裂伤。
【发病机理】 1.急性呼吸循环衰竭:羊水中存在来自胎儿的微粒物质,一旦进入母体血循环,则微粒物质栓塞造成小血管机械性阻塞,这些微粒物质还具有化学介质性质,能刺激肺组织产生和释放前列腺素F2α 、E2 5-羟色胺等血管活性物质。
使肺血管发生痉挛,致肺动脉压升高,右心负荷加重,左心房压急剧下降,于是心搏出量明显减少,肺回流量也明显下降,肺通气与血流比例失调,最终致末梢循环衰竭,急性右心衰竭和急性呼吸衰竭。
死亡病例中的75%死于此种原因。
此外,羊水中作用于胎儿的抗原物质可引起过敏反应而导致休克。
2.急性弥散性血管内凝血(DIC):羊水进入母体循环后引起凝血功能障碍,一般认为羊水中含的促凝物质类似于组织凝血活酶(因子),可激活外源性凝血系统,导致DIC。
除此外羊水中还含有第因子激活物质、肺表面活性物质及胎粪中的胰蛋白酶样物质,这些促凝物质促使血小板聚积,使凝血酶原转化为凝血酶,同样通过血液的外凝系统激活了血凝而发生急性DIC,血中纤维蛋白原被消耗而下降,纤溶系统被激活造成高纤溶症及凝血障碍。
此外纤维蛋白裂解产物蓄积,羊水本身又抑制子宫收缩,使子宫张力下降,致使子宫血不凝而出血不止。
2024版羊水栓塞诊断与处理专家共识解读(PPT课件)

并发症预防
积极预防并发症的发生,如感染、 多器官功能衰竭等,加强患者护
理和营养支持。
并发症治疗
对于出现的并发症,给予相应的 治疗措施,如抗感染治疗、器官
功能支持等。
康复期管理
在患者康复期间,加强随访和管 理,评估患者恢复情况,提供必
要的康复指导和心理支持。
05
专家共识解读与临床实 践指导
CHAPTER
03
及时诊断并采取相应治疗措施,包括抗过敏、抗休克、纠正凝
血功能障碍等对症治疗,成功挽救患者生命
典型案例分析讨论
案例二
羊水栓塞导致产妇死亡的悲剧
诊断与治疗过程
虽经积极抢救,但因病情过重,最终抢救无 效死亡
患者情况介绍
高龄产妇,剖宫产术中突发羊水栓塞
经验教训
应加强对高龄产妇的关注和管理,提高医务 人员对羊水栓塞的认识和应急处理能力
呼吸循环衰竭
突发呼吸困难、发绀、心 动过速、低血压甚至休克 等。
出血
以子宫出血为主,切口渗 血、全身皮肤黏膜出血、 针眼渗血、血尿、消化道 大出血等。
临床表现及分型
多脏器损伤
全身脏器均可受损,除心 肺功能衰竭及凝血功能障 碍外,中枢神经系统和肾 脏是最常见受损的器官。
分型
根据病情严重程度可分为 三型
羊水栓塞诊断与处理 专家共识解读(PPT 课件)
目录 CONTENTS
• 羊水栓塞概述 • 羊水栓塞危险因素及预防 • 羊水栓塞诊断方法与技术 • 羊水栓塞处理原则与策略 • 专家共识解读与临床实践指导 • 总结与展望
01
羊水栓塞概述
CHAPTER
定义与发病机制
01
02
03
04
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
存在DIC。经食道超声能够提示急性右心功能不全及肺动
脉高压[24]。
•
• 免疫反应标记物是否是相关性非常好的诊断标志目前尚未 明确,但可作为诊断AFE的参考指标:
•
•
血清类胰蛋白酶:在经典的抗原抗体介导的过敏反应
• 心跳呼吸骤停和凝血功能障碍是AFE病例死亡的主要原因。 顽固性心脏停跳患者往往会存在三种经典的致命性心律失 常之一:室颤、无脉性电活动、心脏停搏,可能反映了导 致心脏骤停的不同机制:低氧、直接心肌抑制、凝血功能 障碍引起的大出血[9]。对于初始表现为循环衰竭和凝血功 能者,抢救成功后往往发生肺损伤或急性呼吸窘迫综合征 (ARDS)。对于初始表现为心跳骤停者,复苏后常发生 包括缺氧性脑损伤在内的多器官功能衰竭。
• 母体循环中炎症介质和内源性儿茶酚胺浓度的上升可引起 短暂性体循环和肺循环压力升高、子宫平滑肌张力增加等 [16],这一过程通常发生在最初的30分钟内。肺动脉高压 导致通气血流比例不足进而产生缺氧,并发心肌抑制、肺 及中枢神经系统损伤。宫腔压力升高降低胎儿血供,发生 胎儿缺氧、胎心率改变。
• 免疫学机制在AFE发生中扮演重要的角色。补体系统是机 体抵御外来入侵物质第一道防线,羊水进入母体循环可刺 激肥大细胞脱颗粒和组胺释放,进而激活补体[17]。 Benson等[17,18]发现羊水栓塞患者体内补体C3和C4显 著低于正常产妇。最近Tamura等[19,20]的研究也表明羊 水栓塞患者的C1酯酶抑制剂(C1INH)显著降低。 C1INH不仅能降低C1酯酶的活性,还能抑制影响因子Ⅻa、 Ⅺa和激肽释放酶的活性。这些发现都证实了补体系统在 AFE发病机制中的重要性,补体活化可直接、间接导致机 体自身组织损伤,这可能是肺部损伤、肺功能障碍的主要 原因,因而有人认为补体活化可能是AFE的始动环节。 Chen等[21]详细描述了羊水如何通过中性粒细胞的激活和 血小板的聚集诱发炎症反应。Stefano等[22]还提出了“免 疫风暴,ImmunologicStorm”学说,认为:孕妇的免疫 系统处于抑制状态,当羊水进入母体循环后,通过“三低”[2],即低氧血症、 低血压和低凝血功能。但是,具体AFE病例的临床表现取 决于主要被累及的脏器和系统,因此AFE的临床表现具有 多样性。
•
AFE通常发生于分娩过程中,但也可能发生在产后48
小时之内,Knight等人在对英国的60例患者研究中发现,
AFE最常发生在分娩前2小时到分娩后4小时这个时间段内。
• 早期的研究显示,AFE的死亡率高达61~86%[5]。最近的 一项统计性研究分析了英国在2005年到2014年期间所有 被诊断为AFE的病例,结果提示AFE的死亡率为19%[8]。 AFE总体死亡率的降低可能与早期的诊断标准比较宽松、 近年来AFE的复苏救治能力的提高有关。也有学者认为, 如果采用严格的AFE诊断标准,符合AFE所有经典临床表 现(症状和体征)的病例死亡率仍然居高不下[2]。而许多 幸存者又存在因缺氧导致的永久性神经损害[9]。AFE产妇
•
• 事实上,早在上世纪50年代,医学专家们就已经注意到仅 仅羊水成份或胎儿组织进入母体循环并不足以发生AFE, 而孕产妇个体对羊水成份的特异反应是AFE发生的决定性 因素[14]。由于绝大多数的AFE的临床表现类似于全身性 炎症反应综合征(SIRS),有人认为“羊水栓塞”这一 名称不够恰当,Clark[9]等人提出了用一个新名称代替 “羊水栓塞”,即“妊娠类过敏样综合征” (AnaphylactoidSyndromeofPregnancy)。这个名称能 较好地体现目前被广泛接受的AFE的发病机制和病理生理 改变。但是,由于“羊水栓塞”一词已经使用了较长的历
• 羊水栓塞(AmnioticFluidEmbolism,AFE)是指由于羊 水进入母体循环所引起的呼吸循环衰竭、凝血功能障碍等 病理改变的产科特有的一种严重综合征。从1926年被 Meyer[1]首次报道并命名至今已近100年,羊水栓塞仍然 是产科最困惑、最致命的并发症之一[2]。即使在发达国家, 羊水栓塞依然是孕产妇死亡的首要原因[3]。随着临床病例 数量的积累、研究技术的发展、研究方法的改进,对羊水 栓塞的认识(特别是发病机制、病理生理改变、诊断标志 物等方面)有了较长足的深入。本文通过复习现有文献, 对羊水栓塞的发病率、发病机制、诊断和临床管理等方面 的进展做一综述,供临床医生参考。
史,而且读起来比较顺口,根植于广大医务人员和研究者
心中,所以“妊娠类过敏样综合征”这一名称还没有被接 受和广泛使用。
• 目前认为,AFE发生的基础是:分娩过程中,母胎屏障被 破坏,羊水通过母胎屏障的破口(子宫颈内膜静脉、子宫 下段的静脉以及子宫损伤和胎盘附着部位)进入母体循环。 在此基础上,敏感的母体由于胎儿的异体抗原激活致炎介 质产生炎症、免疫等瀑布样级联反应[2,15]。
发病率和病死率
• 虽然AFE病例的绝对数量不多,但在孕产妇死亡病例中的 比例很高,特别是分娩过程中因为意外性心血管功能衰竭 致死的病例中,羊水栓塞往往是最常见的诊断[3]。由于羊 水栓塞的临床表现多样、羊水栓塞的诊断缺乏统一的标准, 确切的羊水栓塞发病率的统计具有一定的困难。最新文献 报道的羊水栓塞发病率为1.9/100000~6.1/100000,其中 英国为1/52600,澳大利亚为1:163934,美国为1: 129535。有研究表明,年龄30岁-39岁行剖宫产的产妇, AFE的发病率呈上升趋势[6,7]。
娩出的新生儿的结局取决于多个因素,主要与母体状态有 关。有报道AFE新生儿的死亡率高达40%[4],遗留神经并 发症的比例接近50%[9]。
发病机制和病理生理学改变
• 传统观点认为,AFE是由鳞状上皮,无定形碎片,胎脂、 黏液或毳毛等羊水羊水有形成分进入母体循环,阻塞肺小 动脉和毛细血管,进而产生缺氧、右心衰、休克等一系列 严重临床症状,即所谓的“机械性梗阻学说”。
• 值得注意的是,在肺血管中检测到羊水的任何成分,都不 再作为AFE的诊断标准[9,14,20]。
•
•
此外,临床上还需其他辅助检查作为诊断依据,比如
心电图,胸片,CT平扫,超声心动图,凝血功能检测,
动脉血气分析等。其中动脉血气分析有助于确定是否存在
通气不足并评估缺氧程度,凝血功能检测有助于判断是否
•
AFE的临床进程被人为分为三个阶段。第一阶段:由
于一过性的肺循环和体循环高血压,导致通气血流比例失
调和低氧血症。主要表现为神志改变、呼吸困难、血氧饱
和度下降、循环衰竭等。第二阶段:由于心肌缺氧的加重
(而肺循环压逐渐正常)和凝血功能受损,主要表现大出
血、DIC、心衰等。第三阶段:随着大出血、缺氧的进一
• 但是,众所周知,大部分AFE病例没有完整的经典三联征 (三低)表现。因此,AFE的诊断采用排他性方法,目前 被较多采用的诊断标准有两个,即英国产科监控系统 (UKOSS)和国际AFE注册中心的诊断标准,两者大同 小异,主要内容为:围产期妇女(特别是分娩期间和分娩 后即刻)出现急性循环衰竭、呼吸困难/低氧、DIC和/或 神志改变等任何两个表现,在充分排除其他医疗解释后, 应考虑AFE[31]。
血功能障碍,研究者的结论不一,甚至相反。最近发现,
妊娠晚期羊水中除了含有促凝物质外,还富含组织因子抑 制剂[15],这或许能部分解释正常分娩产妇循环中有羊水 成份却极少发生AFE(凝血功能障碍)的原因。最近的个 例报道认为,AFE的凝血功能障碍与纤溶亢进的较早启动 有关[26]。
• 有趣的是,Clark[2]认为,产科两个最常见的消耗性凝血 功能障碍的疾病(羊水栓塞和严重胎盘早剥)的病理生理 学(有关凝血功能异常)的机制可能是相似的,都与胎儿 组织进入具有高敏特质的母体循环导致的炎症介质的大量 释放、凝血链条的启动有关。
步加剧,主要表现为组织损伤和终末器官衰竭或多器官功
能衰竭(MODS)。但是,并不是所有AFE的临床表现都
能被清晰的分为三个阶段。
• Clark等分析了大量AFE病例后发现,AFE最常见的临床表 现为在低血压(100%)和胎儿窘迫(100%),心跳呼吸 骤停(87%),肺水肿(93%)和凝血功能障碍(83%)。 其中最常见的前驱症状主要为呼吸急促、憋气、胸痛、发 冷、头晕、心慌、肢体感觉异常、恶心和呕吐。
羊 水 栓塞
遵义市第五人民医院妇产科 罗昭永
羊水栓塞最新进展
• 摘要:羊水栓塞(AFE)是一种罕见的、难以预测、灾难 性的产科特有的临床综合征,严重威胁母婴安全。尽管对 AFE的认识有所提高,AFE仍然是孕产妇死亡的主要原因。 AFE的发病机制至今尚未完全明了,现有的理论不支持传 统的单纯“机械性梗阻”学说。而认为AFE发病机制主要是 敏感母体对羊水成份产生抗原抗体反应和内源性介质释放, 从而引起低氧、低电压和低凝血功能的“三低”临床症状, 即“妊娠类过敏样反应综合征”学说。AFE的诊断主要依 据临床表现和排他性方法,以及免疫介质类指标如补体 C3、C4、STN抗原等。羊水栓塞的治疗主要采取支持性、 对症性方法,强调多学科合作。
• 胎儿娩出前发生AFE,几乎所有病例都会胎心率改变:胎 心晚减速,更常见的为持续胎心减慢。即胎儿急性宫内窘 迫可能会先于产妇其他临床表现出现[2],需要提高警惕。
•
诊断
•
AFE诊断主要基于临床表现。分娩期间或胎儿娩出后
即刻出现经典的三联征:低氧、低血压、低凝血功能(三
低症状)是诊断AFE的金标准9。
补体的激活。
危险因素
• AFE的危险因素包括母体因素、胎儿因素、妊娠并发症以 及医学操作等如[5,29,30]:年龄超过35岁的高龄产妇, 多胎妊娠,剖宫产,产钳助产,前置胎盘,胎盘早剥,子 痫,胎儿宫内窘迫,羊水过多,子宫破裂,某些特定种族 等。手术引产和药物引产术也被认为是一项潜在的危险因 素4。需要注意的是,AFE的危险因素的研究结果还存在 不同的结论,而且很多危险因素是无法避免的,所以识别 危险因素并不能有效地降低AFE的发生率,但可以加强监 督和护理,以便及早发现AFE,及时采取有效措施。
