药物的肝脏毒性
常用中药及复方制剂的肝毒性

常用中药及复方制剂的肝毒性随着中药在全球范围内的广泛应用,越来越多的人开始中药的安全性和副作用。
其中,肝毒性是常用中药及复方制剂的一个重要问题。
本文将介绍常用中药及复方制剂的肝毒性,分析其产生原因,并探讨未来研究方向。
在中医药的应用中,中药及复方制剂具有独特的优势。
中药以其独特的理论体系和丰富的临床经验,为许多疾病的治疗提供了有效的手段。
然而,随着中药的广泛应用,肝毒性问题逐渐显现出来。
许多常用的中药和复方制剂都被报道具有肝毒性,如雷公藤、黄药子、何首乌等。
这些药物引起的肝毒性症状多样,包括急性肝炎、慢性肝炎、肝硬化、肝衰竭等。
例如,雷公藤是一种常用的祛风湿药,但长期使用或过量会引起肝损伤甚至肝衰竭。
黄药子是一种清热解毒的中药,但长期使用或过量也会引起肝损伤。
何首乌是一种补益肝肾的中药,但不当使用也会引起肝损伤。
分析这些药物产生肝毒性的原因,主要包括药物代谢和个体差异等因素。
一些中药成分在体内代谢过程中会产生有害物质,如氧自由基、过氧化物等,这些物质会损害肝脏组织。
个体差异也会影响中药的肝毒性。
一些人对某些中药成分过敏,甚至会引起严重肝损伤。
中药的剂量、剂型、使用时间等因素也可能影响肝毒性的发生。
常用中药及复方制剂的肝毒性是一个值得的问题。
虽然一些肝毒性事件可能难以完全避免,但通过合理用药和加强监管,可以降低肝毒性发生的风险。
医生在开具中药处方时,应严格遵循适应症和剂量范围,避免不必要的用药和过度用药。
患者应选择正规渠道购买中药,避免使用假冒伪劣药品。
加强中药肝毒性的研究和监测,有助于及时发现和控制肝毒性事件。
常用中药及复方制剂的肝毒性是一个不容忽视的问题。
通过合理用药和加强监管,可以降低肝毒性事件的发生率。
未来,需要进一步深入研究中药肝毒性的机制和影响因素,为安全合理地应用中药提供科学依据。
加强国际合作和交流,推动中药的标准化和国际化发展,提高中药的安全性和信誉度。
近年来,中药肝毒性成分代谢与毒理研究备受。
药物毒理学第5章药物对肝脏的毒性作用

坏死 形态学标志: 细胞肿胀、核解离、质膜碎裂及炎 症细胞迁入。 血清酶的测定
坏死模式: 1)灶状 2)带状 1带 少 3带(小叶中心区) 多 对乙酰氨基酚特异性地损伤3带肝细胞 3)全腺泡状(全小叶状)
肝损伤的有关机制
药物对肝细胞内细胞器的主要靶点:
(1)线粒体 (2)质膜:质膜起泡;如对乙酰氨基酚 (3)内质网:如对乙酰氨基酚 (4)细胞核:如黄曲霉素B、半乳糖胺 (5)溶酶体
图5-1 肝小叶模式图
图5-2 肝小叶微细结构
肝小叶 三区
门周区
肝腺泡 三带
1 2 3
带中区
小叶中心区
门管区
中央静脉
图5-3 肝小叶和肝腺泡简图
腺泡分带现象
1)肝细胞各组分水平沿腺泡分带呈 浓度梯度分布 肝细胞中氧浓度:1带>2带>3带; 胆盐浓度: 1带>2带>3带
2)肝细胞蛋白质水平沿腺泡分带呈 异质性分布。 1带谷胱甘肽含量高,该区主要作用 是脂肪酸氧化、糖原异生以及胆汁 分泌; 3带细胞色素P450蛋白含量高,该区 具有很强的脱氧化作用,是肝中毒 的主要靶位。
蛋白质合成
凝血因子 白蛋白 转运蛋白
胆红素和氨 类固醇激素 外源性化学物 胆汁酸依赖性食物脂质和维 生素摄取 胆红素与胆固醇 金属如铜、锰 外源化学物
出血 低蛋白血症、腹水 脂肪肝
黄疸、高血氨肝昏迷 男性第二性征丧失 药物代谢减低 脂肪泻、营养不良、维 生素缺乏 黄疸、高胆固醇血症 金属诱发的神经毒性 药物清除迟缓
四氯化碳、乙醇、丙戊酸钠 氯丙嗪、环孢素A、乙醇 阿莫西林、二苯氨基甲烷 乙醇、双苄基异喹啉类生物碱、 维生素A 双苄基异喹啉类生物碱 雄激素、黄曲霉素
抗病毒药物的肝毒性_孙丽娜

Chinese Hepatology,May.2012,Vol.17,No.5
·热点论坛·
抗病毒药物的肝毒性
孙丽娜 张欣欣
自从高效 抗 逆 转 录 病 毒 治 疗 (HAART)用 于 治 疗 艾 滋 病 以来,大大降低了艾滋病机会性感染的发病率 和 艾 滋 病 的 死 亡 率,已成为全世界控 制 艾 滋 病 公 认 的 有 效 方 法。 但 是,任 一 抗 逆转录 病 毒 药 物 都 具 有 短 期 或 长 期 的 肝 损 伤 ,尤 其 在 伴 有 HBV 和 HCV 感 染 的 患 者 中,有 可 能 增 加 慢 性 HBV 和/或 HCV 导 致 的 潜 在 肝 损 伤 。 [1-3] 将 来 ,更 多 高 效 抗 HIV 或 HBV 和 HCV 的抗病毒药物有待批 准 使 用,但 这 些 药 物 长 期 使 用 可 能 出 现 相 互 作 用 ,从 而 进 一 步 增 加 肝 损 伤 的 风 险 。 [3-5]
抗病毒药物 的 肝 损 伤 与 药 物 中 的 成 分 紧 密 相 关 ,如 用 于 HIV 感染者的有三类药物:核苷类逆转录酶抑制剂(NRTI)、非 核苷类 逆 转 录 酶 抑 制 剂 (NNRTI)、以 及 用 来 联 合 治 疗 HIV 的 蛋 白 酶 抑 制 剂 (PI)。
一 、抗 病 毒 药 物 肝 损 伤 的 发 病 机 制 (一)线粒体毒性 核 苷 类 药 物 整 合 入 病 毒 核 酸 内 终 止 核 酸链的延伸,从而 抑 制 病 毒 复 制。NRTIs是 药 物 前 体,在 抑 制 HIV 逆转录酶之 前,它 们 必 须 通 过 三 个 磷 酸 化 步 骤 才 能 在 细 胞内 被 激 活。 三 磷 酸 NRTIs也 抑 制 人 类 γ-多 聚 酶,该 酶 与 线 粒 体 DNA(mtDNA)的 复 制 相 关 。 [6-7] 所 以 ,NRTIs抑 制 γ-多 聚酶导致了 mtDNA 的减少。 在体外,NRTIs减 少 了 mtDNA 的 量,在 剂 量 依 赖 情 况 下 改变了线粒体形态,而 且 比 细 胞 色 素 氧 化 酶 Ⅱ 表 达 减 少,细 胞 生长减 少,乳 酸 盐 升 高 和 细 胞 内 液 增 加 先 发 生 或 者 同 时 发 生[8]。线粒体毒 性 是 由 核 苷 类 药 物 进 入 细 胞 的 浓 度 决 定 的 。 高 NRTI浓度 比 低 浓 度 导 致 了 更 显 著 的 mtDNA 下 降。 线 粒 体毒性需要长时间的药物暴 露,因 为 只 有 mtDNA 减 少 到 某 个 阈值时,才会观察到 线 粒 体 代 谢 的 改 变。 另 一 方 面,尽 管 NR- TI浓 度 不 高 ,但 长 时 间 的 药 物 暴 露 仍 可 导 致 线 粒 体 毒 性 。 NRTI相 关 的 线 粒 体 性 肝 损 伤 常 与 一 系 列 其 它 并 发 症 有 关。典型的并发症是血清乳酸盐的升高,但这 种 无 症 状 高 乳 酸 盐血症的意义尚不清楚。当高乳酸盐血症出现症状时也缺乏 特异性,如恶心,右上腹压痛或者肌痛等。 另 外 线 粒 体 肌 病、对 称性的末端感觉神经 障 碍、胰 腺 炎、脂 肪 萎 缩 等 并 发 症 也 屡 有 报道。 (二)超敏反应 一 些 药 物 在 治 疗 开 始 后 的 六 星 期 内 就 迅 速导致肝脏损伤[9],并且 还 可 能 同 时 出 现 其 它 临 床 症 状 ,比 如 发热、皮疹、嗜酸性粒细胞增多,后者说明了这 种 肝 脏 损 伤 是 由 于超敏反应介导的急性免疫反应所产生。免疫介导的药物副 作用是一种较 少 见 的 特 殊 类 型 ,不 可 预 知 并 且 与 给 药 剂 量 无
药物性肝损伤

2
DILI发病率逐年增高,西药制剂中以 抗生素(特别是抗结核药物)、解热镇痛 药、抗肿瘤药引发肝损害居多。值得注意 的是中药引起的肝损害比率逐年升高。 在已上市的各类药物中,目前已知有 1100多种药物具有肝毒性,引发DILI的 各种药物所占比例国内外有差异,国外报 道,过量服用对乙酰氨基酚是导致DILI及 急性肝衰竭的首位原因,其次为抗生素及 神经系统药物。
Байду номын сангаас14
三、导致药物性肝损伤的相关因素 药物性肝损伤不是单纯的药源性肝病, 医生还应结合药物、遗传背景和基础疾病加 以分析和处理。 1.药物本身的因素:有些药物本身就具有 肝脏毒性。如抗生素(尤其抗结核药物)、 抗肿瘤药物、中枢神经系统药物、非甾体抗 炎药是常见的引起DILI的药物 。 国外导致DILI的药物主要为抗炎镇痛药, 国内中药发生DILI居各种药物之首。近些年 减肥、保健、美容的时尚风行,也导致肝损 害的增加。
3
在我国通过总结 2003年-2007年国内 发表的DILI相关文献,发现抗结核药物是 导致我国DILI的首要病因(常见药物有异 烟肼、利福平、吡嗪酰胺),在抗结核药 物治疗中肝毒性发生率为8%-30%,而且 以老年人多见。有报道所有因为DILI行肝 移植患者中,14%由异烟肼导致。DILI的 实际临床发生率远高于报道率。
6
一、药物性肝损害的发病机制 药物在肝脏的代谢 药物代谢大致分为3相:第Ⅰ相为非极性 (脂溶性)药物通过氧化、还原和水解等反应 生成极性基团;第Ⅱ相是极性基团与内因性高 极性化合物结合,生成水溶性高且易于排泄的 代谢产物;第Ш相为药物或代谢产物经肝细胞 运转分泌,再由胆汁排泄,也有人将药物向肝 细胞内运转称为0相。
药物性肝损伤
1
药物性肝损害(Drug-induced liver injury , DILI)
药物对肝脏的毒理作用机制

药物对肝脏的毒理作用机制
药物对肝脏的毒理作用机制主要有以下几个方面:
1. 药物在肝脏的代谢过程中可能产生自由基和亲电子基等活性代谢产物,这些产物通常会与谷胱甘肽相结合起到解毒效果。
然而,当药物过量或机体对药物特异反应时,会产生过多活性代谢产物,过度消耗肝脏中的谷胱甘肽,同时也会损害线粒体,导致肝细胞坏死。
2. 药物和药物代谢产物可能干扰细胞代谢的某个环节,影响蛋白合成或胆汁酸分泌,导致肝细胞受到损伤或胆汁淤积。
3. 某些药物可直接对肝脏产生毒性作用。
例如对乙酰氨基酚,服用后会在体内代谢产生具有毒性的中间产物,而这些中间产物可能直接导致肝细胞的坏死。
药物肝毒性评价技术指导原则

药物肝毒性评价技术指导原则2007年10月 美国FDA发布草案 2009年6月 药审中心组织翻译安斯泰来制药有限公司翻译北核协会审核药审中心最终核准目录I. 前言 (1)II. 背景: (1)III. 药物肝毒性的信号和海氏法则 (3)IV. 药物肝毒性的临床评价 (6)A.一般考虑 (6)1. 肝功能异常或肝病患者 (6)2. 药物肝毒性的检测 (7)3. 确认 (7)4. 密切观察 (8)5. 决定停药 (8)6. 评价其他原因的资料 (9)7. 随访至消除 (10)8. 再暴露 (10)9. 研究机会 (11)B. 病例报告表 (12)C. 药物肝毒性的信号或急性肝功能衰竭的解释 (12)1. 肝脏AT异常的频率和强度 (12)2. 转氨酶和胆红素联合升高 (13)D. 药物肝毒性信号的分析 (14)1. 药物代谢评估 (14)2. 对照试验中肝脏相关不良事件的评估 (14)3. 评估整个临床试验数据库中的肝脏相关不良事件 (15)4. 临床试验数据库中海氏法则病例的评估 (15)5. 对药物肝毒性潜力的整体评估 (16)附录A:药物肝毒性的举例说明 (18)药物肝毒性评价技术指导原则I. 前言本指南旨在协助制药行业和进行新药开发的其他研究者评估药物导致严重肝损伤的潜力(即致命的或需要肝移植的情形)。
特别是本指南说明了在药物开发过程中,如何获得和评价预示这种药物引发的肝损伤(DILI)潜力的实验室测定指标。
这样的评价很重要,因为大多数引起严重DILI的药物并不经常导致严重DILI;包括多达几千例受试者暴露于一种新药的典型药物开发数据库也不会出现这样的病例。
然而,如果对临床和实验室数据进行评价,从而找到可能并不严重的较轻微损伤、但可预示能引起更严重损伤的证据的话,那么数据库确实经常可以提供药物引起严重DILI潜力的证据。
本指南提供了一种方法,可用于区别确定药物可能导致显著肝毒性的DILI信号与提示药物不具有这一潜力的信号。
药物肝脏的毒性作用PPT资料99页

药物性肝病的易患因素(2)
因素
酗酒
肥胖
影响
肝毒性阈值降低,发 生率增加,预后差 增加发生率
举例
对乙酰氨基酚、异烟肼、甲氨喋呤
氟烷、曲格列酮、他莫昔芬、甲氨喋呤
饥饿
增加发生率
肝脏病
增加肝损伤
糖尿病
增加肝纤维化
HIV/艾滋 过敏反应增加 病
肾功能减退 增加肝毒性、纤维化
对乙酰氨基酚 海恩酮、培美林、抗结核药、布洛芬 甲氨喋呤 磺胺药
一片思诺斯导致ALT升高超过1000U 干扰素诱发重度慢性肝炎 一起由“乌发丸”引发的医疗纠纷 “龙胆泄肝丸”中毒事件引发的思考
因涉嫌违法宣传 河南叫停神方乌发丸等10种药品 2019-12-17 新华网 河南省政府日前召开全省产品质量和食品 安全专项整治工作会议,省食品药品监督管理局局长李松武透露, 10种药品在媒体上违法宣传,且擅自修改审批内容,肆意夸大药品 疗效,利用专家、医疗机构、患者的名义对疗效做虚假证明,欺骗 误导消费者,因此被叫停在河南的销售。
被停售的10种药品是贵州百花医药股份有限公司生产的百花牌杜 仲降压片(国药准字Z52020258)、山西威奇达药业有限责任公司 生产的磷霉素氨丁三醇散(国药准字h20194124)、云南克雷斯天 然药物制药厂生产的恒古骨伤愈合剂(国药准字Z20195103)、吉 林永利药业股份有限公司生产的精致冠心软胶囊(国药准字 Z20193751)、贵州百花医药集团有限公司生产的六味防脱生发酊 (国药准字B20190156)、北京协和康友制药有限公司生产的罗布 麻茶(瑞草)(国药准字Z10900006)、山西东源药业有限公司生 产的蚁参护肝口服液(国药准字Z20000006)、济南宏济堂制药有 限责任公司生产的神方乌发丸(国药准字Z37021434)、昆明制药 集团股份有限公司生产的刚好牌复方青蒿喷雾剂(国药准字 Z20195887)、楚雄老拨云堂药业有限公司生产的紫灯胶囊(国药 准字Z20195593)。
是药三分毒 长期用药 警惕药物性肝损

是药三分毒长期用药警惕药物性肝损作者:亦鸣来源:《金色年代》2013年第05期药物性肝损让人防不胜防今年60出头的老宋患有关节炎多年,他平时常喝药酒养护关节,配合一点中成药治疗。
两周前,去南方旅游,景点处有卖蛇胆蛇药,言有祛风除湿清凉明目之功效,老宋为之心动,在友人的鼓动下吃了枚蛇胆,买了蛇药。
旅途中受了点风寒,出现了感冒症状,忙自服感冒药和抗生素,随之出现乏力、上腹不适,直到皮肤发黄、尿色加深,家人误以为是病毒性肝炎,送他去医院感染科就诊。
经过检查,医生发现老宋肝功能受损,血清转氨酶、碱性磷酸酶很高。
追问病史,老宋除有关节炎服用中成药史外,两周前出游踏青曾吃了蛇胆,后又因感冒而服用了感冒药和抗生素。
医生在排除其他因素后,确定为药物性肝炎。
罪魁祸首估计就是那个蛇胆。
幸亏诊断明确,处理及时,未引发肝功能衰竭,否则说不上还会赔上一条性命呢。
案例分析:1.很多人误以为中草药安全性高,毒副作用少,很少引起肝损害,其实,不少肝损是由中草药引起的。
近年来中草药所致的不良反应逐年增多,引起肝损害的病例也随之增加,除了培植药材中农药的残留及品种混淆外,中草药本身的毒副作用亦不可忽视。
2.有些药物单独服用其肝毒性不大,但合并服用有可能加强肝毒性。
案例中的老宋不仅服用感冒药和抗生素,还喝药酒、吃蛇胆,多种药物混着吃更容易引起肝损伤。
切记一定要在医生指导下用药,不可随意联合用药。
3.患有慢性疾病需要长期服用一种药物的患者应具备自我保护意识,在去医院就诊时,对自己的病史和服药史做到心中有数,与医生及时沟通,尽量将药物性肝损的风险降到最低。
了解药物性肝损几大特性服药不再怕肝损药物性肝损可分为急性、亚急性、慢性,重者可出现爆发性肝衰竭,肝细胞突然大量坏死,病人在1~2周内可能死亡。
药物性肝损可以是药物的直接毒性,也可以是过敏反应暨免疫机制介导的肝损害。
药物性肝损多有2~8周的潜伏期,早期症状可有发热、纳差、乏力、皮肤瘙痒、黄疸、皮疹等。
2、药物对肝脏的毒性作用(Toxic effects of drugs on liver)
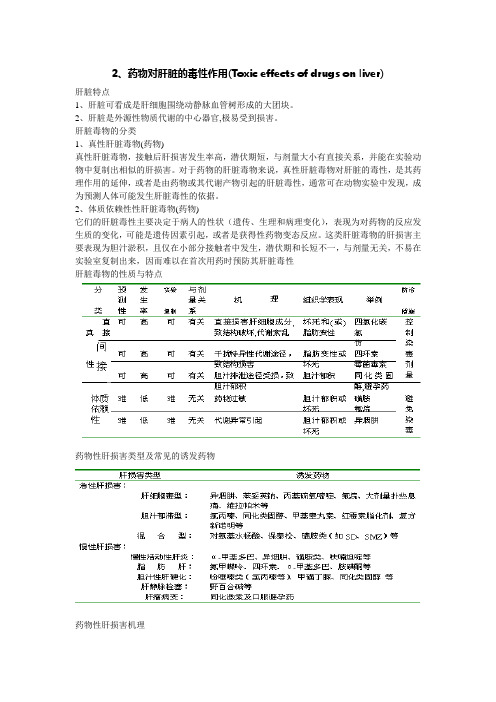
2、药物对肝脏的毒性作用(Toxic effects of drugs on liver)肝脏特点1、肝脏可看成是肝细胞围绕动静脉血管树形成的大团块。
2、肝脏是外源性物质代谢的中心器官,极易受到损害。
肝脏毒物的分类1、真性肝脏毒物(药物)真性肝脏毒物,接触后肝损害发生率高,潜伏期短,与剂量大小有直接关系,并能在实验动物中复制出相似的肝损害。
对于药物的肝脏毒物来说,真性肝脏毒物对肝脏的毒性,是其药理作用的延伸,或者是由药物或其代谢产物引起的肝脏毒性,通常可在动物实验中发现,成为预测人体可能发生肝脏毒性的依据。
2、体质依赖性性肝脏毒物(药物)它们的肝脏毒性主要决定于病人的性状(遗传、生理和病理变化),表现为对药物的反应发生质的变化,可能是遗传因素引起,或者是获得性药物变态反应。
这类肝脏毒物的肝损害主要表现为胆汁淤积,且仅在小部分接触者中发生,潜伏期和长短不一,与剂量无关,不易在实验室复制出来,因而难以在首次用药时预防其肝脏毒性肝脏毒物的性质与特点药物性肝损害类型及常见的诱发药物药物性肝损害机理1、肝细胞毒作用药物肝细胞毒作用,是指某些药物本身具有原浆毒性质,通过干扰肝细胞正常代谢,或抑制酶的活性,或阻滞胆汁分泌,损害肝脏。
其肝损害严重程度与用药量有关,且潜伏期短,发病率高。
/2、特异体质性反应特异体质性反应,包括药物过敏反应引起的肝损害和机体对药物异常代谢引起的肝损害,其病变程度与用药量无关,潜伏期长,发病率低。
肝损害的类型肝坏死脂肪肝胆汁淤积纤维化及肝硬变慢性坏死性肝炎(一)肝坏死坏死(necrosis)是指一个或多个细胞或组织器官的一部分由于不可逆的损害引起的病理性死亡。
许多肝脏毒物能引起肝坏死,根据其范围及严重程度可分为局部性和弥漫性,局部性多见。
⏹多数引起肝小叶中央区坏死,如对乙酰氨基酚(扑热息痛)即可引起;⏹有些也可出现在中间区,如大剂量利尿药呋噻米可引起大鼠肝小叶中间区坏死;⏹少数可引起周边区坏死,如硫酸亚铁。
12 药物对肝脏的毒性作用

药物对肝脏的毒性作用第一节肝脏损伤的生理学和形态学基础肝脏是药源性组织损伤的主要靶器官之一,常常是首当其冲受损的靶器官。
一、肝脏的生理学基础:1、参与糖、脂肪、蛋白质三大物质的代谢、分泌胆汁,激素、内源性废物代谢等。
2、过滤作用:肝的解毒作用、药物代谢、吞噬防御功能二、肝脏损伤的形态学基础:肝的基本结构单位—肝小叶(hepatic lobule)ρ肝脏组织构成单位,多达50万-100万个;ρ中心有一条中心靜脈,周围分布著放射狀的肝细胞索;ρ肝细胞之间为肝血窦,由内皮细胞衬覆而成。
三、肝脏易受药物损伤的原因(参见教材)由其生理学功能、组织学特点所决定。
第二节肝毒物及其分类凡能引起肝损伤的物质均可称为肝毒物(hepatotoxicant ).一、按毒性机制分为:1、体质依赖性肝毒物:多见于药物,如磺胺、异烟肼。
2、真性肝毒物:多见化学物,个别药物。
①直接肝毒物:如对乙酰氨基酚、异烟肼等如乙酰氨基酚、异烟肼等,可通过肝脏细胞色素P450酶系代谢产生亲电子基、自由基、氧自由基等产物,与肝细胞大分子蛋白质形成共价结合,使细胞结构和功能破坏,导致肝细胞膜脂质过氧化、膜蛋白变形、膜结构破坏,细胞死亡。
②间接肝毒物:如抗肿瘤药等如四环素、甲氨喋呤、巯嘌呤等,可干扰细胞酶活性从而导致细胞内物质代谢紊乱的化学物,或其代谢产物能与细胞内生物大分子结合,使细胞功能发生变化的化学物。
二、根据肝毒物的化学性质分为:1、无机肝毒物:重金属类、CCl4等2、有机肝毒物:生物毒物、药物等第三节药物性肝损伤类型及机理一、肝细胞死亡(hepatocyte death )1、细胞坏死 (necrosis) :细胞的被动病死,称作“细胞他杀”。
细胞形态学表现为核与线粒体肿胀,细胞的质膜崩解(细胞膜、细胞器膜、核膜等),结构自溶,并引发急性炎症反应。
药/毒物引起肝细胞坏死的机制:(1)肝细胞膜脂质过氧化:如CCl4、对乙酰氨基酚氧自由基与生物膜多不饱和脂肪酸的侧链及核酸等大分子物质起脂质过氧化反应,使细胞膜的流动性和通透性发生改变,最终导致细胞结构和功能的改变。
药物对肝脏的毒理作用

药物对肝脏的毒理作用一.研究目的毒理学是一门研究外源性毒物对生物体的毒性作用的学科,而作为人体重要解毒排毒的器官,肝脏当然是毒理学研究的一个重点。
二.肝脏结构肝脏是身体内以代谢功能为主的一个器官,并在身体里面扮演着去氧化,储存肝糖,分泌性蛋白质的合成等等。
肝脏也制造消化系统中之胆汁。
在医学用字上,常以拉丁语字首hepato-或hepatic来描述肝脏。
肝脏是人体内脏里最大的器官,位于人体中的腹部位置,在右侧横隔膜之下,位于胆囊之前端且于右边肾脏的前方,胃的上方。
肝脏是人体消化系统中最大的消化腺,成人肝脏平均重达1.5公斤(约在1-2.5公斤之间;另一说1-1.6公斤),为一红棕色的V 字形器官。
肝脏又是新陈代谢的重要器官三.肝脏的解毒原理肝脏常为毒物作用的靶器官,大多数毒物经胃肠道吸收进入机体后循门静脉携入肝脏。
肝脏有高密度的结合点,该处外源性物质代谢酶的浓度较高,它使多数毒物降低毒性,且更易水溶,而有利于排出,但在一些毒物可被活化而毒力加强,可致肝产生局部损伤。
肝损伤常发生在小叶中央,因该处细胞色素P4 o较高,而谷胱甘肽浓度却相对较低的缘故。
四.肝脏损伤的类型及引发原因毒物可引起肝脏细胞内不同细胞器的各种毒性作用,出现不同肝脏损伤的类型:1.脂肪肝:指含脂量超过5 肝重的肝脏。
组织化学显示肝内有过着染的脂肪存在。
这种肝损伤可以是急性的,如由乙基硫氨酸、磷、四环索引起的损伤。
一些毒物如四环素在细胞内形成许多小的脂肪滴,而其它化学物如乙醇则可形成大的脂肪滴而将核挤向一侧。
虽然肝脂质沉积是这些毒物作用常见的结局,但形成的机理各异。
最常见的机理可能是肝脏的甘油三醣释放入血的过程发生障碍而致。
因为甘油三酯只有与脂蛋白结合后形成极低密度脂蛋白才能分泌。
引起肝脏脂质堆积的机理如下:①抑制脂蛋白的蛋白部分的合成(四氯化碳;乙基硫氨酸);②阻止甘油三酯与脂蛋白的结合(四氯化碳);③肝细胞缺钾而干扰了VLDL经细胞膜的转运(乙基硫氨酸):④损伤了线粒体氧化脂质的功能(乙醇);⑤抑制VLDL的重要活性成份磷脂的合成(缺乏胆碱和乳清酸);2.肝坏死:肝坏死与肝细胞的死亡有关。
药物的肝脏毒性

药物的肝脏毒性关键词药物性肝损害药物性肝损害机制肝损害个体差异肝损害诊治近年来,有两种药物因其肝脏毒性被美国食品与药物管理局从市场撤出,药物的肝毒性再次受到公众关注。
据美国统计,被批准进入市场的药物从市场撤出的最常见原因是肝毒性作用;同时,一半以上的急性肝衰竭由于不当用药引起。
因此,本文对药物的肝脏毒性作一综述。
药物在肝脏的生物学转化肝脏担负着几乎所有外来物质的代谢、解毒作用,大多数药物在吸收时是脂溶性的,易通过肠道表面而被吸收。
在肝细胞中,药物发生生物学转化成为水溶性物质,并进一步与葡萄糖苷酸或硫酸盐、谷胱苷肽结合,由肝细胞膜上的转运蛋白输送至血浆或胆汁发挥作用,经肾脏或胃肠道排出体外。
氧化反应参与了肝脏的生物学转化过程,细胞色素P450系统在其中起重要作用[1 ] 。
药物所致肝脏损害的类型一般来说,在规范使用时多数药物都是安全的,每1 000至100 000例患者中仅有1 例发生药物导致的肝损伤。
肝毒性作用与用药患者的个体差异有关,不同种类或同一种类不同药物的肝损伤作用不尽相同。
多数情况下,首次用药距离肝损发生的时间为5 至90 天不等,一旦药物性肝损出现,继续用药往往导致患者死亡。
而异烟肼有所不同,如果肝脏损害轻微,继续服药患者常可自行缓解,但再次用药则发生严重的药物反应。
而乙酰氨基酚的肝毒性呈剂量依赖性,用药剂量往往决定患者的预后。
此外,患者的年龄、性别、体重指数等也影响药物的肝脏代谢过程,同时使用的其他药物或食物、患者的生理状态(如怀孕、伴发肝脏、肾脏疾病等) 等也对预后起重要作用。
女性似乎更容易发生药物导致的肝脏损害,对乙酰氨基酚的肝脏损害患者中有79 %为女性,由于个体差异导致的药物反应也有73 %是女性,具体原因尚不清楚。
此外,苯巴比妥、苯妥英、乙醇、吸烟等均可诱导肝酶改变血药浓度,导致肝毒性作用。
肝脏的损伤机制至少有六种机制参与了药物的肝毒性作用,由于损伤的细胞器不同,肝损害的表现也不相同。
用药不慎可能会损害肝脏

用药不慎可能会损害肝脏在人体内的各个器官中,肝脏是非常重要的脏器之一,因为肝脏在人体的代谢、消化、解毒、凝血,免疫调节等方面都有着非常重要的作用,可以说肝脏是人体那不可缺少的一个工厂,是身体中最重要的排毒器官,我们那些从口进入经过消化以后的有毒物质都是在肝脏触经过解读,然后变成无毒物质,再通过尿液或者是胆汁排出到体外,如果肝脏长期超负荷的工作,就会导致人体内的毒素无法排除出去,可能会伤害我们的肝脏,因此在用药时一定要注意。
下面介绍具体有哪些药物服可能会导致肝脏受损异烟肼该药物可直接使肝脏受到损害。
该药是一种抗结核类药物,它对肝脏的危害非常大,它可能会导致肝脏出现肝炎等情况。
而且如果严重的话也能导致肝硬变,因此在用药的过程中一定要非常注意,定期复查肝功,当肝功出现异常时要在医生的指导下调整药物或加服保肝药物。
安眠药长期服用安眠药也有可能导致肝损伤,尤其是对老年人来说。
因为肝脏是分解安眠药的地方,如果长期服用会导致肝脏不能够及时把有毒物质变化成无毒物质排出体外,就有可能造成肝脏损伤。
而且老年人由于年龄大,肝脏的一些功能会随着年龄的增大而逐渐减弱,因此在服用这些药物的时候,吸收和消化的能力也就减弱,这样就更有可能会导致肝功能衰竭,造成肝损伤。
因此服用这类镇定性药物的时候,一定要注意药物的用量,及时控制,避免长期服用。
降糖药与降脂药降糖药物与降脂药物也有可能导致肝功能受损。
因为大多数的糖类药物是在肝功能中进行消化和代谢的,因此人们在检查肝功能是否正常时,就是看他消化糖的能力是否正常。
同样长期服用降脂药物也有可能会导致肝损伤,因为这样降脂药物和将降糖类药物的原理是一样的,他们都是检测肝功能是否发生异变的药物。
常见的降糖类药物,比如说罗格列酮、胰岛素等,以及常见的降脂类药物烟酸阿西莫,司苯扎贝特等,他们虽然能够检测肝功能的正常与否,但是如果长期服用的话,也会给肝功能造成一定的损害,所以在服用的过程中也是要注意其服用此类药物的量不能过多,服用的过程也不能够太长,避免长期服用,同时要定期梨肝功。
别把中药肝毒性夸大了

别把中药肝毒性夸大了药物性肝损伤是临床用药过程中较易发生的一种问题,即采用药物进行疾病治疗时,药物本身或者代谢产物有一定的毒性作用,这种作用会对人体的肝产生到损害。
近年来,中医药获得了快速发展,临床用药中中药的用药种类和规模不断扩大,这使得越来越多的人开始关注中药的肝毒性;从临床用药过程来看,中药肝毒性存在被夸大的征象,这容易对患者的临床用药造成干扰,而且阻碍中医药的进一步发展。
今天就给大家来科普一下中药肝毒性的那些事。
1、中药肝毒性的基本认识民间一直有一种说法是“中药没有毒,而西药有毒”,这本身就是一个认知误区;因为是药三分毒,中药治疗过程相对安全,仅是因为其毒副作用相对较小,对于人体的损害较轻,但这并不代表中药无毒害。
中医学理论早就对药物的毒副作用进行了阐述,在上古时期,毒与药的含义是相同的;并且在现在最早的药物专著《神农百草经》中,其就根据药物是否有毒,将365中药物分成了上中下三品。
此外,《中华人民共和国要点》也收录了82中有毒性的药物。
中药类型不同,其对于患者造成的肝毒性也就有所差异,同时肝毒性受患者自身身体特质的影响。
研究表明,一些中药及其代谢产物不仅对肝会产生直接毒性作用,而且其会使的肝发生特异质反应,此即为药物性肝损伤。
近年来,中药在临床用药中的频率增加,这使得由中药引起的肝毒性损伤也有上升趋势。
有报道称,在药物性肝损伤患者中,服用中草药是引起肝损伤的首发病因;基于此,有必要进行肝毒性损伤的深入分析,以此来达到科学合理使用中药的目的。
2、常见中药的肝毒性作用过程就中草药本身来看,他们不均具有成分组成复杂的特点,而且药物配伍较为多样,这使得药物的肝毒性作用增强。
临床实践中,有较多的中药成分本身没有的毒害作用,但一些药物的结构较为特殊,当药物进入人体后,其会在代谢过程中转化或产生一定的毒性化合物,这些化合物会对人体产生一定损害。
现阶段,除萜类、蒽醌类外,苯丙素类、生物碱等化合物也是较为常见的重要类型,这些类型的中药均会对人体产生一定的肝毒性作用。
药物肝毒性评价方法研究

药物肝毒性评价方法研究肝脏是人体最重要的器官之一,主要负责药物代谢和排泄。
许多药物是通过肝脏进行代谢,其代谢产物可以再分解成无害的物质,也可以成为有害物质,引起肝脏毒性反应。
肝毒性是目前药物临床使用中常见的不良反应之一,特别是在长期药物使用的情况下更加容易发生。
因此,研究和评价药物在肝脏中的代谢和毒性机制,对于药物安全性的评价和临床应用具有重要的意义。
当前针对药物肝毒性评价常用的方法主要包括离体实验、动物试验和体外测试等方式。
一、离体实验离体实验是指将人体肝脏组织或细胞与药物反应,在人体肝脏中模拟药物代谢和毒性的过程。
这种方法可以模拟人体在代谢药物过程中的情况,比较贴近实际情况,同时可以更加准确地评价药物在肝脏中的代谢毒性。
但是,离体实验存在许多局限性,比如无法考虑整个生物体内药物代谢的复杂性和个体差异性等问题,同时受限于肝细胞来源和细胞状态等因素,也有可能得出偏离实际的结果。
二、动物试验动物试验是将药物注入动物体内,观察药物代谢,测试血清生化参数、肝功能等来评估药物肝毒性。
动物试验的优点在于测试的结果可以考虑整个生物体内药物代谢的复杂性和个体差异性,但是也存在许多问题,如人体肝代谢与动物肝代谢机制存在差异,试验结果与人体的风险并不一定相关,此外动物试验还涉及到动物使用环境的伦理问题等。
三、体外测试体外测试是针对药物肝毒性评价的一种比较新的方法,该方法基于细胞、组织或人体内的生物液的分析,来研究药物的代谢和毒性反应。
相比离体实验和动物试验,体外测试更加环保,不涉及动物使用和血清人体形态的过程,同时具有快速和经济的优势。
但是,这种评价方法目前还缺乏足够的临床数据支持,并有时存在一些偏移或误判的风险。
总结:不同的药物肝毒性评价方法都有各自的优势和局限性,依据具体情况选择相应的方法进行评价是必要的。
未来随着技术的发展,基于人类肝脏的三维培养和微流控技术的改进等,将有助于提高药物肝毒性评价的准确性和可靠性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物的肝脏毒性关键词药物性肝损害药物性肝损害机制肝损害个体差异肝损害诊治近年来,有两种药物因其肝脏毒性被美国食品与药物管理局从市场撤出,药物的肝毒性再次受到公众关注。
据美国统计,被批准进入市场的药物从市场撤出的最常见原因是肝毒性作用;同时,一半以上的急性肝衰竭由于不当用药引起。
因此,本文对药物的肝脏毒性作一综述。
药物在肝脏的生物学转化肝脏担负着几乎所有外来物质的代谢、解毒作用,大多数药物在吸收时是脂溶性的,易通过肠道表面而被吸收。
在肝细胞中,药物发生生物学转化成为水溶性物质,并进一步与葡萄糖苷酸或硫酸盐、谷胱苷肽结合,由肝细胞膜上的转运蛋白输送至血浆或胆汁发挥作用,经肾脏或胃肠道排出体外。
氧化反应参与了肝脏的生物学转化过程,细胞色素P450系统在其中起重要作用[1 ] 。
药物所致肝脏损害的类型一般来说,在规范使用时多数药物都是安全的,每1 000至100 000例患者中仅有1 例发生药物导致的肝损伤。
肝毒性作用与用药患者的个体差异有关,不同种类或同一种类不同药物的肝损伤作用不尽相同。
多数情况下,首次用药距离肝损发生的时间为5 至90 天不等,一旦药物性肝损出现,继续用药往往导致患者死亡。
而异烟肼有所不同,如果肝脏损害轻微,继续服药患者常可自行缓解,但再次用药则发生严重的药物反应。
而乙酰氨基酚的肝毒性呈剂量依赖性,用药剂量往往决定患者的预后。
此外,患者的年龄、性别、体重指数等也影响药物的肝脏代谢过程,同时使用的其他药物或食物、患者的生理状态(如怀孕、伴发肝脏、肾脏疾病等) 等也对预后起重要作用。
女性似乎更容易发生药物导致的肝脏损害,对乙酰氨基酚的肝脏损害患者中有79 %为女性,由于个体差异导致的药物反应也有73 %是女性,具体原因尚不清楚。
此外,苯巴比妥、苯妥英、乙醇、吸烟等均可诱导肝酶改变血药浓度,导致肝毒性作用。
肝脏的损伤机制至少有六种机制参与了药物的肝毒性作用,由于损伤的细胞器不同,肝损害的表现也不相同。
细胞色素P450 参与的高能反应使药物与细胞内的某些蛋白共价结合,导致相应的功能失调,引起离子梯度消失、ATP 减少、肌动蛋白断裂,最终细胞肿胀、溶解[2 ,3 ] 。
有些药物作用于胆小管上的转运蛋白,引起胆管阻塞、胆汁淤积 ,但此时很少发生肝细胞损害[4 ] 。
某些转运蛋白遗传缺陷( 如multidrug2resistance2associated protein 3 ,MRP3) 的患者在使用激素治疗时导致淤胆加重,因此该类患者服用含雌激素的药物应特别慎重。
少数情况下,患者还合并有细胞内病变,因此胆酸的毒性作用逐渐累积,引发细胞损伤。
一旦胆管细胞受损,将导致持续性淤胆,即所谓“胆管消失综合征”。
药物成分一般均为小分子物质,不引发免疫反应。
但是在有高能反应参与的生物学转化过程中,药物可能与某些酶共价结合,形成加合物(adduct) 。
如果加合物足够大,就可能诱发免疫反应,导致抗体形成(抗体介导的细胞毒性作用) 或T 细胞介导的细胞溶解作用[5 ] ,引发炎症反应和肝脏中毒。
在免疫损伤的同时还可出现细胞程序性死亡(凋亡) ,肿瘤坏死因子( TNF) 及Fas 途径破坏肝脏细胞,导致细胞皱缩、核碎裂 [6 ] 。
致凋亡的受体酶一旦被药物激活,便可与细胞内的自我保护途径竞争,其作用的相对强弱最终决定细胞凋亡还是存活。
药物也可能损伤细胞的线粒体,破坏脂肪酸氧化和能量产生。
药物与呼吸链中的酶或线粒体DNA 结合或使其失功时,发生氧化应激,继发无氧酵解,导致乳酸合成增加、三酰甘油沉积 [7 ] 。
脂肪肝最常见于滥用酒精,但药物作用也可导致。
肝脏中的其他细胞也可成为药物的作用靶,如Kupffer 细胞,一旦激活后便加重肝脏损伤[8 ] 。
储脂细胞(stellate cell) 、巨噬细胞等也能放大药物的肝毒性作用,并导致纤维化反应和肉芽肿形成。
化疗药物能够损伤静脉窦的内皮细胞,引起静脉闭塞[9 ] 。
激素治疗可能诱导肝细胞去分化,导致腺瘤甚至癌肿形成[10 ] 。
发病机制为何并非所有患者均出现药物的肝脏毒性表现? 目前认为,由于个体差异(而非用药不当) 造成的药物反应过程是由一连串的偶然事件组成的,即“多点攻击(multihit ) ”。
例如同工酶的遗传差异使其在药物代谢过程中可能产生毒性产物,但一般不引起严重的药物反应[11 ] 。
而且,有些患者表现药物的肝毒性作用呈现逐渐加重又自发缓解的现象,说明机体本身还存在自我保护机制,可抑制或阻碍毒性过程。
即使激活了免疫反应,因细胞表面的主要组织相容性复合体(MHC) 受体不同,也可能出现免疫增强或免疫抑制[12 ] 。
药物与受体的结合受HLA表型的影响,而后者由不同的个体的特异性基因型调节。
药物加合物的抗原呈递作用还依靠HLA 的空间构造,而后者因遗传背景不同也有差异。
细胞表面的新抗原成分可能寿命很短,但当机体再次与药物接触时这些抗原成分可立即被重新合成。
在免疫反应后期,某些因素可能改变反应结局,如白介素210 ( IL210) 或TNF2α,其基因表达不同可能放大或抑制免疫损伤。
例如一种特异性IL210启动子的表型可以抑制IL210 的分泌, 使辅助性Th2 细胞诱导的免疫反应下调,引发双氯芬酸的毒性作用[13 ] 。
而TNF2α的表型差异可能是对乙酰氨基酚产生肝毒性作用的决定因素[14 ] 。
此外,最近发现xenobiotic constitutive androstane 受体可能也是对乙酰氨基酚导致肝脏毒性的一个关键分子,这方面的研究可能使我们发现对非免疫介导的肝脏损伤的新的治疗方法[15 ] 。
以上过程说明,药物导致的肝脏损伤要经过细胞器损伤、细胞坏死、凋亡及随后一系列免疫反应的激活,因此个体差异导致的药物反应具有罕见性、严重性和不可避免性的特征。
但是,有可能在将来通过监测药物的基因多态性确定患者的遗传背景,避免药物的肝毒性反应。
临床表现药物导致的肝毒性反应最常见的是肝细胞的中2重度损伤,临床表现类似于病毒性肝炎,患者有不适、黄疸和转氨酶升高。
大多数患者无明显的过敏体征。
但每种药物的肝毒性反应可略有不同。
如果患者以肝细胞受损为主,则转氨酶可升高五倍以上;而在胆汁淤积综合征中,碱性磷酸酶和胆红素上升为主要表现。
急性肝衰竭多在用药一周后出现,也可能出现更晚,尤其在已有肝脏中毒表现后还继续服药的患者中容易出现。
药物导致肝脏中毒而致患者死亡的案例亦不少见。
老年患者似乎更易发生肝毒性反应,但尚无相关文献报道。
个体差异导致的肝脏损伤由于个体差异造成的药物的肝毒性反应有其相应的特点。
一般而言,主要累及整个肝小叶的肝细胞受损,伴不同程度的坏死、凋亡。
典型的肝炎表现在首次用药数天或数周后出现,即使撤药后也可能持续存在、进行性发展。
肝脏活检对于确定诊断无明显帮助。
过敏反应也有某些药物的副作用是强烈的过敏反应。
如磺胺类药物可以引起患者发热、皮疹和嗜酸细胞增多。
苯妥英中毒也能出现相似症状,并导致淋巴结肿大和严重的肝细胞损伤,这一系列表现被称作“反应代谢综合征”, 治疗效果相当缓慢[16 ] 。
这种过敏反应的迁延过程提示抗原成分在肝细胞表面可以存在数周至数月,因此给治疗带来了困难。
可见,药物导致肝脏损害的早期做到快速诊断、立即撤药是防治的关键。
即使患者缺乏明显的过敏体征或外周血嗜酸细胞增多,肝活检标本就可能已经出现了嗜酸性细胞浸润和肉芽肿形成。
胆管损伤如果患者表现为胆汁淤积,说明药物的毒性作用已累及胆管。
一旦造成胆管的不可逆损伤,患者可以出现严重的皮肤搔痒和黄疸。
诊断与治疗对临床上不能解释的肝功能不全必需考虑药物损伤的可能。
然而确定其具体原因非常困难。
首先需详细询问病史,包括患者的用药史及基础疾病史,如有无病毒性肝炎、低血压或过量饮酒。
必要时行B 超检查或血清学检查帮助诊断。
在肝脏损伤的过程中可能有多种因素或多种药物参与,有时很难辨别其因果关系。
诊断时需结合患者肝脏损伤距离首次用药的间隔时间(一般为5 至90 天不等) 、停药后的病情变化(药物导致的肝脏损伤多在停药后数周内逐渐好转) 、同时存在的危险因素,如嗜酒、怀孕、高龄,以及同时服用的其他药物。
另外,还应充分考虑患者是否存在其他导致肝脏损害的因素,如病毒性肝炎等。
有些患者还具有某种药物的中毒史,对确定诊断也很有帮助。
只有当无法确认肝脏损害为药物所致、且无合适的替代治疗时,才可谨慎的再次使用相同药物。
治疗药物性肝脏损害的关键是早期发现、早期撤药,包括一切可能引起肝脏损害或怀疑是致病原的药物。
对于出现严重过敏反应的患者可以使用糖皮质激素治疗,但是并无对照性的研究结果证实其疗效。
胆汁淤积性肝脏损害也可采用去氧胆酸治疗,但也无相应文献确定疗效。
对乙酰氨基酚中毒引起的肝脏损伤除了可以使用N2乙酰半胱氨酸外,亦无其他特效药物。
如果患者出现凝血障碍或肝性脑病,可以进行肝脏移植。
药物对慢性肝病患者的毒性作用肝病患者是否更易于发生药物性肝损害? 还是肝病患者的酶活性降低,使药物的肝毒性下降? 事实上,这两种猜测均不全面。
即使在肝病晚期时,仍有许多肝酶可发挥作用,尤其是参与结合反应的酶。
例如,细胞色素P450 的同工酶2C19 在严重肝病时可明显下降,但同工酶2D6 几乎不受影响[17 ,18 ] ;在非酒精性脂肪性肝炎中,细胞色素P450 2E1 水平还明显增高, 可能加重对乙酰氨基酚的肝脏毒性[19 ,20 ] 。
而且,在肝硬化患者中,由于纤维化增加了血流和肝细胞的距离,这类患者的药物代谢速度仅是正常人的一半[21 ] 。
总体而言,并非所有肝病患者都易发生药物性肝损害,但也有例外。
丙型肝炎患者接受抑制骨髓的治疗时,容易发生静脉闭塞性疾病[22 ] 。
如果HIV感染的患者同时存在B 型和C 型肝炎病毒的潜在感染,在使用高强度的抗逆转录病毒治疗时容易发生肝脏损害[23 、24 ] 。
对于已有肝硬化表现的患者使用肝毒性药物,可以导致肝功能失代偿[25 ] 。
因此,对必须采用这些药物治疗的患者,医生必须万分谨慎,避免发生严重后果。
综上所述,各种药物均可造成肝脏的毒性作用,在避免不当用药的同时,更需关注个体差异造成的药物中毒。
早期诊断、早期停药是避免严重后果的关键因素。
归根结底,预防药物的肝脏毒性作用需要临床工作者高度的责任心和丰富的知识背景。
参考文献:1 Guengerich FP. Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity. Chem Res Toxicol ,2001 ,14 :6112 Yun CH , Okerholm RA , Guengerich FP. Oxidation of the antihis2 tamine drug terfenadine in human liver microsomes : role of cy2 tochrome P2450 3A ( 4 ) in N2dealkylation and C2hydroxylation.Drug Metab Dispos ,1993 ,21 :4033 Beaune P , Dansette PM , Mansuy D , et al . Human anti2endoplasmic reticulum autoantibodies appearing in a drug2induced hepatitis are di2 rected against a human liver cytochrome P2450 that hydroxylates the drug. Proc Natl Acad Sci USA ,1987 ,84 :5514 Trauner M , Meier PJ , Boyer J . Molecular pathogenesis of cholesta2 sis. N Engl J Med ,1998 ,339 :12175 Robin M2A , Le Roy M , Descatoire V , et al . Plasma membrane cy2 tochromes P450 as neoantigens and autoimmune targets in drug2in2 duced hepatitis. J Hepatol ,1997 ,26 :Suppl 1 :236 Reed JC. Apoptosis2regulating proteins as targets for drug discov2 ery. Trends Mol Med ,2001 ,7 :3147 Pessayre D , Berson A , Fromenty B , et al . Mitochondria in steato2 hepatitis. Semin Liver Dis ,2001 ,21 :578 Jonsson JR , Edwards2Smith CJ , Catania SC , et al . Expression of cytokines and factors modulating apoptosis by human sinusoidal lym2 phocytes. J Hepatol ,2000 ,32 :3929 DeLeve LD , Shulman H , McDonald GB. Toxic injury to hepatic si2nusoids: sinusoidal obstruction syndrome ( veno2occlusive disease) .Semin Liver Dis ,2002 ,22 :2710 Brosens I , Johannisson E , Baulieu E2E , et al . Oral contraceptives and hepatocellular carcinoma. Br Med J ,1986 ,292 :166711 Weinshilboum R. Inheritance and drug response. N Engl J Med ,2003 ,348 :52912 Jaeschke H , Gores GJ , Cederbaum AI , et al . Mechanisms of hepa2 totoxicity. Toxicol Sci ,2002 ,66 : 16613 Aithal GP , Daly AK, Leathart J , et al . Promoter polymorphisms of interleukin210 ( IL210) and interleukin24 ( IL24) predict the risk of diclofenac2induced hepatotoxicity. Gastroenterology , 2000 , 118 : Suppl 2 :A97714 Bernal W, Donaldson P , Underhill J , et al . Tumor necrosis genomic polymorphisms and outcome of acetaminophen ( paracetamol )2in2duced acute liver failure. J Hepatol ,1998 ,29 :5315 Zhang J , Huang W, Chua SS , et al . Modulation of acetaminophen2 induced hepatotoxicity by the xenobiotic receptor CAR. Science ,2002 ,298 :42216 Kleckner H , Yakulis V , Heller P. Severe hypersensitivity to diphenylhydantoin with circulating antibodies to the drug. Ann In2tern Med ,1975 ,83 :52217 George J , Murray K, Byth K, et al . Differential alterations of cy2tochrome P450 proteins in livers from patients with severe chronic liver disease. Hepatology ,1995 ,21 : 12018 Adedoyin A , Arns PA , Richards WO , et al . Selective effect of liver dis2ease on the activities of specific metabolizing enzymes : investigation of cy2tochromes P450 2C19 and 2D6. Clin Pharmacol Ther ,1998 ,64 :819 Weltman MD , Farrell GC , Hall P , et al . Hepatic cytochrome P450 2E1 is increased in patients with nonalcoholic steatohepatitis. Hepa2 tology ,1998 ,27 :12820 Burckart GJ , Frye RF , Kelly P , et al . Induction of CYP2E1 activity in liver transplant patients as measured by chlorzoxazone 62hydroxy2 lation. Clin Pharmacol Ther ,1998 ,63 :29621 Froomes PRA , Morgan DJ , Smallwood RA , et al . Comparative ef2 fects of oxygen supplementation on theophylline and acetaminophen clearance in human cirrhosis. Gastroenterology ,1999 ,116 :91522 Strasser SI , Myerson D , Spurgeon CL , et al . Hepatitis C virus in2 fection and bone marrow transplantation : a cohort study with 102 year follow2up. Hepatology ,1999 ,29 :189323 Clark CJ , Creighton S , Portmann B , et al . Acute liver failure associ2 ated with antiretroviral treatment for HIV : a report of six cases. J Hepatol ,2002 ,36 :29524 Pol S , Vallet2Pichard A , Fontaine H. Hepatitis C and human im2 mune deficiency coinfection at the era of highly active antiretroviral therapy. J Viral Hepat ,2002 ,9 :125 Schenker S , Martin RR , Hoyumpa AM. Antecedent liver diseaseand drug toxicity. J Hepatol ,1999 ,31 :1098。
