不同类型的晶体ppt课件下载
合集下载
化学课件《不同类型的晶体》优秀ppt3 苏教版

不同类型的晶体
2019年5月18日星期六 2019年5月18日星期六
晶体的概念
◆什么叫晶体?
●通过结晶过程形成的具有规则 几何外形的固体叫晶体。
●晶体中的微粒(分子、原子或 离子)按一定的规则排列。
构成晶体的基本微粒和作用力
◆阴阳离子 ●阴阳离子间以离子键结合,形成离子晶体。
◆分子 ●分子间以分子间作用力(又称范德华力)结 合,形成 分子晶体。
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
2019年5月18日星期六 2019年5月18日星期六
晶体的概念
◆什么叫晶体?
●通过结晶过程形成的具有规则 几何外形的固体叫晶体。
●晶体中的微粒(分子、原子或 离子)按一定的规则排列。
构成晶体的基本微粒和作用力
◆阴阳离子 ●阴阳离子间以离子键结合,形成离子晶体。
◆分子 ●分子间以分子间作用力(又称范德华力)结 合,形成 分子晶体。
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
《不同类型的晶体》PPT1 人教课标版

•
8.作为最深层次的认同,文化的认同 在维护 民族团 结和和 睦之中 具有最 根本的 作用, 因此就 要建设 好各民 族共同 的精神 家园, 培养中 华民族 的共同 体意识 。
感谢观看,欢迎指导!
共价键 金属键
思考:结构不同的晶体,性质是否 也不同?分析表1-10归纳各类晶体 的物理性质有何特点?
课堂练习
1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 BaSO4、 金刚石、 冰醋酸、 尿素、 水晶、 Na2O
2、下列各组物质发生状态变化所克服的粒
子间作用力属于同种类型的是( C )
A.食盐和蔗糖熔化
B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
3、分析物质的物理性质,判断其晶体类型: A、碳化铝,黄色晶体,熔点2200℃,熔融态 不导电;_原__子__晶__体____ B、溴化铝,无色晶体,熔点98 ℃,熔融态不 导电;_分__子__晶__体____ C、五氟化钒,无色晶体,熔点19.5℃,易溶 于乙醇、氯仿、丙酮中;__分__子__晶__体_______ D、物质A,无色晶体,熔融时或溶于水中都能 导电__离__子__晶__体_____
•
5.娄机为人诚恳,做事严谨。对是非 曲直, 他当面 判断, 事后从 不再说 ;赞人 全面, 不遗漏
•
6.多样性意味着差异,我国的民族多 样性决 定了以 民族为 载体的 文化的 多样性 ,这种 文化的 多样性 也意味 着各民 族文化 的差异 。
•
7.从自然生态的角度来看,生态平衡 的维护 就是要 维护其 生物物 种的多 样性, 所以维 护社会 和谐的 基础也 就是文 化的多 样性。结构的晶体。晶 体 硅Si
o
180º
高中化学《不同类型的晶体》PPT

离子晶体 离子
决定
分子晶体 分子
原子晶体 原子
结构
性质
晶体 氯化 氯化 钠 铯 熔点 /℃ 801 645
金刚 石
二氧 化硅
二氧 化碳
二氧 化硫
钠
钨 3410
>3550 1723 -56.6 -72.4
97.8
软
硬度 较硬 较硬
晶体 类型 离子晶体
很硬
硬而 脆
软
软
硬
原子晶体
分子晶体
金属晶体
课堂小结
原子
--------
共价键
--------
不导电 导电
差距大 差距大
晶体类型的判断
1.依据构成晶体的微粒及微粒间的关系 2.依据晶体的熔点和硬度 3.依据导电性判断 4.依据元素组成 5.依据物质的分类
离子晶体: 离子化合物(大多数盐、强碱、活泼 金属氧化物)
晶体
原子晶体: 金刚石、单晶硅(Si)、二氧化硅、 金刚砂(SiC) 金属晶体: 所有金属
• 哪些物质属于原子晶体:
金刚石、晶体硅、二氧化硅、金刚砂(SiC)
金属晶体
常见金属晶体: 金属单质或合金 如:钠、钾、铜 有金属光泽、导电、 导热、延展性
物理性质:
,
课堂练习题
• 例 1. 下列各组物质的晶体中 , 化学键类型相同、 晶体类型也相同的是 ( ) • A.SO2和SiO2 B.CO2和H2O • C.NaCl和HCl l4和KCl • 例 2. 下 列 物 质 的 晶 体 中 , 不 存 在 分 子 的 是 ( ) • (A)二氧化碳 (B)二氧化硫 • (C)二氧化硅 (D)硫 • 例 3 、下列晶体熔化时,不需要破坏化学键的是 ( ) • A、金刚石 B、干冰 • C、食盐 D、晶体硅
苏教版高中化学必修二 1.3.3不同类型的晶体 课件(共15张PPT)

拓展视野:时间晶体
2012年初,时间晶体的理论由诺贝 尔物理学奖得主麻省理工学院物理学 家弗兰克·维尔泽克提出。时间晶体是 一种四维晶体,在时空中拥有一种周 期性结构。可以将它看作是一只可以 永远保持走时精确无误的钟,即便是 在宇宙达到热寂之后也是如此。
作业布置: 作业本P22--23
二氧化硅介绍
纯的二氧化硅无色,常温 下为固体,化学式为SiO₂, 难溶于水,熔点1650 ℃, 沸点2230容易导电、 导热等性质的物质。熔沸 点差异很大。
返回
返回
NaCl MgCl2 Na2O MgO 熔点/℃ 801 712 1132 2852
沸点/℃ 1465 1412 1950 3600
硬度
较大 较大 较大 较大 返回
CO2 H2O O2 HCl 熔点/℃ -78 0 -218 -114
沸点/℃ -56 100 -183 -85℃ 硬度 很小 很小 很小 很小
返回
金刚石 晶体硅 碳化硅
熔点/K 3823 1683
---
沸点/K 5100 2628 2700
190(180开 920 801 1291
始气化)
AlCl3属于分子晶体,熔融状态下 不 导电。
2.1999年美国《科学》杂志报道: 在40GPa高压下,用激光器加热到 1800K,人们成功制得了原子晶体
干冰,下列推断正确的是( C )
A.此晶体的熔点、沸点与干冰的相同 B.此晶体干冰易气化可用作制冷材料 C.此晶体硬度大,可用作耐磨材料 D.每摩尔此晶体中含2molC—O键
H C N O Cl Si Na Mg He
不同的微粒 --------不同的类型晶体
氯化钠 ------- 离子晶体 二氧化碳 ------- 分子晶体
《不同类型的晶体》课件

总结与展望
这篇PPT介绍了晶体分类的方法和标准,晶体结构分析的基本技术及应用,以及晶体研究的新趋势和发展前景。
《不同类型的晶体》
这是《不同类型的晶体》的PPT课件,旨在向大家介绍晶体的定义、基本特征 以及不同类型的分类和晶胞形状等内容。
晶体的定义及基本特征
晶体是有序排列的三维空间中的原子、离子或分子的集合体。其基本特征包 括周期性、长程有序以及存在晶体面和晶体轴。
晶体分类
按空间群分
有17种空间群(布拉维格子)和230种点群。
按晶型分
分为立方晶系、正交晶系、单斜晶系、斜方晶 系、构分
包括离子晶体、分子晶体和原子晶体。
按晶胞形状分
常见的有直角棱台型晶体、单斜晶体、六方柱 型晶体和四方柱型晶体。
样例分析
NaCl
以食盐NaCl为例,分析其晶体结构、分类及晶格常 数等基本特征。
Cu
以铜Cu为例,分析其晶体结构、分类及晶格常数等 基本特征。
3.1.3不同类型的晶体ppt课件

原子半径越小,原子间键长越短,键能越大,共价键越稳定,物质的 熔沸点越高。
金刚石、晶体硅、石英、SiC。 金刚石>石英> SiC >晶体硅
;.
17
金属晶体
铍
铜 汞
18
【思考与交流】 金属晶体中存在哪些微粒?如何结合成晶体的?
19
4.金属晶体
(1)定义。
金属阳离子与自由电子通过金属键形成的单质晶体。 说明: ①构成微粒:______金__属__阳__离__子__与__自__由。电子 ②形成晶体作用力:_______。
石墨晶体内既有共价键,又有分子间作用力还有类似金属键的作用力,因此石墨称为 混合型晶体。
22
晶体类型
离子晶体 分子晶体
晶体类型
离子晶体 分子晶体
组成微粒
结 组成微粒 结构
构
微粒间
微作粒用间力
作用力 熔、沸点
阴离子、 阴阳离离子子、 阳离子
离子键
离子键 高
分子 分子
分子间 分作子用间力 作用力
低
熔、硬沸度点
金属键 (2)金属晶体的特点。
①有金属光泽 ②具有良好的导电、导热性、一般具有延展性。
(3)物质范围或实例。 金属、合金
20
石墨的结构
;.
21
拓展视野
石墨
• 石墨为什么很软?
—混合型晶体
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
• 石墨的熔沸点为什么很高? 石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
分子,粒子间以
相结合。 ______
8
2. 分子晶体 (1)定义。
分子间通过分子间作用力按一定规则排列而成的晶体。 说明:
金刚石、晶体硅、石英、SiC。 金刚石>石英> SiC >晶体硅
;.
17
金属晶体
铍
铜 汞
18
【思考与交流】 金属晶体中存在哪些微粒?如何结合成晶体的?
19
4.金属晶体
(1)定义。
金属阳离子与自由电子通过金属键形成的单质晶体。 说明: ①构成微粒:______金__属__阳__离__子__与__自__由。电子 ②形成晶体作用力:_______。
石墨晶体内既有共价键,又有分子间作用力还有类似金属键的作用力,因此石墨称为 混合型晶体。
22
晶体类型
离子晶体 分子晶体
晶体类型
离子晶体 分子晶体
组成微粒
结 组成微粒 结构
构
微粒间
微作粒用间力
作用力 熔、沸点
阴离子、 阴阳离离子子、 阳离子
离子键
离子键 高
分子 分子
分子间 分作子用间力 作用力
低
熔、硬沸度点
金属键 (2)金属晶体的特点。
①有金属光泽 ②具有良好的导电、导热性、一般具有延展性。
(3)物质范围或实例。 金属、合金
20
石墨的结构
;.
21
拓展视野
石墨
• 石墨为什么很软?
—混合型晶体
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
• 石墨的熔沸点为什么很高? 石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
分子,粒子间以
相结合。 ______
8
2. 分子晶体 (1)定义。
分子间通过分子间作用力按一定规则排列而成的晶体。 说明:
不同类型的晶体PPT课件 苏教版

①以Na+为中心,与它最近的等距离的Cl-有多少? ②以Cl ̄为中心,与它最近的等距离的Na+有多少? ③以上构成什么图形? ④以Na+为中心,与它最近的等距离的Na+有多少? ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有多少? ⑥NaCl晶体中每个晶胞中有多少个Na+、Cl ̄ ?
离子晶体
每个Na+周围有六个Cl-
•
18、人生最大的喜悦是每个人都说你做不到,你却完成它了!
•
19、如果你真的愿意为自己的梦想去努力,最差的结果,不过是大器晚成。
•
20、不忘初心,方得始终。
第三单元
从微观结构看物质的多样性
一、不同类型的晶体
气态
物质
液态 固态
晶态 非晶态
晶体:NaCl 非晶体:玻璃
食盐晶体
雪花
金刚石
——像上述这些通过结晶过程形成规则的几何外 形的固体物质,称为晶体。
1、晶体:通过结晶过程形成规则的几何外形 的固体物质。 例如:金刚石、水晶、食盐、雪花
构成晶体的微粒:离子、分子、原子 2、晶胞:在晶体结构中具有代表性的基本重复
原子晶体
相邻原子通过共价键结合而形成空间网状结构 的晶体。
例如:金刚石、二氧化硅
金刚石的晶体结构示意图
109º28´
共价键
在金刚石晶体中, ①每个C与多少个C行成共价键? 4个
②形成怎样的空间结构? 正四面体型 ③金刚石最小碳环由多少个C原子 ?6个
二氧化硅的晶体结构示意图
Si
O
180º
109º28´
•
8、有些人,因为陪你走的时间长了,你便淡然了,其实是他们给你撑起了生命的天空;有些人,分开了,就忘了吧,残缺是一种大美。
离子晶体
每个Na+周围有六个Cl-
•
18、人生最大的喜悦是每个人都说你做不到,你却完成它了!
•
19、如果你真的愿意为自己的梦想去努力,最差的结果,不过是大器晚成。
•
20、不忘初心,方得始终。
第三单元
从微观结构看物质的多样性
一、不同类型的晶体
气态
物质
液态 固态
晶态 非晶态
晶体:NaCl 非晶体:玻璃
食盐晶体
雪花
金刚石
——像上述这些通过结晶过程形成规则的几何外 形的固体物质,称为晶体。
1、晶体:通过结晶过程形成规则的几何外形 的固体物质。 例如:金刚石、水晶、食盐、雪花
构成晶体的微粒:离子、分子、原子 2、晶胞:在晶体结构中具有代表性的基本重复
原子晶体
相邻原子通过共价键结合而形成空间网状结构 的晶体。
例如:金刚石、二氧化硅
金刚石的晶体结构示意图
109º28´
共价键
在金刚石晶体中, ①每个C与多少个C行成共价键? 4个
②形成怎样的空间结构? 正四面体型 ③金刚石最小碳环由多少个C原子 ?6个
二氧化硅的晶体结构示意图
Si
O
180º
109º28´
•
8、有些人,因为陪你走的时间长了,你便淡然了,其实是他们给你撑起了生命的天空;有些人,分开了,就忘了吧,残缺是一种大美。
不同类型的晶体PPT下载1
•
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
•
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
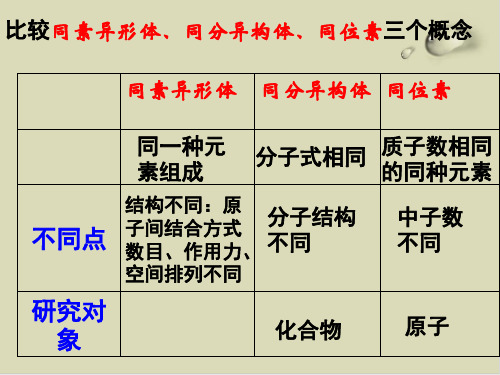
比较同素异形体、同分异构体、同位素三个概念
同素异形体 同分异构体 同位素
同一种元 素组成
分子式相同
质子数相同 的同种元素
不同点
结构不同:原 子间结合方式 数目、作用力、
分子结构 不同
空间排列不同
中子数 不同
研究对 象
化合物
原子
不同类型的晶体
教学要求
【基本要求】 了解金刚石、石墨、足球 烯、石英的微观结构,知道晶体可以分为 原子晶体、分子晶体、离子晶体、金属晶 体。
B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
3、分析物质的物理性质,判断其晶体类型: A、碳化铝,黄色晶体,熔点2200℃,熔融态 不导电;_原__子__晶__体____ B、溴化铝,无色晶体,熔点98 ℃,熔融态不 导电;_分__子__晶__体____ C、五氟化钒,无色晶体,熔点19.5℃,易溶 于乙醇、氯仿、丙酮中;__分__子__晶__体_______ D、物质A,无色晶体,熔融时或溶于水中都能 导电__离__子__晶__体_____
•
5.所有进入现场使用的成品、半成品 、设备 、材料 、器具 ,均主 动向监 理工程 师提交 产品合 格证或 质保书 ,应按 规定使 用前需 进行物 理化学 试验检 测的材 料,主 动递交 检测结 果报告 ,使所 使用的 材料、 设备不 给工程 造成浪 费。
化学课件《不同类型的晶体》优秀ppt7 鲁科版

熔沸点越高
②原子晶体:
原子半径越小→键长越短→键能越大 熔沸点越高 ③分子晶体: 组成和结构相似的分子晶体
相对分子质量越大
熔沸点越高
④金属晶体:
金属阳离子半径越小,电荷数越高 熔沸点越高
【小试牛刀】
4、氮化硅(Si3N4)是一种新型的耐 高温耐磨材料,在工业上有广泛的
应用,它属于
(A)
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
专题1微观结构与物质的多样性
从微观结三构、看不物同质类的型多的样晶性体
雪花
水
干冰
晶
氯
化
钠
金刚石
【问题探究1】
晶体为什么具有规则的几何外形呢?
宏观
决定
反映
微观
晶体规则的几何外形是其内部构成 微粒有规则排列的结果
你知道吗
(1)构成晶体的微粒有哪几种?
原子、分子和离子
(2)微粒之间有哪些类型的相互 作用?
D、Rb、 K、 Na 、 Li
4.下列物质性质的变化规律,与共价键的 键能大小有关的是(BC )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高 B.HF、HCl、HBr、HI的稳定性依次减弱 C.金刚石的硬度、熔沸点都高于晶体硅 D.NaF、NaCl、NaBr、NaI的熔点依次 降低
【小试牛刀】
A.仅① B.仅② C.①和② D. ① ②和③
晶体的导电性:
离子晶体固态时不导电,水溶液中或熔融状 态下导电; 分子晶体不导电,但有些分子晶体溶于水后 导电; 原子晶体不导电;金属晶体任何状态都导电。
稀有气体的特殊性:
稀有气体是单原子分子,构成分子晶体,晶 体中不存在化学键,只存在分子间作用力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
品 、设备 、材料 、器具 ,均主 动向监 理工程 师提交 产品合 格证或 质保书 ,应按 规定使 用前需 进行物 理化学 试验检 测的材 料,主 动递交 检测结 果报告 ,使所 使用的 材料、 设备不 给工程 造成浪 费。
谢谢观看
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
从微观结构看物质的多样性
一、不同类型的晶体
气态
物质
液态 固态
晶态 非晶态
晶体: NaCl
非晶体:玻璃
——像上述这些通过结晶过程形成规则的几何外 形的固体物质,称为晶体。
1、晶体:通过结晶过程形成规则的几何外形 的固体物质。 例如:金刚石、水晶、食盐、雪花
构成晶体的微粒:离子、分子、原子 2、晶胞:在晶体结构中具有代表性的基本重复
分子晶体
分子间通过分子间作用力按一定规则排列而成 的晶体。
例如:CO2
共价键 范德华力
问题(对照书P22图)
①一个CO2晶胞中有多少CO2分子?4个 ②与CO2相邻的等距离的CO2有多少个1?2个
干冰晶体结构示意
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
分子晶体的主要性质:王后雄P35
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有多少? ②以Cl ̄为中心,与它最近的等距离的Na+有多少? ③以上构成什么图形? ④以Na+为中心,与它最近的等距离的Na+有多少? ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有多少? ⑥NaCl晶体中每个晶胞中有多少个Na+、Cl ̄ ?
在NaCl晶体中,以Na+为中心与之最近且距
离相等的Na+共有多少个? 12个
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体型! ④以Na+为中心,与它最近的等距离的Na+有12个! ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有12个! ⑥NaCl晶体中每个晶胞中有多少个Na+、Cl ̄ ?
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
原子晶体
相邻原子通过共价键结合而形成空间网状结构 的晶体。
例如:金刚石、二氧化硅
109º28´
共价键
在金刚石晶体中, ①每个C与多少个C行成共价键?4个
②形成怎样的空间结构? 正四面体型 ③金刚石最小碳环由多少个C原子 ?6个
Si
O
180º
109º28´
共价键
SiO2
①构成SiO2的晶体的微粒是什么? ②SiO2晶体中有无单个分子存在? ③每个Si原子与几个O原子以共价键相结合? ④每个O原子与几个Si原子以共价键相结合? ⑤SiO2的化学式1﹕2代表什么含义? ⑥SiO2中最小环中有多少原子?
Si O
原子晶体的主要性质:王后雄P36
离子晶体: 离子化合物(大多数盐、强碱、活泼 金属氧化物)
原子晶体: 金刚石、单晶硅(Si)、二氧化硅、
晶体
金刚砂(SiC)
金属晶体: 所有金属
分子晶体: 决大多数共价化合物王后雄P35
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
5.所有进入现场使用的成品、半成品 、设备 、材料 、器具 ,均主 动向监 理工程 师提交 产品合 格证或 质保书 ,应按 规定使 用前需 进行物 理化学 试验检 测的材 料,主 动递交 检测结 果报告 ,使所 使用的 材料、 设备不 给工程 造成浪 费。
谢谢观看
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
均摊法确定晶体的化学式
①处于立方体顶点的微粒同时为8个晶胞所共有, 每个微粒有1/8属于该晶胞。
②处于立方体棱上的微粒同时为4个晶胞所共有, 每个微粒有1/4属于该晶胞。
③处于立方体面上的微粒同时为2个晶胞所共有, 每个微粒有1/2属于该晶胞。
④处于立方体内部的微粒,完全属于该晶胞。
在NaCl晶体中:
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
离子晶体
每个Na+周围有六个Cl-
每个Cl-周围有六个Na+
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体型! ④以Na+为中心,与它最近的等距离的Na+有多少? ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有多少? ⑥NaCl晶体中每个晶胞中有多少个Na+、Cl ̄ ?
单位。 3、几种晶体类型
离子晶体:
离子化合物中的阴、阳离子按一定的方式有规则 地排列而形成的晶体。
例如: NaCl
NaCl晶体
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NaCC+ll--
Na+
ClNa+ Cl-
Cl-
Na+
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体形! ④以Na+为中心,与它最近的等距离的Na+有12个! ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有12个! ⑥NaCl晶体中每个晶胞中有4个Na+、4个Cl ̄ !
离子晶体的主要性质:王后雄P34-35
谢谢观看
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
从微观结构看物质的多样性
一、不同类型的晶体
气态
物质
液态 固态
晶态 非晶态
晶体: NaCl
非晶体:玻璃
——像上述这些通过结晶过程形成规则的几何外 形的固体物质,称为晶体。
1、晶体:通过结晶过程形成规则的几何外形 的固体物质。 例如:金刚石、水晶、食盐、雪花
构成晶体的微粒:离子、分子、原子 2、晶胞:在晶体结构中具有代表性的基本重复
分子晶体
分子间通过分子间作用力按一定规则排列而成 的晶体。
例如:CO2
共价键 范德华力
问题(对照书P22图)
①一个CO2晶胞中有多少CO2分子?4个 ②与CO2相邻的等距离的CO2有多少个1?2个
干冰晶体结构示意
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
分子晶体的主要性质:王后雄P35
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有多少? ②以Cl ̄为中心,与它最近的等距离的Na+有多少? ③以上构成什么图形? ④以Na+为中心,与它最近的等距离的Na+有多少? ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有多少? ⑥NaCl晶体中每个晶胞中有多少个Na+、Cl ̄ ?
在NaCl晶体中,以Na+为中心与之最近且距
离相等的Na+共有多少个? 12个
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体型! ④以Na+为中心,与它最近的等距离的Na+有12个! ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有12个! ⑥NaCl晶体中每个晶胞中有多少个Na+、Cl ̄ ?
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
原子晶体
相邻原子通过共价键结合而形成空间网状结构 的晶体。
例如:金刚石、二氧化硅
109º28´
共价键
在金刚石晶体中, ①每个C与多少个C行成共价键?4个
②形成怎样的空间结构? 正四面体型 ③金刚石最小碳环由多少个C原子 ?6个
Si
O
180º
109º28´
共价键
SiO2
①构成SiO2的晶体的微粒是什么? ②SiO2晶体中有无单个分子存在? ③每个Si原子与几个O原子以共价键相结合? ④每个O原子与几个Si原子以共价键相结合? ⑤SiO2的化学式1﹕2代表什么含义? ⑥SiO2中最小环中有多少原子?
Si O
原子晶体的主要性质:王后雄P36
离子晶体: 离子化合物(大多数盐、强碱、活泼 金属氧化物)
原子晶体: 金刚石、单晶硅(Si)、二氧化硅、
晶体
金刚砂(SiC)
金属晶体: 所有金属
分子晶体: 决大多数共价化合物王后雄P35
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
5.所有进入现场使用的成品、半成品 、设备 、材料 、器具 ,均主 动向监 理工程 师提交 产品合 格证或 质保书 ,应按 规定使 用前需 进行物 理化学 试验检 测的材 料,主 动递交 检测结 果报告 ,使所 使用的 材料、 设备不 给工程 造成浪 费。
谢谢观看
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
均摊法确定晶体的化学式
①处于立方体顶点的微粒同时为8个晶胞所共有, 每个微粒有1/8属于该晶胞。
②处于立方体棱上的微粒同时为4个晶胞所共有, 每个微粒有1/4属于该晶胞。
③处于立方体面上的微粒同时为2个晶胞所共有, 每个微粒有1/2属于该晶胞。
④处于立方体内部的微粒,完全属于该晶胞。
在NaCl晶体中:
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
离子晶体
每个Na+周围有六个Cl-
每个Cl-周围有六个Na+
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体型! ④以Na+为中心,与它最近的等距离的Na+有多少? ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有多少? ⑥NaCl晶体中每个晶胞中有多少个Na+、Cl ̄ ?
单位。 3、几种晶体类型
离子晶体:
离子化合物中的阴、阳离子按一定的方式有规则 地排列而形成的晶体。
例如: NaCl
NaCl晶体
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NaCC+ll--
Na+
ClNa+ Cl-
Cl-
Na+
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体形! ④以Na+为中心,与它最近的等距离的Na+有12个! ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有12个! ⑥NaCl晶体中每个晶胞中有4个Na+、4个Cl ̄ !
离子晶体的主要性质:王后雄P34-35
