银染步骤及注意事项
银染方法总汇及注意事项

ptotocol是这样的,请看哪里不妥:蛋白银染步骤步骤溶液时间固定甲醇100ml冰醋酸25ml加双蒸水至250ml 30min冲洗双蒸水3次敏化甲醇75ml戊二醛(25%w/)1.25ml硫代硫酸钠(5%w/) 10ml醋酸钠(17g)加双蒸水至250ml 30min冲洗双蒸水3次银反应硝酸银溶液(2.5%w/) 25ml甲醛(37%w/) 0.1ml加双蒸水至250ml 20min冲洗双蒸水2次显色碳酸钠(6.25g)甲醛(37%w/) 0.05ml加双蒸水至250ml2-5min终止EDTA-Na22H2O(3.65g)加双蒸水至250ml 10min冲洗双蒸水3次建议使用silia的方法!!简单,快!本人的银染方法:1. 固定:100ml MeOH, 24ml H Ac, 56ml 0.04%HCHO, 20ml ddH2O,洗三次,每次>=20分钟;2. 50%EtOH洗PAGE胶三次,每次20分钟;3. 预处理:0.02%Na2S2O3 处理一分钟;4. 水洗:ddH2O漂洗三次,每次20秒;5. 染色:0.8ml 20%AgNO3+72ml 0.04%HCHO处理PAGE胶20分钟;6. 水洗:同上;7. 显色:25ml 12%Na2CO3, 24ml 0.04%HCHO, 1ml 0.02%Na2S2O3, 漂洗10-15分钟;8. 水洗:同上;9. 终止:50%MeOH, 12%H Ac,10分钟。
以上步骤从中科院生化所学来,过程和silia 的基本一致,不知道是否有出入,请大家指正。
谢谢!!!5.2.2.3 银染色1 银染液1(1000ml):甲醇50%乙酸12%甲醇500ml 冰醋酸120ml2 银染液2(1000ml):甲醇30%,乙酸钠0.4M,戊二醛0.5%,硫代硫酸钠0.1%,(含乙酸1-2ml)甲醇300ml 乙酸钠54.4g 戊二醛10ml 硫代硫酸钠1g 乙酸1-2ml3 显色液(1000ml) 无水碳酸钠2.5% 甲醛0.02%无水碳酸钠25g,甲醛1.5ml4 硝酸银(100ml):20%硝酸银(过滤后待用)染色步骤:1 银染液1 洗2次,每次5分钟2 银染液2 洗1次,每次30分钟3 超纯水洗2次,每次1分钟4 0.5%硝酸银洗30分钟5 超纯水洗5次,每次1分钟(关键步骤,共计5分钟)显色液显色6 看到各条带,则倾去显色液, 1%乙酸中止我感觉浸银后、显色前的水洗非常关键,时间不能太长,次数不能太多,否则可能会染不上颜色。
蛋白质银染原理与方法

原理:蛋白质条带的银染是基于蛋白质中各种基团(如琉基、碳基等)与银的结合,检测极限是 2~5.0ng/蛋白条带。
① SDS-PAGE电泳。
注意:银染检测蛋白质的水平是在100ng左右,与CommassieBlue染色比较,银染加样量要少。
否则难以得到清晰的电泳分辨率。
②电泳结束后,戴手套将PAGE胶转移到干净的玻璃培养皿或TIP头盒盖中。
加入25ml FixingSolution(固定液),室温振荡保温30min。
胶需要完全淹没在固定液中。
③彻底弃去固定液,加入25mlIncubation Solution(保育液),室温振荡保温30min。
胶需要完全淹没在保育液中。
④彻底弃去IncubationSolution(保育液),用50ml去离子水洗3次,每次5min。
⑤准备:取2.5ml 10XSilvering Solution, 加入22.5mL水,混匀后使用。
⑥弃去洗涤的水,加入25mlSilvering Solution (银染液)。
室温振荡保温20min。
⑦彻底弃去银染液,加入25mLDevelopingSolution(显色液),室温振荡保温1~10min。
注意观察目的条带。
如果目的条带出现了,可以考虑终止显色。
显色时间不要过长,否则本底较深。
⑧彻底弃去显色液,加入25mLStopping Solution(终止液),室温振荡保温10min。
⑨彻底弃去StoppingSolution(终止液),用50mL去离子水洗3次,每次5min。
弃去洗涤的水,加入25mL PreservingSolution(保护液),室温振荡保温20min。
银染PAGE胶可以拍照保存,也可以室温玻璃纸干燥。
今天第一次银染,结果出来啥也没有,凝胶就像一块海带一样。
能不能提供详细的银染步骤呢?好像有好几种版本,哪位大侠有经验的希望能点拨一下?hotstoe wrote:1. 取下凝胶,蒸馏水冼胶30秒.2. 0.1% 硝酸银染色10分钟.3. 弃去染色液,蒸馏水洗胶1分钟.4.显色液显色15秒,换用新的显色液,显清条带为止.显色液配方: 10克氢氧化钠+0.2克碳酸钠+2m甲醛溶液,定溶到500ml.这个染色方法挺好的,我用过.注意染色时间不能长.我的经验是:1.取下凝胶用去离子水冼胶30秒三次,2.0.1% 硝酸银染色10分钟.3.弃去染色液,蒸馏水洗胶1分钟(换2次去离子水)4.显色液显色15秒,换用新的显色液,显清条带为止.不要试图将所有的条带都显出来,要求越高可能导致背景就深,5.染色后要用固定液(冰乙酸)终止染色,6.固定3分钟后再用去离子水洗涤2遍(整个试验比较费去离子水)。
DNA和蛋白银染步骤(独门绝技--有图)

DNA银染一、银染试剂500ml/瓶(双蒸水稀释)1、固定液:50ml乙醇2、前处理液(敏化液):5ml HNO33、染色液:0.5g 硝酸银(避光配制)4、显色液:无水Na2CO3 12.5g 甲醛200ul 加水至500ml5、终止液:50ml 冰醋酸二、银染步骤(摇床设置52rpm左右)1、准备好放有双蒸水的塑料盒,将电泳后的变性胶放入盒中在摇床上轻摇1min;2、凝胶固定:倒掉盒中的水,加入100ml左右的固定液,摇床上缓缓摇动10min;3、洗胶:弃固定液,用双蒸水洗2次,每次30S;4、凝胶氧化:弃双蒸水,加入100ml左右前处理液氧化6min;5、洗胶:弃前处理液,用双蒸水洗2次每次10S;6、凝胶染色:弃双蒸水,加入100ml左右的染色液避光摇20min;7、洗胶:弃染色液,用双蒸水洗1次10S;8、凝胶显色:加入100ml显色液摇到看到清晰的条带为止;9、终止:弃显色液,迅速加入终止液100ml左右,摇2-3min;10、洗胶:弃终止液,用双蒸水洗2次每次1min。
三、变性聚丙酰胺凝胶的配制(两块、使用1.0BioRad胶板)1.2%的凝胶可以跑微卫星,和基因组DNA1、尿素:7.2g2、30%聚丙酰胺,4.68ml3、10×TBE,1.5ml (Tris碱108g;硼酸55g;EDTA 40ml 0.5mol/L,Ph=8.0;加水至1L)4、30%AP,35ul5、TEMED,4ul四、下图:左为果蝇正常基因组DNA与损伤后基因组DNA;右为果蝇微卫星电泳12h Treatment24h TreatmentMCT 0 5 10 200 5 10 20Protein银染一、银染试剂500ml/瓶(双蒸水稀释)1、固定液:200ml甲醇,50ml冰醋酸2、前处理液(敏化液):150ml 乙醇,34g醋酸钠,1g硫代硫酸钠(使用前加入)3、染色液:1.25g 硝酸银(避光配制)4、显色液:无水Na2CO3 12.5g 甲醛200ul 加水至500ml5终止液:2g甘氨酸二、银染步骤(摇床设置52rpm左右)1、凝胶固定:准备好放有双蒸水的塑料盒,将电泳后的变性胶放入盒中,加入100ml左右的固定液,摇床上缓缓摇动30min;2、洗胶:弃固定液,用双蒸水洗2次,每次1min;3、凝胶氧化:弃双蒸水,加入100ml左右前处理液氧化30min;4、洗胶:弃前处理液,用双蒸水洗3次每次5min;5、凝胶染色:弃双蒸水,加入100ml左右的染色液避光摇20min;6、洗胶:弃染色液,用双蒸水洗2次每次5min;7、凝胶显色:加入100ml显色液摇到看到清晰的条带为止;8、终止:弃显色液,迅速加入终止液100ml左右,摇10min;9、洗胶:弃终止液,用双蒸水洗2次每次5min。
蛋白质染色(银染法)标准操作规程

蛋白质染色(银染法)标准操作规程(编号:041)
1、目的及适用范围
检测聚丙烯酰胺凝胶中的蛋白质,实验原理是在碱性条件下,用甲醛将蛋白带上的硝酸银(银离子)还原成金属银,以使银颗粒沉积在蛋白带上。
染色的程度与蛋白中的一些特殊的基团有关,不含或者很少含半胱氨酸残基的蛋白质有时候呈负染。
2、主要仪器
摇床、避光盒
3、试剂及配制方法
乙醇、冰醋酸、乙酸钠、硫代硫酸钠、硝酸银、碳酸钠、甘氨酸或EDTA.Na2.2H2O、甲醛,去离子水
固定液:100mL乙醇(40%乙醇),25mL冰醋酸(10%冰醋酸)加水到250mL;
致敏液:75mL 乙醇(30%乙醇)17g 乙酸钠,28.2g 三水乙酸钠(34g乙酸钠),0.5g硫代硫酸钠加水到终体积250mL;
银染液:0.625g AgNO3,100 uL37%甲醛(在使用前加入)加水到终体积250mL;
显色液:6.25 g Na2CO3,50 μL 37%甲醛(在使用前加入)加水到终体积250mL;
终止液:3.65g EDTA.Na2.2H2O 或者1g 甘氨酸加水到终体积250mL
保存液:1% 冰醋酸
4、操作步骤
4.1固定:50mL固定液中固定30min或者更长时间
4.2致敏:50mL致敏液中致敏30min
4.3水洗:3 x 10min
4.4银染:50mL银染液中染20min (保持避光)
4.5水洗:2 x 1 min (注意把握时间,水洗时间长显色速度慢,点的颜色偏黄色)
4.6显色:50mL显色液中显色,时间视显色程度而定
4.7终止:50mL终止液中终止10min
4.8保存:1% 冰醋酸,4 ℃
5、注意事项
88。
基本银染和微波快速银染步骤-中文翻译

基本的银染步骤:(90min)材料:超纯水(>18 megohm/cm全程)、塑料染色托盘、摇床、塑料搅拌棒、10mL 一次性管、干净的玻璃杯、量筒、30%乙醇、100%乙醇、固定液(40%乙醇、10%乙酸)注意事项:1.在拿胶前确定用去离子水清洗橡胶手套。
2.用干净的容器,并标明银染专用。
3.当摇动时,确保容器大小可使胶在里面自由移动,染色时溶液能完全沫过胶面。
4.在拿胶或换溶液时,避免徒手摸胶或用金属物品接触,及避免对胶施加压力。
5.用有铁氟龙图层的棒和干净的玻璃容器准备试剂。
6.避免试剂交叉污染。
7.用新鲜配置的溶液。
样品含有高浓度的DTT:如果你的样品含有高浓度的DTT (>50mM),银染时可能导致条带拖尾和黄色背景。
为避免拖尾按照下面的方法还原和烷基化样品:1. 用新鲜配制的DTT还原你的样品到终浓度为17mM,并在70℃加热10min.2. 用新鲜配制的碘乙酰胺烷基化你的样品到终浓度为35mM,并在70℃加热10min.3. 加不含DTT的SDS样品buffer到还原和烷基化后的样品中。
进行电泳,并按手册进行银染。
在开始之前:用试剂盒中的试剂准备如下溶液用于银染:程序:下面的程序用于8*8厘米预制胶,1.0mm厚。
如果要染两块小胶或1.0mm厚的大胶(18*18),保证孵育时间,将所有溶液的体积加倍。
注意:如果你的胶的尺寸和上面提到的不一样,你可能必须通过调整孵育时间和溶液体积来选择银染策略。
所有的孵育应该在一个旋转摇床上进行,以1圈/秒的速度在室温下进行。
确保每个胶有100ml的溶液。
1. 电泳后,将胶取出至合适尺寸的银染托盘内,用超纯水简单的清洗一下。
2. 用100ml固定液在摇床上缓慢旋转,固定胶20min。
如果你用的是Tricine 胶,那么就固定1小时。
注意:如果没有足够的时间完成银染程序,胶可以在固定液中存放一夜。
长时间的固定在某些情况下可能会改善灵敏度和背景。
快速银染银染步骤及相关药品配制

快速银染银染步骤及相关药品配制银染步骤及相关药品配制一.银染基本步骤1.洗板和擦板电泳槽板先用无水乙醇擦一遍,5分钟后用配制的剥离硅烷(repel)溶液涂抹均匀。
放置15-30分钟玻板(用过的玻板先用NaOH溶液浸泡,直至废胶脱落)先用抹布蘸少许洗洁精在自来水下洗净,再用无水乙醇擦一遍,5分钟后用新鲜配制的亲和硅烷(binding)溶液涂抹均匀。
放置15-30分钟2.装板玻板在下,电泳槽板在上,中间放两根压条(涂抹repel和binding的面相互靠近),对齐后,用三对夹子将波板与电泳槽板夹紧。
3.灌胶用针筒吸取6%的聚丙烯酰胺凝胶溶液,缓慢均匀的从灌胶口将胶灌入,灌好后取下靠近灌胶口的夹子,倒插入梳子,注意不要起汽泡,插好后,再夹上夹子。
凝胶需要1-2个小时。
4.预电泳取下夹子,拔出倒插的梳子,在自来水下将灌胶口冲洗干净,放入电泳槽,卡紧,灌入缓冲液,上下槽各300ml左右,注意用夹子夹紧上槽排放缓冲液的胶管。
80W衡功率电泳半小时。
5.点样用吸管吹干净灌胶口的废胶,将梳子顺插入灌胶口,开始点样,注意不要串样,梳齿不要将胶面弄坏。
6.电泳80W衡功率电泳1小时左右。
7.银染将玻板放入配制好的银染液中,银染半小时左右10.显影从银染液中拿出玻板快速水洗3-5秒,然后放入新鲜配制的显影液中,室温显影,直至条带清晰11.用自来水轻轻冲洗板子正反面几次,洗净残余的NaOH。
二.药品配制1.6%聚丙烯酰胺凝胶(PA):Urea: 420.42gAcr: 60g 丙烯酰胺Bis: 3.16g10×TBE: 50ml加超纯水定容至 1L8% 聚丙烯酰胺PA:尿素 420.42gAcr: 80gBis: 4.212g10*TBE: 100ml加超纯水定容至 1L2. 10×TBETris-base: 216g硼酸:110gEDTA-Na2:14.88g3. binding(亲和硅烷)无水乙醇:2mlBinding原液:8ul冰醋酸:8ul4.Repel (剥离硅烷)三氯甲烷:100mlRepel:2ml5.Loading buffer:甲酰氨:49ml10mM EDTA(PH=8.0):1ml溴酚蓝:0.125g二甲苯青:0.125g7.银染液蒸馏水:1500ml无水乙醇:150ml硝酸银溶液(1g/ml):1500ul 8.显影液蒸馏水:1500ml氢氧化钠:30g甲醛:6ml硫代硫酸钠(10mg/ml):300ul。
银染

银染操作步骤1.固定:电泳结束后,取凝胶放入约100ml固定液中,在摇床上室温摇动20分钟,摇动速度为60-70rpm。
固定40分钟以上甚至过夜可以进一步降低背景。
固定液的配制:依次加入50ml乙醇、10ml乙酸和40ml MilliQ级纯水或双蒸水,混匀后即成100ml 固定液,可大量配制室温存放。
2. 30%乙醇洗涤:弃固定液,加入100ml 30%乙醇,在摇床上室温摇动10分钟,摇动速度为60-70rpm。
30%乙醇的配制:70ml MilliQ级纯水或双蒸水中加入30ml乙醇,混匀后即成100ml 30% 乙醇。
3.水洗涤:(洗2次)弃30%乙醇,加入200ml MilliQ级纯水或双蒸水,在摇床上室温摇动10分钟,摇动速度为60-70rpm。
4.增敏:(辅染)现配现用弃水,加入100ml银染增敏液(1X),在摇床上室温摇动2分钟,摇动速度为60-70rpm。
银染增敏液(1X)的配制:99ml MilliQ级纯水或双蒸水中加入1ml银染增敏液(100X),混匀后即为银染增敏液(1X)。
银染增敏液(1X)配制后需在2小时内使用。
银染增敏液(100X)的配制:即2.8%硫代硫酸钠溶液,需用黑袋包裹避光保存。
5.水洗涤(共2次):弃原有溶液,加入200ml MilliQ级纯水或双蒸水,在摇床上室温摇动1分钟,摇动速度为60-70rpm。
弃水,再加入200ml MilliQ级纯水或双蒸水,在摇床上室温摇动1分钟,摇动速度为60-70rpm。
6.银染:弃水,加入100ml银溶液(1X),在摇床上室温摇动10分钟,摇动速度为60-70rpm。
银溶液(1X)的配制:99ml MilliQ级纯水或双蒸水中加入1ml银溶液(100X),混匀后即为银溶液(1X)。
银溶液(1X)配制后需在2小时内使用,最好是现配现用。
银溶液(100 X)的配制:称取5g硝酸银,加水溶解并稀释至500ml,摇匀即得1%的硝酸银溶液,需用黑袋包裹避光保存。
银染法的名词解释

银染法的名词解释对于普通人来说,银染法可能是一个陌生的名词,但对于纺织品行业的从业者来说,它却是一个非常重要的工艺。
银染法是一种利用化学方法将银离子引入纺织品中,以达到防菌、抗菌、净化空气等功能的一种技术。
下面,我们将深入探讨银染法的详细内容。
一、银染法的原理银染法利用的是银离子的抗菌性能。
事实上,早在古代,人们就发现银具有抗菌的作用。
在现代,科学家们通过研究发现,银离子能够干扰细菌的细胞膜和核酸的复制,从而抑制细菌的生长和繁殖。
为了将银离子引入纺织品中,银染法应运而生。
二、银染法的流程银染法的流程主要包括:纺织品预处理、银染剂的配制、浸染银染剂、干燥和固定银离子等步骤。
首先,在纺织品进行预处理。
预处理主要包括漂白、洗涤、软化、充电等步骤,以去除纺织品表面的杂质,使其更加适合染色。
接着,配制银染剂。
银染剂通常由银盐和染料组成。
不同的银盐可以产生不同的效果,例如硝酸银可以产生较强的抗菌效果,氧化银则可以产生净化空气的效果。
然后,将纺织品浸泡在银染剂中。
这个步骤中,纺织品会吸收银离子,并且银离子会与纺织品的纤维结合,从而实现功能的目的。
完成浸染后,需要将纺织品进行干燥。
干燥的目的是除去多余的水分,使银离子更好地固定在纺织品上。
最后,采用适当的固定剂将银离子固定在纺织品上。
固定剂能够与银离子进行反应,形成稳定的化学结构,从而增加银离子在纺织品上的使用寿命。
三、银染法的应用银染法在现代纺织品行业中应用广泛。
首先是医疗纺织品领域。
由于银离子的抗菌性能,银染法在生产医用口罩、手术衣等产品时被广泛采用,可以有效地阻止细菌的传播,保护医护人员和患者的健康。
另外,银染法也被应用于家纺领域。
银染法可以制作出带有抗菌功能的床上用品,例如枕头套、被套等。
这些产品可以减少细菌的滋生,为家庭提供一个干净、健康的生活环境。
此外,银染法还可以应用于户外装备领域。
例如,登山服、户外鞋等产品采用了银染法,不仅可以抑制细菌的生长,还有效防止异味产生,让户外运动更加舒适。
银染方法

银染方法1.搪瓷盘中倒入2000ml左右70%乙醇,把胶做好标记卸入乙醇中,摇床上固定15min2.回收乙醇(可重复用3-5次),蒸馏水洗2遍,每遍2-3min,尽可能把水倒净3.190ml蒸馏水中加入3.6%的NaOH4.2ml、20%AgNO33.6ml、氨水2ml混匀配成染色液。
倒入染色液,染色30min。
4.倒掉染色液,蒸馏水洗3遍,每遍2-3min,尽可能把水倒净5.200ml蒸馏水中加入1%柠檬酸钠1ml,甲醛100ul混匀配成显色液。
倒入显色液显色至清晰。
6.倒掉显色液,加蒸馏水停显,并洗2-3遍测序板的硅化处理1:每块玻璃板的面都需硅化处理,以防止凝胶与两块玻璃板紧贴并减少电泳完毕后从胶模中取出凝胶时凝胶发生破裂的可能性。
硅化方法为;将拟硅化的玻璃板置于通风橱中,并戴手套操作,在拟硅化板面上加2-3ml 5%二氯二甲基硅烷(二氯二甲基硅烷5%溶于氯仿中),用纸巾将硅化液涂布均匀,然后用去离子水洗净玻璃板,再用乙醇冲洗后晾干。
如需要从玻璃板上去除原有的硅,可用KOH-甲醇擦拭之。
KOH-甲醇配制为100ml甲醇中加5g片状KOH即可。
测序板的硅化处理2:1.浓度:4%二氯二甲基硅烷2.成分:二氯二甲基硅烷,三氯甲烷4.用途:制备聚丙稀酰胺凝胶时,可用Repel-silane处理小玻板,使凝胶易于剥离。
5.使用方法:测序用玻璃板必须彻底洗净。
先用温水和洗涤剂洗净,用水洗掉洗涤剂,再用去离子水冲洗干净。
最后用乙醇洗板。
1)长玻璃板的处理每次铺胶前均需用亲和硅烷对长玻璃板进行处理。
1、用镜头纸蘸取亲和硅烷溶液少许(1ml左右),涂在长玻璃板上。
要将整块板都涂满、涂匀。
2、4~5分钟后,用95%乙醇洗长玻璃板三次,以去除多余的亲和硅烷。
2)短玻璃板的处理每次铺胶前均需用剥离硅烷对短玻璃板进行硅化处理。
1、处理短玻璃板前先更换手套,以防与亲和硅烷交叉污染。
2、用镜头纸蘸取剥离硅烷溶液适量(1.5ml左右),涂在短玻璃板上。
我们实验室用的银染方法

我们实验室用的银染方法1.50%甲醇浸泡15分钟(置于摇摆床上,以下省略,本步骤两次,每15分钟更换一次)2.10%甲醇浸泡10分钟3.水漂洗3次,每次数秒4.2μM DTT溶液浸泡20分钟5.0.1%硝酸银溶液浸泡20分钟6.水漂洗3次,每次不超过15秒(每次约150ML)7.显色液漂洗3次,每次不超过15秒(每次约100ML)8.显色液浸泡显色至看到目的蛋白带(约200ML)9.10G柠檬酸定影显色液:15G无水碳酸钠溶于500ml水,用前加入250μL福尔马林搅拌均匀水用双蒸水就可以,纯度越高越好,其他试剂用分析纯,据书上说甲醇用化学纯的比分析纯更灵敏此方法出自冷泉港蛋白质技术指南(实际上是其蛋白质技术会议的总结)灵敏度稍低于分子克隆上老方法,但是非常方便,也比其他方法快速,只需要1.5小时,我染出来的胶非常漂亮,有需要的话可以上传给大家看看一般来说,高背景是由于杂质产生的,银染的水质很重要,最好要用去离子水或双蒸水,装胶的器皿也一定要洗得很干净。
固定、银染之后均需充分的漂洗。
其实银染就是银镜反应,可能是你的样品浓度高,所以白了,浓度更高还会变成一条能反光的带。
固定时间不需加长,我有时来不及还减少固定时间,银染关键是器皿和溶液干净,显色前胶一定要漂干净大板本来效果就差点,浓度越大,条带形状越差,这也很正常,银染薄点的胶效果要好些,因为染的是表面的蛋白1.取下凝胶,蒸馏水冼胶30秒.2. 0.1% 硝酸银染色10分钟.3. 弃去染色液,蒸馏水洗胶1分钟.4.显色液显色15秒,换用新的显色液,显清条带为止.显色液配方: 10克氢氧化钠+0.2克碳酸钠+2m甲醛溶液,定溶到500ml.这个染色方法挺好的,我用过.注意染色时间不能长.材料没什么要求,玻璃会更好一点,但不好搞到,我们是见到什么大小合适就用什么。
液体的量一般是胶体积的5倍,比如13×13×0.1cm的胶,用一百ml一定够,80也行。
银染方法总结

银染的方法种类很多,目前有文献报道的就有100 多种。
大致的原理是银离子在碱性pH 环境下被还原成金属银,沉淀在蛋白质的表面上而显色。
由于银染的灵敏度很高,可染出胶上低于1 ng/蛋白质点,故广泛的用在2D 凝胶分析上,及极低蛋白含量测定的垂直凝胶中。
这里介绍的是我们实验室成功运用的银染方法,主要是用于垂直凝胶电泳中低丰度蛋白的检测!如内源性GST-Pulldown、Co-IP等实验中相互作用蛋白的研究银染操作规程实验原理:在碱性条件下,用甲醛将蛋白带上的硝酸银(银离子)还原成金属银,以使银颗粒沉积在蛋白带上。
染色的程度与蛋白中的一些特殊的基团有关,不含或者很少含半胱氨酸残基的蛋白质有时候呈负染。
试剂:乙醇、冰醋酸、乙酸钠、硫代硫酸钠、硝酸银、碳酸钠、甘氨酸或EDTA.Na2.2H2O、甲醛实验操作程序:固定:30min或者更长时间100ml 乙醇(40% 乙醇)25ml冰醋酸(10% 冰醋酸)加水到250ml致敏:30min75ml 乙醇(30% 乙醇)17g乙酸钠或28.2g三水乙酸钠0.5g硫代硫酸钠加水到终体积250ml 水洗:3 x 10min银染:20min0.625g AgNO3、100 ul 37%甲醛(在使用前加入)加水到终体积250ml水洗:2 x 1 min (注意把握时间,水洗时间长显色速度慢,点的颜色偏黄色)显色:视情况而定6.25 g Na2CO3、50 ul 37% 甲醛(在使用前加入)加水到终体积250ml终止:10min3.65g EDTA.Na2.2H2O 或者1g 甘氨酸加水到终体积250ml保存:1% 冰醋酸,4 ℃注意事项:1.固定时间较长,则加一步水洗30min,以免胶太脆而破碎。
2.甲醛在使用前加入。
3.最好多配制一份显色液,第一次显色到溶液变混浊时换一份显色液,显色到点清晰。
4.显色过程很快,要注意把握时间,避免染色过度。
5.银染液和显色液需要预冷。
银染流程及注意事项

银染流程及注意事项
银染流程银染 protocol
注意事项:
在最初甲醇固定时就应该先除去甘油、尿素、甘氨酸、Triton X 100和两性电解质这些干扰性物质。
蛋白胶固定之前一定要先用水涮干净!
SDS凝胶中的巯基乙醇会导致在60 KDa或67 KDa处出现两条水平线。
减少巯基乙醇的用量即可避免。
不同蛋白质对银染的反应是不一样的,尤其是碱性蛋白染色效果差。
因此,不宜用银染测定不同蛋白的比例。
染色过程中,缓慢的振荡是必要的,一般选择 40 60 rpm.
对于银染条带不理想可尝试优化:
① 反应溶液都平衡到室温,
② 硝酸银和显色液容易失效,可以现配现用
③ PAGE胶固定之前,用水浸洗掉running buffer
④ 检查用水器具是否都去离子彻底(用新鲜配置50%硝酸润洗)。
DGGE银染溶液配制、银染步骤及切胶回收解读

溶液配制固定液:乙醇90ml,冰醋酸4.5ml,定容至900ml(各组分含量:10%乙醇,0.5%冰醋酸)注:如果显影完后不进行终止显影,那么固定液可以回收使用。
染色液:AgNO3 1.4g,甲醛600μl,加入去离子水700ml,振荡混匀,甲醛在使用前加入。
每次使用需新鲜配制,在固定步骤快结束时配制即可。
显色液:NaOH 9g,甲醛1200μl,加去离子水600ml。
显影液的配制可以先配成NaOH溶液放入4℃冰箱贮存,待要用时取出再加入甲醛并混匀。
预冷的显影液可以让条带显影更漂亮清晰,但是显影速度会变慢一些。
银染步骤1.固定将胶放入固定液中,摇床振荡15min。
摇床速度无需很快,小档即可。
2.银染固定液中取出胶,去离子水快速清洗两次,固定液此时可回收。
将胶放入配制好的染色液中,摇床振荡20min。
尽量在通风橱中进行并避光。
有时候胶会飘在水面导致染色结果不好,可调整摇床速度使染色液没过胶。
3.显影染色液中将胶取出,去离子水快速清洗一到两次,尽量迅速!放入预冷过的显影液中显影,并马上迅速振荡容器,使胶周围的银离子扩散均匀,待溶液颜色均匀不变,摇床开小档振荡直至条带显色完全。
4.终止显影将胶取出清洗两次,放入固定液中,即可终止显影,但固定液不可回收了。
如果不需要保存胶的话,这一步可以省略。
5.拍照将胶放在白光透射仪上,轻轻抚去底下的气泡,铺平摆正胶,数码相机拍照。
注意:银染全程,手指不可碰到胶,尤其是染色~显影这一段步骤,摸一下胶就会留下手印。
切胶回收步骤在白光透射仪上用干净的手术刀片切胶,放入灭菌的0.5ml离心管中,加入灭菌水50μl后,用黄枪头捣碎,离心后60~65℃水浴3~6h,取出离心后可以进行PCR实验,如果时间不能安排马上做PCR也可放4℃过夜,第二天做PCR。
银染

一、银染前准备1. 银染水质很重要,最好全部双蒸水或去离子水。
2. 装胶的器皿清晰干净,最后双蒸水多冲几遍。
3. 操作时戴手套,不然gel上会有大手印。
4. 跑胶时我采用大梳子,小样本量。
因为银染本身分辨率就很高,样本量太大时杂带太浓。
小梳子的条带比较模糊。
二、银染过程1. 电泳结束后,自来水冲洗玻璃板两面,预冷,剥下凝胶,双蒸水洗涤两次。
2. 浸没于0.1%的AgNO3溶液中,摇床银染10分钟。
注意事项:a. 时间。
银染时间可延迟到15分钟,但是千万不要超过20分钟,否则胶的背景极深,一个字,丑。
b.浓度。
硝酸银溶液浓度不宜超过0.15%,我的经验表明,AgNO3浓度越高,胶越黄越丑。
3. 双蒸水冲洗两次,1min。
注意事项:a. 充分的漂洗可以降低背景色。
因此漂洗时间一定要到1min4. 浸没于1.2% NaOH+ 0.4% 甲醛溶液中显影,看到模糊的条带后立即大量双蒸水冲洗,中止显影。
注意事项:a. 白色器皿,看条带比较方便。
b.出现淡淡条带后立即中止银染。
千万不要等到看到清晰的目标条带时才中止显影,那时已经显影过度,拍片时背景色极深,丑。
c. 采用“低浓度NaOH×长时间显影”的策略。
实验证明浓度较高的NaOH(浓度超过1.5%)很容易显影过度。
因此不采用“高浓度NaOH×短时间显影”的策略。
d.为便于控制显影速度,得到最佳的信噪比,显影液温度不要过高(显影液提前半小时配,NaOH溶解后会释放热量,导致显影液温度过高),以10度左右为宜,温度过高则易显影过度,背景深;温度过低则显影时间延长。
e. 显影后尽早拍片。
胶片会随着时间逐渐变黄,条带越来越浓,最后杂带逐渐显现,因此拍品要趁早。
时间拖得越久,片子越难看。
he.银染.胶原染色方法
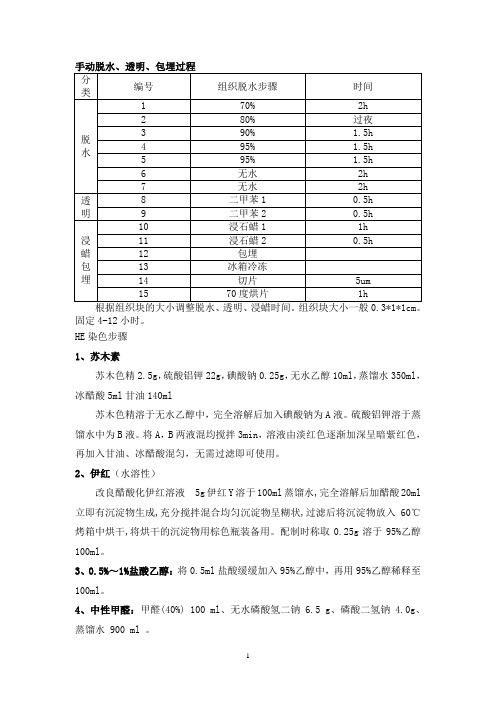
固定4-12小时。
HE染色步骤1、苏木素苏木色精2.5g,硫酸铝钾22g,碘酸钠0.25g,无水乙醇10ml,蒸馏水350ml,冰醋酸5ml甘油140ml苏木色精溶于无水乙醇中,完全溶解后加入碘酸钠为A液。
硫酸铝钾溶于蒸馏水中为B液。
将A,B两液混均搅拌3min,溶液由淡红色逐渐加深呈暗紫红色,再加入甘油、冰醋酸混匀,无需过滤即可使用。
2、伊红(水溶性)改良醋酸化伊红溶液5g伊红Y溶于100ml蒸馏水,完全溶解后加醋酸20ml 立即有沉淀物生成,充分搅拌混合均匀沉淀物呈糊状,过滤后将沉淀物放入60℃烤箱中烘干,将烘干的沉淀物用棕色瓶装备用。
配制时称取0.25g溶于95%乙醇100ml。
3、0.5%~1%盐酸乙醇:将0.5ml盐酸缓缓加入95%乙醇中,再用95%乙醇稀释至100ml。
4、中性甲醛:甲醛(40%) 100 ml、无水磷酸氢二钠 6.5 g、磷酸二氢钠 4.0g、蒸馏水 900 ml 。
染色过程:Gomori染色方法1、Gomori氨性银改良液取5%硝酸银水溶液5ml,滴加浓氨水由棕黑色变清为止,再加入3%氢氧化钠水溶液5ml,此时该液突变紫黑色,这时再加入氨水使之变清晰为止(有少量颗粒)。
最后用蒸馏水补足至50ml,盛棕色试剂瓶中,置于冰箱中备用较长时间。
2、10%中性甲醛:pH=8.210%中性甲醛固定液,福尔马林(40% W/ 甲醛) 100ml,磷酸二氢钠(NaH2PO4•H2O) 4g (无水NaH2PO4 3.5g ),磷酸氢二钠(Na2HPO4)6.5g,补蒸馏水至1000ml。
3、酸性高锰酸钾液:0.25%高锰酸钾100ml与3%硫酸5ml混合。
注意事项:1、所使用的玻璃仪器,须用清洁液处理。
2、配制氨银溶液时,氨水加入的量不能过多或不足,过多感应下降,会使液体过碱,滴染时,切片容易脱落,过少则感应上升,浸染效果不佳,不好掌握。
3、配制氨银液时,有可能用玻璃蒸馏水。
(玻璃蒸馏水器蒸馏的双蒸水)4、使用的化学试剂应尽量用分析纯以上。
银染步骤及注意事项

银染步骤及注意事项银染步骤及注意事项银染色步骤为1次固定10分钟冰醋酸2用双蒸水洗涤凝胶,每次1分钟3染色液1g硝酸银。
5mL37甲醛1L双蒸水现在匹配染色30分钟。
4.快速清洗并清洗凝胶数次。
5开发30克碳酸钠1.5毫升37甲醛200微升10毫克/升硫代硫酸钠显影直到出现清晰的条纹银染色成功的关键因素包括:1 .用超纯水,如纳米纯水或Milli-Q或双蒸水进行银染色的纯化2.使用提供的碳酸钠或ACS试剂级碳酸钠染色后用于水洗的时间长度非常重要。
清洗胶水,然后将其放入通常浸泡在水中的显色溶液中,只需5-10秒钟。
4使用前及时向显色液中加入甲醛和硫代硫酸钠ul/1ml5.使用前及时配制染液银染方法有很多种,目前文献报道有100多种。
然而,确切的染色机理还不是特别清楚。
一般原理是银离子在碱性酸碱度环境下还原成金属银,沉淀在蛋白质表面形成颜色。
银染色广泛用于2D凝胶分析和垂直凝胶,用于极低蛋白质含量的测定,因为它对低于1纳克/蛋白质斑点的染色凝胶具有高灵敏度。
本文介绍了我们实验室成功使用的银染色法,以补充关键操作和要求。
主要用于垂直凝胶电泳中低丰度蛋白的检测,如内源GST-Pulldown、Co-IP等实验中相互作用蛋白的研究。
银染色程序用于检测聚丙烯酰胺凝胶中的蛋白质。
实验原理是在碱性条件下,用甲醛将蛋白质带上的硝酸银和银离子还原成金属银,在蛋白质带上沉积银颗粒。
染色程度与蛋白质中某些特殊基团的有关。
不含或很少含半胱氨酸残基的蛋白质有时会被染色。
银染的详细机制尚不十分清楚。
试剂乙醇、冰醋酸、乙酸钠、硫代硫酸钠、硝酸银、碳酸钠、甘氨酸或乙二胺四乙酸。
Na2.2H2O,甲醛实验程序固定30分钟或更长时间100毫升乙醇40毫升乙醇25毫升冰醋酸10毫升冰醋酸加水250毫升敏化30分钟75毫升乙醇30毫升乙醇17克醋酸钠28.2克三水醋酸钠0.5克硫代硫酸钠加水250毫升水洗涤3×10毫升银染料20分钟0.625克硝酸银100微升37甲醛加水至最终体积250毫升使用前用水冲洗2×1min注意掌握时间水冲洗时间长颜色慢点是黄色发展取决于情况o 6.25 g Na2CO3 o 50 ul 37甲醛添加o 水至最终体积2使用前50ml终止10 min o 3.65 g EDTA、na 2.2h2o 或1g甘氨酸o加水至最终体积250ml保存1冰醋酸4℃注意事项1如果固定时间较长,加一步水洗30分钟以避免胶水太脆而破裂。
蛋白质银染原理与方法

原理:蛋白质条带的银染是基于蛋白质中各种基团(如琉基、碳基等)与银的结合,检测极限是2~5.0ng/蛋白条带。
① SDS-PAGE电泳。
注意:银染检测蛋白质的水平是在100ng左右,与CommassieBlue染色比较,银染加样量要少。
否则难以得到清晰的电泳分辨率。
②电泳结束后,戴手套将PAGE胶转移到干净的玻璃培养皿或TIP头盒盖中。
加入25ml FixingSolution(固定液),室温振荡保温30min。
胶需要完全淹没在固定液中。
③彻底弃去固定液,加入25mlIncubation Solution(保育液),室温振荡保温30min。
胶需要完全淹没在保育液中。
④彻底弃去IncubationSolution(保育液),用50ml去离子水洗3次,每次5min。
⑤准备:取2.5ml 10XSilvering Solution, 加入22.5mL水,混匀后使用。
⑥弃去洗涤的水,加入25mlSilvering Solution (银染液)。
室温振荡保温20min。
⑦彻底弃去银染液,加入25mLDevelopingSolution(显色液),室温振荡保温1~10min。
注意观察目的条带。
如果目的条带出现了,可以考虑终止显色。
显色时间不要过长,否则本底较深。
⑧彻底弃去显色液,加入25mLStopping Solution(终止液),室温振荡保温10min。
⑨彻底弃去StoppingSolution(终止液),用50mL去离子水洗3次,每次5min。
弃去洗涤的水,加入25mL PreservingSolution(保护液),室温振荡保温20min。
银染PAGE胶可以拍照保存,也可以室温玻璃纸干燥。
今天第一次银染,结果出来啥也没有,凝胶就像一块海带一样。
能不能提供详细的银染步骤呢?好像有好几种版本,哪位大侠有经验的希望能点拨一下?hotstoe wrote:1. 取下凝胶,蒸馏水冼胶30秒.2. 0.1% 硝酸银染色10分钟.3. 弃去染色液,蒸馏水洗胶1分钟.4.显色液显色15秒,换用新的显色液,显清条带为止.显色液配方: 10克氢氧化钠+0.2克碳酸钠+2m甲醛溶液,定溶到500ml.这个染色方法挺好的,我用过.注意染色时间不能长.我的经验是:1.取下凝胶用去离子水冼胶30秒三次,2.0.1% 硝酸银染色10分钟.3.弃去染色液,蒸馏水洗胶1分钟(换2次去离子水)4.显色液显色15秒,换用新的显色液,显清条带为止.不要试图将所有的条带都显出来,要求越高可能导致背景就深,5.染色后要用固定液(冰乙酸)终止染色,6.固定3分钟后再用去离子水洗涤2遍(整个试验比较费去离子水)。
银染步骤及注意事项

银染步骤是1 固定10冰乙酸min。
2 清洗双蒸水冲洗凝胶次每次1min。
3 染色染色液1g硝酸银.5mL37甲醛1L双蒸水。
现配染色30min。
4 清洗迅速洗凝胶次。
5 显影30g 碳酸钠1.5mL37甲醛200uL 10mg/L硫代硫酸钠。
显影至清晰带纹出现。
成功银染的关键因素包括 1 用超纯水比如NANOpure或Milli-Q纯化或者是双蒸水作银染。
2 用提供的碳酸钠或者ACS试剂级的碳酸钠。
3 在染色后水清洗所用时间的长短很重要用不超过5-10秒的时间清洗胶然后放入显色溶液中一般在水里浸一下就好。
4 甲醛和硫代硫酸钠ul/1ml在使用前及时加入到显色液中。
5 在使用前及时配染色液。
银染的方法种类很多目前有文献报道的就有100 多种。
但是其准确的染色机制还不是特别的清楚。
大致的原理是银离子在碱性pH 环境下被还原成金属银沉淀在蛋白质的表面上而显色。
由于银染的灵敏度很高可染出胶上低于1 ng/蛋白质点故广泛的用在2D 凝胶分析上及极低蛋白含量测定的垂直凝胶中。
这里介绍的是我们实验室成功运用的银染方法对关键操作及要求做了补充主要是用于垂直凝胶电泳中低丰度蛋白的检测如内源性GST-Pulldown、Co-IP 等实验中相互作用蛋白的研究银染操作规程实验目的检测聚丙烯酰胺凝胶中的蛋白质。
实验原理在碱性条件下用甲醛将蛋白带上的硝酸银银离子还原成金属银以使银颗粒沉积在蛋白带上。
染色的程度与蛋白中的一些特殊的基团有关不含或者很少含半胱氨酸残基的蛋白质有时候呈负染。
银染的详细机制还不是非常清楚。
试剂乙醇、冰醋酸、乙酸钠、硫代硫酸钠、硝酸银、碳酸钠、甘氨酸或EDTA.Na2.2H2O、甲醛实验操作程序固定30min或者更长时间o 100ml 乙醇40 乙醇o 25ml冰醋酸10 冰醋酸o 加水到250ml 致敏30min o 75ml 乙醇30 乙醇o 17g 乙酸钠28.2g 三水乙酸钠o 0.5g硫代硫酸钠o 加水到终体积250ml 水洗3 x10min 银染20min o 0.625g AgNO3 o 100 ul 37甲醛在使用前加入o 加水到终体积250ml 水洗2 x 1 min 注意把握时间水洗时间长显色速度慢点的颜色偏黄色显色视情况而定o 6.25 g Na2CO3 o 50 ul 37 甲醛在使用前加入o 加水到终体积250ml 终止10min o 3.65g EDTA.Na2.2H2O 或者1g 甘氨酸o 加水到终体积250ml 保存1 冰醋酸4 ℃注意事项1固定时间较长则加一步水洗30min以免胶太脆而破碎。
银染

银染步骤及相关药品配制快速银染步骤1.洗板和擦板电泳槽板先用无水乙醇擦一遍,5分钟后用配制的剥离硅烷(repel,4度保存)--(使电泳槽与胶分离)溶液涂抹均匀。
放置15-30分钟玻板(用过的玻板先用NaOH溶液(1瓶加约25L水,可反复使用)浸泡1-2(30min)天,直至废胶脱落)先用抹布蘸少许洗洁精在自来水下洗净,再用无水乙醇擦一遍,5分钟后用新鲜配制的溶液【亲和硅烷(binding)8ul+冰乙酸8ul+无水乙醇至2.0EP管满】【配方二:200ul binding原液+50ml 蒸馏水,可久存】涂抹均匀。
放置15-30分钟2.装板玻板在下,电泳槽板在上,中间放两根压条(涂抹repel和binding的面相互靠近),对齐后,用三对夹子将波板与电泳槽板夹紧。
3.灌胶用针筒吸取凝胶混合液【配方一:50ml 6%的聚丙烯酰胺凝胶溶液+100ul APS(即10%的过硫酸铵:超纯过硫酸铵2g+18ml超纯水)+200ul TEMED】【配方二:50ml 6%的聚丙烯酰胺凝胶溶液+350ul APS(即10%的过硫酸铵:超纯过硫酸铵2g+18ml超纯水)+28ul TEMED,该溶液很快就凝固,需快速灌胶】缓慢均匀的从灌胶口将胶灌入,灌好后取下靠近灌胶口的夹子,倒插入梳子,注意不要起汽泡,插好后,再夹上夹子。
凝胶需要1-2(30min)个小时。
4.预电泳(主要是使凝胶的温度达到一定高度)取下夹子,拔出倒插的梳子,在自来水下将灌胶口冲洗干净,放入电泳槽,卡紧,灌入缓冲液,上下槽各300ml左右,上下槽用一样的缓冲液(即1×TBE)注意用夹子夹紧上槽排放缓冲液的胶管。
80W衡功率电泳半小时。
5.点样用吸管吹干净灌胶口的废胶,将梳子顺插入灌胶口,再用吸管将每个梳孔吹干净,开始点样,注意不要串样,梳齿不要将胶面弄坏。
6.电泳80W衡功率电泳1小时左右(电压可能达到1100V-2000V,若太高则有可能配错,将功率调低,以免温度过高,玻璃板裂开)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
银染步骤是1 固定10冰乙酸min。
2 清洗双蒸水冲洗凝胶次每次1min。
3 染色染色液1g硝酸银.5mL37甲醛1L双蒸水。
现配染色30min。
4 清洗迅速洗凝胶次。
5 显影30g 碳酸钠1.5mL37甲醛200uL 10mg/L硫代硫酸钠。
显影至清晰带纹出现。
成功银染的关键因素包括 1 用超纯水比如NANOpure或Milli-Q纯化或者是双蒸水作银染。
2 用提供的碳酸钠或者ACS试剂级的碳酸钠。
3 在染色后水清洗所用时间的长短很重要用不超过5-10秒的时间清洗胶然后放入显色溶液中一般在水里浸一下就好。
4 甲醛和硫代硫酸钠ul/1ml在使用前及时加入到显色液中。
5 在使用前及时配染色液。
银染的方法种类很多目前有文献报道的就有100 多种。
但是其准确的染色机制还不是特别的清楚。
大致的原理是银离子在碱性pH 环境下被还原成金属银沉淀在蛋白质的表面上而显色。
由于银染的灵敏度很高可染出胶上低于1 ng/蛋白质点故广泛的用在2D 凝胶分析上及极低蛋白含量测定的垂直凝胶中。
这里介绍的是我们实验室成功运用的银染方法对关键操作及要求做了补充主要是用于垂直凝胶电泳中低丰度蛋白的检测如内源性GST-Pulldown、Co-IP 等实验中相互作用蛋白的研究银染操作规程实验目的检测聚丙烯酰胺凝胶中的蛋白质。
实验原理在碱性条件下用甲醛将蛋白带上的硝酸银银离子还原成金属银以使银颗粒沉积在蛋白带上。
染色的程度与蛋白中的一些特殊的基团有
关不含或者很少含半胱氨酸残基的蛋白质有时候呈负染。
银染的详细机制还不是非常清楚。
试剂乙醇、冰醋酸、乙酸钠、硫代硫酸钠、硝酸银、碳酸钠、甘氨酸或EDTA.Na2.2H2O、甲醛实验操作程序固定30min或者更长时间o 100ml 乙醇40 乙醇o 25ml冰醋酸10 冰醋酸o 加水到250ml 致敏30min o 75ml 乙醇30 乙醇o 17g 乙酸钠28.2g 三水乙酸钠o 0.5g硫代硫酸钠o 加水到终体积250ml 水洗3 x
10min 银染20min o 0.625g AgNO3 o 100 ul 37甲醛在使用前加入o 加水到终体积250ml 水洗2 x 1 min 注意把握时间水洗时间长显色速度慢点的颜色偏黄色显色视情况而定o 6.25 g Na2CO3 o 50 ul 37 甲醛在使用前加入o 加水到终体积250ml 终止10min o 3.65g EDTA.Na2.2H2O 或者1g 甘氨酸o 加水到终体积250ml 保存1 冰醋酸4 ℃注意事项1固定时间较长则加一步水洗30min以免胶太脆而破碎。
2甲醛在使用前加入。
3 最好多配制一份显色液第一次显色到溶液变混浊时换一份显色液显色到点清晰。
4 显色过程很快要注意把握时间避免染色过度。
5银染液和显色液需要预冷。
6 所用器皿要很洁净不用手直接接触以免杂蛋白污染7 清洗用水尽量用高纯度去离子水蒸馏水更佳可以减少背景着色。
