分析化学 第6章 络合滴定法
6-5 络合滴定指示剂

第22讲
第六章 络合滴定法
第三讲
(三) 二甲酚橙 二甲酚橙属于三苯甲烷类显色剂,其化学名称为: 3,3’-双[N,N-二(羧甲基)-氨甲基]-邻甲酚磺酞。 常用的是二甲酚橙的四钠盐,为紫色结晶,易溶于水,pH >6.3时呈红色,pH<6.3时呈黄色。它与金属离子络合呈 红紫色。因此,它只能在pH<6.3的酸性溶液中使用。通 常配成0.5%水溶液。 许多金属离子可用二甲酚橙作指示剂直接滴定,如 ZrO2+(pH < 1 ) 、 Bi3+(pH=l-2) , Th4+(pH=2.5-3.5), Sc3+(pH=3-5)、Pb2+ 、Zn2+ 、Cd2+ 、Hg2+ 和Tl3+ 等离子和 稀士元素的离子(pH5-6)都可以用EDTA直接滴定。终点 时溶液由红色变为亮黄色,很敏锐。Fe3+、A13+、Ni2+、 Cu2+等离子,也可以借加入过量EDTA后用Zn2+标准溶液 返滴定。
第22讲
第六章 络合滴定法
第三讲
2 . 当 滴 入 EDTA 时 , 溶 液 中 游 离 的 Mg2+ 逐 步 被 EDTA络合,当达到计量时,已与EBT络合的Mg2+ 也被EDTA夺出,释放出指示剂EBT,因而就引起 溶液颜色的变化: Mg-EBT+EDTA=Mg-EDTA+EBT (鲜红色) (蓝色) 应该指出,许多金属指示剂不仅具有络合剂的性 质,而且本身常是多元弱酸或多元弱碱,能随溶液 pH值变化而显示不同的颜色。例如铬黑T,它是一 个三元酸,第一级离解极容易,第二级和第三级离 解则较难(pka2=6.3,pka3=11.6),在溶液中有下列 平衡: H2ln- = HIn2- = In3(红色) (蓝色) (橙色) pH<6 pH=8-11 pH>12
第20讲 第六章 络合滴定法 第一讲

第20讲
第六章 络合滴定法
第一讲
溶解于酸度很高的溶液中, 当 H4Y溶解于酸度很高的溶液中, 它的两个 溶解于酸度很高的溶液中 羧基可再接受H 而形成H 这样EDTA就相 羧基可再接受 + 而形成 6Y2- , 这样 就相 当于六元酸,有六级离解平衡。 当于六元酸,有六级离解平衡。 Ka1 Ka2 Ka3 Ka4 Ka5 Ka6 10-0.90 10-1.60 10-2.00 10-2.67 10-6.16 10-10.26 由于EDTA酸在水中的溶解度小 通常将其制 酸在水中的溶解度小,通常将其制 由于 酸在水中的溶解度小 成二钠盐, 一般也称EDTA或 EDTA二钠盐 , 常 二钠盐, 成二钠盐 , 一般也称 或 二钠盐 形式表示。 以Na2H2Y·2H2O形式表示。 形式表示
第20讲
第六章 络合滴定法
第一讲
在络合物滴定中常遇到的氨羧络合剂有以下 几种: 几种: 氨三乙酸, (一)氨三乙酸,(二)乙二胺四乙酸 环己烷二胺四乙酸,( (三)环己烷二胺四乙酸 (四)二胺四丙酸 (五)乙二醇二乙醚二胺四乙酸 (六)三乙四胺六乙酸 应用有机络合剂(多基配位体 多基配位体)的络合滴定方 应用有机络合剂 多基配位体 的络合滴定方 已成为广泛应用的滴定分析方法之一。 法,已成为广泛应用的滴定分析方法之一。目前 应用最为广泛的有机络合剂是乙二胺四乙酸 (Ethytlene Diamine Tetraacetic Acid简称 简称EDTA)。 简称 。
第20讲
第六章 络合滴定法
第一讲
第二节 溶液中各级络合物型体的分布
一、络合物的形成常数 在络合反应中,络合物的形成和离解, 在络合反应中,络合物的形成和离解,同处于 相对的平衡状态中。其平衡常数, 相对的平衡状态中。其平衡常数,以形成常数或稳 定常数来表示。 定常数来表示。 (一)ML型(1:1)络合物 一 型 络合物 M+L=ML K形=[ML]/[M][L] 1 K离解 = K形 K形越大,络合物越稳定;K离解越大,络合 越大,络合物越稳定; 越大, 物越不稳定。 物越不稳定。
武大版分析化学上册答案-第6章-络合滴定法2

第6章 络合滴定法2. 在PH=9.26的氨性缓冲溶液中,除氨络合物外的缓冲剂总浓度为0.20 mol ·L -1,游离C 2O 42-浓度为0.10 mol ·L -1。
计算Cu 2+的αCu 。
已知Cu(Ⅱ)- C 2O 42-络合物的lg β1=4.5,lg β2=8.9; Cu(Ⅱ)-OH -络合物的lg β1=6.0。
解:22433222124224()4.58.92 6.96.09.2614 1.261()14333()1321[][] 100.1010(0.10)101[]1101010[][]112[]0.10[][]1[][Cu C O Cu OH NH Cu NH C O C O OH C NH H NH mol L NH NH Ka NH N αββαβαββ------++-=++=⨯+⨯==+=+⨯==+=+=⇒=⋅⇒=++又2324259.353539.36()()()][]1010Cu Cu NH Cu C O Cu OH H NH βαααα--++=≈++=3.铬黑T(EBT)是一种有机弱酸,它的lgK 1H =11.6,lgK 2H =6.3,Mg-EBT 的lgK MgIn =7.0,计算在PH=10.0时的lgK ’MgIn 值。
4. 已知M(NH 3)42+的lg β1~ lg β4为2.0,5.0,7.0,10.0,M(OH)42-的lg β1~ lg β4为4.0,8.0,14.0,15.0。
在浓度为0.10 mol ·L -1的M 2+溶液中,滴加氨水至溶液中的游离NH 3浓度为0.010 mol ·L -1,PH=9.0试问溶液中的主要存在形式是那一种?浓度为多大?若将M 2+离子溶液用NaOH 和氨水调节至PH ≈13.0且游离氨浓度为0.010 mol ·L -1,则上述溶液中的主要存在形式是什麽?浓度又为多少? 解:用氨水调解时:32()121(0.010)(0.010)122M NH αββ=+++=3 2.0 2.0131()[]10100.0083122M NH NH βδα-⨯===32 5.0 4.0232()[]10100.083122M NH NH βδα-⨯===7.0 6.0310100.083122δ-⨯== 10.08.0410100.83122δ-⨯== 故主要存在形式是M(NH 3)42+,其浓度为0.10×0.83=0.083 mol ·L -1用氨水和NaOH 调节时:34811()()11100.1100.01120210M M NH M OH ααα-=+-=+⨯+⨯++=⨯49111100.1510210δ-⨯==⨯⨯ 86211100.01510210δ-⨯==⨯⨯14311100.0010.5210δ⨯==⨯ 15411100.00010.5210δ⨯==⨯故主要存在形式是M(OH)3-和M(OH)42-,其浓度均为0.050 mol ·L -15. 实验测得0.10 mol ·L -1Ag(H 2NCH 2CH 2NH 2)2+溶液中的乙二胺游离浓度为0.010mol ·L -1。
第6章 配位滴定法

效应 效应 配位效应
EDTA 副反应
混合配 位效应
不利于主反应进行
利于主反应进行
提出问题: 用什么来表示副反应对主反应的影响呢?
为了表示副反应对主反应的影响,定量
表示副反应进行的程度,引入副反应系数α
副反应系数的定义式:
=未参加主反 该应 组组 分分 的的 平各 衡型 浓体 度的总浓度=XX
6.3.1副反应系数(α)
[Y ] [N1Y ] [N2Y ] [NnY ] [Y ]
Y Y (H ) Y (N1) Y (N2 ) Y (Nn ) n
当n=1时:
Y Y (H ) Y (N) 1 (二)金属离子的副反应及αM
1.辅助配位效应 由于其他配位剂存在使金属离子参加主反
应能力降低的现象
2.αM(L)
i
[MLi ] cM
[M]
i [M ] [ L]i (1 i[L]i )
i [ L]i
(1 i[L]i )
铜氨络合物各种型体的分布
1.0
0.8
Cu2+
Cu(NH3)42+
分布系数
分 布 0.6
Cu(NH3)22+
分 数
0.4 Cu(NH3)2+
Cu(NH3)32+
0.2
0.0
654321 lgK1-4 4.1 3.5 2.9 2.1
4.金属离子M的总的副反应系数
A若存在n种配位副反应: αM
M
M M
M(L1
)
M(L2
)
M(Ln
)
(n
1)
B若存在2种配位副反应:
练习:
M
M M
M(L1
分析化学 第6章 络合滴定 b - 金属离子指示剂、络合滴定原理、终点误差、判别式、酸度控制(1)

lg
K MIn
lg In(H)
lg M
此时的变色点 pM 'ep lg KMIn lg In(H) lg M
pM 'ep pM ep lg M
金属指示剂变色点pM ’ep随体系酸度变及其它条件的变化而变化。 选择指示剂时应控制反应条件使其变色点与化学计量点尽量接近。
理论变色点,也即终点 pMep lg KMIn lg In(H)
金属指示剂变色点pMep随体系酸度变化而变化。部分金属指示剂变 色点可由p397, 表14查得。
若金属离子有副反应
K MIn '
[MIn] [M' ][In'
]
K MIn
In(H) M
pM
' lg
[MIn] [In' ]
六、常用金属离子指示剂
掌握:作用原理、颜色变化,实用pH范围 铬黑T (EBT) 二甲酚橙(XO) PAN金属指示剂
铬黑T (EBT)
是一多元酸,不同的酸碱型体具有不同的颜色
H2In-
HIn 2-
In3-
pKa2 = 6.3
pKa3 = 11.6
pH
型体及颜色
指示剂络合物颜色
pH < 6.3 6.3 < pH < 11.6
H2InHIn2-
+M
2H+
MIn + H+
pH > 11.6
In3-
适宜pH 范围:6.3 ~ 11.6
二甲酚橙
是一多元酸,不同的酸碱型体具有不同的颜色:
H6In- -4 H+
H2In4-
分析化学第五版第6章 络合滴定法 酸度控制 选择性 应用3

1
2
化时的酸度,视为滴定M的
适宜酸度。
lg
25 20 15 10 5 0 0
25
lgY
滴定M的适宜酸度: pHa:
lg Y(N)
2 4 6
lg Y(H)
8 10 12 14 pH
αY(H) αY(N) 1 K NY C N
pHb:
[OH ] n
sp
lg K 'MY 20
15 10 5 0 0 2 4 6 8 10 12 14 pH
pM = 0 最佳酸度
pH
由此看出,在络合滴定中: 酸度的确定比指示剂的选择更重要。
6.6.2 分别滴定的酸度控制
lg
25 20 15 10 5 0 0
25
设M-被测离子,N-共存离子, 且△lgKC ≥ 5
lg Y(N)
2 4 6
lgY
K′MY与酸度的关系: 1.
lg Y(H)
8 10 12 14 pH
b. 用氧化剂或还原剂改变N离子的价态。
c. 选择其它的络合剂作滴定剂。
6.7.1 络合掩蔽法
常用掩蔽剂:P203 举例: 教材P202,具体实施方法:
主要是用于设计络合滴定实验方案。
使用络合掩蔽剂注意问题:P203 例题21,22(自学)
6.7.2 沉淀掩蔽法
例: 自来水 (含Ca2+、Mg2+)中Ca2+的测定: pH > 12,Mg(OH)2,EDTA可滴定Ca2+
4. 滴定M的最佳酸度
pMep=pMsp
1 1 sp sp pCM ) (lg K MY lg Y(H ) pCM pM sp (lg K MY ) 2 2
分析化学第六版第6章-络合滴定法及答案

第六章络合滴定法一、判断题(对的打√,错的打×)1、EDTA 与金属离子形成的配合物都是1:1 型的( )2、络合滴定中酸度越小,对滴定越有利,因此滴定时,pH 值越大越好( )3、络合滴定法可以测定许多金属离子,对于SO42—等阴离子则不能测定( )4、EDTA 能与多数金属离子络合, 所以选择性较差。
()5、EDTA 滴定法测定自来水中Ca2+、Mg2+时,用EBT 为指示剂,若不加pH=10 的缓冲溶液,终点时不会变色。
( )6、络合滴定要求金属指示剂与金属离子形成的配合物MIn 的稳定常数越大越好( )7、若控制酸度使lg C M K′MY≥6,lg C N K′NY≤1, 就可准确滴定M 而N不干扰( )二、选择题1.EDTA与金属离子形成螯合物时,其螯合比一般为( )A.1:1 B.1:2 C.1:4 D.1:62.EDTA与金属离子络合时,一分子的EDTA可提供的络合原子个数为() A.2 B.4 C.6 D.83.在非缓冲溶液中用EDTA滴定金属离子时,溶液的pH值将( )A.升高B.降低C.不变D.与金属离子价态有关4.下列叙述αY(H)正确的是()A.αY(H)随酸度减小而增大B.αY(H)随pH值增大而减小C.αY(H)随酸度增大而减小D.αY(H)与pH变化无关5.以铬黑T为指示剂,用EDTA溶液滴定Mg2+,可选择的缓冲溶液为()A.KHC8H4O4~HCl B.KH2PO4~K2HPO4C.NH4Cl~NH3·H2O D.NaAc~HAc6.用EDTA直接滴定有色金属离子,终点时所呈现的颜色是()A.游离指示剂In的颜色B.MY的颜色C.MIn的颜色D.a与b的混合颜色7.Fe3+、Al3+对铬黑T有()A.僵化作用B.氧化作用C.沉淀作用D.封闭作用8.在络合滴定中,用返滴定法测Al3+时,以某金属离子标准溶液滴定过量的EDTA,最适合的金属离子标准溶液是()A.Mg2+B.Zn2+C.Ag+D.Bi3+9.以EDTA滴定同浓度的金属离子M,已知检测点时,△pM=0.2,K’MY=109.0,若要求TE=0。
络合滴定法络合物条件稳定常数

可编辑ppt
7
EDTA各种型体分布图
1.0
0.8
H6Y
H2Y
HY
Y
分布系数
0.6
H5Y
0.4
H4Y H3Y
0.2
0.0 0 2 4 6 8 10 12 p1H4
可编辑ppt
8
质子化常数
质子化反应式及质子化常数见教材P169
说明: 1.与金属离子络合的是EDTA的酸根Y,
生成的络和物写成MY.
2.为方便书写略去电荷, 如HY、H2Y…H6Y.
特点:①含多个配体②K稳小③分级络合 举例:Cu + NH3 = 应用: ①掩蔽剂,显色剂,指示剂(常用) ②滴定分析:汞量法:以Hg2+为中心 测 SCN-,Cl- 氰量法:以CN-为络合剂 测 Ni2+ ,Ag+ 反应式 P166 说明:一般不用汞量法,氰量法(?)
螯合物(chelate) 定义:配位中心+多齿配体(一个配体分子中含有多个配 位原子)。
M L ML
K 稳1
[ML] [M ][L]
ML L ML2
K稳2
[ML2 ] [ML][ L]
...
...
ML(n1) L MLn
K 稳n
[MLn ] [ML(n1) ][L]
说明:① P393 表9
a 对比酸碱滴定反应常数,可以看出络合滴定反应完全程度
一般很大,当然这只是考虑主反应,没考虑副反应。
— — N— C2HH COOH
一分子中含六个配为原子
在酸性溶液中可形成H6Y2+
2. EDTA物理性质 白色晶体
型体
溶解度 (22 ºC)
注意:不论乙二 胺四乙酸还是它的 二钠盐,一般都称 作EDTA。P169解释
分析化学第六章配位滴定法

第一节 概述
➢ 配位滴定法: 又称络合滴定法
以生成配位化合物为基础的滴定分析方法
➢ 滴定条件:
定量、完全、迅速、且有指示终点的方法
➢ 配位剂种类:
无机配位剂:形成分级络合物,简单、不稳定 有机配位剂:形成低络合比的螯合物,复杂而稳定 ➢ 常用有机氨羧配位剂 ——乙二胺四乙酸
乙二胺四乙酸:EDTA
➢ 结论:pH, [H] Y(H), [Y4] 副反应越严 pH Y( H) ; pH12Y(H) 1,配合物
练习
例:计算pH5时,EDTA的酸效应系数及对数值,若 此时EDTA各种型体总浓度为0.02mol/L,求[Y4 -]
解:
Y(H )1111 0 0 5 .3 04 1 1 0 1.3 0 0 1 4 60 .2
✓ 注:[Y’] ——EDTA 与 N 配合物平衡浓度 和参与配位的Y4-平衡浓度之和
[Y] ——参与配位反应的Y4-的平衡浓度
➢ 结论: Y(N) ,[Y]副反应越严重
3. Y的总副反应系数[同时考虑酸效应和共存离子效应]
Y[[Y Y ']][H 6Y2][H 5Y[ Y ] 4 ][Y4][N]Y
p H 1 1 lg Z ( 0 H n ) 5 .4 , Z ( O n ) H 2 .5 1 50
Z n Z(N n3 )H Z(O n) H 1 5 .6 150
(三)配合物MY的副反应系数
MHY
KMHY MY H
M(OH)Y KM(OH)Y MYOH
M Y (H ) M M Y Y ' M Y M Y M H Y 1 K M H YH
四、指示剂的封闭、僵化现象及消除方法
❖ 指示剂的封闭现象:化学计量点时不见指示剂变色
分析化学络合滴定法

络合滴定法反应的必备条件
1. 形成的络合物要有足够大的稳定常数, 否则不易得到明显的滴定终点。
2. 在一定反应条件 下,配位数必须固定 (即只生成一种配位数的络合物。)
3. 络合反应速度快。
4. 要有适当的方法确定终点。
络合物(亦称配合物)定义:其结构的共同特征是都具有 中心体,在中心体周围排列着数目不等的配体。中心 体所键合的配位原子数目称为配位数。 络合物可以是中性分子,可以是络阳离子,如 C物o具(N有H一3)定62的+,立或体者构是型络。阴离子,如Fe(CN)63-。络合
1 Ki
i
Kj
j 1
Kn
[MLn] [MLn-1][L]
K 1
1 Kn
n
n K i
i 1
累积稳定常数与平衡浓度的关系
n
多元络合物 ML(n-1)+L
MLn
lgn lgKi
i1
MLi-1L MLi
Ki
[MLi ] [MLi-1][L]
K(ni1)
乙二胺四乙酸(ethylene diamine tetraacetic acid),是最常用的氨羧络合剂。为方便起见,一 般用H4Y表示,为四元酸。
H4Y在水溶液中离解:
H4Y
H3Y-
H++H3Y-
H++H2Y2-
Ka1=10-2.0 Ka2=10-2.67
H2Y 2-
H++HY3-
有色的金属离子形成颜色更深的络合物。
如:N:Y2- CuY2-
CoY2-
MnY2-
CrY- FeY-
兰色
深兰
紫红
紫红
深紫
第6章 络合滴定法(第1-3节)

23
总形成常数和总离解常数关系:
总形成常数--最后一级累积形成常数;总离解常数-最后一级累积离解常数。K离解=1/ K形
累积形成常数的应用:
由各级累积形成常数计算溶液中各级络合物型体的 平衡浓度。
[ML]= β1[M][L]
[ML2]= β2[M][L]2
︰ [MLn]= βn[M][L]n
24
16
图6-2 EDTA-Co(III)螯合物的立体结构
17
Ca-EDTA螯合物的立体构型
O
H2 O C CH2 N H2C N Ca CH2 C O O C O CH2 O O C O H2C
C
18
6-2 溶液中各级络合物型体的分布
一、络合物的形成常数 在络合反应中,络合物的形成和离解,同处于相对 的平衡状态中。其平衡常数,以形成常数或稳定常 数来表示。 EDTA络合物的稳定常数(形成常数) M+Y
•
中心原子(离子):必须具有接受电子对的空轨道, 如金属离子(最多可接受六对,d2sp3杂化,sp3d2 杂化) 配位体:至少能提供一对孤对电子的阴离子或中性 分子,如卤素离子、NH3、SCN-、CN-、乙二胺等
相反电荷离子:当络合物带电时,是保持物质电中 性必不可少的。
6
一、络合滴定中的滴定剂(络合剂)
1. 络合滴定反应必须具备下列条件:
(1)形成的络合物要相当稳定,K形≥108,否则不
易得到明显的滴定终点。 (2)在一定反应条件下要快。 (4)要有适当的方法确定滴定的计量点。
7
2.络合剂的分类 (1)无机络合剂
无机络合剂(单基配位体)是只提供一对孤对电子
仅仅是[L]的函数,与cM无关 因此,根据上述各式,只要知道β值,就可以计 算出在不同L的浓度下,各型体的δ值。
第六章 络合滴定法
K n [ML][L] ML+ L
[ML2]
ML2
K2
[ML2] [ML][L]
==
K
[MLn 1][L] [MLn]
MLn-1+
L
MLn
Kn
[MLn] [MLn 1][L]
络合物的形成常数(对MLn型来讲),其一般规律是 K1>K2>K3… 原因:随着络合体数目的增多, 配体间的排斥作用增强,稳定性下降。
M=M(L)+M(OH)-1
(三)络合物MY的副反应 pH<3,形成酸式络合物,MHY; pH>6,形成碱式络合物,MOHY。 由于这两种络合物不稳定,一般情况
下,可忽略不计。
二、MY络合物的条件形成常数
条件形成常数亦叫表观稳定常数或有效稳定
常数,它是在有副反应发生的情况下络合物的 实际稳定常数。
[HY] [Y][H+
]
=
1 Ka
6
β1H=K1H
HY+H+=H2Y ︰
K
H 2
=
[H2Y] [HY][H+
]
=
1 Ka5
︰
β2H=K1H K2H ︰
:
︰
︰
H5Y+H+=H6Y
K6H
=
[H6Y] [H5Y][H+
]
=
1 Ka1
β6H=K1H K2H … K6H
累积质子化常数的应用: 由各级累积质子化常数计算溶液中 EDTA各型体的平衡浓度。
因此,根据上述各式,只要知道β值,就 可以计算出在不同游离氨的浓度下,各型 体的δ值。如图所示。
锌氨络合物各型体的δ- lg [NH3] 相邻两级络合物分布曲线 的交点处有:
分析化学06 络合平衡和络合滴定法

EDTA
H6 Y2+ =H+ + H5 Y+
[H+][H5Y] Ka1= [H Y] = 10-0.90 6
H5Y+ =H+ + H4Y H4Y =H+ + H3YH3Y- =H+ + H2Y2-
Ka2=
[H+][H4Y] [H5Y]
= 10-1.60
[H+][H3Y] Ka3= = 10-2.00 [H4Y] [H+][H2Y] Ka4= = 10-2.67 [H3Y]
6.2 络合平衡常数
1 络合物的稳定常数 (K, ) M + Y = MY [MY] KMY= [M][Y]
M + L = ML ML + L = ML2
● ● ●
逐级稳定常数 Ki [ML] K1= [M][L]源自[ML2] K2= [ML][L]
● ● ●
累积稳定常数
1=K1=
[ML] [M][L]
M
OHL
+ Y = MY
ML
● ● ●
MOH
● ● ●
M(OH)n MLn M
M(OH) =1 +1[OH-]+ 2[OH-]2+ …+ n[OH-]n
多种络合剂共存
M = M(L1)+ M(L2) +…+ M(Ln)-(n-1) M(L) =1+1[L] +2[L]2+…+n[L]n
● ● ●
MLn-1 + L = MLn
[MLn ]= n [M] [L]n
cM=[M]+[ML]+[ML2]+…+[MLn]
第6章络合滴定法(7)

+
+
CH2COO
-
CH2COOH
H4Y
1分子乙二胺四乙酸,可由2个氨 N和4个羧 O提供六基配位体
4
2、乙二胺四乙酸性质
(1)溶解性 难溶于水、酸及一般有机溶剂,易溶于碱生成 乙二胺四乙酸二钠(Na2H2Y , EDTA) (2)酸性 在pH<1的强酸性溶液中,它的两个羧基可再 接受两个H+,形成H6Y2+ 六元酸
-
aZn (NH3)=1+β1[NH3]+β2[NH3]2+...+β4[NH3]4
[NH3]=0.10 Zn(NH3)2 + Zn(OH) . . 查附录, Zn-NH3的lgβ1~lgβ4分别为 . . aZn (NH3)=105.49 2.27, 4.61, 7.01, 9.06 . . 2+ Zn(NH3)4 查附录, pH=10时, lgaZn(OH)=2.4
即
aY=aY(H)+ aY(N)-1
19
二、金属离子M的副反应系数aM
M
+
Y
MY
L ML ML2 . . . MLn
a M ( L)
[ M ] [M ]
由于其它络合剂L的存在使M 参加主反应能力降低的现象, 称为络合效应 [M']=[M]+[ML]+[ML2]+...+[MLn] 没有与Y络合的M的总浓度
即
=1+β1[L]+β2[L]2+...+βn[L]n
aM(L) =1+β1[L]+β2[L]2+...+βn[L]n
20
如果溶液中的OH-与M形成络合物使M参加主反应 能力降低,则称为羟基络合效应,用aM(OH)表示 附录表12列出了部分金属离子的lgaM(OH) 可查
分析化学第五版第6章 络合滴定法 滴定原理 指示剂 2
M、N有副反应:
lg K MY
M ( L)
sp CM
lg K NY
N ( L)
sp CN
5
说明:分别滴定判别式由准确滴定判别式推导得出。
2. 金属离子指示剂应具备的条件(P189) (1) MIn与In-的颜色显著不同。 (2) 反应灵敏、迅速、有良好的变色可逆性。
(3) MIn的稳定性适当。K′MIn < K′MY (4) 稳定,便于储存和使用。
3. 金属离子指示剂的选择
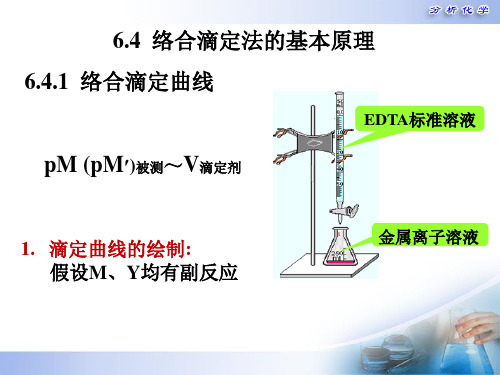
(1)选择依据 指示剂应在pM突跃内发生颜色变化,且 指示剂变色点的pMep应尽量与化学计量点 pMsp一致。
滴定曲线
滴定突跃
20.00 20.02 20.20 22.00 40.00
1.000 1.001 1.010 1.100 2.000
6.12 7.24 8.24 9.24 10.1
计量点的 pM′sp、 pMsp、 pY′sp、 pYsp 计算 (1)M、Y均有副反应: M + Y = MY sp 时:
解: Zn(NH3) =106.68 ∴ Zn = Zn(NH3) + Zn(OH) -1 =106.68
∴ lgK′ZnY = lgKZnY - lgZn - lgY(H) =9.37
1 sp pZn sp (lg K ZnY pC Zn ) 5.69 2
pZnep 12.2
(3)常用指示剂 : P190, 397 要求掌握:① 颜色变化,使用pH范围的确定。
② 会查指示剂在不同pH下的pMep, 会求M有副反应时的pM ′ep。
pMep lg M pM ep
3. 指示剂的封闭、僵化与变质
(1)指示剂的封闭现离子N与In形成 十分稳定的 络合物NIn ,造成颜色不变。
络合滴定法——精选推荐

第六章 络合滴定法络合滴定法是以络合反应为基础的滴定分析方法。
从路易斯酸碱理论来说,络合反应也是路斯酸碱反应,所以络合滴定与酸碱滴定法有许多相似之处,学习时可对照比较,但络合滴定中也有自身的特点,内容更复杂。
络合反应在分析化学中应用广泛,有关理论和实践知识是分析化学重要的内容之一。
6.1 络合滴定分析中常用的络合剂和络合平衡 6.1.1 常用的络合剂络合反应中常用的络合剂很多,如测定金属离子的络合滴定剂、掩蔽剂、指示剂和金属缓冲溶液等等。
络合剂的分类方式也很多,按络合剂中的键合原子分类,可分为:(1)氧配位螯合剂:如磺基水扬酸、酒石酸、柠檬酸、乙酰丙酮等;2.氮配位络合剂:如氨、乙二胺、联吡啶、邻二氮菲等;(3)氧、氮配位络合剂:8-羟基喹啉、氨三乙酸及EDTA 氨羧络合剂等;(4)硫配位螯合剂:如铜试剂、2-巯基苯并噻唑等。
1. 氨羧络合剂络合滴定中重要的滴定剂是具有-N(CH 2COOH)2基团氨羧络合剂,常见的氨羧络合剂见下表。
2. 乙二胺四乙酸的性质:(1) 乙二胺四乙酸结构:(ethylenediaminetetreacetic acid )简称EDTA ,具有结构如图所示。
一个分子中含有二个-N(CH 2CO OH)2基团,与金属离子结合时有六个配位原子,可形成五个五元螯合环,具有很强的络合性能,是常用的络合滴定剂和掩蔽剂。
(2) EDTA 性质:EDTA 在水中的溶解度不大,EDTA 的二钠盐溶解度较大,EDTA 是六元酸,可用H 6Y 2+表示,有六级离解常数。
各级解离常数与对应的质子化常数如后。
,,,++++=Y H H Y H 5269.0a H69.02Y 6H Y 5H H a 101,10)()()(11====-+++K K c c c K Y H H Y H 45+=++6.1a H56.1Y 5H Y 4H H a 101,10)()()(22====-++K K c c c K -++=Y H H Y H 340.2H40.2Y 4(H )Y 3(H )(H a 10 ,10)3===--+K c c cK,,,各组分的分布分数如上图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第6章 络合滴定法 一、填空题
1.EDTA 的化学名称为 ,当溶液酸度较高时,可作 元酸,有 种存在形式。
2. 采用EDTA 为滴定剂测定水的硬度时,因水中含有少量的 Fe 3+
, Al 3+。
应加入 作掩蔽剂; 滴定时控制溶液PH = 。
3. EDTA 络合物的条件形成常数'MY K 随溶液的酸度的变化而改变。
酸度越 则'
MY K 越 ;络合物越 ,滴定突跃越 。
4.以铬黑T为指示剂,溶液pH 值必须维持 ;滴定到终点时溶液由 色变为 色。
5.EDTA 的酸效应曲线是指 ,当溶液的pH 越大,则 越小。
二、选择题
1. 以EDTA 为滴定剂,下列叙述中哪一种是错误的?( )
A. 在酸度较高的溶液中,可形成MHY 络合物;
B. 在碱性较高的溶液中,可形成MOHY 络合物;
C. 不论形成MHY 或MOHY ,均有利于滴定反应;
D. 不论溶液pH 值的大小,只形成MY 一种形式络合物。
2.在pH=12时,以0.0100mol/LEDTA 滴定20.00mol/LCa2+。
等当点时的pCa 值为( ) A.5.3 B.6.6 C.8.0 D.2.0
3. 在pH = 10 的氨性缓冲溶液中, 用EDTA 滴定同浓度的 Zn 2+
至化学计量点时,下列关系式中哪一个是正确的?( ) A. [ Zn 2+
] = [ Y 4 -
] ; B.[Zn 2+
] = [ Y
4 -ˊ
] ;
[ZnY 2 -] C. [ Zn
2+ ˊ
] 2 = K
ˊ
Zn Y
[ZnY 2 -
]
D. [ Zn 2+
] 2
= K ˊZn Y
;
4.在pH=
5.7时,EDTA 是以( )形式存在的:
A.H 6Y 2+ B.H 3Y - C.H 2Y 2- D.Y 4-
5. 在pH = 10 的氨性缓冲溶液中,以EDTA 滴定Zn 2+
至化学计量点时,以下关系式中哪 一个是正确的( ) A.pZn sp = pZn ˊsp
+ lg α Zn ( NH 3 ) ; B. pZn sp = pZn
ˊsp – lg αZn ( NH 3 ) ;
C.pZn sp = lgZn
ˊ
sp
+ p α Zn ( NH 3 ) ; D. pZn sp = lg αZn ( NH 3 ) - pZn ˊsp。
6.为了测定水中 Ca 2 +
, Mg 2+
的含量,以下消除少量 Fe 3+
, Al 3+
干扰的方法中,哪一种是正确的?( )
A. 于pH =10 的氨性溶液中直接加入三乙醇胺;
B. 于酸性溶液中加入KCN ,然后调至pH =10;
C. 于酸性溶液中加入三乙醇胺,然后调至pH =10 的氨性溶液;
D. 加入三乙醇胺时,不需要考虑溶液的酸碱性。
7. 今有 A ,B 相同浓度的Zn 2+
— EDTA 溶液两份;A 为PH = 10 的NaOH 溶液;B 为PH = 10 的氨性缓冲溶液。
对叙述两溶液 K ˊZn Y
的大
小,哪一种是正确的?( ) A. A 溶液的K ˊZn Y 和B 溶液相等; B. A 溶液的K
ˊZn Y 小于B 溶液的K
ˊ
Zn Y
;
C. A 溶液的K
ˊZn Y
大于 B 溶液的K ˊZn Y
; D. 无法确定。
8.EDTA 与Zn 2+
形成的配合物在pH=10时的条件稳定常数'
lg ZnY K =( )
A.16.50 B.0.45 C.16.05 D.16.95 三、 计算题
1. 取100ml 水样,用氨性缓冲液调节至pH =10,以铬黑T为指示剂,用EDTA 标准液(0.008826mol/L )滴定至终点,共消耗1
2.58ml ,计算水的总硬度,如果将上述水样再取100ml ,用NaOH 调节pH =12.5,加入钙指示剂,用上述EDTA 标准液滴定至终点,消耗10.11ml ,试分别求出水样中Ca 和Mg 的量。
2. 已知NH 3的K b =10-4.63
,请计算K a (NH 4+),K H (NH 4+),K OH
(NH 4OH)及pH=9.0时的
(H)
NH
3
4. 已知铜氨络合物各级不稳定常数为
K 不稳1=7.8×10-3 K 不稳2=1.4×10-3 K 不稳3=3.3×10-4
K 不稳4=7.4×10-5
(1)计算各级稳定常数K 1~K 4和各级累积常数β1~β4;
(2)若铜氨络合物水溶液中Cu(NH 3)2+
4的浓度为Cu(NH 3)2+
3的10倍,问溶液中[NH 3]是多少?
7.称取0.1005g 纯CaCO ,溶解后,用容量瓶配成100ml 溶液,吸取25.00ml ,在pH >12时,用钙指示剂指示终点,用EDTA 标准溶液滴定,用去24.90ml ,试计算:⑴EDTA 溶液的浓度(mol/L );(2)每mlEDTA 溶液相当于ZnO 、Fe O 的克数。
8. 计算下面两种情况下的lg K ′(NiY)值。
(1)pH=9.0,c (NH 3)=0.2mol ·L -1
;
(2)pH=9.0,c (NH 3)=0.2mol ·L -1
,[CN -]=0.01mol ·L -1。
9.用控制酸度的方法分步滴定浓度均为
的
和
,若EDTA 浓度也为
,计算:
(1)滴定的合适酸度范围;[最大,不沉淀]
10. 计算lg α
Cd(NH3)
、lg α
Cd(OH)
和lg α
Cd
值(Cd 2+-OH -
络合物的lg β1~lg β4分别是4.3,7.7,10.3,12.0)。
(1)含镉溶液中[NH 3]=[NH 4+
]=0.1;
11.铬蓝黑R 的酸离解常数K a1=10
-7.3
,K a2=10
-13.5
,它与镁的络合物稳定常数K (MgIn)=107.6。
计算pH10.0时(pMg)t 值;若以它为指示剂,在
pH 10.0时以2×10-2
mol ·L -1
EDTA 滴定同浓度的Mg 2+
,终点误差多大?
12.称取干燥Al(OH)凝胶0.3986g,于250ml容量瓶中溶解后,吸取25ml,精确加入EDTA标准液(0.05140mol/L)25.00ml,过量的EDTA 溶液用标准锌溶液(0.04998mol/L)回滴,用去15.02ml,求样品中Al O的含量。
13.今欲配制pH=5.0、pCa=3.8的溶液,所需EDTA与Ca2+物质的量之比,
即n(EDTA):n(Ca)为多少?
15. 在一定条件下,用0.010 mol·L-1 EDTA滴定20.00mL同浓度金属离子M。
已知该条件下反应是完全的,在加入19.98~20.02mL EDTA 时pM值改变1单位,计算K′(MY)。
16.若配制 EDTA溶液的水中含有,判断下列情况下对测定结果的影响。
(1)以为基准物质标定 EDTA,用以滴定试液中的,二甲酚橙为指示剂;
(2)以金属锌为基准物质,二甲酚橙为指示剂标定 EDTA,用以测定试液中的含量;
(3)以金属锌为基准物质,铬黑T为指示剂标定 EDTA,用以测定试液中的含量。
17.以2×10-2 mol·L-1 EDTA滴定浓度均为2×10-2 mol·L-1的Cu2+、Ca2+混合液中的Cu2+。
如溶液pH为5.0,以PAN为指示剂,计算终点误差;并计算化学计量点和终点时CaY的平衡浓度各是多少?
19.称取含Fe2O3和Al2O3的试样0.2015g。
试样溶解后,在pH2以磺基水杨酸为指示剂,加热至50℃左右,以0.02008 mol·L-1的EDTA滴定至红色消失,消耗EDTA 15.20mL;然后加入上述EDTA标准溶液25.00mL,加热煮沸,调pH4.5,以PAN为指示剂,趁热用0.02112 mol·L-1 Cu2+标准溶液返滴,用去8.16mL。
计算试样中Fe2O3与Al2O3的质量分数(以%表示)。
